影响盐类水解的因素和盐类水解的应用ppt课件.ppt
合集下载
盐类的水解第二课时盐的水解影响因素和应用课件

A-+H2O
HA+OH-
碱性
综上:
盐类水解的实质是生成弱酸或弱碱,使水的电离平衡 被破坏而建立起新的平衡。
盐类的水解第二课时盐的水解影响因素和应用
一、影响盐类水解的因素
盐类的水解第二课时盐的水解影响因素和应用
(一)内因:盐的本性(越弱越水解)
对应的酸越弱
酸越难电离
水解后OH-浓度大
碱性强
酸根离子与H+的 结合能力越强
1、配制和保存易水解的盐溶液
问题1:为什么用热水配制CuCl2溶液,溶 液会出现浑浊?怎样配制澄清溶液?
CuCl2+2H2O
Cu(OH)2+2HCl(吸热)
或Cu2++2H2O
Cu(OH)2+2H+(吸热)
热水:升温能够促进水解
配制CuCl2溶液,为防止出现浑浊,应加少量的
_稀__盐__酸__
盐类的水解第二课时盐的水解影响因素和应用
3、加热蒸发可水解的盐溶液 问题4:把FeCl3溶液蒸干并灼烧,最后 得到的固体产物是什么,为什么?
FeCl3+3H2O
Fe(OH)3+3HCl
⑴加热促进水解 ⑵HCl挥发
2Fe(OH)3
△
=
Fe2O3
+
3H2O
盐类的水解第二课时盐的水解影响因素和应用
问题5:Al2(SO4)3溶液加热蒸干后得到固 体是什么?
平衡向右移动
NH3· H2O
c(H+) > c(OH-)
离子方程式: NH4+ + H2O NH3·H2O + H+
化学方程式:NH4Cl + H2O NH3·H2O + HCl
盐类水解影响因素及其应用及各种粒子关系PPT课件
右移 增大 增大 减小 增大 右移 增大 减小 增大 增大
黄色变浅 黄色变浅
右移 增大 增大 减小 减小 左移 增大 增大 减小 减小 右移 减小 减小 增大 增大 左移 增大 增大 减小 减小
黄色加深 黄色加深 红褐色沉淀 黄色加深
右移 减小 减小 增大
增大
有红褐色沉淀 及气体产生
左移 减小 减小 增大 减小 黄色变浅
常见双水解情况:
Al3+ 与HCO3-、CO32-、HS-、S2- 、 〔Al(OH)4〕-
Fe3+ 与HCO3-、CO32- 、〔Al(OH)4〕NH4+与 SiO32-
试写出上述双水解反应的离子方程式。
练习
1、为了使Na2S溶液中的C(Na+)和C(S2-)比值变小,
可加入的物质是( CD)
2、配制和储存易水解的盐溶液时,需考虑抑 制盐的水解。
如,配制FeCl3溶液? 将FeCl3粉末溶于水,加入稀盐酸抑制Fe3+的水解 配制CuSO4溶液? 将CuSO4溶于水,加入稀硫酸抑制Cu2+的水解
3、比较盐溶液酸碱性的强弱
(1)pH NaA大于 NaB
< 酸性 HA HB
(2)pH MgCl2大于AlCl3,
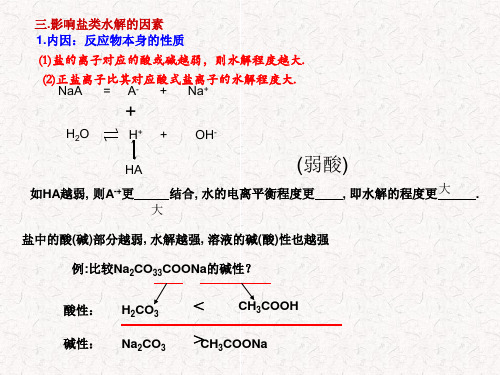
三.影响盐类水解的因素 1.内因:反应物本身的性质
(1)盐的离子对应的酸或碱越弱,则水解程度越大.
(2)正盐离子比其对应酸式盐离子的水解程度大. NaA = A- + Na+
+
H2O
H+ + OH-
HA
(弱酸)
如HA越弱, 则A-+更
结合, 水的电离平衡程度更
大
, 即水解的程度更大 .
影响盐类水解的因素和盐类水解的应用PPT张课件

(3)溶液的酸碱性 组成盐的离子能与水发生水解反应。向盐溶液中加入 H+,可 抑制阳离子水解,促进阴离子水解;向盐溶液中加入 OH-,能抑 制阴离子水解,促进阳离子水解。
注意:越弱越水解,越热越水解,越稀越水解,加酸碱抑制或 促进水解。
下面通过列举不同条件对 FeCl3 和 CH3COONa 水解平衡的影 响情况,分析影响盐类水解的因素:
13.解释某些生活现象时要考虑到盐的水解,如家庭用纯碱 (Na2CO3)去油污,就是利用其水解呈碱性,而碱可以使油脂水解变 成水溶性物质。
14.用于检验溶液:如用最简便的方法区别 NaCl、NH4Cl、 Na2CO3 三种无色透明溶液。可以利用 pH 试纸鉴别,pH=7 的是 NaCl 溶液;pH<7 的是 NH4Cl 溶液;pH>7 的是 Na2CO3 溶液。
17.制备某些胶体要用到盐类水解。如 Fe(OH)3 胶体的制备原 理是:FeCl3+3H2O===Fe(OH)3(胶体)+3HCl。
18.关于盐溶液蒸干后所得产物的判断方法
常见类型
溶液蒸干所得物质
蒸干时得氢氧化物和氧化物
金属阳离子易 的混合物,灼烧时得氧化物,
水解的挥发性 如 AlCl3(FeCl3)溶液蒸干时得 强酸盐 到 Al(OH)3 和 Al2O3[Fe(OH)3 和 Fe2O3]的混合物
干后得不到任何物质
加热时在溶液中就能分解也得不到原物
不稳定的化 质,如 Ca(HCO3)2溶液蒸干后得 CaCO3,
合物水溶液 Mg(HCO3)2 溶液蒸干后得 Mg(OH)2;
KHCO3 溶液蒸干后得 K2CO3
蒸干后得不到原物质,蒸干后得其氧化
易被氧化的
盐
产物,如 FeSO4 溶液蒸干后得 Fe2(SO4)3,
影响盐类水解的主要因素和盐类水解的应用 PPT课件

解析:二者都存在盐的水解和水的电离,A项 正确。B项中注意HCO3-电离出CO32-,HCO3-的水 解弱于CO32-,所以c(OH-)是前者小于后者,C项 错。D项中,加入NaOH固体,前者因OH-与 HCO3-反应而使c(CO32-)增大,后者因OH-抑制 CO32-的水解而使c(CO32-)增大,所以D项正确。
大家有疑问的,可以询问和交流
可以互相讨论下,但要小声点
3.水解平衡常数 水解反应的平衡常数叫做水解平衡常数或水解常数, 用Kh表示。 Kh=Kw·K1a或Kh=Kw·K1b
K数值越大,水解趋势越大。
尝试应用
1.向三份0.1 mol/L的CH3COONa溶液中分别加入 少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化), 则CH3COO-浓度的变化依次为( )
2.了解盐类水解在生产、生活、化学实验 和科学研究中的应用。
影响因素 答案:大 促进 大 促进 抑制 促进
综合拓展 盐类水解平衡及其移动(典型实例) 1.氯化铵水解平衡移动 NH4++H2O NH3·H2O+H+(正反应为吸热反应)
2.CH3COO-+H2O CH3COOH+OH-(正反应为吸热)
关于“离子浓度大小的比较规律”见章末知识热点专 题探究“二”
变式应用
2.Na2S溶液中存2-)>c(HS-)>c(OH-)>c(H+) B.c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) C.c(Na+)=c(HS-)+2c(H2S)+2c(S2-) D.c(OH-)=c(H+)+c(HS-)+2c(H2S)
尝试应用 2.在氯化铁溶液中存在下列平衡: FeCl3+3H2O Fe(OH)3+3HCl,ΔH>0。 (1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一
盐类水解的影响因素及应用PPT精品课件

④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
A.①②③
B.②③④
C.①④
D.①②③④
[解析]①NH4Cl 和 ZnCl2 溶液水解均显酸性,可除 去金属表面的锈;②Al3+与 HCO-3 水解相互促进,产生 大量 CO2,可作灭火剂;③草木灰的主要成分 K2CO3, 水解显碱性,而铵态氮肥水解显酸性,因而不能混合使 用;D 项,Na2CO3 溶液呈碱性,玻璃中的 SiO2 会与碱 反应生成 Na2SiO3,将瓶塞与瓶口黏结。
(1)写出下列溶液中存在的化学平衡:
①FeCl3溶液:Fe3++3H2O
H2O
H++OH- 。
Fe(OH)3+3H+,
②NaHCO3溶液:HCO- 3 +H2O H2CO3+OH-,
HCO-3
++CO23-,H2
++OH- 。
(2)生活常识告诉我们:热碱液去污能力更强,这 说明加热后Na2CO3溶液的碱性 增强 。
B.CH3COONa D.K2SO4
分析:本题用极值法分析,若各盐都不水解,则含阴离
子数目相同;对 CH3COO-+H2O
CH3COOH+
OH-,阴离子数目不变;对 CO23-+H2O
HCO- 3 +
OH-,阴离子数目增多。
答案:C
3.在氯化铵溶液中,下列关系式正确的是( ) A.c(Cl-)>c(NH+4 )>c(H+)>c(OH-) B.c(NH+4 )>c(Cl-)>c(H+)>c(OH-) C.c(Cl-)=c(NH+4 )>c(H+)=c(OH-) D.c(NH+4 )=c(Cl-)>c(H+)>c(OH-)
增大了,使 SO32-+H2
《影响盐类水解的因素和盐类水解的应用》课件

2. 结果分析
根据实验数据,分析不同因素对盐类水解的影响,如温度、浓度等。比较不同盐类的水解 程度和速率,探讨其内在原因。
3. 讨论
结合实验结果和相关理论知识,讨论盐类水解的原理和应用。探讨如何优化实验条件,提 高实验的准确性和可靠性。同时,可以进一步拓展研究其他因素对盐类水解的影响,如催 化剂、溶剂性质等。
造纸行业应用情况介绍
造纸废水处理
盐类水解技术可用于处理造纸废水, 通过水解反应去除废水中的木质素、 纤维素等有机物,降低废水的BOD (生化需氧量)和COD含量。
纸浆漂白
在纸浆漂白过程中,盐类水解技术可 以作为漂白剂的补充或替代,提高纸 浆的白度和亮度。
皮革加工行业应用情况介绍
皮革脱脂
盐类水解技术可用于皮革脱脂过 程,通过水解反应去除皮革中的 脂肪和油脂,提高皮革的柔软度 和透气性。
指导工业生产
盐类水解研究有助于揭示化学反应的规律 和机理,为化学学科的发展提供理论支持 。
在化工、冶金、纺织等工业生产中,盐类 水解反应的应用对于优化生产工艺、提高 产品质量具有重要意义。
环境保护
生物化学
盐类水解反应在废水处理、土壤改良等环 境保护领域具有广泛应用,有助于改善生 态环境质量。
在生物体内,许多生物化学反应都涉及到 盐类水解过程,研究盐类水解有助于深入 了解生物体内的化学变化。
皮革染色
在皮革染色过程中,盐类水解技 术可以改善染料的溶解性和渗透 性,提高染色的均匀度和色牢度 。
其他工业生产领域应用举例
01
石油开采
在石油开采过程中,盐类水解技术可用于处理含油废水,通过水解反应
去除废水中的油类和有机物,降低废水的污染程度。
02
冶金工业
根据实验数据,分析不同因素对盐类水解的影响,如温度、浓度等。比较不同盐类的水解 程度和速率,探讨其内在原因。
3. 讨论
结合实验结果和相关理论知识,讨论盐类水解的原理和应用。探讨如何优化实验条件,提 高实验的准确性和可靠性。同时,可以进一步拓展研究其他因素对盐类水解的影响,如催 化剂、溶剂性质等。
造纸行业应用情况介绍
造纸废水处理
盐类水解技术可用于处理造纸废水, 通过水解反应去除废水中的木质素、 纤维素等有机物,降低废水的BOD (生化需氧量)和COD含量。
纸浆漂白
在纸浆漂白过程中,盐类水解技术可 以作为漂白剂的补充或替代,提高纸 浆的白度和亮度。
皮革加工行业应用情况介绍
皮革脱脂
盐类水解技术可用于皮革脱脂过 程,通过水解反应去除皮革中的 脂肪和油脂,提高皮革的柔软度 和透气性。
指导工业生产
盐类水解研究有助于揭示化学反应的规律 和机理,为化学学科的发展提供理论支持 。
在化工、冶金、纺织等工业生产中,盐类 水解反应的应用对于优化生产工艺、提高 产品质量具有重要意义。
环境保护
生物化学
盐类水解反应在废水处理、土壤改良等环 境保护领域具有广泛应用,有助于改善生 态环境质量。
在生物体内,许多生物化学反应都涉及到 盐类水解过程,研究盐类水解有助于深入 了解生物体内的化学变化。
皮革染色
在皮革染色过程中,盐类水解技 术可以改善染料的溶解性和渗透 性,提高染色的均匀度和色牢度 。
其他工业生产领域应用举例
01
石油开采
在石油开采过程中,盐类水解技术可用于处理含油废水,通过水解反应
去除废水中的油类和有机物,降低废水的污染程度。
02
冶金工业
课件2:3.3.2 影响盐类水解的因素和盐类水解的应用

A.氧化镁 B.氢氧化钠
C.碳酸钠 D. 碳酸镁
9、明矾净水 KAl(SO4)·12H2O
氯化铁也能净水,原理与明矾一样。 练习:
1、某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl) 溶液反应为什么能产生H2? 2、书后溶解性表中,为何在提到Al2(CO3)3和 Fe2(CO3)3时显示的是“ — ”?
;
盐溶液中加水稀释,也可使平衡向 水解 方向移 动,盐的水解程度增大,但溶液酸性(或碱性)减小。
例:碳酸钠溶液加水稀释,水解程度 增大 ,溶 液的碱性 减弱 , pH 变小 。
5
2、溶液的酸碱性
溶液的酸碱性可以抑制或促进盐的水解。
例:
CH3COO- + H2O
CH3COOH + OH-
加酸:H+与OH-反应生成水,降低了生成物 浓 度,平衡向水解方向移动。即促进了 CH3COONa的水解。
第3章 水溶液中的离子平衡
第三节 盐类水解
第2课时 影响盐类水解的因素和盐类水解的应用
水解平衡属于化学平衡(广义)中的一种,
所以,勒夏特列原理同样适用于水解平衡。
一、主要因素: 盐本身的性质(内因)。
盐与水生成弱电解质的倾向越大(弱电 解质的电离常数越小),则水解的程度越大。
水解常数与弱酸(弱碱)的电离常数的关系式
• ⒊质子守恒(水的电离守恒):
• c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
• “大小比较”
• ⒈ CH3COONa溶液有那些离子,大小如何? • c(Na+)>c(CH3COO-)>c(OH-)>c(H+) • ⒉Na2CO3溶液有那些离子?大小如何? • c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+) • ⒊NH4Cl溶液有那些离子?大小如何? • c(Cl-)>c(NH4+)> c(H+)>c(OH-) • 练习:已知等物质的量浓度醋酸与醋酸钠混合溶
C.碳酸钠 D. 碳酸镁
9、明矾净水 KAl(SO4)·12H2O
氯化铁也能净水,原理与明矾一样。 练习:
1、某些活泼金属(如镁)与强酸弱碱盐(如NH4Cl) 溶液反应为什么能产生H2? 2、书后溶解性表中,为何在提到Al2(CO3)3和 Fe2(CO3)3时显示的是“ — ”?
;
盐溶液中加水稀释,也可使平衡向 水解 方向移 动,盐的水解程度增大,但溶液酸性(或碱性)减小。
例:碳酸钠溶液加水稀释,水解程度 增大 ,溶 液的碱性 减弱 , pH 变小 。
5
2、溶液的酸碱性
溶液的酸碱性可以抑制或促进盐的水解。
例:
CH3COO- + H2O
CH3COOH + OH-
加酸:H+与OH-反应生成水,降低了生成物 浓 度,平衡向水解方向移动。即促进了 CH3COONa的水解。
第3章 水溶液中的离子平衡
第三节 盐类水解
第2课时 影响盐类水解的因素和盐类水解的应用
水解平衡属于化学平衡(广义)中的一种,
所以,勒夏特列原理同样适用于水解平衡。
一、主要因素: 盐本身的性质(内因)。
盐与水生成弱电解质的倾向越大(弱电 解质的电离常数越小),则水解的程度越大。
水解常数与弱酸(弱碱)的电离常数的关系式
• ⒊质子守恒(水的电离守恒):
• c(OH-)=c(H+)+ c(HCO3-)+2c(H2CO3)
• “大小比较”
• ⒈ CH3COONa溶液有那些离子,大小如何? • c(Na+)>c(CH3COO-)>c(OH-)>c(H+) • ⒉Na2CO3溶液有那些离子?大小如何? • c(Na+)>c(CO32-)> c(OH-)>c(HCO3-)> c(H+) • ⒊NH4Cl溶液有那些离子?大小如何? • c(Cl-)>c(NH4+)> c(H+)>c(OH-) • 练习:已知等物质的量浓度醋酸与醋酸钠混合溶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【思考】
1.为什么KAl(SO4)2(明矾) , FeCl3 等盐可用做 净水剂?
2.纯碱为什么能去污?去污时为何用热水?
3.泡沫灭火器的化学反应原理是什么?
4.在必修I学习胶体性质时,我们知道制取氢 氧化铁胶体时是在沸水中滴入FeCl3溶液,你 现在知道其中的原理了吗?
二、盐类水解在生活中的应用:
MgCl2· 6H2O △ Mg(OH)2 △
MgO
晶体只有在干燥的HCl气流中加热,才能得到无水MgCl2
【课堂练习】
下列盐溶液加热蒸干、灼烧后,得到什么固体物质?
FeCl3 溶液
Fe2O3
,
Na2SO3 溶液 Na2SO4
,
Fe(NO3)3 溶液 Fe2O3
,
Ca(HCO3)2 溶液 CaCO3
Al(OH)3 + 3CO2
Fe3+ 与 CO32– 2Fe3+ + 3CO32– + 3H2O
Al3+ 与 AlO2–
2Fe (OH)3 + 3CO2
Al 3+ + 3AlO2 – + 6H2O 4Al(OH)3
某些盐的无水物,不能用蒸发溶液的方法制取
AlCl3溶液 蒸干 Al(OH)3 灼烧 Al2O3
,
Fe2(SO4)3 溶液 Fe2(SO4)3
.
水溶液中微粒浓度的大小比较: (考点)
1、电离理论:
① 弱电解质电离是微弱的 如: NH3 ·H2O 溶液中:
> > > c (NH3 ·H2O) c (OH–) c (NH4+) c (H+)
② 多元弱酸电离是分步,主要决定第一步 如:H2Sl(g)
加
NaOH
2、外因: ① 温度:升温,促进水解。
越热越水解
② 浓度:加水稀释,促进水解。 越稀越水解
③ 加酸:抑制 弱碱阳离子的水解。 促进 弱酸根离子的水解。
④ 加碱:促进 弱碱阳离子的水解。 抑制 弱酸根离子的水解。
第3章 水溶液中的离子平衡
第三节 盐类水解
第2课时 影响盐类水解的因素和盐类水解的应用
第3章 水溶液中的离子平衡
第三节 盐类水解
第2课时 影响盐类水解的因素和盐类水解的应用
一、盐类水解的影响因素
1、内因:盐本身的性质。(越弱越水解)
① 不同弱酸对应的盐
> 碱 性 NaClO (aq)
CH3COONa (aq)
< 对应的酸 HClO
CH3COOH
1、内因:盐本身的性质(。越弱越水解)
条件 升温
移动方向 c(H+) pH 水解程度
现象 颜色变深
加水稀释
颜色变浅
通HCl
颜色变浅
加Fecl3
加NaHCO3
颜色变深 红褐↓,无色↑
对于水解平衡 CH3COO– + H2O CH3COOH + OH–
改变条 件
方向 c(Ac– c(HAc
)
)
c(OH
–)
c(H
+)
pH 水解程度
升温
加H2O 加醋酸
> > > > c (Cl–) c (NH4+) c (H+) c (NH3·H2O) c (OH–)
③ 多元弱酸水解是分步,主要决定第一步
如:Na2CO3 溶液中:
> > > c (CO3–)
c (OH–)
c (HCO3–)
c (H2CO3)
单水解程度很小,水解产生的离子或分子浓度远远 小于弱离子的浓度。
升温,促进CO32–水解。
3、泡沫灭火器的原理
Al2(SO4)3 和 NaHCO3溶液:
混合前
Al 3+ + 3H2O HCO3– + H2O
Al(OH)3 + 3H + H2CO3 + OH –
混合后 Al 3+ + 3HCO3– Al(OH)3 + 3CO2
塑料内筒装有Al2(SO4)3溶液 外筒装有NaHCO3溶液
> > > > c (H2S) c (H+) c (HS–) c (S2–) c (OH–)
对于弱酸、弱碱,其电离程度小,产生的离子浓度远 远小于弱电解质分子的浓度。
2、水解理论:
① 弱离子由于水解而损耗。
> 如:KAl(SO4)2 溶液中:c (K+) c (Al3+)
② 水解是微弱 如:NH4Cl 溶液中:
Fe3+ + 3H2O Fe(OH)3 + 3H+
配制 FeCl2溶液:加少量 稀盐酸和Fe粉 ;
配制 CuSO4溶液:加少量
稀硫酸
;
判定离子能否大量共存:
对于发生“完全双水解”的盐类,因水解彻底, 故用“=”,同时有沉淀↓和气体↑产生。例如:
Al3+ 与 HCO3–
Al 3+ + 3HCO3 –
三、盐类水解在化学实验中的应用:
例1.相同温度相同物质的量浓度的几种溶液: ①NH4Cl②NaCl③ Na2CO3④ NaHCO3 ⑤ CH3COONa 其溶液的pH值由小到大的顺序是 _①___②___⑤___④__③_______
易水解盐溶液的配制与保存:
配制、保存溶液应该 抑制 水解
配制 FeCl3溶液:加少量 稀盐酸 ;加相应的酸或碱
② 不同弱碱对应的盐
< 酸 性 MgCl2 (aq)
AlCl3 (aq)
> 对应的碱 Mg(OH)2
Al(OH)3
③ 同一弱酸对应的盐
> 碱 性 Na2CO3 (aq)
NaHCO3 (aq)
对应的酸
< HCO3–
H2CO3
> ∴ 正盐的水解程度
酸式盐的水解程度
3
对于水解平衡
Fe3++3H2O
Fe(OH)3+3H+
1、盐作净化剂的原理: 明矾KAl(SO4)2 、FeCl3 等
Al 3+ + 3H2O Fe 3+ + 3H2O
Al(OH)3 (胶体) + 3H + Fe (OH)3 (胶体) + 3H +
本身无毒,胶体可吸附不溶性杂质,起到净水作用。
2、热的碱水去污
CO3 2– + H2O
HCO3 – + OH –
