帕博西尼说明书翻译
palbociclib的全部数据

Home·Pfizer’s Potential Mega-Blockbuster Breast Cancer Drug 辉瑞口服乳腺癌药物帕博西尼(palbociclib)Pfizer’s PotentialMega-Blockbuster Breast Cancer Drug 辉瑞口服乳腺癌药物帕博西尼(palbociclib)2015年9月5日辉瑞公司的口服乳腺癌药物帕博西尼(palbociclib, Ibrance, 帕博西林)能否成为重磅炸弹产品?帕博西尼(Palbociclib)是近来备受关注的也是辉瑞最重要试验药物之一,2015年2月3日FDA提前批准辉瑞CDK4/6双抑制剂Palbociclib (商品名Ibrance)作为一线药物治疗ER阳性、HER2阴性乳腺癌,比原定4月13日的PDUFA日期提前两个多月。
分析人士预计,palbociclib每年销售额最高可达到30亿-50亿美元之多。
在一项2期临床研究中,使晚期乳腺癌患者的无进展生存期(PFS)平均增加一倍,但对患者总生存期(OS)未显示有统计学意义上的明显改善。
据研究人员2014年4月在圣地亚哥举行的美国癌症研究协会会议上发布的最新数据显示,雌激素受体阳性转移性乳腺癌患者在合并使用Palbociclib与抗雌激素药物来曲唑时,其PFS平均为20.2个月,相比之下,单独使用来曲唑的患者其PFS平均为10.2个月。
辉瑞公司决定在今年第三季度根据乳腺癌试验药物Palbociclib的2期临床试验结果即向美国食品药监局(FDA)申请上市批准,Palbociclib(又名PD-0332991)最早进入人们视野的是在2012年圣安东尼奥乳腺癌会议上(SABCS),一经发布就引起行业广泛关注。
Palbociclib是一种口服的细胞周期素依赖性激酶4、6的抑制药物,主要通过调节细胞周期发挥作用。
Palbociclib主要通过抑制CDK4/6活性来阻止细胞由G1期到S期进而抑制DNA的合成。
生物制药技术在种类繁多的药物中的应用案例

生物制药技术在种类繁多的药物中的应用案例生物制药技术是指利用生物学的原理和方法,通过对生物相关基因、蛋白质和细胞的研究,开发和应用生物制造技术来生产药物和生物治疗产品。
随着科学技术的进步,生物制药技术已成为现代医药产业中的重要组成部分。
在这篇文章中,我将为大家列举一些生物制药技术在不同种类药物中的应用案例。
1. 重组蛋白(Recombinant Protein)药物:重组蛋白药物是由基因重组技术获得的具有生物活性的蛋白质。
由于这些药物能更好地模拟人体自身产生的蛋白质,因此广泛应用于治疗多种疾病。
例如,重组人胰岛素是一种用于治疗糖尿病的常用药物。
通过利用基因工程技术将人类胰岛素基因插入到大肠杆菌或酵母等表达系统中,生产出与人体胰岛素分子结构相似的胰岛素。
2. 抗体药物(Monoclonal Antibodies):抗体药物是由单克隆抗体制备而成的药物,在抗癌、抗炎、免疫调节等领域有广泛应用。
其中最著名的例子是帕博西尼(Herceptin),一种治疗HER2阳性乳腺癌的单克隆抗体药物。
帕博西尼基于HER2蛋白质,并通过抑制 HER2受体的活性来抑制癌细胞生长。
3. 基因治疗(Gene Therapy):基因治疗是一种新型的治疗方法,通过向人体细胞中传递正常的基因来修复异常基因导致的疾病。
例如,在罕见遗传性疾病脊肌萎缩症中,使用基因治疗给患者注射正常的SMN1基因来恢复患者肌肉功能。
这种治疗方法被认为是未来治疗多种遗传疾病的希望。
4. 疫苗(Vaccines):疫苗是一种预防传染病的生物制剂。
利用生物制药技术,疫苗制造商能够生产出高效且安全的疫苗。
例如,经典的麻疹、腮腺炎和风疹(MMR)联合疫苗,通过利用合适的表达系统,生产出包含麻疹、腮腺炎和风疹等三种病毒抗原的疫苗。
5. 基因工程药物 (Genetically Engineered Drugs):基因工程药物是通过改造生物体的基因来生产药物的技术。
乳腺癌神药-帕博西尼

乳腺癌神药-帕博西尼
乳腺癌是世界上第⼆⼤癌症恶性肿瘤,同时也是我国第⼀⼤⼥性健康杀⼿,每年都有⾮常多的乳腺癌患者离世,其中还包括了⼀些我们⼈熟能详明星,⽐如姚贝娜等等。
对于晚期乳腺癌的治疗我们通常使⽤的是靶向性抑制剂,其中帕博西尼就是众多乳腺癌抑制剂中疗效最佳的⼀款,但是由于价格昂贵导致很多患者不得不放弃,不过近⽇帕博西尼正式在我国上市了并且改名为爱博新。
帕博西尼是⼀种⼝服、靶向性CDK4/6抑制剂,能够选择性抑制细胞周期蛋⽩依赖性激酶4和
6(CDK4/6),恢复细胞周期控制,阻断肿瘤细胞增殖。
细胞周期失控是癌症的⼀个标志性特征,CDK4/6在许多癌症中均过度活。
该药治疗效果好:帕博西尼较来曲唑可使乳腺癌⽆进展⽣存期延长⼀倍,是乳腺癌患者的新希望,疗效获得突破。
并且不良反应发⽣率低:帕博西尼是胶囊剂,⼝服即可,与注射剂相⽐,安全性更⾼,便于患者服⽤,提⾼患者依从性。
此外这种药并没有传统化疗的副作⽤,如⾻髓抑制和肠道反应等较轻微。
最后提醒各位虽然帕博西尼/爱博新在我国已经上市了,但是由于还没有纳⼊医保,再加上刚刚上市所以售价⾮常⾼昂,根本不是⼀般家庭能够承受的起的,我们想要⽤帕博西尼治疗乳腺癌可以⽤孟加拉仿制版本,孟加拉帕博西尼也是刚刚上市不久,其疗效也是有着众多的研究实验作为⽀撑的。
如果患者想购买价格更低的孟加拉帕博西尼可以联系咨询我们。
卵巢癌帕博西尼治疗方案

一、概述卵巢癌是一种高度恶性的妇科肿瘤,其发病率位居女性生殖系统恶性肿瘤的第二位。
卵巢癌的治疗方法主要包括手术、化疗、放疗、靶向治疗和免疫治疗等。
帕博西尼(Pazopanib)是一种多靶点抗血管生成药物,近年来在卵巢癌的治疗中取得了显著的疗效。
本文将详细介绍卵巢癌帕博西尼治疗方案。
二、帕博西尼的作用机制帕博西尼是一种口服的小分子多靶点抗血管生成药物,主要通过抑制血管内皮生长因子(VEGF)受体2(VEGFR2)的活性,阻断肿瘤血管生成,从而抑制肿瘤生长和转移。
此外,帕博西尼还能抑制其他与肿瘤生长和转移相关的信号通路,如血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)等。
三、帕博西尼治疗方案1. 适应症帕博西尼主要用于以下情况:(1)晚期卵巢癌患者,经一线化疗后疾病进展或复发。
(2)晚期卵巢癌患者,一线化疗期间或治疗后病情稳定,但无手术指征。
2. 用法用量帕博西尼口服,每日一次,每次750mg,餐后服用。
患者应根据医生的建议调整剂量,并在治疗过程中定期复查肝肾功能。
3. 治疗周期帕博西尼的治疗周期为21天,即连续服用帕博西尼21天,休息7天,然后重复上述过程。
4. 联合治疗帕博西尼可与其他化疗药物联合使用,以提高疗效。
以下是一些常见的联合治疗方案:(1)帕博西尼+卡铂+紫杉醇:适用于晚期卵巢癌患者的一线治疗。
(2)帕博西尼+顺铂+长春瑞宾:适用于晚期卵巢癌患者的二线治疗。
5. 不良反应及处理帕博西尼的不良反应主要包括:(1)高血压:帕博西尼可引起血压升高,患者需定期监测血压,必要时调整剂量或使用降压药物。
(2)手足综合症:表现为手足麻木、疼痛、肿胀等症状,可使用抗过敏药物、冷敷等方法缓解。
(3)皮疹:帕博西尼可引起皮疹,可使用抗过敏药物、外用激素等治疗。
(4)肝肾功能损害:帕博西尼可引起肝肾功能损害,患者需定期复查肝肾功能,必要时调整剂量或停药。
四、疗效评估帕博西尼在卵巢癌治疗中的疗效主要体现在以下几个方面:1. 提高无进展生存期(PFS):帕博西尼可显著提高晚期卵巢癌患者的无进展生存期。
2023肝癌NCCN指南解读

2023肝癌NCCN指南解读前言非小细胞肝癌(HCC)是一种在全球范围内广泛分布的恶性肿瘤,严重威胁人类健康。
为了提高肝癌的诊治水平,美国国家综合癌症网络(NCCN)定期发布肝癌治疗指南,为全球医生提供权威的治疗参考。
本文档将为您详细解读2023年NCCN肝癌指南的最新变化和要点。
指南更新要点1. 风险评估与分期NCCN指南对肝癌的风险评估与分期进行了详细阐述,以便为制定治疗方案提供依据。
其中包括:- 肝功能评估:采用Child-Pugh分级方法评估患者的肝功能。
- 肿瘤分期:根据肿瘤大小、数量、侵犯范围等因素进行TNM 分期。
- 血管侵犯:新增对门静脉、肝动脉和胆管侵犯的评估。
2. 治疗策略NCCN指南针对不同阶段的肝癌提出了具体的治疗策略,包括:- 早期肝癌:手术切除、消融治疗、移植治疗等。
- 中晚期肝癌:系统性抗肿瘤治疗、局部治疗、靶向治疗、免疫治疗等。
- 晚期肝癌:姑息性治疗、靶向治疗、免疫治疗等。
3. 靶向治疗靶向治疗在肝癌治疗中具有重要地位,NCCN指南推荐以下靶向药物:- 索拉非尼(Sorafenib):适用于不能手术切除的中晚期肝癌患者。
- 乐伐替尼(Lenvatinib):适用于晚期肝癌患者。
- 帕博西尼(Pembrolizumab):与乐伐替尼联合使用,适用于晚期肝癌患者。
4. 免疫治疗免疫治疗在肝癌治疗中的地位日益上升,NCCN指南推荐以下免疫检查点抑制剂:- 帕博西尼(Pembrolizumab):适用于晚期肝癌患者。
- 纳武利尤单抗(Nivolumab):适用于晚期肝癌患者。
5. 综合治疗NCCN指南强调肝癌的综合治疗,包括:- 手术、消融治疗与系统性治疗的结合。
- 靶向治疗与免疫治疗的联合应用。
- 支持治疗:如肝功能保护、营养支持、疼痛管理等。
总结2023年NCCN肝癌指南为全球医生提供了关于肝癌诊断、评估和治疗的权威参考。
我国医生应结合我国国情和患者实际情况,遵循指南推荐的治疗策略,提高肝癌的诊治水平,为患者带来更好的预后。
细胞周期依赖性激酶CDKs介绍
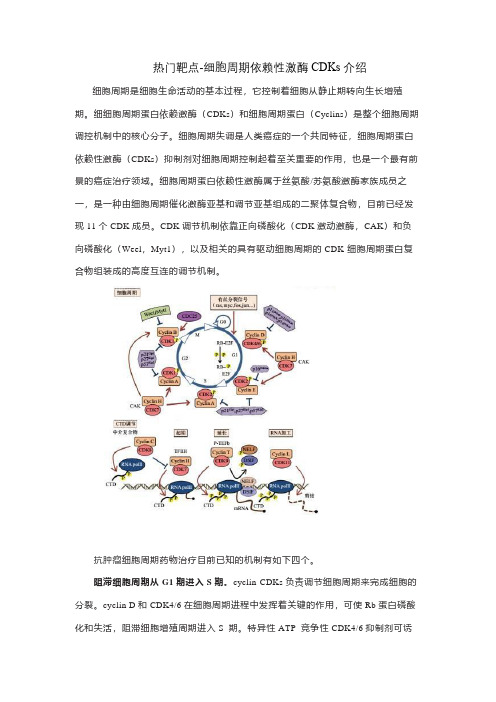
热门靶点-细胞周期依赖性激酶CDKs介绍细胞周期是细胞生命活动的基本过程,它控制着细胞从静止期转向生长增殖期。
细细胞周期蛋白依赖激酶(CDKs)和细胞周期蛋白(Cyclins)是整个细胞周期调控机制中的核心分子。
细胞周期失调是人类癌症的一个共同特征,细胞周期蛋白依赖性激酶(CDKs)抑制剂对细胞周期控制起着至关重要的作用,也是一个最有前景的癌症治疗领域。
细胞周期蛋白依赖性激酶属于丝氨酸/苏氨酸激酶家族成员之一,是一种由细胞周期催化激酶亚基和调节亚基组成的二聚体复合物,目前已经发现11个CDK成员。
CDK调节机制依靠正向磷酸化(CDK激动激酶,CAK)和负向磷酸化(Weel,Myt1),以及相关的具有驱动细胞周期的CDK-细胞周期蛋白复合物组装成的高度互连的调节机制。
抗肿瘤细胞周期药物治疗目前已知的机制有如下四个。
阻滞细胞周期从G1期进入S期。
cyclin-CDKs负责调节细胞周期来完成细胞的分裂。
cyclin D和CDK4/6在细胞周期进程中发挥着关键的作用,可使Rb蛋白磷酸化和失活,阻滞细胞增殖周期进入S 期。
特异性ATP 竞争性CDK4/6抑制剂可诱导Rb 蛋白阳性肿瘤不可逆的细胞周期G1期阻滞。
选择性CDK4/6抑制剂包括ribociclib、abemaciclib和palbociclib,阻滞细胞从G1期进入S期,提高抗肿瘤效果。
诸多的细胞周期治疗药物中,批准临床应用只有CDK4/6抑制剂ribociclib、abemaciclib、palbociclib,阻滞细胞周期从G1期进入S期,激活抗肿瘤免疫,控制代谢功能和调节转录水平。
调节转录水平有丝分裂期间细胞转录保持在低水平状态,只有当丝分裂结束后转录才会重新激活。
CDK9 和CDK12可调控细胞转录。
细胞周期治疗领域的研究主要是寻找转录CDKs的抑制剂。
激活抗肿瘤免疫研究证实,CDK4/6抑制剂不仅能诱导肿瘤细胞周期阻滞,还促抗肿瘤免疫:首先,CDK4/6抑制剂激活肿瘤细胞内源性逆转录病毒成分表达,增加细胞内双链RNA水平,进而刺激产生Ⅲ 型干扰素并增加肿瘤抗原递呈;其次,CDK4/6抑制剂显著抑制调节性T细胞的增殖,促进细胞毒性T细胞对肿瘤细胞的清除。
癌症靶向药
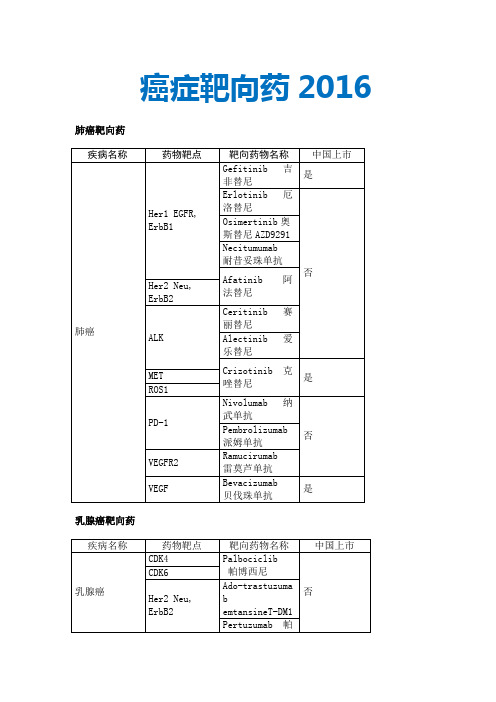
CDK6
Her2 Neu, ErbB2
Ado-trastuzumab emtansineT-DM1
Pertuzumab帕妥珠单抗
Trastuzumab曲妥珠单抗
是
Lapatinib拉帕替尼
Her1 EGFR, ErbB1
mTOR
Everolimus依维莫司
结直肠癌靶向药
疾病名称
药物靶点
靶向药物名称
是
mTOR
Temsirolimus替西罗莫司
否
VEGFR, PDGFR, KIT
Pazopanib帕唑帕尼
KIT, PDGFR, RAF, VEGFR
Sorafenib索拉菲尼
是
PDGFRα/β, VEGFR1/2/3, KIT, FLT3, RET
Sunitinib舒尼替尼
VEGF
Bevacizumab贝伐珠单抗
CD20
Obinutuzumab奥滨尤妥珠单抗
Ofatumumab奥法木单抗
Rituximab利妥西单抗
是
CD52
Alemtuzumab阿伦单抗
否
PI3Kδ
Idela
CD3
BCL2
Venetoclax
淋巴瘤靶向药
疾病名称
药物靶点
靶向药物名称
中国上市
淋巴癌
BTK
否
骨巨细胞瘤
RANKL
Denosumab狄诺塞麦
基底细胞癌
PTCH
Vismodegib维莫德吉
Smoothened
Sonidegib索尼德吉
头颈癌
Her1 EGFR, ErbB1
Cetuximab西妥西单抗
是
首个CDK4/6抑制剂帕博西尼的药理和临床综述

b r e a s t c a n c e r a s i n i t i a l e n d o c f n e — b a s e d t h e r a p y f o r t h e i r me t a s t a t i c d i s e a s e we r e i n t r o d u c e d .T h e r e l a t e d r e g i s t r a t i o n nd a c l i n i c l a d a t a o f
o f t h e Fi r s t CDK4 / 6 I n hi bi t o r Pa l b o c i c l i b
S U N H u i j u a n , Z H A N G J u h o n g , WA N G L i l i , Z H A N G J i a n q i a n g
[ 关键词 ] 帕博西尼 ; 来 曲唑 ; 晚期乳腺癌 [ 中图分类号 ] R 9 6 9 [ 文献标识码 ] A [ 文章编号] 2 0 9 5— 3 5 9 3 ( 2 0 1 6 ) 0 5— 0 4 2 6—0 5
A Re v i e w o f Ph a r ma c o l o g i c a l a n d Cl i n i c a l Re s e a r c h
S h a n g d o n g J i Mn 2 5 0 1 0 1 , Ch i n a:
2 . S h a n d o n g F r e d a P h a r m a c e u t i c a l G r o u p C o . , L t d . , S h a n d o n g P r o v i ci n a l ey K ab L o r a t o r y o fMu c o s a l a n d
帕博西尼说明书翻译

Ibrance(palbociclib)使用说明书2015年第一版批准日期:2015年2月3日;公司:Pfizer Inc.加速批准,突破性治疗指定和优先审评FDA 药品评价和研究中心血液学和肿瘤产品室主任说:“palbociclib添加至来曲唑对被诊断有转移乳癌妇女提供一种新颖治疗选择,”“FDA承诺通过我们的加快批准监管加快癌症药物的上市批准。
”/drugsatfda_docs/label/2015/207103s000lbl.pdf处方资料重点这些重点不包括安全和有效使用IBRANCE所需所有资料。
请参阅IBRANCE完整处方资料。
IBRANCE®(palbociclib)胶囊,为口服使用美国初次批准:2015适应证和用途IBRANCE是一个激酶抑制剂适用与来曲唑联用为有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女的治疗作为初始基于内分泌治疗对其转移疾病。
这个适应证是根据无进展生存(PFS)在加速批准下被批准。
剂型批准此适应证可能取决于在验证性试验中临床获益的证明和描述。
(1)剂量和给药方法IBRANCE胶囊是与食物与来曲唑联用口服。
(2)⑴推荐开始剂量:125 mg每天一次与食物服用共21天接着7天不治疗。
(2.1)⑵建议根据个体安全性和耐受性中断和/或剂量减低给药。
(2.2)剂型和规格胶囊:125 mg,100 mg,和75 mg(3)禁忌证无(4)警告和注意事项⑴血液学:可能发生中性粒细胞减少。
监视完全血细胞计数IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时。
(5.1)⑵感染:监视体征和症状和适当时不给药。
(5.2)⑶胚胎胎儿毒性:可能致胎儿危害。
忠告患者对胎儿潜在风险和使用有效避孕。
(5.4,8.1,8.3)不良反应最常见不良反应(发生率≥10%)是中性粒细胞减少,白细胞减少,疲乏,贫血,上呼吸道感染,恶心,口炎,脱发,腹泻,血小板减少,食欲减退,呕吐,乏力,周围神经病变,和鼻衄。
Zelboraf(vemurafenib)片使用说明书

[转载]Zelboraf(vemurafenib)片使用说明书2011年8月第一版(2011-08-31 22:37:11)转载▼标签:转载原文地址:Zelboraf(vemurafenib)片使用说明书2011年8月第一版作者:tangzhongming Zelboraf(vemurafenib)片使用说明书2011年8月第一版批准日期:2011年8月17日;公司:Plexxikon Inc. HOFFMAN-LA ROCHEFDA的药物评价和研究中心肿瘤药品办公室主任Richard Pazdur, M.D.说“"对有后期黑色素瘤患者今年是重要一年。
Zelboraf是证实改善总生存的第二个被批准新抗癌药物” “3月我们批准了Yervoy(ipilimumab),为后期黑色素瘤另一个新治疗,接受药物后也显示延长患者生存。
”FDA的设备和放射健康部中的在体外诊断设备评价和安全性办公室主任Alberto Gutierrez, Ph.D说:“今天批准的Zelboraf和cobas检验是发展伴随诊断和使用以保证患者以安全方式被暴露至高度有效,更个体化治疗一个大实例。
”译自:/drugsatfda_docs/label/2011/202429s000lbl.pdf处方资料重点这些重点不包括安全和有效使用ZELBORAF所需所有资料。
请参阅下文为ZELBORAF的完整处方资料ZELBORAF™ (vemurafenib)口服片美国初始批准:2011适应证和用途ZELBORAF™是一种激酶抑制剂适用于有不可切除或转移黑色素瘤有用FDA-批准的检验检测BRAFV600E突变患者的治疗。
(1, 5.10)使用限制:有野生型BRAF黑色素瘤患者中建议不使用ZELBORAF。
(5.10, 14)剂量和给药方法(1)推荐剂量:960 mg口服bid。
(2.1)(2)接近12小时间隔给予ZELBORAF有或无进餐。
帕博西尼产品幻灯

2、感染
患者中性粒细胞减少,白细胞减少,导致机体免疫力降低,容易感染,尤其是上呼吸道感染,治疗期间,需监测患者症状和 体征,早期诊断,给予抗感染药物,必要时需停止使用帕博西尼。
3、新陈代谢与营养不良:如食欲减退。
食用增加食欲,改善味觉、易消化吸收的食物(如含B族维生素的食物),改善营养,或服用健胃消食片。平时注意适当锻 炼,放松心情。
研究结果: 至2016年2月26日,共发生331例PFS事件。两组基线特征相似。中位PFS为24.8月(P+L)比14.5 月(安慰剂+L)(HR=0.58 [0.46–0.72], P<0.000001)。P+L组改善ORR(42.1%比34.7%, P=0.031; 可测量病灶者55.3%比44.4% [P=0.013])。OS数据尚未成熟,待进一步分析。
✓ 当与来曲唑联用时,来曲唑的推荐剂量为2.5mg,口服,每天一次,在整个28天治 疗周期连续服药
给药方法
1. 口服。应与食物同服,随餐服药以确保哌柏西利暴露量一致。帕博西尼不得与葡萄柚或葡萄柚 汁同服。
2. 帕博西尼胶囊应整粒吞服(吞服前不得咀嚼、压碎或打开胶囊)。如果胶囊出现破损、裂纹或 其他不完整的情况,则不得服用。
B. 白血球减少症:轻度白血球减少可不必忧虑,其引发感染的危险性和健康人差别不大,中、重度者可以服用“升白药” 如碳酸锂、B族维生素或中药治疗,必要时可输白细胞。
C. 血:贫血患者以饮食补铁补血为主,必要时应考虑采用促红细胞生成素治疗或输血治疗。 D. 血小板减少:血小板减少会导致凝血功能差,简单来说就是出血不容易止住,因此一定要防止出血,轻中度患者可以口
帕博西尼说明书翻译

Ibrance(palbociclib)使用说明书2015年第一版批准日期:2015年2月3日;公司:PfizerInc.加速批准,突破性治疗指定和优先审评FDA药品评价和研究中心血液学和肿瘤产品室主任说:“palbociclib添加至来曲唑对被诊断有转移乳癌妇女提供一种新颖治疗选择,”“FDA承诺通过我们的加快批准监管加快癌症药物的上市批准。
”完整处方资料。
IBRANCE人表皮生剂量和给药方法?IBRANCE胶囊是与食物与来曲唑联用口服。
(2)?⑴推荐开始剂量:125mg每天一次与食物服用共21天接着7天不治疗。
(2.1)?⑵建议根据个体安全性和耐受性中断和/或剂量减低给药。
(2.2)?剂型和规格胶囊:125mg,100mg,和75mg(3)?禁忌证无(4)?警告和注意事项⑴血液学:可能发生中性粒细胞减少。
监视完全血细胞计数IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时。
(5.1)?(5.4,8.1,不良反应CYP3ACYP3ACYP3A底物:有狭窄治疗指数敏感CYP3A4底物当与IBRANCE同时给予时剂量可能需要减低。
(7.3)?完整处方资料1适应证和用途?IBRANCE是适用与来曲唑联用对有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女作为初始基于内分泌治疗对其转移疾病的治疗.? 这个适应证是根据无进展生存(PFS)在加速批准下被批准的[见临床研究(14)]。
对此适应证的继续批准可能取决于在验证性试验中临床获益的证明和描述。
2剂量和给药方法?2.1一般给药信息?IBRANCE疗7与来曲唑剂量。
2.2/或减低剂(5),不良反应(6)和临床研究(14)]。
见制造商处方资料对共同给药产品,来曲唑,在毒性事件中剂量调整指导原则和其他相关安全性资料或禁忌证。
为与强避免强如抑制3125mg“PBC125”100mg体上75mg“PBC75”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ibrance(palbociclib)使用说明书2015年第一版批准日期:2015年2月3日;公司:Pfizer Inc.加速批准,突破性治疗指定和优先审评FDA 药品评价和研究中心血液学和肿瘤产品室主任说:“palbociclib添加至来曲唑对被诊断有转移乳癌妇女提供一种新颖治疗选择,”“FDA承诺通过我们的加快批准监管加快癌症药物的上市批准。
”/drugsatfda_docs/label/2015/207103s000lbl.pdf处方资料重点这些重点不包括安全和有效使用IBRANCE所需所有资料。
请参阅IBRANCE完整处方资料。
IBRANCE®(palbociclib)胶囊,为口服使用美国初次批准:2015适应证和用途IBRANCE是一个激酶抑制剂适用与来曲唑联用为有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女的治疗作为初始基于内分泌治疗对其转移疾病。
这个适应证是根据无进展生存(PFS)在加速批准下被批准。
剂型批准此适应证可能取决于在验证性试验中临床获益的证明和描述。
(1)剂量和给药方法IBRANCE胶囊是与食物与来曲唑联用口服。
(2)⑴推荐开始剂量:125 mg每天一次与食物服用共21天接着7天不治疗。
(2.1)⑵建议根据个体安全性和耐受性中断和/或剂量减低给药。
(2.2)剂型和规格胶囊:125 mg,100 mg,和75 mg(3)禁忌证无(4)警告和注意事项⑴血液学:可能发生中性粒细胞减少。
监视完全血细胞计数IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时。
(5.1)⑵感染:监视体征和症状和适当时不给药。
(5.2)⑶胚胎胎儿毒性:可能致胎儿危害。
忠告患者对胎儿潜在风险和使用有效避孕。
(5.4,8.1,8.3)不良反应最常见不良反应(发生率≥10%)是中性粒细胞减少,白细胞减少,疲乏,贫血,上呼吸道感染,恶心,口炎,脱发,腹泻,血小板减少,食欲减退,呕吐,乏力,周围神经病变,和鼻衄。
(6)报告怀疑不良反应,联系Pfizer公司电话1-800-438-1985或FDA电话1-800-FDA-1088或/medwatch.药物相互作用CYP3A抑制剂:避免IBRANCE与强CYP3A抑制剂的同时使用。
如强抑制剂不能避免,减低IBRANC剂量。
(2.2,7.1)CYP3A诱导剂:避免IBRANCE与强和中度CYP3A诱导剂的同时使用。
(7.2)CYP3A底物:有狭窄治疗指数敏感CYP3A4底物当与IBRANCE同时给予时剂量可能需要减低。
(7.3)完整处方资料1 适应证和用途IBRANCE是适用与来曲唑联用对有雌激素受体(ER)-阳性,人表皮生长因子受体2(HER2)-阴性晚期乳癌绝经后妇女作为初始基于内分泌治疗对其转移疾病的治疗.这个适应证是根据无进展生存(PFS)在加速批准下被批准的[见临床研究(14)]。
对此适应证的继续批准可能取决于在验证性试验中临床获益的证明和描述。
2 剂量和给药方法2.1 一般给药信息IBRANCE的推荐剂量是一粒125 mg胶囊口服服用每天一次共21连续天接着不用治疗7天组成一个28天完整疗程。
IBRANCE应与食物服用[见临床药理学(12.3)]与来曲唑2.5 mg每天一次联用连续28-天疗程自始至终给予。
应鼓励患者在每天接近相同时间服用他们的剂量。
如患者呕吐或丢失一剂,在那天不应服用另外剂量。
在寻常的时间服用下一次处方剂量。
IBRANCE胶囊应被整吞(在吞咽前不要咀嚼,压碎或打开胶囊)。
如破碎,压碎或不完整时不应摄入胶囊。
2.2 剂量调整建议根据个体安全性和耐受性调整IBRANCE剂量[见警告和注意事项(5)]。
某些不良反应的处理[见警告和注意事项(5)]可能需要暂时中断剂量/延迟和/或减低剂量,或永久终止如同表1,2和3提供每种剂量减低计划[见警告和注意事项(5),不良反应(6)和临床研究(14)]。
见制造商处方资料对共同给药产品,来曲唑,在毒性事件中剂量调整指导原则和其他相关安全性资料或禁忌证。
为与强CYP3A抑制剂使用剂量调整避免强CYP3A抑制剂的同时使用和考虑没有或小CYP3A抑制作用另外同时药物。
如患者必须用强CYP3A抑制剂共同给药,减低IBRANC剂量至75 mg每天一次。
如强抑制剂被终止,增加IBRANCE剂量(抑制剂的3–5个半衰期后)至强CYP3A抑制剂使用前剂量[见药物相互作用(7.1)和临床药理学(12.3)]。
3 剂型和规格125 mg胶囊:不透明硬明胶胶囊,大小0,有焦糖帽和体,帽上用白墨汁印,体上“PBC 125”。
100 mg胶囊:不透明硬明胶胶囊,大小1,有焦糖帽和浅橙色体,帽上用白墨汁印,体上“PBC 100”。
75 mg胶囊:不透明硬明胶胶囊,大小2,有浅橙色帽和体,帽上用白墨汁印,体上“PBC 75”。
4 禁忌证无5 警告和注意事项5.1 中性粒细胞减少在临床试验用IBRANCE中曾观察到嗜中性计数减低。
在随机临床试验接受IBRANCE加来曲唑患者报道嗜中性计数3(57%)或4级(5%)减低(研究1)。
任何级别中性粒细胞减少每实验室数据的首次发作中位时间为15天(13-117天)。
≥3级中性粒细胞减少中位时间为7天[见不良反应(6.1)]。
在IBRANCE临床计划中曾报道发热性中性粒细胞减少事件,虽然在研究1中未观察到发热性中性粒细胞减少病例。
IBRANCE治疗开始前和在每个疗程开始,以及在头两个疗程第14天,和当临床指示时监视完全血细胞计数。
建议对发生3或4级中性粒细胞减少患者剂量中断,剂量减低或延迟治疗疗程开始[见剂量和给药方法(2.2)]。
5.2 感染在研究1中用IBRANCE加来曲唑治疗患者与单独来曲唑治疗患者比较曾报道感染较高率。
用IBRANCE加来曲唑治疗患者3或4级感染发生5%而单独用来曲唑治疗患者没有经受3或4级感染。
监视患者感染的体征和症状和当医疗适当时治疗。
5.3 肺栓塞在研究1中用IBRANCE加来曲唑治疗患者(5%)曾报道肺栓塞较高率,与之比较单独用来曲唑治疗患者无病例。
监视患者肺栓塞体征和症状和当医疗适当时治疗。
5.4 胚胎胎儿毒性根据动物中发现和作用机制,IBRANCE可能致胎儿危害。
在大鼠和兔中在母体暴露根据曲线下面积(AUC)人临床暴露大于或等于4倍时IBRANCE致胚胎胎儿毒性。
忠告有生殖潜能女性在用IBRANCE治疗期间和末次剂量后至少2周使用有效避孕[见在特殊人群中使用(8.1,8.3)和临床药理学(12.1)]。
6 不良反应在说明书其他处描述以下标题:●中性粒细胞减少[见警告和注意事项(5.1)]●感染[见警告和注意事项(5.2)]●肺栓塞[见警告和注意事项(5.3)]6.1 临床研究经验因为临床试验是在广泛不同情况下进行的,临床试验观察到不良反应率不能与另一种药临床试验发生率直接比较而且可能不反映实践中观察到的发生率。
在研究1中评价IBRANCE(125 mg/day)加来曲唑(2.5 mg/day)相比单独来曲唑的安全性。
下面描述数据反映在研究1中在83/160例有ER-阳性,HER2-阴性晚期乳癌接受至少1剂治疗患者对IBRANCE暴露。
对palbociclib治疗中位时间为13.8个月而对单独来曲唑臂来曲唑治疗中位时间为7.6个月.在研究1中接受IBRANCE加来曲唑患者由于某种任何级别不良反应剂量减低发生36%。
对来曲唑不允许剂量减低。
接受IBRANCE加来曲唑患者由于一种不良反应永久终止发生7/83(8%)和单独接受来曲唑患者为2/77(3%)。
接受IBRANCE加来曲唑患者中导致终止不良反应包括中性粒细胞减少(6%),乏力(1%),和疲乏(1%)。
在IBRANCE加来曲唑臂患者中被报道最常见任何级别不良反应(≥10%)是中性粒细胞减少,白细胞减少,疲乏,贫血,上呼吸道感染,恶心,口炎,脱发,腹泻,血小板减少,食欲减退,呕吐,乏力,周围神经病变,和鼻衄。
接受IBRANCE加来曲唑患者被最频报道严重不良反应是肺栓塞(3/83; 4%)和腹泻(2/83; 2%)。
在palbociclib加来曲唑臂(55%)与单独来曲唑臂(34%)比较观察到感染事件发生率增加。
在IBRANCE临床计划中曾报道发热性中性粒细胞减少事件,虽然在研究1中未观察到病例。
通过剂量减低和/或剂量延迟或暂时终止处理≥3级中性粒细胞减少由于中性粒细胞减少与永久终止率6%一致[见剂量和给药方法(2.2)]。
表4中列举在研究1中接受IBRANCE加来曲唑或单独来曲唑患者报道的不良药物反应(≥10%)。
7 药物相互作用Palbociclib是主要地被CYP3A和磺基转移酶(SULT)酶SULT2A1代谢。
在体内,palbociclib是一种CYP3A时间-依赖性抑制剂。
7.1 可能增加Palbociclib血浆浓度药物CYP3A抑制剂的影响在健康受试者中某种强CYP3A抑制剂(伊曲康唑[itraconazole])的共同给药增加palbociclib的血浆暴露87%。
避免强CYP3A抑制剂的同时使用(如,克拉霉素[clarithromycin],茚地那韦[indinavir],伊曲康唑,酮康唑[ketoconazole],洛匹那韦[lopinavir]/利托那韦[ritonavir],奈法唑酮[nefazodone],奈非那韦[nelfinavir],泊沙康唑[posaconazole],利托那韦,沙奎那韦[saquinavir],特拉匹韦[telaprevir],泰利霉素[telithromycin],维拉帕米[verapamil],和伏立康唑[voriconazole])。
IBRANCE治疗期间避免柚子或柚子汁。
如IBRANCE与某种强CYP3A抑制剂的共同给药不能避免,减低IBRANCE剂量[见剂量和给药方法(2.2)和临床药理学(12.3)]。
7.2 可能减低Palbociclib血浆浓度药物CYP3A诱导剂的影响在健康受试者中一种强CYP3A诱导剂的共同给药(利福平[rifampin])减低palbociclib的血浆暴露85%。
避免强CYP3A诱导剂(如,苯妥英[phenytoin],利福平,卡马西平[carbamazepine]和圣约翰草的同时使用)[见临床药理学(12.3)]。
中度CYP3A诱导剂的共同给药也可能减低IBRANCE的血浆暴露。
避免中度CYP3A诱导剂的同时使用(如,波生坦[bosentan],依非韦伦[efavirenz],依曲韦林[etravirine],莫达非尼[modafinil],和奈夫西林[nafcillin])[见临床药理学(12.3)]。
