分析化学1章
第一章 绪论(分析化学人民卫生出版社第8版)

第一章 绪论
《 第一章 绪论 》
- 1/33页 -
分析化学 (Analytical Chemistry)
什么是分析化学?
What
Why
为什么要学习分析化学
?
如何学习分析化学?
How
《 第一章 绪论 》
- 2/33页 -
目录
CATALOG
01 分析化学的定义、任务及其特点
02 分析化学的作用和发展趋势
◈实验性强 :
强调动手能力、培养实验操作技能, 提高分析解决实际问题的能力。
◈综合性强:
涉及化学、生物、电学、光学、计 算机等,体现能力与素质。
分析化学工作者应具有很强的责任心
《 第一章 绪论 》
特点
- 7/35页 -
分析化学的作用及发展趋势
1991年IUPAC国际分析科学会议主席E.NIKI 教授所说,21世纪是光明还是黑暗取决于人类 在能源与资源科学、信息科学、生命科学与环 境科学四大领域的进步,而取得这些领域进步 的关键问题的解决主要依赖于分析科学。
《 第一章 绪论 》
- 30/35页 -
教学要求和成绩评价
掌握
定性、定量和结构分析的基本原理。
掌握
分析测试的基本方法和操作技能。
培养
《 第一章 绪论 》
学生实事求是的科学态度和严谨细致的工作 作风,为后续专业课程打下良好的基础。
- 31/35页 -
习题
1、分析化学的英文名称是( )
A
A、analytical chemistry
医药卫生
临床检验:血液、尿液等指标的检测。
《 第一章 绪论 》
- 14/35页 -
分析化学的作用及发展趋势
《分析化学》第1章 绪论ppt课件

1-1 分析化学的任务和作用 分析化学的定义:
研究物质化学组成的表征和测量的科学
主要任务: 主要任务是鉴定物质的化学组成、 结构和测量有关组分的含量。
作用: 研究物质及其变化 在工农业生产中起重要作用
1-2 分析方法的分类
按任务分: 定性分析 :鉴定组成 定量分析:测定含量 结构分析:结构研究
• 例行分析:例行分析是指一般化验 室日常生产中的分析
•
• 仲裁分析:是指不同单位对分析结 果有争议时请权威单位进行裁判的 分析
• 第三节 分析化学发展历史
• 第一次变革:20-30年代溶液四大 平衡理论的建立 技术 → 科学
• 第二次变革:40-60年代经典分析 化学(化学分析)→ 现代分析化学 (仪器分析为主)
• 第三次变革:由70年代末至今提供 组成、结构、含量、分布、形态等 全面信息, 成为当代最富活力的学科 之一
按对象分: 无机分析:Байду номын сангаас定组成和测定含量 有机分析:官能团的分析和 结构鉴定
按测定原理分:
化学分析:重量分析,滴定分析等 仪器分析:光学分析,电分析,色谱 分析,NMR,MS,电子显微镜,x-射线分 析
按试样用量和操作规模分:
常量分析 :S > 0.1g , V > 10mL 半微量分析:S 0.01~0.1g , V 1~10mL 微量分析:S 0.1~10mg , V 0.01~1mL 超微量分析:S < 0.1mg , V < 0.01mL
分析化学第一章 绪论

S
n ( xi x ) 2 Σ i =1 n
1
RSD
பைடு நூலகம்
Sr
=
× 100 % x
(四) 准确度 试样含量的测定值与试样含量的真实值(或标准值) 相符合的程度称为准确度。 准确度常用相对误差量度。
x μ ×100 % Er = μ
(五)检测限(Detection limit, DL) 检测限:在已知置信水平,可以检测到的待测物的最 小质量或浓度。 它和分析信号(Singnal)与空白信号的波动(噪音, Noise)有关,或者说与信噪比(S/N)有关。
提供更全面的
信息和知识
分析科学
(二)仪器分析的发展 总的趋势: (一)提高分析方法的灵敏度
(二)提高检测方法的选择性
(三)各种联用技术的应用
(四)测试的自动化和智能化、微型化
(五)在线与实时分析
(六)分析范围的不断拓宽,层次加深
各种联用技术的应用
1、气相色谱—质谱法(GC—MS) 2、气相色谱—质谱法—质谱法(GC—MS—MS) 3、气相色谱—原子发射光谱法(GC—AED) 4、液相色谱—质谱法(HPLC—MS)
3. 处理好整体与局部
分析仪器——结构流程——关键部件 4. 勤
书山有路勤为径,学海无边苦作舟。
四、主要参考文献 书籍 1、赵藻潘等编,仪器分析(第一版),高教出版社,1999 2、北京大学化学系编,仪器分析教程,北大出版社,1997 3、武汉大学分析化学教研室编,仪器分析习题精解,科学 出版社(第一版),1999 杂志 国内 1. 分析化学 2. 高等学校化学学报 3. 光谱学与光谱分析 国外 1.Analytical Chemistry
二、仪器分析与化学分析 1、仪器分析的特点 仪器分析 化学分析
分析化学1章

【分析化学-第 1 章定量分析化学概念】测试总分:111分1.填空题:分析某试样允许测定的相对误差为1%,若试样称取量为2g左右,则应称至小数点后位,记录应保留位有效数字。
2.填空题:用分度值为0.1 g的台秤称取约20 g的物品, 最多可记录位有效数字。
如用来测定土壤水分, 要求称量的相对误差不大于2%,至少应称取土壤试样g。
3.填空题:平行四次测定某溶液的浓度(mol/L),结果分别为0.2041, 0.2049, 0.2039,0.2043。
则其平均值=,标准差s=, 变异系数CV=,平均值的标准差=。
4.单选题:指出下列表述中错误的表述-----------( )A. 置信水平愈高,测定的可靠性愈高B. 置信区间的大小与测定次数的平方根成反比C. 置信区间的位置取决于测定的平均值D. 置信水平愈高,置信区间愈宽5.单选题:测定某有机物, 称取0.2000 g, 溶解后加入0.01000 mol/L I2标准溶液10.00 mL,回滴I2时消耗0.01000 mol/L Na2S2O319.20 mL, 则此测定的相对误差约是--------( )A. 百分之百B. 百分之几C. 百分之几十D. 千分之几6.填空题:正态分布曲线反映出误差分布的规律性;总体平均值μ表示测量值分布的。
在不存在系统误差的情况下, μ就是;总体标准差σ表示测量值分布的。
7.单选题:下列表述中,最能说明随机误差小的是---------()A. 高精密度B. 与已知的质量分数的试样多次分析结果的平均值一致C. 标准差大D. 仔细校正所用砝码和容量仪器等8.填空题:测定明矾中铝的质量分数,经九次测定得= 10.79%, s= 0.042%, 查表知t0.05,8 =2.31, 置信度为95%时平均值的置信区间是。
9.单选题:在量度样本平均值的离散程度时, 应采用的统计量是----------( )A. 变异系数CVB. 全距RC. 平均值的标准差 s(x-)D. 标准差s10.填空题:根据随机误差的标准正态分布曲线,某测定值出现在u= ±1.0之间的概率为68.3%, 则此测定值出现在u>1.0之外的概率为。
01 《分析化学》课件

尽管分析化学正向着高灵敏度、高速度和仪器自动化的方向发展,但化学分析仍然是分析化学的基础,因 此分析化学仍然要从化学分析学起,进而扩展到仪器分析。这两部分的内容都是高级工程技术人员应该掌握的。
如上例中的相对误差为
RE1
0.0001 1.2301
100%
0.008%
RE2
0.0001 100% 0.0123
0.8%
这说明,绝对误差相同时,测量值越大,相对误差越小,因而在分析测定中,取样量应该大一些,如试样的质量、滴定
消耗标准溶液的体积等。
14 第二节 定量分析的误差
在进行物质分析时,首先要确定物质的化学组成,然后选择适当的分析方法来测定各组分的含量。本书的主要内容 是讨论定量分析方法。
分析化学是研究物质及其变化的重要方法之一,它对于化学学科本身的发展以及与化学有关的各学科领域都起着重 要的作用。分析化学与材料科学、环境科学、能源科学、生命科学、矿物学、地质学、生理学、医学及农业等都有密切 的联系,且相互交叉和渗透,因此,人们常将分析化学称为生产科研的“眼睛”。
1 分析化学概述
2 定量分析的误差
3 有效数字及 其运算规则
7 第一节 分析化学概述
第一章
一、 分析化学的任务及其作用
分析化学是化学学科的一个重要分支,是研究物质化学组成、含量及结构的分析方法和有关理论的一门学科。它可 分为定性分析和定量分析两个部分。定性分析的任务是鉴定物质由哪些元素、原子团或化合物组成;定量分析的任务是 测定物质中有关成分的含量。
1 无机分析和有机分析
分析化学01第1章概论-01
分析化学
第二个重要阶段: 20世纪40年代,仪器分析的发展。 分析化学与物理学及电子学结合的时代。 原子能和半导体技术兴起,如要求超纯材 料,99.99999%,砷化镓,要测定其杂质, 化学分析法无法解决,促进了仪器分析和 各种分离方法的发展。
分析化学
第三个重要阶段: 20世纪70年代以来, 分析化学发展到分析 科学阶段
分析化学
仲裁分析及例行分析: 例行分析Routine analysis:一般化验室日常 生产中的分析。 仲裁分析Referee analysis:不同单位对分 析结果有争论时,请权威的单位进行裁判 的分析工作.
分析化学
分析方法的选择: 方法的选择应从下面几点考虑:测定的具体要求,源自测组分及其含量范围,欲测 组分的性质;
教 材:武汉大学:分析化学(第五版) 邓珍灵主编:现代分析化学实验,中南大学出版社
参考书目: 1 北京大学:定量分析简明教程(第二版) 2 李克安,金钦汉等译,分析化学,北京大学出版社,2001 3 张锡瑜等编著,化学分析原理,分析化学丛书第一卷,第一册, 科学出版社,1991 4 武汉大学:定量分析习题精解,科学出版社,1999 5 汪尔康,21世纪的分析化学,科学出版社,1999 6 R. Kellner et al., (FECS) Analytical Chemistry(中译本:分 析化学,北京大学出版社,2001) 7 J. A. Dean: (世界图书出版社)Analytical Chemistry Handbook 8 D. Harvey: (McGraw Hill ) Modern Analytical Chemistry
分析化学
学习方式
预习、听讲、复习、做作业、课堂讨论、答疑
第一章分析化学

。 。
溶液浓度变换为对某物质的滴定度,可利用式
b TV a x G
1.2.13根据标准溶液的浓度和消耗的体积,算出被测组分含量的
方法称为滴定分析;滴加标准溶液的过程称为 滴定 ;标准溶液与
待测液完全反应的那一点称为 化学计量点 。
1.2.14配制标准溶液的方法有
1.1.19 0.1000 mol·L -1HCl溶液以Na2O(M=62.00 g·mol-1)表示的滴定度(单位:g ·mL-1)为 ( A )
A、0.003100 C、0.03100 B、0.006200 D、0.06200
1.1.20以K2Cr2O7法测定铁矿石中铁含量时,用0.02 mol·L-1 K2Cr2O7滴定。设试样含铁以Fe2O3(M=159.7 g·mol-1)表示 约为50%,则试样称取量约为 (D ) A、0.1g C、1g B 、0.2g D 、0.5g
元素
,
离子
,
官能团
,
化合物
等。
1.2.5已知标准溶液的浓度与
滴加的体积
,计算出待测组 。标准溶
分含量或浓度的一类分析方法称为 液的加入方法叫做
滴定
滴定分析方法
。
重要 1.2.6滴定分析是化学分析法中最 的一类分 析方法,从反应测定本质看可分 配体转移 为 质子转移 、 、 电子转移 三种 类型。 碱 可分别测定 酸 , , 金属离子 卤素离子 , 氧化还原性 物质。 和
定性分析 (2)__ 定量分析 __
1.2.2化学分析法主要包括 滴定 化学分析法的特点是 适用于
分析和
定量分析
分析,
测量准确度高
(整理)分析化学每一章的名词解释和问答题.

第一章蛋白质的结构与功能名词解释1.肽单元2.模体3.蛋白质变性4.β-折叠5.分子伴侣6.protein quaternary structure7.结构域8.蛋白质等电点9.辅基10.肽键11.α- 螺旋12.变构效应13.蛋白质一级结构14.蛋白质二级结构15.蛋白质三级结构16.蛋白质四级结构17.亚基18.肽问答题1.为何蛋白质的含氮量能表示蛋白质相对量?实验中又是如何依此原理计算蛋白质含量的?2.蛋白质的基本组成单位是什么?其结构特征是什么?3.何为氨基酸的等电点?如何计算精氨酸的等电点?(精氨酸的α- 羧基、α- 氨基和胍基的 pK 值分别为 2.17 , 9.04 和 12.48 )4.何谓肽键和肽链及蛋白质的一级结构?5.什么是蛋白质的二级结构?它主要有哪几种?各有何结构特征? 6 .举列说明蛋白质的四级结构。
7.已知核糖核酸酶分子中有 4 个二硫键,用尿素和β- 巯基乙醇使该酶变性后,其 4 个二硫键全部断裂。
在复性时,该酶 4 个二硫键由半胱氨酸随机配对产生,理论预期的正确配对率为 1 %,而实验结果观察到正确配对率为 95 %~100 %,为什么?8.什么是蛋白质变性?变性与沉淀的关系如何?9.举列说明蛋白质一级结构、空间构象与功能之间的关系。
10.举例说明蛋白质的变构效应。
11.常用的蛋白质分离纯化方法有哪几种?各自的作用原理是什么?12.测定蛋白质空间构象的主要方法是什么?其基本原理是什么?第二章核酸的结构与功能名词解释1.核小体2.碱基互补(碱基配对)3.脱氧核苷酸4.增色效应5.Tm值6.核糖体7.核酶8.核酸分子杂交9.TΨC 环10.反密码环11.Z-DNA12.核酸变性13.核酸复性问答题1.细胞内有哪几类主要的 RNA ?其主要功能是什么?2.用32P标记的病毒感染细胞后产生有标记的后代,而用35S标记的病毒感染细胞则不能产生有标记的后代,为什么?3.一种 DNA 分子含 40 %的腺嘌呤核苷酸,另一种 DNA 分子含 30 %的胞嘧啶核苷酸,请问哪一种 DNA 的 Tm 值高?为什么?4.已知人类细胞基因组的大小约 30 亿 bp ,试计算一个二倍体细胞中 DNA 的总长度,这么长的 DNA 分子是如何装配到直径只有几微米的细胞核内的?5.简述 DNA 双螺旋结构模式的要点及其与 DNA 生物学功能的关系。
分析化学 第1章 绪论 习题答案

第1章 绪论第一章 概论3.基准试剂主体含量大于99.9%;高纯试剂杂质含量少;专用试剂指在某一特殊应用中无干扰,如光谱纯、色谱纯。
6.标定c (NaOH)=0.05mol ·L -1时,草酸m =0.05×0.025×63=0.08g称量误差r 0.00020.25%0.1%0.08E ==> 而m (邻)=0.05×0.025×204=0.26gr 0.00020.1%0.26E =< ∴选邻苯二甲酸氢钾好。
若c (NaOH)=0.2mol ·L -1,两种基准物都可称小样,都可以。
8.H 2C 2O 4·2H 2O 会失水,使标定的NaOH 结果偏低;测定有机酸的摩尔质量则偏高。
10.Na 2B 4O 7·10H 2O 、B 、B 2O 3和NaBO 2·4H 2O 与H + 的物质的量之比分别是1∶2、2∶1、1∶1和2∶1。
1.1 30.0mL 0.150mol ·L -1的HCl 溶液和20.0mL 0.150mol ·L -1的Ba(OH)2溶液相混合,所得溶液是酸性、中性、还是碱性?计算过量反应物的浓度。
答案:12L 0.015m ol 230.0)(20.030.00.15020.00.1502)过)((Ba(OH)-⋅=⨯+⨯-⨯⨯=量c1.2 称取纯金属锌0.3250g ,溶于HCl 后,稀释到250mL 容量瓶中,计算c (Zn 2+)。
答案:132L 0.01988m ol 250.065.39100.3250)(Zn -+⋅=⨯⨯=⋅=V M m c1.3 欲配制Na 2C 2O 4溶液用于标定KMnO 4溶液(在酸性介质中),已知14L 0.10mol KMnO 51-⋅≈⎪⎭⎫⎝⎛c ,若要使标定时两种溶液消耗的体积相近,问应配制多大浓度(c )的Na 2C 2O 4溶液?要配制100mL 溶液,应称取Na 2C 2O 4多少克? 答案:O 8H 10CO 2Mn 16HO 5C 2MnO 2222424++=++++--⎪⎭⎫⎝⎛=⎪⎭⎫ ⎝⎛4224O C Na 21KMnO 51n n()()42242244O C Na O C Na 21KMnO KMnO 51V c V c ⋅⎪⎭⎫⎝⎛=⋅⎪⎭⎫ ⎝⎛ 若:)O C Na ()KMnO (4224V V ≈ 则:14422L 0.050mol KMnO 5121)O C (Na -⋅=⎪⎭⎫⎝⎛=c c g 67.00.134********.0)O C Na (3422=⨯⨯⨯=-m1.4 用KMnO 4法间接测定石灰石中CaO 的含量(见例1.6),若试样中CaO 含量约为40%,为使滴定时消耗0.020mol ·L -1 KMnO 4溶液约30mL ,问应称取试样多少克? 答案:()g21.0 %10010208.5630020.05%40 %10010CaO 21KMnO KMnO 51CaO)(3344=⨯⨯⨯⨯⨯=⨯⨯⎪⎭⎫ ⎝⎛⋅⋅⎪⎭⎫ ⎝⎛=s s s m m m M V c w1.5 某铁厂化验室常需要分析铁矿中铁的含量。
分析化学 第1章 绪论

• ⑥设备复杂、昂贵
10
二、仪器分析法发展趋势
• 更高灵敏度(达原子级、分子级水平) • 更高选择性(复杂体系)
• 更快速
• 更自动
• 更简便
• 更经济
11
• 智能化、信息化
• 分析方法的联用 • 原位(in situ)、在体(in vivo)、实时 (real time)、在线(on line)分析
12
三、仪器分析法应用
13
14
1 2 10+9 3 4+3 6+3 4 4+3 4+6 4+6
1 6 7 8 9
2 4 5 3
2
第一章
绪
论
药物分析教研室
3
• 仪器分析法分类
• 仪器分析法特点与发展趋势
• 仪器分析法应用
4
仪器分析学习的特点:
• 所测物理原理(光、电、热、吸附等) 及分析目的不同,仪器分析的方法多 种多样,各方法特点和测定对象不同, 各章有其独立性。
光谱法
色谱法 波谱法(Uv、IR、NMR) 质谱法 (MS) X-射线衍射法 (X-ray)
• 表面分析
8
第2节 仪器分析法特点与发展趋势
• • 仪器分析法特点 仪器分析法发展趋势
9
一、仪器分析法特点
• ①灵敏度高 • ②选择性好 • ③相对误差大 • ④需标准物质作参考 • ⑤分析速度快 1%~5% 10-6~10-12g
分析化学
仪器分析
(曾元儿 张凌 主编 ) 主讲人 池玉梅 药学院药物分析教研室 B1 220 85811053
1
第一章 绪论 第二章 光谱分析法概论 第三章 紫外-可见分光光度法 第四章 荧光分析法 第五章 原子吸收分光光度法 第六章 红外分光光度法 10 第九章 色谱法概论 第十章 经典液相色谱法 第十一章 气相色谱法 第十二章 高效液相色谱法
分析化学教材(系列一)Word版
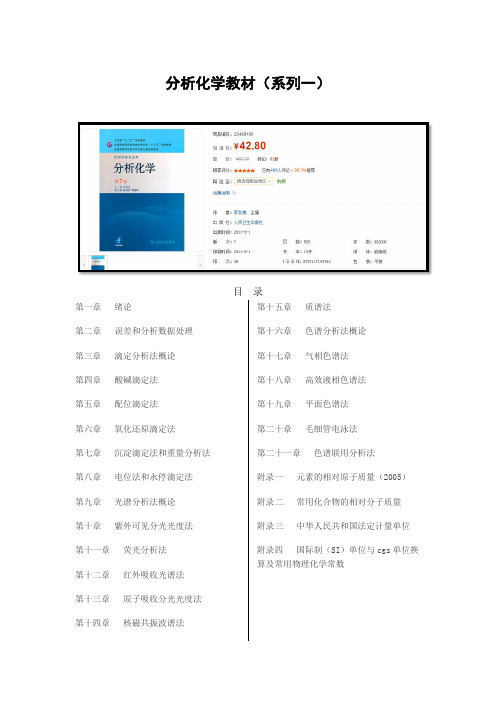
分析化学教材(系列一)目 录第一章 绪论第二章 误差和分析数据处理 第三章 滴定分析法概论 第四章 酸碱滴定法 第五章 配位滴定法 第六章 氧化还原滴定法 第七章 沉淀滴定法和重量分析法 第八章 电位法和永停滴定法 第九章 光谱分析法概论 第十章 紫外可见分光光度法 第十一章 荧光分析法 第十二章 红外吸收光谱法 第十三章 原子吸收分光光度法第十四章核磁共振波谱法第十五章 质谱法 第十六章 色谱分析法概论 第十七章 气相色谱法 第十八章 高效液相色谱法 第十九章 平面色谱法 第二十章 毛细管电泳法 第二十一章 色谱联用分析法 附录一 元素的相对原子质量(2005) 附录二 常用化合物的相对分子质量 附录三 中华人民共和国法定计量单位 附录四 国际制(SI )单位与cgs 单位换算及常用物理化学常数附录五常用酸、碱在水中的离解常数(25℃)附录六配位滴定有关常数附录七常用电极电位附录八难溶化合物的溶度积常数(25℃,I=0)附录九标准缓冲溶液的pH(0—95℃)附录十主要基团的红外特征吸收峰附录十一质子化学位移表附录十二质谱中常见的中性碎片与碎片离子附录十三气相色谱法用表参考文献英文索引中文索引目录第三版前言第二版前言第一版前言第1章绪论第2章误差和分析数据处理第3章重量分析法第4章滴定分析法概论第5章酸碱滴定法第6章络合滴定法第7章沉淀滴定法第8章氧化还原滴定法第9章取样与样品预处理方法附录附录Ⅰ中华人民共和国法定计量单位附录Ⅱ分析化学中常用的物理化学常数及物理量附录Ⅲ国际相对原子质量表附录Ⅳ常用相对分子质量表附录Ⅴ酸、碱在水中的离解常数附录Ⅵ常用标准缓冲溶液的pH(0~60℃)附录Ⅶ络合滴定有关常数附录Ⅷ标准电极电位及条件电位表附录Ⅸ难溶化合物的溶度积(Ksp) 符号表第1章概论1.1 定量分析概述1.1.1 分析化学的任务和作用1.1.2 定量分析过程1.1.3 定量分析方法1.2 滴定分析法概述1.2.1 滴定分析法对反应的要求和滴定方式1.2.2 基准物质和标准溶液1.2.3 滴定分析中的体积测量1.2.4 滴定分析的计算思考题习题第2章误差与分析数据处理2.1 有关误差的一些基本概念2.1.1 误差的表征——准确度与精密度2.1.2 误差的表示——误差与偏差2.1.3 误差的分类——系统误差与随机误差2.2 随机误差的分布2.2.1 频率分布2.2.2 正态分布2.2.3 随机误差的区间概率2.3 有限数据的统计处理2.3.1 数据的集中趋势和分散程度的表示——对μ和σ2.3.2 总体均值的置信区间——对μ的区别间估计2.3.3 显著性检验2.3.4 异常值的检验2.4 测定方法的选择与测定准确度的提高2.5 有效数字思考题习题第3章酸碱平衡与酸碱滴定法3.1 酸碱反应3.1.2 酸碱反应的平衡常数3.1.3 活度与浓度,平衡常数的几种形式3.2 酸度对弱酸(碱)形态分布的影响3.2.1 一元弱酸溶液中各种形态的分布3.2.2 多元酸溶液中各种形态的分布3.2.3 浓度对数图3.3 酸碱溶液的H+浓度计算3.3.1 水溶液中酸碱平衡处理的方法3.3.2 一元弱酸(碱)溶液pH的计算3.3.3 两性物质溶液pH的计算3.3.4 多元弱酸溶液pH的计算3.3.5 一元弱酸及其共轭碱(HA+A)混合溶液pH的计算3.3.6 强酸(碱)溶液pH的计算3.3.7 混合酸和混合碱溶液pH的计算3.4 酸碱缓冲溶液3.4.1 缓冲容量和缓冲范围3.4.2 缓冲溶液的选择3.4.3 标准缓冲溶液3.5 酸碱指示剂3.5.1 酸碱指示剂的作用原理3.5.2 影响指示剂变色间隔的因素3.5.3 混合指示剂3.6 酸碱滴定曲线和指示剂的选择3.6.1 强碱滴定强酸或强酸滴定强碱3.6.2 一元弱酸(碱)的滴定3.6.3 滴定一元弱(弱碱)及其与强酸(强碱)混合物的总结3.6.4 多元酸和多元碱的滴定3.7 终点误差3.7.1 代数法计算终点误差图及其应用3.7.2 终点误差公式和终点误差图及其应用3.8 酸碱滴定法的应用3.8.1 酸碱标准溶液的配制与标定……第4章络合滴定法第5章氧化还原滴定法第6章沉淀重量与沉淀滴定法第7章分光光度法第8章分析化学中常用的分离方法第9章其他常用仪器分析方法附录目录编写说明第1章绪论第1节分析化学的任务与作用第2节分析化学方法的分类第3节试样分析的基本程序第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节误差第2节测量值的准确度和精密度第3节有效数字及其运算法则第4节分析数据的统计处理与分析结果的表示方法第5节相关与回归思考与练习第3章重量分析法第1节挥发法第2节萃取法第3节沉淀法思考与练习第4章滴定分析法概论第1节滴定反应类型与滴定方式第2节基准物质与标准溶液第3节滴定分析的计算思考与练习第5章酸碱滴定法第1节水溶液中的酸碱平衡第2节基本原理第3节滴定终点误差第4节应用与示例第5节非水滴定法思考与练习第6章沉淀滴定法第1节基本原理第2节应用与示例思考与练习第7章配位滴定法第1节配位平衡第2节基本原理第3节滴定条件的选择第4节应用与示例思考与练习第8章氧化还原滴定法第9章电位法和永停滴定法参考资料附录目录符号缩写或简称第一篇概述第1章分析化学的目的及其对社会的重要性1.1 分析化学的目的:对社会的基本重要性1.2 分析化学的目的:作为问题解决者的分析化学家1.3 非常规实验实应用分析化学的目的参考文献第2章分析过程2.1 概述2.2 全分析过程2.3 工作特性2.4 分析化学中的误差参考文献第3章质量保证和质量控制3.1 分析化学的质量和目标3.2 分析方法3.3 如何保证准确度3.4 质是保证和质是控制受规章限制的方面3.5 结论参考文献第二篇化学分析第4章化学分析的基本原理第5章色谱法第6章动力学与催化第7章化学分析的方法及其应用第三篇物理分析第8章元素分析第9章化合物和分子特效分析第10章微束流和表面分析第11章结构分析第四篇基于计算机的分析化学(COBAC)第12章化学计理学第13章计算机软硬件及分析仪器接口第五篇全分析系统第14章联用技术第15章微分析系统第16章过程分析化学VI. 附录汉英索引英汉索引目录总序出版说明第二版前言第一版前言符号表绪论0.1 分析化学的任务与作用0.2 分析方法的分类0.3 发展中的分析化学1 分析质量保证1.1 分析化学中关于误差的一些基本概念 1.2 有效数字及其运算规则1.3 分析数据的统计处理1.4 提高分析结果准确度的方法小结习题分析化学前沿领域简介——化学计量学2 化学分析法2.1 滴定分析概述2.2 滴定分析的基本理论2.3 确定滴定终点的方法2.4 滴定条件选择2.5 滴定分析的应用2.6 重理分析法小结习题化学大师Liebig3 分离分析方法3.1 分析试样的制备和分解3.2 沉淀分离法3.3 溶齐萃取分离法3.4 离子交换分离法3.5 挥发和蒸馏分离法3.6 气相色谱法3.7 高效液相色谱法3.8 色谱分离技术发展简介3.9 膜分离法3.10 激光分离法3.11 复杂试样分析实例3.12 分离技术的发展趋势小结习题科学家及其思维方法简介——色谱学家马丁4 原子光谱分析法4.1 原子吸收分光光度法4.2 原子发射光谱分析法小结习题著名化学家本生对分析化学的贡献5 分子光谱分析法5.1 紫外-可见分光光度法5.2 红外光谱法5.3 分子发光分析法小结习题光分析化学前沿简介——光化学传感器6 核磁共振谱法6.1 基本原理6.2 核磁共振谱仪6.3 化学位移6.4 自旋偶合与自旋裂分6.5 核磁共振谱图解析6.6 13C核磁共振谱小结习题生物分子的革命性分析方法7 质谱法7.1 基本原理7.2 质谱仪7.3 离子的主要类型7.4 有机化合物质谱7.5 质谱图解析7.6 飞行时间质谱简介7.7 UV、IR、NMR和MS四谱综合解析小结习题科学展望——2000年诺贝尔化学奖简介8 电化学分析法8.1 电位分析法8.2 极谱法和伏安法8.3 库仑分析法8.4 电分析化学新进展小结习题2003年诺贝尔化学奖得主阿格雷和麦金农参考文献附录后记目录第1篇分析化学基础第1章分析化学导言1.1 分析化学的定义、任务和作用1.2 分析化学的特点和分类1.3 分析化学的发展趋势1.4 学习分析化学课程的方法思考题第2章试样的采集、制备与分解2.1 试样的采集2.2 固体物料试样的制备2.3 试样的分解思考题第3章定量分析中的误差及数据处理3.1 误差的基本概念3.2 误差的传递3.3 有效数字的表示与运算规则3.4 随机误差的正态分布3.5 少量数据的统计处理3.6 数据的评价——显著性检验、异常值的取舍3.7 回归分析3.8 提高分析结果准确度的方法思考题习题第2篇化学分析法第4章化学分析法概述4.1 化学分析法概述4.2 滴定分析法概述4.3 标准溶液与基准物4.4 化学分析法的计算思考题习题第5章酸碱滴定法第6章配位滴定法第7章氧化还原滴定法第8章沉淀滴定法第9章重量分析法第3篇仪器分析法第10章仪器分析法概述第11章紫外可见吸收光谱法第12章原子吸收光谱法第13章电位分析法第14章气相色谱法第4篇复杂物质分析第15章定量分析中的分离及富集方法第16章复杂物质分析示例附录参考文献目录第1章绪论第1节分析化学的任务和作用第2节分析化学的分类一、化学分析与仪器分析二、定性分析、定量分析和结构分析三、无机分析和有机分析四、常量分析、半微量分析和微量分析五、例行分析和仲裁分析第3节试样分析的基本程序一、取样二、分析试液的制备三、分析测定四、分析结果的计算与评价第4节分析化学的发展与趋势第2章误差和分析数据的处理第1节概述第2节定量分析误差一、系统误差和偶然误差二、绝对误差和相对误差三、准确度与精密度四、提高分析准确度的方法第3节有效数字及其运算法则一、有效数字二、有效数字的运算法则三、有效数字的运算法则在分析化学中的应用第4节分析数据的统计处理与分析结果的表示方法一、偶然误差的正态分布二、实验数据的统计处理三、可疑值的取舍四、分析数据处理与报告第3章重量分析法第1节概述第2节挥发法一、定义二、操作过程三、应用第3节萃取法一、定义及分类二、操作过程三、应用第4节沉淀法一、沉淀重量法二、沉淀的溶解度及影响因素三、沉淀的纯度及其影响因素四、沉淀的类型与沉淀条件五、沉淀法中的计算第5节应用一、药物含量测定二、药物纯度检查第4章滴定分析法概论第1节概述第2节滴定方式一、直接滴定法二、反滴定法三、置换滴定法四、间接滴定法第3节基准物质和标准溶液一、基准物质二、标准溶液三、标准溶液浓度的表示第4节滴定分析中的计算一、计算依据二、计算示例第5章酸碱滴定法第1节概述第2节水溶液中的酸碱平衡一、酸碱质子理论二、溶液中酸碱组分的分布三、酸碱溶液中H+浓度的计算第3节酸碱指示剂一、酸碱指示剂的变色原理二、酸碱指示剂的理论变色点和变色范围三、影响指示剂变色范围的因素四、混合指示剂第4节酸碱滴定法的基本原理……第6章沉淀滴定法第7章配位滴定法第8章氧化还原滴定法第9章电位分析法第10章紫外-可见分光光度法第11章荧光分析法第12章红外分光光度法第13章原子吸收分光光度法第14章经典液相色谱法第15章气相色谱法第16章高效液相色谱法第17章其他分析方法实验部分参考文献附录《分析化学》教学基本要求目录第一章绪论第一节分析化学的任务和作用第二节分析方法的分类一、定性分析、定量分析和结构分析二、无机分析和有机分析三、常量、半微量、微量、超微量分析四、化学分析和仪器分析五、例行分析、仲裁分析和快速分析第三节分析化学的发展趋势一、分析理论与其他学科相互渗透二、分析技术的发展趋势本章小结思考题与习题第二章定量分析误差和分析数据的处理第一节定量分析误差的种类和来源一、系统误差二、随机误差第二节准确度与精密度一、准确度与误差二、精密度与偏差三、准确度与精密度的关系第三节随机误差的正态分布一、频率分布二、正态分布三、随机误差的区间概率第四节有限测定数据的统计处理一、置信度与μ的置信区间二、可疑测定值的取舍三、显著性检验第五节提高分析结果准确度的方法一、选择适当的分析方法二、减小测量的相对误差三、检验和消除系统误差四、减小随机误差第六节有效数字及其运算规则一、有效数字的意义和位数二、数字修约规则三、有效数字的运算规则本章小结思考题与习题第三章滴定分析法概论第一节滴定分析法的分类及滴定方式一、滴定分析法的分类二、滴定分析法对化学反应的要求三、滴定方式第二节滴定分析的标准溶液一、标准溶液浓度的表示方法二、化学试剂的规格与基准物质三、标准溶液的配制第三节滴定分析的有关计算一、滴定分析计算的理论依据二、滴定分析计算示例本章小结思考题与习题第四章酸碱滴定法第一节酸碱反应及其平衡常数一、酸碱反应及其实质二、酸碱反应的平衡常数以及共轭酸碱对Ka与Kb的关系第二节酸碱溶液中各型体的分布系数与分布曲线一、一元弱酸(碱)溶液中各型体的分布系数与分布曲线二、多元酸(碱)溶液中各型体的分布系数与分布曲线第三节酸碱溶液pH的计算一、质子等衡式(质子条件式)二、酸碱溶液pH的计算第四节酸碱指示剂一、酸碱指示剂的作用原理二、影响酸碱指示剂变色范围的因素三、混合酸碱指示剂第五节酸碱滴定原理及指示剂选择一、强碱与强酸的滴定二、强碱(酸)滴定一元弱酸(碱)三、多元酸(碱)的滴定四、酸碱滴定中CO2的影响第六节酸碱滴定法的应用一、酸(碱)标准溶液的配制及标定二、酸碱滴定法应用实例本章小结思考题与习题第五章配位滴定法第一节概述第二节 EDTA及其配合物一、乙二胺四乙酸(EDTA)的结构与性质二、EDTA在水溶液中各存在型体的分布系数三、EDTA与金属离子形成螯合物的特点第三节 EDTA与金属离子的配位平衡一、配合物的稳定常数二、溶液中各级配合物浓度的计算第四节影响配位平衡的主要因素一、酸效应及酸效应系数二、配位效应及配位效应系数三、配合物的条件稳定常数第五节配位滴定原理一、配位滴定曲线二、影响配位滴定突跃范围的主要因素三、准确滴定金属离子的判据四、配位滴定中适宜pH范围第六节金属指示剂一、金属指示剂的作用原理二、金属指示剂应具备的条件三、金属指示剂的选择四、金属指示剂的封闭、僵化和氧化变质现象五、常用的金属指示剂第七节提高配位滴定选择性的方法一、控制溶液酸度二、利用掩蔽和解蔽作用三、采用其他配位剂四、分离干扰离子第八节配位滴定法的应用一、EDTA标准溶液的配制、标定二、各种配位滴定方式三、配位滴定法应用实例本章小结思考题与习题第六章氧化还原滴定法第一节氧化还原反应的特点一、标准电极电势和条件电极电势二、氧化还原反应进行的方向三、氧化还原反应进行的程度四、氧化还原反应速率第二节氧化还原滴定原理一、氧化还原滴定曲线二、化学计量点时溶液电势的计算三、影响氧化还原滴定突跃范围的因素第三节氧化还原滴定的指示剂一、自身指示剂二、特殊指示剂三、氧化还原指示剂第四节常见氧化还原滴定法及其应用一、高锰酸钾法二、重铬酸钾法三、碘量法本章小结思考题与习题第七章沉淀滴定法第一节沉淀滴定法基本原理第二节银量法一、莫尔法二、佛尔哈德法三、法扬司法第三节沉淀滴定法的应用一、标准溶液的配制与标定二、应用示例本章小结思考题与习题第八章分析化学中的常用分离方法第一节沉淀分离法一、无机沉淀剂分离二、有机沉淀剂分离三、共沉淀分离第二节液?液萃取分离法一、萃取分离法的基本原理二、萃取体系的分类和萃取条件的选择三、萃取分离技术四、溶剂萃取在分析化学中的应用第三节离子交换分离法一、离子交换剂的种类和性质二、离子交换树脂的亲和力三、离子交换分离操作技术四、离子交换分离法的应用第四节常规色谱法一、柱色谱法二、纸色谱法三、薄层色谱法本章小结思考题与习题第九章电势分析法第一节电势分析法基本原理一、直接电势法二、电势滴定法三、电池电动势的测量第二节参比电极和指示电极一、参比电极二、指示电极第三节直接电势法及应用一、溶液pH值的测定二、离子活度(浓度)的测定三、直接电势法的应用第四节电势滴定法一、电势滴定法的原理二、电势滴定终点的确定三、电势滴定法的应用本章小结思考题与习题第十章吸光光度分析法第一节吸光光度法的基础知识一、光的基本性质二、光的互补作用与溶液的颜色三、光的吸收曲线第二节光的吸收定律一、朗伯?比耳定律二、朗伯?比耳定律的推导三、吸光度与透光度四、吸光系数、摩尔吸光系数及桑德尔灵敏度第三节显色反应及影响因素一、吸光光度法对显色反应的要求二、影响显色反应的主要因素三、显色剂第四节吸光光度分析法及仪器一、吸光光度分析的类型二、吸光光度分析的定量分析方法三、分光光度计的构造四、分光光度计的类型第五节吸光光度法测量误差及测量条件的选择一、吸光光度法的测量误差二、测量条件的选择第六节吸光光度法的应用一、示差吸光光度法二、多组分的分析三、配合物组成的测定本章小结思考题与习题第十一章原子吸收分光光度法第一节基本原理一、共振发射线与吸收线二、基态原子与激发态原子的关系三、原子吸收线的宽度四、原子吸收的测量五、灵敏度和检出限第二节原子吸收分光光度计一、光源二、原子化器三、分光系统四、检测系统五、读数装置六、原子吸收分光光度计的类型第三节仪器测量条件的选择一、分析线的选择二、灯电流的选择三、原子化条件的选择四、燃烧器高度的选择五、进样量六、单色器狭缝宽度与光谱通带的选择第四节定量分析方法一、标准工作曲线法二、标准加入法第五节干扰及消除方法一、光谱干扰二、化学干扰、物理干扰及电离干扰第六节原子吸收分光光度法的应用一、测定生物样品中的化学元素二、有机物分析本章小结思考题与习题第十二章气相色谱分析法第一节色谱法概述一、色谱法原理介绍二、色谱法的分类第二节气相色谱法的特点及基本原理一、气相色谱法的特点二、气相色谱法的基本原理第三节气相色谱的实验技术一、色谱系统二、实验技术要点三、程序升温和衍生物制备第四节气相色谱法的应用一、定性分析二、定量分析三、气相色谱分析误差产生的原因第五节气相色谱法的新进展一、顶空气相色谱二、气相色谱?质谱联用技术三、气相色谱?红外光谱联用技术本章小结思考题与习题第十三章高效液相色谱法第一节高效液相色谱法的技术参数一、速率理论二、柱外效应三、分离度四、系统适应性实验第二节高效液相色谱法的色谱系统一、高压泵二、梯度洗脱装置三、进样器四、色谱柱五、检测器六、数据处理系统和结果处理第三节高效液相色谱法的分离方式一、吸附色谱法二、分配色谱法三、离子色谱法四、尺寸排阻色谱法五、亲和色谱法第四节样品预处理与色谱柱的保护一、样品预处理二、色谱柱的保护第五节液相色谱分析技术的新进展一、液相色谱?质谱联用技术概述二、超临界流体色谱法概述三、高效毛细管液相色谱法概述本章小结思考题与习题第十四章现代仪器分析简介第一节光分析法导论一、电磁波的辐射能特性二、光分析法的分类第二节原子发射光谱法一、基本原理二、原子发射光谱仪三、应用第三节原子荧光光谱法一、基本原理二、原子荧光光谱仪三、应用第四节分子荧光和磷光分析法一、荧光和磷光的产生二、荧光和磷光强度的影响因素三、荧光/磷光分析仪器四、荧光/磷光分析法应用第五节红外分光光度法一、分子的红外吸收二、红外光谱解析程序第六节核磁共振波谱法一、基本原理二、1HNMR谱的解析三、13CNMR谱的特点与解析第七节流动注射分析本章小结思考题与习题第十五章样品分析的一般过程第一节试样采集和制备一、试样的采集二、试样的制备第二节试样的分解与处理一、无机试样的分解处理二、有机试样的分解处理三、试样分解处理方法的选择四、干扰组分的处理第三节测定方法的选择一、测定的具体要求二、被测组分的性质三、被测组分的含量四、共存组分的影响五、实验室条件第四节分析结果的计算和数据评价一、分析结果的计算及表示方法二、分析结果的报告与评价本章小结思考题与习题附录附录一相对原子质量表(2001年国际原子量)附录二化合物的相对分子质量表附录三弱酸在水中的离解常数(25℃)附录四弱碱在水中的离解常数(25℃)附录五常用浓酸浓碱的密度和浓度附录六几种常用缓冲溶液的配制附录七常用标准缓冲溶液不同温度下的pH值附录八金属离子与EDTA配合物的lgKf(25℃)附录九标准电极电势表(25℃)附录十部分氧化还原电对的条件电极电势(25℃)附录十一难溶化合物的溶度积常数(25℃)参考文献目录绪论0.1 分析化学的任务和作用0.2 分析方法的分类0.2.1 无机分析和有机分析0.2.2 化学分析和仪器分析0.2.3 常量分析、半微量分析和微量分析。
1000150无机及分析化学_第一章1_1002

蒸气压—温度曲线
温度升高,蒸气压增大
20
固体也有饱和蒸气压。如干冰、萘、碘等固体,蒸气 压很大,可直接由固体变成气体(升华)。
饱和蒸气压与物质的种类有关。有些物质的蒸气压很 大,如乙醚、汽油等,有些物质的蒸气压很小,如甘油、 硫酸等。 蒸气压的大小,与液体分子间的吸引力有关,吸引 力越大,蒸气压越小。
防冻剂工作原理
冬天为防止汽车水箱冻裂,可加入甘油、乙二醇等以降 低水的凝固点,避免因结冰,体积膨胀而使水箱破裂。
30
植物的抗旱性和抗寒性
环境温度发生较大改变时,植物细胞中的有机 体会产生大量可溶性碳水化合物来提高细胞液浓度, 凝固点下降,使细胞液能在较低的温度环境中不结 冻。 温度升高时,细胞液浓度增加,细胞液蒸气压 下降较大,使得细胞的水份蒸发减少,因此表现出 植物的抗旱能力。
6
1.3
名称
溶液浓度的表示方法
数学表达式
n( B ) c( B) V
单位
mol﹒L-1
物质的量浓度
质量分数
mB w( B) m
m( B ) n( B ) m
n( B ) n
量纲为1
质量摩尔浓度
mol﹒kg-1
物质的量分数
x( B)
量纲为1
7
1.3.1 物质的量浓度
nB cB V
25
1.4.2 溶液沸点的升高和凝固点下降
1. 溶液的沸点上升
沸点: 液体蒸气压与外界压力相等时的温度。 p 难挥发物质的溶液的沸点总 是高于纯溶剂的沸点,二者 之差为: △Tb = Tb – T0 = kbbB kb称为溶剂的摩尔沸点上升 常数,单位为K· mol-1。 kg·
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【分析化学-第 1 章定量分析化学概念】测试总分:111分1.填空题:分析某试样允许测定的相对误差为1%,若试样称取量为2g左右,则应称至小数点后位,记录应保留位有效数字。
2.填空题:用分度值为0.1 g的台秤称取约20 g的物品, 最多可记录位有效数字。
如用来测定土壤水分, 要求称量的相对误差不大于2%,至少应称取土壤试样g。
3.填空题:平行四次测定某溶液的浓度(mol/L),结果分别为0.2041, 0.2049, 0.2039,0.2043。
则其平均值=,标准差s=, 变异系数CV=,平均值的标准差=。
4.单选题:指出下列表述中错误的表述-----------( )A. 置信水平愈高,测定的可靠性愈高B. 置信区间的大小与测定次数的平方根成反比C. 置信区间的位置取决于测定的平均值D. 置信水平愈高,置信区间愈宽5.单选题:测定某有机物, 称取0.2000 g, 溶解后加入0.01000 mol/L I2标准溶液10.00 mL,回滴I2时消耗0.01000 mol/L Na2S2O319.20 mL, 则此测定的相对误差约是--------( )A. 百分之百B. 百分之几C. 百分之几十D. 千分之几6.填空题:正态分布曲线反映出误差分布的规律性;总体平均值μ表示测量值分布的。
在不存在系统误差的情况下, μ就是;总体标准差σ表示测量值分布的。
7.单选题:下列表述中,最能说明随机误差小的是---------()A. 高精密度B. 与已知的质量分数的试样多次分析结果的平均值一致C. 标准差大D. 仔细校正所用砝码和容量仪器等8.填空题:测定明矾中铝的质量分数,经九次测定得= 10.79%, s= 0.042%, 查表知t0.05,8 =2.31, 置信度为95%时平均值的置信区间是。
9.单选题:在量度样本平均值的离散程度时, 应采用的统计量是----------( )A. 变异系数CVB. 全距RC. 平均值的标准差 s(x-)D. 标准差s10.填空题:根据随机误差的标准正态分布曲线,某测定值出现在u= ±1.0之间的概率为68.3%, 则此测定值出现在u>1.0之外的概率为。
11.填空题:若两次平行分析结果为62.04%和62.39%,按有效数字规则其平均值应表示为。
12.单选题:在定量分析中,精密度与准确度之间的关系是-----------( )A. 精密度是保证准确度的前提B. 精密度高,准确度必然高C. 准确度是保证精密度的前提D. 准确度高,精密度也就高13.填空题:通常标准差的数值比平均偏差要;平均值的标准差值比单次测量结果的标准差值要。
少量测量数据结果的随机误差遵循分布,当测量次数趋于无限次时,随机误差遵循分布。
在少量数据的统计处理中,当测定次数相同时,置信水平愈高,则显著性水平愈,置信区间愈,判断的可靠性愈。
14.填空题:将以下数修约为4位有效数字: 0.032564 修约为0.87246 修约为1.03350 修约为16.0852 修约为15.单选题:对置信区间的正确理解是----------( )A. 一定置信度下以真值为中心包括测定平均值的区间B. 真值落在某一可靠区间的概率C. 一定置信度下以真值为中心的可靠范围D. 一定置信度下以测定平均值为中心包括真值的范围16.单选题:测定试样中CaO 的质量分数, 称取试样0.908 g,滴定耗去EDTA标准溶液20.50 mL, 以下结果表示正确的是----------( )A. 10.08%B. 10%C. 10.1%D. 10.077%17.单选若已知一组测量数据的总体标准差 ,要检验该组数据是否符合正态分布,则应当题:用-----------( )A. t检验B. Q检验C. F检验D. u检验18.填空题:下列情况引起实验误差的性质是: 试样未混匀试剂中含被测组分滴定时操作溶液溅出滴定管最后一位读数不确定19.填空题:0.0684,0.04900,1.0020,pH=10.35 分别是,,,位有效数字。
20.填空题:某重量法测定Se的溶解损失为1.8 mg Se,如果用此法分析约含18%Se的试样, 当称样量为0.400 g时, 测定的相对误差是。
21.填空题:以下计算结果中各有几位有效数字(不必计算只说明几位)?0.1000×(25.00-24.50)×246.47(1) w(X) = ───────────────×100% , 1.000×10000.1208×(25.00-1.52)×246.47(2) w(X) = ───────────────×100% , 1.000×100022.单选题:有一组平行测定所得的数据,要判断其中是否有可疑值,应采用-----( )A. u 检验B. F检验C. t 检验D. Q检验23.单选题:下列表述中,最能说明系统误差小的是--------------()A. 与已知的质量分数的试样多次分析结果的平均值一致B. 标准差大C. 高精密度D. 仔细校正所用砝码和容量仪器等24.单选题:分析测定中随机误差的特点是----------( )A. 数值无规律可循B. 正负误差出现的概率相同C. 大小误差出现的概率相同D. 数值有一定范围25.填空题:0.01605 取三位有效数字为;21.505 取两位有效数字为。
26.填空题:某学生把测定牛奶含氮量的分析结果平均值1.36%简化为1.4%,由此引起的相对误差是%。
27.填空题:用NaOH滴定HAc,以下几种情况下造成的误差属于哪一类?(1) 选酚酞为指示剂滴定至pH=9.0(2) 选酚酞为指示剂,确定终点颜色时稍有出入(3) 选甲基橙为指示剂滴定至pH=4.4(4) 碱式滴定管中气泡未赶出28.单选题:以下情况产生的误差属于系统误差的是-----------()A. 称量过程中天平零点稍有变动B. 指示剂变色点与化学计量点不一致C. 滴定管读数最后一位估测不准D. 称样时砝码数值记错29.单选题:下列有关随机误差的论述中不正确的是-----------( )A. 随机误差具有随机性B. 随机误差是由一些不确定的偶然因素造成的C. 随机误差具有单向性D. 随机误差在分析中是无法避免的30.单选题:测定铁矿中Fe 的质量分数, 求得置信度为95%时平均值的置信区间为35.21%±0.10%。
对此区间的正确理解是----------( )A. 若再作测定, 有B. 在已测定的数据中有95%的数据在此区间内C. 总体平均值μD. 在此区间内包括总体平均值μ31.单选题:以下关于随机误差的叙述正确的是---------( )A. 大小误差出现的概率相等B. 正负误差出现的概率相等C. 正误差出现的概率大于负误差D. 负误差出现的概率大于正误差32.填空题:准确度高低用衡量,它表示。
精密度高低用衡量,它表示。
33.单选题:称取含氮试样0.2g,经消化转为NH4+后加碱蒸馏出NH3,用10 mL 0.05 mol/LHCl吸收,回滴时耗去0.05 mol/L NaOH 9.5 mL。
若想提高测定准确度, 可采取的有效方法是---( )A. 使用更稀的HCl溶液B. 增加试样量C. 使用更稀的NaOH溶液D. 增加HCl溶液体积34.单选题:已知某溶液的pH值为11.90,其氢离子浓度的正确值为-----------( )A. 1×10-12 mol/LB. 1.258×10-12 mol/LC. 1.3×10-12 mol/LD. 1.26×10-12 mol/L35.填空题:随机误差的正态分布曲线的两个重要参数是和,它们分别表示测量结果的和。
36.单选题:以下计算式答案x应为 11.05+1.3153+1.225+25.0678=x ------------( )A. 38.64B. 38.66C. 38.6581D. 38.6737.填空题:有限次测量结果的随机误差遵循分布。
当测量次数无限多时, 随机误差趋向分布,其规律是; 。
38.填空题:在分析过程中,下列情况造成什么性质的误差(系统、随机或过失)?(1) 在重量分析中沉淀溶解损失(2) 称量时读错砝码(3) 试剂中有少量干扰测定的离子(4) 滴定管读数小数点后第二位不确定39.填空题:实验室为检查某一新方法有无系统误差,通常可采用、和等进行对照试验。
40.填空题:按有效数字规则记录测量结果, 最多可至:(1) 用分度值为0.1 g的台秤准确称出5 g试样,记录为g ;(2) 用分度值为0.1 mg的天平准确称出5 g试样,记录为g ;(3) 用10 mL量筒准确量出5 mL溶液,记录为mL ;(4) 用50 mL滴定管准确量出5 mL溶液,记录为mL 。
41.单选题:下列各项定义中不正确的是----------( )A. 总体平均值就是真值B. 相对误差是绝对误差在真值中所占的百分比C. 绝对误差是测定值与真值之差D. 偏差是指测定值与平均值之差42.填空题:在统计学上,把在一定概率下,以测定值为中心包括总体平均值在内的可靠范围,称为,这个概率称为。
43.单选题:有两组分析数据,要比较它们的精密度有无显著性差异,则应当用----( )A. t检验B. F检验C. u检验D. Q检验44.填空题:将以下数修约为2位有效数字:(1) 21.4565 修约为(2) 3.451 修约为45.单选题:分析SiO2的质量分数得到两个数据:35.01%,35.42%, 按有效数字规则其平均值应表示为-----( )A. 35.22%B. 35%C. 35.2%D. 35.215%46.填空题:实验中使用的50 mL滴定管,其读数误差为±0.01mL, 若要求测定结果的相对误差≤±0.1%,则滴定剂体积应控制在mL;在实际工作中一般可通过或来达到此要求。
47.填空题:用甲醛法测得某铵盐中氮的质量分数为(%)5.15 , 5.32 , 5.22 , 5.25。
其平均值()为;标准差(s)为;其平均值的标准差()为; 含氮量在置信度95%时的置信区间。
(t0.05,3=3.18)48.单选题:以下各项措施中,可以减小随机误差的是-----( )A. 做空白试验B. 进行仪器校正C. 增加平行测定次数D. 做对照试验49.填空题:以下各数的有效数字为几位: 0.0050为位; 6.023×1023为位; π为位; pH=10.02为位。
50.填空题:容量瓶与移液管配套使用时, 若其体积关系不符合相应的比例, 会引起误差, 可采用减免。
