【配套K12】河南省罗山高中2016届高三化学二轮复习 强化训练 专题五 电解质溶液(含解析)
高考化学复习河南省罗山高中高三化学二轮专题复习强化训练(有解

高中化学学习材料金戈铁骑整理制作河南省罗山高中2016届高三化学二轮专题复习强化训练(有解析):专题八 重要的非金属及其化合物1、硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。
下列说法正确的是( )A.CO 、SO 2、SO 3均是酸性氧化物B.除去与水反应,图示转化反应均为氧化还原反应C.工业上利用Cl 2和澄清石灰水反应来制取漂白粉D.用CO 合成CH 3OH 进而合成HCHO 的两步反应,原子利用率均为100%【答案】B2、向红色溶液X 中通入气体Y ,溶液逐渐褪色,下列对X 、Y 的推断正确的是( )A. 若X 为品红溶液,则Y 可能为CO2或SO2B. 若X 为含酚酞的NaOH 溶液,则Y 可能是O3C. 若X 为含KSCN 的FeCl3溶液,则Y 一定为HID. 若X 为含少量KMnO4的H2SO4溶液,则Y 一定为SO2【答案】B【解析】3、下列叙述正确的是( )A .可用浓硝酸除去铝制品表面的铜镀层B .用催化法处理汽车尾气中的CO 和NO :CO+NO −−−→催化剂C+NO 2C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸【答案】A4、以下物质间的相互转化关系中(如图),A、B、C是常见的金属或非金属单质,D、E、F 是常见的三种氧化物,常温下,D、E呈气态,F呈固态。
下列推断正确的是( )A.E和D中一定有A元素 B.A一定是金属单质C.单质B肯定是氧化剂 D.C一定是氧气【答案】AD5、往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)()A. B.C. D.【答案】C【解析】n(CO2)==0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH﹣)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol,通入CO2,发生:2OH﹣+CO2=CO32﹣+H2O,OH﹣+CO2=HCO3﹣+H2O,Ca2++CO32﹣=CaCO3↓,设生成xmolCO32﹣,ymolHCO3﹣,则,解得x=0.1,y=0.2,所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3﹣)=0.2mol,可依次发生:①2OH﹣+CO2=CO32﹣+H2O,②Ca2++CO32﹣=CaCO3↓,离子浓度迅速减小,③OH﹣+CO2=HCO3﹣,所以图象C符合,故选:C.6、有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知:还原性I->Fe2+>Br->Cl-)()A.7∶1 B.7∶2 C.7∶3 D.7∶4【答案】C7、将22.4g铁粉逐渐加入到含HNO3 0.8mol的硝酸中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是()【答案】C【解析】发生的反应为Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;Fe+2Fe(NO3)3===3Fe(NO3)2通过计算,可得出正确答案。
河南省示范性高中罗山高中2016届高考化学电化学复习专练含解析
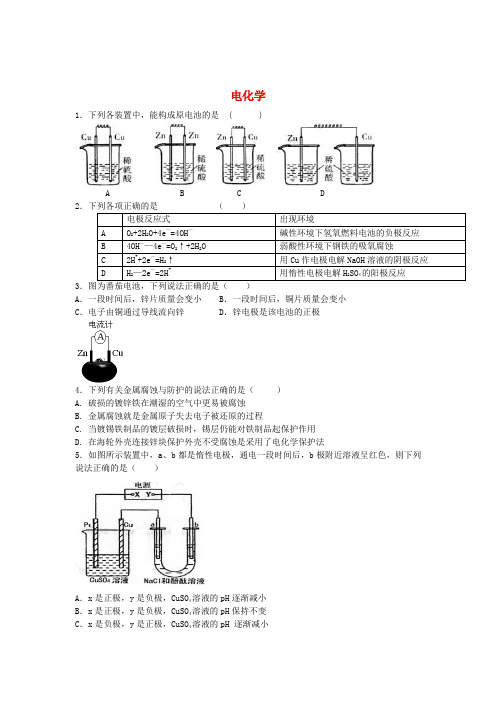
电化学1.下列各装置中,能构成原电池的是 ( )A B C D2电极反应式出现环境A O2+2H2O+4e—=4OH—碱性环境下氢氧燃料电池的负极反应B 4OH——4e—=O2↑+2H2O 弱酸性环境下钢铁的吸氧腐蚀C 2H++2e—=H2↑用Cu作电极电解NaOH溶液的阴极反应D H2—2e—=2H+用惰性电极电解H2SO4的阳极反应3.图为番茄电池,下列说法正确的是()A.一段时间后,锌片质量会变小 B.一段时间后,铜片质量会变小C.电子由铜通过导线流向锌 D.锌电极是该电池的正极4.下列有关金属腐蚀与防护的说法正确的是()A. 破损的镀锌铁在潮湿的空气中更易被腐蚀B. 金属腐蚀就是金属原子失去电子被还原的过程C. 当镀锡铁制品的镀层破损时,锡层仍能对铁制品起保护作用D. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了电化学保护法5.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是()A.x是正极,y是负极,CuSO4溶液的pH逐渐减小B.x是正极,y是负极,CuSO4溶液的pH保持不变C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小D.x是负极,y是正极,CuSO4溶液的pH保持不变6.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是()A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一=C12↑C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+D.钢铁发生电化学腐蚀的正极反应式:Fe一2e—=Fe2+7.利用右图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
下列说法中正确的是()A.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.电镀工业中,X是待镀金属,Y是镀层金属D.外加电流的阴极保护法中,X是待保护金属8.铅蓄电池是最常见的二次电池,其电池总反应可以表示为:Pb(s)+PbO2(s)+2H2SO4(aq)2PbSO4(s)+2H2O(l),下列说法不正确的是()A.电池的电解液为酸性溶液,正极为PbO2、负极为PbB.电池放电时,正极反应为PbO2+2 e-+SO42-+4H+=PbSO4+2H2OC.电池充电过程中,阳极附近溶液的pH升高D.电池充电时,阴极反应为PbSO4+2e-=Pb+SO42-9.用惰性电极电解含有0.400molCu(NO3)2和0.400mol KCl的混合溶液,一段时间后,在一个电极上析出0.300mol Cu,此时在另一电极上放出的气体在标准状况下的体积(标准状况下)为()A.3.36L B.6.72L C.5.60L D.2.80L10.某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示(上端为多孔电极a,下断为多孔电极b),该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
[推荐学习]河南省罗山高中2016届高三化学二轮复习 考点综合训练 走进化学工业(含解析)
![[推荐学习]河南省罗山高中2016届高三化学二轮复习 考点综合训练 走进化学工业(含解析)](https://img.taocdn.com/s3/m/62592b4af5335a8102d220a7.png)
走进化学工业1、下列物质中,可用于治疗胃酸过多的是()A.NaHCO3B.NaOH C.Na2O D.BaCO3【答案】A【解析】B、C中溶于水或与水反应生成强碱,有腐蚀作用;D项产生的Ba2+有毒。
2、在浓盐酸中H3AsO3与SnCl2反应的离子方程式(未配平)为:SnCl2+Cl-+H3AsO3+H+ As+SnCl62-+M 关于该反应的说法中正确的是()A.氧化剂是H3AsO3 B.还原性:Cl->AsC.每生成2molAs,反应中转移电子的物质的量为3mol D.M为OH-【答案】A3、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也叫可入肺颗粒物,与肺癌、哮喘等疾病的发生密切相关,是灰霾天气的主要原因,它主要来自化石燃料的燃烧(如机动车尾气、燃煤)等,下列与PM2.5相关的说法不正确的是()A.大力发展电动车,减少燃油汽车的尾气排放量B.开发利用各种新能源,减少对化石燃料的依赖C.多环芳烃是强致癌物,能吸附在PM2.5的表面进入人体D.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素【答案】D4、A、B、C三种短周期元素在周期表中的相对位置如图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )A.B与C均不存在同素异形体B.X一定是酸性氧化物C.B的氢化物比A、C的氢化物稳定D.A与B形成的化合物X有3种【答案】C【解析】根据A、B、C的位置关系可知,A、B为第二周期元素,C为第三周期元素,设A 的原子序数为a,B的原子序数为a+1,C的原子序数为a+8,a+a+1=a+8,a=7。
A为N,B为O,C为P。
O与P都存在同素异形体,A错;N与O形成的化合物,有的是酸性氧化物如N2O5,有的不是酸性氧化物如NO2、NO等,B错;O的非金属性比N、P强,所以H2O的稳定性比NH3和PH3强,C对;N与O可形成N2O、NO、NO2、N2O3、N2O4、N2O5等多种化合物,D 错。
河南省罗山高中2016届高三化学二轮复习 考点综合训练 化学物质及其变化(含解析)

化学物质及其变化1、下列离子方程式书写正确的是( )A.小苏打溶液中加入过量的石灰水:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O B.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2OC.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2OD.用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O 电解2OH-+H2↑+Cl2↑【答案】C2、已知A、B、C、D、E分别为Ca(OH)2、Ca(HCO3)2、HCl、Ba(NO3)2、Na2CO3五种溶液中的一种。
现将它们相互反应情况列表如下(表中“↓”表示生成沉淀;“↑”表示生成气体;“—”表示无现象)据此可判断C是()A.HClB.Ca(HCO3)2C.Na2CO3 Ba(NO3)2【答案】B3、已知在常温下,测得浓度均为0.1mol/L的下列六种溶液的pH:复分解反应存在一个规律:碱性较强的物质发生类似反应可以生成碱性较弱的物质。
依照该规律,请你判断下列离子反应不能..成立的是()A.CO32-+C6H5OH→HCO3-+C6H5O-B.CO2+H2O+ClO-=HCO3-+HClOC.CO2+H2O+ C6H5O-→HCO3-+C6H5OHD.CO2+H2O+ 2C6H5O-→ CO32-+2C6H5OH【答案】D4、用N A表示阿伏加德罗常数的值,下列说法正确的是()A. 1mol干冰晶体中含有C=O键的数目为2N AB. 工业生产硫酸时,在接触室内每充人N A个SO2可完全转化为1molS03C. 1molCa(ClO)2只作氧化剂且充分反应时,转移的电子数一定为2N AD.在标准状况下2.24L乙醇含有的碳原子数约等于0.2N A【答案】A5、某溶液中含有较大浓度的H+、Fe2+、SO2-4时,下列物质可以在其中大量存在的是()A.CuCl2 B.Cl2 C.NaNO3 D.NH3【答案】A6、有下列三个氧化还原反应:① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2;②2FeCl 2 + Cl 2 = 2FeCl 3 ;③ 2KMnO 4 + 16HCl = 2KCl + 2MnCl 2 + 5Cl 2↑+ 8H 2O 。
河南省罗山高中2016届高三化学二轮复习考点综合训练研究型实验Word版含答案

河南省罗山高中2016届高三化学二轮复习考点综合训练(有解析):研究型实验1、用如图装置进行实验,将液体A 逐滴加入到固体B 中,下列叙述正确的是( )A .若A 为盐酸,B 为MnO 2,C 中盛有品红溶液,则C 中溶液褪色B .若A 为醋酸,B 为贝壳,C 中盛有澄清石灰水,则C 中溶液出现浑浊C .若A 为浓氨水,B 为生石灰,C 中盛有AlCl 3溶液,则C 中先产生白色沉淀后沉淀溶解D .上述实验中仪器D 都可以用长玻璃导管代替【答案】B【解析】本装置为固+液不加热装置,A 项不发生反应,B 项生成CO 2气体,使澄清石灰水变浑浊;C 中产生NH 3,溶于水生成NH 3·H 2O ,与AlCl 3溶液反应生成Al(OH)3沉淀,Al(OH)3沉淀不与NH 3·H 2O 反应;装置中仪器D 起防倒吸作用,不能换作长玻璃导管。
2、下列物质中,属于非电解质的是( )A. 稀盐酸B. 铜丝C. 氯化钠固体D. 蔗糖【答案】D3、已知X 和Y 为同一周期元素。
若X 为IIA 族元素,Y 为IIIA 族元素,它们的原子序数分别为m 和n ,则下列关系式错误的是A .n=m+1B .n=m+10C .n=m+11D .n=m+25【答案】B4、在热的稀硫酸溶液中溶解了10.16g FeCl 2。
当加入50mL 0.4mol/L KNO 3溶液后,使其中的Fe 2+全部转化成Fe 3+,KNO 3溶液也完全反应,并有NO x 气体逸出。
则NO x 是( )A .N 2OB .NOC .N 2O 3D .NO 2【答案】A【解析】FeCl 2―→FeCl 3,n (FeCl 2)=10.16g 127g/mol=0.08mol ,根据电子得失守恒,设KNO 3中N 降低了x 价,则有0.08×(3-2)=0.05×0.4×x ,x =4,故降到5-4=1,A 正确。
河南省罗山高中2016届高三化学二轮复习考点突破(有解析):考点105 物质性质的研究

河南省罗山高中2016届高三化学二轮复习考点突破(有解析):考点105 物质性质的研究1、已知:还原性HSO3﹣>I﹣,氧化性IO3﹣>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法不正确的是()A.0~b间反应:3HSO3﹣+IO3﹣=3SO42﹣+I﹣+3H+B.a点时消耗NaHSO3的物质的量为1.2 molC.b~c间反应:I2仅是氧化产物D.c点之后碘的物质的量不变是因为还原剂消耗完全【答案】C【解析】还原性HSO﹣3>I﹣,所以首先是发生以下反应离子方程式:IO3﹣+3HSO3﹣═I﹣+3SO42﹣+3H+,继续加入KIO3,氧化性IO ﹣3>I2,所以IO3﹣可以结合H+氧化I﹣生成I2,离子方程式是IO3﹣+6H++5I﹣═3H2O+3I2,A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,所以其离子方程式为:3HSO3﹣+IO3﹣═3SO42﹣+I﹣+3H+,故A正确;B.a点碘酸钾的物质的量是0.4mol,根据碘酸钾和亚硫酸氢钠的关系式知,消耗NaHSO3的物质的量=×3=1.2mol,故B正确;C.根据图象知,b﹣c段内发生IO3﹣+6H++5I﹣═3H2O+3I2,只有I元素的化合价变化,所以I2是氧化产物也是还原产物,故C错误;D.碘具有氧化性,由图可知c点之后碘的物质的量不变,则是因为还原剂消耗完全,故D正确;故选C.2、某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中氧原子的个数可以是()A.1到4 B.2或3C.只有4 D.1或4【答案】D【解析】解:相对分子质量小于150,由氧的质量分数为可知,则分子中氧原子数目<=4.7,所以该有机物分子中最多含有4个O;当含有1个O原子时,该有机物的相对分子量为16×2=16,则C、H的总相对原子量为16,=1…2,该有机物为分子式为:CH4O,为甲醇;当含有2个O时,该有机物的相对分子量为:16×2×2=64,C、H的总相对原子量为32,=2…4,该有机物分子式为:C2H8O2,不存在该物质;当含有3个O原子时,该有机物的相对分子量为:16×3×2=96,C、H的总相对原子量为48,=3…6,该有机物分子式为:C3H12O3,不存在该物质;当含有4个O原子时,该有机物的相对分子量为:16×4×2=128,C、H的总相对原子量为64,=4…8,该有机物分子式为C5H4O4,结构简式为:HOOCC≡CCH2COOH;所以该有机物分子中含有的O原子数可能为1或4,故选D.3、下列说法正确的是()A.汽车尾气不会引起呼吸道疾病B.生铁、不锈钢、青铜都属于合金C.某次酸雨的pH为4.3,是由于溶解了CO2D.普通玻璃的主要成分是纯碱、石灰石和石英【答案】B4、已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。
配套K12河南省罗山高中2016届高三化学二轮复习 考点突破4 离子反应(含解析)

离子反应1、下列各组中的离子,能在溶液中大量共存的是()A.H+、Na+、CO32-、Cl B.Ba2+、Na+、SO42-、Cl一C.K+、H+、SO42-、OH-D.Ag+、Al3+、NO3-、H+【答案】D【解析】A项氢离子和碳酸根反应;B项硫酸钡沉淀;C项氢离子和氢氧根反应。
2、有四位同学分别对四种溶液中所含的离子进行检测,所得结果如下,其中所得结果错误的是( )A.K+、Na+、Cl-、NO-3B.OH-、CO2-3、Cl-、K+C.Ba2+、Na+、OH-、NO-3D.Cu2+、NO-3、OH-、Cl-【答案】D【解析】检测到四种溶液中所含的离子必须能共存,才正确,D项中的Cu2+与OH-不能大量共存,故D错误。
3、下列物质中,含有自由移动的Cl-的是()A.KClO3溶液 B.CaCl2溶液 C.KCl晶体 D.液态氯化氢【答案】B【解析】A中KClO3电离出K+和ClO3—;B中电离出Ca2+和Cl-;C中KCl晶体不能发生电离;D中HCl为液态,无电离。
4、能大量共存于同一溶液中,且当加入另一种强电解质使水电离出的c(H+) = 1×10-13 mol/L 时又一定能发生反应的离子组是()①Na+、Ba2+、Cl-、HCO3-②K+、NH4+、CH3COO-、SO42-③Ca2+、Cu2+、 NO3-、SO32-④Fe3+、Na+、SCN-、Cl-⑤Al3+、Na+、HCO3-、NO3-⑥Fe2+、Na+、NO3-、I-⑦Ag+、NH4+、OH-、NO3-⑧Na+、K+、CH3COO-、NO3-A.①②⑥ B.②③⑥ C.①② D.③⑤⑦【答案】A【解析】①离子之间不发生任何反应,可存在于同一溶液中,HCO3-既能与OH-反应也能与H+反应而不能大量存在,故①选;②离子可大量共存于同一溶液中,碱性条件下NH4+不能大量存在,酸性条件下CH3COO-不能大量存在,故②选;③Ca2+、Cu2+与SO32-反应生成沉淀而不能大量共存,故③不选;④Fe3+与SCN-发生络合反应而不能大量共存,故④不选;⑤Al3+与HCO3-发生互促水解反应而不能大量共存,故⑤不选;⑥离子可大量共存于同一溶液中,但在酸性条件下Fe2+、I-与NO3-发生氧化还原反应而不能大量共存,在碱性条件下Fe2+不能大量存在,故⑥选;⑦Ag+、NH4+、OH-不能大量共存,故⑦不选;⑧无论在酸性还是碱性条件下离子之间都不发生任何反应,可大量共存,故⑧不选故答案选A 。
[推荐学习]河南省罗山高中2016届高三化学二轮复习 强化训练 专题五 电解质溶液(含解析)
![[推荐学习]河南省罗山高中2016届高三化学二轮复习 强化训练 专题五 电解质溶液(含解析)](https://img.taocdn.com/s3/m/06d8c333b7360b4c2e3f645c.png)
电解质溶液1、某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是A.NO3- B.S2- C.AlO2- D.SO32- 【答案】C2、下列有关溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)> c(CO32-)> c(H2CO3)B.在0.1mol·L-1Na2CO3溶液中:c(OH-)= c(HCO3-)+c(H2CO3-)+ c(H+)C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)> c(H+)D.常温下,CH3COONa和CH3COOH混合溶液呈中性, c(Na+)=0.1mol·L-1:c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)【答案】D3、向两份a mL b mol/L的稀盐酸中分别加入xmL的水和ymLbmol/LBa(OH)2溶液,此时两溶液的pH恰好相等,则x、y的关系符合(式中a、b均大于零,设两溶液混合时的体积有加和性)A. y=2ax+bB.y=ax/(2x+3a)C.a/2y-3a/2x=1D. x=2ay/(a+y)【答案】BC4、下列图示与对应的叙述相符的是()A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液B.图2表示某吸热反应分别在有、无催化剂的情况卞反应过程中的能量变化C.图3表示0.1 000mol·L-1NaOH溶液滴定20.00mL0.1 000mol·L-1醋酸溶液得到滴定曲线D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化【答案】D【解析】A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故A错误;B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B错误;C、强碱氢氧化钠滴定弱酸醋酸溶液时,恰好完全反应时,所得溶液为醋酸钠溶液显示碱性,pH大于7,而不是等于7,故C错误;D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al (OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2,生成BaSO 4沉淀,发生反应为SO 42-+Ba 2+=BaSO 4↓,NH 4++OH -=NH 3?H 2O ,所以沉淀质量继续增加;当SO 42-完全沉淀时,共需加入0.02molBa (OH )2,加入0.04molOH -,Al 3+反应掉0.03molOH -,生成Al (OH )30.01mol ,剩余0.01molOH -恰好与NH 4+完全反应,此时溶液中NH 4+完全反应,此时溶液为氨水溶液;(a 到b )继续滴加Ba (OH )2,Al (OH )3溶解,发生反应Al (OH )3+OH -=AlO 2-+2H 2O ,由方程式可知要使0.01molAl (OH )3完全溶解,需再加入0.005molBa (OH )2,此时溶液为氨水与偏铝酸钡溶液,(b 到c ),故D 正确.故选D . 5、下列有关电解质溶液的推理中正确的是( )A .室温下,pH =4的醋酸和pH =10的氢氧化钠溶液等体积混合,其pH> 7B .pH =3的盐酸与pH =11的氨水等体积混合后,溶液中:c (NH4+)>c (Cl-)>c (OH-)>c (H+)C .物质的量浓度相等的NH4Cl 溶液和NH4HSO4溶液中,NH4+浓度相等D .在有AgI 沉淀的上清液中滴加NaCl 溶液,可以观察到白色沉淀产生【答案】B6、在常温下,0.1000mol·L -1Na 2CO 3溶液25mL 用0.1000mol·L -1盐酸滴定,其滴定曲线如图6。
配套K12河南省罗山高中2016届高三化学二轮复习 考点突破106 身边化学问题的探究(含解析)

身边化学问题的探究1、用右图装置不能达到有关实验目的是( )A .用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)B .用乙图装置制备Fe(OH)2C .用丙图装置制取金属锰D .用丁图装置比较NaHCO 3和Na 2CO 3的热稳定性【答案】D2、下列溶液中有关物质的浓度关系正确的是( )A .c (NH 4+)相等的(NH 4)2SO 4、NH 4HSO 4、NH 4Cl 溶液中:c (NH 4HSO 4)>c >c (NH 4Cl )B .向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c (Na +)>c (CH 3COO ﹣)>c (H +)>c (OH ﹣)C .1.0 mol/L Na 2CO 3溶液:c (OH ﹣)=c (HCO 3﹣)+c (H +)+2c (H 2CO 3)D .某二元弱酸的酸式盐NaHA 溶液中:c (H +)+c (Na +)=c (OH ﹣)+c (HA ﹣)+c (A 2﹣)【答案】C【解析】A .含有同等浓度的铵根离子的盐中,化学式中含有铵根离子个数越多其浓度越小,硫酸氢铵电离出氢离子抑制铵根离子水解,所以c (NH 4+)相等的(NH 4)2SO 4、NH 4HSO 4、NH 4Cl溶液中:c <c (NH 4HSO 4)<c (NH 4Cl ),故A 错误;B .混合溶液呈酸性,则c (H +)>c (OH ﹣),根据电荷守恒得c (H +)+c (Na +)=c (CH 3COO ﹣)+c (OH ﹣),所以c (Na +)<c (CH 3COO ﹣),故B 错误;C .根据质子守恒得c (OH ﹣)=c (HCO 3﹣)+c (H +)+2c (H 2CO 3),故C 正确;D .任何电解质溶液中都存在电荷守恒,根据电荷守恒得c (H +)+c (Na +)=c (OH ﹣)+c (HA﹣)+2c (A 2﹣),故D 错误;故选:C .3、钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法正确的是( )A .与每个Ba 2+距离相等且最近的Ba 2+共有6个B .晶体中Ba 2+的配位数为8C .晶体的化学式为Ba 2O 2Ba 2+O 22–D.该氧化物是含有非极性键的离子化合物【答案】D4、已知短周期元素的离子,a A2+、b B+、c C3-,d D-都具有相同的电子层结构,则下列叙述中正确的是 ( )A.原子半径:A>B>D>C B.原子序数:d>c>b>aC.离子半径:C>D>B>A D.单质的还原性:A>B>D>C【答案】C【解析】A、B两元素的原子失去外层电子后与C、D得电子后电子层结构相同,说明A、B在C、D的下周期,其相对位置为C DB A,所以原子序数a>b>d>c。
【配套K12】河南省罗山高中2016届高三化学二轮复习 考点突破56 化学技术可持续发展(含解析)

化学技术可持续发展1、下列反应的离子方程式正确的是()A.金属铝溶于稀稍酸中:B.纯碱溶液显碱性的原因:C.将少量的硝酸银溶液滴入碘化钠溶液后,再滴加硫化钠:D.Ca(ClO)2溶液中通人过量的二氧化硫气体:【答案】B2A.NaHCO3溶液中,一定有c(Na)=c(HCO3)+c(CO3)B.将a mol/LHCN溶液与a mol/L NaOH溶液等体积混合后,测得所得溶液显碱性(pH>7),则c(OH﹣)>c(H+),c(CN﹣)>c(Na+)C.等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)D.1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小【答案】C【解析】A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),故A错误;B.二者恰好反应生成NaCN,溶液呈碱性,则c(OH﹣)>c(H+),再结合电荷守恒得c(CN ﹣)<c(Na+),故B错误;C.酸的电离平衡常数越大,酸的电离程度越大,则酸根离子水解程度越小,相同浓度的钠盐pH越小,根据电离平衡常数知,酸根离子水解程度CO32﹣>CN﹣>CH3COO﹣,所以相同浓度的钠盐溶液pH大小顺序是pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故C正确;D.加水稀释促进醋酸电离,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则溶液中c(OH﹣)增大,故D错误;故选C.3、分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。
在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有()A.3种 B.4种 C.5种D.6种【答案】C4、下列有关物质性质和结构正确()A.3115P是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子B.Na的原子半径比Cl的大,但Na+的半径比Cl-的小C.Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱D. Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4【答案】B5、短周期元素X 、Y 、Z 的原子序数依次递增,其原子的最外层电子数之和为13.X 与Y 、Z 位于相邻周期,Z 原子最外层电子数是X 原子内层电子数的3倍或者是Y 原 子最外层电子数的3倍.下列说法正确的是( ) A .X 的氢化物溶于水显酸性 B .Y 的氧化物是离子化合物 C .Z 的氢化物的水溶液在空气中存放不易变质 D .X 和Z 的最高价氧化物对应的水化物都是弱酸 【答案】B6、将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数为( ) A .等于15%B .小于15%C .大于15%D .不能确定【答案】B【解析】设这两种溶液的体积是V ,质量分数为5%和25%的氨水密度分别是ρ2和ρ1,ρ2>ρ1,则25%ρ1V +5%ρ2Vρ1V +ρ2V×100%<15%; 故选B .7、在一定条件下KClO 3与I 2发生下列反应:2KClO 3+I 2====2KIO 3+Cl 2,则下列推断正确的是( )A.该反应的电子转移数目是10B.I 2是氧化剂C.还原性Cl 2>I 2D.还原产物为KIO 3,氧化产物为Cl 2 【答案】A试题分析: 2KClO 3+I 2====2KIO 3+Cl 2中,氯元素的化合价由+5价降低为0价,碘元素的化合价由0价升高为+5价。
高考化学复习河南省罗山高中高三化学二轮专题复习强化训练(有解.docx

高中化学学习材料鼎尚图文收集整理河南省罗山高中2016届高三化学二轮专题复习强化训练(有解析):专题八 重要的非金属及其化合物1、硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。
下列说法正确的是( )A.CO 、SO 2、SO 3均是酸性氧化物B.除去与水反应,图示转化反应均为氧化还原反应C.工业上利用Cl 2和澄清石灰水反应来制取漂白粉D.用CO 合成CH 3OH 进而合成HCHO 的两步反应,原子利用率均为100%【答案】B2、向红色溶液X 中通入气体Y ,溶液逐渐褪色,下列对X 、Y 的推断正确的是( )A. 若X 为品红溶液,则Y 可能为CO2或SO2B. 若X 为含酚酞的NaOH 溶液,则Y 可能是O3C. 若X 为含KSCN 的FeCl3溶液,则Y 一定为HID. 若X 为含少量KMnO4的H2SO4溶液,则Y 一定为SO2【答案】B【解析】3、下列叙述正确的是( )A .可用浓硝酸除去铝制品表面的铜镀层B .用催化法处理汽车尾气中的CO 和NO :CO+NO −−−→催化剂C+NO 2C.浓硫酸具有吸水性,因此可用作干燥剂,能干燥氢气、硫化氢、氨气等气体D.因为浓硫酸在常温下不可与铁或铝反应,因此常温下可用铁制或铝制容器储存浓硫酸【答案】A4、以下物质间的相互转化关系中(如图),A、B、C是常见的金属或非金属单质,D、E、F 是常见的三种氧化物,常温下,D、E呈气态,F呈固态。
下列推断正确的是( )A.E和D中一定有A元素 B.A一定是金属单质C.单质B肯定是氧化剂 D.C一定是氧气【答案】AD5、往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)()A. B.C. D.【答案】C【解析】n(CO2)==0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH﹣)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,n(Ca2+)=0.1mol,通入CO2,发生:2OH﹣+CO2=CO32﹣+H2O,OH﹣+CO2=HCO3﹣+H2O,Ca2++CO32﹣=CaCO3↓,设生成xmolCO32﹣,ymolHCO3﹣,则,解得x=0.1,y=0.2,所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3﹣)=0.2mol,可依次发生:①2OH﹣+CO2=CO32﹣+H2O,②Ca2++CO32﹣=CaCO3↓,离子浓度迅速减小,③OH﹣+CO2=HCO3﹣,所以图象C符合,故选:C.6、有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知:还原性I->Fe2+>Br->Cl-)()A.7∶1 B.7∶2 C.7∶3 D.7∶4【答案】C7、将22.4g铁粉逐渐加入到含HNO3 0.8mol的硝酸中,反应生成的气体的物质的量(x)(假设HNO3的还原产物只有NO)随消耗铁粉的物质的量(y)变化关系中正确的是()【答案】C【解析】发生的反应为Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O;Fe+2Fe(NO3)3===3Fe(NO3)2通过计算,可得出正确答案。
河南省罗山高中2016届高三化学二轮复习 考点综合训练 从实验到化学(含解析)

从实验到化学1、下列操作中正确的是()A.用25mL量筒量取4.0mol/L的盐酸5.62mLB.用托盘天平称取5.56gKCl固体C.配制450mL0.2mol/LH2SO4溶液时应选用500mL容量瓶D.分液漏斗使用前需检查是否漏水,分液结束后漏斗中的上层液体从下口放出【答案】C【解析】A、量筒只能准确到0.1mL,不能量取5.62mL液体,故A错误;B、天平只能准确到0.1g,用托盘天平称取5.56gKCl固体,故B错误;C、实验室里没有450mL的容量瓶,要采用500mL的容量瓶,故C正确;D、分液漏斗的使用原则:使用前需检查是否漏水;分液时下层液体从下口放出,上层液体从上口倒出,故D错误.2、下列叙述中正确的是()A.摩尔是物质的质量的单位 B.碳的摩尔质量为12gC.阿伏加德罗常数约为6.02×1023mol-1 D.一个碳原子的质量为12g【答案】C【解析】A摩尔是物质的量的单位,B单位错;D一个碳原子的相对原子质量为123、下列各种仪器:①漏斗;②容量瓶;③锥形瓶;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶.常用于物质分离的是()A.①③⑦ B.②⑥⑦C.①④⑧ D.④⑥⑧【答案】C【解析】解:常用的物质分离的方法:过滤、萃取分液、蒸馏、分馏,各种方法所用的物质分离仪器有:漏斗、分液漏斗、蒸馏烧瓶.故选C.4、0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比()A.5︰2B.3︰1C.15︰2D.1︰3【答案】C【解析】FeCl3溶液氯离子的物质的量是0.5mol,KCl溶液氯离子的物质的量是0.2mol.所以物质的量之比等于微粒的个数比即5︰25、下列实验操作中叙述正确的是()A.萃取操作必须在分液漏斗中进行B.漏斗、试管、蒸馏烧瓶、天平、分液漏斗、研钵常用于物质分离C.用剩的药品均不能放回原试剂瓶中D.分液时,分液漏斗内下层液体从下口放出,上层液体从上口倒出【答案】D【解析】A.萃取可用固相萃取装置,不一定用分液漏斗,故A错误;B.天平用于称量一定质量的固体,不能用于分离,故B错误;C.对化学实验剩余药品,大多是不可以放回原瓶的,但是极少数例外,如金属钠切下一小块后可放回原瓶,故C错误;D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,以避免两种液体相互污染,故D正确.故选D.6、下列实验操作中,主要不是从安全因素考虑的是( )A. 过滤操作中,用玻璃棒引流B. 给试管里的液体加热,液体的体积一般不超过试管容积的1/3C. 酒精灯中的酒精不能少于1/3,不多于2/3D. 稀释浓H2SO4时,必须是浓H2SO4慢慢加入水中,并不断用玻璃棒搅拌【答案】A【解析】本题主要考查实验安全知识。
【配套K12】河南省罗山高中2016届高三化学二轮复习 考点突破54 化肥和农药(含解析)

化肥和农药1、普钙是目前使用最广泛的磷肥,其主要成分是( )A .Ca 5(PO 4)3FB .Ca(H 2PO 4)2和CaSO 4C .Ca 3(PO 4)2和CaHPO 4D .CaHPO 4和Ca(H 2PO 4)2【答案】B【解析】根据题中所给出的信息分析,本题重点考查的是磷肥的相关知识。
2、下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是 ①金属钠投入到FeCl 3溶液中②过量的NaOH 溶液和铝铵矾[NH 4Al(SO 4)2]溶液混合 ③少量电石(CaC 2)投入到过量的NaHCO 3溶液中④Na 2O 2投入到FeCl 2溶液中( )A .②④ B.③ c .②③ D .①④【答案】B3、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反应为( )OH FeO K Zn 242823++()()KOH OH Fe OH Zn 42332++下列叙述不正确的是 A. 放电时每转移mol 3电子,正极有421FeO molK 被氧化B. 充电时阳极反应为:()O H FeO OH e OH Fe 2243821062+=+----C. 放电时负极反应为:()23663OH Zn OH e Zn =+---D. 放电时正极附近溶液的碱性增强【答案】A4、下列说法正确的是( )A .若发生A 2+ 2D -=2A -+ D 2反应,则氧化性D 2>A 2B .若X 原子的质子数是a ,中子数是b ,则该核素可表示为 XC .若相同温度和浓度的两种钠盐溶液的碱性NaA <NaB ,则酸性HA >HBD .若主族元素的简单离子R 2- 和M +的电子层结构相同,则原子序数R >M【答案】C5、25℃时,向盛有50mL pH=2的HA 溶液的绝热容器中加入pH=13的NaOH 溶液,加入NaOH 溶液的体积(V )与所得混合溶液的温度(T )的关系如图所示.下列叙述正确的是( )A .HA 溶液的物质的量浓度为0 0l mol ·L ﹣1B .b→c 的过程中,温度降低的原因是溶液中发生了吸热反应C .a→b 的过程中,混合溶液中可能存在:c (A ﹣)=c (Na +)D .25℃时,HA 的电离平衡常数K 约为1.43×10﹣2【答案】C【解析】A、恰好中和时混合溶液温度最高,即b点,此时消耗氢氧化钠=0.04L×0.1mol/L=0.004mol,得出50mlHA的浓度==0.08mol/L,故A错误;B.b→c的过程中,温度降低的原因是溶液中发生了反应恰好生成NaA,继续滴加氢氧化钠溶液不再发生反应,溶液温度降低,故B错误;C.NaA呈碱性,HA呈酸性,a→b的过程中,混合溶液中可能呈中性,存在:c(A﹣)=c(Na+),故C正确;D.电离平衡常数K===1.43×10﹣3,故D错误;故答案选C.6、某溶液中可能含有OH﹣、CO32﹣、AlO2﹣、SiO32﹣、SO42﹣、HCO3﹣、Na+、Fe3+、Mg2+、Al3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是()A.原溶液中一定含有的阴离子是:OH﹣、SiO32﹣、AlO2﹣、CO32﹣B.反应最后形成的溶液中的溶质为NaClC.原溶液中一定含有Na2SO4D.原溶液中含有CO32﹣与AlO2﹣的物质的量之比为1:2【答案】A【解析】由图象分析可知,开始无沉淀生成说明加入的盐酸和溶液中的碱反应,说明溶液中一定含OH﹣离子,则与氢氧根离子不能共存的离子为Fe3+、Mg2+、Al3+;随后反应生成沉淀逐渐增大,说明是AlO2﹣、SiO32﹣和氢离子反应生成氢氧化铝沉淀和硅酸沉淀,由于AlO2﹣与HCO3﹣;继续加入盐酸沉淀量不变,消﹣发生反应生成氢氧化铝沉淀,则溶液中一定不存在HCO3耗盐酸的离子只能是CO32﹣离子,反应完后继续加入盐酸,沉淀逐渐减小,到不再改变,进一步证明沉淀是氢氧化铝和硅酸沉淀,氢氧化铝沉淀溶于盐酸,最后剩余沉淀为硅酸;硫酸根离子不能确定存在,但根据溶液的电中性可知,溶液中一定含有Na+离子;A、依据判断原溶液中一定含有的阴离子是:OH﹣、SiO32﹣、AlO2﹣、CO32﹣,故A正确;B、反应最后形成的溶液中的溶质为NaCl和AlCl3,故B错误;C、溶液中硫酸根离子不能确定,剩余原溶液不中一定含有Na2SO4,故C错误;D、依据图象可知和碳酸根离子反应的盐酸为2体积,CO32﹣+2H+=CO2↑+H2O 氢氧化铝溶解消耗的盐酸体积为4体积,Al(OH)3+3H+=Al3++3H2O,原溶液中含有CO32﹣与AlO2﹣的物质的量之比为3:4,故D错误;故选A.7、有FeO、Fe2O3的混合物若干克,在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻了8克;将等质量的原混合物与盐酸反应,欲使之完全溶解,需1mol/L的盐酸的体积至少为()A.0.5L B.0.1LC.2L D.1L【答案】D【解析】解:FeO、Fe2O3的混合物在足量氢气中加热充分反应,冷却后称得剩余固体比原混合物减轻了8克,减少的质量为氧离子的质量,则混合物中含有氧离子的物质的量为:=0.5mol,将等质量的原混合物与盐酸反应,欲使之完全溶解,反应生成氯化铁和氯化亚铁,根据电荷守恒可知消耗氯离子的物质的量一定等于氧离子所带电荷,则消耗氯离子的物质的量为:n(Cl﹣)=2n(O2﹣)=0.5mol×2=1mol,所以欲使之完全溶解,需1mol/L的盐酸的体积至少为=1L,故选D.8、下列关于过氧乙酸消毒液使用和保存方法不正确的是()A.将消毒液放在阴凉、避光的地方B.盛混合液的容器盖上可留一两个透气小孔C.在使用的时候,要注意稀释,消毒液不是越浓越好D.与“84”消毒液同时使用效果更好【答案】D【解析】拧紧后不透气易发生爆炸;NaClO水溶液呈碱性可与过氧乙酸反应,使氧化能力降低。
河南省罗山高中2016届高三化学二轮复习 考点综合训练 化学与技术的发展(含解析)

化学与技术的发展1、设NA为阿伏加德罗常数的值,下列说法中正确的是( )A.6.0g金刚石中含有的共价键数为NAB.56g铁粉与酸反应失去的电子数一定为0.2 NAC.1 mol·L﹣1AlCl3溶液中含有3NA个ClD.标况下,11.2LSO3所含的分子数为0.5NA【答案】A2、某芳香族酯类化合物甲的分子式为C14H10O5,1mol甲水解后只生成一种产物乙,其物质的量为2mol,下列说法正确的是()A.符合上述条件的甲共有3种B.1mol甲最多可以和7molH2发生反应C.乙中的所有原子一定共平面D.分别燃烧1mol乙与1mol苯耗氧量相同【答案】A【解析】解:酯类化合物甲含﹣COOC﹣,甲的分子式为C14H10O5,1mol甲水解后只生成一种产物乙,其物质的量为2mol,则乙中含﹣OH和﹣COOH,由碳原子数的关系可知,乙为或或,A.乙有3种,则发生酯化反应生成的甲有3种,故A正确;B.甲含有2个苯环和1个酯基,只有苯环与氢气发生加成反应,则1mol甲最多可以和6molH2发生反应,故B错误;C.乙含有苯环、C=O以及羟基,与苯环直接相连的原子在同一个平面上,由于含有﹣OH,且O原子为sp3杂化,呈V形,H原子与苯环不一定在同一个平面上,故C错误;D.乙的分子式为C7H6O3,可拆写成C6H4·CO2·H2O,分别燃烧1mol乙与1mol苯耗氧量不同,故D错误.故选A.3、温度为2 5℃时, 将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解, 通电一段时间后, 在阴极逸出a mol气体, 同时有 WgNa2SO4·10H2O析出, 若温度不变, 此时剩余溶液中的溶质的质量分数为()ABCD【答案】D【解析】用Pt作电极,电解饱和硫酸钠溶液时,阳极上氢氧根离子放电生成氧气,阴极上氢离子放电生成氢气,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠晶体和电解的水组成的也是饱和溶液。
【配套K12】河南省罗山高中2016届高三化学二轮复习 考点突破86 芳香烃(含解析)

芳香烃1、用分液漏斗可以分离的一组混合物是( )A .溴和CCl 4B .苯和溴苯C .硝基苯和水D .汽油和苯【答案】C【解析】A 、B 、D 项的物质可以互溶,不会分层,不可用分液漏斗分离。
2、2005年11月13日中国石油吉林石化公司双苯厂发生爆炸事故,大量硝基苯泄漏,引起松花江水污染,安全生产和环保问题再次引起人们的关注.下列关于硝基苯的叙述正确的是( )A .硝基苯是一种油状物质,会浮在水面上B .实验室制硝基苯需要用水浴加热C .硝基苯中毒是由蒸气吸入或误食引起的,与皮肤接触不会引起中毒D .硝基苯是由苯酚和硝酸直接反应生成的【答案】B【解析】硝基苯是一种油状液体,但是其密度大于水,故而泄漏时排入河流,会在水底随水流而动,A 错;硝基苯对于人体的皮肤有一定的腐蚀性,故而C 的说法也是错误的;硝基苯是有苯和硝酸在硫酸催化是硝化生成,故而D 也是错误的。
3、将112 mL 乙炔气体溶于2 mol 苯中,再加入30 g 苯乙烯,所得混合物中含碳的质量分数为( )A .75%B .66.7%C .92.3%D .无法计算【答案】C【解析】乙炔、苯、苯乙烯的分子式分别为C 2H 2、C 6H 6、C 8H 8可以看出,三种物质的最简式均为CH ,所以无论三种物质以何种比例混合,混合物中碳的质量分数均为1213×100%=92.3%,故选C 项。
4、某烃结构式如下:﹣C≡C﹣CH=CH ﹣CH 3,有关其结构说法正确的是( )A .所有原子可能在同一平面上B .所有原子可能在同一条直线上C .所有碳原子可能在同一平面上D .所有氢原子可能在同一平面上【答案】C 【解析】有机物﹣C≡C﹣CH=CH ﹣CH 3中,具有苯环、乙烯的共面结构以及乙炔的共线结构,所以苯环的6个碳原子一定共面,具有乙烯结构的后4个碳原子一定共面,具有乙炔结构的两个碳原子(倒数第四个和倒数第五个)一定共线,所有的碳原子可以共面. 故选C .5、蒽 的一氯取代物其同分异构体的种类有( )A 、 2种B 、 3种C 、 4种D 、 5种【答案】B6、已知化合物B3N3H6(硼氮苯)与苯的分子结构相似,如图所示,则硼氮苯的四氯取代物(B3N3H2Cl4)的同分异构体的数目为()A.2 B.3 C.4 D.5【答案】B【解析】解:方法一、苯的二氯取代物有邻、间、对三种同分异构体,硼氮苯也应该有这三种同分异构体,但考虑苯环上的六个碳原子是完全相同的,而硼氮苯中,B、N是两种不同的原子,所以间位上应有两种不同的排列,其中一种重复,所以一共有四种同分异构体.方法二、将二个Cl原子“定一、移一”,首先将一个Cl原子定在B原子上,移动另一Cl 原子,得3种结构;将一Cl原子定于N原子上,移动另一Cl原子,也得3种结构,其中有两种(另一Cl在B上的)与前面重复,故只有四种.故选B.7、由无水醋酸钠与碱石灰共热可得甲烷,预测无水苯乙酸钠与碱石灰共热时,所得有机物主要是( )A、苯B、甲苯C、乙苯D、苯甲酸钠和甲烷【答案】B【解析】无水醋酸钠与碱石灰共热得甲烷的反应称为脱羧反应,其原理是NaOH中氢氧键断裂,,而—CH3与H原子结合生成CH4,因此无水苯乙酸钠与碱石灰共热时脱羧生成—CH3。
配套K12河南省罗山高中2016届高三化学二轮复习 考点突破79 电解池(含解析)

电解池1、用石墨作电极,电解1 mol/L 下列物质的溶液,溶液的pH 保持不变的是( )A .HClB .NaOHC .Na 2SO 4D .NaCl【答案】C【解析】电解HCl 溶液生成氢气和氯气,溶质减少,pH 增大;电解NaOH 溶液实质是电解水,NaOH 溶液浓度增大,pH 也增大;电解NaCl 溶液生成NaOH ,pH 增大。
2、pH =a 的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH >a ,则该电解质可能是 ( )A .H 2SO 4B .AgNO 3 C.Na 2SO 4 D .NaOH【答案】D3、下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。
装置Ⅰ的离子交换膜只允许Na +通过,已知电池充放电的化学方程式为:当闭合开关K 时,X 电极附近溶液变红。
下列说法正确的是( )A .闭合开关K 时,钠离子从右到左通过离子交换膜B .闭合开关K 时,负极反应式为:3NaBr-2e -=NaBr 3+2Na +C .闭合开关K 时,X 电极反应式为: 2Cl --2e-=Cl 2↑D .闭合开关K 时,当有0.1molNa +通过离子交换膜,X 电极上析出标准状况下气体1.12L【答案】D4、下列叙述中,正确的是( )A. 在AgBr 饱和溶液中加入3AgNO 溶液,达到平衡时,溶液中-Br 浓度降低B. 常温下,某溶液中由水电离出的()L mol OH c /10110--⨯=,该溶液一定呈酸性C. 3FeCl 溶液和()342SO Fe 溶液加热蒸干、灼烧都得到32O FeD. 用惰性电极分别电解2CuCl 溶液和2MgCl 溶液分别得到单质Cu 和Mg【答案】A5、在25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出a mol 气体,同时有W g Na 2SO 4·10H 2O 析出,若温度不变,此时剩余溶液中溶质的质量分数为( )A.W W +18a×100% B.W W +36a ×100%C.71W 161?W +18a ?×100% D.71W 161?W +36a ?×100% 【答案】D【解析】此题要注意题目条件。
【配套K12】河南省罗山高中2016届高三化学二轮复习 考点突破5 氧化还原反应(含解析)

氧化还原反应1、已知在酸性条件下有以下反应关系:①KBrO 3能将I -氧化成KIO 3,本身被还原为Br 2;②Br 2能将I -氧化为I 2;③KIO 3能将I -氧化为I 2,也能将Br -氧化为Br 2,本身被还原为I 2。
向KBrO 3溶液中滴加少量KI 的硫酸溶液后,所得产物除水外还有( )A.Br -、I 2B.Br 2、Br -、I 2C.Br 2、I 2、IOD.Br 2、IO【答案】D【解析】假设KBrO 3的量一定,KI 的量由少到多依次加入,所得产物(除水外)依次为①Br 2和IO ,②Br 2、I 2和IO ,③Br 2和I 2,④Br 2、Br -和I 2,⑤Br -和I 2。
后面所发生的反应分别是过量的I -与IO 和Br 2的反应(IO 比Br 2的氧化性强),但与本题无关。
2、有Fe 2+、3NO -、Fe 3+、4NH +、H +、H 2O 六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述不正确的是( )A .还原产物为4NH +B .氧化剂与还原剂物质的量之比为8∶1C .若有1 mol 3NO -参与反应,则有3 mol H 2O 生成D .Fe 2+在反应中被氧化【答案】B3、下列物质在氧化还原反应中硫元素只具有还原性的是A .H 2SB .SO 2C .H 2SO 3D .H 2SO 4【答案】A4、在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )A.在含等物质的量2AlO -、OH -、23CO -的溶液中,逐滴加入盐酸,离子反应发生的先后顺序为2AlO -、OH -、23CO - B.在含等物质的量的Fe 3+、Cu 2+、H +的溶液中加入锌粉,离子反应发生的先后顺序为Fe 3+、Cu 2+、H +、Fe 2+C.在含等物质的量的Ba(OH)2、KOH 的溶液中,缓慢通入CO 2,离子反应发生的先后顺序为KOH 、Ba(OH)2、K 2CO 3、BaCO 3D.在含等物质的量的FeBr 2、FeI 2的溶液中,缓慢通入氯气,离子反应发生的先后顺序为I -、Br -、Fe 2+【答案】B【解析】A 项,OH -先反应,错误;B 项,氧化性Fe 3+>Cu 2+>H +>Fe 2+,顺序正确;C 项,反应开始有BaCO 3沉淀生成,先后顺序为Ba(OH)2、KOH、K2CO3、BaCO3,错误;D项,还原性I->Fe2+>Br-,反应顺序为I-、Fe2+、Br-,错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解质溶液1、某溶液中含有NO3-、S2-、AlO2-、SO32-四种阴离子,若向其中加入过量的盐酸,微热并搅拌,再加入过量的NaOH溶液,则溶液中物质的量基本不变的阴离子是A.NO3- B.S2- C.AlO2- D.SO32- 【答案】C2、下列有关溶液中微粒的物质的量浓度关系正确的是()A.在0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)> c(CO32-)> c(H2CO3)B.在0.1mol·L-1Na2CO3溶液中:c(OH-)= c(HCO3-)+c(H2CO3-)+ c(H+)C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)> c(H+)D.常温下,CH3COONa和CH3COOH混合溶液呈中性, c(Na+)=0.1mol·L-1:c(Na+)= c(CH3COO-)> c(CH3COOH)> c(H+)= c(OH-)【答案】D3、向两份a mL b mol/L的稀盐酸中分别加入xmL的水和ymLbmol/LBa(OH)2溶液,此时两溶液的pH恰好相等,则x、y的关系符合(式中a、b均大于零,设两溶液混合时的体积有加和性)A. y=2ax+bB.y=ax/(2x+3a)C.a/2y-3a/2x=1D. x=2ay/(a+y)【答案】BC4、下列图示与对应的叙述相符的是()A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液B.图2表示某吸热反应分别在有、无催化剂的情况卞反应过程中的能量变化C.图3表示0.1 000mol·L-1NaOH溶液滴定20.00mL0.1 000mol·L-1醋酸溶液得到滴定曲线D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化【答案】D【解析】A、KNO3的溶解度随着温度的升高而升高,溶解度曲线上的点是饱和溶液,曲线以下的a点是不饱和溶液,故A错误;B、反应物的总能量大于生成物的总能量,则反应是放热反应,加入催化剂会降低活化能,改变反应的速率,但反应热不改变,故B错误;C、强碱氢氧化钠滴定弱酸醋酸溶液时,恰好完全反应时,所得溶液为醋酸钠溶液显示碱性,pH大于7,而不是等于7,故C错误;D、开始滴加同时发生反应为SO42-+Ba2+=BaSO4↓,Al3++3OH-=Al (OH)3↓,当Al3+沉淀完全时需加入0.03molOH-,即加入0.015molBa(OH)2,加入的Ba2+为0.015mol,SO42-未完全沉淀,此时溶液含有硫酸铵、硫酸铝;(开始到a)再滴加Ba(OH)2,生成BaSO 4沉淀,发生反应为SO 42-+Ba 2+=BaSO 4↓,NH 4++OH -=NH 3?H 2O ,所以沉淀质量继续增加;当SO 42-完全沉淀时,共需加入0.02molBa (OH )2,加入0.04molOH -,Al 3+反应掉0.03molOH -,生成Al (OH )30.01mol ,剩余0.01molOH -恰好与NH 4+完全反应,此时溶液中NH 4+完全反应,此时溶液为氨水溶液;(a 到b )继续滴加Ba (OH )2,Al (OH )3溶解,发生反应Al (OH )3+OH -=AlO 2-+2H 2O ,由方程式可知要使0.01molAl (OH )3完全溶解,需再加入0.005molBa (OH )2,此时溶液为氨水与偏铝酸钡溶液,(b 到c ),故D 正确.故选D . 5、下列有关电解质溶液的推理中正确的是( )A .室温下,pH =4的醋酸和pH =10的氢氧化钠溶液等体积混合,其pH> 7B .pH =3的盐酸与pH =11的氨水等体积混合后,溶液中:c (NH4+)>c (Cl-)>c (OH-)>c (H+)C .物质的量浓度相等的NH4Cl 溶液和NH4HSO4溶液中,NH4+浓度相等D .在有AgI 沉淀的上清液中滴加NaCl 溶液,可以观察到白色沉淀产生【答案】B6、在常温下,0.1000mol·L -1Na 2CO 3溶液25mL 用0.1000mol·L -1盐酸滴定,其滴定曲线如图6。
对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )A .a 点:c (CO 2-3)>c(HCO -3)>c(OH -)B .b 点:5c(Cl -)>4c(HCO -3)+4c(CO 2-3)C .c 点:c(OH -)=c(H +)+c(HCO -3)+2c(H 2CO 3)D .d 点:c(H +)=2c(CO 2-3)+c(HCO -3)+c(OH -)【答案】B7、下列说法正确的是( )A .某二元弱酸的酸式盐NaHA 溶液中:c (H +)+c (Na +)=c (OH -)+c (HA -)+c (A 2-)B .一定量的(NH 4)2SO 4溶液与NH 3·H 2O 混合所得的酸性溶液中:c (NH 4+)<2c (SO 42—)C .物质的量浓度均为0.01mol/L 的CH 3COOH 和CH 3COONa 的溶液等体积混合后所得溶液中:c (CH 3COOH)+c (CH 3COO -)=0.02mol/LD .物质的量浓度相等的①NH 4HSO 4溶液、②NH 4HCO 3溶液、③NH 4Cl 溶液中c (NH 4+)的大小关系:①>②>③【答案】B【解析】B 选项的电荷守恒表达式为c (NH 4+)+c (H +)=c (OH -)+2c (SO 42—),由于溶液呈酸性,即c (H +)>c (OH -),则c (NH 4+)<2c (SO 42—),故B 正确。
C 选项应为c (CH 3COO -)+c (CH 3COOH)=0.01mol/L 。
D 选项中,由于NH 4+与HCO 3—的水解互相促进,所以②中c (NH 4+)最小,故D 错误。
8、下列相关反应的离子方程式书写正确的是( )A.4molFe 在5molCl2中点燃反应:5Cl2+4Fe=2FeCl2+2FeCl3B.氯化铁溶液中通入硫化氢:2Fe3++H2S=2Fe2++S↓+2H+C.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2OD.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32-【答案】B试题分析:A、铁在氯气中燃烧都生成氯化铁,不会生成氯化亚铁,与量无关,错误;B、铁离子与硫化氢发生氧化还原反应,生成亚铁离子和单质硫,正确;C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀时氢氧根离子与铝离子反应生成氢氧化铝沉淀,同时和铵根离子反应生成氨气,错误;D、NaHCO3溶液中加入过量的Ba(OH)2溶液时溶液中有氢氧根离子剩余,而所给离子方程式表示碳酸氢钠过量,错误,答案选B。
9、下列说法正确的是( )A.溶度积小的物质一定比溶度积大的物质溶解度小B.对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小C.难溶物质的溶度积与温度无关D.难溶物的溶解度仅与温度有关【答案】B【解析】溶度积与溶解度必然联系,但对同类型的难溶物,溶度积小的一定比溶度积大的溶解度小。
某一难溶物质的溶度积仅与温度有关,难溶物的溶解度不仅与温度有关,还与酸碱度和其它离子的浓度有关。
10、用已知浓度的盐酸来测定某个Na2CO3溶液的浓度时,若配制Na2CO3溶液时所用Na2CO3中分别含有:①NaOH②NaCl ③NaHCO3④K2CO3杂质,则所测结果偏小的是( )A.仅① B.仅② C.仅②③ D.②③④【答案】D【解析】中和1 mol HCl需Na2CO3的质量为53 g,需NaCl、NaOH、NaHCO3、K2CO3的质量分别为0 g、40 g、84 g、69 g,可见Na2CO3中若混有NaOH会使所测结果偏大,混有NaCl、NaHCO3、K2CO3时所测结果偏小。
11、温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是()A.③①④②⑤B.①③⑤④②C.③②①⑤④D.⑤②④①③【答案】A【解析】首先根据盐类水解规律将其按酸碱性分组,呈酸性的是①③④,呈中性的是②,呈碱性的是⑤。
在呈酸性的①③④中,NH4HSO4中的HSO42—电离出H+,其溶液的酸性最强,其pH最小,(NH4)2SO4溶液中的NH4+浓度大于NH4NO3溶液中的NH4+浓度,其达到水解平衡时,(NH4)2SO4溶液中的H+浓度大于NH4NO3溶液中的H+浓度。
CH3COONa溶液呈碱性,pH最大,综上所述,其pH 由小到大的排列顺序是③①④②⑤。
12、已知几种难溶电解质的溶度积常数Ksp(25℃)见下表:下列叙述不.正确的是()A.Ksp的大小与三种卤化银见光分解的难易无关B.将等体积的4×10-3mol·L-1的AgNO3溶液和4×10-3mol·L-1K2CrO4溶液混合,有Ag2CrO4沉淀产生C.向AgCl的悬浊液中滴加饱和Nal溶液可以得到黄色AgI悬浊液D.向100 mL 0.1mol·L-1的Na2SO4溶液中加入1 mL 0.1 mol·L-1的AgNO3溶液,有白色沉淀生成【答案】D13、下列关于等体积、等pH的NaOH和氨溶液的说法正确的是( )A.两种溶液中OH—溶浓度相同B.需要等浓度、等体积的盐酸中和C.温度升高10℃,两溶液的pH仍相等D.两种溶液中溶质的物质的量浓度相同【答案】A14、下列有关电解质溶液中微粒的物质的量浓度关系正确的是A.在0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO-3)>c(CO2-3)>c(H2CO3)B.在0.1 mol·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO-3)+c(H2CO3)C. 向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO2-3)>c(HCO-3)>c(OH-)>c(H+)D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)【答案】D15、25℃时,有下列四种溶液:①0.1mol/L 的CH3COOH溶液;②pH=13的NaOH溶液;③0.05mol/L的 H2SO4溶液;④0.1mol/L 的Na2CO3溶液。
