腹腔、盆腔外科手术用可吸收防粘连产品
防粘连产品及相似产品的综合比较
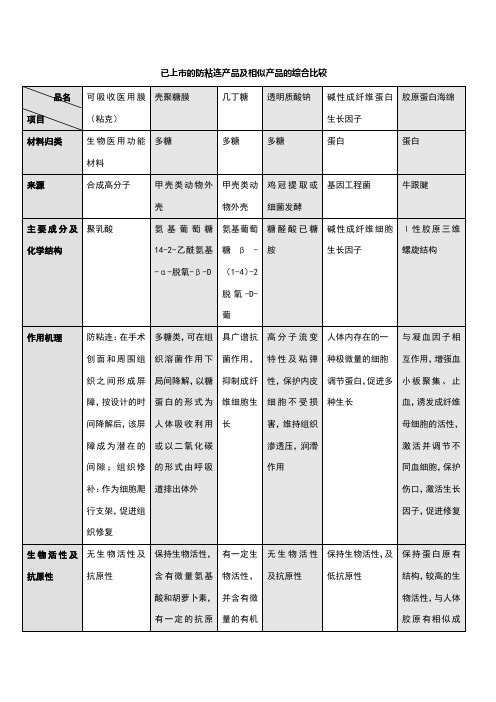
已上市的防粘连产品及相似产品的综合比较粘连平(黑龙江燎原科技有限公司)成分:聚乙二醇和盐酸小檗碱作用机制:1、.无色.略有微臭的物体.它可以与水性任意混合.也可以与某有机溶济混合,但不溶于乙醚.其性质稳定. 毒性小.对许多药物有增溶.增加稳定性和延长药效作用.并且不被肠道细菌分解.不能被机体组织吸收利用.2、聚乙二醇化蛋白质有以下特点:(1)增加溶解度和稳定性 (2)改变药代动力学(与药物蛋白结合减缓代谢)(3)改变免疫原性(与有治疗价值的酶因子结合降低免疫原型)3、盐酸小檗碱:是由中药黄连提取加工出的一种物质,味苦,色黄,具有抗炎性渗出,抗感染的作用.同时它还具有除疤痕促进修复多靶点作用.术优康(贵州扬生医用器材有限公司)术尔泰(河南传承医疗器械有限公司)成分:羧甲基葡聚糖钠(属于壳聚糖的衍生物)粘液状态作用机制:具有保护组织生物活性,保护组织t-PA活性,减少渗出,缓和刺激,润滑隔离及生物屏障作用,促进上皮、组织创面完全性修复。
外用,喷涂,湿敷,冲洗。
医用几丁糖凝胶(术亿宁)成分:几丁糖--医用几丁糖凝胶是由蟹壳提纯的高分子化合物几丁质(作用机制:防止术后组织粘连的机理有:(1)医用几丁糖凝胶具有选择性促进上皮细胞、内皮细胞生长而抑制成纤维细胞生长的生物特性,从而促进组织生理性修复,抑制疤痕形成,减少组织粘连。
(2)医用几丁糖凝胶具有局部止血作用及抑制血纤维蛋白束形成,从而减少了因血肿机化而造成的组织粘连。
(3)医用几丁糖凝胶有润滑作用及生物屏障作用,能有效地阻止粘连发生。
医用几丁糖凝胶保护关节软骨的机理在于几丁糖在理化性质上与关节内氨基多糖相似,具有粘弹性,缓吸收性,而氨基多糖时软骨及软骨基质构成与代谢的基础。
益术康(医用透明质酸那凝胶)成分:医用透明质酸钠凝胶(非处方、OTC产品)---不得用于眼科作用机制:(一)外科形成无序的纤维网络结构隔离在组织表面,使炎症浆膜与正常浆膜隔离。
抑制粒细胞的游走及活性,刺激巨噬细胞作用,抑制炎证反应,减少术后粘连的形成。
粘克可吸收医用膜(聚乳酸防粘连膜)和同类产品的比较
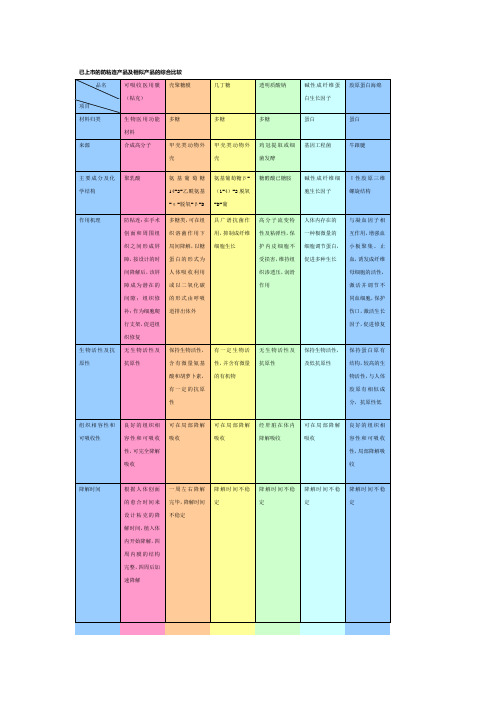
糖醛酸已糖胺
碱性成纤维细胞生长因子
Ι性胶原三维螺旋结构
作用机理
防粘连:在手术创面和周围组织之间形成屏障,按设计的时间降解后,该屏障成为潜在的间隙;组织修补:作为细胞爬行支架,促进组织修复
多糖类,可在组织溶菌作用下局间降解,以糖蛋白的形式为人体吸收利用或以二氧化碳的形式由呼吸道排出体外
一切手术止血与损伤的修复,适用外科、皮肤科、骨科、妇科及难愈性创伤的愈合
安全可靠性副作用
安全可靠无毒副作用柔韧兴好
纯化度低,强度低,无毒副作用
无毒副作用
无毒副作用
有致敏性
安全可靠无毒副作用
疗效
粘克结合国内外相关产品有缺点的基础上生产的新一代防粘连产品,防粘连作用确切、组织修补效果明显
有防粘连作用、对皮肤损伤有一定修复作用
具广谱抗菌作用,抑制成纤维细胞生长
高分子流变特性及粘弹性,保护内皮细胞不受损害,维持组织渗透压,润滑作用
人体内存在的一种极微量的细胞调节蛋白,促进多种生长
与凝血因子相互作用,增强血小板聚集、止血,诱发成纤维母细胞的活性,激活并调节不同血细胞,保护伤口,激活生长因子,促进修复
生物活性及抗原性
无生物活性及抗原性
可在局部降解吸收
良好的组织相容性和可吸收性,局部降解吸收
降解时间
根据人体创面的愈合时间来设计粘克的降解时间,植入体内开始降解,四周内膜的结构完整,四周后加速降解
一周左右降解完毕,降解时间不稳定
降解时间不稳定
降解时间不稳定
降解时间不稳定
降解时间不稳定
可吸收医用膜(粘克)
壳聚糖膜
几丁糖
透明质酸钠
碱性成纤维蛋白生长因子
一些生物材料在相关产品上的应用志利

适用范围:用于手术过程中视野渗血以及小静脉出血的局部止血;封闭缺损组织;防止组织粘连。
杭州普济医药技术开发有限公司
医用生物蛋白胶
性能组成:本产品是由一定比例来自猪血的纤维蛋白原,凝血酶,ⅩⅢ因子,钙离子,以及附件组成。
适用范围:本产品主要用于组织的损伤,缺损的修复。
上海其胜生物制剂有限公司
医用胶原蛋白海绵
性能组成:人体胎盘提取型以人体胎盘为原料,经过提取其中的胶原蛋白而成。其中,总蛋白含量:胶原蛋白海绵大于总重量的25%,羟脯氨酸含量不小于总蛋白含量的9%。牛跟腱型,以牛跟腱为原料经过提取其中的胶原蛋白而成,其中,总蛋白含量:胶原蛋白海绵大于总重量45%,羟脯氨酸含量不小于总蛋白含量的9%。
适用范围:用于胸腹腔手术过程中视野渗血,小静脉出血的止血,降低创面组织液渗出。
上海利康瑞生物工程有限公司
HM医用蛋白封合胶
性能组成:组分1:纤维蛋白原和ⅩⅢ因子,组分1溶解液:PH6.5-8.0注射用水。组分2:凝血酶,组分2溶解液:PH6.5-8.0注射用水和Ca2+。配套使用器械为双联注射器。
适用范围:该产品可用于神经外科和普外科,可减少局部手术创面渗血和漏液,具有止血和封闭缺损组织作用。
瑞士Biomet Merck Gmbh
塞普棉消炎止血胶原海绵Septocoll E Hemostyptic Collagen Fleece
性能组成:本产品由胶原(从马蹄组织中提出的蛋白)和庆大霉素制成。
适用范围:临产上适用于外科手术中止血消炎。
纤维蛋白原和纤维蛋白类
广州倍绣生物技术有限公司
聚乳酸防粘连膜作用原理及安全有效性

聚乳酸防粘连膜的功能是在手术创面形成屏障,在手术粘连形成期过后自行降解,防止术后组织粘连的发生。
【作用原理】:弘健医用膜(聚乳酸防粘连膜)屏障作用:弘健医用膜为柔性半透明薄膜,具有一定的机械强度,植入体内后,能在预期的时间内保持膜的形态,将手术创面与邻近器官组织隔离,以避免处于愈合过程中的创面与周围组织直接接触,从而可有效防止不良粘连的发生。
随着创面的愈合,纤维增生渐趋静止,弘健医用膜按照设计的时间被降解吸收,临时屏障消失而没有任何残留与蓄积。
支架作用:这是弘健医用膜的一个专利设计,该产品有一面为支架面,与创面贴附。
在手术创面部位植入弘健医用膜后,创面边缘的上皮细胞以膜为支架爬行生长,加快了创面的上皮化进程,促进创面的修复,并且使形成的瘢痕平整光滑,更有利于预防粘连的形成。
【产品说明】通用名:弘健医用膜/聚乳酸防粘连膜商品名:弘健医用膜成分:聚DL-乳酸(PDLLA)[物理性状] 本产品为无色或白色、透明或半透明、柔韧、无杂质薄膜。
批准文号:国食药监械(准)字2010第3640159号国家医疗器械分类目录:6864-01(可吸收性止血、防粘连材料)作用安全性:材料1,弘健医用膜使用的原材料乳酸为人体固有的物质,与人体无氧呼吸或紧张性活动时产生的乳酸相同,能被人体完全代谢,无蓄积。
乳酸在医药领域已得到长期、广泛的应用。
2,聚乳酸材料经FDA批准,用于医学材料、生物工程和药物载体等多个领域。
3,以聚乳酸为材料制成的医用产品有芬兰Bio-fix公司、日本Grand fix公司的可吸收骨钉及缝合线,美国Johnson 公司缝合线、美国SurgiWrap公司可降解抗组织粘连膜等,证明是极其安全的。
合成:聚乳酸及其共聚物具有良好的物理和化学性能,其强度、机械性能和降解速率等主要技术指标,通过对分子量及共聚体配比的调节,使产品得到适当的强度支持和适宜的降解速率降解:弘健医用膜的降解过程分为两个阶段:水解过程:聚乳酸材料在体液(水)的作用下,聚合物共聚链断裂,材料的机械强度减弱。
欣可聆注射液在妇科腹腔镜术后防粘连的临床应用

欣可聆注射液在妇科腹腔镜术后防粘连的临床应用目的:观察欣可聆注射液预防腹腔镜术后腹、盆腔粘连的临床应用。
方法:选择129例行腹腔镜手术的妇科患者,89例关腹前于腹腔内创面上注入欣可聆注射液20 ml,40例未用欣可聆注射液,前瞻性对比观察两组临床效果。
结果:①使用过欣可聆注射液术后疼痛轻于未使用过的;②使用过欣可聆注射液术后通气排便时间早于未使用过的;③使用过欣可聆注射液平均住院日短于未使用过的;④使用过欣可聆注射液复发率低于未使用过的。
结论:欣可聆注射液是预防腹腔镜术后腹腔粘连的有效方法,值得推广应用。
标签:欣可聆注射液;粘连;妇科;腹腔镜欣可聆注射液是外科手术用防粘连冲洗液,具有良好的防止组织粘连的作用,已被广泛应用于妇科和外科的腹腔镜手术当中。
我院自2004年开始在妇科腹腔镜手术中采用欣可聆注射液预防腹盆腔粘连,报道如下:1资料与方法1.1一般资料妇科腹腔镜手术患者129例,使用欣可聆注射液89例,平均年龄36.3岁;病种及手术分布见表1。
未使用欣可聆注射液患者40例。
两组患者年龄、病种等具有可比性。
1.2方法将欣可聆注射液接口处消毒后,接上可控流速的导管,待排出气体、防粘连液正常流出后,接到手术冲洗针上,根据临床需要调节流出速度;也可直接将防粘连液灌注在手术部位。
89例关腹前于腹腔内创面上注入欣可聆注射液20 ml,40例未用欣可聆注射液。
前瞻性对比观察两组临床效果。
1.3观察指标腹痛程度、通气排便时间、术后住院时间、复发率。
2结果2.1术后疼痛除外术后潴留的少数二氧化碳气体导致的肩背疼痛,根据患者自诉情况表明,使用过欣可聆注射液的术后无疼痛或疼痛程度较未使用过的轻。
2.2术后通气排便时间通过观察在8、12、24、48、72 h内两组患者的排气情况,发现使用过欣可聆注射液的通气排便时间早于未使用过的,见表2。
表2 两组术后通气排便时间比较(例)2.3术后平均住院日使用过欣可聆注射液术后平均住院时间短于未使用过的,见表3。
几种手术防粘连材料的性能比较分析

几种 手术 防粘连材料 的性能 比较分析
罗 军
( 海军总医院采 购中心 , 北京 10 3 ) 007 【 要】 摘 本文对 目前 国内较常见的几种手术防粘连材料性 能进行 比较 。 选取聚乳酸防粘连凝胶 、 透明质酸钠 、 聚乳酸防粘连膜 、
是在保证 正常伤 口愈合和避免感染 的前提下 ,消除或减少粘
连 的发生率和严重程度 。本文尝试着从材料来源 、 产品特性和
2 结 果
应用等方 面对上述几种产 品进行简 要的 比较 ,以供临床使用
选择 。
21聚乳酸防粘连凝胶 : . 属生物功能材料 , 来源于合成 医用高分子。主要成份 为聚
11对象 .
按照 目前国 内市 场常见 的防粘连 产 品主要 成分及 剂型 ,
选取聚乳 酸 防粘连凝 胶 、 明质 酸钠 、 透 聚乳 酸 防粘连膜 、 医用
壳聚糖膜等 4类 防粘连产 品 , 以相 关代表产 品的注册证 、 医疗
收 稿 日期 :0 8 0 - 3 2 0 - 2 0 修 回 日期 :0 8 0 —1 20 - 3 2
属生物功能类材料 , 主要成份为聚 D, 酸 , P L A经 L乳 由 DL 延压 加工而成 , 在创面 和周 围组织之 间形 成机械屏障 , 组织相 容性 较好 ,可降解吸收 。 自身 降解吸收后经三 羧酸循环生成 C H 0排 出体 外 。P L A具 有 微孔 结 构 ( 径 l~3 O和 DL 孔 0 m) ,有利 于营 养物质 交换 ,经 叠层技 术制 成 的表 面改 良
【 3 】Ta F n C ,W o g HF n ,Ng K K,e a h a feiua t1 .T e fe o pd r t l
atlg u re f rf;o g u ia M RIsrel c 】 uo o sf tgas ln i dnl o e a t t uvi neⅡ. l a
医用可吸收防粘连膜产品的研究进展及基本要求

医用可吸取防粘连膜产品的研究进展及基本规定〔摘要〕本文对国内外医用可吸取防粘连膜产品进行了综述,分析了可吸取防粘连高分子材料的应用现状及前景,并初步探讨了该类产品需要符合的理化性能、防粘连有效性和生物相容性的基本规定。
〔核心词〕可吸取;防粘连膜;高分子材料0前言粘连是结缔组织纤维带与相邻的组织或器官结合在一起而形成的异常构造。
在外科手术后,易发生组织粘连,这既是外科领域常见的临床现象,也是患者在愈合过程中必须经历的过程。
如果粘连现象在腹腔、盆腔骨骼等手术中出现,就会引发严重的并发症,如粘连性肠梗阻、因盆腔组织粘连而造成的女性不育症;甲状腺手术后出现粘连则引发喉返神经损伤。
粘连发生的重要因素有下列几个:(1)因局部缺血而引发的炎症;(2)手术过程中的创伤;(3)身体中异物的存在;(4)出血处和暴露伤口处得细菌感染。
现在,国内外有两种途径来避免术后组织粘连,一种是根据生理/ 药理机制的治疗办法,重要是药品减轻炎性反映和溶解纤维蛋白,另一种是医疗器械类的物理阻隔防粘连膜。
其中防粘连膜是一种含有适度柔软性,能够将患处与周边组织物理性隔离的膜材料,其在组织愈合过程中起到防粘连作用,并且术后能够在体内自行降解或被吸取,含有良好的组织相容性。
本文仅对医用可吸取防粘连膜产品及其材料进行叙述,并初步探讨了该类产品需要符合的理化性能、防粘连有效性和生物相容性的基本规定。
1国内外医用可吸取防粘连膜产品的应用现状及前景现在市场上的医用可吸取防粘连膜产品基本上分为两类:一类来源于天然高分子材料,重要有透明质酸、纤维素衍生物及其它们的复合物、壳聚糖及其改性产物;一类来源于人工合成高分子材料,重要有聚乳酸、乳酸-乙醇酸共聚物(PLGA)、聚乙二醇(PEG)及其它们的复合物。
(1)透明质酸和纤维素衍生物将透明质酸进行交联能够提高其粘度和在腹膜内的存留时间。
通过引入三价铁离子使其与透明质酸上的羧基螯合,可得到离子化交联的透明质酸防粘连膜Intergel➅。
粘克,可吸收的防粘连膜

粘克的支架作用
粘克®防粘连原理
粘克的屏障时效
粘克®的降解时间
粘克®的降解时间根据不同部位创面修复所需的时间而设计。
不同规格粘克®的降解时间为: 脏器用:保持屏障作用4周,2个月降解完毕 肌腱用:保持屏障作用6周,3个月降解完毕 骨科用:保持屏障作用8周,4个月降解完毕
在实际使用中,相同规格的产品在不同的个体及植入部位,因供血状 况、机体内环境的不同,使粘克的降解时间产生一定的差异。
6864-01(可吸收性止血、防粘连材料) 粘克—2006年12月获国家食品药品监督管理局批准
(国食药监械[准]字2006第3641181号)
粘克®防粘连原理
屏障作用
粘克为柔性透明薄膜,具有一定 的机械强度,植入体内后,能在 预期的时间内保持膜的形态,将 手术创面与邻近器官组织隔离, 以效避免处于愈合过程中的创面 与周围组织直接接触,从而可有 效防止不良粘连的发生。
织的刺激、加快手术速度……
粘连的预防
使用防粘连产品
临床认为理想的防粘连产品----
生物相容性好 可靠的安全性 有确切的防粘连效果 可降解,无体内蓄积 使用方便,操作简单
第二部分 产品篇
粘克®简介
粘克®简介
基本情况
粘克—可吸收医用膜\聚乳酸防粘连膜; 粘克—以乳酸为原料,
采用现代生物材料聚合与成膜技术制成, 完成相应功能后可被降解吸收, 医用生物材料; 临床上用于预防手术后不良粘连; 粘克—Ⅲ类医疗器械,国家医疗器械目录号:
粘连的处理
临床上对轻、中度粘连患者无法处理,粘连造 成的痛苦与危害伴随患者终身;
对严重影响功能或危及生命的粘连,需要二次 手术松解粘连部位;
松解术后70%以上的患者将会再次发生粘连, 形成恶性循环;
可吸收防粘连膜的开发及评价

生物医学工程研究JournalofBiomedicalEngineeringResearch2013,32(3):180~183△通信作者 Email:guoxp@bloomagefreda.com可吸收防粘连膜的开发及评价刘建建,冯晓毅,张燕,李超,郭学平△(华熙福瑞达生物医药有限公司,山东济南250101)摘要:本研究旨在制备并评价生物可吸收防粘连膜。
采用透明质酸钠和羟乙基纤维素为主要原料,以透明质酸钠的分子量、投料比、交联剂加入量为考察因素,以膨胀倍数及最大断裂力为指标,利用正交试验法优化可吸收防粘连膜制备工艺,评价膜性能。
最佳的制备工艺采用2000kD透明质酸钠,投料比1/1,交联剂加入量为50μl/ml,其在大鼠模型中表现出显著的防粘连效果。
该膜具有较高的机械强度,防粘连效果显著。
关键词:透明质酸钠;羟乙基纤维素;正交设计;可吸收;防粘连中图分类号:R318 文献标识码:A 文章编号:16726278(2013)03018004DevelopmentandEvaluationofAbsorbableAnti-adhesionFilmLIUJianjian,FENGXiaoyi,ZHANGYan,LIChao,GUOXueping(BloomageFredaBiopharmCO.,LTD,Jinan250101,China)Abstract:Toprepareandevaluatetheabsorbableanti-adhesionfilm.Hyaluronicacid(HA)andhydroxyethylcellulose(HEC)wereusedasmainrawmaterial,whiletheorthogonaldesignwasadoptedtooptimizethepreparationprocesswithHAmolecularweight,HA-HECratio,crosslinkerconcentrationasstudyfactors.Theoptimalpreparationconditionswereasfollow:2000kDHA,HA/HEC1/1,crosslinkerconcentrationwas0.5μl/mL.Moreover,thisfilmwaseffectiveforratmodelinanti-adhesion.Theabsorbableanti-adhesionfilmwithenoughmechanicalstrengthcanplayanattractiveroleinanti-adhesion.Keywords:Hyaluronicacid;Hydroxyethylcellulose;Orthogonaldesign;Absorbable;Anti-adhesion1 引 言在外科领域,特别是在腹部手术中,绝大多数会出现术后粘连的问题,可能导致小肠梗阻,继发性不孕症以及腹盆腔疼痛等多种术后并发症[1-2]。
医用可吸收防粘连膜产品的研究进展及基本要求

医用可吸收防粘连膜产品的研究进展及基本要求医用可吸收防粘连膜是一种无毒、无刺激性、可完全降解的生物材料,常用于手术或创伤后修复,以预防或减少手术后粘连的发生。
该类产品具有多种形式和材料的选择,如薄膜、凝胶和生物活性因子等。
下面将详细介绍医用可吸收防粘连膜产品的研究进展及基本要求。
研究进展:随着生物材料科学的发展,医用可吸收防粘连膜的研究也取得了显著进展。
目前已有多种材料被用于制备防粘连膜产品,包括聚乳酸(PLA)、聚乙二醇(PEG)、明胶、玻尿酸等。
这些材料具有良好的可吸收性和生物相容性,可以有效防止机体对膜的排斥和刺激反应。
此外,研究者们还开展了与防粘连膜材料相结合的生物活性因子的研究。
例如,利用生物活性因子如生长因子、抗炎因子等可以进一步促进疗效的提高。
同时,还有一些研究涉及表面改性和结构优化等方面的探索,以改善防粘连膜的物理性能和应用效果。
基本要求:1.可吸收性:防粘连膜应具有良好的可降解性能,在一定时间内能够被机体完全吸收,避免对机体造成不必要的刺激和排斥反应。
2.生物相容性:防粘连膜应具有良好的生物相容性,不会引起感染、毒性或免疫反应。
3.防粘连性能:防粘连膜应具有良好的防粘连性能,能够有效防止组织间的粘连和黏连,减少并发症的发生。
4.物理性能:防粘连膜应具有适当的力学性能和物理特性,如柔韧性、张力、表面粗糙度等,以适应不同手术环境和组织需要。
5.可操作性:防粘连膜应易于操纵和操作,便于手术医生使用,能够适应不同手术需求。
6.易保存性:防粘连膜应易于保存和储存,在长时间保存的情况下仍能保持产品的物理性能和功能。
总结:医用可吸收防粘连膜的研究进展在材料选择、生物活性因子应用和物理性能优化等方面取得了显著进展。
未来的研究需要更加重视临床应用效果和安全性的验证,并持续改进产品的性能和质量,以满足不同手术和治疗需求。
医用可吸收防粘连膜的发展将为手术治疗提供更好的修复和预防粘连的选择,提高手术效果和患者生活质量。
透明质酸钠凝胶在妇产科腹盆腔手术后粘连预防中的临床效果分析

透明质酸钠凝胶在妇产科腹盆腔手术后粘连预防中的临床效果分析目的探讨透明质酸钠凝胶在预防妇产科腹盆腔手术后粘连中的应用效果。
方法选取50例采用透明质酸钠凝胶预防术后粘连的妇产科腹盆腔手术患者(观察组)及未使用该药物的50例妇产科腹盆腔手术的患者(对照组)为研究对象,两组患者均为2次手术的患者,比较两组手术时腹盆腔粘连情况。
结果观察组术后粘连发生率少于对照组,粘连分级情况好于对照组,有统计学意义(P<0.05)。
结论透明质酸钠凝胶有利于减少妇产科腹盆腔手术后粘连,值得推广应用。
标签:透明质酸钠凝胶;妇产科;腹盆腔手术;术后粘连术后粘连是对妇产科腹盆腔手术的效果具有严重的影响,也是进一步外科手术的主要原因。
随着微创手术的开展、抗生素的应用,术后组织粘连的发生率有逐渐下降的趋势,但仍然是较为棘手的问题。
透明质酸钠凝胶是一种新型的组织粘连预防用药,具有高度的可塑性、黏弹性以及良好的生物相容性,流动性优胜于其他类型的凝胶样防组织粘连物质,在预防腹腔、盆腔术后组织粘连中发挥着重要的作用[1]。
我院将采用透明质酸钠凝胶和未使用透明质酸钠凝胶预防术后粘连的腹盆腔手术患者进行比较,探讨透明质酸钠凝胶的应用效果,报道如下。
1 资料与方法1.1 一般资料50例我院婦产科2012年12月至2014年4月收治手术患者(观察组),纳入标准:⑴主要脏器功能正常,无严重心、肺、肾等重要器官功能障碍,⑵入院后有完善的检查和手术准备;⑶均履行知情同意授信,并经医院伦理委员会批准;⑷无内分泌及免疫系统疾病;⑸有腹盆腔手术史;⑹均为2次手术的患者;⑺采用透明质酸钠凝胶预防术后粘连;排除标准:⑴合并恶性肿瘤患者;⑵心、肝、肾、循环、呼吸、神经、代谢等方面的功能严重紊乱者;⑶绝经后患者;⑶血液系统疾病、严重感染、糖尿病者;⑷有精神病史、神经系统疾病;⑸腹盆腔粘连史;年龄25~45岁,平均32.8±11.6岁。
初次手术原因:子宫肌瘤22例,卵巢肿瘤13例,异位妊娠9例,附件包块、盆腔炎等3例,输卵管积水3例。
四种临床产品预防手术后腹部粘连效果比较

四种临床产品预防手术后腹部粘连效果比较发表时间:2016-03-04T10:40:58.273Z 来源:《中国综合临床》2015年12月供稿作者:张会会1原芳1高权荣2林龙翔1张瑞明3孙雨龙1[导读] 中国科学院深圳先进技术研究院软组织粘连可以在身体组织损伤或手术治疗后发生,其中在腹部、盆腔、肌腱和脊柱等手术后尤为常见。
张会会1原芳1高权荣2林龙翔1张瑞明3孙雨龙11.中国科学院深圳先进技术研究院广东深圳518055;2.内蒙古医科大学内蒙古呼和浩特010059;3.内蒙古医科大学附属医院内蒙古呼和浩特010059基金项目:中国科学院“百人计划”资助项目(Y544011001);深圳市未来产业发展专项资金资助项目(SY49439),深圳市孔雀计划通讯作者:孙雨龙,中国科学院深圳先进技术研究院. 作者简介:张会会(1987年-),硕士,研究助理,主要从事防粘连产品的研究.【摘要】目的比较四种临床常用的防粘连产品在腹腔手术后防治粘连的效果,为临床更有效地使用防粘连产品提供指导.方法48只成年雌性SD 大鼠随机平均分成6组:无损伤假手术组、损伤粘连组和四个产品实验组.给予不同处理后,第14天对大鼠腹部粘连严重程度进行评价.结果四种防粘连产品均可预防大鼠腹部粘连,可吸收医用膜效果最好,粘连评分和粘连率最低(0.4,13%),与损伤粘连组(4.0,100%)比较有统计学意义(P <0.05),其余三组与损伤粘连组比较无统计学意义(P >0.05).结论可吸收医用膜、聚乙二醇小檗碱液、医用透明质酸钠凝胶和医用几丁糖均有降低大鼠术后腹腔粘连的疗效,可吸收医用膜防粘连效果明显优于其他三者. 【关键词】粘连; 防粘连产品; 粘连预防; 腹部手术【中图分类号】R656.4【文献标识码】A 【文章编号】1008-6315(2015)12-0618-02软组织粘连可以在身体组织损伤或手术治疗后发生,其中在腹部、盆腔、肌腱和脊柱等手术后尤为常见[1],文献报道腹部手术后约有67% ~ 93%的病人发生术后粘连[2].腹腔粘连发生在伤口愈合过程中,其形成与腹膜纤维蛋白沉积和纤维蛋白溶解能力之间的不平衡有关.局部的粘连将会导致严重的临床并发症,包括肠梗阻、不孕症和慢性盆腔疼痛[1],严重影响了手术效果和患者生活质量,加重了患者的经济和精神负担. 薄膜和粘稠液体类的物理隔离材料广泛应用于预防术后粘连的形成,多种产品已经用于临床防粘连.可吸收医用膜由乳酸聚合成,生物相容性好,可以生物降解吸收,用于预防或减少椎间盘突出症及腹(盆)腔手术的术后粘连; 医用聚乙二醇小檗碱液主要成分为聚乙二醇400聚合物和盐酸小檗碱,辅助用于预防或减少腹(盆)腔手术的术后粘连;医用透明质酸钠凝胶主要原料是由微生物发酵法制取的透明质酸钠,它用于预防或减少腹(盆)腔手术的术后粘连;医用几丁糖是无色透明的粘稠溶液,适用于所有腹腔、盆腔手术,可预防术后肠粘连和盆腔粘连,也被推荐用于预防肌腱、关节及神经粘连. 动物实验和临床应用显示这四种材料对腹腔手术、妇科手术和骨科术后防粘连均有一定的效果[3-8],但缺乏对多种防粘连产品进行比较的研究,难以客观评价各产品防治特定部位粘连效果的优劣,影响了临床更有效地使用防粘连产品.本研究利用大鼠腹部粘连模型,比较国内常用的四种防粘连产品在预防腹部手术后粘连的效果,为临床医生在外科手术中选择合适的防粘连产品提供参考.1材料与方法1.1实验动物成年雌性SD 大鼠48只,SPF级,体重230-280g,由广东省医学实验动物中心提供.动物饲养在恒温的环境中,每天亮/暗交替各12h, 并给予充足的食物和饮水.动物在实验前先检疫一周,待动物适应环境后进行实验. 1.2主要材料与仪器1.2.1防粘连产品可吸收医用膜(上海典范医疗科技有限公司);医用聚乙二醇小檗碱液(黑龙江燎原科技有限公司);医用透明质酸钠凝胶(上海建华精细生物制品有限公司);医用几丁糖(上海其胜生物制剂有限公司).1.2.2主要试剂戊巴比妥钠(默克公司);生理盐水(四川科伦药业);75%医用酒精(广东宝锭山药业有限公司);碘伏消毒液(江西草珊瑚消毒用品有限公司).1.2.3主要仪器医用真丝缝合线(上海浦东金环医疗用品股份有限公司);可吸收缝合线(上海浦东金环医疗用品股份有限公司).1.3手术方法按照文献报道的动物腹部粘连手术模型[9],无菌环境中,大鼠以40mg/kg戊巴比妥钠腹腔注射进行麻醉,沿腹中线切口6cm,再沿腹白线将肌层切口5cm,开腹后拉出盲肠,无损伤假手术组再将盲肠放回腹腔,腹壁肌层用4-0真丝线连续缝合,皮肤用4-0线间断缝合;其余组均将盲肠用牙刷刷100次,造成约1cm ×2cm 的损伤,并在腹壁距中线切口1cm 与盲肠相对处切除同样大小的浅层肌肉.造模后损伤粘连组将直接将盲肠放回腹腔, 并逐层缝合关腹;产品实验组用纱布止血后,将0.6ml液体产品(聚乙二醇小檗碱液、医用透明质酸钠凝胶或医用几丁糖)涂抹于腹壁和盲肠损伤处,或可吸收医用膜(1.5cm ×2.5cm)覆盖在腹壁和盲肠的损伤处,医用膜四角用7-0线与腹壁固定,然后将盲肠放入腹腔内,两损伤处对应后,逐层缝合关腹,最后用红霉素软膏涂抹皮肤缝合处,标记后放入笼内.1.4粘连评价术后14天将大鼠麻醉致死,U 型切口打开腹腔,充分暴露,按照文献方法对大鼠腹壁、盲肠与脂肪三者之间的粘连程度进行粘连评分[10]. 评分分为5个等级(表1).手术引起的炎症、浆膜损伤、局部缺血、出血、化学性刺激和异物残留等是引起术后粘连的重要因素,预防粘连的措施有改进外科手术技术、使用药物和采用生物隔离物,针对粘连发生的不同环节及机理,采取各种措施,以达到防止术后粘连的目的.临床通常使用多种防粘连生物材料产品预防术后粘连, 研究多为单个或少数产品防治粘连的效果,不能为临床针对特定病症在市场上多种防粘连产品中选择合适产品提供有效的指导,为此,本项目利用动物模型比较了国内常用的四种防粘连产品在预防腹部手术后粘连的效果.本实验中的假手术组和损伤粘连组的数据显示动物模型的成功构建,研究发现可吸收医用膜、聚乙二醇小檗碱液、透明质酸钠凝胶和几丁糖均有预防腹部粘连的效果,透明质酸钠凝胶、聚乙二醇小檗碱液和医用几丁糖使用方便,但它们防治腹部粘连的效果远不及可吸收医用膜,原因可能是可吸收医用膜对腹壁和盲肠损伤处的隔离效果较好,而溶液类产品容易流动,在体内容易被体液稀释,不能像可吸收医用膜一样,真正起到组织隔离效果,从而达到有效防治粘连的功效.动物和临床研究显示聚乳酸、透明质酸钠、几丁糖和聚乙二醇小檗碱液对预防腹部手术、妇科手术和骨科术后粘连均有一定的效果[3-8].一项有关聚乳酸凝胶和透明质酸钠凝胶预防腹腔粘连的对照研究结果发现[11],术后2周聚乳酸组腹腔粘连发生率比透明质酸组高,另一项研究比较了化学改性壳聚糖膜及透明质酸钠对腹膜粘连预防作用[12],结果表明化学改性壳聚糖膜具有明显的抗腹膜粘连的作用,且比透明质酸钠具有优势.本研究实验发现聚乳酸可吸收膜防腹部粘连效果优于透明质酸钠凝胶,医用透明质酸钠凝胶和医用几丁糖防治大鼠腹部粘连效果相近,这些结果与先前一些研究结果有差异,第一个原因是防粘连样品的不同,本实验使用的是CFDA 批准的临床产品,其他实验是自制的样品或不同厂家的产品,且本实验中聚乳酸采用的是可吸收的膜;第二,粘连模型中组织损伤的差别,为了更好地模拟临床情况,本实验对盲肠制造了较大的创伤,即将盲肠用牙刷刷100次,而其他实验仅用手术刀片轻刮盲肠浆膜制造损伤.因此本实验构建的动物模型更能代表临床实际情况. 可吸收医用膜预防腹壁和盲肠之间粘连的效果好,但它不能有效地防治脂肪与其他组织之间粘连,此外它与组织的贴附性不好,需缝合固定,造成使用不便,且降解较慢,体内放置两周,膜还尚未降解完全甚至完全没有降解,因此有待开发新型产品,一方面能够有效地预防多种组织的粘连,另一方面可以在临床手术中方便使用,产品容易在体内降解.参考文献[1] MonkBJ,BermanML,MontzFJ.Adhesionsafterextensivegynecologicsurgery:clinicalsignificance,etiology,andprevention[J].AmJObstet[ Gynecol,1994,170(5Pt 1):1396-403.2] MenziesD,EllisH.Intestinalobstructionfromadhesions--howbigistheproblem[J].AnnalsoftheRoyalCollegeofSurgeonsofEngland,[ 1990,72:60-63.3] 黄德清,丁吉元,曹永成,等.不同浓度透明质酸钠防肌腱粘连的对比研究[J].实用骨科杂志,1999,5(2):74-77. [4] 赵建华,王民刚,蒋祖言,等.聚乳酸薄板预防椎板切除术后硬脊膜外纤维瘢痕粘连的实验研究[J].中国脊柱脊髓杂志,1997,7(6):254-257. [5] 刘双利,侯春林,魏长征,等.新型壳聚糖衍生物预防椎板切除术后硬膜外粘连的实验研究[J].中国脊柱脊髓杂志,2009,19(10):769-773. [6] 郭健,余亮,余生元,等.几丁糖预防腹部术后肠粘连的疗效观察[J].中国修复重建外科杂志,2009,23(8):1023-1024. [7] 卢立炳,周茹建,王宝虎,等.医用几丁糖预防腰椎间盘突出症术后椎管瘢痕粘连的临床应用[J].临床外科杂志,2005,13(8):532-533. [8] 靳安民,闵少雄,高艳杰,等.医用聚乙二醇小檗碱液预防腰椎管术后硬膜外粘连的临床观察[J].黑龙江医学,2007,31(3):201-203. [9] HarrisES,MorganRF,RodeheaverGT.AnalysisofthekineticsofperiGtonealadhesionformationintheratandevaluationofpotentialantiadheG[ siveagents[J].Surgery,1995,117(6):663-669.10] LauderCI,GarceaG,StricklandA,etal.Useofamodifiedchitosandextrangeltopreventperitonealadhesionsinaratmodel[J].JSurg[ Res,2011,171(2):877-82.11] 李幼林,潘江华,童晓春,等.聚乳酸凝胶和透明质酸钠凝胶预防腹腔粘连的对照研究[J].海峡药学,2008,20(7):48-49. [12] 章志量,周卸来,倪有娣,等.凝胶化改性壳聚糖膜预防腹膜粘连的效果研究[J].肝胆胰外科杂志,2005,17(3):199-202.。
医用可吸收防粘连膜产品的研究进展及基本要求

[ 3 ] 吕志高 .一种非负矩阵分解方 法研究 以及 在盲源分 离 中的应用 [ D].武汉科技大学 :吕志高 , 2 0 1 3 .
析 ,由粗到细逐步观察信号 ,表征信号在频域和时
域 的特 点 。非 负矩 阵分解 技术 利用 非 负矩 阵分解 对
数 据稀 疏性 和独 立性 的分 析 ,在实 际 的心 电信 号处
( 2 ) 壳 聚糖 及其 改性 产物
术后 防粘 连隔 离膜百 菲米@ ,产 品材料 为 医用
聚 乙二 醇 ( P E G)及 其它们 的复 合物 。
( 1 ) 透 明质 酸和纤 维素 衍生 物 将 透 明质酸 进行 交联 可 以提 高其粘 度 和在腹 膜 内的存 留时 间。通过 引入 三价铁 离子 使其 与透 明质
[ 4 ]姚成 .心电信号智 能分析 关键技 术研 究 [ D].吉 林
大 学 :姚 成 , 2 0 1 2 .
[ 5 ]L e e D D, S e u n g H S .L e a ni r n g t h e p a r t s o f o b j e c t s b y n o n
—
理 中完 成盲 源信 号分 离 的任务 ,尤 其在 处理 一些 低
n e g a t i v e m a t r i x f a c t o r i z a t i o n[ J ] .N a t u r e .1 9 9 9 , 4 0 1
频 、抗干扰性较差的信号时 ,能够有效分离出来反
应 心脏 活动 的心 电源 信号 。 [ 参 考文献 ]
[ 1 ]赵丹 、马胜前 .基于小波变换 的虚拟心 电信号分 析仪
医疗 装 备 2 0 1 4第 4期
医用防粘连凝胶 ph范围

医用防粘连凝胶ph范围医用防粘连凝胶在我国医疗领域具有广泛的应用,其产品种类繁多,性能各异。
其中,医用透明质酸钠凝胶(防粘连眼科粘弹剂)和医用可吸收防粘连膜产品等均在临床手术中发挥着重要作用。
本文将针对医用防粘连凝胶的pH范围进行探讨,以期为临床应用提供参考。
一、医用防粘连凝胶的种类与特点1.医用透明质酸钠凝胶(防粘连眼科粘弹剂)医用透明质酸钠凝胶是由透明质酸的钠盐与生理平衡盐配制而成的无色透明胶状液体,具有优异的生物相容性。
该产品贮存于预灌封玻璃注射器内,经湿热灭菌,并配有无菌冲洗针。
在眼科手术中,医用透明质酸钠凝胶作为粘弹性保护剂,能够有效地防止组织粘连。
2.医用可吸收防粘连膜产品医用可吸收防粘连膜产品是一种具有适度柔软性的高分子材料,可以将患处与周边组织物理性隔离,防止术后组织粘连。
该类产品在体内可自行降解或被吸收,具有良好的组织相容性。
目前,医用可吸收防粘连膜产品在腹腔、盆腔骨骼等手术中具有广泛应用。
二、医用防粘连凝胶的pH范围医用防粘连凝胶的pH范围对其生物相容性和防粘连效果具有重要影响。
一般情况下,医用防粘连凝胶的pH值应控制在4.0~7.0之间,以保证其具有良好的生物相容性和稳定性。
1. 在pH4.0~7.0的范围内,医用防粘连凝胶能够保持稳定的物理性能和生物活性,有利于术后组织的愈合与恢复。
2. 如果pH值过高或过低,可能会影响防粘连凝胶的生物相容性,导致组织刺激或炎症反应,进而影响术后康复。
三、结论医用防粘连凝胶在医疗领域具有广泛的应用前景,其pH范围的控制在很大程度上影响着产品的生物相容性和防粘连效果。
因此,在选择和使用医用防粘连凝胶时,应注意其pH值,以确保临床应用的安全性和有效性。
同时,针对不同科室和手术需求,选用具有针对性的防粘连凝胶产品,以提高术后康复效果。
总之,医用防粘连凝胶在手术中起着至关重要的作用。
在实际应用中,医护人员需根据患者病情和手术类型,选择适宜的防粘连凝胶产品,并关注其pH范围,以确保术后康复效果。
腹腔、盆腔外科手术用可吸收防粘连产品

附件2腹腔、盆腔外科手术用可吸收防粘连产品注册技术审查指导原则一、前言腹腔、盆腔外科手术用可吸收防粘连产品为植入性高风险医疗器械。
本指导原则旨在为申请人进行腹腔、盆腔外科手术用可吸收防粘连产品的研发及注册申报提供技术指导,同时也为食品药品监管部门对注册申报资料的审评提供参考。
本指导原则系对腹腔、盆腔外科手术用可吸收防粘连产品的一般要求。
申请人应根据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
若不适用,应详细阐述理由及相应的科学依据。
本指导原则系对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。
如果有能够满足相关法规要求的其他方法,也可以采用,但是应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制订的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围本指导原则适用于腹腔、盆腔外科手术用可吸收防粘连产品。
同时包括与该产品配套使用的器械与工具(如有)。
三、注册申报资料要求(一)综述资料1.概述(1)申报产品管理类别:Ⅲ类。
(2)分类编码:6864。
(3)产品名称:申报企业应根据医疗器械命名的有关规定进行命名,并详细说明确定依据。
2.产品描述产品描述应全面、详细,至少应包括申报产品名称、产品性状(薄膜、凝胶或溶液等)、规格尺寸(说明所有尺寸大小,如适用)、产品组成成份[主体成分、改性剂及全部辅料(包括溶剂)]及组成比例、各组分的化学名称、分子结构式、原材料(国际通用规范化学名称)、各组分在产品中的功能、产品作用原理、适用部位、预期用途、技术性能指标、规格型号划分的依据等。
与产品配套使用的器械(如有)应说明其结构组成、尺寸及原材料信息、与产品在临床应用中的配合使用情况。
3.注册单元及型号规格(1)注册单元划分原则为:①不同性状的产品(如薄膜、凝胶或溶液等),不能划为同一注册单元。
术尔泰联合玻璃酸钠预防腹盆腔手术后粘连的效果观察

术尔泰联合玻璃酸钠预防腹盆腔手术后粘连的效果观察张玲慧;郭建光;王冠秀;白春辉;连华【摘要】目的观察术尔泰联合玻璃酸钠预防腹盆腔手术后粘连的效果.方法将腹盆腔手术148例随机分为试验组和对照组各74例.两组术后均行常规生理盐水和术尔泰溶液冲洗,手术结束关腹前试验组于手术创面涂抹玻璃酸钠凝胶,对照组未涂抹玻璃酸钠凝胶.比较两组术后24 h肛门通气排便、体温及腹盆腔粘连情况.结果试验组术后24 h内肛门通气排便率明显高于对照组(x2 =5.78,P=0.02),术后体温≥37.7%℃发生率明显低于对照组(x2=5.19,P=0.02),腹盆腔粘连程度明显轻于对照组(Z =3.27,P=0.001).结论腹盆腔手术后应用术尔泰联合玻璃酸钠能预防和减少手术后粘连.%Objective To observe the therapeutic efficacy of shuertai combined with sodium hyaluronate in prevention of adhesion after abdominal and pelvic cavity operation.Methods A total of 148 patients after abdominal and pelvic cavity operation were randomly divided into experimental group (n =74) and control group (n =74).After douching with normal saline (NS) and Shuertai solution,sodium hyaluronate was smeared on the wound surface before abdominal suture in experimentalgroup.Control group was not applied with sodium hyaluronate.Anal venting and defecation,body temperature,and abdominal and pelvic cavity adhesion 24 h after operation were compared.Results The incidence rate of anal venting and defecation postoperative 24 hours in experimental group was significantly higher than that in control group (x2 =5.78,P =0.02) ; the incidence rate of body temperature ≥37.7℃ in experimental group was significantly lower than that in control group (x2 =5.19,P =0.02) ; thedegree of abdominal and pelvic cavity adhesion in experimental group was lower than that in control group (Z =3.27,P =0.001).Conclusion Shuertai combined with sodium hyaluronate after abdominal and pelvic cavity operation may prevent and reduce incidence rate of postoperative adhesion.【期刊名称】《临床误诊误治》【年(卷),期】2013(026)008【总页数】3页(P96-98)【关键词】术尔泰;玻璃酸钠;腹盆腔手术;粘连【作者】张玲慧;郭建光;王冠秀;白春辉;连华【作者单位】050071 石家庄,石家庄医学高等专科学校西校区;050600 河北行唐,行唐县人民医院普外科;050600 河北行唐,行唐县人民医院普外科;050600 河北行唐,行唐县人民医院普外科;050600 河北行唐,行唐县人民医院普外科【正文语种】中文【中图分类】R619.3腹盆腔手术破坏了腹膜间皮细胞纤维蛋白原的释放和溶解平衡,易造成腹膜及肠粘连[1]。
医用几丁糖凝胶使用说明书

术亿宁医用几丁糖凝胶使用说明书成份:本品内含30mg/ml的几丁糖,用生理平衡液配制而成。
作用机理:医用几丁糖是由蟹壳提纯的高分子化合物几丁质(chitin),经脱N-乙酰基再深加工后制成的一种聚氨基葡萄糖,是一种具有良好生物相容性、生物可降解性及生物学活性的医用高分子多糖类物质。
其防止术后组织粘连的机理有:(1)医用几丁糖具有选择性促进上皮细胞、内皮细胞生长而抑制成纤维细胞生长的生物学特性,从而促进组织生理性修复,抑制疤痕形成,减少组织粘连。
(2)医用几丁糖具有局部止血作用及抑制血纤维蛋白束形成,从而减少了因血肿机化而造成的组织粘连。
(3)医用几丁糖凝胶有润滑作用及生物屏障作用,能有效地阻止粘连发生。
针对腹部手术肠腔内表面大,而且易发生粘连的浆膜粗糙面不易被发现等因素,为了使整个肠管、脏器表面都能均匀涂布上医用几丁糖凝胶,就必须增加使用剂量,从而能达到更为理想的防粘连效果。
适用范围:普通外科、妇产科等腹、盆腔手术,可预防术后肠粘连和盆腔粘连。
物理性状:本品为无色、透明粘稠状胶体。
用法:在关腹前将本品均匀涂布于腹、盆腔肠管、脏器表面和壁层腹膜,然后关腹。
注意事项:1.本品为无菌制品,应严格无菌操作。
2.本品仅适用于局部使用,不得静脉注射。
3.包装破损禁止使用。
4.用于预防组织粘连,必须在充分止血条件下使用,否则会将低使用效果。
禁忌症:目前未有明确禁忌。
副作用:本品为高度纯化、无毒、无致敏的天然聚糖,但医生应有使用任何天然生物材料具有潜在过敏性危险的意识。
目前尚未发现其它不良反应。
规格:1mL/支,2mL/支, 3mL/支, 5mL/支贮存:避光,2~8℃冷藏,不能冰冻。
有效期:两年。
生产企业许可证编号:冀食药监械生产许20050284号产品注册号:国食药监械(准)字2006第3640519号产品标准编号:YZB/国 0950-2005 《医用几丁糖凝胶》生产批号:见产品标签或外包装盒。
生产企业名称:石家庄亿生堂医用品有限公司注册、生产地址:石家庄市新石北路399号1号楼售后服务单位:石家庄亿生堂医用品有限公司邮编:050091 服务电话:0311-83861370。
医用耗材说明书:手术防粘连溶液

【导读】手术防粘连溶液是一种用于手术过程中预防和减少组织粘连的特殊溶液。
手术后组织愈合过程中,有时会出现组织之间黏连的情况,称为粘连。
粘连可能导致疼痛、不适以及影响器官功能。
为了减少或避免这种情况的发生,该产品应用于手术过程中,形成一层保护膜来分离组织,并降低组织间的黏连。
手术防粘连溶液分类1、聚乙二醇(PEG)基溶液:聚乙二醇是一种常用的手术防粘连溶液成分,具有良好的生物相容性和生物降解性。
这类溶液通常涂在手术切口或受伤组织表面,形成保护膜来分离组织并减少粘连。
2、胶原基溶液:胶原是人体组织中丰富的蛋白质成分,具有良好的生物相容性。
胶原基溶液可通过涂抹或喷洒在手术切口或受伤组织表面,形成保护层来减少粘连的发生。
3、载体/纺织品基溶液:这类手术防粘连溶液通常含有一定的载体或纺织品,如纱布片、网片等。
载体/纺织品基溶液可以用于包裹或填塞手术切口或空腔,以分离组织和减少粘连。
4、草酸基溶液:草酸是一种有机酸,具有良好的生物降解性。
草酸基溶液通常通过浸泡或涂抹在手术切口或受伤组织表面,形成保护层来防止组织粘连。
手术防粘连溶液简介手术防粘连溶液用于预防手术后粘连的配方溶液,通常由几种物质混合而成,如玻璃清洁剂、聚乙烯醇、生理盐水等。
它可以用于多种手术,例如腹腔镜手术、胸膜镜手术、骨科手术等。
手术防粘连溶液的作用是可以包裹和阻挡新生的组织、纤维和细胞,并减少愈合过程中的肉芽组织生长,从而减少粘连的发生。
手术防粘连溶液不会导致任何负面影响,它是安全和可靠的,可以在手术中随时使用。
手术防粘连溶液原理手术防粘连溶液的原理是通过涂覆在手术切口周围和腹腔内壁和器官表面上的防粘连溶液,形成一层防粘连的物理障碍,使手术中受损组织的表面不易形成黏附物质,从而减少组织间的粘连。
同时,防粘连溶液还能减少组织炎症反应、促进创面愈合、促进渗出液的排出,有助于减少手术后并发症的发生。
防粘连溶液的具体成分根据不同制剂而异,常见的成分有羟丙基甲基纤维素、透明质酸、胆碱、明胶等。
腹腔镜阑尾切除术后采用防粘连膜预防粘连性肠梗阻效果观察

腹腔镜阑尾切除术后采用防粘连膜预防粘连性肠梗阻效果观察发布时间:2021-05-24T06:59:39.373Z 来源:《中国蒙医药》2021年第1期作者:袁来顺王志平常丽芳[导读] 目的:探讨腹腔镜阑尾切除术后采用防粘连膜预防粘连性肠梗阻的效果。
方法:选取2019年1月-2020年6月于我院进行腹腔镜阑尾切除术的患者120例,随机分为两组,对照组常规关腹,研究组关腹前放置防粘连膜。
对比两组患者术后疼痛已以及恢复情况的差异。
结果:术后1d和术后7d两组患者疼痛程度差异不显著(P>0.05),术后3d研究组疼痛程度较对照组更低(P<0.05);研究组排气时间和肠鸣音回复时间较对照组更早(P<0.05),研究组肠梗阻发生率(1.7%)较对照组(10.0%)更低。
袁来顺王志平常丽芳北京市昌平中医医院北京市 102200【摘要】目的:探讨腹腔镜阑尾切除术后采用防粘连膜预防粘连性肠梗阻的效果。
方法:选取2019年1月-2020年6月于我院进行腹腔镜阑尾切除术的患者120例,随机分为两组,对照组常规关腹,研究组关腹前放置防粘连膜。
对比两组患者术后疼痛已以及恢复情况的差异。
结果:术后1d和术后7d两组患者疼痛程度差异不显著(P>0.05),术后3d研究组疼痛程度较对照组更低(P<0.05);研究组排气时间和肠鸣音回复时间较对照组更早(P<0.05),研究组肠梗阻发生率(1.7%)较对照组(10.0%)更低。
结论:选用术后防粘连膜对腹腔镜阑尾切除术患者进行治疗效果良好,可减少患者疼痛,促进患者康复。
【关键词】防粘连膜;腹腔镜;阑尾切除;疼痛急性阑尾炎是外科临床上常见的一种疾病,属于急腹症的范畴,患者一旦发病病情急骤,需尽快明确病情并确诊,根据患者具体情况及时进行治疗[1]。
外科腹部手术后常见并发症为粘连性肠梗阻,占所有肠梗阻的20-40%[2]。
近些年来,高分子材料在预防术后粘连等不良事件发生率方面的作用成为学者们研究热点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件2腹腔、盆腔外科手术用可吸收防粘连产品注册技术审查指导原则一、前言腹腔、盆腔外科手术用可吸收防粘连产品为植入性高风险医疗器械。
本指导原则旨在为申请人进行腹腔、盆腔外科手术用可吸收防粘连产品的研发及注册申报提供技术指导,同时也为食品药品监管部门对注册申报资料的审评提供参考。
本指导原则系对腹腔、盆腔外科手术用可吸收防粘连产品的一般要求。
申请人应根据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
若不适用,应详细阐述理由及相应的科学依据。
本指导原则系对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。
如果有能够满足相关法规要求的其他方法,也可以采用,但是应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制订的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围本指导原则适用于腹腔、盆腔外科手术用可吸收防粘连产品。
同时包括与该产品配套使用的器械与工具(如有)。
三、注册申报资料要求(一)综述资料1.概述(1)申报产品管理类别:Ⅲ类。
(2)分类编码:6864。
(3)产品名称:申报企业应根据医疗器械命名的有关规定进行命名,并详细说明确定依据。
2.产品描述产品描述应全面、详细,至少应包括申报产品名称、产品性状(薄膜、凝胶或溶液等)、规格尺寸(说明所有尺寸大小,如适用)、产品组成成份[主体成分、改性剂及全部辅料(包括溶剂)]及组成比例、各组分的化学名称、分子结构式、原材料(国际通用规范化学名称)、各组分在产品中的功能、产品作用原理、适用部位、预期用途、技术性能指标、规格型号划分的依据等。
与产品配套使用的器械(如有)应说明其结构组成、尺寸及原材料信息、与产品在临床应用中的配合使用情况。
3.注册单元及型号规格(1)注册单元划分原则为:①不同性状的产品(如薄膜、凝胶或溶液等),不能划为同一注册单元。
②产品配方不同不能划为同一注册单元。
(2)规格型号的划分对于存在多种型号规格的产品,应当明确各型号规格的区别。
应当采用对比表及带有说明性文字的图片、图表,对各种型号规格的结构组成、功能、产品特征、性能指标等方面进行描述。
同一注册单元检测时应考虑产品之间的差异性,如有必要应进行相关差异性检测。
4.包装说明综述资料应包括有关产品包装信息,以及与该产品一起销售的配件包装情况;应当说明与灭菌方法相适应的最初包装信息。
5.适用范围和禁忌症申请人可根据申报产品的具体预期用途及研究资料,参考本指导原则相关内容要求进一步确认申报产品具体的适用范围及禁忌症。
6.与同类产品的比较信息应当提供同类产品(国内外已上市)信息,阐述申请注册产品的研发背景和目的。
对于参考的同类产品,应当说明选择其作为研发参考的原因。
申请人应综述同类产品国内外研究及临床使用现状及发展趋势。
提交申报产品与已批准上市的同类产品等同性的对比资料,同时列表比较说明产品与同类产品在工作原理、结构组成、制造材料、性能指标以及适用范围等方面的异同。
(二)研究资料1.原材料控制应明确产品的起始物质,列明产品生产过程中由起始物质至终产品过程中所需全部材料(主体成分、改性剂及全部辅料)的化学名称、商品名/材料代号、CAS号、MSDS、化学结构式/分子式、分子量、来源和纯度、使用量或组成比例、供应商名称、符合的标准等基本信息,建议以列表的形式提供。
如果材料为某种聚合物,应提供分子式、平均分子量以及分子量分布的测定值(如果能够测定),推荐使用凝胶渗透色谱法测定。
如果材料为固体,应提供单位重量和尺寸信息。
如果材料是液体,应提供粘度、颜色和pH值等信息。
若产品的成分中含有胶原或其他动物源性材料,申请材料中应明确动物源性材料的种属和组织,以及胶原或其他材料的特定类型。
含动物来源材料产品的材料要求应符合《动物源性医疗器械产品注册申报资料指导原则》的相关要求。
应说明原材料的选择依据,起始材料及来源和纯度。
原材料应具有稳定的供货渠道以保证产品质量,需提供原材料生产厂家的资质证明及外购协议。
应明确所用原材料(主体成分、改性剂及全部辅料)的性能标准和验收标准及相关的安全性评价报告,上述材料应以列表的形式逐一列出。
2.生产工艺提交产品的生产工艺管理控制文件,详细说明产品的生产工艺和步骤,列出工艺图表。
应包括产品制备及配套使用的器械的工艺路线、关键工序、质量控制指标及相关的验证报告。
对生产工艺的可控性、稳定性应进行确认。
对生产加工过程中所使用的所有助剂(如:溶剂等)均应说明起始浓度、去除措施、残留浓度、对残留量的控制标准、毒性信息以及安全性验证报告。
应对生产、加工和包装步骤进行确认。
应给出每个过程或步骤的目的、每个过程或步骤中所使用的成分和材料、质量控制措施和所使用的设备。
应提供产品加工过程中以及终产品的质量控制要求(包括检测方法、手段)。
确证终产品的放行质量控制要求、检测方法、抽样原则及可接收标准。
3.产品性能研究(1)如果产品中含某种聚合物,应提供分子式、平均分子量以及分子量分布的测定值(如果能够测定),推荐使用凝胶渗透色谱法测定。
如果产品为固体,应提供单位重量和尺寸信息。
如果产品是液体,应提供装量、粘度、颜色和pH值等信息。
(2)应对每种材料(组分)进行检测,以评价其性质。
应控制材料(组分)的质量如:外观、粘度(如适用)、平均分子量、pH值、有机挥发性杂质含量,以及微粒物质等。
应明确所使用原材料的质量控制要求(标准)、检测方法。
应提供选材和质控标准(质量控制要求)确定的依据。
(3)提供从原材料至成品的全部制备过程(包括生产过程)。
说明产品的化学配方和生产工艺。
说明制备产品所使用的非参与化学反应成分、反应成分(包括催化剂、固化剂和反应中间体)。
应当对共聚体(如适用)进行分析,以确定(评价)产品的均一性。
(4)说明对产品的单一组分、复合组分(如适用)以及终产品的灭菌方式,应提交灭菌验证资料。
(5)无论是原材料中残留物、产品制备(生产)过程产生的化学残留物、或者是产品制备(生产)过程中引入的化学物质(不期望物质),应进行分析和控制。
应对已灭菌终产品通过极性和非极性溶液进行浸提萃取,应采用具有足够灵敏度的方法如高效液相色谱法检测潜在的毒性污染物。
此外,还应检测挥发性和非挥发性残留物质。
(6)应使用客观(定量)的测定方法详细并充分的表征产品的独有、显著特性,以便使审评人员能对这些特性有一个清楚的认识。
(7)应描述产品的关键物理性质。
根据产品性质制定检测项目。
固体、凝胶和液体防粘连产品可分别检测其撕裂强度、粘性和粘度。
确证产品的组成成分和结构信息是产品能否进行临床前和临床研究的关键。
因此需对产品进行全面研究确认,包括产品的物理尺寸、材料和性能。
(8)有效性研究应在适当的动物模型上进行产品有效性研究,通过这些研究能合理的推论出对人体的有效性。
动物研究也可以作为参考以更好地设计临床研究方案。
动物研究应尽可能的体现手术方法(开放性手术、腔镜下手术)、特定手术部位(如:在体壁和内脏之间、肠袢周围)、粘连的类型(如:新生粘连形成、原有粘连的再粘连)、粘连的评价方式(如:评分、发生率、广泛程度、严重程度),以及拟在人体临床研究中的产品使用方法。
这些研究应进行良好设计并设立对照组,以便显示产品治疗组与对照组之间具有显著的统计学差异。
植入后发生的任何感染都应报告并对结果进行统计处理。
应对预期用于人体的各不同剂量组进行比较。
还应提供对所使用动物模型的基本原理及其局限性的简要讨论。
申请人应阐明试验中选择的有效性终点观察时间与粘连形成的临床匹配性。
(9)应对产品可以防粘连的作用机理进行阐明,并提供支持性科学文献。
应考虑不同组织解剖部位粘连形成的机制可能不同。
应考虑产品降解的时间与临床粘连形成关键时间是否匹配。
(10)申请人应对产品进行体外降解试验研究,降解研究报告应说明所用材料、材料来源、研究设备、试验方案、试验步骤、支持文献等。
4.生物相容性评价及安全性研究(1)生物相容性本指导原则所涉及的产品是植入人体的,产品材料对人体应安全,不能对人体组织、血液、免疫等系统产生不良反应。
产品所使用材料的生物相容性优劣是防粘连产品研究设计中首先考虑的重要问题,申请人应提供有关研究评价技术资料,以便于审评人员全面掌握其对产品安全性进行研究及评价的情况。
生物相容性研究应遵循GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》相关要求,与组织接触24小时—30天的产品建议进行以下试验:∙细胞毒性∙致敏性∙刺激性或皮内反应∙急性全身毒性∙溶血试验∙遗传毒性(Ames回复突变、染色体畸变、小鼠淋巴瘤突变)∙热原试验∙植入试验∙降解试验∙亚慢性毒性应根据材料的预期用途制定植入、亚慢性毒性试验方案,材料的植入部位、植入时间应模拟临床使用的实际情况。
应根据产品特性设计试验方案,试验剂量应高于在体内可检测水平。
试验材料应植入到预期使用部位或其附近,评价时间应截止到材料被动物体完全吸收为止,须监测动物的全身毒性和植入部位的局部反应以及宏观病理学和组织病理学结果。
若接触时间大于30天,建议进行慢性毒性和致癌性研究(如大鼠2年植入试验)。
对于某些材料,如某些生物相容性项目没有必要进行测试,应提供足够的理由或证据说明。
但对其他一些材料,根据材料性质,可能需要增加测试项目。
在进行临床研究之前,应完成所有的临床前安全性研究,致癌性、生殖系统和发育毒性试验可能除外。
这些除外的项目取决于遗传毒性试验的结果、是否有可能发生生殖和发育毒性以及产品的预期用途。
知情同意书应披露任何一项悬而未决的安全性研究(结果)。
如果预期用途是提高生育能力,应进行生殖毒性试验。
(2)安全剂量范围在所有生物相容性和毒性测试中,试验中的产品剂量都应反映用于人体预期使用剂量合理的安全范围。
通常,应选择一系列剂量进行动物试验,直至剂量达到人体最高用量的10倍。
如达不到上述安全剂量范围,应证明人体暴露量大于十分之一的动物试验观察中无不良反应剂量的合理性。
(3)阻碍或延迟愈合试验减少粘连形成可能延迟和阻碍期望的愈合过程,动物试验研究时应评价这种情况。
在缝线拆除后,位于缝合或吻合部位的防粘连产品不应降低组织支持强度。
本试验可以在有效性研究中设计并增加专门观察指标。
(4)感染试验应测试防粘连材料接种细菌后对败血症的发生是否有促进作用,发生这种情况的原因可能是防粘连材料刺激细菌生长、抑制抗生素扩散到感染部位、与产品相关的感染性微生物由手术部位进入血液循环途径增多或其他未知机理导致的败血症。
因此应在防粘连材料存在和不存在的情况下分别给动物接种多种消化道微生物的混合物,针对死亡率和脓肿形成进行评分,这一试验需达到一定的样本量,并采用恰当的试验方案,以确保试验结果具有统计学意义。
