离子反应1
离子反应(1)
+ Cl-1
Al3+ +3NO3-
酸碱盐的电离和主要溶解性规律:
A.酸碱盐的电离
(1)酸的特征:只能电离出一种阳离子——H+
如:H2SO4=2H++SO42-(酸)
NaHSO4=H++Na++SO42(不是酸) (2)碱的特征:只能电离出一种阴离子——OH如:KOH=K++OH-(碱) Ba(OH)2=Ba2++2OH-(碱)
二、强电解质和弱电解质:
阅读 P14--15
强电解质:在水溶液里全部电离成离子的 电解质。
弱电解质:在水溶液里部分分子电离成 离 子的电解质。
强电解质
强酸:HCl H2SO4 HNO3 HBr HI HClO4 强碱:NaOH KOH Ca(OH)2 Ba(OH)2 大多数盐类:KNO3、NaCl
B.酸碱盐的主要溶解性规律
(1)酸:除硅酸(H2SiO3)外,大多数常 见酸易溶于水; (2)碱:KOH、NaOH、Ba(OH)2和氨水易溶, Ca(OH)2微溶,其余碱均不溶于水; (3)盐:钾盐、钠盐、铵盐、硝酸盐易溶 于水,盐酸盐除AgCl外易溶,硫酸盐除 BaSO4外易溶.
先溶解,后电离.
弱电解质
弱酸:CH3COOH 弱碱:NH3· 2O H H2CO3 Mg (OH)2 等难溶性碱
极少数盐: (和弱电解质
强电解质 物质结构 电离程度 溶液里粒子 导电性 物质类别 离子化合物 某些共价化合物 完全 水合离子 强 大多数盐类、强酸、 强碱 如 KNO3、NaCl、 HCl、H2SO4、NaOH 弱电解质 某些共价化合物 部分 分子、水合离子 弱 弱酸、弱碱、水 如 CH3COOH 、 NH3·H2O
高中化学-离子反应(1)

专题三
考点 :
1.电解质的判断 电解质的判断
离子反应
电离方程式、 2.电离方程式、离子反应方程式的正误判断 电离方程式 3.离子共存 离子共存
氯化钠固体不导电, 氯化钠固体不导电,而溶于水后却能导电
一、电解质和非电解质
电解质:在水溶液里或 电解质:在水溶液里或熔融状态下能够导电的 盐等) ( 化合物。 化合物。 如:酸、碱、盐等) 非电解质:在水溶液里或 非电解质:在水溶液里或熔融状态下都不导电 蔗糖、酒精等) ( 化合物。 的化合物。 如:蔗糖、酒精等)
注意: 注意:
对象:化合物 对象 化合物
找出下列物质中的电解质 NaCl晶体 NaCl晶体 熔融NaCl 熔融NaCl NaCl溶液 NaCl溶液 酒精 KNO3 CH3COOH 浓硫酸 HCl NaOH NH4Cl CH4 CaCO3 蔗糖 H NH3·H2O Cl2 Cu SO3 NH3 CO2
金属不是电解质,它的导电和 金属不是电解质 它的导电和 电解质导电原因有何不同? 电解质导电原因有何不同? 电解质溶液导电是靠阴、 电解质溶液导电是靠阴、阳离子的定向移动 ; 金属导电是靠自由电子的定向移动. 金属导电是靠自由电子的定向移动
注意:熔融状态只能破坏离子键 不能破坏共 注意 熔融状态只能破坏离子键,不能破坏共 熔融状态只能破坏离子键 价键,所以 所以共价化合物类的电解质只在水溶液 价键 所以共价化合物类的电解质只在水溶液 中能导电。 中能导电。如HCl H2SO4 HNO3只有在水溶 液中才能导电。 液中才能导电。
2.下列物质属于非电解质的是( B ) 下列物质属于非电解质的是( 下列物质属于非电解质的是 A、液态汞 B、液态氨 C、硫酸钡 、 、 、 D、硝酸 、 3.下列叙述正确的是( ) 下列叙述正确的是( 下列叙述正确的是 C A.固体氯化钠不导电,所以氯化钠是非电解质 .固体氯化钠不导电, B.铜丝能导电,所以铜是电解质 .铜丝能导电, C.氯化氢水溶液能导电,所以氯化氢是电解质 .氯化氢水溶液能导电, D.五氧化二磷溶于水能导电,所以五氧化二磷 .五氧化二磷溶于水能导电, 是电解质
离子反应(1)

编号NO. 武安市第十中学高一化学(苏教版)必修—第二专题第二单元主备:姜亚妮主审:曹俊彦离子反应(第一课时)学习目标1.理解强电解质和弱电解质的概念。
2.学会书写常见强电解质和弱电解质的电离方程式。
重点难点强、弱电解质有关概念的辨析,弱电解质电离方程式的书写。
学习过程复习:1.电解质:在里或状态下能够导电的化合物。
如:氯化钠、硝酸钾、氢氧化钠等。
非电解质:在水溶液或熔融状态下都不的化合物。
如:CO2、SO2、SO3、NH3、蔗糖、酒精等。
2. 电离:电解质在水溶液中或熔化状态下产生自由移动离子的过程。
注意:单质既不是电解质也不是非电解质。
练习1:根据有关概念回答下列问题:①Cu ②CuSO4晶体③熔化的KNO3 ④CO2⑤盐酸⑥NaCl溶液判断上述物质中:能够导电的是;属于电解质的是;属于非电解质的是。
练习2:电离方程式的书写Ba(OH)2NaClNa2SO4NaHCO3NaHSO4(水溶液中)【自主探究】一、强电解质和弱电解质1、强电解质:在水溶液中能的电解质。
常见物质:强酸—、、、HBr、HI、HClO4等。
强碱—、、Ca(OH)2、Ba(OH)2等。
大多数盐—NaCl、KNO3、AgCl、BaSO4、CaCO3等。
2、弱电解质:在水溶液中的电解质。
常见物质:弱酸—、、、H2SO3、H2S。
弱碱—、Fe(OH)3、Cu(OH)2、Mg(OH)2。
水二、弱电解质的电离CH3COOH HClONH3•H2O H2O【互动交流】强调:1、电解质的强弱与溶解度无关。
2、强电解质的导电性不一定比弱电解质强。
3、溶液的导电性取决于离子的浓度和离子所带的电荷数有关。
【课堂展示】【达标检测】1、下列物质既不是电解质,又不是非电解质的是()A.食盐水B.H2OC. NaHSO4D. Ca(OH)22、下列物质能够导电又是强电解质的是()A . NaCl晶体B.液态氯化氢C.熔融的KNO3 D. NH3·H2O3、下列物质的水溶液能导电,且属于非电解质的是()A . CH3COOH B. SO2C. NaHCO3D. NaOH4、下列电离方程式错误的是( ) A.NaHCO3=Na++HCO3-B.NaHSO4=Na++H++SO42-C.H2SO4=2H++SO42-D.KClO3=K++Cl-+3O2-5、下列电离方程式错误的是()A .Ba(OH)2=Ba2+ + 2 OH-B. NaHSO4(熔融)=Na+ + H ++ SO42-C.MgCl2=Mg2+ + 2 Cl-D. H2SO4=2H+ + SO42-。
必修1 第一章 第二节 离子反应(1)
核心知识点一:注意:(1)电解质、非电解质均应是化合物。
金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。
溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
核心知识点二:强电解质与弱电解质强电解质——在水中能够完全电离的电解质;如强酸(H2SO4、HNO3、HCl、HBr、HI)、强碱(KOH、NaOH、Ba(OH)2、Ca(OH)2)和大多数盐。
弱电解质——在水中不能够完全电离的电解质;如纯水,弱酸(HF、HClO、CH3COOH、H2SO3、H2CO3、H2SiO4,H3PO4)、弱碱(NH3·H2O、Fe(OH)3、Mg(OH)2等)、个别盐(醋酸铅)三、电离1. 溶液的导电性溶液导电是有条件的:有自由移动的电子或者阴阳离子;而电解质水溶液里或熔融状态下一般可产生自由移动的阴阳离子。
强碱和盐等离子化合物在固态时,固体内虽然存在阴、阳离子,但是不能自由移动,所以不能导电;在熔融状态或水溶液里能电离出自由移动的离子,故能导电。
酸在固态或液态(熔融状态)时只有分子,没有自由移动的离子,因而也不导电,如液态HCl、H2SO4等不能导电;但是在水溶液里受水分子的作用,电离产生自由移动的离子,因而能够导电。
电解质溶液的导电能力影响因素:①溶液中离子浓度②离子所带电荷多少。
即离子浓度越大,离子所带电荷越多,溶液导电能力越强。
所以,溶液导电能力的强弱与该溶液是强电解质溶液还是弱电解质溶液无关,即盐酸溶液的导电性不一定比醋酸溶液强。
高一化学离子反应1

A、①② B、②③④
C、③④
D、全部
2、下列物质的水溶液能导电,但属于非电解质是( C)
A、HClO
B、Cl2
C、CO2 D、 NH4HCO3
二、电离
为什么电解质在水溶液里或熔化状态下能够导电?
因为此时它们发生了电离 结果:产生了能够自由移动的离子
电离:电解质在溶于水或受热熔化时, 离解成自由移动的离子的过程。
用l电=离N方a程+ 式+ 表C示l-
比较
电离程度
强电解质 完全电离
弱电解质 部分电离
溶液中粒子 离子
分子,离子
同浓度溶液导电性
强
弱
物质 类别实例
大多数盐类, 弱酸,弱碱, 强酸,强碱, 水,如醋酸, (如 KNO3 NaCl,碳酸,氨水 KOH,)
小结:
一、电解质和非电解质 二、 强电解质和弱电解质 三、电离
第二节 离子反应
回忆
1、下面哪些物质能导电?为什么能导电 ? 盐酸、NaOH 溶液 、NaCl固体、石墨、蔗糖、KCl 溶液、Cu
小结:(1)石墨、铜能导电,因为其中有自 由移动的电子。 (2)盐酸、NaOH 溶液、KCl溶液能导电因 为它们的溶液中有自由移动的离子存在。
一、电解质和非电解质
1.电解质:在水溶液里或熔融状态下能导电的化合物. 如:酸、碱、盐等。 2.非电解质:在水溶液里或熔融状态下都不导电的化合物. 如:蔗糖、酒精等。
作业: 写出下列物质的电离方程式:
H2SO4 H2SO3 NH3.H2O H2S
Ba(OH)2
NaHSO4 CH3COOH
;快手号出售 https:// 快手号出售;
练 习
下列物质哪些是电解质?哪些是非电解质? Cu 、 NaCl固体、CO2 、 Na2O 、蔗糖、NaCl溶液、H2O、 酒精、浓硫酸 。
离子反应1

3.把 0.05mol 的 NaOH 固体分别加入下列 100ml 溶液中,溶液的导电能力变化不大的是( A、自来水 B、0.5mol/L 盐酸 C、0.5mol/L 醋酸 D、0.5mol/LNH4Cl 溶液
Na2CO3:________________________CH3COOH NH3.H2O 课 堂 展 示 归 纳 总 结 1. 下列物质 ①铁片 反 馈 (2) 以上物质中属于电解质的是_____________ (3) 以上物质中属于非电解质的是___________。 达 标 ( 4 ) 以 上 物 质 中 属于 强电 解 质 的 是 ____________ 。 ( 5 ) 以 上 物 质 中属 于 弱 电 解 质 的 是 ____________。 2.写出下列物质在水溶液中的电离方程式: ⑪ NH4NO3 ⑬ KHCO3 ⑮ AgNO3 ⑰ FeCl2 ⑲ NH4HCO3 ⑫ Na2SO4 ⑭ Al2(SO4)3 ⑯ CuSO4 ⑱ Ca(NO3)2 ⑳ KHSO4 ) ⑦KOH ②液态的 HCl ③NH3 ⑨O2 ④酒精 ⑩BaSO4 固体 ⑤盐酸 ⑥H2SO4 H2CO3
年级 学习目标
高一
课题离子Biblioteka 应(1)设计者崔延如
审核人
吕晓翠
1. 理解电解质、非电解质、强电解质、弱电解质的概念; 2. 学习酸、碱、盐在水溶液中电离方程式的书写; 3. 从电离角度进一步认识酸、碱、盐。 1. 电解质、非电解质的判断 1. 电解质、非电解质的判断 2. 电离方程式的书写 2. 电离方程式的书写
1. 判断下列说法是否正确,错误的给出原因 ⑪ NaCl 溶液是电解质。 ⑪ 电解质都是化合物,化合物也都是电解质。 ⑪ 酸碱盐都是强电解质。 ⑪ 在水溶液或者熔融状态下可以导电的物质就是电解质。 ⑪ 因为 BaSO4 不溶于水,所以它是弱电解质。
第4节离子反应(1)

下列反应的离子方ቤተ መጻሕፍቲ ባይዱ式正确的是
A.氢氧化钠溶液中通入少量二氧化硫: SO2+OH-=HSO3- B.碳酸氢钠溶液与足量氢氧化钡溶液混合: HCO3-+Ba2++OH-=BaCO3↓+H2O C.盐酸滴入氨水中:H++OH-=H2O D.碳酸钙溶解于稀硝酸中: CO32-+2H+=CO2↑+H2O
⑥ Na+ K+ CO32- OH⑦ K+ H+ MnO4
-
I-
三:判断离子方程书写的正误
1:看是否符合事实
金属铁放入稀硫酸中: 2Fe+6H+=2Fe3++3H2↑
2:看是否能用离子方程式表示
氯化铵固体与熟石灰混合加热: NH4++OHˉ=NH3↑+H2O
3:看各物质的化学式是否正确 4:看元素守恒
【例3】在FeI2溶液中,通入氯气 ⑴少量氯气时 ⑵ 过量氯气时 还原性:I->Fe2+>Br少量时: FeI2 + Cl2 = FeCl2 + I2 2I- + Cl2 = I2 + 2Cl-
过量时:
2FeI2 + 3Cl2 = 2FeCl3 + 2I2 2Fe2+ + 4I- + 3Cl2 = 2Fe3+ + 6Cl- + 2I2
用氢氧化钠溶液吸收过量CO2 : OH-+CO2=HCO3-
例2: (以少定多)
NaHCO3溶液与Ca(OH)2溶液混合? ⑴Ca(OH)2少量时
2NaHCO3 + Ca(OH)2 = CaCO3↓+ Na2CO3 + 2H2O
离子反应(1)

—酸碱盐在水溶液中的电离
深圳“电老虎”一月致五命 汗液含盐夏季易触电
2009年的6月份,仅仅这一个月内,在深圳市的宝 安区,就有5人因为触电而身亡。频繁发生的触电现 象引起了市民的恐慌,专家们也在第一时间分析了其 中的原因:
原因
1.由于高温、暴晒等因素,一些电器、线路容易发生老化, 长期不检修就会出现短路、漏电等现象。 2.天热时,人容易出汗,因而更容易导电 ; 为什么人体出汗后更容易导电
练一练
下列物质中:
①、HCl ④、盐酸 ②、蔗糖 ⑤、铜 ③、NaCl ⑥、NaOH
⑦、乙醇
⑧、CuSO4
⑨、Cl2
属于电解质的是: ③ ⑥ ⑧ ①
② 属于非电解质的是 : ⑦
NaCl加放到水中
水分子与NaCl 晶体作用
NaCl溶解并电离
NaCl的电离动画
氯化钠晶体
2、电解质的电离
定义:电解质在水溶液里或熔融状态下离解
1、电解质和非电解质
在水溶液中或熔融状态下 电 解 质: 能够导电的化合物。 非电解质: 在水溶液中和熔融状态下都 不能导电的化合物。
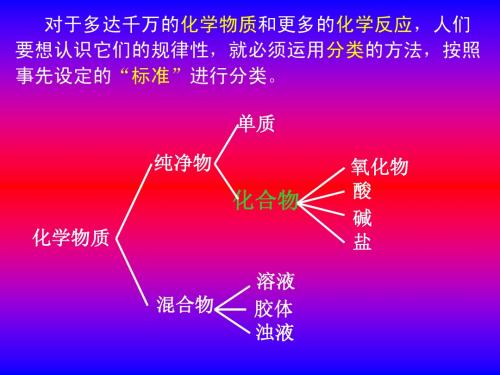
再议物质分类:
电解质 混和物
酸 碱 盐 水 活泼金属氧化物 非电解质 乙醇、蔗糖等 大部分有机物、 非金属氧化物 和氨气
物质
纯净物
化合物
单质
不是电解质也不是非电解质
注意 判断
1.电解质和非电解质均是化合物,单质和混合 1、铜、石墨均导电,所以它们是电解质。( ×) 物既不是电解质也不是非电解质; 2、NaCl溶液能导电,所以它是电解质。( × ) 2.电解质导电的条件是水溶液或熔融状态下, 3、电解质在水溶液中和熔融状态下都一定 两者满足其一即可; 能导电 。 (× ) 3.电解质导电必须是电解质本身在水溶液中或 熔融状态下导电,不能是发生化学反应的生 4、SO2在水中能导电,所以SO2是电解质。 成物质导电。 ( ×)
离子反应1·课件

操作
反应现象
产生白色沉淀
有气体产生
产生白色沉淀
产生白色沉淀
溶液呈褐色
(注:Ba(ClO)2是白色沉淀,ClO-能使I-氧化。) 试判断a、b、c、d、e、f分别是:a ,b c ,d ,e ,f
, 。(填化学式)
答案 Na2CO3 BaCl2
Na2SO4 NaClO HCl KI
2.由于发生氧化还原反应, 由于发生氧化还原反应, 离子不能大量共存。 离子不能大量共存。
(1)具有较强还原性的离子不能与 ) 具有较强氧化性的离子大量共存。如S2-、 具有较强氧化性的离子大量共存。 HS-、SO32-、I-和Fe3+不能大量共存。 不能大量共存。
(2)在酸性或碱性的介质中由于发 ) 生氧化还原反应而不能大量共存。 生氧化还原反应而不能大量共存。 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、 HS-、SO32-、HSO3-、I-、Fe2+等不能大量 共存; 在碱性条件下可以共存, 共存;SO32-和S2-在碱性条件下可以共存, 但在酸性条件下则由于发生2S 但在酸性条件下则由于发生 2-+SO32+6H+=3S↓+3H2O反应不能共在。H+与 反应不能共在。 ↓ 反应不能共在 S2O32-不能大量共存。 不能大量共存。
(3)有弱电解质生成。如OH-、 )有弱电解质生成。 CH3COO-、PO43-、HPO42-、H2PO4-、F-、 ClO-、AlO2-、SiO32-、CN-、C17H35COO-、 等与H 不能大量共存; 等与 +不能大量共存;一些酸式弱酸根 如HCO3-、HPO42-、HS-、H2PO4-、 HSO3-不能与 不能与OH-大量共存;NH4+与OH大量共存; 不能大量共存。 不能大量共存。 要求:知道常见的强酸、 要求 知道常见的强酸、强碱 知道常见的强酸
医学课件离子反应1

2.电离方程式等号两边电荷总量有什么关系?
复习与思考:根据以上的电离方程式,从电离的角度 怎样定义酸、碱和盐?
小结:电离时生成的阳离子全部是H+ 的化合物叫做酸; 电离时生成的阴离子全部是OH- 的化合物叫做碱; 电离时生成的阳离子是金属阳离子(或NH4+), 阴离子是酸根离子的化合物叫做盐。
课前思考与讨论
1. 金属能否导电?为什么? 2. NaCl固体能否导电?为什么? 3. NaCl溶液能否导电?为什么?
为什么氯化钠在干燥时不导电,而溶于水后 却能导电了呢?
氯化钠在水溶液中电离产 生了Na+和 Cl-,在氯化钠 溶液中接通直流电源后, Na+向阴极移动, Cl-向阳极 移动,带电粒子的定向移 动就形成了电流,因此氯 化钠的水溶液能够导电。
思考:常见物质中哪些属于电解质?
小结(重点!):
① 酸、碱、盐都是电解质,大部分金属氧化物是电解质; ② 单质、混合物不是化合物,故既不是电解质,也不是 非电解质; ③ CO2、氨气、SO3不是电解质,其水溶液虽然能导电, 是由于其与水反应生成的物质导电。 ④ 一般有机物如:蔗糖、乙醇等都是非电解质。
离子浓度越大,溶液导电 能力越强。
一、电离
1.定义:物质离解成自由移动的离子的过程 2.条件:溶于水或熔融
3.结果:产生自由移动的离子
4.电离方程式:表示物质电离过程的化学方程式
练习:写出下列物质的电离方程式: (1) HCl、 H2SO4、HNO3 (2)NaOH 、 KOH、Ba(OH)2 (3)NaCl 、 Na2SO4、Al2(SO4)3
例:下列叙述正确的是 (C ) A.NaCl溶液在电流作用下电离成Na+与Cl_ B.溶于水后能电离出H+的化合物都是酸 C.氯化氢溶于水能导电,但液态氯化氢不能导电 D、导电性强的溶液里自由移动离子数目一定多
离子反应(1)

这些自由的离子是如何产生的呢?为什么氯化 钠固体不导电,而氯化钠溶液和熔融NaCl可以?
NaCl在水中溶解和电离的过程图
二、电离
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程 条件:溶于水或熔融
二、电离
定义: 物质溶解于水,离解成自由移动的离子的过程 条件:溶于水或熔融
练习1:找出下列物质中的电解质
NaCl 晶体 熔融 NaCl NaCl 溶液 酒精 KNO3 CH3 COOH 浓硫酸 HCl NaOH NH4 Cl CH4 CaCO3 蔗糖 NH3 · H2 O Cl2 Cu SO3 NH3 CO2
混和物
物质 纯净物 单质 化合物 非电解质 乙醇、蔗糖等大部分有机物
电解质
四、再议物质分类:
混和物
物质 纯净物 单质 化合物 非电解质 乙醇、蔗糖等大部分有机物
电解质
四、再议物质分类:
混和物
物质 纯净物 单质 不是电解质 化合物 非电解质 乙醇、蔗糖等大部分有机物
电解质
四、再议物质分类:
混和物
HCl = H
+
+
Cl
-
HNO 3
=
H
+
+
NO 3 -
三、酸、碱、盐
盐酸、硝酸和硫酸都能够导电,说明: 在水溶液中电离生成了能够自由移动的离子
HCl = H
+
+
Cl
-
HNO 3
H2 SO 4
=
=
H
+
+
+
+
NO 3 SO 4
离子反应1

HCl气体、Ca(OH)2固体、KNO3固体、CO2、Hg、NH3、KOH溶液、金刚石、石墨、蔗糖、酒精、硫、铝。
生:(由讨论并回答)
师:CO2、NH3、蔗糖与酒精都不是电解质,我们为研究方便,将CO2、NH3、蔗糖与酒精等这些在水溶液或熔融状态下都不导电的化合物叫做非电解质。
HCl、H2SO4、HNO3的电离也可以用HCl=H++Cl-、
H2SO4=2 H++ SO42-HNO3= H++NO3—
由此,我们可以看出从电离的角度对酸的扳指有了一个新的认识。
[板书]酸:电离时生据老师刚才讲的酸的定义的方法,概括出碱和盐的本质。
[板书]碱:电离时生成的阴离子全部是氢氧根离子(OH—)的化合物。
盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。
注意:盐电离出的阳离子可以有氢离子如:NaHSO4
这节课我们学习了电解质与非电解质的概念,导电的条件和原因,其中电解质与非电解质的概念是本节课的重点。
课题:离子反应(一)decai高中
教
学
目
标
知识目标:1、知道酸、碱、盐在溶液中能发生电离及其本质。
2、了解电解质和非电解质概念
3、学会电离方程式的书写,能对电解质导电性进行微观分析,进而认识其导电原因。
能力目标培养学生通过实验现象分析、探究化学反应实质的能力。
德育目标:1、通过实验激发学生学习化学的兴趣和情感。
2、培养学生严谨求实、勇于探索的科学态度。
3、对学生进行透过现象看本质的辨证唯物主义教育。
重点
难点
重点是对电解质概念以及酸、碱、盐等概念的理解与掌握。
难点是通过微观分析认识离子导电的原因。
离子反应(1)

(2)能电离出H+的是________,属于酸的是________。
(3)属于碱的是________________,其中属于难溶性碱的是________。
(4)属于难溶性盐的是________。
2、写出下列各物质在水中的电离方程式:
(1)CH3COONH4(2)H2CO3
(3)K2S(4)AgNO3
(4)SO2、SO3、CO2、NH3的水溶液能导电,但导电原因是与水作用后的生成物(H2SO3、H2SO4、H2CO3、NH3·H2O)电离所致,并非自身电离出自由离子,所以SO2、SO3、CO2、NH3等为非电解质,而H2SO3、H2SO4、H2CO3、NH3·H2O则是电解质。
练习:①Cu,②NaCl晶体,③NaHSO4晶体,④SO3,⑤H2SO4溶液,⑥酒精,⑦NaOH晶体,⑧石墨,⑨CH3COOH属于电解质的是(填序号,下同);属于非电解质的是;能导电,但不属于电解质的是。
(3)盐的电离,如CuSO4:__________________________________________________。
3、从电离的角度认识酸、碱、盐
4.电解质溶液的导电性
因为电解质溶液中含有________________,所以电解质溶液导电。
课堂展示
展示小组合作探究各阶段的成果
归纳总结
年级
高一
课题
第二节离子反应(1)设计者乔红日审人张晓宁学习目标
1、了解电解质、非电解质的概念,能判断常见的电解质和非电解质。
2、从电离角度进一步认识酸、碱、盐,学会酸、碱、盐在水溶液中电离方程式的书写。
学习重点
电解质、非电解质的概念
学习难点
离子反应-第1课时

A.H2CO3 Ba(OH)2 H2S H3PO4
B.FeCl3 HCl C2H5OH(乙醇) NH4Cl
C.CH3COOH H2S NH3 •H2O H2O
D.Na2SO4 H2SO4 HNO3 KNO3 2.某化合物易溶于水,但其水溶液不导电,则该 化合物是( C )。 A.弱电解质 C.非电解质 B.强电解质 D.不能确定其类型
离子方程式书写有前提条件
• 实验室制氨气 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O 能不 能写离子方程式
只有在水溶液或熔融状态下进行 的离子反应
易溶、易电离的物质——离子
• HNO3 NaOH • CuSO4 强酸: Ba(OH)2 Ca(OH)2 硫、硝、盐 钾、钙、钠、钡
弱电解质:水溶液里部分分子电离成离子的电解质。
弱酸 弱碱 水
3大强酸,中强酸以外
4大强碱以外
水
找出强电解质弱电解质? HNO3 NaOH NaCl BaSO4 H2CO3 CH3COOH H2O
强电解质: HNO3 弱电解质:H2CO3 电离程度
NaOH NaCl CH3COOH H2O
BaSO4
• 氧化物
CaO Na2O
多元弱酸的酸式酸根离子——不拆
HCO3- HSO3- ——不拆开写
写NaHCO3 与HCl的离子方程式
HCO3-+H+=H2O+CO2↑
微溶物
澄清石灰水与盐酸 浑浊石灰水与盐酸
2OH-+2H+=2H2O
OH-+H+=H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.(高考题组合)下列说法正确的是( )。 A.NaHCO3的电离方程式为 NaHCO3==Na++H++CO32-(2014· 福建,10A) B.HClO是弱酸,但NaClO是强电解质 (2012· 山东,8A改编) C.KClO3和SO3溶于水后能导电,故KClO3和SO3为 电解质(2013· 重庆,2A) D.BaSO4的水溶液不易导电,故BaSO4是弱电解质 (2013· 天津,1D)
2.能发生双水解反应(须有沉淀生成的双水解反应) Al3+ Fe3+ CO32-、HCO3-、、AlO2-
牢记
CO32-、HCO3-、S2-、HS-、AlO2-
再思考: 1.NH4+与CO32- ; 2.NH4+与CH3COO- ;3. NH4+与SiO323.Al3+与ClO- ; 4.Al3+与SiO32- 能否大量共存?依据? 思考: 所有的弱酸根阴离子与弱碱阳离子混合都会因发生双解 反应而不能大量共存吗?完全双水解的条件是?
二、强弱电解质(水溶液电离情况) 三、电离方程式的书写 补充:写出Al2O3在熔融状态下的电离方程式 写出电解熔融的Al2O3方程式 对比:用方程式表示 1.Ba2+与SO42-反应: 2.BaSO4在水溶液中的电离: 3. BaSO4的溶解平衡:
很稀的盐酸和比较浓的醋酸溶液,哪一个的导电性 较强? 电解质溶液导电能力取决于什么因素?
离子反应-------离子共存 考纲说明:了解离子反应的概念、离子反应的条件 课本链接:必修1 P30<<离子反应>>
离子反应 一、定义:在水溶液中有离子参加或生成的反应 二、本质: 溶液中某些离子浓度减小 三、类型: 1.复分解反应:
(1)生成难(微)溶性物质
(2)生成易挥发性物质 (3)生成难电离物质(弱酸、弱碱、水等)
练习:写出下列反应的离子方程式
1.硫酸镁溶液与氢氧化钡溶液反应:
2.硫酸溶液与氢氧化钡溶液反应: 3.硫酸与硝酸银溶液反应: 4.醋酸钠溶液中滴加浓盐酸: 5.向苯酚钠溶液中通入少量的二氧化碳:
6.氯化铵溶液中加入氢氧化钠稀溶液:
7.向醋酸溶液中加入氢氧化钠溶液
8.写出AlCl3与NaHCO3溶液混合后反应的离子方程式
与电解质的强弱有关吗? ①电解质溶液导电能力的强弱只取决于在相同条件下
(温度、外电压等)溶液中自由移动离子的浓度大小 和离子所带电荷的多少 ②与电解质的强弱没有直接关系 ③弱电解质溶液的导电能力不一定弱(例较浓的醋酸 溶液),强电解质溶液的导电能力不一定强(如很稀 的盐酸)
四、电解质溶液的导电 (1) 电解质溶液导电的原因:电解质在溶剂水的作用 阳离子 。 定向移动
书写离子方程式步骤
离子方程式的书写及正误判断
1.书写的关键。
书写离子方程式的关键是要抓住两易、两等、两查: 强碱、大多数可溶性盐 ) 以实际参加反应的离子符号表示,非电
两易:即易溶、易电离的物质 ( 可溶性的强电解质包括强酸、
解质、弱电解质、难溶物、气体、氧化物、单质等用化学式表示。
两等:离子方程式两边的原子个数、电荷种类和总数均应相
(1)生成难(微)溶性物质
H+(酸) SiO32K+、Na+、Ba2+除外
牢记
OH-(碱)
SO42CO32盐 SO32SiO32Cl-
Ba2+、 Ca2+、 Ag+
K+、N Hg+
(2)生成易挥发性物质
H+ OH-
牢记
CO32-、HCO3-、SO32-、HSO3-、S2-、HSNH4+
大量共存=不反应 1.复分解反应(阴、阳两两组合,难溶或难电离) 2.氧化还原 3、络合 4、完全双水解 高频不共存组合 (H+)NO3-、 ClO-与Fe2+、SO32-、I-、S2- Fe3+与I-、S2-、SCN- H+与CH3COO-、SiO32-、ClO-、F-、CO32- NH4+与OH- HCO3-与H+、OH- CO32-与(除Na+,K+,NH4+外)所有阳离子 Al3+与AlO2注:Fe3+与Fe2+共存、 (H+)NO3-与Cl-共存 NH4+与CO32-共存 AlO2-与OH-共存
③ 碱盐 由碱转化成盐的三个途径: a.(11)碱 + 酸性氧化物盐 + 水
1.少量CO2
NaOH/KOH溶液 ①2OH- + CO2 = CO32- + H2O Ca(OH)2 / Ba(OH)2 溶液 ②Ca2+ +2OH- + CO2(少) = CaCO3 ↓+ H2O Ba2+ BaCO3 2.过量CO2 OH- + CO2= HCO3- Ca(OH)2 / Ba(OH)2 NaOH/KOH溶液 3.石灰乳? ③Ca(OH)2 + CO2(少) = CaCO3 + H2O ③Ca(OH)2 + CO2(过) = Ca2+ + 2HCO3-
①.互相促进水解程度大小(越弱越水解) ②.水解产物是溶解度非常小物质(↑↓容易脱离反应体系)
课堂练习: 1.向FeCl3溶液中加入KSCN溶液 现象: 溶液由黄色变成血红色 离子方程式: 2.向AgNO3溶液中滴加稀氨水 现象: 先有沉淀产生,后沉淀逐渐溶解 离子方程式(分步): 总结:离子反应的主要类型 1.复分解反应 2.完全双水解反应 3.络合反应 共同特点:
等。
两查:检查各项是否都有公约数,是否漏写必要的反应条件。
2.注意的问题。 (1) 强酸、强碱和易溶于水的盐改写成离子形式,难溶物
质、难电离物质、易挥发物质、单质、氧化物、非电解质等均
写化学式。 (2) 微溶物作为反应物,若是澄清溶液写离子符号,若是
悬浊液写化学式。作为生成物,一般写化学式(标↓号)。
⑤盐酸能导电,是电解质。
要注意区分电解质和电 解质溶液
判断化合物是电 解质还是非电解 质,与其溶解性 无关。
1.下列说法正确的是
(
)
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质 ②可溶于水的盐都是强电解质 (CH3COO)2Pb、HgCl2
强弱只与是否完全电离有关,与水溶性无关 弱酸不完全电离,小于0.5 mol· L-1
离子反应
整理1.
在见的有机物中,哪些物质是电解质?哪些物质是 非电解质?哪些既不是电解质也不是非电解质?
整理2 在无机物中,那一类物质是电解质?那一类物质是 非电解质?那一类物质既不是电解质也不是非电解质?
课前检测:下列物质
一、电解质非电解质
NaOH、盐酸、硫酸、铜、BaSO4、Na2O、NH3、乙醇 Cl2、SO2、Al2O3、AlCl3、NaCl、NH4Cl、NaHSO4 1.是电解质的是: 。 物质类别: 酸、碱、盐、活泼金属氧化物、H2O 。 2.是非电解质的是: 。 物质类别: 大多数有机物、非金属氧化物、NH3。 3.水溶液能导电,熔融状态下不导电的是: 。 物质类别: 酸、AlCl3(共价化合物)、受热易分解的盐 。 4.只能在熔融状态下导电的是: 。 活泼金属氧化物,难溶于水的盐(离子化合物) 物质类别: 。 5.水溶液能导电,熔融状态也导电的是: 。 物质类别: 强碱、受热不易分解的盐 。
(3)生成难电离物质(弱酸、弱碱、水等) H+ OHOHRCOO-、F-、ClO-、AlO2- 、 C6H5ONH4+ H+ 、 HCO3- HSO3- HS-(弱酸酸式根) 弱酸 弱碱 水
课堂检测. 判断下列离子组在水溶液中能否大量共存 1(14广东).Na+、Ca2+、Cl-、SO422 (14广东).Fe2+、H+ 、SO32-、ClO3 (14广东) .Mg2+、NH4+、Cl- 、SO424(14江苏).pH=1的溶液中:Na+、K+、MnO4-、CO32- 5(13广东). K+、Ca2+、Cl-、NO36(13广东). K+、NH4+、OH-、SO427(12广东). K+、Cu2+、OH-、NO38(12广东). Na+、NH4+、Br-、SO429(12广东). Mg2+、H+、SiO32-、SO4210(11广东). Ag+、Fe3+、Cl―、SO42― 11(11广东).K+、SO42-、Cu2+、NO3― 12(11广东). NH4+、OH-、Cl-、HCO3-
判断正误: A.冰醋酸和盐酸是电解质 B.氯化银、碳酸和水分别属于强电解质、弱电解质 和非电解质 C.长江三角洲形成和肾功能衰竭进行的血液透析都均 与胶体知识有关 D.纯碱、明矾和生石灰分别属于碱、混合物和氧化物 E.醋酸、葡萄糖和乙醇分别属于强电解质、弱电解质 和非电解质 F. 醋酸钠、碳酸氢钠和蔗糖分别属于强电解质、弱 电解质和非电解质 G.碱石灰、漂白粉和过氧化钠分别属于碱、混合物 和氧化物
③0.5 mol· L-1所有一元酸溶液中氢离子浓度都是0.5 mol· L-1 ④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
酸的浓度未定
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
熔融的离子化合物都能导电
2.医院里用HgCl2的稀溶液作手术刀的消毒剂。 HgCl2熔融时不导电,熔点低。HgS难溶于水和 稀的强碱,却易溶于饱和的NaCl溶液。关于HgCl2 的描述合理的是 ( ) 共价化合物 A.是难溶的共价化合物 B.是离子化合物 C.是一种强电解质 D.是一种弱电解质 判断电解质强弱的关键是:电离程度
下,电离出 自由移动的离子 ,在外加电源的作用下,阴、
