3.2.1萃取精馏
第三章 多组分精馏和特殊精馏(化工分离过程)

3.1.3 最少理论板数(Nm)和组分分配
全回流对应最少理论板数,但全回流下无产品采出, 因此正常生产中不会采用全回流。 什么时候采用全回流呢?
1、开车时,先全回流,待操作稳定后出料。 2、在实验室设备中,研究传质影响因素。 3、工程设计中,必须知道最少板数。
最少理论板数的计算
Fenske(芬斯克)方程推导前提: 1、塔顶采用全凝器,(若采用分凝器,则分凝器为第1块塔板) 2、所有板都是理论板。
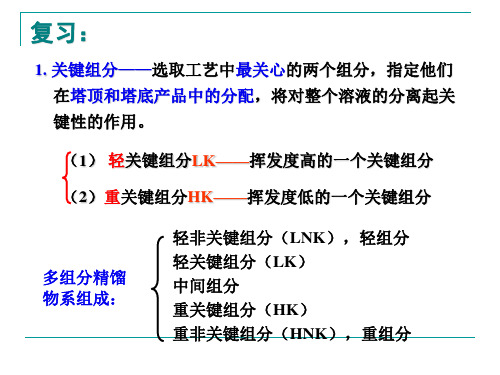
一、关键组分(Key Components)
Na=串级数(2)+分配器(1)+侧线采出
F
(0)+传热单元(2) = 5
已被指定的可调变量: (1)进料位置;(2)回流比; (3)全凝器饱和液体回流或冷凝 器的传热面积或馏出液温度。
余下的2个可调设 计变量往往用来指 定组分在馏出液和 釜液中的浓度。
两组分精馏 指定馏出液中一个组分的浓度,就确定了馏 出液的全部组成;指定釜液中一个组分的浓 度,也就确定了釜液的全部组成。
下面通过实例分别对二组分精馏和多组分精馏过 程分析进行比较。
二组分精馏实例:苯-甲苯
图3-1 二组分精馏流率、温度、浓度分布
三组分精馏实例:苯(LK)-甲苯(HK)-异丙苯
图3-2 三组分精馏流量分布 图3-3 三组分精馏温度分布
四组分精馏实例:苯-甲苯(LK)-二甲苯(HK)-异丙苯
图3-6 四组分精馏液相组成分布
⎜⎜⎝⎛
yA yB
⎟⎟⎠⎞ 2
= ⎜⎜⎝⎛
xA xB
⎟⎟⎠⎞1
代入(3-2)式:
⎜⎜⎝⎛
yA yB
⎟⎟⎠⎞1
= α1 ⎜⎜⎝⎛
xA xB
⎟⎟⎠⎞1
=
⎜⎜⎝⎛
萃取精馏综述

萃取精馏综述公司内部档案编码:[OPPTR-OPPT28-OPPTL98-OPPNN08]摘要萃取精馏是一种特殊精馏方法,适用于近沸点物系和共沸物的分离。
萃取精馏按操作方式可分为连续萃取精馏和间歇萃取精馏,间歇萃取精馏是近年发展起来的新的萃取精馏方法。
萃取剂的选择是萃取精馏的关键,因此,萃取剂的选择方法很重要。
关键词:萃取精馏;间歇萃取精馏;萃取剂选择AbstractExtractive distillation is a kind of special rectification method, applicable to almost boiling point system and the separation of azeotrope. Extractive distillation according to the operation mode can be divided into continuous batch extractive distillation, extractive distillation and batch extractive distillation is a new extraction distillation method developed in recent years. The selection of extraction agent is the key of extractive distillation, therefore, the selection of extraction agent method is very important.Key words: extractive distillation; The batch extractive distillation; Extracting agent selection萃取精馏作为一种分离络合物、近沸点混合物及其他低相对挥发度混合物技术,在石油化学工业中的1 ,3- 丁二烯的分离、芳烃抽提、乙醇/ 水分离、环己烷提纯等过程得到广泛的应用。
简述萃取精馏的特点(一)

简述萃取精馏的特点(一)简述萃取精馏1.萃取精馏的定义–萃取精馏是一种分离和提纯混合物的方法,通过差异性溶解度来分离物质。
–它包括两个关键步骤:萃取和精馏。
2.萃取–萃取是将混合物中的溶质通过溶剂转移到另一个液相中的过程。
–溶剂选择很重要,它应具有合适的极性和溶解能力。
–萃取可以用于分离有机物、金属离子等。
3.精馏–精馏是将混合物中的组分通过加热和冷却转化为气相和液相的过程。
–根据组分的沸点差异,将较易挥发的成分从混合物中分离出来。
–精馏可用于提炼石油、制取纯酒精等。
4.萃取精馏的特点–高效性:萃取精馏可获得高纯度的目标物质。
–可逆性:溶质在溶剂中可逆地转移,便于再次提取或分离。
–选择性:通过调整萃取剂和操作条件,可以选择性地提取特定物质。
–可扩展性:根据需要可进行多级萃取和精馏,进一步提高纯度。
5.Markdown格式的使用–Markdown是一种轻量级标记语言,用于简单而直观地排版文本。
–标题与副标题:使用井号(#)来表示标题的级别,多级标题用多个井号。
–列点方式:使用连字符(-)或星号(*)加空格来表示列点。
–强调和格式化:使用星号或下划线包围文本加粗或斜体显示。
以上为萃取精馏的简述及其特点,根据要求,采用Markdown格式的标题副标题形式进行排版。
6.规则的遵守–禁止使用任何HTML字符,包括尖括号、标签等。
–不可出现网址、图片及电话号码等内容,以确保文章纯文本格式。
–文章要以标题副标题的形式进行排版,提供清晰的信息结构。
7.总结–萃取精馏是一种常用的分离和提纯方法,通过溶解度差异实现物质分离。
–它包括萃取和精馏两个步骤,能够高效、可逆、选择性地分离混合物。
–使用Markdown格式的标题副标题形式来编写文章,清晰而简洁,适合展示相关信息。
以上是我根据要求列举的关于萃取精馏的特点以及使用Markdown 格式的注意事项。
希望对您有所帮助!。
萃取蒸馏

——3.3.1萃取精馏
普通精馏小结
普通精馏操作是分离液体混合物的最常用和有效的方法。 应用范围: (1)待分离的两组分的挥发性相差较大,根据经验相对 挥发度最少应大于1.05。(如例5-1) (2)待分离的混合物不存在恒沸点。 (3)组分间无化学反应,组分不发生分解。 (4)混合物各组分在一般(中低压,温度不很高)条件 下能够汽化和液化。
25
溶剂的选择方法
试验法:
汽液平衡数据的测定和气相色谱法快速测定关键组分在溶 剂中的无限稀释活度系数和选择性等。
常用无限稀 释活度系数
计算机辅助分子设计方法(CAMD) :
①根据设计任务,设定分子筛选评价指标,即指定设计分 子的关键物理性质; ②预选一定结构的基团,按某种规律组合成溶剂分子; ③用UNIFAC法估算溶剂分子的关键物理性质,并进行初步 筛选; ④修正初选合格溶剂的关键物理性质的数值,结合工艺过 程的特点确定较优溶剂。
5
特殊精馏的分类
(2)共沸精馏(Azeotropic Distillation)*
加入的质量分离剂与被分离系统中的一个或几个组分形成 最低沸点(或最高沸点)共沸物,从塔顶(或塔釜)分离。 加入的质量分离剂称为共沸剂(entrainer)。
6
(3)加盐精馏(Salt Distillation):
利用盐效应使原组分的溶解度变化,从而引起气液 平衡变化的精馏过程。 可能应用得很少,从中国知网
塔底---丙酮同系物
两种方案比较知,选择甲醇同系物有利。 因为如用丙酮的同系物作萃取剂时,该萃取剂要克服 原溶液中沸点差异,使低沸点物质与萃取剂一起由塔 釜排出。
24
溶剂的选择---(2)氢键因素
考虑组分间能否生成氢键。
萃取精馏 (2)

萃取精馏简介萃取精馏是一种常用的分离和纯化技术,主要用于提取和分离混合物中的化学物质。
该技术结合了萃取和精馏两种方法,通过不同挥发性的化学物质在不同温度下的蒸发和液相之间的分配系数差异,实现分离和纯化的目的。
本文将介绍萃取精馏的原理、操作步骤和应用领域。
原理萃取精馏主要依靠不同化学物质在不同温度下的蒸发性质和溶解性差异来实现分离。
在一个封闭的系统中,将混合物加热并加入适当的萃取剂。
随着温度升高,不同挥发性的成分会发生蒸发。
这些蒸发的分子被萃取剂吸附并形成气液平衡,然后从系统中离开。
萃取剂可以选择具有高选择性的化学物质,以实现对目标化合物的高效提取。
通过调整温度和压力等操作条件,可以控制不同组分的蒸发和液相分配,使得目标化合物可以从混合物中得到纯化。
操作步骤萃取精馏通常包括以下几个步骤:1.准备混合物:将需要分离和纯化的混合物准备好,并确定目标化合物。
2.选择适当的萃取剂:根据混合物特性和目标化合物的性质,选择适当的萃取剂。
萃取剂应具有高选择性和溶解度,以确保对目标化合物的高效提取。
3.加热和混合:将混合物和萃取剂加入一个封闭的系统中。
适当控制温度和搅拌速度,使混合物充分混合。
4.蒸发和萃取:随着温度升高,不同挥发性的成分会发生蒸发,并被萃取剂吸附。
蒸发的分子和萃取剂形成气液平衡,并从系统中离开。
这样,目标化合物就被从混合物中提取出来。
5.分离和收集:通过冷却和凝固,将萃取剂中的目标化合物得到纯化。
分离和收集可以通过降温、过滤或其他适当的方法实现。
应用领域萃取精馏在化学、制药、食品、石油和环保等领域都有广泛的应用。
在化学合成中,萃取精馏可用于纯化有机合成产物。
通过合适的选择萃取剂和操作条件,可以实现有机产物的分离和纯化,提高化学合成的产率和效率。
在制药工业中,萃取精馏常用于从天然草药中提取活性成分。
通过萃取精馏的方法,可以实现天然营养素、药物成分和有益化合物的纯化和分离。
在食品加工中,萃取精馏可用于提取和分离食品中的香料、色素和营养成分。
简述萃取精馏的特点

简述萃取精馏的特点萃取精馏是一种利用溶剂将物质从混合物中分离的方法。
它的特点如下:1.原理简单:萃取精馏的基本原理是利用不同物质在不同溶剂中溶解度不同的特点进行分离。
通过选择适当的溶剂,可以将目标物质从混合物中有效地提取出来。
2.分离效果好:萃取精馏可以实现高效而精确的物质分离。
由于目标物质与溶剂的溶解度差异,可以实现高纯度的分离。
此外,可以通过控制温度和压力等操作参数,进一步提高分离效果。
3.适用范围广:萃取精馏适用于分离液体混合物中的有机物、无机物、固体混合物等。
例如,可以用来提取天然药物中的有效成分、分离石油中的有用成分等。
4.操作简便:相比其他分离方法,萃取精馏的操作相对简单易行。
只需要加入适量的溶剂,加热至沸点,然后通过分离器将目标物质和溶剂分离,最后蒸发溶剂即可得到纯净的目标物质。
因此,萃取精馏是一种常用且被广泛采用的分离方法。
5.高效节能:萃取精馏在分离过程中可以实现高效的热能利用,从而减少能源消耗。
通过控制加热方式和分馏塔的设计等参数,可以最大限度地利用热能,提高生产效率,降低能源成本。
6.可控性强:萃取精馏的过程可以通过控制操作参数来实现目标物质的选择性分离。
通过调节温度、压力、溶剂比例等参数,可以调控目标物质和杂质在溶剂中的相对溶解度,从而实现对特定物质的高效分离。
7.可连续操作:萃取精馏可以实现连续操作,提高生产效率和产品质量的稳定性。
通过设计合理的流程和设备,可以实现连续供料、连续萃取、连续分馏,从而实现大规模生产。
总之,萃取精馏是一种高效、可控性强、适用范围广的物质分离方法。
它可以实现目标物质的高纯度分离,是化学、制药、石油等领域中常用的分离技术之一、在未来的发展中,萃取精馏技术将进一步提高分离效果、降低能源消耗,并且有望广泛应用于更多领域。
3.2.1萃取精馏
ln( 1 / 2 ) s A21 ( x2 x1 ) x2 ( x2 2 x1 )( A12 A21 )
xs A1s As 2 2 x1 ( As1 A1s ) xs ( A2 s As 2 ) c( x2 x1 )
其中A12、A21为组分1,2组成二元系统的端值常数,也 称Margules常数(或配偶参数)。C为表征三组分系统性质 的常数。
溶剂的作用:改变组分间的相互作用;稀释作用。
二、萃取精馏原理及溶剂的选择 2.溶剂的选择
3.2.1 萃取精馏
溶剂的选择要综合考虑各种参数:
①选择性 12,s / 12 ②溶剂易于再生,S与原溶液中的组分要有一定的沸点差;
③不形成共沸物;不发生化学反应。
④价格、来源、粘度、毒性、腐蚀性。 ⑤与原溶液中组分的溶解度。
如:苯酚、苯胺等环结构化合物与苯和甲苯一类芳烃
的分子结构,比起与链烷烃和环烷烃来,更加相似些。
二、萃取馏原理及溶剂的选择 2.溶剂的选择
3.2.1 萃取精馏
12,s
(2) 定量——初步筛选
1)实测气液平衡数据筛选溶剂是非常昂贵的! 2)常用气相色谱法快速测定关键组分在溶剂中的无限稀 释活度系数和选择性
N R ,m
3.2 萃取精馏和共沸精馏
在化工生产中常常会遇到待处理的物料是:
1) 各组分的挥发度十分接近,即组分之间的相对挥发度
接近于1;
2) 形成共沸物(或恒沸物); 应用普通精馏或是无法分离,或是十分不经济。
普通的处理方法是向精馏系统添加第三种组分,通过它
对原料液中各组分的不同作用,改变它们之间的相对挥发 度,使原来难以进行精馏分离的系统变得易于分离。这类
硕士研究生分离工程思考题答案

1.1、什么是绿色分离工程,实现的途径。
答:绿色分离工程是指分离过程绿色化的工程实现 。
途径:对传统分离过程进行改进、优化,使过程对环境的影响最小甚至于没有。
手段:开发及使用新型的分离技术1.2、化工分离技术的特性答:化工分离技术的重要性、化工分离技术的多样性、化工分离技术的复杂性1.3、化工分离技术发展的特点答:1、竞争促进了分离过程的强化:化工塔器的内件:高效塔板、规整填料和散装填料发明层出不穷2、耦合分离技术引起重视:综合了两种分离技术的优点 ,可以解决许多传统的分离技术难以完成的任务3、信息技术推动了分离技术的发展: 4、根据国情,加速分离科学和技术的发展 1.4 、简述分离过程的集成化答:1、反应过程与分离过程的耦合2、分离过程与分离过程的耦合3、过程的集成:(1)传统分离过程的集成(2)传统分离过程与膜分离的集成(3)膜过程的集成1.5、分离过程的种类与特性答:分离过程:借助一定的分离剂,实现混合物中的组分分级(Fractionalization )、浓缩(Concentration )、富集(Enrichment )、纯化(Purification )、精制(Refining )与隔离(Isolation )等的过程。
1、扩散式分离过程—— 涉及物质从进料向一股产品流的扩散传递。
分为平衡分离过程和速率分离过程 。
(1)蒸发、蒸馏和干燥等(根据挥发度或汽化点的不同);(2)结晶(根据凝固点的不同);(3)吸收、萃取和沥取等(根据溶解度的不同) ;(4)沉淀(根据化学反应生成沉淀物的选择性) ;(5)吸附(根据吸附势的差别);(6)离子交换(用离子交换树脂);(7)等电位聚焦(根据等电位pH 值的差别);(8)膜分离(超滤、反渗透、渗析等)、场分离(电泳、热扩散、气体扩散等)(根据扩散速率差) 2、非扩散式分离过程(即机械分离过程) —— 完成产品相的分离 。
(1)过滤、压榨(根据截留性或流动性差异) ;(2)沉降(根据密度或粒度差);(3)磁分离(根据磁性差);(4)静电除尘、静电聚结(根据电特性);(5)超声波分离(根据对波的反应特性)。
萃取精馏

步骤为:
开始 给定P.T.F.Zi 查Ki 设e 求xi(或yi) 输出
否
xi 1
yi 1
?
?
是
求出e.D.B.xi.yi
(2)已知F、Zi、P、e,求T、yi、xi
(或者知F、Zi、 T 、e,求P 、yi、xi)
求T
Ki
T,P ⑥
Zi xi Ki (1 Ki )e
12 S lg 12
' ' ' x2 x1 xS A1S A2 S A12 x x 2 1
▲溶剂浓度xs 的影响
' ' ' x2 x1 A A A 1S 2S 12 0时 x x 2 1
一、二组分溶液的活度系数
◆ 三个方程比较 Null对三方程进行了考核,结果为:
▲与理想溶液偏差不大的系统,三个方程都 能很好的表达实验数据。
▲具有中等正偏差的系统,各方程的适用性 有显著差别,总的来说, Wilson方程较好。 ▲具有很大正偏差的系统, Wilson方程显示 出绝对的优势。Van Laar和van Margules方 程基本上不能使用,但Van Laar比van Margules方程要好一些。
x3 A13 A32 2x1 A31 A13 x3 A23 A32 C x2 x1
1 lg 2
2 lg 3
lg 3 1
1 2 3
◆ 柯干方程 当三个二组分溶液均属于非对称性不太大时, 柯干推出的计算活度系数比值的公式为:
1 ' ' ' x2 x1 x3 A13 lg A12 A23 2
萃取精馏实验实验报告

一、实验目的1. 理解萃取精馏的基本原理和操作过程。
2. 掌握萃取精馏装置的操作方法和实验技巧。
3. 通过实验,了解萃取精馏在分离混合物中的应用。
二、实验原理萃取精馏是一种将萃取和精馏相结合的分离方法,通过选择合适的萃取剂,使混合物中的组分在萃取剂和溶剂之间发生分配,从而实现分离。
其基本原理如下:1. 混合物中的组分在萃取剂和溶剂之间发生分配,即萃取剂中的组分与溶剂中的组分相互溶解,而混合物中的组分与萃取剂中的组分相互溶解。
2. 通过控制温度、压力等条件,使萃取剂中的组分在溶剂中的溶解度降低,从而实现分离。
三、实验器材和药品1. 实验器材:萃取精馏装置、温度计、压力计、冷凝器、蒸馏烧瓶、搅拌器、分液漏斗、锥形瓶等。
2. 实验药品:乙醇、水、乙二醇、混合物等。
四、实验步骤1. 将混合物加入萃取精馏装置的蒸馏烧瓶中,加热使其沸腾。
2. 调节温度,使混合物沸腾,产生蒸汽。
3. 蒸汽进入冷凝器,冷凝成液体。
4. 液体进入分液漏斗,与萃取剂混合,发生萃取。
5. 萃取后的液体分层,上层为萃取剂,下层为混合物。
6. 将上层萃取剂从分液漏斗中取出,进入另一个蒸馏烧瓶中,加热使其沸腾。
7. 重复步骤2-6,直至混合物中的组分得到分离。
五、实验现象1. 混合物加热沸腾后,产生蒸汽。
2. 蒸汽冷凝成液体,进入分液漏斗。
3. 分液漏斗中的液体分层,上层为萃取剂,下层为混合物。
4. 萃取剂加热沸腾后,产生蒸汽。
5. 重复上述过程,直至混合物中的组分得到分离。
六、实验结果通过实验,成功实现了混合物中各组分的分离。
实验结果如下:1. 萃取剂对混合物中组分的选择性较好,能够有效地实现分离。
2. 萃取精馏操作简便,易于掌握。
3. 萃取精馏在分离混合物中具有较高的应用价值。
七、实验结论1. 萃取精馏是一种有效的分离方法,适用于分离混合物中的组分。
2. 通过选择合适的萃取剂和操作条件,可以提高萃取精馏的分离效果。
3. 萃取精馏在化工、医药、食品等领域具有广泛的应用前景。
3.3.1萃取精馏(2)

S
2
A 1 x x A A
12 s s 1S 2S
塔釜
0 x1
ln 12 / s
12 / s
12 / s 顶 12 / s 釜
S P 1 ln PS 2
1 xs xs A1S A2 S A12
(3-40)
S
n-1 n n+1
1 Lm W S Vm
(3-42)
F m-1 m m+1
④汽相流率越往下越大,即越往上越小。
W 7
3.3.1.3 萃取精馏过程分析
(2)塔内溶剂含量分布
假定:1)恒摩尔流;2)(xS)D=0 精馏段物料衡算:V
D
S LD
(3-43a) (3-43b)
14
3.3.1.3 萃取精馏过程分析
萃取精馏的注意事项
(2)由于组分间相对挥发度是借助萃取剂的加入量来调 节的,随萃取剂在液相中的浓度的增加,组分1、2 的相对挥 发度增大。当塔顶产品不合格时,不能采用加大回流的办法 来调节,因这样做会使萃取剂在塔内浓度降低,反而使情况 更加恶化。
一般调节方法有: ①加大萃取剂用量; ②减少进料量,同时减少塔顶产品的采出量。这也就是 在不改变下降液量的前提下加大了回流比。
从而影响分离效果。
13
3.3.1.3 萃取精馏过程分析
萃取精馏的注意事项
萃取精馏与一般精馏虽然都是利用液体的部分汽化、蒸 汽的部分冷凝产生的富集作用,从而将物料加以分离的过程, 但是,由于萃取精馏中加入了大量的萃取剂,因此与一般精 馏相比有如下几点需要注意: (1)由于加入的萃取剂的量大(一般要求 xS>0.6),因 此,塔内下降液量远远大于上升蒸汽量,从而造成汽液接触 不佳,故萃取精馏塔的塔板效率低,大约为普通精馏的一半 左右(回收段不包括在内)。在设计时应注意塔板结构及流 体动力情况,以免效率过低。
萃取精馏和共沸精馏

将上式的浓度改为脱溶剂的相对浓度: (3-29)
以l代表液相中原溶液组分之流率,以v 代 表汽相中原溶液组分之流率,即:
则:
S
当(xS)D=0 时:
F
(3-32)
D
n-1 n n+1
m m-1 m+1
W
比较(3-29)式和(3-32)式: (3-29)
可得:
(3-32)
(3-33 )
因为S为重组分,(yS)n+1<(xS)n ,所以:
1、二元系 (1)二元均相共沸物
系统压力不高时,汽相视为理想气体:
共沸点处:
即:
或
——计算方程
?已知总压P,如何求共沸组成x和共沸温度T
1)假定T; 2)计算P1S和P2S; 3)由1=f(x1,T,P)、2=f(x1,T,P)和1/2 =P1S/P1S计算x1;
4)代入:
——校核方程
5)如上式成立,则结束计算,如不成立,则 假定新的T,继续试差计算。
一、共沸物的特性与其组成的计算 二、共沸剂的选择 三、共沸精馏流程 四、共沸精馏的计算 五、共沸精馏与萃取精馏比较
一、共沸物的特性与其组成的计算
对于共沸物,混合物的蒸汽压-组成曲线上 之极值点相当于汽、液平衡相的组成相等。
多元共沸物汽液相组成相等点并不一定对应 于恒压下T—x 图上的极值点或恒温下P—x 图上的极值点。
① 溶剂存在下塔内的液汽比大于脱溶剂情况 下的液汽比。 对溶剂作物料衡算:
当(xS)D=0 时 :
设Sn=Ln(xS)n,即n板下流液体中溶剂的流率:
可见:Sn>S ②各板下流之溶剂流率均大于加入的溶剂流 率,且溶剂挥发度越大,差值也越大。
精馏

用平衡蒸馏仪直接测定气液相平衡组成是最可靠的实验方法,也是最早使用的方法。将待分离组分以等摩尔配好,加入溶剂,在平衡蒸馏仪中蒸馏,使达到平衡,然后取样分析以同样量的不同溶剂进行试验,可以比较溶剂的选择度(有限浓度)。
2.2.1.5用实验精馏柱测定
萃取精馏溶剂沸点高,不易挥发,故循环使用的富溶剂液体从塔顶部加入。实验装置在全回流下操作。待稳定后采收集板上的样品进行分析,记录循环液流量并分析其组成。利用这些数据作物料衡算可求出有关气相组成。
(4)无萃取剂加入状况下的有限回流比操作,回收萃取剂。
如下图所示:
二.萃取精馏溶剂
1.萃取精馏溶剂的选择原则:
1溶剂有良好的选择性,能使待分离组分活度系数增大,提高其相对挥发度,而且溶剂的用量较少时就有较好的效果。
2对待分离组分是一种良好的溶剂,在精馏操作条件下,不致因相分离而失去相对挥发度增大的优点,或造成操作上的困难。
S
2.2溶剂筛选方法
目前主要的溶剂筛选方法有实验法、数据库查询法、经验值方法、计算机辅助分子设计法(CAMD)等。
2.2.1实验法
用实验法筛选溶剂是目前使用最广泛的方法,可以取得很好的结果,但是实验耗费较大,实验周期较长。实验法有直接法、沸点仪法、色谱法、气提法等。
2.2.1.1直接法
用气液平衡仪直接测定气相、液相平衡组成。从而得到无限稀释活度系数r的值,也称为平衡组分分析法。该法进行溶剂的筛选具有操作简单、形象直观、数据准确、既可定性又可定量等优点。实验室广泛使用。但该法的缺点是气液组成须逐一进行测定,工作量大,工作周期长;当须进行外推得到r时不确定性大,易于造成误差。
连续加料方式萃取精馏是在操作过程中,萃取剂从靠近塔顶位置连续加入。为了减少萃取剂用量及使操作可行,其步骤如下:
共沸精馏、萃取精馏介绍

共沸精馏、萃取精馏介绍一、什么是恒沸精馏(共沸精馏)在被分离的物系中加入共沸剂(或者称共沸组分),该共沸剂必须能和物系中一个或几个组分形成具有最低沸点的恒沸物,以至于使需要分离的集中物质间的沸点差(或相对挥发度)增大。
在精馏时,共沸组分能以恒沸物的形式从精馏塔顶蒸出,工业上把这种操作称为恒沸精馏。
下面以制取无水酒精为例,说明恒沸精馏的过程,水和酒精能形成具有恒沸点的混合物,所以用普通的精馏方法不能获得纯度超过96%(体积)的乙醇,若在酒精和水的溶液中加入共沸组分-苯,则可构成各种恒沸混合物,但以酒精、苯和水所组成的三组分恒沸混合物的沸点为最低(64.84℃)。
当精馏温度在64.85℃时,酒精、苯和水的三元混合物首先被蒸出;温度升至68.25℃时,蒸出的是酒精与苯的二元恒沸混合物;随着温度继续上升,苯与水的二元恒沸混合物和酒精与水的二元恒沸混合物也先后蒸出,这些恒沸物把水从塔顶带出,在塔釜可以获得无水酒精。
工业上广泛地用于生产无水酒精的方法,就是根据此原理。
恒沸精馏的过程中,所加入的共沸组分必须从塔顶蒸出,而后冷凝分离,循环使用。
因而恒沸精馏消耗的能量(包括汽化共沸剂的热量和输送物料的电能)较多。
二、什么是萃取精馏?在被分离的混合物中加入萃取剂,萃取剂的存在能使被分离混合物的组分间的相对挥发度增大。
精馏时,其在各板上基本保持恒定的浓度,而且从精馏塔的塔釜排出,这样的操作称为萃取精馏。
例如,从烃类裂解气的碳四馏分费力丁二烯时,由于碳四馏分的各组分间沸点相近及相对挥发度相近的特点,而且丁二烯与正丁烷还能形成共沸物,采用普通的精馏方法是难以将丁二烯与其它组分加以分离的。
如果采用萃取精馏的方法,在碳四馏分中加入乙腈做萃取剂,则可增大组分间的相对挥发度,使得用精馏的方法能将沸点相近的丁二烯、丁烷和丁烯分离。
碳四馏分经过脱碳三、和碳五馏分后,进入丁二烯萃取剂精馏塔,在萃取剂乙腈的存在下,使丁二烯(包括少量的炔烯)、乙腈与其它组分分开,从塔釜采出并进入解析塔,在此塔中,丁二烯、炔烯从乙腈中解析出来,萃取剂循环使用。
萃取精馏的原理

萃取精馏的原理萃取精馏是一种常见的分离和提纯混合物的方法,它基于不同物质在溶剂中的溶解度不同而实现。
这种方法在化工、制药、食品加工等领域有着广泛的应用。
它的原理简单而有效,下面我们就来详细了解一下萃取精馏的原理。
首先,我们需要了解萃取精馏的基本原理。
萃取精馏是利用两种或两种以上的互不溶解的液体,通过它们在一定条件下的相互作用,使其中一种物质从原液中转移到另一种液体中,从而达到分离和提纯的目的。
这种方法的核心在于利用不同物质在不同溶剂中的溶解度差异,通过合适的操作条件,使目标物质从混合物中被有效地提取出来。
其次,我们来看一下萃取精馏的操作步骤。
首先,将原液与另一种溶剂混合,并充分搅拌使两种液体充分接触。
然后,根据目标物质在两种液体中的溶解度差异,通过合适的温度、压力、搅拌速度等条件,促使目标物质从原液中转移到另一种溶剂中。
最后,通过分离器将两种液体进行分离,从而得到目标物质的提取物和废液。
接下来,我们来探讨一下萃取精馏的应用领域。
萃取精馏广泛应用于化工工业中的物质提取、精制和分离过程,如石油化工中的石油提炼、有机合成中的反应物提取等。
同时,它也被广泛应用于制药工业中的药物提取和纯化、食品加工中的香精提取等领域。
可以说,萃取精馏在现代工业生产中扮演着非常重要的角色。
最后,我们需要注意一些萃取精馏的注意事项。
首先,选择合适的溶剂对于提高萃取效率至关重要,需要考虑目标物质的溶解度、毒性、成本等因素。
其次,控制好操作条件也是非常重要的,包括温度、压力、搅拌速度等,这些条件直接影响着萃取效率和产品质量。
另外,对于有机溶剂的选择和处理也需要严格遵守相关的安全操作规程,确保操作过程安全、环保。
总的来说,萃取精馏作为一种重要的分离和提纯方法,其原理简单而有效,广泛应用于化工、制药、食品加工等领域。
通过合理选择溶剂、控制操作条件和严格遵守操作规程,可以实现高效、安全、环保的萃取精馏过程,为工业生产提供了重要的技术支持。
化工萃取精馏工艺详解

化工萃取精馏工艺详解一、基本原理和流程萃取精馏是在被分离溶液中加入另一组分(称为溶剂或萃取剂),增大被分离组分的相对挥发度,因而能用精馏方法分离。
萃取剂的沸点比原溶液各组分的沸点均高,且不和被分离溶液各组分形成恒沸物。
二、萃取精馏的分类萃取精馏按照其操作方式可以分为两类,即连续萃取精馏和间歇萃取精馏。
1、连续萃取精馏连续萃取精馏过程中,进料、溶剂的加入及回收都是连续的。
连续萃取精馏一般采用双塔操作,第一个塔是萃取精馏塔,被分离的物料由塔的中部连续进入塔内,而溶剂则在靠近塔顶的部位连续加入。
在萃取精馏塔内易挥发组分由塔顶馏出,而难挥发组分和溶剂由塔底馏出并进入溶剂回收塔。
在溶剂回收塔内,可使难挥发组分与溶剂得以分离,难挥发组分由塔顶馏出,而溶剂由塔底馏出并循环回送至萃取精馏塔。
2、间歇萃取精馏间歇萃取精馏是近年来兴起的新的研究方向,由于间歇萃取精馏具有间歇精馏和萃取精馏的优点,近年来引起了一些学者的注意。
间歇萃取精馏比连续萃取精馏复杂的多,其流程及操作方法与连续萃取精馏不同。
例如,在0.1MPa压力下,苯的沸点为80.1℃,环己烷的沸点为80.73℃。
由这两种组分构成的溶液,很难用一般精馏方法分离。
若在该溶液中加入糠醛(沸点为161.7℃),则溶液中两组分的相对挥发度发生显著变化,如下表所示:对苯和环己烷混合液,可以选用糠醛为萃取剂,用萃取精馏法来分离,其流程如图4-7所示。
原料由萃取精馏塔中部加入,糠醛在原料入口以上接近塔顶的某块板加入,这样可以使绝对部分塔板上均能保持较高的溶剂浓度。
苯与糠醛从塔釜中排出并送入溶剂回收塔,在回收塔顶得到苯,塔顶得到回收的糠醛,糠醛回到萃取精馏塔回用。
萃取精馏流程中,萃取精馏塔是主要设备,它可以分为三段功能区域:提馏段,进料板以下的塔板,在此段中提馏回流液中的轻组分。
吸收段,进料与溶剂入口之间的塔板,在此段用溶剂吸收蒸汽中的重组分。
分离溶剂段,溶剂入口以上的若干块塔板,用以降低溶剂在馏出物中的浓度,提高产品纯度,减少溶剂损失。
萃取精馏溶剂要求

萃取精馏溶剂要求萃取精馏溶剂是一种在化学工业中广泛应用的溶剂分离技术。
它通过利用不同物质在溶剂中的分配系数差异,将混合物中的目标组分从其他组分中分离出来。
萃取精馏溶剂的要求如下:1. 溶解性:萃取精馏溶剂应具有较高的溶解性,能够有效地将目标组分溶解在其中。
同时,它应该与其他组分的溶解性差异较大,以实现有效的分离。
2. 稳定性:萃取精馏溶剂应具有良好的化学稳定性,能够在高温、高压等恶劣条件下保持稳定。
这样可以确保在分离过程中不会发生副反应或降解,影响分离效果。
3. 选择性:萃取精馏溶剂应具有较高的选择性,即对目标组分具有较强的亲和力,而对其他组分的亲和力较低。
这样可以实现目标组分与其他组分的有效分离。
4. 温度范围:萃取精馏溶剂应具有适宜的沸点范围,以便在溶剂分离过程中实现高效的蒸馏。
同时,它还应具有适宜的冷凝温度范围,以便在沸馏过程中实现高效的冷凝和回收。
5. 可再生性:萃取精馏溶剂应具有良好的可再生性,能够在分离过程中被回收和重复使用。
这样可以降低成本,并减少对环境的负面影响。
6. 安全性:萃取精馏溶剂应具有良好的安全性,不会对人体健康造成危害。
它应该具有低毒性、低挥发性和低燃点,以降低操作过程中的风险。
7. 环境友好性:萃取精馏溶剂应具有良好的环境友好性,不会对环境造成污染。
它应该具有良好的生物降解性和可再生性,以减少对自然资源的消耗和环境的负荷。
萃取精馏溶剂的选择取决于具体的应用需求和分离系统的特点。
在实际应用中,需要根据目标组分的性质、溶剂与其他组分的亲和力差异、溶剂的可用性和成本等因素进行综合考虑。
常用的萃取精馏溶剂包括石油醚、乙醚、氯仿、苯、四氯化碳等。
萃取精馏溶剂在化学工业中具有重要的应用价值。
通过选择合适的溶剂和优化操作条件,可以实现高效的组分分离和纯化,提高产品质量和产率。
未来,随着科学技术的不断进步,萃取精馏溶剂的研究和开发将进一步推动化学工业的发展。
萃取精馏原理

萃取精馏原理及过程分析
图 1 萃取精馏流程(1塔为萃取精馏塔,2塔为溶剂回收塔)
一、萃取精馏原理
溶剂在萃取精馏中的作用是使原有组分的相对挥发度按所希望的方向改变,并有尽可能大的相对挥发度。
当被分离物系的非理想性较大,且在一定浓度范围难以分离时,加入溶剂后,原有组分的浓度均下降,而减弱了它们之间的相互作用,只要溶剂的浓度足够大,就突出了两组分蒸汽压的差异对相对挥发度的贡献,实现了原物系的分离。
在该情况下,溶剂主要起了稀释作用。
当原有两组分 A和B的沸点相近,非理想性不大时,若相对挥发度接近于1,则用普通精馏也无法分离。
加入溶剂后,溶剂与组分A形成具有较强正偏差的非理想溶液,与组分B 形成负偏差溶液或理想溶液,从而提高了组分A对组分B的相对挥发度,以实现原有两组分的分离。
溶剂的作用在于对不同组分相互作用的强弱有较大差异。
二、萃取精馏过程分析
一般规律:
(1)汽液流率:
* 由于溶剂的沸点高,流率较大,在下流过程中溶剂温升会冷凝一定量的上升蒸汽,导致塔内汽相流率越往上走越小,液相流率越往下流越大。
* 溶剂存在下,塔内的液汽比大于脱溶剂情况下的液汽比;
* 各板下流的溶剂流率均大于加入的溶剂流率;
* 汽相流率、液相流率都是越往上越小。
*
(1)浓度分布。
溶剂在塔内浓度分布分为四段:
* 1)溶剂回收段:
* 2)精馏段:
* 3)提馏段:
* 4)塔釜:
*
举例:丙酮 / 甲醇 / 水萃取精馏塔内液相浓度分布(图 3-18 )。
图 2 丙酮/甲醇萃取精馏塔液相浓度分布
◆丙酮;○甲醇;▲水(溶剂)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cui Qun
NO. 9
2013-5-9
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
用于特殊精馏的物料,大都 α12 ≈1或α12 =1
3.2.1 萃取精馏
萃取精馏基本原理是选择合适的溶剂造成待分离的二 组分之间活度系数变化。关键是设法提高α12 ,s。
显然原料液中组分1和组分2间的非理想性大,容易选 到合适的溶剂。
中溶剂选择是否适当起关键作用。
NO. 5
2013-5-9
Cui Qun
化工分离工程
第 三 章
(2) 萃取过程流程
3.2.1 萃取精馏
溶剂的沸点比被分
塔顶得一个纯组分A (常为轻组分)
塔顶得一个纯组分B
离组分高.
为了使塔内维持较 高的溶剂浓度,溶 剂加入口一定要位 于进料板之上, 溶剂加入口需要与 塔顶保持有若干块
ln 12 ln(Ps / P2s )T2 A12 (1 2x1 ) 1
(Ps / Ps )T3 (Ps / Ps )T2 1 2 1 2
式(3)
ln
12, s 12
xs ( A1s A2 s ) A12 (1 2 x1 )
原溶液的性质和浓度
②稀释作用——反映S加入,组分1,2间的相互 作用变弱,xs 越大,组分1和2间的作用越弱。这 一溶剂作用称为溶剂的稀释作用。 ①相互作用——反映S对 料液中组分1,2的不同 作用的效果,即: 相互 作用。
若要使得
设法使得
12,s 1
A1s 0 A2s 0
S与组分1形成正偏差溶液。 S与组分2形成负偏差溶液;至少能形成理想 溶液,即: A2 s 0
化工分离工程
第 三 章
3.2 萃取精馏和共沸精馏
对上述这些体系,通常采用的分离方法:
1) 各组分在常压时沸点虽十分接近,但各组分的蒸汽压随
温度变化的程度有明显差异时,一般可以通过选择适当
的操作压力实现经济的分离。 2) 恒沸物的组成随压力有比较显著的改变,可以采用操作 压力不同的双塔系统实现分离; 3) 恒沸物是非均相的,也可以采用双塔系统实现分离。
T3-组分1、组分2和溶剂S三组分物系泡点温度; T2-组分1、组分2二组分物系泡点温度。
NO. 15 2013-5-9 Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择 2) 溶剂的作用
3.2.1 萃取精馏
式(2)
ln 12,s ln(Ps / P2s )T3 A12 (1 xs )(1 2x1 ) xs ( A1s A2s ) 1
A12 0
(非理想性不大)
A12 (1 xs ) 这相对 12,s 没有什么影响。
以
1 ( A12 A21 ) A12 , A21 2 1 s ( A1s As1 ) A1s , As1 A1 2 1 s ( A2 s As 2 ) A2 s , As 2 A2 2 A12
2013-5-9 Cui Qun
带入上式(1)得:
NO. 13
塔板起回收溶剂的
作用,这一段称溶 剂回收段。
S+B
S
NO. 6
2013-5-9
Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
1) 溶剂的选择性
ˆ f iV V ˆ 定义: i yi P
3.2.1 萃取精馏
12,s ( 1 / 2 ) s 12 ( 1 / 2 )
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
3.2.1 萃取精馏
Байду номын сангаас
2) 溶剂的作用
x1,x2是由组分1,2,S组成的 三元溶液中的组分1,2浓度。
代入 ln(1 / 2 ) s A21 ( x2 x1 ) x2 ( x2 2 x1 )( A12 A21 )
xs A1s As 2 2 x1 ( As1 A1s ) xs ( A2 s As 2 ) c( x2 x1 )
NO. 2
2013-5-9
Cui Qun
化工分离工程
第 三 章
3.2 萃取精馏和共沸精馏
4)更普通的处理方法是向精馏系统添加第三种组分,通过 它对原料液中各组分的不同作用,改变它们之间的相对
挥发度,使原来难以进行精馏分离的系统变得易于分离。
这种既应用热能,又加入分离媒(介)质的精馏称为特 殊精馏。
NO. 4
2013-5-9
Cui Qun
化工分离工程
第 三 章
3.2.1 萃取精馏
3.2.1 萃取精馏
萃取精馏是通过加入适当选择的溶剂以改善被分离组 分之间的汽液平衡关系,使分离由难变易的精馏。
(1) 萃取过程流程
当用萃取精馏分离两个组分溶液,以得到两个纯组分 时,须应用两个塔。
萃取精馏的使用是否成功,最终由经济核算决定。其
NO. 7
2013-5-9
Cui Qun
化工分离工程
第 三 章
二、萃取精馏原理及溶剂的选择
3.2.1 萃取精馏
1) 溶剂的选择性
1,2
ˆ K1 V 1 f10 L 2 V ˆ K 2 1 2 f 20 L
一般萃取精馏的压力不高,所以可假设气相为理想气体, 则:
ˆV 1 1
溶剂的性质和浓度
NO. 16
2013-5-9
Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择 2) 溶剂的作用
下面分别讨论(2)式右边各项对α12 ,s 的影响:
3.2.1 萃取精馏
(2) ln 12,s ln(Ps / P2s )T3 A12 (1 xs )(1 2x1 ) xs ( A1s A2s ) 1
2) 溶剂的作用
3.2.1 萃取精馏
由Morrgules(马古斯或马格勒斯)方程求得组分(1,2)s 的活度系数比值与溶剂S的选择性 α12 ,s关联,分析溶剂S加入 对α12 ,s的影响。 若用三元Margules方程求液相活度系数,则在溶液S存在 下γ1/γ2为:
ln( 1 / 2 ) s A21 ( x2 x1 ) x2 ( x2 2 x1 )( A12 A21 )
ˆ fiL L ˆ i xi P
ˆ fiL i xi f i oL
ˆ f iV f i L 气液平衡: ˆ
yi i f i oL Ki V ˆ xi i P
ˆi V yi P i xi f i oL
1,2
ˆ K1 V 1 f10 L 2 V ˆ K 2 1 2 f 20 L
ˆ V 1 2
f
0L 1
P
s 1
f 20 L P2s
1 P1s 12 s 2 P2
NO. 8 2013-5-9 Cui Qun
化工分离工程
第 三 章
二、萃取精馏原理及溶剂的选择
3.2.1 萃取精馏
1) 溶剂的选择性
加入溶剂S后,组分1对组分2的相对挥发度为 :
12,s
xs
NO. 17 2013-5-9
Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择 2) 溶剂的作用
萃取精馏处理的物料大致分两类:
3.2.1 萃取精馏
① 在全浓度范围内α12 ≈1
② 仅在恒沸浓度和邻近区域浓度内α12 ≈1
——即恒沸物。
NO. 18
2013-5-9
Cui Qun
xs A1s As 2 2 x1 ( As1 A1s ) xs ( A2 s As 2 ) c( x2 x1 ) 式⑴
其中A12、A21为组分1,2组成二元系统的端值常数,也 称Margules常数(或配偶参数)。
NO. 11 2013-5-9 Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
2) 溶剂的作用
3.2.1 萃取精馏
如果三对二组分溶液均简化为对称系统,则:C=0,
A12 A21
A1s As1
A2 s As 2
定义:组1,2的脱溶剂基浓度(对称相对浓度):
x1 x1 x1 x 2
x2 x2 x1 x 2
12 ,s ( 1 / 2 )s 12 ( 1 / 2 )
溶剂S的选择性,是权衡溶剂效果的重 要指标 。
当然,要全面评价溶剂的效果,必须与原溶液的性质结 合起来考虑。下面讨论溶剂的作用。
NO. 10 2013-5-9 Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
ln 1 x2 A12 2( A21 A12 ) x1
ln 2 x12 A21 2( A12 A21 ) x2
NO. 12 2013-5-9 Cui Qun
化工分离工程
第 三 章
(2) 萃取精馏原理及溶剂的选择
2) 溶剂的作用
由 ln 1 x2 A12 2( A21 A12 ) x1 ,
Ps 1 1 ( s )T3 ( ) s P2 2
加入溶剂S后,组分1和
组分2的活度系数比 。
T3-组分1、组分2和溶剂S三组分物系泡点温度。
Ps Ps 1 ( 1s )T3 P2s P2
随温度的变化不大
