第三章 不饱和烃
第三章不饱和烃

思考题: 1、乙烯分子为什么是平面结构?夹角 近似120 ?
。
2、为什么乙烯分子的C—H键长比wenku.baidu.com烷
分子的C—H键长要短一点?C=C双键
键长比乙烷分子的C—C单键要短?
3、乙烯的化学活性比乙烷高?
(二)异构现象
烯烃由于双键的存在和双键不能旋转,因此烯烃
的异构和同碳数的烷烃多。
1、碳链异构
2、位置异构
单 链
体:能形成高分子化合物的低分子化合物 节: 化学组成相同,可重复的最小单位
聚合度: 链节的数目
CH3
CH3
CH3
CH2 Cl
C-C为非极性键
C-C为极性键
CH3
CH2
Cl
四、诱导效应 诱导效应是指在有机分子中引入一原子或基团后,
使分子中成键电子云密度分布发生变化,从而使化学
E标记其构型。
⑷命名:命名时将Z或E写在化合物名称前面,并
用短线隔开。
H3 C Br C C
H Cl
CH3 C H C
Cl
Br
( E)-1-溴-1-氯-丙烯
H3 C C H C CH2CH3 CH3
顺-3-甲基-2-戊烯 (E)- 3-甲基-2-戊烯
(E)- 3-甲基-4-异丙基-3-庚烯
三、烯烃的性质
3-不饱和烃
(2) Z, E - 标记法
a. 次序规则
•取代基的先后顺序,首先决定于和双键直接相连原子的原子序数
-I>-Br>-CI>-F>-OH>-NH2>-CH3>-H •取代基团中,如果和双键碳原子相连的第一原子相同,则必须
比较其后相连原子的原子序数 ,如:
CH3 CHCH3 > C、C、H CH2CH3 > C、H、H CH3 H、H、H
碳架异构
CH3 CH3CH2CH CH2 CH3C CH3 CH3CH2CH2C CH CH3CHCH CH CH3CH2C CCH3 CH2 CH3CH=CH2CH3
b. 位置异构又叫官能团异构
官能团异构
(2) 顺反异构
由于双键不能旋转以及SP2杂化轨道的同一平面性所引起
反式 a C C b a b
分子轨道从SP2(SP) 杂化变成SP3 杂化。由于断裂一个形成两个,故 加成反应为放热反应。
断裂 +Q 断裂
C-C П 键 SP2
C-C σ 键 + Q SP3
1. 加氢
(1) 催化加氢和还原 在适当催化剂存在下,烯烃或炔烃与氢气进行加成反应,生成相应的烷烃。
(C2H5)2C=CHCH3 + H2 Cat. (C2H5)2CHCH2CH3 Cat. CH3CH2CHCH2CH2CH3 CH3
有机化学 第三章 不饱和烃

(一) 烯烃和炔烃的结构 (二) 烯烃和炔烃的同分异构 (三) 烯烃和炔烃的命名 (四) 烯烃的物理性质 (五) 烯烃和炔烃的化学性质 (六) 烯烃和炔烃的工业来源和制法
第三章 不饱和烃
含有碳碳重键(C=C或C≡C)的开链烃称为不饱和烃。 例如:
(一) 烯烃和炔烃的结构
(1) 烯烃的结构 (2) 炔烃的结构
最大
次大
次小
最小
③当取代基不饱和时,把双键碳或三键碳看成以单键和多 个原子相连。
(C) (C) -C CH 可看作 -C C-H
(C) (C)
(C) (C) -CH=CH2 可看作 -C C-H
HH
∴ -CCH > -CH=CH2
根据以上规则,常见基团优先次序如下所示:
-I > -Br > > -OR……
-Cl >
-SO3H >
-F >
-OCOR
举例:
(H,H,C)C
C(C,C,H)
(H,H,C)C,(H,H,C)
CH3CH2 C=C CH3
(H,H,H)C
CH(CH3)2 CH2CH2CH3
C(C,H,H)
CH3CH2CH CH3CH
(H,H,H)C,(H,H,C)C
Z-3-甲基-4-异丙基-3-庚烯
CH=CH2
5-乙烯基-2-辛烯-6-炔
第三章 不饱和烃(Unsaturated Hydrocarbon...

硫酸氢异丙酯
异丙醇
加
水
H 3PO 4 280~300℃ 7~8MPa
H2C CH2 + H2O
H3C CH2OH
H3C CH CH2 + H2O
H3PO4 105℃ 2MPa
H3C CH CH3 OH
用于醇的制备
加次卤酸
H2C CH2 + HOCl
在实际生产过程中,用 氯和水(Cl2+H2O)代 替次氯酸.
加 卤 素
亲电 试剂
H3C CH CH2
+ Br2
CCl4
H3C CH CH2 Br Br
1,2-二溴丙烷
烯烃可使溴的四氯化碳溶液褪色,此反应可用 于烯烃的鉴别.
溴与一些烯烃加成的反应速率
烯烃 相对速率
CH2=CHBr
0.04
1
H2C
CH2
CH3CH CH2 (CH3)2C (CH3)2C CH2 C(CH3)2
+
-H
+
CH3 CH3 C CH CH3 C CH3 + CH3 CH3
CH3 C CH2 CH3 C CH2 CH3
硼氢化反应
6 RCH CH2 + B2H6 H2O2 NaOH 3 H2O 2 (RCH2CH2)3B
(RCH2CH2)3B
第三章 不饱和烃

CH3CH CH2 + HBr
CH3CHCH3 + CH3CH2CH2 CH3CHCH3 Br
主要产物
+
+
CH3CH2CH2 Br
次要产物
正碳离子的稳定性: 正碳离子的稳定性:
CH3
CH3 CH3 H H + + + + > CH3 C > H3C C > H C C H CH3 H H
O R1 R C OH + O C R2
根据产物的类型,可测定烯烃的结构。 根据产物的类型,可测定烯烃的结构。
(3) 臭氧化反应
O CH3CH CH2
Zn/H2O H2O2
O3
CH3HC O
CH2 O
CH3CHO + HCHO CH3COOH + HCOOH O
R1 C C R2 H
R
O3 R C H O
CH3 C CH2 + H2C C CH3
70℃ 60%H2SO4
CH3 CH3
CH3
CH3 CH3
CH3 C CH2 C CH2 + CH3
反应历程: (两步)
H H C C H
δ+ δ-
H H
+ Br-Br H
第三章 不饱和烃

§3.1
烯烃
⑴.定义: 分子中含有一个碳碳双键的开链不饱 和烃叫做烯烃。 ⑵.通式: CnH2n(n≥2)。官能团:C=C ⑶.烯烃的构造异构:
骨架(碳链)异构 构造异构 官能团异构 异构 立体异构 位置异构 顺反异构 构型异构 对映异构 构象异构
烯烃的同分异构现象比烷烃的要复杂,除骨架异 构外,还有由于双键的位置不同引起的位置异构和双 键两侧的基团在空间的位置不同引起的顺反异构。
CH3
π π
CH3
+ Br-Br
δ+ δ-
C C
CH3
-
+ Br -C-Br
C+
百度文库
C C
CH3 Br+ + Br- Br
-
CH3 C C Br+ Br-C- -C-Br
溴鎓离子
⑤.与HXO(HOBr或HOCl)的加成: 即与卤 素(Cl2或Br2)的水溶液加成,且反式加成,生 成邻卤代醇。
H2O
H Br
顺式构型不一定是Z构型,反式构型也不一 定是E构型。如:
Br Cl C=C Cl H
CH3-CH2 CH3 C=C H CH2-CH3 H C=C CH2-CH2-CH3
反-1,2-二氯-1-溴乙烯 (E,E)-3-甲基-4-乙基-3,5-壬二烯 (Z)-1,2-二氯-1-溴乙烯
顺,反-3-甲基-4-乙基-3,5-壬二烯
第3章不饱和烃
[ CH2-CH2 ]n
聚乙烯 (高分子)
150~300Mpa
低压法
TiCl 4
Al(C2H5)3 60~75℃
低压聚乙烯
n CH2=CH2
0.1~1Mpa
[ CH2-CH2 ]n
TiCl 4
Al(C2H5)3 10Mpa
nCH3CH=CH2
50℃
[ CH-CH2 ]n CH3
聚丙烯
Ⅰ、烯
烃 > 四、烯烃的化学性质
双键碳原子中位次较小的一个)。
其它同烷烃的命名原则。
7 6 5 4 3 2 1
CH 3CHCH 2CH 2C=CHCH 3 CH 2CH 2CH 3 CH 3
6-甲基-3-丙基-2-庚烯
Ⅰ、烯
烃 > 二、烯烃的异构和命名
(2)几个重要的烯基
烯基——烯烃从形式上去掉一个氢原子后剩下
的一价基团。下面是IUPAC允许沿用俗名的烯基。
生反应。
④ 不能独立存在。
Ⅰ、烯
烃 > 二、烯烃的异构和命名
1、烯烃的同分异构 (1)碳链异构和位置异构 CH3CH2CH=CH2 CH3CH=CHCH3 CH3C=CH2
CH3
1-丁烯 2-丁烯 2-甲基丙烯
双键位置异构
碳链异构
Ⅰ、烯
烃 > 二、烯烃的异构和命名
第三章不饱和烃

>
Cl
H H 顺—2—丁烯 (Z)—2—丁烯
H
19
反—2—氯—2—丁烯 (E)—2—氯—2—丁烯
注意: 顺式不一定是Z构型;反式不一定是E构型。 ☺为什么啊? • 如果分子中有两个以上双键时,并且双键的每 一个碳上均有不同的两个原子或基团,这种情 况在命名时,每一个双键都要进行顺反或Z、E 说明。 H CH
6.烯烃的相对密度都小于1. 7.烯烃几乎不溶于水,但可溶于非极性溶剂.
21
▲顺反异构的物理性质
沸点与分子的极性有关, 熔点与分子对称性有关。
顺、反-2-丁烯的偶极矩与其熔、沸点
22
顺、反-1,2-二氯乙烯的偶极矩与其沸点
23
顺式与反式烯烃熔、沸点的比较: 极 性: 顺式>反式
故 b.p: 顺式>反式
H 3C CH3 H H CH3
12
4、
H H3C
4与5为顺反异构
5、
H
顺反异构(几何异构): 由于分子中的刚性结构(通常是双键或环)限制了 碳碳单键的旋转而造成分子中的原子或基团在空间 的不同排列形式。
a b
c d
a b
a b
a b
c
c
有顺反异构体
无顺反异构体
产生几何异构的两个条件:1.分子中有限制旋转的因 素。如碳-碳双键。2.双键的两个碳原子各自连接的 13 两个原子或基团都不相同。
《有机化学》第三章 不饱和烃

H3C CH CH3
OSO3H
H3C CH CH3 + H2O
OSO3H
H3C CH CH3
OH
(4)与水的加成
H2SO4(cat.)
CH3CH CH2 + H2O
H3C CH CH3
OH
(5)与次卤酸的加成
反应特点: 符合Markovnikov规则
CH3CH CH2 + HBrO
CH3 CH CH2 Br OH
的两原子可相对的自由旋转。 能相对自由旋转。
c.键的可极化度:较小。 较大
1.2 单烯烃的异构现象
1.2.1 结构异构
CH3 CH2 CH CH2 CH3 CH CH CH3
1-丁 烯
2-丁 烯
官能团碳碳双键 位置异构
CH3 C CH2 2-甲 基 丁 烯 CH3
碳链异构
结构异构是由于分子中各原子的结合顺序不同而引起的, 位置异构和碳链异构均属于结构异构。
(E)-2-氯-2-丁烯
1.4 单烯烃的化学性质
反应部位 氧化反应
加成反应
CC C H
α-氢的反应
键电子云集中在两核之间, 不易与外界试剂接近
π键
键的电子云暴露在外,
CC
易受亲电试剂(+)进攻
裸露的π电子云
亲电试剂:缺电子的试剂
第三章不饱和烃

(Z)-2- bromo-1-chloro-1-fluoroethene
H3C
-CH3>-H,
-CH2CH2CH3>-CH2CH3
(E)-3-ethyl-2-hexene
Cl H
Br Cl
Cl H
Cl Br
(Z)-1,2-二氯-1-溴乙烯
(E)-1,2-二氯-1-溴乙烯 (顺-1,2-二氯-1-溴乙烯)
(反-1,2-二氯-1-溴乙烯)
2,5-庚二烯的顺反异构
H C
H C
CH3
H2C
H C H H C
CH3
H3C C H C H CH3
H
C C
H2C
H2C
C C
C C
H CH3
H3 C
H
H
H
顺 ,顺
顺 ,反
反 ,反
?
有没有反, 顺-2,5-庚二烯?
顺反异构体物理性质不相同
b.p.(℃)
cis (或Z型) 1,2-二氯乙烯 trans(或E型) 48.4 1.4454 1.2565 m.p.(℃) 60.3
(CH3)2C=C(CH3)2>(CH3)2C=CHCH3 >(CH3)2C=CH2>CH3CH=CH2>CH2=CH2 卤化氢的活性顺序 HI >HBr > HCl
第三章不饱和烃

不饱和,可加成
亲电加成 自由基加成 还原加氢
R
总结: 炔烃的性质与烯烃相似
CH2
C
C
H
末端氢有弱酸性
键可被氧化
可与强碱反应
问题:两者有何不同之处? 炔烃有何特殊性质?
烯烃和炔烃的化学性质一览表
烯烃和炔烃的共性:
C C + Y Z
加 成 反 应
C Y C Z
Y Y Z Z C Y
Z C Z
C
C
一取代乙烯、 1,2-二取代乙烯 。 1,1-二取代乙烯、三取代乙烯 3 醇 H 重排 HgSO4 C H2 O C C + H2SO4 OH H H
。 2 醇
C O
乙炔
乙醛;
一取代炔
甲基酮; 二取代炔
非甲基酮。
(4)加 H2SO4: C C + H2SO4 C H C OSO2OH H2O C H C OH
a.烯烃与炔烃的反应活性:
炔烃(线型分子,易于吸附)> 烯烃。
分子中同时含有C=C和C≡C,将得到什么产物?如:
(3) 重金属炔化物的生成: Ag(NH3)2NO3 Cu(NH3)2Cl Ag Cu C C C Ag C Cu (白) (红)
HC
CH
+
一、 催化加氢
C C + H H 435 Cat. C C
第3章 不饱和烃
三、共轭二烯烃的化学 性质
2
第一节 烯烃
不饱和烃--分子中具有碳碳双键或叁键的烃。 烯烃、二烯烃、炔烃 烯烃----分子中具有碳碳双键的烃叫做烯烃。 通式:CnH2n
3
一、烯烃的结构和同分异构现象
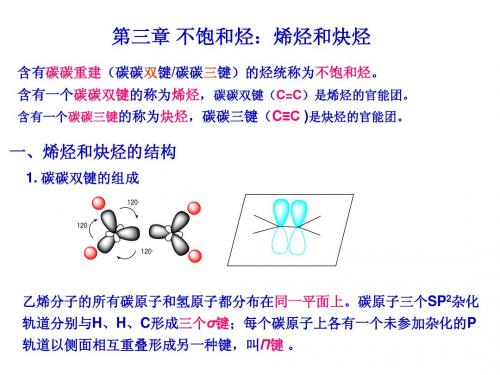
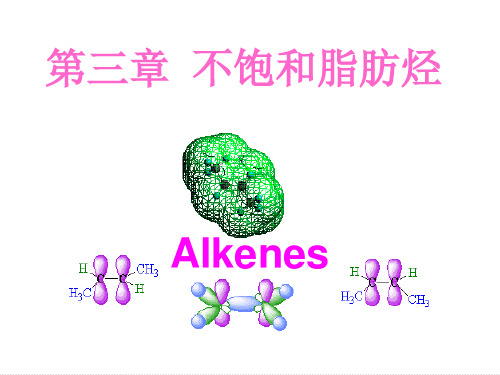
(一)烯烃的结构 乙烯分子是平面结构,所有原子都在同一平面上 彼此之间的键角约为1200 “ C=C ”是两个不同的共价键,一个键一个π键
CH2=CH-CH=CH2 CH3CH2-C CH
47
二、炔烃的命名
系统命名
1.选主链:含三键的最长碳链为主链,称 “某炔”。 2.编号:从近三键的一端开始。 3.其他:同烯烃。
CH3CH2CH2C
1-戊炔
CH
CH3CH2C
CCH3
CH3 CH3CHC
2-戊炔
4-甲基-2-戊炔
CCH3
48
(5)加水
(1)碱性高锰 酸钾氧化 (2)酸性高锰 酸钾氧化
3.聚合反应
22
(二)化学性质
1.加成反应(p28)
(1)催化加氢 CH2=CH2+H2 Pt CH3-CH3
(2)加卤素(Cl2、Br2)
CH3CH=CH2+Br2
红棕色
CCl4
《有机化学》第三章 不饱和烃
第三章 不饱和烃
不饱和烃是指分子结构中含有碳碳双键或三键的烃。不饱和烃中含有碳碳双键的叫烯烃,含有碳碳三键的称为炔烃。含有两个或多个碳碳双键的不饱和烃称为二烯烃和多烯烃。一个不饱和烃分子结构中同时含有碳碳双键和三键则称为烯炔。不饱和烃的双键和三键不太牢固,容易发生亲电加成反应、取代反应及氧化反应。
烯烃是指含有碳碳双键的不饱和烃,包括链状烯烃和环状烯烃,其官能团为碳碳双键。链状烯烃的通式为C n H 2n (n ≥2)。相对于饱和烷烃,烯烃分子结构中每增加1个双键则减少2个氢原子。
一、烯烃的结构和异构现象 (一)烯烃的结构
烯烃的结构中主要特征部分为碳碳双键,以最简单的烯烃-乙烯为例来了解双键的结构,乙烯的分子式为C 2H 4,乙烯的两个C 原子和四个氢原子均在同一个平面上,每个碳原子只和3个原子相连,为平面型分子。碳碳双键由1个σ键和1个π键构成,而不是两个单键构成。乙烯的平面构型如图3-1(a )所示,分子模型见图3-1(b )和3-1(c )。
C
C
H H
H H
121.7°117°
0.108nm
(a)乙烯的平面构型 (b)球棍模型 (c)比例模型
图3-1 乙烯分子的结构
拓展阅读
碳原子的sp 2杂化和π键
杂化轨道理论认为,乙烯分子中的碳原子在成键过程中,处于激发态的1个2s 轨道和2个2p 轨道进行杂化,形成3个能量相同的sp 2杂化轨道,称为sp 2杂化,其杂化过程可表示为:
2s 2p
激发
sp 2杂化
sp 2杂化轨道
2p
2s 2p
基态
激发态
杂化态
形成的3个sp 2杂化轨道中每个含有1/3的s 轨道成分和2/3的p 轨道成分,形状是一头大一头小;3个sp 2杂化轨道的对称轴分布在同一平面上,夹角为120°,呈平面三角形,每个碳原子还有一个2p z 轨道未参与杂化,其对称轴垂直于3个sp 2杂化轨道的对称轴所形成的平面,见图3-2。
第三章 不饱和烃

炔丙基(2-丙炔基) 丙炔基(1-丙炔基) 1,2-亚乙烯基
(2) 烯烃和炔烃的命名
(一)烯(炔)烃的系统命名法,基本上和烷烃相似 1.选择一个含双键的最长的碳链为主链。
2.从最靠近双键的一端起,把主链碳原子依次编号
3.双键的位次必须标明出来,只写双键两个碳原子中位 次较小的一个,放在烯烃名称的前面。
(1)烯基和炔基
烯(炔)基:当烯(炔)烃上去掉一个氢原子后剩下的 一价基团叫做烯(炔)基。
CH2=CH–
乙烯基
CH3 – CH=CH –
丙烯基(1-丙烯基)
CH2 = CH –CH2 –
烯丙基(2-丙烯基)
CH3 – C=CH 2
异丙烯基(1-甲基乙烯基)
HC≡C –
乙炔基
HC≡C –CH2 – CH3 –C≡C – – CH=CH–
亲电加成
烯烃中的π键是弱键,电子云受原子核束缚力较小,流动性 较大而易极化,容易给出电子,而与缺电子的试剂容易发生 加成反应。不饱和烃与亲电试剂所进行的加成反应称为亲电 加成。
1.与酸的加成
O
(1)与卤化氢的加成
HX H
①HX的活泼次序: HI > HBr >HCl 浓HI,浓HBr能和烯烃起反应,浓盐酸要用AlCl3催化剂才行。 ②烯烃与HX加成活性:
马氏规则的理论解释
1. 碳正离子的稳定性解释法
第三章 不饱和烃
CH3
C H
C CH3
wk.baidu.com
H
沸点 3.7℃ 熔点 –138.9℃
沸点 0.9℃ 熔点 –106.5℃
四、 烯烃的化学性质*** 原因 化学 性质 活泼 部位 表现
键重叠程度小,键能小 键电子云易流动,易极化
C=C 键,氢*** 易加成、氧化、聚合、 -氢取代等
1、加成反应***
烯烃的加成反应,实质上是碳碳双键的加 成反应,也就是打断一个键,两个一价原 子或基团分别加到双键碳原子上,形成两个 新的键,从而生成饱和的化合物。
键能: 键大(346 kJ.mol-1),键小(264kJ.mol-1)
同分异构 烯烃的异构体
1-丁烯: CH 构造异构
碳链异构
官能团位置异构 构型异构---顺反异构
CH CH2
3
CH2
1-丁烯
2-丁烯 2-甲基丙烯
CH3 CH
CH
CH3
CH3 CH2 C CH3
***顺反异构---分子中具有双键或环状 结构使键的自由旋转受阻,与双键原子或环 相连接的不同原子或原子团可能存在不同的 空间排布,由此而产生的立体异构现象.
CH3 C H C
CH3 H
△H=-119.7kJ.mol-1
一般△H越小,烯烃越稳定。反式比顺式稳定。另可测定双 键的数目。
有机化学第三章不饱和烃
08:38
第三章 不饱和烃 14
二.异构现象:(相同的分子式,不同的结构)
1.碳链异构:和烷烃一样,如:1—丁烯和甲基丙烯(异
丁烯):
CH3
CH3—CH CH—CH3
CH2 C—CH3
2.官能团位置异构:由于双键位置不同所产生的异构, 如:
CH3—CH CH2—CH2—CH3
CH2 CH—CH2—CH2—CH3
H2O BrCH2CH2OH
08:38
第三章 不饱和烃 33
实验证明:Br+与Br-是由碳-碳双键的两侧分别加到两 个碳原子上的,为反式加成。
Br +
CH2 + Br
CH2 溴钅翁离子
Br CH2 CH2 Br
+ Br2
Br
Br 由于上述反应是由Br+,即亲电子试剂的进攻引起的,所以 这类反应叫亲电加成
2-乙基-1-戊烯
H3C CH C CH2 H3C CH2 CH2 CH2 CH3
3-甲基-2-乙基-1-己烯
08:38
第三章 不饱和烃 10
一、 系统命名法 (续)
(2)主链编号,使双键的编号尽可能小;
12345 6
H3C CH CH2 C CH CH3
65 4 3 2 1
CH3
CH3
1
H3C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章不饱和链烃
烯烃的结构同分异构
1、了解烯烃的结构;
2、掌握烯烃的通式及构造异构现象;
§3-1 烯烃
一、烯烃的结构
二、烯烃的构造异构现象
1、烯烃的结构;
2、烯烃的通式及构造异构现象
烯烃的通式及构造异构现象
讲解为主
补充练习题
多练习烯烃构造式的书写
复习:烷烃的结构
引入:烯烃和烷烃有什么区别呢?
第三章不饱和烃
第一节烯烃
烯烃是指含有C=C键(碳-碳双键)(烯键)的碳氢化合物。每个单烯烃的分子中比同样碳原子数的直链烷烃少了两个氢原子,所以属于不饱和烃。
烯烃分为链烯烃与环烯烃。按含双键的多少分别称单烯烃、二烯烃等。
一、烯烃的结构
1、结构特征
碳碳双键是烯烃的宫能团,代表着烯烃结构的特征,烯烃的碳原子在形
成双键的时候,
键能610KJ / mol Array
C—C 346KJ / mol
由键能看出碳碳双键的键能不是碳碳单键的两倍,说明碳碳双键不是由两个碳碳单键构成的。事实说明碳碳双键是由一个σ键和一个π键构成的。
双键( C=C) = σ键 + π键
双键中有π键易断,所以化学性质活泼,容易发生化学反应.结构最简单的烯烃就是乙烯(CH2=CH2)。
H H
| |
构造式: H—C = C—H
模型P22:比例模型球棍模型
2、烯烃的同系物和通式
与烷烃相似,把含有C=C鍵,在分子结构上相差一个或若干个CH2的碳氢化合物称为烯烃的同系物。
随碳原子数的增加分别得到丙烯、丁烯、戊烯等,由于烯烃中出现了碳碳双键,每个单烯烃的分子中比同样碳原子数的直链烷烃少了两个氢原子,所以烯烃的通式为CnH2n,其中n为大于1的正整数,系差也是CH2,结构最简单的烯烃就是乙烯(CH2=CH2)。
补充数学推导法:从烷烃C n H2n+2,每多一个碳碳键就少两个氢原子
二、烯烃的构造异构现象
与烷烃相似的,含有四个及四个以上碳原子的烯烃都存在同分异构现象,但是由于烯烃分子中含有了碳碳双键,所以烯烃的同分异构现象要复杂一点,
在烯烃的构造异构中,包含有两种形式,一种是碳链异构,一种是官能团异构。
在碳链异构中,碳碳双键的位置不变,而碳链发生了改变,如:
烯烃同分异构体的推导方法:以C7H14为例写出所有同分异构体的构造式
1. 先写出最长碳原子链作为主链,然后变换双键位置,其他用氢饱和。
C=C─C─C─C─C─C C─C=C─C─C─C─C C─C─C=C─C ─C─C
2、后写出少一个碳原子的直链作主链,把取下来的一个碳原子作为支链加到直链上,并由“心”到“边”地依次变动变换支链和双键的位置:C─C─c -C─C─C C─C─C─C─C─C
││
C C
3、再写出少两个碳原子的直链,把取下来的两个碳原子作为支链加在这一直链上,先“整”加一个乙基,后“散”加两个甲基。添加这些取代基时注意由“心”到“边”和由“对”、“邻“到“间”:
C─C─C─C─C (4)
│
C
│
C
C
│
C─C─C─C─C (对位) (5)
│
C
C
│
C─C─C─C─C (对位) (6)
│
C
C ─C ─C ─C ─C (邻位) (7) │ │ C C
C ─C ─C ─C ─C (间位) (8) │ │ C C
4、一次重复步骤3
练习:写出烯烃C 6H 12的所有同分异构体
2-甲基-1-戊烯 2-甲基-2-戊烯 4-甲基-2-戊烯 4-甲基-1-戊烯
CH 2=CCH 2CH 2CH 3
CH 3
CH 3
CH 3C =CHCH 2CH 3
CH 3CH CH 3
CH=CHCH 3
CH 3C CH 3
HCH 2CH=CH 2
223
3CH=C 3
23
CH 2=C
CH 3CHCH 3
CH 3
CH 3C=CCH 3
CH 3CH 3
CH 3
C CH 3
CH 3
CH=CH 2
第三章 不饱和链烃
烯烃的命名
1、了解烯烃的习惯命名法
2、掌握烯烃的命名方法;
3、比较烯烃烷烃的系统命名法
§3-1 烯烃
三、烯烃的命名
1、烯烃的命名方法;
2、烯烃与烷烃的系统命名法比较
1、烯烃的命名方法;
2、烯烃与烷烃的系统命名法比较
讲解为主、模型演练
P33习题1-3
对比烯烃烷烃系统命名法
复习:1、烯烃的结构和通式
2、烯烃的同分异构体
引入:烯烃和烷烃一样,相同碳原子具有多种结构,那么该如何区分呢?
三、烯烃的命名 1、习惯命名法
习惯命名法仅适用于简单的烯烃,其命名规则与烷烃相同。如:
乙烯 丙烯 正丁烯
CH 3
CH 2= C -CH 3 异丁烯 2、烯基的命名
烯烃分子中去掉一个氢原子的剩余基团称为烯基。
CH 2=CH- 乙烯基 CH 3-CH=CH- 丙烯基
CH 2=CH-CH 2- 烯丙基(2-丙烯基) CH 2=C-CH 3 异烯丙基
︱
3、系统命名法
烯烃的系统命名法与烷烃有许多相同之处,但由于烯烃分子中有官能团(C=C)存在,因此命名方法与烷烃有所不同。命名原则如下。
1、首先选择含有双键的最长碳链作为主链,按主链中所含碳原子的数目命名为某烯.主链碳原子数在十以内时用天干表示,如主链含有三个碳原子时,即叫做丙烯;在十以上时,用中文字十一,十二,……等表示,并在烯之前加上碳字,如十二碳烯.
CH 3(CH 2)CH 3 CH 3(CH 2)3CH=CH(CH 2)4CH 3
十三烷 5-十一碳烯
2、从距离碳碳双键最近的一端开始,对主链碳原子进行编号(用阿拉伯数字1,2,3,…),或者说给予双键最小的编号。碳碳双键的位次用两个双键碳原子中编号小的碳原子的号数表示,写在“某烯”之前,并用半字线相连。 CH CH C H CH CH CH C CH CH H 223222
3CH 3-C=CH-CH 2-CH-CH 3
CH 3
CH 32345611
2
3
6
4
(2)(3)
(1)X
X
编号正确编号错误
主链选择
