2014届步步高(广东专用)大一轮复习 难溶电解质的溶解平衡
高考化学一轮复习 第四节 难溶电解质的溶解平衡习题讲解课件

ppt精选
13
2.解析:实验①中为了不引入杂质离子,应加入氨水使 Fe3+沉淀,
而不能用 NaOH 溶液。实验②中根据溶解度数据可知 Mg(OH)2 能转化为 Fe(OH)3,因此在 MgCl2 溶液中加入足量 Mg(OH)2 除去 Fe3+,然后将沉淀一并过滤。实验③中利用 Fe3+极易水解
的特点,根据题意可知调节溶液的 pH=4 可使 Fe3+沉淀完全,
ppt精选
6
2.解析:②会生成 CaCO3,使 Ca2+浓度减小,错误;加入氢氧 化钠溶液会使平衡左移,有 Ca(OH)2 沉淀生成,但 Ca(OH)2 的溶度积较大,要除去 Ca2+,应把 Ca2+转化为更难溶的
CaCO3,③错误;恒温下 Ksp 不变,加入 CaO 后,溶液仍为 Ca(OH)2 的饱和溶液,pH 不变,④错误;加热,Ca(OH)2 的溶
为了不引入杂质离子,可使用 CuO、Cu(OH)2 等调节溶液的 pH。
答案:(1)Fe(OH)3 (2)氨水 不会引入新的杂质
解度减小,溶液的 pH 降低,⑤错误;加入 Na2CO3 溶液,沉
淀溶解平衡向右移动,Ca(OH)2 固体转化为 CaCO3 固体,固体
质量增加,⑥正确;加入 NaOH 固体平衡向左移动,Ca(OH)2
固体质量增加,⑦错误。
答案:A
ppt精选
7
考点二 [教材知识层面] 1.(1)Fe3++3NH3·H2O===Fe(OH)3↓+3NH4+ (2)Cu2++H2S===CuS↓+2H+ 2.(1)CaCO3+2H+===Ca2++CO2↑+H2O (2)Mg(OH)2+2NH+4 ===Mg2++2NH3·H2O 3.(1)沉淀溶解平衡 (2)AgCl AgBr (3)溶解度小 溶解度更 小 (4)①CaSO4+CO32-===CaCO3+SO42- ②ZnS+Cu2+===CuS+Zn2+
【红对勾系列】2014届高考化学一轮复习 课时作业28 难溶电解质的溶解平衡

课时作业28 难溶电解质的溶解平衡时间:45分钟分值:100分一、选择题(共50分,每小题5分)1.纯净的NaCl并不潮解,但家庭所用的食盐因含有M g Cl2杂质而易于潮解。
为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。
对此有下列说法,其中正确的是( )A.食盐颗粒大一些有利于提纯B.设计实验的根据是M g Cl2比NaCl易溶于水C.设计实验的根据是NaCl的溶解平衡D.在整个过程中,NaCl的物质的量浓度会变大[答案]C[解析]饱和食盐水已不再溶解食盐,但对于M g Cl2并未达到饱和。
NaCl(S) Na+(aq)+Cl-(aq),当M g Cl2被溶解时,C(Cl-)增大,平衡左移,还可得到比原来更多的食盐。
2.有关CaCO3的溶解平衡的说法中,不正确的是( )A.CaCO3沉淀析出和沉淀溶解不断进行,但速率相等B.CaCO3难溶于水,其饱和溶液不导电,属于弱电解质溶液C.升高温度,CaCO3沉淀的溶解度增大D.向CaCO3沉淀中加入纯碱固体,CaCO3的溶解度降低[答案]B[解析]CaCO3固体在溶液中达到溶解平衡后,沉淀溶解与沉淀生成速率相等,但不为0;一般来说,升高温度,有利于固体物质的溶解;CaCO3难溶于水,但溶解的部分是完全电离的,电离出Ca2+和CO2-3,属于强电解质;向CaCO3溶解平衡体系中加入纯碱固体,增大了CO2-3浓度,使溶解平衡向左移动,降低了CaCO3的溶解度。
3.工业废水中常含有Cu2+、CD2+、PB2+等重金属离子,可以通过加入过量难溶电解质FeS、MNS等,使这些金属离子形成硫化物沉淀除去。
根据以上事实,可推知FeS、MNS具有的相关性质为( )A.在水中的溶解能力大于CuS、CDS、PBSB.在水中的溶解能力小于CuS、CDS、PBSC.在水中的溶解能力与CuS、CDS、PBS相同D.均具有较强的吸附性[答案]A[解析]根据题意,FeS、MNS的溶解能力大于CuS、CDS、PBS的溶解能力。
2014步步高大一轮复习_第8章——第八章 大题冲关滚动练之八

2 (2)将适量 K2FeO4 配制成 c(FeO4 )=1.0 mmol· 1 的试样,将试样分别置于 L
- - - -
20 ℃、30 ℃、40 ℃和 60 ℃的恒温水浴中,测定 c(FeO2 )的变化,结果见图 4
大题冲关滚动练之八——电解质溶液的图表类综合题
(2)下图是 NaOH 滴定磷酸的 pH 变化曲线图,已知曲线右端 NaOH 已过量。
H3PO4+OH ===H2PO4 +H2O ①写出第一次滴定突跃前反应的离子方程式_________________________________;
BE ②你认为曲线中没有第三个突跃的可能原因是________。
10-6 (3)H2CO3 一级电离平衡常数的数值 Ka1≈__________。 当pH<5时,此溶液 (4)解释 pH<5 的溶液中 H2CO3 的 pC 总是约等于 3 的原因是____________________ 是碳酸的饱和溶液 _________________________。
(5)人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3 )可以抵消少量酸或碱, 维持
- -
-
- 2 10- 5 mol· - 1,而 CO2- 的浓度更小。 L 解析 (1)根据图像推断三种离子不能大量共存,如当 pH=4 时,c(HCO- )达不到 3 10 5 mol· 1,而 CO3 的浓度更小。 L 3 解析 (1)根据图像推断三种离子不能大量共存,如当 pH=4 时,c(HCO3 )达不到 - - - - - 2 (2)根据图像,当 pH=7的浓度更小。)>c(H2CO3)>c(CO2- )。 10- 5 mol· - 1,而pH=7 时,c(HCO3 )>c(H2CO3)>c(CO3 )。 L CO2- 时,c(HCO- 3 (2)根据图像,当 3 3 10 5 mol· 1,而 CO2 的浓度更小。 L 3 + - + - - - - - (3)H2CO3 H+ +HCO时,c(HCO-)>c(H7 CO3)>c(CO2-)。 )=10- 7 mol· - 1 时,c(HCO3 )=10- 3 mol· - 1, L 1 时,c(HCO-)=10 3 mol· 1, L (2)根据图像,当 +HCO-。当 c(H+ - pH=7 3 。当 c(H 3 3 2 mol· 3- (3)H2CO3 H )=10 L L 3 (2)根据图像,当 pH=7- 时,c(HCO3 )>c(H2CO33)>c(CO2 )。 3 - -7 - + + 7 10- 7×10- 3L-1 时,c(HCO-)=10-3 mol· -1, (3)H2CO3- 4+ H +HCO3 - mol· - 1 - 6 L 3 - 1 。当 c(H )=10 ×10 c(H2CO3)=10- 4 mol· - 1,所以c(H+ )=10- 7 4mol· 时,c(HCO-)=10- 3 mol· - 1, L ,所以 Ka1=10 - 4 =10- 6。 (3)H2CO3 H +HCO L L c(H2CO3)=10 mol· 3 。当 Ka1= -10- -3=10 。 L 3 7 10 10 ×10 - - - c(H2CO3)=10-4 mol· - 1,所以 Ka1=10- 7×10- 3=10-6。 L -4 (4)当 pH<5 时,碳酸为饱和溶液。 = 10 (4)当 pH<5 时,碳酸为饱和溶液。 c(H2CO3)=10 4 mol· 1,所以 Ka1 L =10 6。 -4 10 - + + (5)当过量的酸进入血液中时,HCO3 和 H+ 结合生成 H2CO3,由于 c(H+ )增大更多, (4)当 pH<5 时,碳酸为饱和溶液。 -和 H 结合生成 H2CO3,由于 c(H )增大更多, (5)当过量的酸进入血液中时,HCO3 (4)当 pH<5 时,碳酸为饱和溶液。 - + + + 所以 c(H+ )/c(H2CO3)将变大。 (5)当过量的酸进入血液中时,HCO-和 H+ 结合生成 H2CO3,由于 c(H+ )增大更多, 3 所以 c(H )/c(H2CO3)将变大。 (5)当过量的酸进入血液中时,HCO3 和 H 结合生成 H2CO3,由于 c(H )增大更多, + 所以 c(H+ )/c(H2CO3)将变大。 所以 c(H )/c(H2CO3)将变大。
高考化学一轮复习 专题22 难溶电解质的溶解平衡课件
③若向沉淀溶解平衡体系中加入相同的离子,平衡向生产沉淀 的方向移动。
④若向沉淀溶解平衡体系中加入某些离子,可与体系中某些 离子反应生成难溶的物质或气体,则平衡向溶解的方向移动。
深度思考:蓝皮P90 考点深度思考7
讨论1:(09·浙江)已知:25°C时,K sp[M g(O H )2]5 .6 1 1 0 -1 2
A.加入Na2SO4可以使溶液由a点变到b点 B.通过蒸发可以使溶液由d点变到c点 C.d点无BaSO4沉淀生成 D.a点对应的Ksp大于c点对应的Ksp
练习 4:蓝皮P92 随堂跟踪 2
二、溶解平衡的应用: 1. 沉淀的生成
(1)条件: Qc Ksp 时有沉淀生成。
(2)应用: ① 分离离子:同一类型的难溶电解质,溶度积小的先析出。 ② 调节pH提纯物质: 例如:加入氨水调节pH至7~8,可除去氯化铵中的杂质氯化铁。
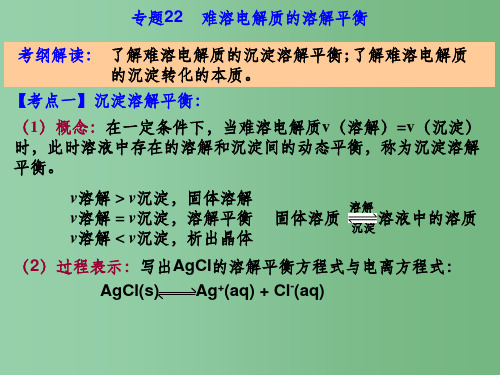
固体溶质 溶解 溶液中的溶质
沉淀
(2)过程表示:写出AgCl的溶解平衡方程式与电离方程式: AgCl(s) Ag+(aq) + Cl-(aq)
讨论:AgCl(s)
Ag+ (aq)+ Cl-(aq)
在AgCl的饱和溶液中,有AgCl固体存在,当分别向溶液中加 入下列物质时,将有何种变化?
加入物质
平衡 溶液中浓度 移动 c(Ag+) c(Cl-) KSP
Fe3+ + 3NH3•H2O=Fe(OH)3↓+3NH4+
试卷26:…加入碳酸钙,将浸出液pH调至5,从而除掉铁离子…
讨论2:(11·天津)工业废水中常含有一定量的Cr2O72—和CrO42—, 它们会对人类及生态系统产生很大的伤害,必须进行处理。
高考化学一轮总复习 第八单元 第4讲 难溶电解质的溶解平衡课件

二、影响沉淀溶解平衡的因素 1.内因:难溶物质的___性__质___,这是决定因素。 2.外因。 (1)浓度:加水稀释,平衡向__沉__淀__溶__解____的方向移动,但 Ksp__不__变____。 (2)温度:绝大多数难溶盐的溶解是吸热过程,升高温度, 平衡向_沉__淀__溶__解___的方向移动,Ksp___增__大___。 (3)相同离子:向平衡体系中加入难溶物相应的离子,平衡 向_生__成__沉__淀_的方向移动。
(2)沉淀剂法:如用H2S沉淀Cu2+,离子方程式为:
______C_u_2_+_+__H_2_S_=_=_=_C_u_S_↓_+__2_H_+_________。
2.沉淀的溶解。 (1)酸溶解:难溶于水的 CaCO3 可溶于盐酸,用离子方程式 表示为:_______C_a_C_O_3_+__2H__+_=_=_=_C_a_2_+_+__C_O_2_↑_+__H_2_O________。 (2)盐溶解:用离子方程式表示 Mg(OH)2 溶于 NH4Cl 溶液: __M_g_(_O__H_)_2+__2_N__H_4+_=_=__=_M_g_2_+_+__2_N__H_3_·_H_2_O___。 3.沉淀的转化。 (1)实质:___沉__淀__溶__解__平__衡___的移动。如 MgCl2 溶液―Na―O→H Mg(OH)2―Fe―C→l3 Fe(OH)3,则 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
(2)沉淀转化的规律:复分解反应总是向着某些离子浓度减 小的方向进行,若生成难溶电解质,则向着生成溶度积较小的 难溶电解质的方向进行。一般说来,__溶__解__度__小__的沉淀转化成 溶__解__度__更__小__的沉淀容易实现。
(3)应用:锅炉除垢:将 CaSO4 转化为 CaCO3,离子方程式 为:CaSO4+CO23-===CaCO3+SO24-;矿物转化:CuSO4 溶液遇 ZnS 转化为 CuS,离子方程式为:__Z__nS_+__C_u_2_+_=_=_=_C_u_S_+__Z_n_2_+____。
高三化学一轮复习精练 难溶电解质的溶解平衡

证对市爱幕阳光实验学校第26讲难溶电解质的溶解平衡根底热身1.以下对沉淀溶解平衡的描述正确的选项是( )A.开始时,溶液中各离子浓度相B.沉淀溶解到达平衡时,沉淀的速率和溶解的速率相C.沉淀溶解到达平衡时,溶液中溶质的离子浓度相,且保持不变D.沉淀溶解到达平衡时,如果再参加难溶性的该沉淀物,将促进溶解2.在BaSO4饱和溶液中,参加Na2SO4(s),达平衡时( )A.c(Ba2+)=c(SO2-4)B.c(Ba2+)=c(SO2-4)=[K sp(BaSO4)]1/2C.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)=K sp(BaSO4)D.c(Ba2+)≠c(SO2-4),c(Ba2+)·c(SO2-4)≠K sp(BaSO4)3.[2021·六校] (双选)以下现象、解释与结论均正确的选项是( )4.[2021·六校第一次] 在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+离子,:K sp[Fe(OH)3]=×10-39;K sp[Cr(OH)3]=7.0×10-31;K sp[Zn(OH)2]=1.0×10-17;K sp[Mg(OH)2]=×10-11。
当氢氧化物开始沉淀时,以下哪一种离子所需溶液的pH最小( )A.Fe3+B.Cr3+C.Zn2+ D.Mg2+5.[2021·六校] (双选)以下有关说法不正确的选项是.......( ) A.25 ℃时,0.1 mol·L-1的三种溶液的pH关系为:pH(NaHCO3)>pH(Na2CO3)>pH(CH3COONa)B.25 ℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液,c(H+)相C.25 ℃时,BaCO3在纯水中的K sp比在Na2CO3溶液中的K sp大D.NaHCO3和Na2CO3混合溶液中,一有c(Na+)+c(H+)=c(OH-)+c(HCO-3)+2c(CO2-3)能力提升6.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中到达沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图K26-1所示。
高考化学一轮复习第八章第4节难溶电解质的溶解平衡教师用书

高考化学一轮复习第八章第4节难溶电解质的溶解平衡教师用书[考试说明] 1.了解难溶电解质的沉淀溶解平衡。
2.了解难溶电解质的沉淀转化的本质。
3.了解溶度积的含义及其表达式,能进行相关的计算。
[命题规律] 本节内容是历届各地高考的热点,考查点有三个:一是考查溶解平衡的建立及平衡的移动;二是结合图像,考查溶度积的应用及影响因素;三是沉淀反应在生产、科研和环保中的应用。
考点1 沉淀溶解平衡及其应用知识梳理1.沉淀溶解平衡 (1)概念在□01一定温度下,当难溶电解质溶于水形成□02饱和溶液时,□03沉淀溶解速率和□04沉淀生成速率相等的状态。
(2)溶解平衡的建立(3)特点(4)表示AgCl 在水溶液中的电离方程式为□11AgCl===Ag ++Cl -。
AgCl 的溶解平衡方程式为□12AgCl(s)Ag +(aq)+Cl -(aq)。
2.影响沉淀溶解平衡的因素以AgCl(s)Ag +(aq)+Cl -(aq) ΔH >0为例3.沉淀溶解平衡的应用 (1)沉淀的生成 ①调节pH 法如除去CuCl 2溶液中的杂质FeCl 3,可以向溶液中加入CuO ,调节溶液的pH ,使Fe 3+形成Fe(OH)3沉淀而除去。
离子方程式为□38Fe 3++3H 2O Fe(OH)3+3H +,□39CuO +2H +===Cu 2++H 2O 。
②沉淀剂法如用H 2S 沉淀Hg 2+的离子方程式为□40Hg 2++H 2S===HgS↓+2H +。
(2)沉淀的溶解①酸溶解法:如CaCO 3溶于盐酸,离子方程式为□41CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②盐溶解法:如Mg(OH)2溶于NH 4Cl 溶液,离子方程式为□42Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
③配位溶解法:如Cu(OH)2溶于NH 3·H 2O 溶液,离子方程式为□43Cu(OH)2+4NH 3·H 2O===[Cu(NH 3)4]2++2OH -+4H 2O 。
2014步步高大一轮复习总结-第8章——第八章-第1讲

知识梳理
探究高考
练出高分
知识梳理·题型构建
【递进题组】
题组一
1
2
题组二
3
4
知识梳理
探究高考
练出高分
知识梳理·题型构建
题组一
1
2
题组二
3
4
题组一 条件改变时电离平衡移动结果的判断
1.(2011·新课标全国卷,10)将浓度为 0.1 mol·L-1 HF 溶液加水不断稀释,
下列各量始终保持增大的是
A.c(H+)
A.减小、减小
B.减小、增大
C.增大、增大
D.增大、减小
解析 在 NaHCO3 溶液中存在如下电离
平衡,HCO-3 H++CO32-,当加入少
许冰醋酸时,HCO-3 与冰醋酸电离出的
H+反应生成 CO2 和 H2O,上述平衡向
左
移
动
,
c(CO
2- 3
)
减
小
。
当
加
入
少
量
Ba(OH)2 固体时发生如下反应,Ba2++
第1讲 弱电解质的电离平衡
【考纲要求】
1.了解电解质在水溶液中的电离以及电解质溶液的 导电性。 2.了解弱电解质在水溶液中的电离平衡。 3.了解电离平衡常数。 重难点:弱电解质在水溶液中的电离平衡。
知识梳理·题型构建
弱电解质的电离平衡
考点一 弱电解质的电离平衡 考点二 电离平衡常数 考点三 强酸与弱酸的比较
3.下列溶液中所含微粒种类由大到小的顺序是__B_A__C_D__。 A.氨水 B.氯水 C.硫酸氢钠溶液 D.盐酸
解析 氨水:NH3、H2O、NH3·H2O、NH+ 4 、OH-、H+共 6 种;氯水:H2O、Cl2、 HClO、H+、Cl-、ClO-、OH-共 7 种;NaHSO4 溶液:H2O、Na+、H+、SO24-、 OH-共 5 种;盐酸:H+、Cl-、OH-、H2O 共 4 种。
高考化学一轮复习难溶电解质的溶解平衡讲义

——————————教育资源共享步入知识大海————————难溶电解质的溶解均衡李仕才【课标要求】1.掌握难溶电解质的溶解均衡及溶解均衡的应用2.运用均衡挪动原理剖析、解决积淀的溶解和积淀的转变问题【教课过程】一、溶解均衡1.难溶电解质的定义是什么?难溶物的溶解度能否为0?在 20℃时电解质的溶解性与溶解度的关系以下:溶解性易溶可溶微溶难溶溶解度2.当 AgNO3与 NaCl 反响生成难溶AgCl 时,溶液中能否含有Ag+和 Cl -?此溶液能否为AgCl 的饱和溶液?3.难溶电解质(如AgCl )能否存在溶解均衡?并写出AgCl 的溶解均衡表达式。
4.溶解均衡的观点?其有哪些特点?二、积淀反响的应用1.积淀的生成(1)积淀生成的应用:在波及无体制备、提纯工艺的生产、科研、废水办理等领域中,常利用生成积淀达到分别或某些离子的目的。
(2)积淀的方法a 调理 pH法:如:工业原料氯化铵中混有氯化铁,加氨水调pH 值至 7- 8b加积淀剂法:写出使用Na2S、 H2S 作积淀剂使 Cu2+、 Hg2+形成积淀的离子方程式 .【思虑】1) 在生活中,水资源是很可贵的,假如工业废水中含有Ag+,理论上,你会选择加入什么试剂?2) 粗盐提纯时 ,NaCl 溶液中含有2- 离子,选择含2+ 2+SO Ca 仍是Ba 离子的试剂除掉?42.积淀的溶解(1)积淀溶解的原理:想法不停移去溶解均衡系统中的相应离子,使均衡向积淀溶解的方向挪动(2)应用举例:a)难溶于水的盐溶于酸中如:CaCO3溶于盐酸,FeS、Al(OH)3、Cu(OH)2溶于强酸b ) 难溶于水的电解质溶于某些盐溶液如:Mg(OH)2溶于NH4Cl溶液c)难溶物因发生氧化复原反响而溶解如:不溶于盐酸的硫化银可溶于硝酸3.积淀的转变(1)积淀转变的本质:(2)积淀转变的应用:如锅炉除水垢(CaSO4),一些自然现象的解说金戈铁骑三、溶度积(K sp)1.观点:2.表达式:关于积淀溶解均衡M m A nn+ m-Mm (aq)+Na (aq) , K sp =3.溶度积规则:比较K sp与溶液中相关离子浓度幂的乘积(离子积Q c)判断难溶电解质在给定条件下积淀可否生成或溶解。
【步步高】(广东专用)高考化学一轮复习 第八章 第4讲 难溶电解质的溶解平衡

第4讲难溶电解质的溶解平衡[考纲要求] 1.了解难溶电解质的沉淀溶解平衡。
2.了解难溶电解质沉淀转化的本质。
考点一沉淀溶解平衡及应用1.沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)溶解平衡的建立固体溶质溶解沉淀溶液中的溶质①v溶解>v沉淀,固体溶解②v溶解=v沉淀,溶解平衡③v溶解<v沉淀,析出晶体(3)溶解平衡的特点(4)影响沉淀溶解平衡的因素①内因难溶电解质本身的性质,这是决定因素。
②外因以+(aq)+Cl-(aq) ΔH>0为例(5)20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡的应用(1)沉淀的生成①调节pH法如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH+4。
②沉淀剂法如用H2S沉淀Cu2+,离子方程式为H2S+Cu2+===CuS↓+2H+。
(2)沉淀的溶解①酸溶解法如CaCO3溶于盐酸,离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
②盐溶液溶解法如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH+4===Mg2++2NH3·H2O。
③氧化还原溶解法如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法如AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O。
(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
深度思考1.下列方程式+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、③CH3CH3COO-+H+各表示什么意义?答案①AgCl的沉淀溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH 的电离平衡。
高考化学一轮复习课件第六单元难溶电解质的溶解平衡PPT文档ppt

解析:Ksp(PbCl2)只与温度有关,温度不变,Ksp(PbCl2)不 变,A错误;根据图象知当盐酸的浓度大于1 mol·L-1时PbCl2 的溶解度随盐酸浓度的增大而增大,则PbCl2能与一定浓度的 盐酸反应,B正确;y点铅元素的存在形式不是Pb2+,x、y两点 对应的溶液中c(Pb2+)不相等,C错误;往含Pb2+的溶液中加入 浓盐酸至过量,可将Pb2+先转化为PbCl2(s)(存在沉淀溶解平衡, 溶液中含有Pb2+),然后转化为其他形式,D错误。
ห้องสมุดไป่ตู้(2)沉淀剂法:如用 H2S 沉淀 Cu2+,离子方程式为______ ________C_u_2_+_+__H__2S_=_=__=_C_u_S_↓__+__2_H_+______________。
2.沉淀的溶解 (1)酸溶解:难溶于水的 CaCO3 可溶于盐酸,用离子方程式 表示为______C__a_C_O_3_+__2_H_+__=_=_=_C_a_2_+_+__C__O_2_↑__+__H_2_O__________。 (2)盐溶解:用离子方程式表示 Mg(OH)2 溶于 NH4Cl 溶液: __________________________________________________。 3.沉淀的转化 (1)实质:___沉__淀__溶__解__平__衡____的移动。如 MgCl2 溶液―Na―O→H Mg(OH)2―Fe―C→l3 Fe(OH)3,则 Ksp[Mg(OH)2]>Ksp[Fe(OH)3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第4讲 难溶电解质的溶解平衡[考纲要求] 1.了解难溶电解质的沉淀溶解平衡。
2.了解难溶电解质的沉淀转化的本质。
考点一 沉淀溶解平衡及应用1.沉淀溶解平衡(1)沉淀溶解平衡的概念在一定温度下,当难溶强电解质溶于水形成饱和溶液时,溶解速率和生成沉淀速率相等的状态。
(2)溶解平衡的建立固体溶质 溶解沉淀溶液中的溶质 ①v 溶解>v 沉淀,固体溶解 ②v 溶解=v 沉淀,溶解平衡 ③v 溶解<v 沉淀,析出晶体 (3)溶解平衡的特点(4)影响沉淀溶解平衡的因素 ①内因难溶电解质本身的性质,这是决定因素。
②外因以AgCl(s) Ag +(aq)+Cl -(aq) ΔH >0为例(5)20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:2.沉淀溶解平衡的应用 (1)沉淀的生成 ①调节pH 法如除去NH 4Cl 溶液中的FeCl 3杂质,可加入氨水调节pH 至7~8,离子方程式为 Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH +4。
②沉淀剂法如用H 2S 沉淀Cu 2+,离子方程式为H 2S +Cu 2+===CuS ↓+2H +。
(2)沉淀的溶解 ①酸溶解法如CaCO 3溶于盐酸,离子方程式为CaCO 3+2H +===Ca 2++H 2O +CO 2↑。
②盐溶液溶解法如Mg(OH)2溶于NH 4Cl 溶液,离子方程式为Mg(OH)2+2NH +4===Mg 2++2NH 3·H 2O 。
③氧化还原溶解法如不溶于盐酸的硫化物Ag 2S 溶于稀HNO 3。
④配位溶解法如AgCl 溶于氨水,离子方程式为AgCl +2NH 3·H 2O===[Ag(NH 3)2]++Cl -+2H 2O 。
(3)沉淀的转化①实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化)。
②应用:锅炉除垢、矿物转化等。
深度思考1.沉淀的溶解平衡是怎样建立的?勒夏特列原理是否适用于该平衡?答案 难溶电解质的溶解度虽然很小,但不可能为零(完全不溶解),溶液中的离子结合成难溶电解质时,也不可能完全进行到底。
故难溶电解质在水中会建立如下平衡:M m A n (s) 溶解沉淀m M n +(aq)+n A m -(aq)。
勒夏特列原理同样适用于沉淀溶解平衡。
2.难溶的氯化银在水中也存在着溶解平衡AgCl(s) Ag +(aq)+Cl -(aq),怎样用实验证明溶液中可以同时存在着少量的Ag+和Cl-?答案取适量的AgCl溶解于试管中,滴加酸化的AgNO3溶液,生成白色沉淀,证明溶液中含Cl-,另取适量AgCl溶解于试管中,滴加Na2S溶液,生成黑色沉淀,证明溶液中含Ag+。
3.(1)0.1 mol·L-1的盐酸与0.1 mol·L-1的AgNO3溶液等体积混合完全反应后溶液中含有的微粒有________________________。
(2)下列方程式①AgCl(s) Ag+(aq)+Cl-(aq)、②AgCl===Ag++Cl-、③CH3COOH CH3COO-+H+各表示什么意义?答案(1)H2O、H+、OH-、Ag+、Cl-、NO-3、AgCl(2)①AgCl的溶解平衡;②AgCl是强电解质,溶于水的AgCl完全电离;③CH3COOH的电离平衡。
4.(1)在实验室中怎样除去NaCl溶液中的BaCl2?(2)怎样除去AgI中的AgCl?答案(1)向溶液中加入过量的Na2CO3溶液充分反应过滤,向滤液中加适量盐酸。
(2)把混合物与饱和KI溶液混合,振荡静置,溶度积大的AgCl就慢慢转化为溶度积小的AgI。
5.试用平衡移动原理解释下列事实:(1)BaCO3不溶于水,为什么不能作钡餐?(2)CaCO3难溶于稀H2SO4,却能溶于醋酸中;(3)分别用等体积的蒸馏水和0.01 mol·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量。
答案(1)BaCO3(s) Ba2+(aq)+CO2-3(aq),HCl===H++Cl-,2H++CO2-3===H2O+CO2↑,盐酸电离的H+与BaCO3产生的CO2-3结合生成CO2和H2O,破坏了BaCO3的溶解平衡,c(Ba2+)增大,引起人体中毒。
(2)CaCO3(s) Ca2+(aq)+CO2-3(aq),H2SO4===SO2-4+2H+,因为生成的CaSO4溶解度较小,会附在CaCO3的表面,阻止平衡的右移。
而CH3COOH CH3COO-+H+生成的醋酸钙易溶于水;当H+与CO2-3结合生成CO2和H2O时,CaCO3的溶解平衡右移。
(3)用水洗涤AgCl,AgCl(s) Ag+(aq)+Cl-(aq)平衡右移,AgCl的质量减少,用HCl洗涤AgCl,稀释的同时HCl电离产生的Cl-会使平衡左移,AgCl减少的质量要小些。
题组一沉淀溶解平衡及其影响因素1.有关AgCl的沉淀溶解平衡的说法正确的是(双选)()A.AgCl沉淀生成和溶解同时在不断进行,且速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.只要向含有AgCl的饱和溶液中加入盐酸,一定会有沉淀生成D.向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀会转变为AgBr沉淀答案AD解析A项,沉淀溶解平衡是一个动态平衡,正确;B项,沉淀溶解平衡存在,则肯定存在Ag+和Cl-,故不正确;C项,如果加入盐酸后溶液中Cl-的浓度小于原饱和溶液中的Cl-浓度,则不产生沉淀;D项,向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀会转变为AgBr沉淀。
2.已知溶液中存在平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)ΔH<0,下列有关该平衡体系的说法正确的是()①升高温度,平衡逆向移动②向溶液中加入少量碳酸钠粉末能增大钙离子浓度③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液④恒温下向溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入Na2CO3溶液,其中固体质量增加⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑥⑦答案 A解析②会生成CaCO3,使Ca2+浓度减小,错误;加入氢氧化钠溶液会使平衡左移,有Ca(OH)2沉淀生成,但Ca(OH)2的溶度积较大,要除去Ca2+,应把Ca2+转化为更难溶的CaCO3,③错误;恒温下K sp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,④错;加热,Ca(OH)2的溶解度减小,溶液的pH降低,⑤错;加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,⑥正确;加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,⑦错。
3.下列叙述不正确的是(双选) () A.CaCO3能够溶解在CO2的水溶液中B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液C.AgCl难溶于氨水D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀答案BC解析沉淀溶解平衡体系中的离子被消耗可促进沉淀的溶解,增大某种离子浓度可以促进沉淀生成。
A项中CaCO3(s) Ca2+(aq)+CO2-3(aq),H2CO3 H++HCO-3,CO2-3和H+结合生成HCO-3,促使两个平衡都向右移动,CaCO3逐渐溶解转化为Ca(HCO3)2;B项中Mg(OH)2(s) Mg2+(aq)+2OH-(aq),加入盐酸或NH4Cl溶液,均消耗OH-,促使Mg(OH)2溶解;C项中AgCl(s) Ag+(aq)+Cl-(aq),加入氨水后Ag++2NH3·H2O [Ag(NH3)2]++2H2O,所以AgCl逐渐溶解;D项中反应的离子方程式为Mg2++SO2-4+Ba2++2OH-===Mg(OH)2↓+BaSO4↓,得到两种沉淀。
题组二沉淀溶解平衡在工农业生产中的应用(一)废水处理4.水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。
目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。
以下处理措施和方法都正确的是__________(填字母编号,可多选)。
(2)①下列物质中不可以作为混凝剂(沉降剂)使用的是______(填字母编号,可多选)。
A.偏铝酸钠B.氧化铝C.碱式氯化铝D.氯化铁②混凝剂除去悬浮物质的过程是________(填字母编号)。
A.物理变化B.化学变化C既有物理变化又有化学变化(3)在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
某厂废水中含KCN,其浓度为650 mg·L-1。
现用氯氧化法处理,发生如下反应:KCN +2KOH +Cl 2===KOCN +2KCl +H 2O 再投入过量液氯,可将氰酸盐进一步氧化为氮气。
请配平下列化学方程式:KOCN + KOH + Cl 2―→ CO 2+ N 2+ KCl + H 2O 。
若处理上述废水20 L ,使KCN 完全转化为无毒物质,至少需液氯__________g 。
答案 (1)BC (2)①B ②C (3)2 4 3 2 1 6 2 35.5解析 (1)工业废水中的废酸可加生石灰中和,属于化学变化。
CuS 、HgS 、Ag 2S 均难溶,所以加硫化物如Na 2S 可沉淀Cu 2+等重金属离子,消除污染;纯碱可加入石灰水生成CaCO 3沉淀而除去。
(2)偏铝酸钠、碱式氯化铝、氯化铁水解生成胶体,除去悬浮物,而Al 2O 3难溶于水,不能产生胶体,不能作混凝剂。
在除去悬浮物的过程中既有物理变化又有化学变化。
(3)根据KCN +2KOH +Cl 2===KOCN +2KCl +H 2O 、2KOCN +4KOH +3Cl 2===2CO 2+N 2+6KCl +2H 2O ,n (KCN)=20 L ×0.650 g·L -165 g·mol -1=0.2 mol , n (Cl 2)=0.2 mol +0.2 mol2×3=0.5 mol ,所以m (Cl 2)=0.5 mol ×71 g·mol -1=35.5 g 。
(二)废物利用5.硫酸工业中废渣称为硫酸渣,其成分为SiO 2、Fe 2O 3、Al 2O 3、MgO 。
某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH =3.7时,Fe 3+已经沉淀完全;一水合氨电离常数K b =1.8×10-5,其饱和溶液中c (OH -)约为1×10-3 mol·L -1。
