来那替尼结构式列表
赛普替尼 分子量

赛普替尼(Selpercatinib),其化学名为LOXO-292,是一种选择性RET抑制剂,用于治疗RET融合阳性的非小细胞肺癌和甲状腺癌等类型的癌症。
赛普替尼的分子式为C29H31N7O3,根据分子式计算其分子量如下:
碳(C)的原子量约为12.01,因此C29 = 29 * 12.01
氢(H)的原子量约为1.008,因此H31 = 31 * 1.008
氮(N)的原子量约为14.01,因此N7 = 7 * 14.01
氧(O)的原子量约为16.00,因此O3 = 3 * 16.00
分子量的计算公式为:
分子量= (C的数量×C的原子量) + (H的数量×H的原子量) + (N的数量×N的原子量) + (O的数量×O的原子量)
将上述数值代入计算:
分子量= (29 ×12.01) + (31 ×1.008) + (7 ×14.01) + (3 ×16.00)
分子量≈348.29 + 31.248 + 98.07 + 48.00
分子量≈525.608
所以,赛普替尼的分子量大约是525.61 g/mol。
这个计算是基于分子式中每种元素的原子量的标准值,实际分子量可能会有极小的变化,这取决于原子量的精确值。
厄洛替尼化学结构

厄洛替尼化学结构厄洛替尼(Erlotinib)是一种口服的抗癌药物,属于酪氨酸激酶抑制剂。
它是以厄洛替尼盐酸盐的形式使用,化学结构如下:厄洛替尼的化学名为N-(3-氯-4-氟苯基)-7-甲氧基-6-[3-(4-吡啶基)丙基]喹唑啉-4-胺盐酸盐。
它的分子式为C22H23N3O4•HCl,相对分子质量为429.90g/mol。
厄洛替尼的结构可以分为两个主要部分:喹唑啉环和对应位置上的苯环。
喹唑啉环是厄洛替尼基本结构的核心,它包含有氮原子和氧原子的杂环结构。
喹唑啉环上的甲氧基与3-氯-4-氟苯基相连接的烷基链相连。
苯环是四氯苯环,在喹唑啉环的3-位上连接了一个丙基链。
另外,苯环的位置4上连接了一个吡啶环。
厄洛替尼是一种酪氨酸激酶抑制剂,它通过与受体酪氨酸激酶(receptor tyrosine kinase,RTK)如表皮生长因子受体(epidermal growth factor receptor, EGFR)结合,抑制信号通路的激活,从而抑制肿瘤细胞的增殖和生长。
EGFR是一种转膜酪氨酸激酶受体,在肿瘤细胞和正常细胞上表达,它的异常激活与多种癌症的发生和发展密切相关。
厄洛替尼可以通过与EGFR的ATP结合位点竞争结合,抑制EGFR激酶的活性,并阻断下游信号通路的传递,从而抑制肿瘤细胞的增殖和生长。
厄洛替尼在临床上主要用于非小细胞肺癌(non-small cell lung cancer, NSCLC)的治疗。
它可以作为单药使用,或与其他化疗药物联合使用,用于晚期或转移性NSCLC的一线和二线治疗。
此外,厄洛替尼也被用于治疗其他类型的癌症,如胰腺癌、头颈部癌症和卵巢癌等。
厄洛替尼具有一定的不良反应,包括中性粒细胞减少、腹泻、皮疹、结膜炎、肺炎等。
在使用厄洛替尼治疗时,医生会根据患者的具体情况进行剂量的调整和不良反应的监测。
此外,对于EGFR突变的NSCLC患者,厄洛替尼的疗效可能会更好。
因此,在治疗前,医生通常会进行EGFR基因突变的检测,以指导厄洛替尼的使用。
sotyktu(氘可来昔替尼)结构式

Sotyktu是一种有机化合物的结构式,其化学式为C5H7N。
它的分子结构由五个碳原子、七个氢原子和一个氮原子组成。
Sotyktu是一种含氮的有机化合物,具有一定的化学活性和生物活性。
1. Sotyktu的结构特点Sotyktu的分子结构中包含了一个含有双键的环状结构。
其中,五个碳原子构成了一个环状结构,而一个氮原子连接在环状结构上。
这种结构使得Sotyktu具有一定的化学反应性,可以参与环状结构的开合反应以及与其他分子发生化学反应。
2. Sotyktu的化学性质由于其含有双键的环状结构,Sotyktu具有一定的反应活性。
它可以与其他分子发生加成反应、取代反应、还原反应等。
另外,Sotyktu还具有碱性,可以与一些酸性物质发生中和反应。
在适当的条件下,Sotyktu还能发生聚合反应,形成聚合物化合物。
3. Sotyktu的生物活性Sotyktu作为一种含氮的有机化合物,具有一定的生物活性。
它可以作为药物分子的前体,参与药物合成过程。
Sotyktu也可以作为农药、杀虫剂等化学品的原料,发挥杀菌、杀虫等作用。
在生物化学领域,Sotyktu的生物活性也备受关注,研究人员通过对其结构和性质的研究,探索其在生物体内的作用机制。
4. Sotyktu在工业上的应用Sotyktu作为一种有机化合物,具有丰富的化学性质和生物活性,因此在工业上具有广泛的应用价值。
它可以作为化工原料,用于合成其他有机化合物,如染料、树脂、聚合物等。
Sotyktu还可以作为表面活性剂、溶剂等在工业生产中发挥作用。
Sotyktu还可以作为催化剂参与化学反应,提高反应速率和产率。
5. Sotyktu的研究与应用前景随着对有机化合物结构和性质的深入研究,Sotyktu的研究也在不断深化。
研究人员不断探索其在医药、农药、化工等领域的应用前景,努力发掘其在新材料、新技术领域的潜在应用价值。
研究人员也在不断寻求Sotyktu的合成新方法、改变其结构、提高其性能,希望能够推动其在实际生产和应用中发挥更大的作用。
海洋天然产物喹啉类生物碱的生物活性研究进展

化学鸟住够3終2021,-------------------------------------------------------综施专论―Chemistry&Bioengineeringdoi:10.3969/j.issn.1672-5425.2021.03.001李林拮,姚彤,毛联岗,等.海洋天然产物喳啡类生物碱的生物活性研究进展[J].化学与生物工程,2021,38(3):1-5,19.LI L Z,YAO T?MAO L G,et al.Research progress in biological activity of marine natural product quinoline alkaloids[J].Chemistry &-Bioengineering,2021,38(3):1-5,19.海洋天然产物瞳咻类生物碱的生物活性研究进展李林詰1,姚彤3,毛联岗',顾娜笃季春伟笃张珍明2,",李树安2"(1.江苏海洋大学海洋科学与水产学院,江苏连云港222005;2.江苏海洋大学环境与化学工程学院,江苏连云港222005;3.连云港杰瑞药业有限公司,江苏连云港222006;4.江苏省海洋资源开发研究院,江苏连云港222005)摘要:海洋天然产物摩咻类生物碱是从海洋生物中提取的次级代谢产物,具有新颖的化学结构和广谱的生物活性,是多种新药开发研制的先导化合物。
对海洋天然产物喳咻类生物碱的来源及生物活性进行了综述,并对其发展前景进行了展望。
关键词:海洋天然产物;喳咻类生物碱;生物活性中图分类号:0629.3文献标识码:A文章编号:1672-5425(2021)03-0001-05Research Progress in Biological Activity of Marine Natural Product Quinoline Alkaloids LI Linzhe1,YAO Tong3,MAO Liangang3,GU Na2,JI Chunwei2,ZHANG Zhenming24,LI Shuan24*(1.School of Marine Science and Fisheries^Jiangsu Ocean University^Lianyungang222005,CAzna;2.School of Environmental and Chemical Engineering9Jiangsu Ocean University,Lianyungang222005,C加na;3.J A RI Pharmaceutical Co.,Lul・,Lianyungang2220069China;4.Jiangsu Institute of MarineResources Development9Lianyungang222005^China)Abstract:Marine natural product quinoline alkaloids are secondary metabolites extracted from marine organisms9which are the leading compounds for the development of a variety of new drugs with novel chemical structures and broad-spectrum biological activities.In this paper,we review the sources and biological activities of marine natural product quinoline alkaloids?and put forward a prospect of their development.Keywords:marine natural product;quinoline alkaloids;biological activity嗟咻类化合物具有优良的药理活性,在医药化学、农药等领域应用广泛。
肺癌靶向3种EGFRTKI药物的比较PPT课件

2013年 厄洛替尼一线 阿法替尼
2015年 AZD9291
2011年 阿法替尼+ 西妥 西单抗(I期)
2014年 埃克替尼一线 Ceritinib
2014年 AZD9291 CO 1686
肺腺癌驱动基因的发现背景
2007
2015
肺腺癌不再是一个疾病,而是一组疾病,需要精准治疗!
中国肺腺癌驱动基因特点
埃克替尼 125 mg Tid
(n=200)
1:1 随机
吉非替尼 250 mg qd
(n=199)
主要终点: 无进展生存期(PFS)
次要终点: • 总生存期(OS) • 客观缓解率(ORR) • 疾病控制率(DCR) • 疾病进展时间(TTP) • 生活质量(QoL) • 安全性与耐受性 探索性终点: • EGFR基因突变
EGFR-TKI 治疗晚期NSCLC的临床研究对比
研究
IPASS First-SIGNAL WJTOG 3405 NEJGSG002 OPTIMAL EURTAC LUX-LUNG 3 LUX-LUNG 6 CONVINCE
N
EGFR TKI 类型
ORR (%) PFS (月) HR PFS
261
0.58 0.28 期待
厄洛替尼与吉非替尼临床研究对比
CTONG 0901 (Erlotinib vs. Gefitinib)
ⅢB /Ⅳ 期 NSCLC
厄洛替尼
PD
150 mg/d qd
Байду номын сангаас
DNA直接测序
法证明有EGFR Exon19或21突
R 1:1†
变的 ≥18岁的成 年患者
N=256
吉非替尼 PD
盐酸杰克替尼结构

盐酸杰克替尼结构
盐酸杰克替尼是一种口服的小分子靶向药物,也被称为“靶向治疗的里程碑”。
它是一种酪氨酸激酶抑制剂,可以抑制肿瘤细胞的生长和分裂,从而达到治疗癌症的目的。
盐酸杰克替尼的化学结构非常特殊,它是一种含有苯环和吡咯环的化合物。
它的分子式为C29H30ClN7O,分子量为493.06。
它的化学名称是N-(2-(二甲基氨基)乙基)-6-(4-((4-甲基吡咯[1,5-a]吡咯-3-基)氨基)苯氧基)-4- (4-甲基吡咯[1,5-a]吡咯-3-基)吡咯[1,5-a]吡咯-3-酮盐酸盐。
盐酸杰克替尼的作用机制是通过抑制肿瘤细胞中的酪氨酸激酶,从而阻止肿瘤细胞的生长和分裂。
它主要用于治疗慢性髓性白血病、急性淋巴细胞白血病、胃肠道间质瘤和神经内分泌肿瘤等恶性肿瘤。
盐酸杰克替尼的副作用主要包括恶心、呕吐、腹泻、食欲不振、疲劳、头痛、皮疹等。
在使用盐酸杰克替尼的过程中,需要密切监测患者的血常规、肝功能和肾功能等指标,以及心电图和眼科检查等。
总的来说,盐酸杰克替尼是一种非常重要的抗癌药物,它的研发和应用为癌症治疗带来了新的希望。
但是,在使用盐酸杰克替尼的过程中,需要注意副作用的出现和监测患者的身体状况,以确保治疗的安全和有效。
厄洛替尼化学结构

厄洛替尼化学结构
厄洛替尼(Erlotinib)是一种靶向治疗药物,也被称为中文名称“威罗菲”。
化学名为N-(3-氟-4-甲氧基苯基)-6-(4-(二甲氨基)-
1-哌啶基)-4-喹啉胺。
厄洛替尼的分子式为C22H23N3O4F,分子量为429.44。
厄洛替尼作为一种表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,能够抑制EGFR和HER-2的活性,从而阻碍癌细胞生长和扩散。
在临床中,厄洛替尼主要用于非小细胞肺癌的治疗。
厄洛替尼的化学结构中,含有四个重要结构部分。
首先是喹啉结构,它是厄洛替尼的骨架结构,也是许多抗癌药物的结构基础。
其次
是哌啶结构,是厄洛替尼的一部分,可以与EGFR结合,从而抑制其活性。
第三是芳基结构,这种结构具有成键相对位置的稳定性和亲合力
强的性质,使厄洛替尼能够结合在EGFR的结合口袋中,起到抑制EGFR 活性的作用。
最后是甲氧基和氟原子,它们分别附在芳基结构上,能
够提高药物分子的亲水性和亲脂性,增强药物在体内的药效。
总之,厄洛替尼的化学结构复杂,但是其含有的四个重要结构部分使它能够具有良好的生物活性和抗癌治疗效果。
药物劳拉替尼(Lorlatinib)合成检索总结报告
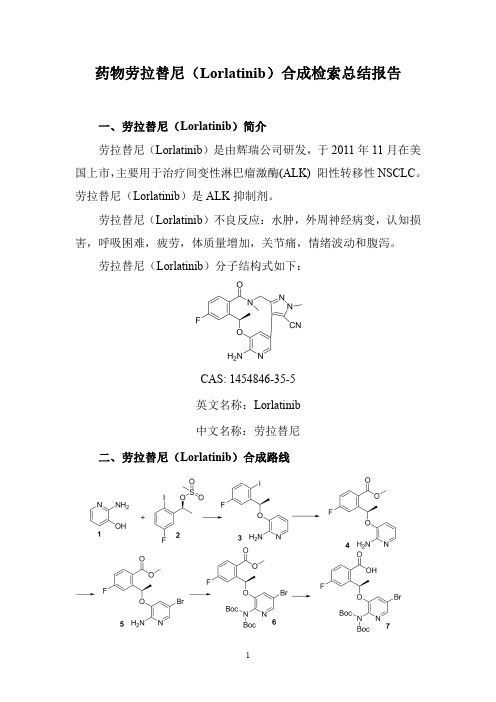
药物劳拉替尼(Lorlatinib)合成检索总结报告一、劳拉替尼(Lorlatinib)简介劳拉替尼(Lorlatinib)是由辉瑞公司研发,于2011年11月在美国上市,主要用于治疗间变性淋巴瘤激酶(ALK)阳性转移性NSCLC。
劳拉替尼(Lorlatinib)是ALK抑制剂。
劳拉替尼(Lorlatinib)不良反应:水肿,外周神经病变,认知损害,呼吸困难,疲劳,体质量增加,关节痛,情绪波动和腹泻。
劳拉替尼(Lorlatinib)分子结构式如下:CAS:1454846-35-5英文名称:Lorlatinib中文名称:劳拉替尼二、劳拉替尼(Lorlatinib)合成路线三、劳拉替尼(Lorlatinib )合成检索总结报告(一)劳拉替尼(Lorlatinib )中间体3的合成合成方法实验步骤参考文献合成方法一A suspension of Cs2CO 3(65g,201mmol)and compound 1(13.3g,121mmol)in CH 3-THF (600ml.)and acetone (300ml.)was stirred at RT for 30minutes then heated at 40°C before drop-wise addition of a solution of compound 2(34.4g,80mmol)in CH 3-THF (300ml.)via addition funnel.The resulting mixture was left stirring at 75-80°C for 24h.The reaction was then filtered through celite with MTBE,the solvents removed in vacuo and the residue purified by column chromatography over silica gel which was eluted with cyclohexane/EtOAc (9:1to 1:1)to give compound 3(14.3g,39%yield,90%ee)as a white solid.The solids were then recrystallised from heptane/EtOAc to give compound 3(10.8g,37%yield,95%ee).WO2013/132376;(2013);(A1)English;Journal of MedicinalChemistry ;vol.57;nb.11;(2014);p.4720–4744;WO2014/207606;(2014);(A1)English(二)劳拉替尼(Lorlatinib )中间体4的合成合成方法实验步骤参考文献Compound 3(20g,57mmol)was dissolved in methanol (300mL),and sequentially treated with triethylamine (15.4mL,113mmol)and PdCl 2(dppf)(4.1g,5.7mmol).ThisWO2013/132376;(2013);(A1)English;合成方法一mixture was heated at 100°Cfor 16hours,under a 100psi carbon monoxide atmosphere.LCMS indicated consumption of starting material.The reaction mixture was filtered through a pad of Celite,and the filtrate evaporated to a brown oil.The crude product was purified by flashchromatography over silica gel which was eluted with 50%to 75%ethyl acetate in cyclohexane,affording the pure product 4as a brick-red solid (13.0g,79%yield).WO2014/207606;(2014);(A1)English;Angewandte Chemie -International Edition ;(2016);p.3590–3595.(三)劳拉替尼(Lorlatinib )中间体5的合成合成方法实验步骤参考文献合成方法一Compound 4(13.0g,45mmol)was dissolved in acetonitrile (195mL),and cooled to <10°C in an ice water bath.NBS (7.9g,45mmol)was added drop-wise to the cooled reaction mixture as a solution in acetonitrile (195mL),monitoring the internal temperature to ensure it did not rise above 10°C.After addition was complete,the mixture was stirred for 15minutes.TLC (1:1cyclohexane/ethyl acetate)showedconsumption of starting material.The reaction mixture was evaporated,and the residue redissolved in ethyl acetate (400mL),and washed with 2M aqueous NaOH (2x 300mL),and 10%aqueous sodium thiosulfate solution (300mL).The organic extracts were dried over MgSO 4,and evaporated to a red oil (17.6g).The crude product was purified over silica gel,which was eluted with 10%to 50%ethyl acetate in cyclohexane,which gave compound 5(12.0g,73%yield).WO2013/132376;(2013);(A1)English;Journal of MedicinalChemistry ;vol.57;nb.11;(2014);p.4720–4744;WO2014/207606;(2014);(A1)English(四)劳拉替尼(Lorlatinib )中间体6的合成合成方法实验步骤参考文献合成方法一To a solution of compound 5(30g,81.3mmol)in DCM (325mL)was added DIEA (42.5mL,244mmol),DMAP (1.99g,16.3mmol)and (Boc)2O (53.2g,244mmol).The reaction was stirred overnight,and then concentrated.Purification by column chromatography over silica gel (0-25%EtOAc/heptane)afforded compound 6(39.3g,85%)as a viscous gum.WO2013/132376;(2013);(A1)English合成方法二To a solution of compound 7(2000g,5.4mol)in dry DCM (dichloromethane)(32000mL)was added DIPEA (N.N-dsisopropyleibylamine)(2100g,16.28mol)andDMAP (4-dimethylaminopyridine)(132g,1.08mol).Then Boc20(di-tert-butyl-dicarbonate)(3552g,16.28mol)was added to the mixture in portions.The reaction was stirred at RT for overnight.TLC (petroleum ether/EtOAc =5:1)show the reaction was complete,the mixture was washed with sat.NH4CI (15L)two times,then dried over Na2S04and concentrated to give a crude product which was puri ‐fied by column (silica gel,petroleum ether/EtOAc from 20:1to 10:1)to give compound 8(2300g,75%)as a white solid.WO2014/207606;(2014);(A1)English(五)劳拉替尼(Lorlatinib )中间体7的合成合成方法实验步骤参考文献合成方法一Compound 6(50g,87.81mmol,100mass%)was charged to a round bottom flask (RBF)containing tetrahydrofuran (12.25mol/L)in Water (5mL/g,3060mmol,12.25mol/L)and sodium hydroxide (1mol/L)in Water (1.5equiv.,131.7mmol,1mol/L).The biphasic mixture was stirred at RT for 14hours.1N HCl was added to adjust pH to <2.THF was then removed by vacuum distillation.The productprecipitated out was collected by filtration.The filter cake was rinsed with water,pulled dried then dried in vacuum oven to constant weight (48h,55°C,25mbar).48.3g isolated,99%yield.WO2014/207606;(2014);(A1)English (六)劳拉替尼(Lorlatinib )中间体9的合成合成方法实验步骤参考文献合成方法一To a reaction vesselunder N 2were charged compound 7(9.97kg,17.95mol),compound 8(3.52kg,18.85mol)and 2-methyltetrahydrofuran (97L).Triethylamine (7.45kg,73.6mol)was added while keeping the internal temperature below 35°C.The reaction mixture was held for 30min and n-propylphosphonic anhydride (T3P),50%solution in ethyl acetate (22.85kg,35.9mol)was charged slowly,maintaining the internal temperature below 25°C.The reaction mixture was held at 20°C for at least 2h until reaction was deemed complete.Ethyl acetate (35L)and water (66L)were added followed by 0.5N Hydrochloric acid solution (80L).The aqueous layer was removed and the organic layer was washed with brine solution (80L).The organic layer was concentrated and solvent exchanged with 2-methyl-2-butanol (80L)give compound 9(23wt/wt%)solution in 2-methyl-2-butanol .This solution was carried forward to the next step directly in three batches,assuming 12.00kg (100%yield)from this step.WO2014/207606;(2014);(A1)English(七)劳拉替尼(Lorlatinib )中间体10的合成合成方法实验步骤参考文献2-Methyl-2-butanol (100L)was combined with potassium acetate (1.8kg,18.34mol),palladium(ll)acetate (0.10kg,0.46mol)and water (0.10kg,5.73mol).The resulting mixture was purged with nitrogen.Di(1-adamantyl)n-butylphosphine (0.23kg,0.43mol)was added.An amount of 20%of compound 9(3.97kg active or 17.3L of step 1WO2014/207606;合成方法一solution in 2-methyl-2-butanol)was added,and the resulting reaction mixture was heated at reflux for 2h.The remaining solution of compound 9in 2-methyl-2-butanol wassubsequently added to the reaction over a period of 5h.The resulting mixture was heated until the reaction was deemed complete (typically 16-20h).This reaction step wasprocessed in three batches,and the isolation was done in one single batch.Thus,the combined three batches were filtered through CELITE to remove insoluble materials.The filtrate was concentrated to a low volume (approximately 20L).Acetonitrile (60L)was added.The resulting mixture was heated to reflux for 2-4h,then cooled to RT for granulation.The resulting slurry was filtered to give compound 26as a crude product.The crude product was combined with ethyl acetate (80L)and Silicycle thiol (5kg).The resulting mixture was heated for 2h,cooled to RT and filtered.The filtrate was concentrated to approx.20L,and the resulting slurry was granulated and filtered.The filter cake was rinsed with ethyl acetate (4L)and dried in a vacuum oven to give compound 10as a pure product (4.74kg,43.5%overall last two steps)(2014);(A1)English ;WO2019/209633;(2019);(A1)English(八)劳拉替尼(Lorlatinib )11的合成合成方法实验步骤参考文献合成方法一Into a 100mL Easymax reactor equipped with an overhead stirrer,was added the bis-Boc protected macrocycle 10(7g,10mmol)and methanol (28mL).The slurry was heated to 60°C and treated with 6N hydrochloric acid (9mL,54mmol)and held for 3hours.Once reaction was determined complete,the mixture was cooled to 40°C and treated with 1N sodium hydroxide (39mL,39mmol)to partially neutralize the mixture.The mixture was treated with2-methyltetrahydrofuran (53mL),followed by neutralization to pH 7with 1N sodium hydroxide (13.5mL,13.5mmol).The mixture was treated with sodium chloride (10.1g,173mmol)and warmed to 60°C.The bottom aqueous layer wasWO2017/21823;(2017);(A1)Englishremoved using a separatory funnel.The organic phase was washed with water(50mL)at60°C.The water wash was removed by separatory funnel.The organic layer was speck free filtered into a clean125mL reactor fitted with overhead agitator and distillation head.Additional2-methyltetra-hydrofuran(70mL)was added to the organic mixture and the mixture was concentrated by atmospheric distillation to a volume of approximately30mL.The solution was treated with2-methyltetrahydrofuran(12mL)and adjusted to60°C. The solution was treated with n-heptane(10.5mL),followed by seeding with Form11of lorlatinib free base(45mg,0.11 mmol).After aging the slurryfor1hour,n heptane(73.5mL)was added over2hours at 60°C.The resultant slurry was held for1hour at60°C followed by cooling to20°C over1hour and granulated for 16hours.The slurry was filtered,and the product cake was washed with n heptane(12mL).The solids were dried in the oven at60°C for12hours to give Form7ofPF-0463922free base(8.24mmol,3.36g)as a white solid in 82%yield with>98%purity合成方法二To a reactor under N2was added compound10(4.74kg,7.82mol)and ethyl acetate(54L).Hydrochloric acid37%(5.19L,63.2mol)was charged slowly while keeping theinternal temperature below25°C.The reaction mixture wasstirred for24-48h until the reaction was complete.Ethylacetate(54L)and water(54L)were added.The reactionmixture was then treated with triethylamine until pH8-9was reached.The aqueous layer was removed and then theorganic layer was washed water(2x54L).The organiclayer was concentrated under reduced pressure to approx.54L to give compound11(unisolated).WO2014/207606;(2014);(A1)English合成方法三10(3.68grams,6.07mmol)was dissolved in ethyl acetate(18.4mL)and37%HCl was added dropwise while keepingthe internal temperature below28°C.The reaction mixturewas stirred for17hours to complete Boc-deprotection.Tothe reaction mixture,water(40ml)was added and layerswere separated at pH<1.Then,to the aqueous layer,freshethyl acetate(40mL)was added and pH was adjusted to pH9.2using saturated solution of yers wereseparated and organic layer was dried at anhydrous Na2SO4and evaporated to dryness.The evaporated residuecontaining0.8grams of Lorlatinib was dissolved in methanol(1.6mL),then water(1.6mL)was added and reactionsuspension was warmed to reflux temperature and stirred forWO2019/209633;(2019);(A1)English1hour.The obtained solution was then cooled atroom tem-perature for 2-3hours and oiling out was occurred.The mixture was then warmed again to reflux temperature for about half an hour and left cool down slowly to roomtemperature overnight.Oiling out was occurred again and the mixture was stirred for one day at room temperature and crystallization was occurred.The resulting suspension was filtered off and dried at room conditions (open Petri dish at about 20-25°C and 30-40%relative humidity)yielding 676mg of crystalline Lorlatinib form Z (water content by KF 9.4%)额外另附(九)劳拉替尼(Lorlatinib )中间体12的合成合成方法实验步骤参考文献合成方法一To a solution of compound 5(10g,27mmol)in MeOH (150mL)were added a solution of NaOH (5.42g,13.55mmol)in water (40mL).The mixture was heated at 40°C for 10h.Then cooled and evaporated under reduced pressure.The residue was added water (150mL)and extracted with EA (50mL).The aqueous phase was adjusted to pH about 7and extracted withEA (50mL*3).The combined organic phase was washed with brine,dried with Na 2SO 4and evaporated under reduced pressure to provide compound 12(9.5g,98.7%yield)as a light yellow solid.WO2018/137679;(2018);(A1)English合成方法二To a solution of compound 5(400mg,0.961mmol)in MeOH,was added 2M NaOH (1.0mL,2.0mmol).The mixture was stirred at room temperature.After 6hours,the reaction was only -20%complete by LCMS.Additional 4M NaOH (1.0mL,4.0mmol)was added.The mixture was stirred at room temperature.After 11h,the reaction was complete.About 70%of the solvent was removed under reduced pressure and the residue was adjusted to pH =~7with 2N HCI.The precipitate was collected throughfiltration and rinsed with MeOH/water to afford compound 12as a solid (321mg,83%yield).WO2013/132376;(2013);(A1)English额外另附(十)另附劳拉替尼(Lorlatinib )中间体13的合成合成方法实验步骤参考文献合成方法一To a solution of compound 8(8.4g,45.07mmol),HATU (17.12g,45.07mmol)and DIEA (14.53g,112.68mmol)in DMF (200mL)was added compound 12(10.0g,28.17mmol)under N 2with ice-water bath.The mixture was stirred overnight at room temperature.Water (500mL)was was added and extracted with EA (100mL*3).The combined organic phase was washed with brine,dried with Na 2SO 4and evaporated under reduced pressure.The residue was purified by silica gel column chromatography (PE:EA =2:1to 1:1,v:v)to provide compound 13(10.0g,73%yield)as an off-white solid.WO2018/137679;(2018);(A1)English。
氘可来昔替尼结构式

氘可来昔替尼是一种处方药,用于治疗重度骨关节炎,类风湿性关节炎等症状。
它具有如下结构式:
其中,分子式为C21H24O6,由碳、氢、氧三种元素组成。
其结构式包括基团和键,反映了分子中原子的连接方式。
氘可来昔替尼是一种复杂的有机化合物,具有多个官能团和化学键。
其中,碳原子之间通过共价键相连形成碳链或碳环,氢原子位于碳原子上,而氧原子则与碳原子形成羧基。
这些基团和键的组合方式决定了氘可来昔替尼的化学性质和生物学活性。
氘可来昔替尼的结构式中,存在多种化学键,包括碳-碳键、碳-氢键和羧基中的碳-氧键。
这些化学键的存在和强度影响了氘可来昔替尼的物理和化学性质,如溶解度、稳定性、酸碱性等。
同时,氘可来昔替尼的结构式还反映了其分子内的相互作用力和分子间的相互作用力,这些因素对于药物的代谢动力学性质和药效学作用具有重要影响。
总之,氘可来昔替尼的结构式反映了该药物的化学组成、结构和性质。
通过研究氘可来昔替尼的结构式,我们可以更好地了解该药物的化学性质、生物学活性、代谢动力学性质和药效学作用,为药物的开发、制备、质量控制和临床应用提供科学依据。
然而,需要强调的是,氘可来昔替尼作为一种处方药,其使用应当在医生的指导下进行,且需要根据患者的具体情况进行剂量和疗程的调整。
同时,氘可来昔替尼也存在一些副作用和不良反应,如胃肠道反应、过敏反应等,在使用过程中应当密切关注患者的身体状况,及时调整治疗方案。
药物Neratinib(来那替尼)合成检索总结报告

药物Neratinib(来那替尼)合成检索总结报告一、Neratinib(来那替尼)简介Neratinib(来那替尼)于2017年7月在美国上市,主要用于阳性乳腺癌成人患者的延长辅助治疗。
Neratinib(来那替尼)常见的不良反应有腹泻、恶心、腹痛、乏力、呕吐、皮疹等等。
Neratinib(来那替尼)分子结构式如下:CAS:698387-09-6CAS:915942-22-2英文名称:Neratinib英文名称:Neratinib Maleate中文名称:来那替尼中文名称:来那替尼马来酸盐本文主要对Neratinib(来那替尼)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、Neratinib(来那替尼)合成路线(中间体其他合成路线请参考总结报告)三、Neratinib (来那替尼)合成检索总结报告(一)Neratinib (来那替尼)中间体3的合成合成方法实验步骤参考文献操作方法一50mmolof 3-aminoacrylonitrile 2,50mmol solid base catalyst ZrO 2-Cr 2O 3and 50mL of tetrahydrofuran was added to the reaction flask,Stir at room temperature,a mixture of 55mmol of methyl 4-ethoxy-2-chloro-5-nitrobenzoate 1and 15mL of tetrahydrofuran was added dropwise to the above reaction flask,after the reaction was stirred at room temperature for 2h,Then reflux 2h,After cooling the catalyst was filtered,The catalyst can be reused after drying.The solvent was distilled off under reduced pressure,To the residue was added 400mL of dichloromethane,Wash with 50mL of distilled water three times,The combined organic layers,After drying over anhydrous sodium sulfate,the solvent was distilled off under reduced pressure,The compound of formula (3).Yield 87%.CN106905234;(2017);(A)Chinese (二)Neratinib (来那替尼)中间体4的合成合成方法实验步骤参考文献40mmol of compound 3,40mmol anhydrous potassium carbonate and 40mL DMF was added to the reaction flask,CN106905234;操作方法一The reaction was stirred at50~60o C for 4h,cool to room temperature,Add 60mL of water,Stirring 0.5h,The precipitated solid was filtered,The crude solid was recrystallized from ethanol,Drying under reduced pressure to obtain compound of formula (4).Yield 90%.(2017);(A)Chinese(三)Neratinib (来那替尼)中间体5的合成合成方法实验步骤参考文献操作方法一A mixtureof 20g (77mmol)of 4-hydroxy-7-ethoxy-6-nitroquinoline-3-carbonitrile 4was refluxed with 120mL of POCl 3under N 2for 2hours.The mixture was cooled to room temperature and excess POCl 3was removed in vacuo.The residue was then cooled in an ice bath and 500mL of CH 2Cl 2was slowly added to dissolve the residue.The resulting solution was added to a flask containing 250mL of ice-cold saturated K 2CO 3and stirred for 30minutes.The organic layer was extracted,washed,dried over MgSO 4and evaporated to give 18g (86%)of the title compound 5as an off-white solid mp 200-202°2018/208584;(2018);(A1)English 操作方法二A mixture of 3.45g (13mmol)of 7-Ethoxy-4-hydroxy-6-nitro-quinoline-3-carbonitrile 4,5.55g (26mmol)of phosphorous pentachloride,and 10ml of phosphorous oxychloride was refluxed for 3hours.The mixture was diluted with hexane and the solid was collected.The solid was dissolved in 500ml of ethyl acetate and washed with cold diluted sodium hydroxide solution.The solution was dried over magnesium sulfate and filtered through a pad of silica gel.The solvent was removed giving 2.1g of beige solid 5.EP1950201;(2008);(A1)English;EP1117659;(2003);(B1)English;EP973746;(2003);(B1)English(四)Neratinib (来那替尼)中间体6的合成合成方法实验步骤参考文献50mmol of compound of formula (5),100mL ethanol and 100mL distilled water was added to the reaction flask,The system temperature was raised to 50o C,Followed by adding。
甲磺酸仑伐替尼胶囊说明书.pdf
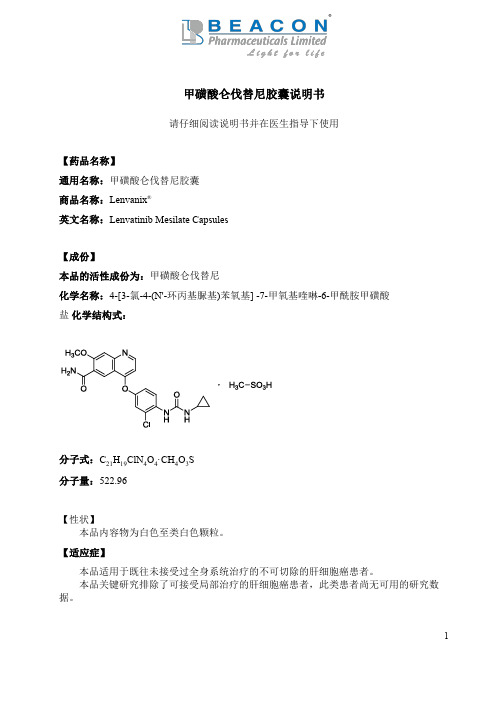
甲磺酸仑伐替尼胶囊说明书请仔细阅读说明书并在医生指导下使用【药品名称】通用名称:甲磺酸仑伐替尼胶囊商品名称:Lenvanix®英文名称:Lenvatinib Mesilate Capsules【成份】本品的活性成份为:甲磺酸仑伐替尼化学名称:4-[3-氯-4-(N'-环丙基脲基)苯氧基] -7-甲氧基喹啉-6-甲酰胺甲磺酸盐化学结构式:分子式:C21H19ClN4O4·CH4O3S分子量:522.96【性状】本品内容物为白色至类白色颗粒。
【适应症】本品适用于既往未接受过全身系统治疗的不可切除的肝细胞癌患者。
本品关键研究排除了可接受局部治疗的肝细胞癌患者,此类患者尚无可用的研究数据。
【规格】4mg (按C21H19ClN4O4计算)【用法用量】推荐剂量对于体重<60 kg的患者,本品推荐日剂量为8 mg(2粒4 mg胶囊),每日一次;对于体重≥60 kg的患者,本品推荐日剂量为12 mg(3粒4 mg胶囊),每日一次。
应持续治疗至疾病进展或出现不可耐受的毒性反应。
给药方法口服。
本品应在每天固定时间服用,空腹或与食物同服均可。
本品应整粒吞服,也可以将本品(不能将其打开或压碎)与一汤匙水或苹果汁在玻璃杯中混合,形成混悬剂。
胶囊必须在液体中停留至少10分钟,搅拌至少3分钟以溶解胶囊壳,然后吞服混悬剂。
饮用后,必须将相同量的水或苹果汁(一汤匙)加入玻璃杯中,搅拌数次,然后喝完玻璃杯中所有的液体。
如果患者遗漏一次用药且无法在12小时内服用,无需补服,应按常规用药时间进行下一次服药。
在对本品进行剂量调整(暂停、减量)之前,应积极治疗恶心、呕吐和腹泻等不良反应;应积极治疗胃肠毒性反应,以减少肾功能不全或肾衰竭发生的风险(参见【注意事项】)。
监测、剂量调整和停药可能需要暂停给药、调整剂量或停止本品治疗来管理某些不良反应。
轻度至中度不良反应(例如1级或2级)一般无需暂停给药,除非积极治疗后,患者仍不耐受。
来那度胺胶囊Lenalidomide-详细说明书与重点

来那度胺胶囊Lenalidomide英文名:Lenalidomide Capsules汉语拼音:Lainaduan Jiaonang【成份】本品主要成份为:来那度胺。
化学名称:化学名称:3-(4’-氨基-1-氧-1,31,3-二氢-2H-异吲哚异吲哚-2-基)哌啶基)哌啶基)哌啶-2,62,6-二酮。
化学结构式:分子式:C13H13N3O3分子量:259.3【性状】本品为硬胶囊,内容物为白色至类白色粉末。
【适应症】本品与地塞米松合用,治疗曾接受过至少一种疗法的多发性骨髓瘤的成年患者。
【规格】(1)5mg(2)10mg (3)25mg【用法用量】必须在有多发性骨髓瘤治疗经验的医生监督下开始并提供治疗用药。
若患者的中性粒细胞绝对计数(ANC)<1.0×109/L,和/或血小板计数<50×109/L,则不得开始本品的治疗。
推荐剂量:本品的推荐起始剂量为25mg。
在每个重复28天周期里的第1~21天,每日口服本品25mg,直至疾病进展。
地塞米松的推荐剂量为在每28天治疗周期的第1、8、15和22天口服40mg地塞米松。
处方医生应根据患者的肾功能状况谨慎选择本品的起始剂量和随后的剂量调整(见表1),应根据患者的年龄选择地塞米松的起始剂量和随后的剂量调整(见表2)。
表1:按照肾功能状况确定来那度胺的起始剂量表2:按照年龄确定地塞米松的起始剂量本品应于每天大致相同的时间服用。
不应打开、破坏和咀嚼胶囊,应将胶囊完整吞服,最好用水送服,可与食物同服也可空腹服用。
若某次错过规定的服药时间小于12小时,患者可补服该次用药。
若某次错过规定的服药时间大于12小时,则患者不应再补服该次用药,而应在第二天的正常服药时间服用下一剂量。
不要因为漏服而同时服用2日的剂量。
【不良反应】1.MM-009和MM-010研究中复发/难治性多发性骨髓瘤患者的安全性数据总结在2项关键性、安慰剂对照的III期临床研究(MM-009和MM-010)中,来那度胺的剂量为:每28天周期中的第1~21天每日口服来那度胺25mg。
甲磺酸特拉替尼结构式

甲磺酸特拉替尼结构式
甲磺酸特拉替尼是一种化学物质,其结构式如下所示:
C₁₆H₁₆N₆O₄S.
这个结构式展示了甲磺酸特拉替尼分子中每个原子的排列方式。
其中,C代表碳,H代表氢,N代表氮,O代表氧,S代表硫。
这种
结构式可以帮助化学家们理解甲磺酸特拉替尼分子的化学特性,以
及它与其他化合物之间的相互作用。
甲磺酸特拉替尼是一种酪氨酸激酶抑制剂,常用于治疗特定类
型的白血病和其他恶性肿瘤。
它的结构式对于理解其药理学和药物
代谢具有重要意义。
总的来说,甲磺酸特拉替尼的结构式为C₁₆H₁₆N₆O₄S,
这种结构式有助于科学家和药物研究人员了解该化合物的化学特性
和药理学作用。
巴瑞替尼 结构式

巴瑞替尼结构式全文共四篇示例,供读者参考第一篇示例:巴瑞替尼是一种针对癌症治疗的药物,其分子式为C20H19FN4O2,结构式如下:巴瑞替尼通过抑制有丝分裂期激酶Bcr-Abl,从而阻止癌细胞的增殖和扩散。
巴瑞替尼最初被开发用于治疗慢性粒细胞白血病(CML),是第一个针对特定致癌基因的靶向治疗药物,也被广泛应用于其他类型的癌症治疗。
巴瑞替尼的结构式可以帮助我们理解其分子结构,从而更好地理解其药理作用和药效。
巴瑞替尼的分子式为C20H19FN4O2,这意味着其由20个碳原子、19个氢原子、1个氟原子、4个氮原子和2个氧原子组成。
在巴瑞替尼的结构式中,可以看到有一个含氮的芳香环,一个氟原子连接在芳香环上,还有一个氧原子连接在另一个芳香环上。
这些结构特征对于巴瑞替尼的药理作用起着重要的作用,有助于其与靶标的结合以实现治疗作用。
巴瑞替尼是一种重要的抗癌药物,通过其特定的分子结构和药理作用,为患者提供了一种有效的治疗选择。
希望通过对巴瑞替尼结构式的认识,能更加深入地了解这种药物及其在癌症治疗中的应用。
第二篇示例:巴瑞替尼(Baricitinib)是一种新型的治疗风湿性关节炎和其他自身免疫性疾病的药物,属于Janus激酶(JAK)抑制剂。
它是一种口服药物,用于在其他疾病治疗方案无效或不耐受时进行治疗。
巴瑞替尼的化学结构式如下:巴瑞替尼的分子式为C16H17N7O2S,分子量为371.42克/摩尔。
它是一种微量化合物,主要通过口服给药获得,通过肝脏代谢,极少通过尿液排泄。
巴瑞替尼通过抑制JAK1和JAK2两种重要的信号传导蛋白来发挥其治疗作用。
JAK蛋白是一种激酶,参与了细胞内的信号传导路径的调节。
通过抑制JAK1和JAK2,巴瑞替尼可以降低炎症和自身免疫反应,从而减轻疾病症状,改善患者的生活质量。
白血病第三代BCR-ABL酪氨酸激酶抑制剂:普纳替尼

⽩⾎病第三代BCR-ABL酪氨酸激酶抑制剂:普纳替尼普纳替尼于2012年12⽉14⽇获F D A批准上市,⽤于A B L T315I突变的慢性粒细胞⽩⾎病(C ML)或费城染⾊体阳性(P h+)的急性淋巴细胞⽩⾎病(A L L)患者的治疗,也可⽤于对以往酪氨酸激酶抑制剂(T K I)耐药或不耐受的C ML或P h+A L L患者的治疗。
商品名:I C L U S I G通⽤名:p o n a t i n i b(普纳替尼)靶点:A B L⼚家:A r i a d规格:15m g、30m g、45m g美国获批:2012年12⽉获批适应症:C M L、P h+A L L推荐剂量:每⽇⼀次,每次45m g,随餐或不随餐服⽤临床数据普纳替尼在C ML和P h+A L L患者中的安全性和有效性在⼀个单臂、开放、国际、多中⼼试验中进⾏了评估。
所有患者均接受普纳替尼(每次45mg,每⽇⼀次)治疗。
C P-C ML的主要疗效终点是主要细胞遗传学反应(MC y R),包括完全和部分细胞遗传学反应(C C y R和P C y R)。
A P-C ML、B P-C ML和P h+A L L的主要疗效终点均为主要⾎液学反应(Ma H R),定义为完全⾎液学反应(C H R)或⽆⽩⾎病证据(N E L)。
MC y R:即主要细胞遗传学反应,定义为含有费城染⾊体的细胞⽐例在0-35%之间。
C C y R:即完全细胞遗传学反应,定义为费城染⾊体消失或B C R-A B L1⽔平在1%-0.1%。
MMR:即主要分⼦遗传学反应,定义为B C R-A B L1⽔平⼩于0.1%。
C H R:即完全⾎液学反应,定义为⾎细胞计数正常,未发现异常⾎细胞。
⼊组患者的⼈群特征为:中位年龄59岁;53%的患者为男性;13%为亚洲⼈,6%为⿊⼈或⾮裔美国⼈,79%为⽩⼈,3%为其他种族;92%的患者E C OG评分为0或1;从诊断到⾸次给药的中位时间为6.1年;88%的患者对之前的T K I 耐药;55%的患者存在⼀个或多个B C R-A B L激酶域突变;7%的患者之前接受过1种T K I治疗,37%的患者之前接受过2种T K I治疗,56%的患者之前接受过3种或以上T K I治疗。
