必修1 专题1 第三单元
高一化学必修 第一册 2020版(苏教版)

专题2 研究物 质的基本方法
专题2 研究物质的 基本方法
第一单元 研究物质的实验方法 第二单元 溶液组成的定量研究 第三单元 人类对原子结构的认识
专题3 从海水中 获得的化学物质
专题3 从海水中获 得的化学物质
第一单元 氯气及氯的化合物 第二单元 金属钠及钠的化合物 第三单元 海洋化学资源的综合应 用
专题4 硫与环 境保护
专题4 硫与环境保 护
第一单元 含硫化合物的性质 第二单元 硫及其化合物的相互转 化 第三单元 防治二氧化硫对环境的 污染
专题5 微观结构 与物质的多样性
专题5 微观结构与 物质的多样性
第一单元 元素周期律和元素周期 表 第二单元 微粒之间的相互作用 第三单元 从微观结构看物质的多 样性
高一化学必修 第一册 2020 版(苏教版)
演讲人
202X-06-08
目录
01. 专题1 物质的分类及计量
02. 专题2 研究物质的基本方法
03.
专题3 从水中获得的化学物质
04. 专题4 硫与环境保护
05.
专题5 微观结构与物质的多样性
专题1 物质的 分类及计量
专题1 物质的分类 及计量
第一单元 物质及其反应的分类 第二单元 物质的化学计量 第三单元 物质的分散系
2020
感谢聆听
苏教版(2020版)高中化学课程目录(必修1-2,选修1-3)

9 第二单元 芳香烃
10 专题4 生活中常用的有机物一烃的含氧衍生物
11 第一单元 醇和酚
12 第二单元 醛 羧酸
13 专题5 药物合成的重要原料——卤代烃、胺、酰胺
14 第一单元 卤代烃
15 第二单元 胺和酰胺
16 第三单元 有机合成设计
17
专题6 生命活动的物质基础——糖类、油脂、蛋白 质
18 第一单元 糖类和油脂
18 第一单元 元素周期律和元素周期表
19 第二单元 微粒之间的相互作用力
20 第三单元 从微观结构看物质的多样性
序号
必修第二册
1 专题6 化学反应与能量变化
2 第一单元 化学反应速率与反应限度
3 第二单元 化学反应中的热
4 第三单元 化学能与电能的转化
5 专题7 氮与社会可持续发展
备注 备注
6 第一单元 氮的固定
19 第二单元 蛋白质
7 第二单元 重要的含氮化工原料
8 第三单元 含氮化合物的合理使用
9 专题8 有机化合物的获得与应用
10 第一单元 化石燃料与有机化合物
11 第二单元 食品中的有机化合物
12 第三单元 人工合成有机化合物
13 专题9 金属与人类文明
14 第一单元 金属的冶炼方法
15 第二单元 探究铁及其化合物的转化
6 第一单元 原子核外电子的运动
7 第二单元 元素性质的递变规律
8 专题3 微粒间作用力与物质性质
9 第一单元 金属键 金属晶体
10 第二单元 离子键 离子晶体
11 第三单元 共价键 共价晶体
12 第四单元 分子间作用力 分子晶体
13 专题4 分子空间结构与物质性质
14 第一单元 分子的空间结构
高中化学三维设计江苏专版必修一讲义:专题1第三单元人类对原子结构的认识含答案

第三单元人类对原子结构的认识——————————————————————————————————————[课标要求]1.了解人类对原子结构的认识过程。
2.掌握原子的构成,深刻理解构成原子的三种微粒间的关系。
3.知道核素的涵义,认识元素、同位素、核素三者之间的关系,并学会正确判断同位素。
1.原子结构模型先后经历了道尔顿、汤姆生、卢瑟福、玻尔等多位科学家的研究。
2.在化学反应中原子核不发生变化,原子的最外层电子数可能发生变化。
3.A Z X表示一个质量数为A,质子数为Z的原子,其中子数为A-Z。
4.同种元素(质子数相同)的不同原子(中子数不同)互称同位素。
核素的种类与原子种类相同。
原子结构模型的演变1.古希腊原子学说万物由间断的、不可分的原子构成,原子的结合和分离是万物变化的根本原因。
2.道尔顿原子学说19世纪初,道尔顿认为,物质由原子构成,原子不能被创造,不能被毁灭,在化学变化中不可再分割。
3.汤姆生原子结构模型1897年,汤姆生发现原子中存在电子,并提出了一个“葡萄干面包式”的原子结构模型。
4.卢瑟福原子结构模型原子由原子核和核外电子构成,原子核带正电荷,电子带负电荷,在原子核周围做高速运动。
5.玻尔原子结构模型原子核外,电子在一系列稳定的轨道上运动,每个轨道都有一个确定的能量值。
6.现代原子结构学说——电子云模型原子核外电子的运动不遵循经典力学的原理,必须用量子力学方法描述核外电子的运动。
1.提出原子结构模型的科学家,从时间的先后顺序来看,下列排列正确的是() A.汤姆生、玻尔、卢瑟福、道尔顿B.汤姆生、玻尔、道尔顿、卢瑟福C.卢瑟福、道尔顿、汤姆生、玻尔D.道尔顿、汤姆生、卢瑟福、玻尔解析:选D19世纪初,道尔顿提出了原子学说;1904年汤姆生提出了一个被称为“葡萄干面包式”的原子结构模型;1911年卢瑟福提出了带核的原子结构模型;1913年玻尔提出了新的原子结构模型。
2.如图所示的原子结构模型的演变图中,(1)为道尔顿实心球式原子模型,(2)为卢瑟福行星运转式原子模型,(3)为汤姆生葡萄干面包式原子模型,(4)为近代量子力学原子模型,(5)为玻尔轨道式原子模型。
人民版历史必修1:专题一.三

栏目 导引
专题一
古代中国的政治制度
【综合探究】
(1)材料1中图一反映了秦朝的
中央制度存在什么矛盾?依据图二说明唐代
是如何解决这一矛盾的?此解决措施起到什
么作用? (2)材料2中元朝设置的中书省与唐朝的中书省 有何不同?
栏目 导引
专题一
古代中国的政治制度
【思路引领】
(1)本题考查学生的史料阅读
能力,着重于对专制主义中央集权下君权与相
不断加强,相权逐渐削弱。
栏目 导引
专题一
古代中国的政治制度
但作为一种比较成熟、完备的政治制度,三 省六部制的进步作用还是十分明显的。学习 时要结合唐以后各朝代君权、相权的矛盾斗 争,中央官制的损益变化,全面认识中国古 代政治制度的显著特点。
栏目 导引
专题一
古代中国的政治制度
跟踪训练 三省六部制完善了自秦朝以来的中央集权制
1.形成与演变:魏晋南北朝时期逐步形成三
省体制;隋朝在继承魏晋以来中央行政制度 的基础上创立了三省六部制;唐朝时三省分工 明确,中书省掌决策,门下省掌审议,尚书省负责 执行政令,三省长官都是宰相。隋唐时期,
尚书省下设吏、户、礼、兵、刑、工六部。
栏目 导引
专题一
古代中国的政治制度
2.特点:三省六部制是在继承和发展前代政
专题一
古代中国的政治制度
四、选官制度的历史变化 贵族 1.世官制:将官职限定在_______范围内, 由贵胄子弟世代继承祖上的权位。 2.察举制
中央 (1)含义:是由官吏察访合适的人才向_____推
荐,最后由中央予以任用的选官制度。
栏目 导引
专题一
古代中国的政治制度
(2)演变:①汉武帝即位后,诏令中央和地方 的主要行政长官向朝廷举荐人才,后又规定
新教材高中化学专题1物质的分类及计量第三单元物质的分散系第1课时常见分散系胶体学生用书苏教版必修

第三单元物质的分散系第1课时常见分散系胶体课程目标1.了解分散系的概念及分散系的种类。
2.知道胶体是一种常见的分散系。
3.了解胶体的主要性质和应用。
图说考点学业基础——自学·思记·尝试[新知预习]1.分散系(1)分散系概念:把由一种或几种物质(称为分散质)分散到另一种物质(称为分散剂)中形成的混合物体系,称为分散系。
(2)按分散质、分散剂状态进行分类,共有__________种组合。
按分散质粒子大小分类:(3)分类{2.胶体________________________________[即时自测]1.判断正误,正确的打“√”,错误的打“×”(1)直径在10-9~10-7 m之间的粒子称为胶体。
( )(2)胶体都是均匀透明的液体。
( )(3)胶体一般比较稳定,不易产生沉淀。
( )(4)分散质粒子直径大小在几纳米到几十纳米之间的分散系是胶体。
( )(5)根据是否产生丁达尔效应,将分散系分为溶液、胶体与浊液。
( )(6)NaCl溶液、水、泥浆、淀粉溶液都属于胶体。
( )(7)FeCl3溶液呈电中性,Fe(OH)3胶体带电,通电时可以定向移动。
( )(8)可以利用丁达尔效应区分胶体和溶液。
( )2.下列分散系属于胶体的是( )A.白酒B.食盐水C.淀粉溶液 D.碘酒3.胶体的最本质的特征是( )A.丁达尔效应B.可以透过滤纸C.布朗运动D.分散质颗粒的直径在10-9~10-7 m之间4.2022年春节,电影《长津湖之水门桥》的热映,激发了国人的爱国之心。
冰墩墩同学去电影院观看电影,发现放映室射到屏幕上的光形成了明亮的光柱,他立即用学过的化学知识“丁达尔效应”解释了这种现象。
当光束通过下列分散系时,能观察到丁达尔效应的是( )A.NaCl溶液 B.蔗糖溶液C.CuSO4溶液 D.AgI胶体核心素养——合作·探究·分享提升点1 三种分散系的比较例1胶体、浊液与溶液的本质区别在于( )A.分散系是否有丁达尔现象B.分散质粒子是否带电荷C.分散系是否稳定D.分散质粒子直径的大小[提升1] 雾霾天气,就是“气溶胶细小粒子在高湿度条件下引发的低能见度事件”。
高中化学目录(必修1、2+选修)

苏教版高中化学必修1专题1化学家眼中的物质世界1 2 第一单元丰富多彩的化学物质18 第二单元研究物质的实验方法27 第三单元人类对原子结构的认识专题2从海中获得的化学物质39 40 第一单元氯、溴、碘及其化合物49 第二单元钠、镁及其化合物专题3从矿物到基础材料63 64 第一单元从铝土矿到铝合金71 第二单元铁、铜的获取及应用78 第三单元含硅矿物与信息材料专题4硫、氮和可持续发展87 88 第一单元含硫化合物的性质和应用96 第二单元生产生活中的含氮化合物附录I 相对原子质量表 (108)附录II 常见酸、碱和盐的溶解性表(20℃)109 附录III 中英文名词对照表 (110)元素周期表苏教版高中化学必修2专题1 微观结构与物质的多样性 1 2 第一单元原子核外电子排布与元素周期律12 第二单元微粒之间的相互作用力18 第三单元从微观结构看物质的多样性专题2 化学反应与能量转化29 30 第一单元化学反应速率与反应限度34 第二单元化学反应中的热量40 第三单元化学能与电能的转化47 第四单元太阳能、生物质能和氢能的利用专题3 有机化合物的获得与应用57 58 第一单元化石燃料与有机化合物69 第二单元食品中的有机化合物80 第三单元人工合成有机化合物专题4 化学科学与人类文明91 92 第一单元化学是认识和创造物质的科学99 第二单元化学是社会可持续发展的基础附录I 相对原子质量表 (107)附录II 中英文名词对照表 (108)元素周期表苏教版高中化学选修——物质结构与性质专题1揭示物质结构的奥秘 1专题2 原子结构与元素的性质7第一单元原子核外电子的运动 (8)第二单元元素性质的递变规律 (18)专题3 微粒间作用力与物质性质31第一单元金属键金属晶体 (32)第二单元离子键离子晶体 (38)第三单元共价键原子晶体 (43)第四单元分子间作用力分子晶体 (53)专题4 分子空间结构与物质性质65第一单元分子构型与物质的性质 (66)第二单元配合物的形成和应用 (76)专题5 物质结构的探索无止87附录中英文名词对照表 (108)元素周期表苏教版高中化学选修——化学反映原理专题1 化学反应与能量变化 1 第一单元化学反应中的热效应 (2)第二单元化学能与电能的转化 (13)第三单元金属的腐蚀与防护 (23)专题2化学反应速率与化学平衡31 第一单元化学反应速率 (32)第二单元化学反应的方向和限度 (42)第三单元化学平衡的移动 (52)专题3溶液中的离子反应61 第一单元弱电解质的电离平衡 (62)第二单元溶液的酸碱性 (71)第三单元盐类的水解 (79)第三单元难溶电解质的沉淀溶解平衡 (87)附录I 中英文名词对照表……………………97附录II常见的酸、碱和盐溶解性表(20℃)98 附录III难溶电解质的溶度积常数(25℃) (99)附录IV弱电解质在水中的电离平衡常数(25℃) (100)元素周期表苏教版高中化学选修——有机化学基础专题1认识有机化合物1第一单元有机化学的发展与应用 (2)第二单元科学家怎样研究有机物 (6)专题2有机物的结构与分类17第一单元有机化合物的结构 (18)第二单元有机化合物的分类和命名 (29)专题3常见的烃39第一单元脂肪烃 (40)第二单元芳香烃 (48)专题4烃的衍生物59第一单元卤代烃 (60)第二单元醇酚 (66)第三单元醛羧酸 (78)专题5生命活动的物质基础89第一单元糖类油脂 (90)第二单元氨基酸蛋白质核酸 (100)附录中英文名词对照表 (114)。
高一历史必修一专题1-3知识结构
列强侵华
掠夺原料
3、(1840ห้องสมุดไป่ตู้1919) 表现:两次鸦片战争、
民
中法战争、
族
甲午中日战争、
屈
八国联军侵华
辱
史
原因:①②③
日本侵华
(1931-1945) 罪行:①②③
军:黄海海战(英雄) 军民维护国家主权
4、 (1840-1919) 民:三元里抗英、义和团、反割台斗争 民
族
抗
关内关外抗日救亡 (1931-1936)
④ 新
前提:国共合作(标志) 国民革命 兴起:国民党一大召开
民
高潮:北伐
主
失败的标志、原因、意义
主
农村包围城市道路
义 国共十年对峙
革 (1927-1937) 长征(1934-1936)、遵义会议
命 全民族抗战 爆发的标志、反攻序幕
人民解放战争 (1946-1949)
战略决战、渡江战役
工人罢工、募捐; 爱国工商业者抵制日货; 爱国学生 “一二九运动”;
5、探索史(近代中国的民主革命)
①含义:近代中国人民进行的反封建反侵略的资产 阶级民主革命 领导:农、资产阶级 旧民主主义革命 (1840-1919) 史实:太平天国、辛亥革命
②阶段 领导:中共
新民主主义革命 (1919-1949) 领导:新民主主义革命
权 力
加
加
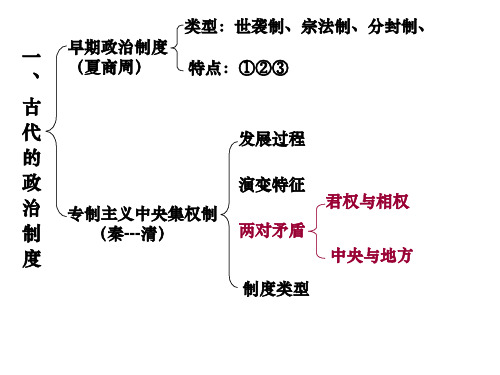
强 巩固(西汉):内外朝、刺史制度
强
,
,
相 权
完善(隋唐): 三省六部制、科举制
地 方
不 断
加强(北宋): 设参知政事
权 力
削
缩
弱 强化(明清): 废丞相、设内阁;建立军机处 小
专题1第三单元 物质的分散系课后巩固2021-2022学年上学期高一化学苏教版(2019)必修第一册

专题1 物质的分类及计量第三单元物质的分散系课后巩固2021-2022学年上学期高一化学苏教版(2019)必修第一册一、单选题(共16题)1.氯化铁溶液与氢氧化铁胶体具有的共同性质是()A. 都属于分散系B. 都可以透过半透膜C. 都能产生丁达尔效应D. 都有相同的颜色2.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。
制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径为5.5∼36nm的磁流体。
下列说法中正确的是()A. 所得到的分散系属于胶体B. 用一束光照射该分散系时,看不到一条光亮的“通路”C. 该分散系不能透过滤纸D. 该分散系的分散质为Fe(OH)33.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,有关说法正确的()A. a、b、c三点溶液的c(CH3COO-):a>b>cB. a、b、c三点醋酸的电离程度:b >a >cC. a、b、c三点溶液用等体积的氢氧化钾溶液中和,消耗氢氧化钾溶液浓度:a>b>cD. 若使b 点溶液中的pH值增大,可采取的措施是稀释溶液或加入醋酸钠晶体4.将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。
下列关于NaHSO4的说法中正确的是( )A. 因为NaHSO4是离子化合物,因此能够导电B. NaHSO4固体中阳离子和阴离子的个数比是2∶1C. NaHSO4固体熔化时破坏的是离子键和共价键D. NaHSO4固体溶于水时既破坏离子键又破坏共价键5.不能用胶体的观点解释的现象是()A. 在河流入海口处易形成三角洲B. 电影放映时会出现一条光路C. 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗D. 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀6.将以下4份溶液分别置于如图的装置中,其他条件相同时,灯泡最亮的是( )A. 100 mL 1 mol·L-1的盐酸B. 100 mL 2 mol·L-1的蔗糖溶液C. 100 mL 1 mol·L-1的氯化钠溶液D. 30 mL 1 mol·L-1的氯化钙溶液7.下列物质中,不属于...电解质的是()A. CO2B. NaOHC. MgCl2D. H2SO48.下列电离方程式书写正确的是()A. CaCl2=Ca2++ Cl22−B. HNO3⇌H++ NO3−C. NaHCO3=Na++H++ CO32−D. NaClO=Na++ClO-9.下列液体中,属于分散系,但不会出现丁达尔效应的是()①淀粉溶液②乙醇③硅酸胶体④火碱溶液⑤Fe(OH)3胶体⑥肥皂水A. ②④B. ①③C. ⑤⑥D. ④10.下列有机物属于电解质的是()A. 苯B. 酒精C. 己烷D. 甲酸11.实验室中用电解水的方法制取氢气和氧气,为了增强溶液的导电性最好加入下列电解质中的()A. NaClB. Na2SO4C. CuCl2D. AgNO312.在溶液导电性实验装置里,分别注入20 mL 4 mol·L-1的醋酸和20 mL 4 mol·L-1的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则()A. 灯光明暗程度不变B. 灯光变暗C. 灯光变亮D. 灯光明暗程度变化不明显13.下列电离方程式正确的是()A. NaHCO3溶于水:NaHCO3⇌Na++ HCO3−B. NaHSO4溶于水:NaHSO4=Na++H++ SO42−C. HF溶于少量水:HF=H++F-D. H2CO3溶液:H2CO3=2H++ CO32−14.下列叙述正确的是()A. 硫酸钡固体不导电,所以硫酸钡是非电解质B. 铜能导电,所以铜是电解质C. 氯化氢水溶液能导电,所以氯化氢是电解质D. 三氧化硫溶于水能导电,所以三氧化硫是电解质15.在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后,又逐渐变亮的是()A. 盐酸中逐滴加入食盐溶液B. 硫酸中逐滴加入氢氧化钠溶液C. 硫酸中逐滴加入氢氧化钡溶液D. 醋酸中逐滴加入氨水16.“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有下列性质中的( )A. 能全部通过半透膜B. 能全部通过滤纸C. 粒子做布朗运动D. 能发生丁达尔效应二、综合题(共4题)17.以下为中学化学中常见的几种物质:①液氨,②熔融KCl ,③NaHSO4固体,④铜,⑤盐酸,⑥蔗糖,⑦澄清石灰水。
(完整版)苏教版高中化学目录全

必修1专题1化学家眼中的物质世界第一单元丰富多彩的化学物质●物质的分类与转化●物质的量●物质的聚集状态●物质的分散系第二单元研究物质的实验方法●物质的分离与提纯●常见物质的检验●溶液的配制及分析第三单元人类对原子结构的认识●原子结构模型的演变●原子核外电子排布●原子核的组成专题2从海水中获得的化学物质第一单元氯、溴、碘及其化合物●氯气的生产原理●氯气的性质●氧化还原反应●溴,碘的提取第二单元钠、镁及其化合物●金属钠的性质与应用●碳酸钠的性质与应用●离子反应●镁的提取与应用专题3从矿物到基础材料第一单元从铝土矿到铝合金●从铝土矿中提取铝●铝的氧化物与氢氧化物●铝及铝合金第二单元铁、铜的获取及应用●从自然界获取铁和铜●铁,铜及其化合物的应用第三单元含硅矿物与信息材料●硅酸盐矿物与硅酸盐产品●二氧化硅与信息材料专题4硫、氮和可持续发展第一单元含硫化合物的性质和应用●二氧化硫的性质和作用●硫酸的制备和性质●硫和含硫化合物的相互转化第二单元生产生活中的含氮化合物必修2专题1微观结构与物质的多样性第一单元原子核外电子排布与元素周期律第二单元微粒之间的相互作用力第三单元从微观结构看物质的多样性专题2 化学反应与能量转化第一单元化学反应速率与反应限度第二单元化学反应中的热量第三单元化学能与电能的转化第四单元太阳能、生物质能和氢能的利用专题3 有机化合物的获得与应用第一单元化石燃料与有机化合物第二单元食品中的有机化合物第三单元人工合成有机化合物专题4 化学科学与人类文明第一单元化学是认识和创造物质的科学第二单元化学是社会可持续发展的基础选修1 化学与生活专题1 洁净安全的生存环境第一单元空气质量的改善第二单元水资源的合理利用第三单元生活垃圾的分类处理第四单元化学品的安全使用专题2 营养均衡与人体健康第一单元摄取人体必需的化学元素第二单元提供能量与营养的食物第三单元优化食物品质的添加剂第四单元造福人类健康的化学药物专题3 丰富多彩的生活材料第一单元应用广泛的金属材料第二单元功能各异的无机非金属材料第三单元高分子材料和复合材料选修2 化学与技术专题1 多样化水处理技术第一单元水的净化与污水处理第二单元硬水软化第三单元海水淡化专题2 从自然资源到化学品第一单元氨的合成第二单元氯碱生产第三单元硫酸工业第四单元镁和铝的冶炼专题3 让有机反应为人类造福第一单元有机药物制备第二单元合成洗涤剂的生产第三单元纤维素的化学加工第四单元有机高分子合成专题4 材料加工与性能优化第一单元材料的加工处理第二单元材料组成的优化第三单元复合材料的制造专题5 为现代农业技术添翼第一单元土壤酸碱性的改良第二单元化肥的生产与合理使用第三单元无土栽培技术第四单元化学农药的发展专题6 从污染防治到绿色化学第一单元环境污染的化学防治第二单元绿色化学与可持续发展选修3 物质结构与性质专题1 揭示物质结构的奥秘专题2 原子结构与元素第一单元原子核外电子的运动第二单元元素性质的递变规律专题3 微粒间作用力与物质性质第一单元金属键金属晶体第二单元离子键离子晶体第三单元共价键原子晶体第四单元分子间作用力分子晶体专题4 分子空房间结构与物质性质第一单元分子构型与物质的性质第二单元配合物是如何形成的专题5 物质结构的探索无止境选修4 化学反应原理专题1 化学反应与能量变化第一单元化学反应中的热效应第二单元化学能与电能的转化第三单元金属的腐蚀与防护专题2 化学反应速率与化学平衡第一单元化学反应速率第二单元化学反应的方向和限度第三单元化学平衡的移动专题3 溶液中的离子反应第一单元弱电解质的电离平衡第二单元溶液的酸碱性第三单元眼泪的水解第四单元沉淀溶解平衡选修5 有机化学基础专题1 认识有机化合物第一单元有机化学的发展与应用第二单元科学家怎样研究有机物专题2 有机物的结构与分类第一单元有机化合物的结构第二单元有机化合物的分类和命名专题3 常见的烃第一单元脂肪烃第二单元芳香烃专题4 烃的衍生物第一单元卤代烃第二单元醇酚第三单元醛羧酸专题5 生命活动的物质基础第一单元糖类油脂第二单元氨基酸蛋白质核酸选修6 实验化学专题1 物质的分类与提纯课题1 海带中碘元素的分离及检验课题2 用纸层析法分离铁离子和铜离子课题3 硝酸钾晶体的制备专题2 物质性质的探究课题1 铝及其化合物的性质课题2 乙醇和苯酚的性质专题3 物质的检验与鉴别课题1 牙膏和火柴中某些成分的检验课题2 亚硝酸钠和食盐的鉴别专题4 化学反应条件的控制课题 1 硫代硫酸钠与酸反应速率的影响因素课题 2 催化剂对过氧化氢分解反应速率的影响课题3 反应条件对化学平衡的影响专题5 电化学问题研究课题1 原电池课题2 电解与电镀专题6 物质的定量分析课题1 食醋总酸含量的测定课题2 镀锌铁皮锌镀层厚度的测定高中化学:必修1必修2选修1化学与生活选修2化学与技术选修3物质结构与性质选修4化学反应原理选修5有机化学基础选修6实验化学。
2021高中同步创新课堂化学优化方案—习题(苏教版必修1):专题1第三单元知能演练轻巧夺冠

1.“神舟”十号所用动力燃料之一的氢化锂三兄弟:LiH、LiD、LiT。
其中Li的质量数为7,下列有关叙述中正确的是()A.物质的量相等的三种化合物质子数之比为1∶2∶3B.物质的量相等的三种化合物中子数之比为1∶1∶1C.三种化合物的摩尔质量之比为8∶9∶10D.三种化合物的化学性质不相同解析:选C。
锂(Li)原子的质量数为7,中子数为7-3=4,该锂原子为73Li,三种氢化锂分别表示为73Li11H、73Li21H、73Li31H,质子数均为4,质子数之比为1∶1∶1,A项错误;中子数分别为4、5、6,B项错误;质量数分别为8、9、10,摩尔质量之比为8∶9∶10,C项正确;因同位素的化学性质相同,故三种氢化锂的化学性质相同,D项错误。
2.下列关于16 8O的叙述正确的是()A.质量数为8B.质子数为8C.中子数为16 D.电子数为16解析:选B。
m n X中m是质量数,n是质子数。
依据构成原子的粒子间关系,可知电子数是n,中子数是m-n。
3.下列结构示意图中,表示阴离子的是()解析:选D。
A表示原子、B表示阳离子、C表示原子、D表示阴离子。
4.下列说法中正确的是()A.某微粒核外电子排布为2、8、8,则该微粒肯定是氩原子B.最外层电子达到稳定结构的微粒只能是稀有气体的原子C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子D.某元素原子的最外电子层上只有2个电子,则该元素肯定是金属元素解析:选C。
具有2、8、8结构的微粒还可能为S2-、Cl-、K+、Ca2+等,A不对;最外层电子达到稳定结构的微粒还可能是由活泼金属的原子失去电子或活泼非金属的原子得到电子而形成的离子,B不对;具有相同电子层结构的离子指核外电子层数和每层电子数都相同,C正确;最外电子层上只有2个电子的Be、Mg等是金属元素,而He则是稀有气体元素,D不对。
5.下列八种化学符号:1H、2H、14C、6Li、23Na、14N、7Li、24Mg。
2024版新教材高中化学专题1物质的分类及计量第三单元物质的分散系学科素养升级练苏教版必修第一册

第三单元学科素养升级练1.设N A表示阿伏加德罗常数的值,下列说法正确的是( )A.含0.1N A个CO2-3的Na2CO3固体的质量为10.6gB.含1molHCl的盐酸与足量Fe反应,Fe失去的电子总数为2N AC.水的摩尔质量就是N A个水分子的质量之和D.2mol氦气含有电子数为8N A2.下列诗词中所描述的物质,不属于分散系的是 ( )A.“大漠孤烟直,长河落日圆”中的“烟”B.“曾经沧海难为水,除却巫山不是云”中的“云”C.“明月几时有,把酒问青天”中的“酒”D.“已是悬崖百丈冰,犹有花枝俏”中的“冰”3.气溶胶是固体或液体小颗粒分散到空气中形成的。
下列有关说法错误的是 ( ) A.气溶胶是胶体的一种,其分散剂是气体B.根据分散质和分散剂的状态,可以将胶体分为9种C.气溶胶的分散质粒子直径在1~100nm之间D.气溶胶的分散质粒子不能透过滤纸4.FeCl3溶液、Fe(OH)3胶体、Fe(OH)3浊液是三种重要的分散系,下列有关叙述错误的是( )A.Fe(OH)3胶体区别于其他两种分散系的本质特征是分散质粒子的直径在10-9~10-7m 之间B.可用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体C.三种分散系均具有吸附性D.三种分散系均属于混合物5.澳大利亚科学家发现了一种纯碳新材料“碳纳米泡沫”,其中每个泡沫约含有4000个碳原子,直径约为6~9nm,在低于-183℃时,该泡沫具有永久磁性。
下列叙述正确的是( )A.“碳纳米泡沫”是一种新型的含碳化合物B.把“碳纳米泡沫”分散到适当的溶剂中,不可能产生丁达尔效应C.“碳纳米泡沫”和金刚石的性质完全相同D.“碳纳米泡沫”与石墨的相互转化是化学变化6.“纳米材料”是当今材料科学研究的前沿,其研究成果广泛应用于催化及军事科学中。
纳米氧化铜颗粒的直径在1~100nm之间,若将纳米氧化铜颗粒分散到液体分散剂中,所得的分散系可能具有的性质是( )A.所得的分散系一定是溶液B.能产生丁达尔效应C.所得的液体一定呈胶状D.所得的分散系一定是悬浊液7.下列说法中正确的是 ( )A.胶体区别于其他分散系的本质特征是具有丁达尔效应B.可以用稀FeCl3溶液与稀NaOH溶液反应制取Fe(OH)3胶体C.用光束照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同D.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水的目的8.下列物质的分类正确的是( )9.下列说法正确的是 ( )A.SO2溶于水后所得水溶液能导电,所以SO2是电解质B.固体Na2SO4不导电,所以Na2SO4是非电解质C.电解质溶液导电的原因是溶液中有可以自由移动的离子D.金属铜能导电,但铜是非电解质10.(生产环保情境)将浑浊的黄河水变成清澈的饮用水的过程中,明矾起到举足轻重的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原子结构测试题
一、选择题
1、同种元素的原子一定具有 A .不同的质量数 B .相同中子数 C .相同的质子数
D .不同的电子数
2、下列关于原子的叙述正确的是
A .1
1H 表示氢原子核的质子数是1,中子数也是1。
B .14C 表示碳的一种同位素原子中含有7个质子和7个中子。
C .9
19F -表示该微粒的质量数为19,电子数为9。
D .2324N a M g 和表示两种原子含有相同的中子数。
3、有关等物质的量的6
12C 原子和614
C 原子,下列叙述正确的是 ①含有相同数目的原子 ②含有相同物质的量的质子 ③属于同种元素 ④具有相同的质量
⑤中子数相等
⑥电子数相等
⑦完全燃烧时消耗氧气的质量相等 ⑧具有几乎相同的化学性质
A .只有②③⑤
B .只有①②③
C .全正确
D .除④⑤外都正确 4、若某阳离子X 2+有m 个电子,其质量数为a ,则核内中子数为
A .m 2+
B .m 5+
C .a m 2--
D .a m +
5、简单离子a
2a n A +核外有x 个电子,A 的质量数可表示为 A .()2x n + B .()2x n - C .2x D .()n 2x +
6、下列微粒中,电子数目最多的是:
A .H 2O
B .NH 3
C .Na +
D .Al 7、下列离子的电子排布与氩原子核外电子排布不同的是:
A .Mg 2+
B .S 2-
C .K +
D .Cl -
8、某元素原子核外电子排布为:L 层电子数是K 层和M 层电子数之和的两倍,则某元素是:
A .钠
B .镁
C .氖
D .氯 9、比较多电子原子中电子能量大小的依据是:
A .原子核的电荷数
B .所处的电子层
C .电子离核远近不同
D .不能比较
10、下列微粒中与OH -离子具有不相同的质子数和相同的电子数,该微粒可能为: A .F - B .Cl -
C .NH 2-
D .CH 4
11、X 元素的原子其核电荷数为n ,X 2-离子和Y 3+离子的电子层结构相同,则Y 原子
的质子数是: A .n+1 B .n+2
C .n+3
D .n+5 12、含有4个原子核,10个电子的微粒是:
A .CH 4
B .NH 4+
C .H 3O +
D .PH 3
13、某化合物由A 、B 两元素组成,已知A 、B 两元素质量比为7∶4,原子量比为
7∶8,则化合物可能是: A .A 2B B .AB 2
C .AB 3
D .A 2B 5 14、质量数为27的元素R ,其核内有14个中子,则R 可形成的离子是:
A .R +
B .R 2+
C .R 3+
D .R 2-
15、某元素原子L 层电子数比K 层电子数多5个,该元素的最高正化合价为
A .+5
B .+6
C .+7
D .无最高正化合价 16、元素化合价一般决定于原子的
A .核内质子数
B .核外电子数
C .核外电子层数
D .最外层电子数
17、M 层有2个价电子的元素A 和L 层有5个价电子的元素B ,组成稳定的化合物,
该化合物的式量为
A .88
B .40
C .100
D .72
18、已知元素R 的某种同位素的氯化物RCl x 为离子化合物,其中该元素的阳离子的核内有y 个中子,核外有z 个电子,则该同位素的组成可表示为
A .z
y
R
B .z
y z R +
C .x z
y z
R ++
D .x z
y z x
R +++ 19、1992年,我国取得重大科技成果之一就是发现了三种元素新的同位素,其中一
种是80
208H g ,它的中子数为
A .80
B .128
C .208
D .288
20、下列分子或离子中,与氖原子含有相同电子数的是
①F-②Na+ ③HF ④NH3⑤CH4
A.仅①②③B.仅②③④C.仅①②⑤D.①②③④⑤
二、填空题
28、在1—18号元素中,电子总数是最外层电子数二倍的元素是;最外层
电子数是次外层电子数二倍的是;次外层电子数是最外层电子数二倍的是。
29、最外层(M层)电子数为6的原子,核电荷数为,原子结构简图为,
气态氢化物的分子式为,向此氢化物的水溶液中滴加石蕊后呈色。
30、下列各题中的物质均由核电荷数为1—10的元素组成,请填写化学式。
(1)只有两个原子核和两个电子组成的分子是;
(2)1个最外层有4个电子的原子,和2个最外层有6个电子的原子结合的分子是;
(3)1个最外层有5个电子的原子和3个只有1个电子的原子结合的分子是;
(4)由3个最外层是6个电子的原子结合而形成的分子是;
(5)由两个原子核10个电子结合而成的分子是,由五个原子核10个电子结合而成的分子是,
31、画出下列几种微粒的结构示意图,并写出微粒符号:
(1)原子核内有2个质子的原子、。
(2)核外有18个电子的二价阳离子、。
(3)核外有18个电子的一价阴离子、。
(4)原子核外L层为最外层,L层电子数是K层电子数3倍的原子、。
32、元素
35
其显最高正价为,显负
19X在其化
价时为;元素
9
合物中,最高价为,负
价为。
33、某金属元素R原子的质量数为52,已知R n+离子含有28个中子和21个电子,则
R显+n价时的氢氧化物,其化学式为。
