热学复习
中考物理专题《热学》复习课件《比热》-热学
比 热 容1.理解比热的概念比热是表示质量相等的不同物质,升高(或降低)相同的温度,吸收(或放出)的热量不相等的这一物质特性的物理量。
单位质量的某种物质,温度升高(或降低)1℃,吸收(或放出)的热量,叫做这种物质的比热容,简称比热。
公式:c =)(0t t m Q -吸或c =)(0t t m Q -放,比热的单位:焦/(千克℃)2.热量计算公式的物理意义物体温度升高吸收的热量Q 吸=cm (t -t 0),式中t 表示末温,t 0表示初温,t -t 0表示物体升高的温度。
如果用△t 表示物体升高的温度,则Q 吸=cm △t 。
物体温度降低放出的热量Q 放=cm (t 0-t ),式中t 0-t 表示物体降低的温度。
如果用△t 表示物体降低的温度,则Q 放=cm △t 。
Q =cm △t 只适用于物体温度改变(温度升高或温度降低)时,物体吸收或放出热量的计算。
公式还说明吸热或放热的多少跟物质的比热、物体的质量、温度改变的多少三个因素有关。
甲 乙 丙甲 乙 一、基础考查题1.(2005台州)下列能用比热容解释的事实是( )。
A .用力搓手后双手发热B .吐鲁番地区昼夜温差较大C .堆积的种子受湖升温D .生石灰加水温度骤然升高2.(2004温州)将质量相同的三块金属甲、乙、丙加热到相同的温度后,放到表面平整的石蜡上。
经过一定时间后,观察到的现象如图所示。
则三块金属的比热容( )。
A .甲最大B .乙最大C .丙最大D .一样大3.(2005金华)水的比热容较大,人们往往用它的这一特征为生产、生活服务。
下列事例中与这一特征无关的是( )。
A .让热水流过散热器来取暖B .在大的河流上建水电站,用水发电C .晚上向秧田里灌水D .汽车发动机用水循环冷却二、迁移实践题4.(2005绍兴)用如图甲实验装置测定液体的比热容。
已知容器内待测液体质量为300g ,电热丝电阻是5Ω。
闭合开关S ,调节滑动变阻器至电流表示数如图乙所示,12min 后,发现温度计示数升高5℃。
大学物理复习题(热学)

E
0
V
(10)、设有下列过程 10)、设有下列过程 )、 (1)用活塞缓慢地压缩绝热容器中的理想气体。(设无摩擦) 用活塞缓慢地压缩绝热容器中的理想气体。(设无摩擦) 。(设无摩擦 用缓慢地旋转的叶片使绝热容器中的水温上升。 (2)用缓慢地旋转的叶片使绝热容器中的水温上升。 冰溶解为水。 (3)冰溶解为水。 一个不受空气阻力及其摩擦力作用的单摆的摆动。 (4)一个不受空气阻力及其摩擦力作用的单摆的摆动。 其中是可逆过程的是: 其中是可逆过程的是: )(1)、(2)、(3)、(4 (A)(1)、(2)、(3)、(4) )(1)、(2)、(3 (B)(1)、(2)、(3) )(1)、(3)、(4 (C)(1)、(3)、(4) )(1)、(4 (D)(1)、(4) (D)
12、如图,一定量的理想气体,由平衡态A 12、如图,一定量的理想气体,由平衡态A变到平衡 的理想气体 ),则无论经过什么过程 则无论经过什么过程, 状态B 状态B(PA=PB),则无论经过什么过程,系统必然 对外做正功;( ;(B (A)对外做正功;(B)内能增加 从外界吸热;( ;(D 向外界放热。 (C)从外界吸热;(D)向外界放热。 [B]
[ C ]
(C)
N N H2 < O2 N N
f(v)
O2 H2
v
7、理想气体绝热地向真空自由膨胀,体 积增大为原来的两倍,则始、末两态 理想气体绝热地向真空自由膨胀, 积增大为原来的两倍,则始、 的温度T 和始、末两态气体分子的平均自由程λ 的温度T1与T2和始、末两态气体分子的平均自由程λ1 、λ2的关系为
30m/s的速度区间内 的速度区间内, 6、温度为T时,在方均根速度为 v2+30m/s的速度区间内, 温度为T 则有: H2和O2两种气体分子数占总分子数的百分比相比较 ,则有:
热学李椿第三版复习资料

热学李椿第三版复习资料热学李椿第三版复习资料热学是物理学中的一个重要分支,它研究的是热量的传递、转化和相互作用。
而李椿的《热学》第三版是热学领域的经典教材之一,被广大学生和研究者所喜爱和使用。
本文将介绍《热学》第三版的复习资料,帮助读者更好地掌握和理解热学知识。
首先,我们来了解一下《热学》第三版的内容结构。
该教材分为七个章节,分别是热力学基础、理想气体的热力学、热力学第一定律、理想气体的过程、热力学第二定律、热力学函数和相变等。
每个章节都涵盖了热学领域的重要知识点,从基础概念到高级理论都有所涉及。
在复习《热学》第三版时,我们可以按照章节的顺序进行学习和总结。
首先,我们可以重点关注热力学基础这一章节。
在这一章节中,我们可以学习到热力学的基本概念和基本定律,如温度、热量、功、内能等。
同时,还可以了解到热力学系统的性质和状态方程等内容。
通过对这些基础知识的掌握,我们可以为后续章节的学习打下坚实的基础。
接下来,我们可以深入学习理想气体的热力学。
理想气体是热学领域中的一个重要概念,它在实际应用中具有广泛的意义。
在这一章节中,我们可以学习到理想气体的状态方程、内能、焓、熵等热力学函数的计算方法。
同时,还可以了解到理想气体的特殊过程和理想气体的热力学性质等内容。
通过对理想气体的热力学的学习,我们可以更好地理解和应用热力学知识。
在热力学第一定律这一章节中,我们可以学习到能量守恒定律在热学领域中的应用。
通过学习热力学第一定律,我们可以了解到热力学系统内能的变化和热量、功的关系。
同时,还可以学习到热力学过程中的能量转化和能量传递等内容。
通过对热力学第一定律的学习,我们可以更好地理解和分析热力学系统的能量变化。
在理想气体的过程这一章节中,我们可以学习到理想气体在不同过程中的热力学性质。
通过学习理想气体的过程,我们可以了解到等温过程、绝热过程、等容过程和等压过程等不同过程中的热力学性质和计算方法。
同时,还可以学习到理想气体的循环过程和热机效率等内容。
工程热力学知识点

工程热力学复习知识点一、知识点基本概念的理解和应用(约占40%),基本原理的应用和热力学分析能力的考核(约占60%)。
1. 基本概念掌握和理解:热力学系统(包括热力系,边界,工质的概念。
热力系的分类:开口系,闭口系,孤立系统)。
掌握和理解:状态及平衡状态,实现平衡状态的充要条件。
状态参数及其特性。
制冷循环和热泵循环的概念区别。
理解并会简单计算:系统的能量,热量和功(与热力学两个定律结合)。
2. 热力学第一定律掌握和理解:热力学第一定律的实质。
理解并会应用基本公式计算:热力学第一定律的基本表达式。
闭口系能量方程。
热力学第一定律应用于开口热力系的一般表达式。
稳态稳流的能量方程。
理解并掌握:焓、技术功及几种功的关系(包括体积变化功、流动功、轴功、技术功)。
3. 热力学第二定律掌握和理解:可逆过程与不可逆过程(包括可逆过程的热量和功的计算)。
掌握和理解:热力学第二定律及其表述(克劳修斯表述,开尔文表述等)。
卡诺循环和卡诺定理。
掌握和理解:熵(熵参数的引入,克劳修斯不等式,熵的状态参数特性)。
理解并会分析:熵产原理与孤立系熵增原理,以及它们的数学表达式。
热力系的熵方程(闭口系熵方程,开口系熵方程)。
温-熵图的分析及应用。
理解并会计算:学会应用热力学第二定律各类数学表达式来判定热力过程的不可逆性。
4. 理想气体的热力性质熟悉和了解:理想气体模型。
理解并掌握:理想气体状态方程及通用气体常数。
理想气体的比热。
理解并会计算:理想气体的内能、焓、熵及其计算。
理想气体可逆过程中,定容过程,定压过程,定温过程和定熵过程的过程特点,过程功,技术功和热量计算。
5. 实际气体及蒸气的热力性质及流动问题理解并掌握:蒸汽的热力性质(包括有关蒸汽的各种术语及其意义。
例如:汽化、凝结、饱和状态、饱和蒸汽、饱和温度、饱和压力、三相点、临界点、汽化潜热等)。
蒸汽的定压发生过程(包括其在p-v和T-s图上的一点、二线、三区和五态)。
理解并掌握:绝热节流的现象及特点6. 蒸汽动力循环理解计算:蒸气动力装置流程、朗肯循环热力计算及其效率分析。
1-3热力学定律复习

•化学热力学的理论基础是热力学第一定律和热力学第二定律.
•在气液固三种聚集状态中, 气体最容易用分子模型进行研究. 一,气体的pVT关系
理想气体 理想气体状态方程: pV = nRT 真实气体 范德华方程 二,热力学第一定律 • 热力学第一定律本质是能量守恒. U = Q + W • 基本概念和术语
数据包括标准热容、标准相变焓、标准生成焓和标准燃烧焓 等.
8
二 热力学第一定律--系统与环境,过程与途径
系统
所研究的 物质对象
敞开系统 封闭系统 隔离系统
物质进出 能量得失
√
√
√
系统的宏观性质: • 广延性质 n, V, U, H, S, G, A, …, 有空间上的加和性.
• 强度性质 T, p, Vm , Um , , …, 无空间上的加和性.
理想气体:在任何温度/ 压力下均服从理想气体状态方程的气体. 两个特征: (1)分子本身必定不占有体积; (2)分子间无相互作用.
3
一 气体的 p V T 关系—理想气体
分压力pB: 无论是理想气体还是真实气体, 混合气中任一组分B的 摩尔分数yB与总压力p 的乘积定义为该组分的分压力:
pB = yB p
功的符号: 系统得功, W > 0 ;系统作功, W <0 .
体积功的一般计算式:
W
V2 V1
pambdV
热(Q): 因系统与环境间未达到热平衡而传递的能量. 热的符号: 系统吸热, Q > 0 ;系统放热, Q < 0. 热的类型: 物质变温过程的热; 相变热; 化学反应热等.
• 故功和热不是系统性质, 不是状态函数!
《热学》第四章和第五章复习

第四章 热力学第一定律 基本要求一、 可逆和不可逆过程 (1)准静态过程(2)理解什么是可逆过程,什么是不可逆过程.知道只有无耗散的准静态过程才是可逆过程。
二、 功和热量 (1)明确功是在力学相互作用过程中能量转移,热量是在热学相互作用过程中的能量的转移,它们都是过程量,它们都是过程量。
知道“作功”是通过物体宏观位移来完成;而“热传递”是通过分子之间的相互作用来完成。
(2)知道功有正负,熟练掌握从体积膨胀功微分表达式pdV W d -=出发计算体积膨胀功。
从几何上理解功的大小等于p-V 图上热力学过程曲线下面的面积。
三、热力学第一定律(1)知道能量守恒与转化定律应用到热学中就是热力学第一定律。
明确热力学第一定律是把内能、功和热量这三个具有能量量纲的物理量结合在一个方程中:即 W Q U +=∆; (2)一微小过程中热力学第一定律表示为:W d Q d dU +=;对于准静态过程热力学第一定律表示为:pdV Q d dU -=(3)内能是态函数,内能一般应是温度和体积的函数。
内能应当包含分子的热运动动能和分子之间的相互作用势能,也应包括分子内部的能量;在热学中的内能一般不包括系统做整体运动的机械能。
四、热容和焓(1)知道热容的定义、热容是过程量、热容与物体的量有关。
(2)知道焓的定义pV U H +=;知道焓的物理意义。
五、热力学第一定律对理想气体的应用(1)知道焦耳定律;即理想气体的内能仅是温度的函数;知道理想气体的焓也只是温度的函数。
内能和焓的微分可分别表示为:dT C dU m V ,ν=;dT C dH m p ,ν=;这两个公式适用于理想气体任何过程。
(2)理想气体的准静态过程的热力学第一定律可表示为pdV dT C dQ m V +=,ν;利用上式可得迈耶公式:R C C m V m p =-,,ν;(3)会熟练利用热力学第一定律处理一些常见热力学过程。
(4)会推导准静态绝热过程方程,熟记并会熟练利用绝热过程方程,同时应知道绝热过程方程的适用条件。
热力学复习要点梳理与总结

热力学复习要点梳理与总结热力学是物理学中的重要分支,研究物质及其相互作用中所涉及的能量转化与传递规律。
为了更好地复习热力学知识,以下是热力学的核心要点进行梳理与总结。
一、热力学基本概念1. 热力学系统:指所研究的物质或物质的集合。
可以分为封闭系统、开放系统和孤立系统三种。
2. 热力学平衡:指热力学系统各个部分相互之间没有宏观可观测到的差别。
3. 热力学第零定律:当两个系统与第三个系统分别达到热力学平衡时,这两个系统之间也达到热力学平衡,它们之间的温度相等。
4. 热力学第一定律:能量守恒定律,系统的内能变化等于系统对外做功加热量的代数和。
5. 热力学第二定律:自发过程只会在熵增加的方向上进行。
二、热力学方程1. 理想气体状态方程:pV = nRT,其中p表示气体的压强,V表示气体的体积,n表示气体的摩尔数,R为气体常量,T表示气体的温度。
2. 等温过程:系统温度恒定,内能不变。
pV = 常数。
3. 绝热过程:系统与外界没有能量的交换,熵不变。
pV^γ = 常数,其中γ为气体的绝热指数。
4. 等容过程:系统体积恒定,内能变化全部转化为热量。
p/T = 常数。
5. 等压过程:系统压强恒定,内能变化全部转化为热量。
V/T = 常数。
6. 等焓过程:系统焓恒定,内能变化全部转化为热量。
Q = ΔH,其中Q表示吸热量,ΔH表示焓变化。
三、热力学循环1. 卡诺循环:由等温膨胀、绝热膨胀、等温压缩、绝热压缩四个过程组成,是一个理想的热力学循环。
它能够以最高效率转换热能为功。
2. 斯特林循环:由等容膨胀、绝热膨胀、等容压缩、绝热压缩四个过程组成,可应用于制冷领域。
四、热力学熵1. 熵的定义:系统的无序程度。
dS = dQ/T,其中dS表示系统熵变,dQ表示系统吸热量,T表示系统温度。
2. 熵增原理:孤立系统熵不断增加,自发过程只能在熵增加的方向上进行。
3. 等温过程中熵变:ΔS = Q/T。
五、熵与热力学函数1. 熵与状态函数:熵是状态函数,只与初末状态有关,与过程无关。
《热学》期末复习用 各章习题+参考答案

(
29 × 10 3
)
485������
(4) 空气分子的碰撞频率为
√2������ ������
√2
6 02 × 10 × 22 4 × 10
3 3
×
(3
7 × 10−10)
× 485
(5) 空气分子的平均自由程为
7 9 × 109
������
485 7 9 × 109
6 1 × 10 8������
(������ + ������ )������������ ������ ������������ + ������ ������������
(4)
联立方程(1)(2)(3)(4)解得
������ + ������
������
2
������ ������ ������ (������ ������ + ������ ������ ) (������ + ������ )
������ (������ + ∆������) ������
������
������
(������ + ∆������) ������
������
ln
������������ ������
ln ������
������ + ∆������
ln
Hale Waihona Puke 133 101000ln
2
2
+
20 400
269
因此经过 69 × 60 40 后才能使容器内的压强由 0.101MPa 降为 133Pa.
1-7 (秦允豪 1.3.6) 一抽气机转速������ 400������ ∙ ������������������ ,抽气机每分钟能抽出气体20������.设 容器的容积������ 2 0������,问经过多长时间后才能使容器内的压强由 0.101MPa 降为 133Pa.设抽 气过程中温度始终不变.
热力学复习题1

1. 公式d u = c v d t 适用理想气体的任何过程。
( )2. 孤立系统的熵与能量都是守恒的。
( )3. 焓h = u + p v ,对闭口系统,没有流动功,所以系统不存在焓这个参数。
( )4. 绝热节流前后其焓不变,所以温度也不变。
( )5. 在相同热源和在相同冷源之间的一切热机,无论采用什么工质,他们的热效率均相等。
( )6. 孤立系统熵增原理表明:过程进行的结果是孤立系统内各部分的熵都是增加的。
7. 凡符合热力学第一定律的过程就一定能实现。
( )8. δq = d u + δw 及δq = c v d T + P d v 两式均可适用于工质,任何过程。
( ) 9. 系统经历一个可逆定温过程,由于温度没有变化,故不能与外界交换热量。
( ) 10. 当压力升高,饱和温度也升高了,故饱和蒸汽的比容将增大。
( ) 11. 通用气体常数R 与工质的种类无关,气体常数Rg 与工质的种类和状态有关。
12. 在pv 图上定温线比定熵线更缓,TS 图上定容线比定压线更陡。
13. PV 图上定温线是等轴双曲线。
14. 可逆循环的熵变等于零,所以可逆循环的净热等于零。
15. 根据卡诺定理,任何可逆循环的热效率都相等,且都等于121T T -=η(其中,T2表示低温热源温度,T1表示高温热源温度) 16. 无论可逆与不可逆循环,均有TdS Q =δ。
、 17. 把热量全部变为功是不可能的。
18. 对气体加热其温度一定升高。
19. 蒸气推动汽轮机工作的过程可以看成绝热膨胀过程,其水蒸气的焓降转换为功输出。
20. 闭口绝热系是孤立系。
21. 理想气体绝热自由膨胀过程中温度和焓、熵都不变。
22. 透平机在空气中转动对其做功,若该过程进行的无限缓慢随时可以达到新的平衡则可以看成是可逆过程。
1、典型的不可逆过程2、平衡状态3、平衡是否意味着系统内各点的状态参数必须完全相同4、关于节流:不可逆,绝热节流前后焓不变理想气体不能用节流降温蒸气压缩式制冷可以5、理想气体哪些量是温度的单值函数6、定压过程的加热量全部转化为焓增;7、定容过程全部加热量转化为内能的增量8、关于熵的判断说法:例如任何过程,熵只增不减若从某一初态经可逆与不可逆两条路径到达同一终点,则不可逆途径的∆S必大于可逆过程的∆S可逆循环∆S为零,不可逆循环∆S大于零不可逆过程∆S永远大于可逆过程∆S若工质从同一初态,分别经可逆和不可逆过程,到达同一终态,已知两过程热源相同,问传热量是否相同?若工质从同一初态出发,从相同热源吸收相同热量,问末态熵可逆与不可逆谁大?若工质从同一初态出发,一个可逆绝热过程与一个不可逆绝热过程,能否达到相同终点?理想气体绝热自由膨胀,熵变?任何可逆过程的熵总是不变,任何不可逆过程工质的熵总是增加的熵增大的过程必是不可逆过程将热量全部变成功是不可能的9、卡诺效率的适用条件10、水蒸气凝结过程放热量Q,对应的饱和温度T,则该过程的熵变为多少?11、理想气体和水蒸气四个基本热力过程,PV图和TS图的表示。
热力学第一定律复习

所以上述两过程 W≈0
20112011-4-2
祝大家学习愉快,天天进步! 祝大家学习愉快,天天进步!
3、相变化
(2)有气体参加的过程 例:蒸发 B(l)→ B(g)
定温、定压,W’ =0 时 可逆相变 定温、定压,
Q p =∆ g H l
W = − p∆V = − p (Vg − Vl ) ≈ − pVg ≈ −nRT
20112011-4-2
祝大家学习愉快,天天进步! 祝大家学习愉快,天天进步!
13/46 13/46
3、相变化
可逆相变
气液间可逆相变( 气液间可逆相变(恒T、P)P是液体在T时的饱和蒸汽压。 可逆相变 是液体在T时的饱和蒸汽压。 气固间可逆相变 可逆相变( 是固体在T时的饱和蒸汽压。 气固间可逆相变(恒T、P)P是固体在T时的饱和蒸汽压。 固液间可逆相变 可逆相变( 是固体在P时的熔点。 固液间可逆相变(恒T、P)T是固体在P时的熔点。
∆U = Q + W ≈∆ g H − nRT l
[一般在大气压及其平衡温度下的相变(可逆相变) 一般在大气压及其平衡温度下的相变(可逆相变) 焓数据可查文献,是基础热数据, 焓数据可查文献,是基础热数据,其与压力关系不 因此不标明压力] 大,因此不标明压力]
20112011-4-2 祝大家学习愉快,天天进步! 祝大家学习愉快,天天进步! 12/46 12/46
由热力学稳定单质生 (6) 标准摩尔生成焓:一定温度下由热力学稳定单质生 ) 标准摩尔生成焓:一定温度下由热力学稳定单质 的物质B的标准摩尔反应焓 的物质 的标准摩尔反应焓, 成化学计量数 νB=1的物质 的标准摩尔反应焓,称为物质 B在该温度下的标准摩尔生成焓。 ∆f H m ( B )表示 在该温度下的标准摩尔生成焓 在该温度下的标准摩尔生成焓。 没有规定温度, 时的数据有表可查。 1)没有规定温度,一般298.15 K时的数据有表可查。 3)由定义可知:稳定态单质的 ∆f Hm ( B) = 0 稳定态单质的 (6) 标准摩尔燃烧焓:一定 标准摩尔燃烧焓:一定温度下, 1mol物质 B 与 氧气进行完全燃烧反应,生成规定的燃烧产物时的 标准摩尔反应焓,称为B在该温度下的标准摩尔燃烧 焓。 ∆ Hm ( B) 表示.单位:J mol-1 c
《热学》第二章和第三章复习

第二章分子动理学理论的平衡态理论 基本要求一、麦克斯韦速率分布(1)掌握麦克斯韦速率分布函数,理解它的物理意义和它的分布曲线,并知道它的分布曲线是如何随温度或者分子质量变化。
(2)熟练掌握平均速率、方均根速率、最概然速率3个公式。
二、 麦克斯韦速度分布 (1)掌握麦克斯韦速度分布。
(2)知道如何利用麦克斯韦速度分布导出麦克斯韦速率分布。
三、 气体分子碰壁数及其应用 (1)知道气体气体压强和碰壁数的物理意义。
(2)能利用麦克斯韦速度分布推导气体分子碰壁数公式和理想气体压强公式,并熟记它们。
(3)会利用气体分子碰壁数公式研究一些实际问题。
四、波尔兹曼分布(1)掌握粒子在外场中的分布;(2)掌握波尔兹曼分布;(3)会从波尔兹曼分布出发求粒子在外场中的分布和麦克斯韦速度分布。
五、能量均分定理(1)理解自由度和自由度数,知道单原子分子、双原子分子和多原子分子的自由度; (2)掌握能量积分定理;会求常温下理想气体的内能、定体热容等。
(3)了解固体的热容和杜隆-珀蒂定律第三章 输运现象与分子动理学理论的非平衡态理论 基本要求一、黏性现象知道什么是层流,什么是湍流。
掌握牛顿黏性定律,理解气体黏性微观机理。
二、 扩散现象掌握菲克定律,理解气体扩散微观机理。
三、 热传导定律掌握傅立叶定律,理解气体热传导微观机理。
四、 气体分子平均自由程(1)理解什么是碰撞(散射)截面,掌握刚性分子碰撞截面公式。
(2)掌握气体分子间平均碰撞频率和分子平均自由程公式。
五 气体输运系数知道气体黏性系数、导热系数、扩散系数如何随温度和压强变化。
第二章和第三章复习题一 选择题1 水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)? (A) 66.7%. (B) 50%. (C) 25%. (D) 0. [ ]2 做布朗运动的微粒系统可看作是在浮力ρρ/0mg -和重力场的作用下达到平衡态的巨分子系统.设m 为粒子的质量,ρ 为粒子的密度,ρ 0为粒子在其中漂浮的流体的密度,并令z = 0处势能为0,则在z 为任意值处的粒子数密度n 为 (A) )}1(exp{00ρρ-⋅-kTmgz n .(B) )}1(exp{00ρρ-⋅kTmgz n .(C) }/exp{00kT z mgn ρρ-.(D) }/exp{00kT z mgn ρρ.[ ]3 在二氧化碳激光器中,作为产生激光的介质CO 2分子的两个能级之能量分别为ε1 = 0.172 eV ,ε2 = 0.291eV ,在温度为 400℃时,两能级的分子数之比N 2∶N 1为(玻尔兹曼常量k = 1.38×10-23 J/K ,1 eV = 1.60×10-19 J )(A) 31.5. (B) 7.7. (C) 0.13. (D) 0.03. [ ] 4 温度为T 时,在方均根速率s/m 50)(212±v 的速率区间内,氢、氨两种气体分子数占总分子数的百分率相比较:则有(附:麦克斯韦速率分布定律:v v v ∆⋅⋅⎪⎪⎭⎫ ⎝⎛-⎪⎭⎫ ⎝⎛π=∆222/32exp 24kT m kT m N N,(A) ()()22N H //N N N N ∆>∆, (B) ()()22N H //N N N N ∆=∆,(C) ()()22N H //N N N N ∆<∆(D) 温度较低时()()22N H //N N N N ∆>∆ ,温度较高时()()22N H //N N N N ∆<∆ [ ]5 下列各图所示的速率分布曲线,哪一图中的两条曲线能是同一温度下氮气和氦气的分子速率分布曲线? [ ]6 在一个体积不变的容器中,储有一定量的理想气体,温度为T 0时,气体分子的平均速率为0v ,分子平均碰撞次数为0Z ,平均自由程为0λ.当气体温度升高为4T 0时,气体分子的平均速率v ,平均碰撞频率Z 和平均自由程λ分别为:(A) v =40v ,Z =40Z ,λ=40λ. (B) v =20v ,Z =20Z ,λ=0λ. (C) v =20v ,Z =20Z ,λ=40λ. (D) v =40v ,Z =20Z ,λ=0λ. [ ] 7 一定量理想气体分子的扩散情况与气体温度T 、压强p 的关系是:(A) T 越高、p 越大,则扩散越快. (B) T 越低、p 越大,则扩散越快. (C) T 越高、p 越小,则扩散越快. (D) T 越低、p 越小,则扩散越快. [ ] 二 填空题8 一容器内储有某种气体,若已知气体的压强为 3×105 Pa ,温度为27℃,密 度为0.24 kg/m 3,则可确定此种气体是________气;并可求出此气体分子热运动的最概然速率为_______________________m/s. (普适气体常量R = 8.31 J ·mol -1·K -1)9质量为 6.2×10-14 g 的某种粒子悬浮于27℃的气体中,观察到它们的方均根 速率为 1.4 cm/s ,则该种粒子的平均速率为__________.(设粒子遵守麦克斯韦速率分布律) 10 设气体分子服从麦克斯韦速率分布律,v 代表平均速率,v p 代表最概然速率,那么,速v v O O (B (A (D O(C O率在v p 到v 范围内的分子数占分子总数的百分率随气体的温度升高而__________(增加、降低或保持不变).11用绝热材料制成的一个容器,体积为2V 0,被绝热板隔成A 、B 两部分,A 内储有1 mol 单原子分子理想气体,B 内储有2 mol 刚性双原子分子理想气体,A 、B 两部分压强相等均为p 0,两部分体积均为V 0,则两种气体各自的内能分别为E A =________;E B =________; (2) 抽去绝热板,两种气体混合后处于平衡时的温度为T =______.12一氧气瓶的容积为V ,充入氧气的压强为p 1,用了一段时间后压强降为p 2,则瓶中剩下的氧气的内能与未用前氧气的内能之比为__________.13 设某原子能反应堆中心处单位时间穿过单位面积的中子数为 4×1016 m -2·s -1,且设这些中子是温度为 300 K 的热中子,并服从麦克斯韦速度分布律,试求中子气的分压强. (阿伏伽德罗常量N A = 6.02×1023 mol -1,玻尔兹曼常量k = 1.38×10-23 J ·K -1 中子的摩尔质量为1.01×10-3 kg )14玻尔兹曼分布律是自然界中的一条较为普遍的分布定律.对处于任何力场中的任何微粒系统只要______________________________可以忽略,这定律均适用. 15 一个很长的密闭容器内盛有分子质量为m 的理想气体,该容器以匀加速度a垂直于水平面上升(如图所示).当气体状态达到稳定时温度为T ,容器底部的分子数密度为n 0,则容器内离底部高为h 处的分子数密度n =_____________________. 16 用总分子数N 、气体分子速率v 和速率分布函数f (v ) 表示下列各量:(1) 速率大于v 0的分子数=____________________; (2) 速率大于v 0的那些分子的平均速率=_________________;(3) 多次观察某一分子的速率,发现其速率大于v 0的概率=_____________. 17 图示的曲线分别表示了氢气和氦气在同一温度下的分子速率的分布情况.由图可知,氦气分子的最概然速率为___________,氢气分子的最概然速率为________________.18 一定量的某种理想气体,先经过等体过程使其热力学温度升高为原来的4倍;再经过等温过程使其体积膨胀为原来的2倍,则分子的平均碰撞频率变为原来的__________倍.19 已知氦气和氩气的摩尔质量分别为M mol 1 = 0.004 kg/mol 和M mol 2 =0.04 kg/mol ,它们在标准状态下的粘度分别为η1 =18.8×10-6 N ·s ·m -2和η2 = 21.0×10-6 N ·s ·m -2.则此时氩气与氦气的扩散系数之比D 2/ D 1= __________________. 三 计算题20 由N 个分子组成的气体,其分子速率分布如图所示.(1) 试用N 与0v 表示a 的值. (2) 试求速率在1.50v ~2.00v 之间的分子数目. (3) 试求分子的平均速率.21 将1 kg 氦气和M kg 氢气混合,平衡后混合气体的内能是2.45×106 J ,氦分子平均动能a16v (m /s)f (v )1000020是 6×10-21 J ,求氢气质量M . (玻尔兹曼常量k =1.38×10-23 J ·K -1 ,普适气体常量R =8.31 J ·mol -1·K -1)22 假设地球大气层由同种分子构成,且充满整个空间,并设各处温度T 相等.试根据玻尔兹曼分布律计算大气层中分子的平均重力势能P ε.(已知积分公式⎰∞+-=01/!d e n ax n a n x x )23 在直径为D 的球形容器中,最多可容纳多少个氮气分子,才可以认为分子之间不致相碰?(设氮分子的有效直径为d ).24 一长为L ,半径为R 1 = 2 cm 的蒸汽导管,外面包围一层厚度为2 cm 的保温材料(导热系数为 K = 0.1 W ·m -1·K -1)蒸气的温度为100℃,保温材料的外表面温度为20℃.求:(1) 每秒钟从单位长度传出的热量; (2) 保温材料外表面的温度梯度. 四 理论推导和证明25 试根据麦克斯韦分子速率分布律222/3)2exp()2(π4)(v vv kTm kTm f -=,验证以下不等式成立 1)1(>⋅vv . [积分公式22321d )exp(λλ=-⎰∞x x x ,λλ21d )exp(02=-⎰∞x x x ]五 错误改正题26 已知有N 个粒子,其速率分布函数为: f ( v ) = d N / (N d v ) = c ( 0 ≤v ≤v 0 ) f ( v ) = 0 (v >v 0) 有人如下求得c 与v(1) 根据速率分布函数的归一化条件,求得常数c ,即有1d d )(00===⎰⎰∞v vv v v Nc Nc Nf∴ c = 1 / (N v 0) (2) 此粒子系统的平均速率⎰∞=0d )(v v v v Nf ⎰=0d 1v v v v N N0021d 10v v v vv ==⎰上述关于c 、v 的解答是否正确?如有错误请改正. 六 回答题27 由理想气体的内能公式mol2MiRTM E =可知内能E与气体的摩尔数M / M mol 、自由度i 以及绝对温度T 成正比,试从微观上加以说明.如果储有某种理想气体的容器漏气,使气体的压强、分子数密度都减少为原来的一半,则气体的内能是否会变化?为什么?气体分子的平均动能是否会变化?为什么?28在什么条件下,气体分子热运动的平均自由程λ与温度T 成正比?在什么条件下,λ与T 无关?(设气体分子的有效直径一定)29 什么叫分子的有效直径?它是否随温度变化而变化?为什么?30 什么是气体中的输运过程?。
热学复习-初三物理(光华)

2.生活中常见的凝华现象 c.在寒冷的冬天,在玻璃 窗的内表面会有冰花。
树 枝 上 的 “ 雾 凇 ”
d.冰棍外表 的“白霜”
钨丝
吸 热
固态
升华 气态
钨蒸气
放 热
凝华
钨的 颗粒
固态
一、温度
描述物体的冷热程度
摄氏温度的规定方法:
a.把把一标准大气压下,冰水混合物的温度规定为0℃ b.把一标准大气压下,沸水的温度规定为100℃
热水
冷水
= 冷水分子数 热水分子动能 ﹥ 冷水分子动能 热水内能 ﹥ 冷水内能 分子势能 =分子势能 结论1:物体的温度越高,内能越大。
热水分子数
(同一个物体,温度越高)
问2:同温度时,一大杯热水与一小杯热水 谁的内能大?
热水 800c 分子数
热水 800c
﹥ 分子数 每个分子动能 = 每个分子动能 每个分子势能 = 每个分子势能
1. 下表是水表面气压与液体沸点的关系 2. 请说出高压锅在设计上利用了什么热学原理?
沸点/℃
100 101
105 121Байду номын сангаас
110 143
112 154
114 163
116 175
118 187
120 199
122 211
气压
/kPa
3.如果把这种高压锅拿到哪些地区销售更容易?
液化
——放热过程
物质由气态变成液态的过程。
测量温度的工具是 常用温度计 理是 液体的热胀冷缩 。
,它的原
测量体温的工具叫做 体温计 ,它的测量范 围是 35~42℃ ,最小刻度是 0.1℃ 。
人体的正常温度是 37 ℃,人感到比较舒适 的温度是 25 ℃左右,
热学复习题

1.热力学系统处于平衡态应满足的条件为 、 和 。
2.在微观上,绝对温度是 的量度。
3.在相同的温度下,氧气和氦气的分子平均速率的比值=He O V V :2____ __;氧气和氦气的分子平均动能的比值=He O εε:2____ _____。
4. 1mol 理想气体在气缸中进行无限缓慢的膨胀,其体积由V 1变到V 2。
〔1〕当气缸处于绝热情况下时,理想气体熵的增量△S=_____ _________;〔2〕当气缸处在等温情况下时,理想气体熵的增量△S=_____ _________。
5.卡诺循环由 ____ ____过程和____ ____过程组成。
6.试说明以下各量的物理意义:⎰21)(v v dv v f : 。
⎰∞0)(dv v vf : 。
R i 2: 7.如下图,一定量的理想气体由状态a 经三个不同过程到达状态b 。
这三个过程中, 过程对外做功最大, 过程吸热最小。
8.从分子动理论的观点看,气体的粘滞现象的产生是由于分子热运动引起__ __迁移的结果,气体热传导现象的产生是由于_____ ______迁移的结果,气体扩散现象是由于______ ______迁移的结果。
9.如熔解时体积膨胀,那么晶体的熔点随压强增大而 ;如熔解时体积缩小,那么晶体的熔点随压强增大而 。
10. 在微观上,温度是 的量度。
温度是 参量,只具有 意义。
11.一容器中贮有氧气,其压强为 1.0×105Pa ,温度为300K 。
那么其 分子数密度为m -3,氧气的密度为 kg •m -3,分子平均平动能为 J 。
12. 1mol 理想气体在气缸中进行无限缓慢的膨胀,其体积由V 1变到V 2。
〔1〕当气缸处于绝热情况下时,理想气体熵的增量△S=_____ _________;〔2〕当气缸处在等温情况下时,理想气体熵的增量△S=_____ ________。
13.试说明以下各量的物理意义: dvv f )(: 。
热力学重点知识总结(期末复习必备)

热力学重点知识总结(期末复习必备)热力学重点知识总结 (期末复必备)1. 热力学基本概念- 热力学是研究物质和能量转化关系的科学领域。
- 系统:研究对象,研究所关注的物体或者物质。
- 环境:与系统相互作用的外部世界。
- 边界:系统与环境之间的分界面。
2. 热力学定律第一定律:能量守恒定律- 能量既不会凭空产生,也不会凭空消失,只会在不同形式之间转化。
- $\Delta U = Q - W$,其中 $U$ 表示内能,$Q$ 表示传热量,$W$ 表示对外界做功。
第二定律:热力学箭头定律- 热量不会自发地从低温物体传递到高温物体,而是相反的方向。
- 热量自发地会沿着温度梯度从高温物体传递到低温物体。
- 第二定律的一个重要应用是热机效率计算:$\eta =\frac{W}{Q_H}$,其中 $Q_H$ 表示从高温热源吸收的热量,$W$ 表示对外界做的功。
第三定律:绝对零度定律- 温度无法降低到绝对零度,即 $0$K 是一个温度的下限。
- 第三定律提供了热力学的温标基准,即绝对温标。
3. 热力学过程绝热过程- 绝热过程是指在过程中不与环境发生热量交换的过程。
- 绝热过程中,系统的内能会发生改变,但传热量为零。
等温过程- 等温过程是指在过程中系统与环境保持恒定的温度。
- 在等温过程中,系统的内能不变,但会发生热量交换。
绝热可逆过程- 绝热可逆过程是指绝热过程与可逆过程的结合。
- 在绝热可逆过程中,系统不仅不与环境发生热量交换,还能够在过程中达到热力学平衡。
4. 热力学系统分类封闭系统- 封闭系统是指与环境隔绝,但能够通过物质和能量交换来进行工作的系统。
开放系统- 开放系统是指与环境可以进行物质和能量交换的系统,也称为流体系统。
孤立系统- 孤立系统是指与环境既不进行物质交换,也不进行能量交换的系统。
5. 热力学熵- 熵是热力学中一个重要的物理量,表示系统的无序程度或混乱程度。
- 熵的增加反映了系统的混乱程度的增大,熵的减少反映了系统的有序程度的增大。
热力学第一第二定律复习

热力学第二定律 一、重要概念 卡诺循环,热机效率,热力学第二定律,克劳修斯不等式 熵,规定熵,标准熵,标准摩尔反应熵,亥姆霍兹函数 ,吉布斯函数 二、主要公式与定义式 1. 可逆热机效率:η = -W / Q1 =(Q1+Q2)/ Q1 = 1 - T2 / T1 (T2 , T1 分别为低温,高温热源) 2.卡诺定理:任何循环的热温熵小于或等于0
(3) 对于凝聚相,状态函数通常近似认为只与温度有关, 而与压力或体积无关,即 d U≈d H= n Cp,m d T
(5) 相变过程 可逆相变:在温度T对应的饱和蒸气压下的相变,如水 在常压下的0℃ 结冰或冰溶解,100 ℃ 时的汽化或凝结等 过程。 由温度T1下的相变焓计算另一温度下的相变焓T T2 q q D Hm (T2)= D Hm (T1)+ D C dT
三、ΔS、ΔA、ΔG的计算 1.ΔS的计算(重点) 特例:恒温过程: ΔS = nRln(V2/V1) 恒容过程: ΔS =nCV,mln(T2/T1) 恒压过程: ΔS =nCp,mln(T2/T1) (2) 相变过程:可逆相变 ΔS =Δ H/T ; 非可逆相变 需设计路径计算 (3) 标准摩尔反应熵的计算 Δ rSmθ = ∑ vB Smθ (B,T) 2.Δ G的计算 (1) 平衡相变或反应达到平衡:Δ G=0 (2) 恒温过程:ΔG=Δ H-TΔS (3) 非恒温过程:Δ G=Δ H- ΔT S =Δ H -(T 2S2-T1S1) 注:题目若要计算Δ G,一般是恒温过程;若不是恒温, 题目必然会给出绝对熵。
(1) Δ S(隔离)>0,自发(不可逆); Δ S(隔离)=0,平衡(可逆)。 (2)恒T、恒p、W ’=0过程(最常用): dG<0,自发(不可逆);dG=0,平衡(可逆)。 (3) 恒T、恒V、W ’=0过程: dA<0,自发(不可逆); dA=0,平衡(可逆)。
热学复习题答案

热学复习题1.气体分子的速率分布函数)f, 是系统中速率v附近单位速率区间的分(v子数占总分子数的百分比. ( R )2. 微观上,气体的温度表示每个分子的冷热程度. ( F)3. 气体的温度是分子平均平动动能的量度. ( R )一.选择题(每小题3分,共30分)1.一定量某理想气体所经历的循环过程是:从初态(V0 ,T0)开始,先经绝热膨胀使其体积增大1倍,再经等容升温回复到初态温度T0, 最后经等温过程使其体积回复为V0 , 则气体在此循环过程中( A )(A)对外作的净功为负值. (B) 对外作的净功为正值.(C) 内能增加了. (D) 从外界净吸收的热量为正值.2.如图所示,一定量的理想气体从体积V1膨胀到体积V2分别经历的过程是:A→B等压过程; A→C等温过程; A→D绝热过程. 其中对外作功最少的过程为:( C )(A)是A→B.(B)是A→C.(C) 是A→D.(D) 既是A→B,也是A→ C ,两者一样多.3.两容器内分别盛有氢气和氦气,若它们的温度和质量分别相等,则:( A )(A)两种气体分子的平均平动动能相等.(B) 两种气体分子的平均动能相等. (C) 两种气体分子的平均速率相等. (D) 两种气体的内能相等.4若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻耳兹曼常量,R 为摩尔气体常量,则该理想气体的分子数为:( D )(A) pV/m . (B) pV /(mT ). (C) pV /(RT ) . (D) pV / (kT ).5. 下图所列各图表示的速率分布曲线,哪一图中的两条曲线能是同一温度下氮气和氦气的分子速率分布曲线 ( B )6.已知一定量的某种理想气体,在温度为T 1与T 2时分子最可几速率分别为v p1和v p2,分子速率分布函数的最大值分别为f (v p1)和f (v p2), 若T 1>T 2 , 则( B )(A) v p1>v p2 , f (v p1)>f (v p2) . (B) v p1>v p2 , f (v p1)<f (v p2) . (C)v p1<v p2 , f (v p1)>f (v p2 ) . (D) v p1<v p2 , f (v p1)<f (v p2) .7. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的气体分子数减少了 ( B )(A) 500. (B) 400. (C) 900. (D) 2100.8. 已知氢气与氧气的温度相同,请判断下列说法正确的是 ( D )(A)(C)(B)(D)(A)氧分子的质量比氢分子大,所以氧气的压强一定大于氢气的压强. (B)氧分子的质量比氢分子大,所以氧气的密度一定大于氢气的密度. (C)氧分子的质量比氢分子大,所以氢分子的速率一定比氧分子的速率大.(D)氧分子的质量比氢分子大,所以氢分子的方均根速率一定比氧分子的方均根速率大.9.设1 mol 理想气体,从同一初始平衡态出发,进行可逆的等压过程或等体过程.在温熵图中,对于相同的温度 ( B ) (A) 等压过程曲线的斜率大于等体过程曲线的斜率. (B) 等压过程曲线的斜率小于等体过程曲线的斜率. (C) 两种过程曲线的斜率相等. (D) 两种过程曲线的斜率孰大孰小取决于温度的值.10. 在密闭容器中,若将理想气体分子的平均速度提高为原来的两倍,则( D )(A)温度和压强都提高为原来的2倍;(B) 温度变为原来的2倍,而压强变为原来的4倍; (C) 温度变为原来的4倍,而压强变为原来的2倍;(D) 温度和压强都提高为原来的4倍.11. 在一定的温度下,理想气体分子速率分布函数()v f 是一定的。
热学复习黄代绘1

热学复习气体分子动理论1、理想气体状态方程、压强公式、温度公式2、经典统计在理想气体中的应用 1)麦氏速率分布律 A .速率分布函数B.分布函数曲线随温度(T )和分子种类(m 或M )变化()1d 0=⎰∞v vf MRT m kTv p 22==MRT m kTv ππ88==MRT m kT v 332==p nkT=21322t mv kTε==23tp n ε=vd (v)d vN f N =RTMm pV =作业:No.10二、44. 下列各图所示的速率分布曲线,哪一图中的两条曲线是同一温度下氮气和氦气的分子速率分布曲线?解:由归一化条件()1d 0=⎰∞v v f ,说明f (v )曲线下面积都等于1。
若pv 大,则pv v >的)(v f 将减小。
而在同一温度下,氮气和氦气的pv 不等,所以(D)不对。
(A)、(C)中pv 大)(v f 没有减小,所以(A)、(C)都不对。
故选BC .对最概然速率的理解:如果把整个速率区间范围分成许多相等的小区间,则最概然速率所在区间的分子所占的比率最大。
作业:No.10二、1D.如果不是麦氏速率分布函数,怎样求2v v v p 、、作业:No.10四、11. 设由N 个气体分子组成的热力学系统,其速率分布函数为:⎩⎨⎧><<--=)(0)0()()(000v v v v v v v k v f速率分布曲线如图所示,试求: (1) 分布函数中的常数k ; 解:由归一化条件 1d )(0=⎰∞v v f有1231d )(d )(3030000=+-=⎰--=⎰∞kv kv vv v v k v v f v 所以306v k =(2) 最可几速率v p ;解:最可几速率满足0d )(d =v v f ,即 02d )(d 0=+-=kv kv v v f 所以 20v v p =(3) 速率在0~0.3v 0之间的分子数∆N ; 解: N v v v v v N v v Nf N v v 216.0d )(6d )(003.000303.00=⎰--=⎰=∆ (4) 分子平均速率v ; 解:2d )(6d )(00203000v v v v v v v v vfv v =⎰--=⎰=∞ (5) 分子的方均根速率2v 。
热力学总复习提纲

如果是可逆的,其热效率均为1-T2/T1;如果是不可逆的,其热效
率恒小于1-T2/T1。
即:
t
1 T2 T1
① t,c f (T1, T2 )
② T1, T2 t,c
③ T1 T2 t,c 0
④ T1 , T2 0,t,c 1
2、卡诺循环——由两个无摩擦的定温过程和两个无摩擦的绝热 过程组成的热机循环。
du cV 0dT dh cp0dT
ds du pdv T
ds dh vdp T
14
3-.不做膨胀功 w 0
气体向真空自由膨胀就是比体积增大而又不做膨胀功的过程。
b.不做技术功 wt 0
流体在各种换热设备及输送管道中的流动就是压力不断下降 而又不做技术功的过程。
②
摩尔分数:
xi
ni nmix
③
体积分数:
i
Vi Vmix
2. 平均摩尔质量和气体常数
M mix x1M1 x2M 2 xn M n
混合气体的气体常数为:
3 道尔顿定律
Rg ,mix
R M mix
n
理想混合气体的压力pmix等于各组成气体分压力pi的总和 pmix pi i 1
总以变化量出现,内能零点人为规定。
(5)焓 H
定义式: H=U+pV (J)
物理意义:开口系中随工质流动而携带的、取决于热力状态的能量。
随工质流动跨越边界而转移的能量
焓———微观动能、微观势能和推动功的总和
(6)熵 S
定义式: dS Q
T
dS dU pdV T
物理意义:熵体现了可逆过程传热的大小与方向
热学复习题

1. 气缸内贮有36 g 水蒸汽(视为刚性分子理想气体),经abcda 循环过程如图所示。
其中a -b 、c -d 为等体过程,b -c 为等温过程,d -a 为等压过程。
试求:(1) d -a 过程中水蒸气作的功W da (2) a -b 过程中水蒸气内能的增量∆E ab (3) 循环过程水蒸汽作的净功W(4) 循环效率η(注:循环效率η=W /Q 1,W 为循环过程水蒸汽对外作的净功,Q 1为循环过程水蒸汽吸收的热量,1 atm = 1.013×105 Pa) 解:水蒸汽的质量kg 1036-3⨯=M水蒸汽的摩尔质量kg 1081-3mol ⨯=M水蒸汽视为刚性多原子分子理想气体,则其总自由度数为 6=i ` (1) d -a 等压压缩过程中水蒸气对外作的功为J10065.51025)-(5010013.12)(3-35⨯=⨯⨯⨯⨯=-=a d a da V V p W(2) a -b 等体升压升温过程中水蒸气内能的增量为53-mol10013.12)-(6102526)(2)(⨯⨯⨯⨯⨯=-⋅=-=∆a b a a b V ab p p V i T T C MM EJ 10039.34⨯=(3) 由理想气体状态方程可得b 点温度K91431.8)1081/( 1036102510013.16)/(3-3--35≈⨯⨯⨯⨯⨯⨯⨯==RMM V p T molab b则b -c 等温膨胀过程中水蒸气对外作的功为3--33-5mol10521050ln102510013.16lnln⨯⨯⨯⨯⨯⨯⨯===bc b b bc b bc V V V p V V RT MM WJ 10053.14⨯≈循环过程水蒸汽作的净功为J 10465.510065.510053.1334⨯=⨯-⨯=-=da bc W W W(4) 循环过程水蒸汽吸收的热量J10092.410053.110039.34441⨯=⨯+⨯=+∆=+=bc ab bc ab W E Q Q Q循环效率 %35.1310092.410465.5431≈⨯⨯==Q W ηp (atm )V (L)2、 质量为 ,摩尔质量为的理想气体,摩尔定压热容为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热学复习总结
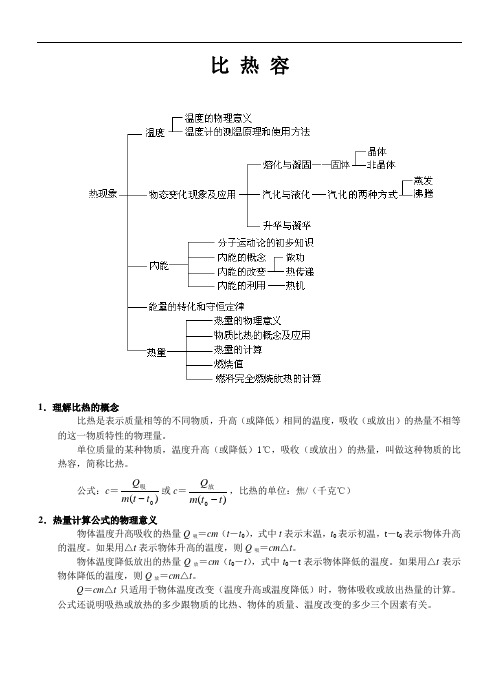
一、知识网络
二、重、难点知识分析
1、晶体与非晶体熔化过程分析
晶体吸收热量,温度上升,但状态不变,直到达到熔点;达到熔点后,继续吸热,开始熔化,但温度不变,直到全部熔化。
非晶体在整个吸热过程,温度逐渐上升,物体状态逐渐由固态变为液态。
二者主要区别是:熔化时,晶体温度不变,非晶体温度上升;越来越多的晶体迅速变为液态,所有受热非晶体缓慢地由固态变为液态(相对),要经历半固半液的中间状态。
2、晶体熔化、凝固的条件和液体沸腾的必要条件及应用
晶体熔化的必要条件:①达到熔点,②吸热;晶体凝固的必要条件:①达到凝固点点,②放热;液体沸腾的必要条件:①达到沸点,②吸热。
具体应用例题:
(1)把正在熔化的0℃的冰拿到0℃的房间里,问冰能不能熔化?
分析:冰要熔化,需要同时具备两个条件:①达到熔点,②吸热,温度为0℃,达到熔点,但周围温度也为0℃,冰不能从外界吸热(热传递的条件是存在温度差),所以不能熔化。
(2)如图所示,在大烧杯内盛一定量水,在试管内放有少量水,当烧杯内水被加热沸腾后,问试管内水能不能达到沸点,能不能沸腾?
分析:当烧杯内水沸腾后,试管内水的温度与外界一致,也达到沸点,但由于不能从外界吸热,所以不能沸腾。
3、热传递过程中热量的计算
在热传递过程中,高温物体温度降低,放出热量;低温物体温度升高,吸收热量。
如何计算物体吸、放热的多少呢?公式:Q=cmΔt,符号意义:Q──吸收(或放出)的热量──J;c──比热容──J/(kg?℃);m──吸(或放)热物体的质量──kg;Δt──变化的温度──℃。
计算中须注意:
(1)m的单位一定用kg;(2)Δt不是某一时刻的温度,而是变化的温度:
升高的温度:Δt=t-t
0;降低的温度:Δt=t
-t。
(3)如果没有热损失,对于两
个发生热传递的物体来说,Q
吸=Q
放。
4、能量的转化和转移例子
在本部分,能量的转化和转移例子较多,主要是内能与其它形式能的相互转化和内能在不同物体或同一物体的不同部分之间的转移。
常见例子:做功改变物体内能中,对物体做功,是机械能转化为内能,物体对外做功,是内能转化为机械能;热传递是内能的转移,燃料燃烧是化学能转化为内能和光能;等等。
5、根据比热容分析问题
比热容是反映物质吸、放热能力的一种特性,通常根据比热容分析问题有两类:
(1)根据物体吸、放热情况判断物质的比热容,例如:如图所示,是一位同学给两个物体加热时,所绘制的温度──时间图象,已知给两个加热的热源完全相同,假设物体相同时间吸收的热量相等,且两物体的质量相等,试分析组成两物体的物质的比热容大小关系。
分析:因为在相等时间内物体吸收的热量相等,且物体的质量相等,所以可根据Q=cmΔt,通过比较升高的温度的多少来判断两物体的比热容大小,温度升高的越多,物体的比热容越小。
根据图中虚线所标,在相等时间内甲的温度升高的多,所以甲的比热容较小。
(2)根据不同物质的比热容分析物体吸、放热情况和温度变化。
例1:为什么沿海地区的温差比内陆地区小?
分析:水的比热容大于干泥土的比热容,当沿海地区和内陆地区在相同的日照情况下,吸收或放出的热量相同,比热容大的物体温度变化较小,因此沿海地区的温差比内陆地区小。
例2:汽车发动机常用循环水来冷却,请问为什么用水做冷却物质?
分析:这是因为水的比热容大,在温度变化相同的情况下,能够吸收更多的热量,适合于做冷却剂。
6、关于物态变化的分析
判断物态变化主要分析变化前后的状态,例如:用铁水浇铸铸件。
分析:物体原来的状态为液体,铸件为固体,这一过程是由液态变为固态,所以为凝固;有时物体的状态没有明确说出,需要分析具体的状态,例如:夏天清晨,植物上常有露水。
分析:这一过程最终的状态是液态,可原来的状态却不清楚,到底是
固态,还是气态?因为是夏天,所以不可能是固态,因此是由气态变为液态,为液化过程。
特别是生活中“白气”的形成过程,首先分析“白气”的状态,它不可能是水蒸气,因为水蒸气是透明的,而“白气”是不透明的,所以“白气”一般是小液滴,为液态,也有时候为小冰晶,为固态;然后分析原来的状态,一般为气态,从而可确定物态变化。
夏天的“白气”一般为液化,例如:开水锅冒的“白气”;冰棒冒的“白气”;雾;等等。
冬天的“白气”比较复杂,液化、凝固、凝华都有可能。
三、相似辨析
1、热量、内能、温度
三个量是热学中常见的三个量,有时容易混淆。
它们之间的联系是:在热传递过程中,物体吸收(或放出)热量,物体的内能会增加(或减小),同时物体的温度一般会升高(或降低),也就是三个量中某一量在变化时,可能会伴随着其它两个量的变化。
三个量的区别:温度是表征物体冷热程度的物理量,它反映了物体内部大量分子无规则运动的剧烈程度,温度越高,分子运动越剧烈,分子具有的动能就越大,温度只能说“是”或“升高”、“降低”多少度;热量是在热传递过程中出现的一个物理量,实质是热传递过程中能量转移的数量,热量只能说“吸收”、“放出”,不能说“具有”多少热量,也就是说,热量只有物体在温度或状态发生变化时才有意义;内能是物体内大量做无规则运动的分子具有的动能和分子势能的总和,一切物体都具有内能。
2、蒸发、沸腾
相同点:都是汽化过程,都需要吸热。
不同点:(1)发生的温度不同:蒸发在任何温度下都能发生,而沸腾在一定温度下才能发生;(2)发生的位置不同:蒸发只发生在液体的表面,而沸腾是在液体的表面和内部同时发生;(3)发生的程度不同:蒸发是缓慢的汽化,而沸腾是剧烈的汽化。
3、冰、雪
相同点:都是同一种物质的同一状态。
不同点:一般情况下,冰是由液体(水)凝固形成的,雪是由气态(水蒸汽)直接凝华形成的。
辨别方法:如果透明,则为冰,凝固形成;如果不透明,则为雪,凝华形成。
4、热值、比热容
相同点:它们都是物质的一种特性,但不是物质的唯一特性,与物质的多少无关。
不同点:热值是燃料的特性,反映燃料燃烧放热能力的性质,起其单位是:J/kg;比热容是所有物质都具有的特性,反映物质在温度变化时吸、放热能力的性质,其单位是:J/(kg?℃)。
