2-第二章_逐步聚合反应
高分子化学-第二章 缩聚和逐步聚合
N0
N0
反应程度与转化率的区别
转化率:参加反应的单体量占起始单体量的分数,是指已 经参加反应的单体的数目
反应程度:则是指已经反应的官能团的数目
例如: 一种缩聚反应,单体间双双反应很快全部变成二聚体,就 单体转化率而言,转化率达100%;而官能团的反应程度 仅50%
反应程度与平均聚合度的关系
聚合度是指高分子中含有的结构单元的数目
聚加成:形式上是加成反应,但反应机理是逐步反应。 如聚氨酯的合成(p17)。
开环反应:部分开环反应为逐步反应,如水、酸引发的己内 酰胺的开环反应。
氧化-偶合:单体与氧气的缩合反应, 如 2,6-二甲基苯酚和氧 气形成聚苯撑氧,也称聚苯醚。
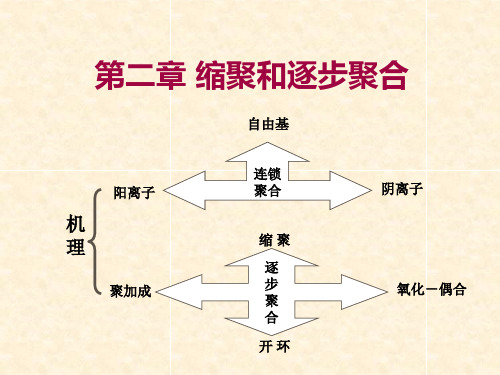
2 逐步聚合反应的特点
官能团间的反应,无特定的活性中心;无所谓的引发、 增长、终止等基元反应;反应逐步进行,每一步的反 应速率和活化能大致相同;
[ H + ][ A- ] KHA =
[ HA ]
[ HA ] [ H + ] [ A- ] = KHA
代入式
-d [ COOH ] = k1k3[ COOH ][OH ][ H+]
dt
k 2KHA
催化用酸HA:可以是二元酸本身,但反应较慢,也可以是 外加酸,如H2SO4,大大加速
自催化缩聚反应
无外加酸,二元酸单体催化剂,[HA] = [COOH]
Flory对此进行了解释:
官能团等活性理论是近似的,不是绝对的,这一理论大大简化了研 究处理,可用同一平衡常数表示,整个缩聚过程可以用两种官 能团之间的反应来表征
COOH + HO
k1
OCO
k1
2. 线型缩聚动力学
不可逆条件下的缩聚动力学
高分子化学第二章逐步聚合反应

2.1 缩合反应与缩聚反应
O
酯 化
CH3C_ OH + H_OCH2CH3
反
O
应
CH3C_OCH2CH3 + H2O
酰 胺 化
O CH3C_OH + H_NHCH2CH3
反
O
应
CH3C_NHCH2CH3 + H2O
双官能团单体的多步缩合反应:
H O O C(CH 2)4CO_O H+H _N H (CH 2)6N H 2
3、单体通式 a–R–c
H2N(CH2) 5OH 仅参加前面二类型的均缩聚或混缩聚反应而不能单独进行 聚合,这叫共缩聚反应,产物叫做共缩聚物。
合成一种线型缩聚物一般可有多种聚合反应路线和相应的 单体,但是按照这些单体的合成难易、聚合反应的难易以 及聚合物相对分子质量的高低,通常只有一两种单体是最 符合条件的。
2 与官能团所处的空间环境有关 对苯二胺 + 对Biblioteka 二甲酰氯 反应活性较低H2N_
_NH 2+CO l C _ _COl C 全芳聚酰胺
间苯二胺 + 间苯二甲酰氯 反应活性较高
H2N_ _NH 2+CO l C _ _COl C 全 芳 聚 酰 胺
3 环化反应倾向大小 羟基酸的聚合-环化反应倾向与碳原子数
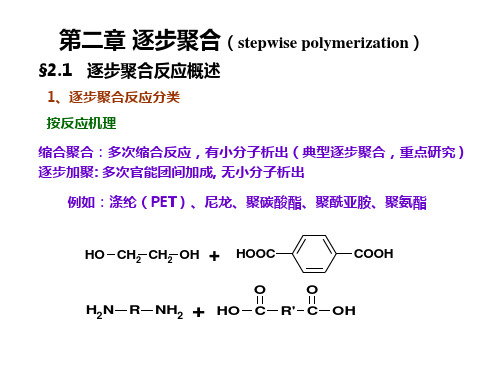
由带两个或两个以上官能团的单体之间连续、重复进行的缩 合反应称为缩合聚合反应,简称缩聚反应。
2.2 逐步聚合反应单体
2.2.1 线型缩聚反应单体的类型
1、单体通式 a–R–b
HO(CH2)5COOH
H2N(CH2) 5COOH
属于均缩聚反应,得到均缩聚物。
2-高分子化学(第四版)第二章--缩聚和逐步聚合反应

7810 1112如二元酸和二元醇,生成线形缩聚物。
通式如下:许多阶段性的重复反应而生成高聚物的过程,每一阶段都得到稳定的化合物。
实际过程中含有二聚体,三聚体,四聚体等,任何一个缩聚反应的单体转化率、产物聚合度与反应时间关系示意图聚合度与反应程度的关系37凝胶点的预测实验测定时通常以聚合混合物中的气泡不能上升时的反应程度为凝胶点。
凝胶点也可以从理论上进行预测。
多官能团单体参加反应只是体形缩聚反应产生凝胶化过程的一个必要条件,但不是充分条件,只有当反应单体的平均官能度大1.纤维:世界上约l/2的合成纤维是用PET制造的。
2.片材和薄膜PET片材是继PVC片材之后,用于医药品包装的片材,而在欧洲一些国家禁止PVC用于一次性包装之后,PET更成为主要的医药主链含碳酸酯结构的聚合物。
工业化仅限双酚A聚碳酸酯,耐热,强度好的工程塑料。
由于其抗冲性能和透明性特好,是热塑性可用作门窗玻璃,PC层压板广泛用于银行、使馆、拘留所和公共场所的防护窗,用于飞机舱罩,工业安67,前期进行水溶液聚合,达到一定聚合度后转盐,以防胺挥发,并达到等基盐可加少量单官能团醋酸或己二酸微过聚酰胺主链中引入芳环,增加耐热性和刚72以及由亚甲基桥连接的多元酚醇。
酚醛预聚物形成:酚醛缩聚平衡常数极大,可看作为不可逆反应,进行水溶液缩聚并不妨碍低分子预聚物的形成,为无规预聚物。
不碱性酚醛树脂主要用作粘合剂,生产层压板。
醛树脂。
8182其它缩聚产物的例子:89n C=N-R-N=C O O + n HOR'OH C-N-R-N-CO OOR'OH H96残留的羧基和亚胺基继续反应固化。
106107109115116界面缩聚由于需采用高活性单体,且溶剂消耗量大,设备利用率低,因此虽然有许多优点,但工业上实际应用并不型聚碳酸酯。
高分子化学 第2章 逐步聚合反应1

N0-N N P= =1 - N0 N0
17
解:当己二酸过量时,尼龙-66的分子结构为
HO CO(CH2)4CONH(CH2)6NH n CO(CH2)4COOH
112 114
q+2 ( Na+Nb ) / 2 1 +r Xn = = = ( Na+Nb-2 NaP ) / 2 1 +r-2rP q+2( 1 -P )
表示了Xn与P、r或q之间的定量关系式
21
q+2 1 +r Xn = = 1 +r-2rP q+2( 1 -P )
讨论两种极限情况:
当原料单体等当量比时 即r=1或q=0
n HORCOOH
2-3、2-4官能度体系 如:苯酐和甘油反应 苯酐和季戊四醇反应
体形缩聚物
双官能度体系的成环反应
2-2或 2 官能度体系是线形缩聚的必要条件,但 不是充分条件 在生成线形缩聚物的同时,常伴随有 成环反应
9
2.2.3 平均官能度(f)
体系中可能反应的官能团总数(总当量数)被体系 分子数所除而得的结果。
与醛缩合,官能度为 3
官能度与官能团的关系?
如: 乙炔
7
对于不同的官能度体系,其产物结构不同
1-n官能度体系 一种单体的官能度为 1,另一种单体的官能度大 于1 ,即 1-1、1-2、1-3、1-4体系 只能得到低分子化合物,属缩合反应 2-2官能度体系 每个单体都有两个相同的官能团 可得到线形聚合物,如
第二章逐步聚合(stepwisepolymerization)分解
反应进度描述
a. 转化率无意义 b. 反应程度P:参加反应的官能团数/起始官能团数
Xn = 1/(1-P)
(2)大分子生长终止 热力学特征:平衡常数,粘度
动力学限制
a. 用单官能团封端 b. 副反应 ① 环化反应(聚合初期) 羟基酸HO(CH2)nCOOH 措施: 提高单体浓度, 降低反应温度, 利于线型聚合 ② 官能团消去反应(聚合中后期) ③ 化学降解反应(聚合中后期)(缩合反应的逆反应) ④ 链交换反应(聚合中后期)(不影响Mn,且利于Mn均 匀化)
b.
官能团位置
H2C OH
H
OH
HC OH H2C OH
H
H
§2.2
逐步聚合反应机理
单体+单体 单体+二聚体 单体+二聚体 反应速率 R1 平衡常数K1 R2 R3 R4 Rn K2 K3 K4 Kn
aAa+bBbaABb+ab aABb+ aAaaABAa+ab aABb+ bBb bBABb+ab ……
不平衡线形逐步聚合
非线形逐步聚合
2、逐步聚合反应的单体 (1) 单体的官能团与官能度 官能团:参与反应并表征反应类型的原子(团) 官能度:单体分子中反应点的数目叫做单体官能度(f ), 一般就等于单体所含功能基的数目。
官能团的数目和位置:
OH
酸性
+
HCHO
碱性
(2) 单体的反应能力 a. 官能团种类 酰氯 > 酸酐 > 酸 > 醚或酯
+
HOOC
O O R' C
COOH
H2N
R
NH2
+
第2章逐步聚合反应

合度倒数的平方。
讨论: ① 对于密闭体系,nw=P,则:缩聚产物的平均聚合度与反
应析出的小分子浓度成反比。
因此,对平衡常数不大的缩聚反应,在密闭体系中得不到
高相对分子质量的产物。
2.2 线型缩聚反应
① 对于敞开体系,不断排出析出的小分子产物,当缩聚 物相对分子质量很大时,N0>>N,可认为:P=1,则 :
本章学习目标
能力目标 能运用线型缩聚反应的基本原理分析与解释典型线型缩聚反 应的工艺条件与控制措施; 能运用体型缩聚反应的基本原理和特点合理制定典型体型缩 聚产物的制备方案; 能对缩聚反应的原料配料、反应程度、聚合度、凝胶点等重 要工艺参数进行必要的计算; 能熟悉重要线型缩聚物与体型缩聚物的结构及其合成方法。
结论:利用活性中心的不同活性,可以控制反应的阶段性。
单体中官能团的空间分布——影响高聚物的结构与性能
在单体中参加反应的官能团的空间分布对缩聚反应及产物 的性质也有很大的影响。
2.2 线型缩聚反应
2.2.1 线型缩聚反应的机理
100
1
(1) 线型缩聚反应的机理特征 4000
2
80
线型缩聚反应由一连串的缩
2.1 概述
缩聚反应的分类 按反应产物的分子结构不同分类
线型缩聚反应——产物为线性结构
体型缩聚反应——产物为支链结构或体型结构
2.1 概述
按反应中生成的键合基团分类
2.1 概述
按参加反应单体的种类分类 均缩聚反应;实例:ω-氨基酸、 ω-羟基酸等单体进行
缩聚反应。 混缩聚反应:实例:二元酸与二元胺、二元酸与二元醇
2.1 概述
(4) 单体的反应能力
单体的反应能力对聚合速率的影响 对于聚酯反应,酰化剂所带官能团的反应能力顺序为: 酰氯>酸酐>羧酸>酯 所以:二元酰氯与二元醇反应生成聚酯的速率最快, 酸酐次之,然后是羧酸和酯。
第二章 逐步聚合反应

PPO
5)Diels-Alder 反应
共轭双烯烃与另一烯类发生1,4加成,制得梯形聚合 物,即多烯烃的环化聚合。
O H 2C CH2 + H2C CH2 O
O
n O
2.2 缩聚反应
2.2.1 缩聚反应 在众多有机化合物中,有许多种类的化合物都 可以发生两种或相同官能团之间的缩合反应。例如:
ClOC6H4COCl>HOOCC6H4COOH>HO(CH2)2OOCC6H4COO(CH2)2OH
2.单体参加聚合反应的活性还与其功能团的空间环境有关。 对苯二胺+对苯二甲酰氯全芳聚酰胺 间苯二胺+间苯二甲酰氯全芳聚酰胺 单体反应活性不同, 聚合物的性能也不同。
又如:甘油参加一般缩聚反应时两个 伯羟基的反应活性较高而仲羟基的活性 较低。
HO OC6H4COO(CH2)2O
H
m1
+ HO O(CH2)2OOCC6H4CO H
m2
R' OH
O H [ O C R
O C O R' ] n OH + HO R' [ O
O C R
O C O R' ] m OH
原因:单功能团杂质,单体对聚合物的裂解。 结果:大分子变小,平均相对分子质量降低。 措施:提高原料纯度,特别减小单功能团化合物的含量。
2.1 引言
按聚合机理或动力学分类:
※ 连锁聚合(Chain Polymerization)
活性中心(Active Center)引发单体,迅速连锁增长
自由基聚合 活性中心不同 阳离子聚合 阴离子聚合 ※ 逐步聚合(Stepwise Polymerization)
第二章逐步聚合反应

例2 : HOOC(CH2)4COOH + H2N(CH2)6NH2 HOOC(CH2)4CONH(CH2)6NH2 + H2O ( 二聚体)
反应总式:f = 2,2 体系
采用2-2官能度反应体系
若采用2-2官能度反应体系,其结果与含单个 官能团的体系不同 如用己二酸和丁二醇反应,一分子己二酸和 一分子丁二醇缩合一次就生成一分子H2O,同时 形成一个二聚体 这种二聚体因仍含有端羟基和羧基,可以进一 步与单体酸或醇缩合,也可跟另一个二聚体分子及 n-聚体缩合,如此逐步反应就可得到线型高分子 聚酯。
(2-2) (2-3)
=
结构单元总数 大分子数
=
N0 N
由(2-3)可知:
1 Xn
=
N N0
代入(2-2)得:
P = 1-
1 Xn
1 Xn = 1 P
(2-4)
例2:等mol比 HOROH + HOOCR’COOH体系
t=0
t=t
-OH: N0 ,-COOH: N0
-OH: N , -COOH: N
+
缩聚反应是被人们最早发现为制备聚 合物的合成反应,第一个合成高分子 (酚醛树脂,1909)即是缩聚物
现今缩聚反应无论在理论、实践上都 不断有新的发展、新品种、新工艺、新方 法、新反应不断出现,反映了这一领域活 跃的现状。
2.2 缩聚反应
缩聚反应是缩合聚合反应的简称,是指带有官 能团的单体经许多次的重复缩合反应而逐步形 成聚合物的过程,在机理上属于逐步聚合 有机反应中许多官能团间的反应即为缩合反应, 除主产物外,还有副产物生成 例如醋酸与乙醇的酯化反应是典型的缩合反应, 主产物是醋酸乙酯,副产物是水
02 逐步聚合

第二章逐步聚合第一节概述一、逐步聚合反应的分类1、缩合聚合反应通过缩合作用生成聚合物的反应,简称“缩聚反应”。
PET、PA66、PC等。
2、加成缩合聚合反应通过加成反应和缩合反应交替进行生成聚合物的反应。
酚醛树脂、氨基树脂、环氧树脂。
3、氧化偶联聚合反应通过氧化偶联反应生成聚合物的反应。
苯的氧化偶联聚合生成聚苯;酚的氧化偶联聚合生成聚苯醚。
4、逐步加成聚合反应通过加成反应逐步生成聚合物的反应。
聚氨酯的合成、D-A聚合等,反应式见p181表7-1。
二、缩聚反应的基本概念1、官能度指1个分子中能够参与反应的官能团个数。
2、缩合反应指有机官能团之间的相互作用,除主产物外,还有副产物生成。
如果是1-n体系,缩合反应的结果只能得到低分子物。
3、线形缩聚2-2体系或2体系进行缩合反应(缩聚),形成线形缩聚物。
naAa + nbBb → a-(AB)n-b + (2n-1)abnaRb → a-R n-b + (n-1)ab除聚合速率外,分子量控制是线形缩聚的关键。
4、体形缩聚2-3、3-3体系进行缩聚,形成体形缩聚物,例如:醇酸树脂。
除聚合速率外,凝胶点控制是体形缩聚的关键。
5、缩聚反应的官能团改变官能团的种类、个数、残基,就可合成出众多的缩聚物。
第二节线形缩聚机理除聚合速率外,分子量的影响和控制是线形缩聚中的核心问题。
一、线形缩聚与成环倾向1、反应倾向一般来说,5、6元环比较稳定,因此如果形成的是5、6元环,则易发生成环反应;否则,主要发生线形缩聚反应。
2、影响因素单体浓度,影响着成环反应与线形缩聚的竞争。
成环反应是单分子反应,缩聚则是双分子反应,因此,低浓度有利于成环反应,高浓度有利于缩聚反应。
二、线形缩聚的机理n-聚体 + m-聚体→(n + m)-聚体 + 低分子物1、逐步性(1)特点a、没有特定的活性种。
缩聚初期,主要是单体之间、单体和低聚物之间的反应,以后则是低聚物之间的反应。
b、没有活化能不同的链引发、链增长、链终止等基元反应,各步反应的速率常数和活化能都相等。
第2章逐步聚合习题参考答案

第二章 缩聚与逐步聚合反应-习题参考答案1.名词解释:逐步聚合;缩合聚合;官能团等活性;线型缩聚;体型缩聚;凝胶点;转化率;反应程度。
答:逐步聚合——单体转变成高分子是逐步进行的,即单体官能团间相互反应而逐步增长。
缩合聚合——由带有两个或两个以上官能团的单体之间连续、重复进行的缩合反应。
官能团等活性——在一定聚合度范围内,官能团活性与聚合物分子量大小无关。
线型缩聚——参加反应的单体都含有两个官能团,反应中形成的大分子向两个方向增长,得到线型缩聚物的一类反应。
体型缩聚——参加反应的单体中至少有一种单体含有两个以上的官能团,且体系平均官能度大于2,反应中大分子向三个方向增长,得到体型结构的聚合物的这类反应。
凝胶点——开始出现凝胶瞬间的临界反应程度。
转化率——参加反应的单体量占起始单体量的分数反应程度——参与反应的基团数占起始基团的分数。
3.由己二元酸和己二胺等摩尔合成尼龙—6,6。
已知聚合反应的平衡常数K=432,如果要合成聚合度在200的缩聚物,计算反应体系中的水含量应控制为多少?解:n X =n X =200,K=432代入此式可得: 224320.0108200w n K n X === 答:反应体系中的水含量应控制为0.0108 mol/L.4.计算等摩尔的对苯二甲酸与乙二醇反应体系,在下列反应程度时的平均聚合度和分子量。
0.500,0.800,0.900,0.950,0.995。
解: 等物质量条件下,有PX -=11,聚苯二甲酸乙二醇酯结构单元的分子量:M 0=192。
11n X p=-,n o n X M M ⨯=,因此各反应程度时的平均聚合度和分子量见下表:7.氨基己酸进行缩聚反应时,如在体系中加入0.2mol%的醋酸,求当反应程度P 分别达到0.950,0.980,0.990时的平均聚合度和平均分子量。
解: 方法1:2212 1.998'110.002a a ab b f N f N N N ⨯⨯===++++ 当p=0.950时,22202 1.9980.9502n X pf ==≈-⨯- 214010720=⨯=⨯=n o n X M M当p=0.980时,22482 1.9980.9802n X pf ==≈-⨯- 513610748=⨯=⨯=n o n X M M当p=0.990时,22912 1.9980.9902n X pf ==≈-⨯- 937910791=⨯=⨯=n o n X M M方法2:rpr r Xn 211-++=, NcNa Na r 2+==0.996 P=0.95, 20=XnP=0.98, 46=XnP=0.99, 83=Xn8.用Carothers 法计算下列聚合反应的凝胶点:(1)邻苯二甲酸酐+甘油,摩尔比3:2。
第二章 逐步聚合反应.

第二章 逐步聚合反应§2.1 概述前面提到,大部分缩聚反应属于逐步聚合机理,因此,以缩聚反应为例来阐述逐步聚合反应的规律和特点,并介绍重要逐步聚合物。
缩聚是基团间的反应,乙二醇和对苯二甲酸缩聚成涤纶聚酯,以及己二酸和己二胺缩聚成聚酰胺-66,都是典型的例子。
nHO(CH2)2OH+n +(2n-1)H 2O 2)22)4CONH(CH 2)6H nHOOC(CH 2)4COOH+nH 2N(CH 2)6NH +(2n-1)H 2O缩聚在高分子合成中占有重要的地位,聚酯、聚酰胺、酚醛树脂、环氧树脂、醇酚树脂等杂链聚合物多由缩聚反应合成。
此外,聚碳酸酯、聚酰亚胺、聚苯硫醚等工程塑料,聚硅氧烷、硅酸盐等半无机或无机高分子,纤维素、核酸、蛋白质等天然高分子都是缩聚物,可见缩聚反应涉及面很广。
特别是近年来通过缩聚反应制得了许多性能优异的工程塑料和耐热聚合物。
缩聚逐步聚合不论在理论上还是在实践上都发展得很快,新方法、新品种、新工艺不断出现,这一领域十分活跃。
还有不少非缩聚的逐步聚合,如合成聚氨酯的聚加成、制聚砜的芳核取代、制聚苯醚的氧化耦合、己内酰胺经水催化合成尼龙-6的开环聚合等。
这些聚合反应产物多数是杂链聚合物,与缩聚物相似。
§2.2 缩合反应与缩聚反应一、缩合反应——两个官能团间缩掉一小分子进行的化合反应缩合反应的反应物中每个反应物只能有一个官能团。
例如:O H H COOC CH OH CH CH COOH CH 2523233+→+O H CH CONHCH CH NH CH H C COOH CH 23232233+→+O H CH OCH CH CH OH CH CH 22322323+→O H OCOCH CO CH COOH CH 22333+→分别生成酯、酰胺、醚和酸酐。
二、缩聚反应1、缩聚反应的定义由两个或两个以上官能团的单体之间连续、重复进行的缩合反应,即缩合聚合反应,简称缩聚反应。
章逐步聚合反应

第二章逐步聚合反应2.1逐步聚合反应概述逐步聚合反应在高分子合成工业中占有很重要的地位,是合成高分子化合物的重要方法之一。
通过这一反应已经合成了大量的有工业价值的聚合物,例如,人们所熟知的酚醛树脂、脲醛树脂、涤纶、尼龙、环氧树脂和聚氨酯等。
特别是近年来,逐步聚合反应的研究无论在理论上,还是在实际应用上都有了新的发展,一些高强度、高模量及耐高温等综合性能优异的高分子材料不断问吐。
例如,聚碳酸酯、聚砜、聚苯醚、聚酰亚胺及聚苯并咪唑等。
2.1.1 逐步聚合反应的分类可以根据不同的原则对逐步聚合反应进行分类,常见的有以下几种分类方法。
2.1.1.1 按聚合反应机理分类(1) 缩合聚合(缩聚反应)缩聚反应是缩合反应的多次重复,在官能团之间的每一步反应过程中,都有小分子副产物生成。
这乓最典型、最重要的逐步聚合,也是本章要讨论的重点。
许多重要的聚合物的合成反应(如聚酯,聚酰胺等)都属此类。
(2) 逐步加聚反应若逐步聚合的每一步反应都是官能团间的加成反应,并且在反应过程中出,就称逐步加聚反应。
如二元醇和二异氰酸酯的反应合成聚氨酯就属此类。
2.1.1.2 按反应热力学的特征分类(1) 平衡反应或称平衡可逆聚合反应通常系指平衡常数小于103的聚合反应酯的生成反应等。
如聚对苯二甲酸乙二醇酯的生成反应等。
(2) 不平衡反应或称不呵逆聚合反应通常系指甲—衡常数大于103的聚合反应。
这种方法一般是使用高活性的单体或采取其他相应的措施来实现。
如二元酰氯同二元胺生成聚酰胺的反应。
2.1.1.3 按聚合物链结构分类(1) 线形逐步缩聚参加聚合反应的单体都只带有两个官能团,聚合过程中,分子链成线形增长,最终获得的聚合物结构是可溶可熔的线形结构。
(2) 体型逐步缩聚参加聚合的单体至少有—种含有两个以上官能团,在反应过程中,分子链从多个方向增长,可以生成支化的和交联的体型聚合物,如丙三醇和邻苯二甲酸酐的反应。
2.1.1.4 按参加反应的单体种类分类(1) 均缩聚只有一种单体参加的缩聚反应,叫均缩聚。
《高分子化学》第2章 逐步聚合反应

1 概述
1. 1 逐步聚合的基本概念
逐步聚合是高分子合成最基本的类型之一。逐步聚合
的基本特征是官能团之间的反应。聚合度随时间逐步增 长,而转化率在聚合初期即可达到很高。
缩聚反应是最常见的逐步聚合反应。聚酰胺、聚
酯、聚碳酸酯、酚醛树脂、脲醛树脂、醇酸树脂等均为重 要的缩聚产物。
许多特殊结构的聚合物也都是通过缩聚反应制得的。 缩聚反应的基本特征是平衡和反应中脱出小分子。
26
第二章 逐步聚合反应
27
第二章 逐步聚合反应
2)聚合反应的可逆平衡 缩聚一般为可逆平衡反应,与低分子的缩合反应相似。
由于体系中所有的活性官能团具有同样的活性,因此可用 一个平衡常数来表示。
OH + COOH
OCO + H2O
K k1 [OCO ][H 2O] k 1 [OH][ COOH]
子降解,单体分子与聚合物分子之间存在可逆平衡的逐步 聚合反应。
如聚酯化反应:
n HOOC R COOH + n HO R' OH
聚合 水解
HO ( OC-R-CO O-R'-O )nH + (2n-1) H2O
9
第二章 逐步聚合反应
(ii)不平衡线形逐步聚合反应 聚合反应过程中生成的聚合物分子之间不会发生交换
18
第二章 逐步聚合反应
缩聚反应的单体转化率、产物聚合度与反应时间关系 示意图:
单 体 转 化 率
产 物 聚 合 度
反应时间
19
第二章 逐步聚合反应
3 线形缩聚反应机理
3.1 线形缩聚与成环反应
缩聚反应过程中常常存在两种环化反应:分子内环化与 单体单元内环化。 3.1.1 分子内环化
高分子课件第二章 逐步聚合反应

五、线型缩聚机理
许多缩聚物都是通过逐步聚合的机理聚合得到的。
单体(一聚体)
二聚体
三聚体
......
低聚体 + 低聚体
高聚体
低聚体 + 高聚体
高聚体
大多数缩聚反应都是可逆平衡反应
OH +
k1 COOH k-1
OCO
+ H2O
平衡常数
K
k1 k1
OCO H2O OH COOH
酯化反应的K=4。在实际生产中,为使反应尽量 向生成高聚物的方向移动,通常要采取措施将副产 物小分子尽量排除。如:通入惰性气体或抽真空。
a
a
AA
n
+n
A
如: a
b
b
BB
B b
AA A
B B BA A
A
B B BA
B AB B
A
B BB
3、按照热力学特征分 ⑴ 平衡缩聚
具有可逆变化特性的缩聚反应
如:
nHOROH + nHOOCR'COOH
H
OROOCR'CO n OH + (2n-1)H 2O
⑵ 不平衡缩聚反应
在缩聚反应的条件下不发生逆反应的缩聚反应
NH2(CH2)3COOH
成环—单分子反应 缩聚—双分子反应
O
( 内
C
CH3 CH
O
交 酯
/
O
H2C H2C
CH CH3
内
C
环
O
酯 )(
CH2
环
C O +H2O 酰
N
胺
H
)
故增加单体浓度,有利于缩聚反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH +
COOH
k1 k
1
OCO
k1 [OCO ][ H 2O] K k - 1 [OH ][ COOH ]
对所有缩聚反应来说,逐步特性是共有的,而可 逆平衡的程度可以有很大的差别
17
多数缩聚反应属可逆平衡反应
根据K值(平衡常数)大小,大致分三类:
(1)K较小的反应,如聚酯化反应(K≈4)。低分子 副产物的存在对分子量影响较大,可逆反应; (2)K中等的反应,如聚酰胺反应,K≈300~500, 低分子副产物对分子量有所影响;
HA 根据酸AH的解离平衡,
KHA = [H+][A-] [HA] [H+][A-] [HA] = KHA
H+ + A-
,可得:
2—8
2—9
代入式2—7,得到:
d[COOH] k 1 k 3 [COOH][OH] [H ] dt k 2 K 解离
将常数合并,可得到下式:
2—10
24
dC 2 - k `C dt
此时外加酸催化为二级反应
29
积分得
1 1 - k `t C C0
1 k`C0 t 1 1-P
P~t关系式
将 C = Co (1-P) 代入上式
Xn = k` C 0 t + 1
Xn~t关系式
外加酸催化缩聚反的聚合度随聚合时间变化较 快。通常外加酸催化缩聚反应的速率常数比自催化 聚合速率常数大 1~2 个数量级左右。因此工业上 常采用外加酸催化工艺。
d[COOH] k[COOH][OH ][H ] dt
2—11
反应体系中的氢离子可以来自于单体羧酸本身,也 可外加。这两种情况的动力学过程不同。
1)自催化缩聚
当二元酸和二元醇中两种基团数量相同,无外加酸, 则氢离子来自于二元酸本身。因此氢离子浓度等于 羧基数量,也等于羟基数量。式2—5可写成:
3.2、2-2体系反应物过量 基团数(摩尔) 比 r(<1) 体系中两原料的起始不同 官能团的摩尔数之比
Na r Nb
过量分率 q
某物质的过量分子数 q 未过量物质分子数
∴C = 1 P -
dp p2 k1 [(1 p ) 2 ] dt K
pnw dp 2 k1 [(1 p) ] dt K
总反应速率与反应速度,低分子副产物含量,平衡常数有关
32
五. 线形缩聚物的聚合度
影响缩聚物聚合度的因素:反应程度、平衡常数、基团数比 1. 反应程度对聚合度的影响
脂、环氧树脂等。
8
3.2 按参加反应的单体数分类
均缩聚:只有一个单体参加的反应。2官能度体系:aRb 共缩聚:两种或者两种以上单体参加的反应。 aAa+bBb+aA’a(改性)
3. 3 按聚合物的特征基团分类 - COOR (聚酯) -CONH(聚酰胺) -SO2 - NHCOO(聚砜) (聚氨酯)
2—5
22
因碳阳离子难以测定,利用第一步平衡反应来消除。
[C (OH)2 ] k1 [COOH][HA] k2 [A ]
2—6
代入2—5中,得:
[HA] d[COOH] k1k 3 [COOH][OH] dt k 2 [A ]
2—7
可见,聚酯化反应对羧基、羟基和酸均为一级反应。
23
25
dc kc 3 dt
2—12
分离变量,并积分,得:
1 1 2 2kt c2 c0
2—13
由反应程度概念,可得:
c0 c p c0
或
c c 0 (1 p)
2—14
代入2—12,可得:
26
1 2 2c 0 kt 1 (1 — p) 2
2—15
根据聚合度与反应程度的关系,可得聚合度随聚合 时间变化的关系式。
K K 1
1 Xn K 1 1 p
聚酯反应K≌4,在密闭系统内,最高的p值=2/3,
Xn 3
34
2.2非封闭体系
pnw (1 p) 0 K
2
1 Xn 1 P
K pnw
K nw
聚合度与K平方根成正比,
与低分子副产物浓度平方根成反比。
低分子物可以不断除去,可获得较高的反应程度和聚合度。 减少逆反应的措施:减压、加热或通惰性气体等排除副产物。
Xn
1 1 p
p↑,Xn↑
单体等摩尔或aRb型的单体,进行不可逆缩聚时(没有 考虑平衡与否),聚合度将随反应程度的加深而增加。
上式有局限性。
33
2. 平衡常数对聚合度的影响
2.1封闭体系
以聚酯反 应为例
当正逆反应达到平衡时,总聚合速率为零, 且两原料等当量时:
p
p2 (1 p) 2 0 K
应。∴ 逐步的可逆平衡反应。
12
3.4 聚合度与反应程度p的关系 反应程度p:参加反 平均聚合度:结构单
应的官能团数占起始 官能团数的分率。
元总数除以大分子数。
N0 N N p 1 N0 N0
Xn
N0 N
N0 DP 2N
Xn
1 1 p
以等当量的二 元酸和二元醇 或羟基酸.
(3)K很大的反应,可看作不可逆反应。如聚砜、聚 碳酸酯等反应。
18
2.4 线形缩聚动力学
“官能团等活性”:假定任何反应阶段,不论单体、二
聚体、多聚体或高聚物,其两端官能团的反应能力不 随分子链的增长而变化,那么每一步有反应的平衡常 数必然相同。
Flory提出了官能团等活性理论: 不同链长的端基官能团,具有相同的反应能 力和参加反应的机会,即官能团的活性与分子的 大小无关。 等活性的概念将有利于动力学的简化处理。
+ (2n-1)H2O
产物有特征基团
特点:
1. 缩聚物有特征结构官能团;
2. 有低分子副产物;
3. 缩聚物和单体分子量不成整数倍。
逐步形成大分子
低分子副产物
4
2. 官能度 官能度:反应物分子中能参加反应的官能团数。
1-1官能度体系:醋酸与乙醇反应体系,醋酸和乙醇均 为单官能团物质。 1-2官能度体系:丁醇(官能度为1)与邻苯二甲酸酐 (官能度为2)反应的体系。 体系中若有一种原料属单官能度,缩合后只能得
14
N0:体系中起始的官能团数(羧基或羟基数); N:反应到t时体系中残留的官能团数(羧基或羟基数)。
1mol二元酸与1mol二元醇反应:
Example
体系中的羟基数或羧基数为:
1*2=2mol(N0) 反应若干时间后,体系中残存的羧基数: 0.5mol(N); 大分子数: 0.5mol(有一个羧基,就有一条大分子)
35
3. 线形缩聚物聚合度的控制 反应程度 聚合度的重要影响因素,不是控制手段 平衡常数 控制分子量的有效办法——端基封锁法: 某一单体稍过量(即非等摩尔比),使大分子链端带有
相同的官能团;
naAa (n 1)bBb bB[ AB]n b
加一种单官能团物质,使其与大分子端基反应,起封 端作用。
aABb aAa(bBb) aABAa(bBABb) ab a( AB)b a( AB)b a( ABAB)b ab n 聚体 m 聚体 (n m) 聚体 水
反应是官能团间的反应,无明显的引发、增长、终止, 反应是一步步增长的,具有逐步性。且每一步是可逆反
0.5 p 1 0.75 2
2 Xn 4 0.5
15
1 Xn 1 p
P=0.9 P=0.9995
聚合度将随反应程度而增加;
符合此式须满足的条件:官能团 数等当量。
X n 10 X n 200
16
3.5 缩聚反应平衡常数 大部分线型缩聚反应是可逆反应,但可逆程度有差别 可逆程度可由平衡常数来衡量,如聚酯化反应:
2-2或2官能度体系的单体进行缩聚形成线 形缩聚物。
6
3. 缩聚反应的分类 3.1 按聚合物的结构分类 线形缩聚
单体含有两个官能团,形成的大分子向两个方向增长, 得到线形缩聚物的反应。如涤纶、尼龙、聚碳酸酯等。 体形缩聚 至少有一单体含两个以上的官能团,形成的大分子向 三个方向增长,得到体形结构缩聚物的反应。如酚醛树
3. 4 按聚合方法分类 溶液、熔融、界面、固相缩聚
9
2.3 线形缩聚反应机理
1. 线形缩聚单体
条件:1)必须是2-2、2官能度体系;
2)反应单体要不易成环;
3)少副反应,保证一定的分子量 ; (副反应包括:成环反应,链交换、降解等反应等)
10
3. 线形缩聚机理——逐步与可逆 3.1 机理
aAa bBb aABb ab
31
聚酯反应速率是正、逆反应速率之差 封闭体系: 水部分排出时:
dC k1C 2 k 1 (1 C ) 2 dt
dC k1C 2 k 1 (1 C )nw dt
根据反应程度及平衡常数关系式
N0-N C-C 1 C 0 - P= = = N0 C0 1
K=k1/k-1
到低分子化合物。
5
2-2官能度体系:如二元酸和二元醇,生成线形缩聚 物。通式如下:
naAa nbBb a[ AB]相互反应的官能团A、B(如
氨基酸、羟基酸等),可经自身缩聚,形成类似的线形 缩聚物。通式如下:
naRb a[ R]n (n 1)ab
为了加速反应,常外加酸作为聚酯化反应的催化剂 反应速率将由自催化和酸催化两项组成:
dC - = kC3 + ka [ H + ] C 2 dt
dC - = ( kC + ka [ H + ])C 2 dt
