案例5 碳正离子的重排
有机化学第五版下册课后答案

第十二章羧酸P32-331.命名下列化合物或写出结构式:1 3-甲基丁酸2 3-对氯苯基丁酸3 间苯二甲酸4 9,12-十八碳二烯酸5 4-甲基己酸 CH3CH2CHCH3CH2CH2COOH6 2-羟基丁二酸 HOOCCHOHCH2COOH7 2-氯-4-甲基苯甲酸8 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:第四版保留4.完成下列转变:5、怎样由丁酸制备下列化合物6、解:7、指出下列反应中的酸和碱;按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱;8.1按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔2按碱性降低的次序排列下列离子:①碱性:CH3HC C CH3O>>②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度;产物DC5H 10有一个不饱和度;从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇;10.解:1由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2;2该烃有旋光性,氧化后成二元酸,所以分子量=662=132;故二元酸为CH3CHCH2COOHCOOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR 谱图:3200-2300cm-1为羟基中O-H键的伸缩振动;1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的 C-H键的面外弯曲振动;再由化学性质知D为羟酸,其中和当量为121±1,故D的分子量为122,因此,又由题意:E为氨基酸,分子量为75,所以E的结构为H 2NCH2COOH;第十三章羧酸衍生物P77-781.说明下列名词:酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂;酯:是羧酸分子和醇分子间脱水形成的产物;油脂:是高级脂肪酸的甘油醇酯;皂化值:是指完全皂化1克油脂所需的KOH的质量以mg为单位;干性油:是指那些在空气中放置后能逐渐变成有韧性的固态薄膜的油;碘值:是指100克油脂完全加成时所能吸收的碘的质量以克为单位;非离子型洗涤剂:此处实指非离子型表面活性剂,即在水溶液中不离解出正负离子的表面活性剂此处的非离子型表面活性剂起主要的洗涤去污作用;2.试用方程式表示下列化合物的合成路线:(1)由氯丙烷合成丁酰胺;2 由丁酰胺合成丙胺3 由邻氯苯酚、光气、甲胺合成农药“害扑威”或先醇解后氨解也可;3.用简单的反应来区别下列各组化合物:解:前一化合物与水几乎不反应,而后一化合物因水解而冒烟;2 丙酸乙酯与丙酰胺解:分别与氢氧化钠水溶液作用,并加热,有氨气放出使红色石蕊试纸变蓝色者为丙酰胺,否则为丙酸乙酯;3 CH3COOC2H5和 CH3CH2COCl解:前一化合物与水不反应,而后一化合物因水解而冒烟;4 CH3COONH4和CH3CONH2解:在常温下与氢氧化钠水溶液作用,有氨气放出使红色石蕊试纸变蓝色者为乙酸铵,否则为乙酰胺;注:此试验不需加热,否则乙酰胺因水解也有氨气放出;5 CH3CO2O 和 CH3COOC2H5解:用适量热水试之,乙酸酐因水解而溶解于水,乙酸乙酯因难以水解而不溶于水; 或用碱性水溶液彻底水解,再将水解液进行碘仿反应,呈阳性者为乙酸乙酯,呈阴性者为乙酸酐;4.由合成解:5.由丙酮合成 CH33CCOOH解:种用酮的双分子还原,片呐醇重排反应和碘仿反应进行合成;6.由五个碳原子以下的化合物合成:解:顺式烯烃,最常用的合成方法是炔烃的顺式还原,用Lindlar催化剂最好;7.由ω-十一烯酸CH2=CHCH28COOH合成H5C2OOCCH213COOC2H5;解:目标产物比原料增加了碳原子,为此必须选用合适的增长碳链方向;8、由己二酸合成解:从6个碳缩成为5个碳,正好是一个α位碳进攻酯基碳的结果,宜用酯缩合反应;目标分子中的乙基酮的α位,可以用卤代烃引入;9.由丙二酸二乙酯合成解:分析乙酸单元后可见,目标产物只需在丙二酸分子中引入亚乙基即可;合成路线如下10.由合成解:或11.由合成解:硝酸具有氧化性,易将酚类氧化,需先进行“保护”;12、由合成解:目标产物是在原甲基的邻位再导入烃基,显然要用上苯环上的烷基化反应或酰基化反应,即以Freidel-Crafts反应为主;13.由合成解:14.由苯合成解:15.某化合物A的熔点为85°C,MS分子离子峰在480m/e,A不含卤素、氮和硫;A的IR在1600cm-1以上只有3000~2900cm-1和1735cm-1°C,B和C的NMR证明它们都是直链化合物;B用铬酸氧化得到一个中和当量为242的羧酸,求A和B的结构; 解:1 MS分子离子峰在480m/e,说明化合物分子量为480;2 题目已知醇为直链醇,酸为直链酸;3 A能皂化,说明A为羧酸酯;4 B氧化后所得羧酸的分子量为242,则其式量符号下式关系:C n H2n+1COOH = 242,解得: n = 14所以B为: CH3CH214OH ,式量为228;5 C的分子量为480-227+17 = 270,则C的式量应符合:C n H2n+1COOH = 270,解得: n = 16所以C为: CH3CH215COOH ;综合起来,化合物A的结构为: CH3CH215COOCH214CH31735处为C=O伸缩振动吸收,3000~2900处为饱各C—H键伸缩振动吸收;注:此题有误,中和当量为242的羧酸改为中和当量为256A C15H31COOC16H33 B的结构为C16H33OH第十四章含氮有机化合物P125-1291.给出下列化合物的名称或写出结构式:1对硝基氯化苄21,4,6-三硝基萘 3苦味酸4 6 3-氨基戊烷72-氨基丙烷或异丙胺8二甲基乙基胺或N,N-二甲基乙胺9N-乙基苯胺10顺-4-甲基环己胺 11N-甲基间甲苯胺122,4-二羟基偶氮对硝基苯或对硝基偶氮-2,4-二羟基苯133-氰基-5-硝基氯化重氮苯2.按其碱性的强弱排列下列各组化合物,并说明理由:1 吸电子基使碱性降低,供电子基使碱性增强,所以有:2 吸电子基使碱性降低,供电子基使碱性增强,所以有:2.比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由:解:五种化合物中,按形成氢键的可能、能力可推知其沸点从高到低的次序是:正丙醇 > 正丙胺 > 甲乙胺 > 三甲胺 > 正丁烷4.如何完成下列转变:12345.完成下列反应,并指出最后产物的构型是R或S:解:反应的前两步都不涉及到手性碳,反应的第三步为Hofmann重排,转移基团在分子内转移,其构型保持不变;由于分子组成而变了,旋光性可能改变,也可能不变,此处测定结果为左旋;6.完成下列反应:1该题如果改换一下甲基的位置,则情况不同,如下:234或5利用Hofmann重排反应降级反应来完成缩碳:6利用卤代烃的氰解来增加一个碳原子:78芳环上的亲核取代反应,先加成后消去:9不对称酮形成烯胺后,再进行烃基化时,烃基化主要发生在取代基较少的α位;与普通碱催化反应正好相反;NOH:10含β-H的氧化叔胺在加热时发生顺式消除反应协同反应生成烯烃和R27.指出下列重排反应的产物:1碳正离子的形成及其重排:2碳正离子的形成及其重排:3碳正离子的形成及其重排:片呐醇重排反应:4碳正离子的形成及其重排:片呐醇重排反应:5碳正离子的形成及其重排:片呐醇重排反应:6Wolff重排:7Beckmann重排:8Baeyer-Villiger重排:8.解释下述实验现象:1对溴甲苯与NaOH在高温下反应,生成几乎等量的对和间甲苯酚;22,4-二硝基氯苯可以由氯苯硝化得到,但如果反应产物用NaHCO3水溶液洗涤除酸,则得不到产品;解:1溴苯一般不易发生亲核取代反应,该反应是经过苯炔中间体历程进行的,表示如下:解:2氯苯可以直接硝化生成2,4-二硝基氯苯,但2,4-二硝基氯苯因两个硝基的吸电子作用,使其很易水解,生成2,4-二硝基苯酚,所以得不到2,4-二硝基氯苯的产物;9.请判断下述霍夫曼重排反应能否实现,为什么原第四版解:该反应不能实现,因为仲胺分子中N原子上没有两个可被消去的基团,无法形成氮烯中间体.9. 完成下列反应的反应历程;3解:本题为Hofmann重排类型的题目;只是反应体系发生了变化,NaOH水溶液改变了CH3ONa的甲醇溶液,所以最后形成的是较稳定的氨基甲酸甲酯,,而不是易分解的氨基甲酸;10.从指定原料合成:1从环戊酮和HCN制备环己酮;2从1,3-丁二烯合成尼龙-66的两个单体-己二酸和己二胺;3由乙醇、甲苯及其他无机试剂合成普鲁卡因4由简单的开链化合物合成(1)解:2解:3解:4解:11.选择适当的原料经偶联反应合成:12,2′-二甲基-4-硝基-4′-氨基偶氮苯第四版第五版: 2,2′-二甲基-4′-氨基偶氮苯2解:12.从甲苯或苯开始合成下列化合物:1间氨基苯乙酮2邻硝基苯胺3间硝基苯甲酸41,2,3-三溴苯5613.试分离下列各组化合物1PhNH2、PhNHCH3和PhNCH32的混合物:214.试剂丙胺甲基乙基胺三甲胺1对甲基苯环磺酰氯生成白色固体生成白色固体不反应15.892C,C用HNO 2处理,再与H 3PO 2反应生成3,3-二乙基联苯D;试写出A 、B 、C 和D 的结构式; 解:16.某化合物A,分子式为C 8H 17N,其核磁共振谱无双重峰,它与2mol 碘甲烷反应,然后与Ag 2O 湿作用,接着加热,则生成一个中间体B,其分子式为C 10H 21N;B 进一步甲基化后与湿的Ag 2O 作用,转变为氢氧化物,加热则生成三甲胺、1,5-辛二烯和1,4-辛二烯混合物;写出A 和B 的结构式;解:能与两摩尔碘甲烷反应,说明为一个仲胺;根据产物烯的位置可推知: NMR 无双重峰,说明其旁没有单个H;这句话排除了如下结构式的可能:16.化合物A 分子式为C 15H 17N,用苯磺酰氯和KOH 溶液处它没有作用,酸化该化合物得到一清晰的溶液,化合物A 的核磁共振谱如下图所示,试推导出化合物A 的结构式; 解:化合物分子式为,C 15H 17N,不饱和度为8,分子中可能含2个苯环;结合NMR 谱图可得:18.请用概念图或思维导图的形式总结芳香烃衍生物的合成方法;第十五章 含硫和含磷有机化合物 P 163-1651.写出下列化合物的结构式:(1) 硫酸二乙酯 2甲磺酰氯 3对硝基苯磺酸甲酯 4磷酸三苯酯 5对氨基苯磺酰胺 62,2’-二氯代乙硫醚 7二苯砜 8环丁砜 9苯基亚膦酸乙酯 10苯基亚膦酰氯 119-BBN 9-硼双环3,3,1-壬烷 9-BBN 2.命名下列化物:2-羟基乙硫醇 巯基乙酸 对磺酸基苯甲酸 对甲苯磺酸甲酯 羟甲基乙基硫醚或乙硫基甲醇 碘化二甲基环己基锍 氯化四羟甲基鏻 N -甲基-对甲苯磺酰胺 苯基膦酸二乙酯或O,O -二乙基苯膦酸酯 甲基乙基亚膦酰氯 11C 6H 53SiOH 12 CH 33O-SiCH 33三苯基硅醇三甲基叔丁氧基硅烷3.用化学方法区别下列化合物:1234解:1乙硫醇能溶于稀的氢氧化钠溶液中,而二甲硫醚不溶;2分别加入碳酸钠溶液,有二氧化碳气体逸出的为乙磺酸,无则为甲磺酸甲酯;3硫醇可溶于稀的氢氧化钠溶液中,而醇不溶;4前者不易水解,后者更易水解,后者不潮湿的空气中会水解冒烟;4.试写出下列反应的主要产物:解:1 23 4 55.完成下列转化:123456786.使用有机硫试剂或有机磷试剂,以及其他有关试剂,完成下列合成:123解:123第十七章周环反应1.推测下列合物电环化时产物的结构:2.推测下列环加成反应的产物的结构:3.马来酸酐和环庚三烯反应,给出的产物如下;试说明这个产物的合理性;环庚三烯的π电子是4n+2体系,加热是进行对旋电环化,然后再与马来酸酐进行4+2环加成反应,由于环状二烯的LUMO相互作用,可产生对称性允许的次级效应,有利于形成内型过渡态,最后生成内型产物;4.指出下列反应过程所需条件:5.试说明下列反应从反应物到产物的过程:该反应是反应经过两次碳的1,5同面迁移,且C构型保持;6.自选材料通过环加成反应合成下列化合物;7.自选材料通过环加成反应合成下列化合物;8.下面的反应按光化学进行时,反应产物可得到哪一种I或II解:1反应物π电子数属4n体系,光照下对旋是允许的,产物是I;2反应物中起电环化反应的π电子数属4n+2体系,光照下顺旋是允许的;产物是II;9.通过怎样的过程和条件,下列反应能得到给出的结果;10.通过什么办法反-9,10-二氢萘转化为顺-9,10-二氢萘11.确定下列反应在加热反应时所涉及的电子数;6个π电子电环化反应4个π电子电环化反应4+2环加成反应4+2环加成反应12.解释下列现象:1 在狄尔斯-阿尔德反应时,2-叔丁基-1,3-丁二烯反应速率比1,3-丁二烯快;2 在-78℃时,下面反应b的反应速率比a快1022倍;3解:1在狄尔斯-阿尔德反应中,双烯体是用其HOMO轨道提供电子的,属亲核部分,双烯体上有供电子叔丁基的存在时,使反应速率加快;2 a2+2环加成反应的逆反应,b 4+2环加成反应的逆反应,温度有利于4+2反应,光照有利于2+2环加成反应;3化合物是一个π-π共轭体系,本身有一定的稳定性,但它不是芳香环,而甲苯是一个芳香环,,从非芳香环重排成芳香环因芳香体系的形成将放出大量的热量;第十八章杂环化合物P2321.命名下列化合物:2.为什么呋喃能与顺丁烯二酸酐进行双烯合成,而噻吩及吡咯则不能试解释之;解:五元杂环的芳香性比较是:苯>噻吩>吡咯>呋喃;由于杂原子的电负性不同,呋喃分子中氧原子的电负性较大,π电子共轭减弱,而显现出共轭二烯的性质,易发生双烯合成反应,而噻吩和吡咯中由于硫和氮原子的电负性较小分别为和3,芳香性较强,是闭合共轭体系,难显现共轭二烯的性质,不能发生双烯合成反应;3.为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之;解:呋喃、噻吩和吡咯的环状结构,是闭合共轭体系,同时在杂原子的P轨道上有一对电子参加共轭,属富电子芳环,使整个环的π电子密度比苯大,因此,它们比苯容易进行亲电取代反应;4.吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式;5、比较吡咯与吡啶两种杂环;从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论;解:吡咯与吡啶性质有所不同,与环上电荷密度差异有关;它们与苯的相对密度比较如下:6、写出斯克劳普合成喹啉的反应;如要合成6-甲氧基喹啉,需用哪些原料4-甲氧基苯胺、甘油、浓硫酸、硝基苯7、写出下列反应的主要产物:8、解决下列问题:1 区别吡啶和喹啉;2 除去混在苯中的少量噻吩;3 除去混在甲苯中的少量吡啶;4 除去混在吡啶中的六氢吡啶;解:1吡啶溶于水,喹啉在水中的溶解度很小这是由于多了一个疏水性苯基的结果;2噻吩溶于浓H2SO4,苯不溶;用分液漏斗振荡后分液;3吡啶溶于水,甲苯不溶;4苯磺酰氯与六氢吡啶生成酰胺,蒸出吡啶;或根据六氢吡啶的碱性比吡啶的碱性强得多,将混合物先溶于乙醚等有机溶剂,再向溶液中加入适量的酸,将六氢吡啶和酸生成的盐沉淀出来;9、合成下列化合物:解:1210.杂环化合物C5H4O2经氧化后生成羧酸C5H4O3,把此羧酸的钠盐与碱石灰作用,转变为C 4H4O,后者与钠不起反应,也不具有醛和酮的性质,原来的C5H4O2是什么11. 写出下列Friedlnder反应机理;Friedl nder合成Friedl nder synthesis,又称Friedl nder喹啉合成或和任何含有-CH2CO-的或生成;反应以德国化学家 Paul Friedl nder 1857-1923 的名字命名;反应可用、、或其他;反应机理如下:反应有两种可行的机理;一是邻氨基苯甲醛或酮 1与羰基化合物 2发生生成 3,然后水生成4并再次失水化,得喹啉 7;另一种是 1 先与 2 缩合成,然后再发生分子内羟醛并失水,生成 7;注:R1:-H,R2:-CH3 R3:-COOC2H512.用浓硫酸将喹啉在220~230°C时磺化,得喹啉磺酸A,把A与碱共熔,得喹啉的羟基衍生物B;B与应用斯克劳普法从邻氨基苯酚制得的喹啉衍生物完全相同,A和B是什么磺化时苯环活泼还是吡啶环活泼解:磺化时苯环比吡啶环更活泼;A、B的结构如下:13.α、β-吡啶二甲酸脱羧生成β-吡啶甲酸烟酸,为什么脱羧在α-位解:脱羧是以偶离子的形式进行的,可表示如下:脱羧时涉及到碳-碳键的异裂,吡啶环持有负电荷;碳-碳键断裂时联想一下该决定速率步骤的过渡态,负电荷处在α-位能被电负性大的氮所分散,负电荷处在β-位则不能被有效的分散;因此,脱羧发生在α-位;14.毒品有哪几类,它的危害是什么解:一种类1.兴奋剂如:肾上腺素、安非他明、甲基安非他明、3,4-亚甲二氧基-N-甲基-1-苯基丙胺、咖啡因、尼古丁、柯卡因2.幻觉剂:麦角二乙酰胺、大麻3.抑制剂:巴比土酸盐、阿普唑仑、维利眠、鸦片制剂海洛因、可待因、吗啡二危害:略;第十八章糖类化合物p257-2581. 解释概念1还原糖p232:凡能被托伦试剂或菲林试剂等若氧化剂氧化的糖类,都称为还原糖; 2非还原性糖p232:凡不能被托伦试剂或菲林试剂等若氧化剂氧化的糖类,都称为非还原糖;3醛糖的递升和递降p236:醛糖经与HCN发生亲核加成增加一个碳原子后,再经水解,还原可生成多一个碳原子的醛糖,这个方法称为递升;反之去掉一个碳原子而生成低一级的糖的过程称为递降;4糖的变旋现象p240:在水溶液中糖的比旋光度发生变化的现象,称为变旋现象;5糖苷p240:糖的半缩醛羟基苷羟基与另一羟基化合物失水而生成的缩醛均称为“配糖物”简称为“苷”2.写出D-+-甘露糖与下列化合物的反应、产物及其名称:解:D-+-甘露糖在溶液中存在开链式与氧环式α型和β型的平衡体系,与下列 物质反应时有的可用开链式表示,有的必须用环氧式表示,在用环氧式表示时,为简单起见,仅写α-型;3. D-+-半乳糖怎样转化成下列化合物的 写出其反应式;4.果糖是酮糖,为什么也可像醛糖一样和托伦试剂或斐林试剂反应,可是又不与溴水反应 解:在碱性条件下,果糖可是通过差向异构化转化为醛糖葡萄糖和甘露糖,与托伦试剂或斐林试剂反应;在酸性条件下,不能发生异构化,转化为醛糖,所以不能与溴水反应; 5. 解 推导过程:1 戊糖与胲反应生成肟,说明有羰基存在;2 戊糖与4NaBH 反应生成C 5H 12O 4说明是一个手性分子;3C 5H 12O 4与乙酐反应得四乙酸酯说明是四元醇有一个碳原子上不连有羟基;4C 5H 12O 4与CH 3OH 、HCl 反应得糖苷C 6H 12O 4,说明有一个半缩醛羟基与之反应;糖苷被HIO4氧化得C 5H 10O 4,碳数不变,只氧化断链,说明糖苷中只有两个相邻的羟基,为环状化合物,水解得和,说明甲基在分子末端,氧环式是呋喃型;递推反应如下:C 5H 10O 4可能的结构式为:6.解:推导过程:1蜜二糖是还原性双糖,说明它有游离的半缩醛羟基;2蜜二糖是+-乳糖的异构物,能被麦芽糖酶水解,说明它是由半乳糖和葡萄糖以α-苷键结合的双糖;37.解:1糖水杨苷用苦杏仁酶水解得D-葡萄糖和水杨醇,说明葡萄糖以β-苷键与水杨醇结合;(CH)SO和NaOH处理得五甲基水杨苷,说明糖水杨苷有五个羟基,产物2水杨苷用324酸化水解得2,3,4,6-四甲基-D-葡萄糖和邻甲氧基甲酚邻羟基苄甲醚,说明葡萄糖以吡喃式存在并以苷羟基与水杨醇的酚羟基结合;此糖水杨苷的结构如下:8.推导过程:1茜根酸不与拖伦试剂反应,说明无游离半缩醛羟基存在;可见茜根酸的结构未肯定之处在于:1D-木糖和葡萄糖的构型α,β型;2樱草糖是否是还原糖,因此,樱草糖出现两种结构式;9.解:可见,I是D-型还原性单糖,不成脎说明α-位上无羟基,I经氧化,甲基化,酸的α-溴代,水解生成四羟基正戊酸说明了此点,I经Ruff降解得内消旋的酒石酸,证明3,4-位上羟基同侧,由题意,可推出II~VII的结构10.解:成脎反应发生在C1和C2上,这三种糖都能生成同一种脎D-葡萄糖脎,则可证明它们的C3,C4,C5具有相同的构型:11.解:推导过程:A的可能结构如下:B的可能结构如下:。
有机化学中常见涉及碳正离子中间体的重排反应及其特征探讨

肄
I CH 3
H
子, 然后脱去一分 子水 , 形成一个 叔碳正离子 中间体 , 叔碳 正离
H
,
子重排 后以更稳定 的羰基正 离子 的形式存 在 , 同时这 样 的羰 基 正 离子容易脱去质子, 最 后得到重排 产物。 如下 图所示 :
』
C H
R 一 一 CH 3
何供 电子 的共轭 效 应 , 如p 一叮 r 共轭 和超共 轭效 应等 , 都能使 碳
正离子 的稳 定性提高 。 丙醇重 排后 的碳 正离子还 是原来 的伯碳 正离子, 稳定性没有提 高, 所 以这样 的碳 正离子不会发 生重排 ,
稳定 的碳 正离子 中间体 , 这个 碳 正离子 经重 排后得 到较 稳定 的
碳 正离子 中间体 , 最后 经S 2 反应 或E 反应 后 得到相 应 的重排 产物 , 如下图所示 :
2 一 甲基一 1 一 丙醇和 2 , 2 一 二甲基一 4 一 甲基 戊醇 , 初 步形成 的分别是
伯碳 正 离子, 仲碳 正 离子 、 经 重 排后分 别生 成了更稳 定 的叔碳
有机 匕 学中常见涉及碳正离子中间体的 重排反应及其特征探讨
口 广西 师 范 大学 潘 英 明 刘 锦 玲
【 摘 要】 阐述有机化学中常见涉及碳正离子中间体的重排
— — — — -
。
c
反应 , 通过 对简单 醇重排反应 的分析, 总结出经过 碳正 离子 中间
体 的 亲核 重排 反 应 的 特征 。
丙 醇与2 一 甲基一 1 一 丙醇 和2 , 2 . 二甲一 4 一 甲基戊 醇反应 的区别 : 2 ~
【 中图分类号】G 【 文献标识码】 A 【 文章编号】 0 4 5 0 — 9 8 8 9 ( 2 ( ) 1 3 ) 1 2 C 一 0 1 4 6 — 0 3
碳正离子_精品文档

(3)频哪醇重排
5 碳正离子的应用
利用取代反应可以制备很多物质,而消去脱氢也是制备某些烯烃等的一种重要方法。阳离子聚合可以制备很多有用的高分子材料,但起反应机理有待进一步研究。
5. 重排反应,如Wagner-Meerwein重排,Demyanov 重排,频哪醇重排生成更稳定的碳离子
当醇羟基的b-碳原子是个仲碳原子(二级碳原子)或叔碳原子(三级碳原子)时,在酸催化脱水反应中,常常会发捷姆扬诺夫重排。脂肪族或脂环族伯胺与 亚硝酸作用而导致的重排,也可视为一种瓦格涅尔-米尔外因重排。
3.3 溶剂效应 溶剂化在形成碳正离子的过程中起着重要作用。
3.4 芳构化效应 根据休克尔规则,共面、共轭,p电子数等于4n+2 的环状体系具有芳香性,因此也比较稳定。
4 碳正离子的反应
碳正离子的反应很多,大致可以分为以下几类: 1.单分子亲核取代反应(SN1) 2.芳烃的亲电取代反应;
2.3 由其他正离子生成
如偶氮正离子脱去 N2 生成碳正离子
3 碳正离子稳定性影响因素
3.1电子效应 给电子基团使碳正离子稳定性增加,吸电子集团使碳正离子稳定性降低。
共轭效应可以明显稳定碳正离子
缺电子的p-Π共轭
3.2 空间效应
中心碳原子连接的基团越大,则张力越大,有利于碳正离子的形成。
如:
卤化烃在 Ag+或Lewis 酸中离解,卤原子带着一对电子离去,产生碳正离子;醇,醚,酰卤在酸或Lewis 酸作用下也可生成碳正离子;用超酸甚至可以从非极性化合物如烷烃中夺取H而生成碳正离子。
2.2 质子或其他阳离子与不饱和体系的加成
对于不饱和体系,可通过质子或其它带正电荷的原子团或Lewis 酸的加成来产生碳正离子。
碳正离子重排规律

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,重排结果是形成新的富电中心。
有机化学中的重排反应

有机化学中的重排反应重排反应是有机化学中一类重要的反应类型,它指的是在分子内,原子的连接方式发生改变,形成不同的同分异构体或结构异构体的化学反应。
重排反应在有机化学领域具有广泛的应用和重要的理论意义。
本文将介绍几种常见的有机化学重排反应及其机理和应用。
一、Wagner-Meerwein重排反应Wagner-Meerwein重排反应是一类重要的碳正离子重排反应,它指的是烷基或芳基正离子的骨架发生重新排列的反应。
该反应的机理是通过重排步骤使得碳正离子的位置发生变化。
例如,烷基正离子在重排反应中可以通过氢的迁移、碳骨架的迁移或者亲电自由基的捕获等方式形成不同位置的同分异构体。
Wagner-Meerwein重排反应在合成有机化合物中有着广泛的应用,可以用于构建碳骨架、生成复杂的天然产物分子以及合成药物等领域。
二、Claisen重排反应Claisen重排反应是一类重要的氧化重排反应,它经常用于合成酮或醛类化合物。
该反应是通过氧的迁移和碳骨架的重排来转化一个氧杂环底物或氧杂环中间体到另一个化合物。
Claisen重排反应在有机合成中得到了广泛的应用。
通过选择合适的底物和条件,可以有效地实现各种氧杂环化合物的合成和转化。
三、Hofmann重排反应Hofmann重排反应是一种氮杂杂环化合物的重排反应,它可以将一些含有氮杂杂环的底物转化为相应的醇、酮或醛化合物。
该反应的机理是通过化学键的断裂和重组来完成的。
Hofmann重排反应在有机合成中具有重要的应用,可以实现对氮杂杂环底物的立体和功能改变。
同时,该反应也是许多天然产物的合成关键步骤之一。
四、Beckmann重排反应Beckmann重排反应是一种重要的氮杂环重排反应,它将氮杂杂环化合物转化为酸中的相应醛或酮类化合物。
该反应的机理是通过氮杂杂环中氧原子的迁移和化学键的重组来实现的。
Beckmann重排反应在有机合成中得到了广泛的应用,可以用于合成酮和醛类化合物,为药物和天然产物的合成提供了重要的方法。
有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨

有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨【摘要】阐述有机化学中常见涉及碳正离子中间体的重排反应,通过对简单醇重排反应的分析,总结出经过碳正离子中间体的亲核重排反应的特征。
【关键词】碳正离子中间体重排反应有机化学特征在有机化学中,碳正离子的重排反应有重要的作用,但是因为其涉及的反应广泛,在有机化学的学习中人们很难通过单纯的记忆系统地掌握全部的反应。
通过对比总结碳正离子重排反应的规律特征,可以加深人们对此类反应的理解和认识,从而更好地进行有机化学的学习和研究。
一、有机化学中常见涉及碳正离子中间体的重排反应(一)Wanger-Meerwein重排1.一元醇的重排机理本质。
在醇分子中,羟基上的氧原子电负性很强,有两对孤对电子,在酸性条件下,这个氧原子上的孤对电子会从溶液中夺取一个质子H+,形成钅羊盐,此时,氧原子连有两个氢原子,碳氧键极性增加,碳氧键断裂,氧原子得到了碳原子上的一个电子,以水分子的形式被脱去,剩下一个不稳定的碳正离子中间体,这个碳正离子经重排后得到较稳定的碳正离子中间体,最后经SN2反应或E1反应后得到相应的重排产物,如下图所示:2.一元醇重排在反应中的应用。
以3,3-二甲基-2-丁醇为原料制备烯烃为例,反应历程如下:3.对比分析一元醇在稀硫酸条件下的脱水反应特征。
比较丙醇与2-甲基-1-丙醇和2,2-二甲-4-甲基戊醇反应的区别:2-甲基-1-丙醇和2,2-二甲基-4-甲基戊醇在稀硫酸的作用下,反应得到的是重排产物;而丙醇在稀硫酸的作用下,形成的碳正离子,没有经历重排过程即生成了产物。
由此得到的结论是:不是所有的醇,在稀硫酸的作用下,反应都经历碳正离子重排的过程。
那么,究竟是什么样的一元醇反应要经历重排过程呢?物质的存在与其自身的稳定性有很大的关系,重排后得到的碳正离子越稳定,重排性越大。
在碳正离子中,带正电荷的碳离子核外只有7个电子,是一个缺电子的基团,这样的离子不满足八隅体规则,稳定性很低,但是与其相连的烃基通过超共轭效应,对碳正离子具有供电子的能力(如甲基),从而降低其缺电子的性质,提高了碳正离子的稳定性。
第五章、重排反应

* CH CH CH3
OH CH3
200C
0
例:
CH3 * OCH2 CH=CHCH3 CH3 CH3 0 200C
OH CH3
* CH2CH=CHCH3
三、克莱森(Claisen)重排
烯丙基芳醚在加热时,重排得到邻位或对位的烯丙基苯酚产物: 例:
* OCH2CH=CH 2 200C
0
OH * CH2 CH=CH2 +
OH
* CH2 CH=CH2
当邻位被占据时,得对位产物,对位产物是两次重排的产物: 例:
* OCH2 CH=CHCH3 CH2 CH
+
O
_ OH
O (CH3)2NCHCPh CH2Ph
O CH3S CHCPh CH3
CH2Ph
锍盐:
CH3S
+
O CH2CPh
_ OH
CH3
通式:
(CH3)2N CH2R1 R
+
_ OH
(CH3)2NCHR1 R
通常:
R=PhCH2 , Ph2CH , CH2=CHCH2 , et c. O R1=PhC , CH3CO , Ph , CH2=CH , et c
例:
O C CH2COOH O C CH2COOH
CH2COOH (1)KOH / EtOH HO C COOH
(2) H3 O
+
CH2COOH
例:
O SeO2
O O (1)KOH / EtOH
(2) H3 O
+
HO COOH
HO
OH CrO3
O
O
例:
_ KMnO4 / OH
碳正离子重排反应

《碳正离子重排反应》碳正离子重排反应,这在化学世界里可是相当有趣的事儿。
碳正离子就像个调皮的小粒子,不安分地待在原来的地方。
它为啥会重排呢?这得从它自身的“小脾气”说起。
它总是想让自己变得更稳定,就像我们人总想找个更舒服的地方待着一样。
当它觉得周围的环境不太利于自己稳定存在时,就会开启重排之旅。
在一些化学反应里,碳正离子周围的原子或者基团就像它的小伙伴。
有时候,某个小伙伴会发现一个更好的“位置”,然后就会和碳正离子商量着换一换。
比如说,一个甲基基团可能会从一个碳原子旁边跳到另一个碳原子旁边,这一过程就改变了碳正离子的结构。
这重排反应的过程就像一场小闹剧。
原本规规矩矩的原子排列,因为碳正离子的“突发奇想”,瞬间变得热闹起来。
周围的电子云也像被搅乱的云团,重新分布组合。
那些化学键就像连接小伙伴们的绳子,有的松开,有的重新系上,忙得不亦乐乎。
从能量角度看,碳正离子重排是为了降低自身的能量。
就像一个小球从高处滚到低处,在能量更低的状态下它才能更安稳。
重排后的碳正离子可能形成了更稳定的结构,比如从一级碳正离子变成了二级碳正离子,或者从二级变成了三级。
这就好比一个人从简陋的小房子搬到了宽敞舒适的大房子,心里别提多踏实了。
在有机合成中,碳正离子重排反应可是个重要的角色。
化学家们就像导演,利用这个反应来巧妙地构建想要的有机分子结构。
有时候,他们故意引发碳正离子重排,让分子按照他们的设计进行“变身”。
这就像把一堆积木重新组合,拼出一个全新的造型。
不过,碳正离子重排反应也不是毫无规律地瞎折腾。
它遵循着一定的化学原理和规则。
就像游戏有游戏规则一样,它只能在这些规则允许的范围内进行“活动”。
化学家们通过研究这些规则,就能更好地预测和控制碳正离子重排反应的发生。
碳正离子重排反应就像化学世界里的一场奇妙冒险,充满了变化和惊喜,为有机化学的发展和创新提供了无限可能。
有机化学(第五版)(下册)课后答案解析李景宁

第十二章羧酸 (P32-33) 1.命名下列化合物或写出结构式:(1) 3-甲基丁酸 (2) 3-对氯苯基丁酸(3) 间苯二甲酸 (4) 9,12-十八碳二烯酸(5) 4-甲基己酸 CH3CH2CH(CH3)CH2CH2COOH(6) 2-羟基丁二酸 HOOCCH(OH)CH2COOH(7) 2-氯-4-甲基苯甲酸(8) 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:(第四版保留)4.完成下列转变:5、怎样由丁酸制备下列化合物?6、解:7、指出下列反应中的酸和碱。
按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.(1)按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔(2)按碱性降低的次序排列下列离子:①碱性:CH3HC C CH3O>>②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度。
产物DC5H10有一个不饱和度。
从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇。
10.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为CH3CH(CH2COOH)COOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR谱图:3200-2300cm-1为羟基中O-H键的伸缩振动。
1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的 C-H 键的面外弯曲振动。
论述碳正离子重排1

一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,重排结果是形成新的富电中心。
碳正离子和缺电子重排

姓名:李广申学号:250967碳正离子和缺电子重排碳正离子通常被分为具有定域电荷的经典碳正离子及具有离域电荷的非经典碳正离子。
经典碳正离子可以被一个“Lewis结构”代表,仅包括两电子二中心键。
其中带正电荷的碳原子的价电子层有六个电子,形成三个共价键,这就是通常所指的碳正离子。
如CH3+,CH2=CHCH2+ 等。
非经典碳正离子不能被一个“Lewis结构”所代表,带正电荷的碳原子外面有八个电子,其中一对电子为三中心键。
如降冰片正离子。
1234567这里主要对经典碳正离子的形成及其性质进行一下讨论。
一、碳正离子的形成1、中性分子的异裂使中性分子发生异裂是生成碳正离子最常用的方法。
和碳原子直接相连的原子或原子团带着一对成键电子离去。
R—X R+ +X-,如:(CH3)3C—Cl(CH3)3C+ +Cl-一般叔碳正离子或其他较稳定的碳正子(苯甲型、烯丙型,二苯甲基碳正离子、三苯甲基碳正离子),较容易通过直接离解形成,而且介质的极性愈大,离解时所需的能量愈小。
例如:氯代叔丁烷再空气中离解成碳正离子,所需能量为628.5KJ/mol,而在水溶液中形成碳正离子,离解所需能量仅为83.74KJ/mol.离去基团愈容易离去,也愈有利于碳正离子的形成。
有时离去基团较难离去时,可加路易士酸予与帮助。
R—Br +AlBr3R+ +AlBr4-(芳烃的傅—克烷基化反应)R—X + Ag+R+ +AgX (卤代烃与AGNO3的醇溶液反应)CH3COF +BF3 CH3—C+=O +BF4-(CH 3)CF +SbF 5(CH3)C + +SbF 6-利用超酸溶剂可以制备碳正离子的稳定溶液。
例:用100% H 2SO 4制备三苯甲基碳正离子。
(C 6H 5)3COH + 2H 2SO 4(C 6H 5)3+ +H 3O + + 2H 2SO 42. 质子或其他带电荷的原子团与不饱和体系加成最常见的正离子是H +离子。
烯烃酸化水合生成醇就包括着H+与C=C 双键的加成。
重排反应总结

不过,后来Schleyer与Brown完成的工作也确信 了phenonium ion的存在。他们测定了一系列化 合物的乙酸解反应速率.
OBs H H CH 3 CH 3 H CH3 OAc H CH3 H H3C CH3 X X Solvent-assisted erythro OAc
Aryl Participation---The Phenonium Ion Controversy
有关芳基能否进行和如何进行邻基参与,一直 存在争论. 1949年,Cram发现3-phenyl-2-butyl tosylate, 在HOAc中的溶剂解反应中,L-Threo-tosylate 生成了96%的外消旋产物,而L-erythro-tosylate 则生成了98%的光学活性的L-erythro-acetate。 由此,他提出了phenonium中间体的存在.
H
X Aryl-assisted threo
logkt -2.0 -3.0 -4.0
P-MeO
P-Me m-Me H P-Cl
m-Cl
M-CF3
P-CF3
-5.0
P-NO2
m,m’-(CF3)2
-0.4
0
0.4
0.8
s
如果没有邻基参与,那么反应速率logkt (产物生成 速率) 应与取代基X的s值有线性相关关系。 事实上,当X为强拉电子取代基时, log kt-s符 合linear free-energy relationship;但X为给电子 取代基时,则出现很大偏差。
Z A X B Gauche B Z A + A Z +
案例5 碳正离子的重排
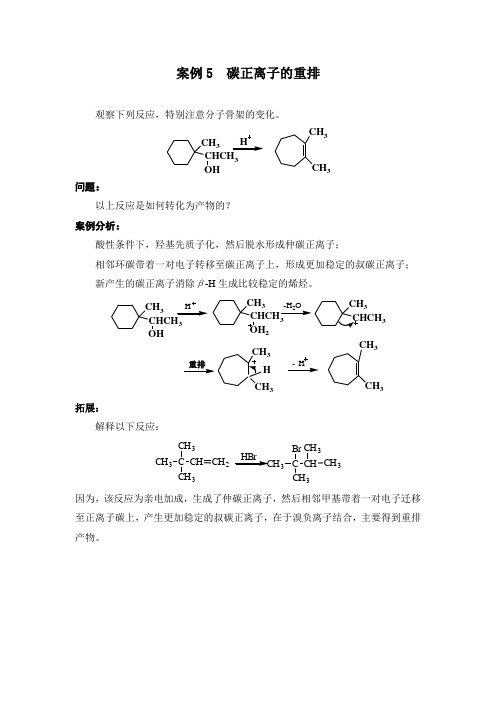
案例5 碳正离子的重排观察下列反应,特别注意分子骨架的变化。
H CHCH3 OH CH3 CH3
CH3
问题:
以上反应是如何转化为产物的?
案例分析:
酸性条件下,羟基先质子化,然后脱水形成仲碳正离子;
相邻环碳带着一对电子转移至碳正离子上,形成更加稳定的叔碳正离子;
新产生的碳正离子消除β-H生成比较稳定的烯烃。
H
CHCH3
OH
3
3
3
重排
CH3
CH3
H
-H
CH33
CHCH
OH2
CH3
2
拓展:
解释以下反应:
CH3C
CH3
CH3
CH CH2
HBr
CH3C
CH3
CH
Br
CH3
CH3
因为,该反应为亲电加成,生成了仲碳正离子,然后相邻甲基带着一对电子迁移至正离子碳上,产生更加稳定的叔碳正离子,在于溴负离子结合,主要得到重排产物。
碳正离子参与的重排反应和串联反应及其应用实例

碳正离子参与的重排反应和串联反应及其应用实例
碳正离子稳定性判断:碳正离子周围的基团越多则碳正离子越稳定;电荷越分散,正
碳离子上正电荷越小,离子越稳定。
碳正离子的碳是sp2杂化的,其p轨道是空的,本身
比较缺电子,不稳定,因此与给电子越强的基团相连越稳定。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。
它们稳定性的一般规律
如下:
(1)苄基型或烯丙型通常较平衡;
(2)其它碳正离子是:3°\ue2°\ue1°;
(可以用逊于共轭表述相同碳正离子的稳定性)
碳正离子越稳定,能量越低,形成越容易。
碳正离子根据结构特点不同可分为:经典
碳正离子和非经典碳正离子。
1、碳正离子的三个sp2杂化轨道必须能斯脱°,当坐落于桥头的碳构成碳正离子时,由于桥的刚性,使与碳相连的三个键无法满足用户互相成°,因此具备张力,并使碳正离
子不平衡。
且刚性越大越不平衡。
桥碳原子数越少,环路的刚性越大。
2、与小环烷基相连的碳正离子,由于小环烷烃的香蕉键,会对碳正离子有很强的超
共轭效应,因此可以很好地稳定碳正离子,其稳定碳正离子的能力甚至与苯环相当。
碳正离子重排规律

碳正离子重排规律有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,重排结果是形成新的富电中心。
不会发生重排的碳正离子

不会发生重排的碳正离子
碳正离子是一种非常稳定的离子,不会发生重排反应。
这是因为碳正离子的电子排布非常稳定,具有很高的能量稳定性,不容易被外界的影响所改变。
因此,碳正离子在有机化学中具有重要的应用价值,常被用于合成各种有机分子。
在实际应用中,我们可以通过合适的方法来制备碳正离子,并利用其稳定性进行各种化学反应。
不过需要注意的是,由于碳正离子的反应活性较强,操作时需要谨慎,以免发生不可控的反应。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
案例5 碳正离子的重排观察下列反应,特别注意分子骨架的变化。
H CHCH3 OH CH3 CH3
CH3
问题:
以上反应是如何转化为产物的?
案例分析:
酸性条件下,羟基先质子化,然后脱水形成仲碳正离子;
相邻环碳带着一对电子转移至碳正离子上,形成更加稳定的叔碳正离子;
新产生的碳正离子消除β-H生成比较稳定的烯烃。
H
CHCH3
OH
3
3
3
重排
CH3
CH3
H
-H
CH33
CHCH
OH2
CH3
2
拓展:
解释以下反应:
CH3C
CH3
CH3
CH CH2
HBr
CH3C
CH3
CH
Br
CH3
CH3
因为,该反应为亲电加成,生成了仲碳正离子,然后相邻甲基带着一对电子迁移至正离子碳上,产生更加稳定的叔碳正离子,在于溴负离子结合,主要得到重排产物。
