wittig反应
Wittig Reaction

谢谢!
• Georg Wittig (June 16, 1897 – August 26, 1987) was a German chemist who reported a method for synthesis of alkenes(烯烃) from aldehydes and ketones ( 醛和 酮)using compounds called phosphonium ylides in the Wittig reaction. He shared the Nobel Prize in Chemistry with Herbert C. Brown in 1979.
3.水相中的Wittig 反应
近年来,人们对在水相中的有机合成反应越来越关注, 而水相中的Wittig 反应就是一个典型的例子。在水相Wittig 反应的报道中,人们总是在研究可溶于水的反应原料,比 如先是发现了可溶于水的甲醛能在水相中发生Wittig 反应; 而后来通过改造Ylide,使之成为水溶性原料,发现它还能 与除甲醛外的不溶于水的芳香醛发生Wittig 反应。在2000 年报道了用机械碾磨固相合成磷Ylide 以及首次在无溶剂的 条件下发生的Wittig 反应。指出,通过机械碾磨方法破坏 了磷化合物的晶格及其无晶体形相的形成。在不同的固相 之间,通过微晶体的无机碱,发生了一个磷盐的去质子化 过程。而发生的Wittig 反应后的结果也和传统的Wittig 反 应不同。如果稳定磷Ylide 发生的是E/Z 反应,则E 式产物 占优的;而固相碾磨的Wittig 反应得到的结果却是E/Z_摩 尔比例约等于1,不过这却是一种全新的方法。经典的 Wittig 反应直到现在也一直被人们研究着并发展着。
• Wittig‘s contributions also include the preparation of phenyllithium(苯基 锂)and the discovery of the 1,2Wittig rearrangement and the 2,3Wittig rearrangement.
wittig

10-甲基硬脂酸的合成(90)
亚油酸:Z,Z-9,12-十八碳二烯酸酯(101)
油酸是人体不能合成,或是合成的量远不能满足需要的脂肪酸,叫做必需脂肪酸。 亚油酸是公认的一种必需脂肪酸。由于亚油酸能降低血液胆固醇,预防动脉粥样硬化 而倍受重视。研究发现,胆固醇必须与亚油酸结合后,才能在体内进行正常的运转和 代谢。如果缺乏亚油酸,胆固醇就会与一些饱和脂肪酸结合,发生代谢障碍,在血管 壁上沉积下来,逐步形成动脉粥样硬化,引发心脑血管疾病季膦盐中与磷相连的烷基至少要有一个H,因 此不能用叔卤代烃来制备; 2) 所用碱的强弱是非常关键的,这主要取决于R' 来决定, 如果R'是吸电子基团,会使内膦盐的酸性 增强, 选择较弱的碱就可脱去HX,否则需强碱。 3) 磷叶立德对水等质子性溶剂非常敏感, 加热也 易分解。因此, 制备时必须防潮, 一般要在非质子 溶剂如THF, DMF, DMSO及醚等中进行反应, 且不能 加热。
Wittig反应的优点与缺点
(1)一般只能与醛反应, 与酮反应非常缓 慢, 甚至不反应; (2)在非极性溶剂中反应缓慢;
目前已有许多关于该反应改进方法的报道, 如使 用相转移催化方法,提高温度或压力、加入添加剂、 微波辐射或光照射、声波、使用硅胶或离子溶剂, 另 外, 在水中或电池中进行Wittig反应的报道也非常多。
Wittg反应在合成天然产物中的应用
Wittig反应在天然产物合成中发挥了巨大的作用.主要 体现在以下几个方面: 1.合成长链不饱和脂肪酸 2.合成前列腺素 3.合成香料 4.合成昆虫信息素 5.合成类葫萝卜素等
Wittg反应在合成天然产物中的应用
一、长链不饱和脂肪酸 长链不饱和脂肪酸是动物、高等植物脂类的基本组成部 分,碳原子数一般在12-28之间。具有一个或多个双键,动物 脂类主要含顺式不饱和羧酸。
Wittig反应

魏悌锡G.Wittig1897-?德国化学家魏悌锡(G.Witting,1897-)德国化学家。
1897年9月16日生于柏林,他曾在土宾根(Tubingen)大学读书。
第一次世界大战使他辍学从军,战后他继续求学。
1923年他毕业于马尔堡(Marburg)大学,1926年获该校博士学位。
他曾在许多大学任教。
1956年被聘为海德尔堡(Heidelburg)大学教授。
由于他对磷有机化合物在有机合成方面应用的出色研究工作,获得了1979年诺贝尔奖金。
Wittig反应是指Wittig试剂与醛酮反应得到烯烃的一类重要反应。
如Wittig在1953年报告了下列反应:Wittig反应使醛、酮变成烯面目为之一新,这是获得诺贝尔奖金三个反应中有名的一个反应。
Wittig反应关键是制备Wittig试剂,那么什么是Wittig试剂,它又是怎样制备的呢?周期表的第三周期元素磷与碳结合,碳带负电荷,磷带正电荷彼此相邻,这种邻两性离子,类似于内盐结构。
如PH3PCH2,这种中性化合物叫叶立德(ylide),ylide这个字是由两个西文字中取来的。
Yl是有机基团的字尾,ide是盐的字尾,如甲基Methyl,氯化物为Chloride。
上面的化合物中有一个有机基团,有一个具有很强的类似盐的极性,所以就得到这个名字。
而叶立德如 ,也可以写成另一种形式:PH3=CH2,这种形式叫叶林(ylene),ene是烯的字尾。
因此所谓Wittig试剂可用如下的共振式表示:通过研究三甲基亚甲基磷[(CH3)P=CH2]的NMR以后倾向于认为碳为SP2杂化,磷为SP3杂化更符合偶极的ylide结构。
而ylene对结构只有较小贡献。
因此,用ylide(叶立德)表示Wittig试剂是比较准确的。
实际上进行与醛、酮的反应时也是通过ylide而发生的目录1wittig反应wittig反应Wittig 反应羰基用膦叶立德变为烯烃,称Wittig 反应(叶立德反应)。
wittig反应介绍

Wittig反应介绍李曼琳中国药科大学0940120目录1 前言 (2)2 Wittig试剂的制备 (3)3 Wittig反应机理[5] (4)4 Wittig反应的立体选择性 (6)5 Wittig反应在有机合成中的应用[4] (8)6 Wittig反应的改进 (11)7 总结 (14)参考文献 (16)Wittig反应介绍李曼琳0940120摘要:Wittig反应是合成烯烃最为普遍的反应,该反应产率较高,条件温和,具有高度的位置选择性。
本文就Wittig反应的机理、Wittig试剂的制备,反应立体选择性、反应的应用及改进作了介绍。
关键词:Wittig反应,Wittig-Horner反应,氮杂Wittig反应,机理,立体选择,应用1 前言1953年德国科学家Wittig发现二苯甲酮和亚甲基三苯基膦作用得到接近定量产率的1,1-二苯基乙烯和三苯氧磷[1],这个发现引起了有机合成化学工作者的高度重视,并把它称之为Wittig反应。
本反应是很重要的制备烯烃方法,Wittig也因此在1979年获得诺贝尔化学奖。
在Wittig 等人不断地实践中,人们认识到多种亚甲基化三苯膦都可以同多种醛、酮发生反应得到烯。
近年来发现许多具有d空轨道的杂原子亦能与它相连的碳负离子发生p-n共扼而趋于稳定[1],这类具有新型结构的化合物被称为叶立德(Ylid)。
典型的反应是有Wittig反应是有亚甲基化三苯基膦与醛或酮的反应[2]:根据R的不同,可将磷叶立德分为三类:当R为强吸电子基时(如一COOCH3, -CN等),为稳定的叶立德;当R为烷基时,为活泼的叶立德;当R为烯基或芳基时,为中等活度的叶立德。
制备不同活度的叶立德所用碱的强度不同,活泼的叶立德必须用强碱(如苯基锂,丁基锂),而稳定的叶立德,由于季磷盐α-H酸性较大,故用C2H5OH甚至NaOH即可。
叶立德本身就是稳定的碳负离子化合物,这些碳负离子与羰基化合物的亲核加成反应,都是合成C-C键的重要方法。
wittig反应介绍

Wittig反应介绍李曼琳中国药科大学目录1 前言 (2)2 Wittig试剂的制备 (3)3 Wittig反应机理[5] (4)4 Wittig反应的立体选择性 (6)5 Wittig反应在有机合成中的应用[4] (8)6 Wittig反应的改进 (11)7 总结 (14)参考文献 (16)Wittig反应介绍李曼琳摘要:Wittig反应是合成烯烃最为普遍的反应,该反应产率较高,条件温和,具有高度的位置选择性。
本文就Wittig反应的机理、Wittig试剂的制备,反应立体选择性、反应的应用及改进作了介绍。
关键词:Wittig反应,Wittig-Horner反应,氮杂Wittig反应,机理,立体选择,应用1 前言1953年德国科学家Wittig发现二苯甲酮和亚甲基三苯基膦作用得到接近定量产率的1,1-二苯基乙烯和三苯氧磷[1],这个发现引起了有机合成化学工作者的高度重视,并把它称之为Wittig反应。
本反应是很重要的制备烯烃方法,Wittig也因此在1979年获得诺贝尔化学奖。
在Wittig 等人不断地实践中,人们认识到多种亚甲基化三苯膦都可以同多种醛、酮发生反应得到烯。
近年来发现许多具有d空轨道的杂原子亦能与它相连的碳负离子发生p-n共扼而趋于稳定[1],这类具有新型结构的化合物被称为叶立德(Ylid)。
典型的反应是有Wittig反应是有亚甲基化三苯基膦与醛或酮的反应[2]:根据R的不同,可将磷叶立德分为三类:当R为强吸电子基时(如一COOCH3, -CN等),为稳定的叶立德;当R为烷基时,为活泼的叶立德;当R为烯基或芳基时,为中等活度的叶立德。
制备不同活度的叶立德所用碱的强度不同,活泼的叶立德必须用强碱(如苯基锂,丁基锂),而稳定的叶立德,由于季磷盐α-H酸性较大,故用C2H5OH甚至NaOH即可。
叶立德本身就是稳定的碳负离子化合物,这些碳负离子与羰基化合物的亲核加成反应,都是合成C-C键的重要方法。
wittig

很多具有香味化合物的结构是:脂肪族不饱和醇、
醛、酮、羧酸 、酯(或内酯)
1、反式烯醛(反式异构体达到95%以上)
具有青香、醛香、果香、辛香、脂肪香。在未稀释之 前,香气强烈而尖刺,在稀释后有令人愉快的绿叶清香和 水果香气。
2、反式-2-烯醇:多种蔬菜、水果的香味来源。 如下制备方法:
3、多烯脂肪族醛、酮、酯
Schlosser 等认为Wittig 反应必须首先通过形 成内鏻盐,它与反应物保持着平衡关系,然后通过 形成四元杂环,最后分解成不同的烯类。
反应机理---形成“内鏻盐”结构的机理
内鎓盐已经通过下列方式捕获到:
Ú Ä l ç Î Ñ « £ Î Ð É ³ ´ ¸ Ï º ï Î LiBr Ph3P O Li
Wittig反应改进—HWE反应
Wittig反应改进—HWE反应
反应特点: 1)膦酸酯容易制得:
(EtO)3P + RX
[ (EtO)3PR ] X
O (EtO)2PR + EtX
2)膦酸酯碳负离子的亲核性大于磷叶立德,能够与
醛、酮反应,且反应条件温和。
3)磷酸根易溶于水,因此易于与产物分离。 4)反应的立体化学受取代基的电子效应、立体效应 以及溶剂的影响较小,主要以E型产物为主。
五、类胡萝卜素 应用:类胡萝卜素→维生素A→视黄醛 食用色素抑制肿瘤的辅助药物
维生素A的合成(170)
谢 谢 大 家 !
Wittig反应的优点与缺点
(1)一般只能与醛反应, 与酮反应非常缓 慢, 甚至不反应; (2)在非极性溶剂中反应缓慢;
目前已有许多关于该反应改进方法的报道, 如使 用相转移催化方法,提高温度或压力、加入添加剂、 微波辐射或光照射、声波、使用硅胶或离子溶剂, 另 外, 在水中或电池中进行Wittig反应的报道也非常多。
wittig反应顺反分离

wittig反应顺反分离Wittig反应是一种有机合成中常用的方法,它可用于合成烯烃化合物。
在这个反应中,醛或酮与一个季碳化鎓产生亲核加成反应,生成一个亚磷酰亚金属酯,然后经过脱氧磷化制备相应的烯烃。
这个反应的顺反分离是非常重要的一步,它确保了所需的烯烃产物纯度和回收率。
下面我们将一步一步回答[wittig反应顺反分离]这个主题。
首先,让我们回顾一下Wittig反应的机理。
在这个反应中,醛或酮与亲电磷试剂反应生成亚磷酰亚金属酯,然后通过脱氧磷化生成烯烃。
亚磷酰亚金属酯是一个重要的中间体,因为它可以进行后续的选择性化学反应,生成所需的烯烃产物。
在Wittig反应中,反应条件的选择对于顺反分离是至关重要的。
一般而言,反应需要在干燥、无氧的条件下进行,以防止不需要的副反应。
此外,反应温度也需要控制在适当的范围内,以确保反应能够高效进行。
通常情况下,反应温度在0-100C之间选择。
第一步,要确保反应体系中的所有试剂和溶剂都是干燥和无氧的。
这可以通过常见的气相干燥或通过使用干燥剂来实现。
一旦试剂和溶剂干燥,它们可以在干燥箱中保存,并用惰性气体排气。
第二步,将亲电磷试剂和醛或酮溶解在适当的溶剂中。
通常情况下,溶剂是惰性的,并且可以与反应物和中间体形成稳定的配合物。
乙二醇二甲醚(DME)和四氢呋喃(THF)是常用的溶剂选择。
第三步,将亲电磷试剂缓慢滴加到醛或酮溶液中。
滴加速度的控制对于生成稳定的中间体至关重要,并且可以避免副反应的发生。
通常情况下,滴加速率控制在每分钟1-2滴之间。
第四步,在亲电磷试剂完全加入后,让反应混合物在预设的温度下搅拌一段时间。
反应时间的选择取决于反应物的不同和所需的产物的纯度。
通常情况下,反应时间在数小时到数天之间。
第五步,反应结束后,将反应混合物经气相层析或柱层析分离产物和未反应的反应物。
这个步骤对于顺反分离是至关重要的,因为它确保了纯度和回收率的高。
最后,通过蒸馏或结晶等方法纯化烯烃产物。
wittig反应

wittig反应羰基用磷叶立德变为烯烃,称Wittig 反应(叶立德反应、维蒂希反应)。
这是一个非常有价值的合成方法,用于从醛、酮直接合成烯烃。
基本介绍:本反应是由仲烃基溴(较典型)与三苯磷作用生成叶立德(Ylides,分子内两性离子),后者与醛或酮反应(Wittig 反应),给出烯烃和氧化三苯磷,反应形式这是极有价值的合成烯烃的一般方法。
根据中间体叶立德的稳定性可分为不稳定的叶立德的反应和稳定的叶立德的反应。
1.不稳定的叶立德的反应当 RR'CHBr 中,R 和R' 是氢原子或简单烷基,则烃基三苯基磷盐的α-H 酸性较弱,需较强的碱(常用叔丁基锂或苯基锂)才能生成叶立德,刚生成的叶立德活性很高,是类似格氏试剂那样强的亲核试剂,能迅速地在温和条件下与醛或酮起反应给出加成物,反应不可逆。
加成物可自发分解给出烯烃。
产物如有立体异构,则一般得到 E 和 Z 的混合物。
如用苯基锂制备叶立德,并且使反应在较低温度下进行,则产物以 E 异构体为主。
2.稳定的叶立德的反应当 RR'CHBr 中,R 或R' 是一个-M 基团(吸电子基团,如酯基),则烃基三苯基磷盐的去质子化可以在较弱的碱性条件下实现,并且产生的叶立德较稳定,可以分离,其活性相对较弱,一般需与亲电性较强的羰基反应。
当产物有主体异构存在时,E- 异构体通常占优。
应用:一、Wittig反应的主要用于合成各种含烯键的化合物。
(1)环外烯键化合物的合成:Wittig反应生成的烯键处于原来的羰基位置,一般不会发生异构化,可以制得能量上不利的环外双键化合物。
例:(2)共轭多烯化合物的合成:Wittig试剂与α,β-不饱和醛反应时,不发生1,4-加成,双键位置固定。
利用此特性可合成许多共轭多烯化合物。
如β-胡萝卜素的合成二、Wittig反应用于制备醛和酮:采用α-卤代醚制成Wittig试剂,然后与醛或酮反应得烯醚化合物,再经水解生成醛,提供了合成醛、酮的一个新方法。
witig反应机理

witig反应机理一、介绍Wittig反应是一种有机合成反应,由德国化学家乔治·维蒂希(Georg Wittig)于1954年首次提出。
该反应是将醛或酮与三甲基膦亚烷(Ph3P=CH2)反应,生成烯烃和三甲基膦氧化物的过程。
Wittig反应的机理相对简单,但是在有机合成中具有广泛的应用。
二、机理Wittig反应的机理可以分为两个步骤:形成亚磷酸盐与消除。
1. 形成亚磷酸盐首先,三甲基膦与碱金属或碱土金属的丙醇盐在乙醚中反应生成亚磷酸盐:Ph3P + R-O-M → Ph3P(O)-CHR + R-OH + M+其中,R代表一个芳香族或脂肪族基团。
2. 消除接下来,在存在亚磷酸盐的情况下,将其与醛或酮进行加成反应,生成不稳定的四元环中间体。
这个四元环中间体通过消除产生烯烃和三甲基膦氧化物:Ph3P(O)-CHR + R'-CHO → Ph3P=CH-R' + R'-C(O)-H + H2O其中,R'代表一个芳香族或脂肪族基团。
三、影响反应的因素1. 亚磷酸盐的稳定性亚磷酸盐的稳定性对Wittig反应的产率有很大影响。
如果亚磷酸盐不稳定,那么四元环中间体将无法形成,从而导致反应失败。
因此,在进行Wittig反应时,需要选择稳定性较高的亚磷酸盐。
2. 反应物的选择在Wittig反应中,醛或酮是必需的反应物。
不同的醛或酮会对反应产率产生不同的影响。
一般来说,具有较强电子吸引性基团的醛或酮会更容易发生Wittig反应。
3. 溶剂的选择溶剂也对Wittig反应有很大影响。
通常情况下,乙醚、四氢呋喃和二甲基甲酰胺等极性较强的溶剂可以提高反应速率和产率。
4. 温度和时间温度和时间也是影响Wittig反应的重要因素。
一般来说,较高的温度和较长的反应时间可以提高反应速率和产率。
但是,过高的温度和过长的反应时间可能会导致副反应的发生。
四、总结Wittig反应是一种广泛应用于有机合成中的重要反应。
wittig反应整理版

wittig 反应,最早由G. Wittig等发表在Ber. 87, 1318 (1954)ibid. 88, 1654 (1955).,是醛酮与含磷的试剂-烃代亚甲基三苯基膦反应,生成相应的烯类化合物。
,它是近年来在有机合成方法上发展较快地反应之一,wittig 真是由于此反应及相关的研究荣获了1979年的诺贝尔化学奖。
主要是形成了内翁盐,(氧磷杂环丁烷中间体)这里主要想解决实际应用上的几个问题。
1. 反应中wittig 试剂的选择问题2.反应条件的选择问题,(溶剂,温度,碱性条件)3.立体选择性的问题4.反应后处理遇见的问题下面我将一一对上面的问题,根据自己的经验,并且参考一些资料作出简单的分析给出一些建议。
首先,反应中wittig 试剂的选择经典的wittig 试剂是季膦盐(准确地说是内翁盐),它是一种呈黄色和红色的化合物,它的制备可以由三苯基磷与有机卤化物,在碱性条件非质子溶剂中生成,常用的溶剂DMF,THF,DMSO等,常用的碱是正丁基锂,醇钠,二甲基亚砜盐等强碱。
wittig 试剂根据它所联的基团不同我们分成活性大的不稳定的wittig 试剂和活性小的稳定的wittig 试剂。
所以选择不同的试剂主要看你的底物的活性,总的来说醛的活性大于酮的大于酯的。
随着科技进步,wittig 试剂也有了很多的改良的方法,主要是用膦酸酯和取代的膦酸酯及酰胺代替ylide. 这种改良的反应我们称它为horner反应。
Wittig 反应条件的选择在这里我只是粗浅的谈谈一般的情况,如有什么不当之处,欢迎大家指正!反应条件的选择受制于反应的底物,你所要达到的目的。
一般的溶剂选择可以分为极性的和非极性的,这里又可以分为质子给与体和电子授受体。
这个反应中常用的是:THF,DMF,DMSO,DCM,苯,乙醚,aq.NaOH等反应的温度在-78~室温,有些反应由于中间态ylide盐稳定,要使反映进行温度可以到100度。
wittig反应实验流程

wittig反应实验流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!Wittig 反应是一种重要的有机合成反应,用于将醛或酮转化为烯烃。
[1,2]-wittig重排反应的立体化学
![[1,2]-wittig重排反应的立体化学](https://img.taocdn.com/s3/m/42d2c67c3d1ec5da50e2524de518964bce84d252.png)
[1,2]-wittig重排反应的立体化学1 Wittig重排反应Wittig重排反应又被称为三元体酶(TEM)反应,是一类重要的有机化学反应,是受到德国有机化学家Georg Wittig博士发明的,用于合成醛类和酮类。
在相应的化学实验中,受体物质和迁移基接上一个碘芳烃,形成碘芳烃Wittig重排反应物,而受体物质生成的最终产物是一种醛类或酮类,它们的结构是由接触时的精确立体结构决定的。
2 立体化学立体化学是一门处理分子及其相互作用的科学,旨在探索分子空间结构与它们由此决定的功能之间的关系。
立体化学在Wittig重排反应中发挥重要作用,提供了描述反应物和产物分子结构空间结构的方法。
立体化学考虑分子空间结构,把反应中的分子抽象成集合。
在Wittig反应中,必须具备下述几个要素:碘芳烃接受物必须含有一个可以形成螺环的碳原子,而且这个碳原子必须处于非共价态;碘芳烃迁移物要有脂环,能够与受体物质的碳原子发生分子间作用,从而促进立体化学非共价键的形成;而受体物质必须具有一个可以和碳原子反应的反应原子,诸如氧,氮,硫等。
此外,碘芳烃迁移物和受体物质还受益于“小分子”作用,即空间协同作用。
这是指来自碘芳烃迁移物和受体物质的分子三维结构特征,如共价和非共价键,分子间作用力,电子位错态,侧链相互作用和取向性等,一起参与碘芳烃重排反应,这也是Wittig重排反应取得成功的原因。
有三类事件可以影响碘芳烃的重排反应:电子位错,空间协同作用以及受体物质的结构。
电子位错意味着受体物质结构不同,通过改变电子结构来控制碘芳烃Wittig重排反应形成不同的碳碳键类型,如醛类或酮类,而空间协同作用会增强受体物质的分子叠加能量以增加反应速率,而受体物质的结构则决定了立体结构,决定碘芳烃重排反应的特性。
总之,立体化学是Wittig重排反应的重要控制因素,实验上一定要注意立体结构的形成,考虑分子空间结构、受体物质的结构及其电子结构以及空间协同作用以确保实验获得理想成果。
Wittig反应和Wittig改良反应2015.11.28

Wittig Reaction Wittig-Schlosser Reaction Wittig-Horner Reaction
石 娅 2015,11,28
Wittig Reaction
• 由磷叶立德和羰基化合物反应生成烯烃的反应称为Wittig反应。
• 早在20世纪中叶,G.Wittig和G.Geissler研究了五价的磷化合物,
该反应是维生素D的A环和C、D环对接的主 要方法之一:
Zhu,G,-D.;Okamura,W.H.Chem.Rev.1995,95,1877.
15
Thanks for your attention
16
反应时可用THF,Et2O,甲醚,甲基叔丁酯,甲苯作溶剂。
Wittig试剂需要无水无氧条件,条件较苛刻,且顺反异构不好控制。
6
Synthetic Applications:
Discodermolide(圆皮海绵内酯)中间体的合成
Smith, A. B., Kobayashi, K..J. Am. Chem. Soc. 2000, 122, 8654-8664.
Duffield, J. J., Pettit, G. R. J. Nat. Prod. 2001, 64, 472-479.
抗肿瘤剂Muricatacin的合成
Couladouros, E. A., Mihou, A. P. Tetrahedron Lett. 1999, 40, 4861-4862.
9
Mechanism
10
Synthetic Applications
ISP-I (myriocin, thermozymocidin)的不对称 全合成:
分子内aza-wittig反应的定义

分子内aza-wittig反应是有机合成中一种重要的方法,它是以氮杂环化合物为原料,通过环内一分子的氮杂环化合物内攻击亚砜碳氧双键,生成相应的氮杂杂环化合物的一种反应。
这一反应是目前的有机化学领域非常活跃的研究方向之一。
1. 反应条件分子内aza-wittig反应的反应条件相对较为温和,一般在常温下就可以进行。
通常情况下,反应所需的溶剂可以选择是常见的溶剂,例如乙醚、二甲基甲酰胺(DMA)等。
一些文献中还报道了在无溶剂条件下进行分子内aza-wittig反应的研究。
2. 反应机理分子内aza-wittig反应的机理较为复杂,但一般可以分为端口攻击机制和环内攻击机制两种。
在端口攻击机制中,氮杂环化合物通过亚砜碳氧双键的开裂,生成相应的亚砜亚胺中间体,最终生成目标产物。
而在环内攻击机制中,氮杂环化合物内部的亚砜碳氧双键会被氮原子所攻击,最终生成目标产物。
3. 反应优势分子内aza-wittig反应在有机合成中具有许多优势,例如原料易得、操作简便、反应条件温和等,因此备受有机合成化学家的青睐。
分子内aza-wittig反应可以高效地构建含氮杂环环结构的有机化合物,为合成有生物活性的芳香族和杂环化合物提供了一种有效的手段。
4. 反应的应用分子内aza-wittig反应在药物合成、天然产物合成等领域得到了广泛的应用。
通过该反应,可以合成一系列含氮杂环结构的药物分子,为医药化学领域的发展提供了有力支持。
分子内aza-wittig反应还可以在功能性材料的合成中起到重要作用,例如光电材料、液晶材料等领域。
总结:分子内aza-wittig反应是一种重要的有机化学反应,具有许多优势,并且在药物合成、功能材料合成等领域得到广泛的应用。
对于有机化学领域的研究人员来说,深入研究分子内aza-wittig反应的机理及其应用,对于加深对有机合成领域的理解具有重要意义。
分子内aza-wittig反应作为有机化学的重要反应之一,其在药物合成、功能材料合成等领域都有着广泛的应用前景。
witting反应机理

witting反应机理
Witting 反应是一种化学反应,其机理如下:
1.在反应条件下,原料中的烷基硼酸(R—BH2)与
有机硅化物(RSiX3)发生反应,生成烷基硅烷(R—SiH3)和氢氧化硼(H2O2)。
2.烷基硅烷再与另一种有机硅化物(R'SiX3)发生反
应,生成新的烷基硅烷(R'—SiH3)和原有的烷基硅烷(R—SiH3)。
3.这个反应可以不断重复进行,直到所有的烷基硼
酸和有机硅化物都发生反应。
4.最终,会得到多种不同烷基硅烷和氢氧化硼。
Witting 反应常用于合成烷基硅烷化合物,如烷基硅氧烷和烷基硅烷烷基化合物。
该反应可以在低温和低压条件下进行,并且具有较高的产率。
witting的反应
Wittig反应
Wittig反应(维蒂希反应)是醛或酮与磷叶立德(Wittig试剂)发生亲核加成生成烯烃反应,该反应由德国化学家Georg Wittig在1954年发现,为此他获得了1979年的诺贝尔化学奖。
Wittig反应在烯烃合成上有着广泛的应用,可用于合成双键位置确定的烯烃。
Wittig反应的反应物一般是醛/酮和单取代的磷鎓内盐。
使用活泼叶立德时所得产物一般都是Z型的,或Z/E异构体比例相当;而使用比较稳定的叶立德时,或在Schlosser改进的条件下,产物则以E型为主。
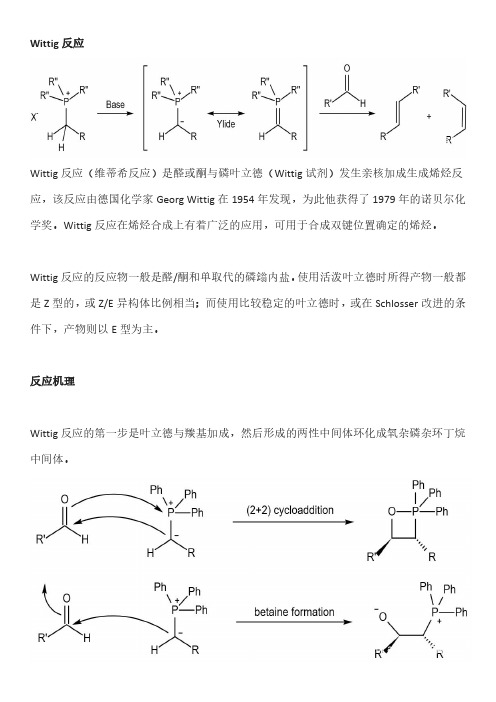
反应机理
Wittig反应的第一步是叶立德与羰基加成,然后形成的两性中间体环化成氧杂磷杂环丁烷中间体。
环碎裂后生成烯烃和三取代基氧膦。
磷和氧原子的作用力非常强是本反应的动力。
对于活泼的Wittig试剂而言,与醛和酮反应时第一步的速率都较快,但成环反应速率较慢,是速控步。
但对于稳定的叶立德而言,R基团可以稳定碳上的负电荷,第一步是速控步。
因此总体的成烯反应速率减小,而且生成的烯烃中E型比例较大。
这也是不活泼的Wittig 试剂与有位阻的酮反应很慢的缘故。
实验二-Witting反应:顺、反-1,2-二苯乙烯的制备

实验二—Witting反应:顺、反-1,2-二苯乙烯的制备一、实验目的1、掌握Wittig反应合成烯烃的原理和方法;2、巩固分液操作。
二、实验原理本实验通过苄氯与三苯基膦作用,生成氯化苄基三苯基鏻,再在碱存在下与苯甲醛作用,制备1,2-二苯乙烯。
第二步是两相反应,通过季鏻盐起相转移催化剂和试剂的作用,反应可顺利进行,具有操作简便,反应时间短等优点。
(C6H5)3P+C6H5CH2Cl(C6H5)3PCH2C6H5Cl(C6H5)3P=CHC6H5C6H5CHO+(CH5)3PO6产物中,顺式烯烃为液体,极性大;反式烯烃为固体,极性小。
加入无水乙醇大极性溶液中,会析出反式烯烃。
三、仪器及药品仪器:圆底烧瓶、球形冷凝管、直形冷凝管、抽滤瓶、布氏漏斗、分液漏斗等 药品:苄氯、三苯基膦、氯仿、二甲苯、苯甲醛、二氯甲烷、NaOH、乙醇四、实验步骤1、苄基三苯基氯化鏻的制备在50 mL圆底烧瓶中,加入1.0 mL苄氯、2.0 g三苯基膦和15 mL氯仿,装上带有干燥管的回流冷凝管,在水浴上回流2h。
反应完毕,蒸出氯仿,再向反应瓶中加入5 mL二甲苯,充分摇振混合,抽滤。
用少量二甲苯洗涤结晶,于110ºC烘箱中干燥1 h,备用。
2、顺、反-1,2-二苯乙烯的制备在50 mL三口瓶中,加入上步得到的0.59g苄基三苯氯化鏻,0.2 mL苯甲醛和8 mL二氯甲烷,装上回流冷凝管。
在电磁搅拌器的充分搅拌下,自三口瓶一侧慢慢滴入1.0 mL 50%氢氧化钠水溶液,使其保持微沸。
滴加完毕,继续搅拌15min。
将反应混合物转入分液漏斗,摇振后分出有机层,有机相用无水硫酸镁干燥,滤去干燥剂,在水浴上蒸去有机溶剂。
残余物加入无水乙醇加溶解(约需10 mL),然后置于冰浴中冷却,析出反-1,2-二苯乙烯结晶。
抽滤,干燥。
五、注意事项1、苄氯蒸气对眼睛有强烈的刺激作用,一定要在通风橱中取用,转移时切勿滴在瓶外,如不慎沾在手上,应用水冲洗后再用肥皂擦洗。
wittig反应介绍

WOIRD格式Wittig反应介绍李曼琳中国药科大学0940120目录1前言.................................................................................................. (2)2Wittig试剂的制备.................................................................................................. .. (3)[5].............................................................................................. 3Wittig反应机理4Wittig反应的立体选择性.................................................................................................. .. (6)[4]5Wittig反应在有机合成中的应用 (8)6Wittig反应的改进.................................................................................................. (11)7总结.................................................................................................. . (14)参考文献.................................................................................................. (16)1Wittig反应介绍李曼琳0940120摘要:Wittig反应是合成烯烃最为普遍的反应,该反应产率较高,条件温和,具有高度的位置选择性。
her反应机理

her反应机理
Wittig反应又称为Wittig-Horner反应,是一种广泛应用于有机合成中的重
要反应,由西德化学家Georg Wittig和重庆大学教授 Horner发现,主要用于有
机碱或醛类的烃烃裂变的反应。
Wittig反应的反应机理的核心思想是前添加:一个特定的Wittig取代剂与能
用于Wittig反应的一种烃根氯化反应后生成惰性Wittig离子配对,然后将
Wittig离子配对添加到一个含碱性氧原子(通常是-OR或-SR)的醛或酮类基团,以
形成烃基丙烯酰膦,最后形成的活性键的破裂发生烃烃裂变,最终生成烯烃和羟基烷酸(或羧酸)。
与此同时,Wittig离子配对也会形成稳定的碳-氧歧视键而被脱去,因而实现了Wittig反应的机理。
Wittig反应是一种多步反应,需要运用到费米-科罗夫转换,哈勃取代等机理,才能实现反应,并且具有高灵敏性。
该反应易于操作,特别是平衡反应条件,绿色、简单、快速和无害,可在短时间内优化工艺,缩短反应过程,提高产物的纯度。
它可以满足化学制造行业的高用量要求,是合成化学中一种重要的应用,广泛用于药物、农药、医药中间体、复杂有机结构、染料等有机合成中。
Wittig反应在合成化学领域中具有重要意义,在药物合成、有机合成、有机
固体化学等领域都发挥着不可替代的作用,是一项具有潜力的发明。
通过不断完善该反应,可以为有机化学技术的发展做出重要贡献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
练习8:用魏悌希试剂合成 (CH3)2C=CHC6H5 ① (CH3)2CO + Ph3P=CHC6H5
②C6H5CHO + Ph3P=C(CH3)2
Ph3P + C6H5CH2–Br Br
Ph3P + CH3CHCH3
练习6: 2-甲基-1-丙醇、异丙醇 HO–C–C–C OH
C C–C–C
2,4-二甲基-2-戊烯 Br
–C–C=C–C C
第二十二讲——作业
一、分析可能的原料组合
1、由格利雅试剂制备醇
OH
①
OH -C-CH3 ②
ቤተ መጻሕፍቲ ባይዱ
-CH2CH2OH③
2、由魏悌C希3H试7剂制备烯烃
①
–CH=CHCH3 ②
=CHCH2CH3
二、合成 1、用乙烯、丁二烯合成 ①
C2H5 OH ②
OH
C2H5 OH
2、用乙烯、甲苯、环戊烷合成
6、魏悌希(Witting)反应
以羰基化合物和卤代烃为原料,通过魏悌希试剂,
制备结构较复杂的烯烃。
+
- 强碱性条件
(C6H5)3P + CH3X 三苯基膦
R(C4N+6NH季–HC5-)鏻43lCP(季盐–l C铵H盐3X)邻消位去两-H性和离卤子素
(C6H5)3P=CH2 三苯基亚甲基膦
+-
(C6H5)3P–CH2
C–C–C + Ph3P
C–C–C=HOPPh3+ P+PhO3=C(CH3)2 C
C–C–C=C–C CC
练习7:苯、乙烯、丙烯
3-甲基-1-苯基-2-丁烯
–MgX+ CH2–CH2 O
–C–C–OH Br
C–C–C + Ph3P
–C––CC=–CPHPhO3 +
P+PhO3==CC((CCHH33))22
-CH2CHCH2-
磷叶立德(ylide)
yl—基团;ide—盐
O + ((CC66HH55))33P+P=–CC-HH22
CH2
C==O==+ =Ph=3P==C
Ph3P + CHXRR′ 三苯基膦 (含H)卤代烃
HO-HX
魏Ph悌3P希=C试R剂R′
Ph3P+–CHX-RR′
季鏻盐
C=O + Ph3P=CRR′
C=CRR′
