钠与钠的化合物
高一化学钠及其化合物笔记

高一化学钠及其化合物笔记
1.钠的基本性质:钠是一种银白色的金属,在空气中易氧化,与水反应产生氢气和氢氧化钠。
2. 钠的化合物:钠主要形成氯化钠、碳酸钠、硫酸钠等化合物。
3. 氯化钠:氯化钠是钠的最常见化合物,被广泛用于食品加工和腌制,也是制备其他钠化合物的重要原料。
4. 碳酸钠:碳酸钠是一种重要的工业原料,用于玻璃制造、纺织工业、造纸工业等。
5. 硫酸钠:硫酸钠是一种重要的化学原料,在制造洗涤剂、颜料、纤维素等方面具有广泛的应用。
6. 钠与生命:钠在人体中起着重要的作用,参与调节细胞内外液体的平衡,维持神经、肌肉等组织的正常功能。
7. 钠的危害:过量的摄入钠会引起高血压、心脏病等健康问题,需要合理控制钠的摄入量。
8. 钠的环境影响:含钠的废水对水生生物和水环境具有一定的危害,需要加强环保措施,减少钠的排放。
- 1 -。
钠及其化合物PPT

(3) (3)焰色系元指素_____的焰色,物属_理_____变
化。
精选版课件ppt
29
(2006年全国理综I、28).(15分)
在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选用适当的化学试剂和实验用品、
用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
2、将Na、Mg、Al各0.3mol分别放入100mL1mol/L的盐酸中,
同温同压下产生的气体体积比是( )C
A、1:2:3
B、6:3:2
C、3:1:1
D、1:1:1
精选版课件ppt
32
练习:
1、某种H2和CO的混合气体,其密度为相同条件下O2密度的
1/2,将3.2g这种混合气充入一盛有足量Na2O2的密闭容器
结构
性质
制取 保存 应用
物理性质 化学性质
精选版课件ppt
2
教材回顾:
一、Na
碱
钠的氧化物
金 二、钠的化合物 NaOH
属
NaCl Na2CO3和NaHCO3
三、碱金属元素
精选版课件ppt
3
一、钠的性质
(一)、钠的物理性质
钠是 银白 色金属,具有金属光泽,质地
,
可以柔用软刀切割,密度
,熔点小
,是热
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
与酸反应 Na2O+2HCl=2NaCl+H2O 2Na2O2+4HCl=4NaCl+2H2O+O2↑
类别
金属钠和钠的成分

金属钠和钠的成分
金属钠(Sodium)和普通的钠都指的是相同的元素,其化学符号为Na。
钠是一种金属元素,位于周期表的第11族,原子序数为11。
它在自然界中以离子化合物的形式广泛存在,如氯化钠(食盐)、碳酸钠、硫酸钠等。
金属钠是指纯净的钠元素,是一种银白色的金属,在常温常压下是固态。
由于钠在空气中具有较强的活性,因此通常保存在惰性气体(如氩气)中或者在密封的容器中存放,以防止其与空气中的氧气和水蒸气反应产生氧化物和氢氧化物。
钠的主要化合价为+1,它在化合物中通常以钠离子(Na^+)的形式存在。
例如,在氯化钠(NaCl)中,钠以+1价的阳离子的形式存在,而氯以-1价的阴离子的形式存在,形成了普遍的食盐。
总之,金属钠和普通的钠都是指同一种元素,即化学符号为Na的金属元素,其在自然界中以离子化合物的形式广泛存在。
钠及其化合物的化学方程式和离子方程式

化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反应:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al +3Cu 2+2Al 3++3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO4Al 2(SO 4)3 +3H 2O Al 2O 3+6H+2Al 3++3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH2NaAlO 2+H 2O Al 2O 3+2OH-2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 +NaOH NaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4 Al 3++3H 2O Al(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓Al 3++3OH-Al(OH)3 ↓冰晶石电解4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-2AlO2-+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO43Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
几种重要的金属化合物钠和钠的化合物

白色固体 -2价 价 常温 不稳定
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3
生成条件 稳定性 与水反应 与CO2反应 特性 用途
— —
强氧化性、 强氧化性、漂白性 供氧剂、 供氧剂、漂白剂
三 碳酸钠和碳酸氢钠 俗 名
Na2CO3 俗 名 纯碱或苏打 NaHCO3 小苏打 —— 结晶水合物 Na2CO3.10H2O
碳酸钠和碳酸氢钠的相互转变
2NaHCO3 = Na2CO3 + H2O + CO2
固体
△
NaHCO3 + NaOH = Na2CO3 + CO2 + H2O = 2NaHCO3
溶液
Na2CO3
正盐
CO2 + H2O 加OH—或△
NaHCO3
酸式盐
表2:碳酸钠与碳酸氢钠的比较 :
碳酸钠 化学式 式量 俗名 颜色状态 水溶性 与酸反应 热稳定性 用途 碳酸氢钠
Na2CO3 106 纯碱、 纯碱、苏打 白色粉末
(250C溶解度为 克) 溶解度为33克 溶解度为
NaHCO3 84 小苏打 细小白色晶体
(250C溶解度为 克) 溶解度为9克 溶解度为
Na2CO3+2HCl=2NaCl+H2O+CO2 ↑ NaHCO3+HCl=NaCl+H2O+CO2 ↑
NaHCO3
白色粉未,加水部分溶 白色粉未 加水部分溶 解,感受不到热量变化
仍有固体残留 溶液变微红色
加水部分溶解, 加水部分溶解,溶液 的碱性比Na 的碱性比 2CO3弱
溶液变红色
加水先变成含结晶 水的晶体, 水的晶体,溶液的 碱性比NaHCO3强 碱性比
钠及其化合物方程式和离子方程式

1、钠和水、氧气、硫、氯气:反应:2Na+O2点燃Na2O2 (或加热) 4Na+O2=2Na2O 2Na+S=Na2S 2Na+Cl2点燃2NaCl2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na+2OH-+H2↑3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H2↑离子方程式: 2Na+2H+=2Na++H2↑方程式: 2Na+H2SO4=Na2SO4+H2↑离子方程式: 2Na+2H+=2Na++H2↑方程式: 2Na+2CH3COOH=2CH3COONa+H2↑2Na+2CH3COOH=2CH3COO-+2Na++H2↑4.钠分别和硫酸铜溶液、氯化铁溶液方程式: 2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑方程式: 6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑1.氧化钠分别与水、盐酸方程式: Na2O+H2O=2NaOH 离子方程式: Na2O+H2O=2Na++2OH-方程式: Na2O+2HCl=2NaCl+H2O 离子方程式: Na 2O+2H+=2Na++H2O2.过氧化钠分别与盐酸、水方程式: 2Na2O2+4HCl=4NaCl+2H2O+O2↑离子方程式: 2Na2O2+4H+ =4Na++2H2O+O2↑方程式: 2Na2O2+2H2O=4NaOH+O2↑离子方程式: 2Na2O2+2H2O=4Na++4OH-+O2↑3.过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O21.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na2CO3、NaHCO3的方法)碳酸钠受热不分解2NaHCO3△Na2CO3+H2O+CO2↑2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na2CO3+HCl=NaHCO3CO32-+H+=HCO3-NaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O过量的盐酸时:Na2CO3+2HCl=2NaCl+CO2↑+H2O CO32-+2H+=CO2↑+H2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量醋酸:Na2CO3+CH3COOH=NaHCO3+CH3COONa CO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2O HCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2O CO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2O NaHCO3+CH3COOH=CH3COONa+CO2↑+H2O HCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或CO2+Na2CO3+H2O=2 NaHCO3↓CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合 (类似:澄清石灰水可以改为氢氧化钡溶液)少量石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO3 2 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOH HCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑2NaCl+2H2O电解Cl2↑+H2↑+2NaOH 2Cl-+2H2O电解Cl2↑+H2↑+2OH-9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么?CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3 + OH-溶液呈碱性第 1 页共1 页。
钠及钠的化合物详解

三、碳酸钠和碳酸氢钠
往饱和氢氧化钠溶液、饱和Na2CO3溶液中通 入过量CO2后有什么现象?原因?
S(g) NaOH Na2CO3 NaHCO3 30℃ 109 21.5 9.6
复习:
1、钠保存在煤油中,煤油的作用是什么?
四、氢氧化钠
3、NaOH的保存(固体、溶液) 4、NaOH固体的称量 5、氢氧化钠的制法: ① ②碱金属的相似性和递变性
⑴结构的相似性和递变性 ①相似性: 最外层只有一个电子,在化学反应中容易失去一 个电子,形成+1价的离子。化合物形式相同。 ②递变性: 电子层数: 原子半径:
碱金属的相似性和递变性
10.用途差异: Na2O用途不广泛, Na2O2用途比较 广泛,可做供氧剂、漂白剂、杀菌剂、消毒剂等。
三、钠的碳酸盐和碳酸氢盐
1.俗名差异:Na2CO3俗名纯碱、苏打等; NaHCO3俗名小苏打。
2.溶解性差异:二者均溶解于水,但Na2CO3的 溶解度大于NaHCO3的。
3.水解程度差异:二者均为弱酸盐,水解使溶 液显碱性,但Na2CO3水解程度大于NaHCO3的。 水解原理应用如泡沫灭火剂、去油污等。
2、钠与氯气反应的现象?
3、钠着火,能否用水或CO2灭火?为什么?
4、钠在下来溶液中反应的剧烈程度: 0.1mol/L的硫酸溶液、盐酸溶液、乙醇溶 液、醋酸溶液?
三、碳酸钠和碳酸氢钠
1.俗名差异 2.溶解性差异
3.水解程度差异 4.热稳定性差异 5.与酸反应速率差异 6.与NaOH反应差异 如何鉴别碳酸钠与碳酸氢钠?
4.热稳定性差异:Na2CO3很稳定,一般不分解; NaHCO3不稳定,受热分解。 5.与酸反应速率差异:二者都能与酸反应 Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑ 从反应过程看:CO32-→HCO3-→H2CO3→H2O+CO2因此 跟相同浓度的强酸反应产生CO2的速率NaHCO3大于 Na2CO3的。因此泡沫灭火剂常用NaHCO3。 6.与碱反应差异:Na2CO3不能与碱发生中和反应, NaHCO3中含有没完全中和的H+,故能继续与碱反应。 HCO3-+OH-= CO32-+H2O
钠和钠的化合物常用化学方程式

钠和钠的化合物常用化学方程式一、钠1.钠在氧气中燃烧:2Na+O2Na2O22.钠在氯气中燃烧:2Na+Cl22NaCl3.钠常温条件下和氧气反应:4Na+O2===2Na2O4.钠和硫共热:2Na+S Na2S5.钠和水反应:2Na+2H2O===2NaOH+H2↑2Na+2H2O===2Na++2OH-+H2↑6.钠和稀盐酸反应:2Na+2HCl===2NaCl+H2↑2Na+2H+===2Na++H2↑7.钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O===2Na++Cu(OH)2↓+H2↑8.向氯化铝溶液中加入少量钠:6Na+2AlCl3+6H2O===6NaCl+2Al(OH)3↓+3H2 ↑6Na+2Al3++6H2O===6Na++Al(OH)3↓+3H2 ↑9.向氯化铝溶液中加入足量钠:4Na+AlCl3+2H2O===NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O===4Na++AlO2-+2H2↑二、氧化钠1.氧化钠和水反应:Na2O+H2O===2NaOH Na2O+H2O===2Na++2OH-2.氧化钠及二氧化碳反应:Na2O+CO2===Na2CO33.氧化钠及盐酸反应:Na2O+2HCl===2NaCl+H2O Na2O+2H+===2Na++H2O4.向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O===Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O===Cu(OH)2↓+2Na+5.向氯化铝溶液中加入少量氧化钠:3Na2O+2AlCl3+3H2O===2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6.向氯化铝溶液中加入足量氧化钠:2Na2O+AlCl3===NaAlO2+3NaCl2Na2O+Al3+===AlO2-+4Na+三、过氧化钠1.过氧化钠及水反应:2Na2O2+2H2O===4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2.过氧化钠及二氧化碳反应:2Na2O2+2CO2===2Na2CO3+O2↑3.过氧化钠及盐酸反应:2Na2O2+4HCl===4NaCl+2H2O+O2↑2Na2O2+4H+===4Na++2H2O+O2↑4.向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O===2Cu(OH)2↓+4Na++O2↑5.向氯化铝溶液中加入少量过氧化钠:6Na2O2+4AlCl3+6H2O===4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O===4Al(OH)3↓+12Na++3O2↑6.向氯化铝溶液中加入过量过氧化钠:2Na2O2+AlCl3+2H2O===NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O===AlO2-+4Na++O2↑7.过氧化钠及硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O===4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1.向氢氧化钠溶液中通入少量二氧化碳:2NaOH+CO2===Na2CO3+H2O2OH-+CO2===CO32-+H2O2.向氢氧化钠溶液中通入过量二氧化碳:NaOH+CO2===NaHCO3OH-+CO2===HCO3-3.向氢氧化钠溶液中通入少量二氧化硫:2NaOH+SO2===Na2SO3+H2O 2OH-+SO2===SO32-+H2O4.向氢氧化钠溶液中通入过量二氧化硫:NaOH+SO2===NaHSO3OH-+SO2===HSO3-5.碳酸氢钠溶液及氢氧化钠溶液混合:NaHCO3+NaOH===Na2CO3+H2OHCO3-+OH-===CO32-+H2O6.向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH===CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-===CaCO3↓+H2O7.向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH===CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-===CaCO3+CO32-+2H2O五、碳酸钠1.碳酸钠溶液及澄清石灰水反应:Na2CO3+Ca(OH)2 ===CaCO3↓+2NaOHCO32-+Ca2+===CaCO3↓2.碳酸钠溶液及氯化钡溶液混合:Na2CO3+BaCl2===BaCO3↓+2NaClCO32-+Ba2+===BaCO3↓3.碳酸钠溶液滴入少量盐酸:Na2CO3+HCl===NaHCO3+NaClCO32-+H+===HCO3-4.碳酸钠溶液滴入足量盐酸:Na2CO3+2HCl===2NaCl+CO2↑+H2OCO32-+2H+===CO2↑+H2O5.碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH===2CH3COONa+CO2↑+H2OCO32-+2CH3COOH===2CH3COO-+CO2↑+H2O6.碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O===2NaHCO3CO32-+CO2+H2O===2HCO3-7.向饱和碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O===2NaHCO32Na++CO32-+CO2+H2O===2NaHCO3↓8.碳酸钠溶液及氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O===2Al(OH)3↓+3CO2↑9.碳酸钠溶液及氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O===2Fe(OH)3↓+3CO2↑六、碳酸氢钠1.碳酸氢钠溶液滴入盐酸:NaHCO3+HCl===NaCl+CO2↑+H2OHCO3-+H+===CO2↑+H2O2.碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH===CH3COONa+CO2↑+H2OHCO3-+CH3COOH===CH3COO-+CO2↑+H2O3.碳酸氢钠溶液及氯化铝溶液混合:3NaHCO3+AlCl3===Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+===Al(OH)3↓+3CO2↑4.碳酸氢钠溶液及氯化铁溶液混合:3NaHCO3+FeCl3===Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+===Fe(OH)3↓+3CO2↑5.碳酸氢钠溶液及氢氧化钠溶液混合:NaHCO3+NaOH===Na2CO3+H2OHCO3-+OH-===CO32-+H2O6.碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2OCa2++HCO3-+OH-===CaCO3↓+H2O7.碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O8.碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
钠和化合物的化学方程式和离子方程式

钠及其化合物的化学方程式和离子方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH-AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na 2CO3+H2O NaHCO3+NaOHCO 32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO 3+H2O H2CO3+NaOHHCO 3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O。
钠及其化合物的化学方程式和离子方程式

一■、钠点耀1、钠在氧气中燃烧:2Na + O2=—=Na2O2点耀2、钠在氯气中燃烧:2Na + Cl2=2NaCl3、钠常温条件下和氧气反应:4Na + O2=2Na2OA4、钠和硫共热:2Na+S^^=Na2s5、钠和水反应:2Na +2H2O^=2NaOH + H2f2Na + 2H2O^=2Na+ + 2OH- + H2 f6、钠和稀盐酸反应:2Na + 2HCl^=2NaCl + H2f2Na + 2H+^=2Na+ + H2 f7、钠投入到硫酸铜溶液中:2Na + CuSO4+2H2O^=Na2so4+Cu(OH)2;+H2 f2Na+Cu2+ + 2H2O^=2Na+ + Cu(OH)2 ;+H2 f8、向氯化铝溶液中加入少量的钠:6Na + 2AlCl3+ 6H2O^=6NaCl + 2Al(OH)3;+3H2 f6Na +2Al3+ + 6H2O^=6Na++Al(OH)3;+3H2 f9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+ 2H2O^=NaAlO2+3NaCl +2H2f4Na+Al3+ + 2H2O^=4Na++AlO2- + 2H2 f高温10、钠在高温条件下与四氯化钛反应:4Na+TiCl4=^工4NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O + H2O=2NaOHNa2O + H2O^=2Na+ + 2OH-2、氧化钠与二氧化碳反应:Na2O + CO2^=Na2CO33、氧化钠与盐酸反应:Na2O + 2HCl^=2NaCl + H2ONa2O + 2H+^=2Na+ + H2O4、向硫酸铜溶液中加入氧化钠:Na2O + CuSO4+H2O^=Cu(OH)2J+Na2sO4Na2O + Cu2+ + H2O^=Cu(OH)2J+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O + 2AlCl3+ 3H2O^=2Al(OH)3 J+6NaCl3Na2O + 2Al3+ + 3H2O===2Al(OH)3 J+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3^=NaAlO2+3NaCl2Na2O+Al3+ ==AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O^^4NaOH + O2f2Na2O2+2H2O===4Na+ +4OH-+O2 f2、过氧化钠与二氧化碳反应:2Na2O2+2CO2^=2Na2cO3+O2f3、过氧化钠与盐酸反应:2Na2O2+4HCl^』NaCl +2H2O+O2f2Na2O2+4H+=^4Na+ + 2H2O + O2 f4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O==2Cu(OH)2;+2Na2SO4+O2 f2Na2O2+ 2Cu2+ + 2H2O^=2Cu(OH)2J+4Na++O2 f 5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+ 6H2O^^Al(OH)3J+12NaCl + 3O2 f6Na2O2+4Al3+ + 6H2O^=4Al(OH)3J+12Na++3O2 f6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+ 2H2O^=NaAlO2+3NaCl + O2f2Na2O2+Al3+ + 2H2O^=AlO2-+4Na+ + O2f7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O^=4Fe(OH)3J+4Na2sO4+O2f4Na2O2+4Fe2+ + 6H2O^=4Fe(OH)3J+8Na+ + O2f四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fC12+2OH-^=Cl- + ClQ- + H2OA3、氯气通入热的浓氢氧化钠溶液中:3C12+6NaOH^^=5NaC1 + NaC1O3+ 3H2OA3c12+ 6OH-^^=5C1- + C1O3-+3H2OA4、硫和氢氧化钠溶液共热:3S+6NaOH --------2Na2S+Na2sO3+3H2OA3S+6OH-^^=2s2-+SO32- + 3H2O5、硅溶于氢氧化钠溶液中:Si + 2NaOH + H2O^=Na2SiO3+ 2H2fSi + 2OH- + H2O^=SiO32- + 2H2f6、氧化铝溶于氢氧化钠溶液中:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH + CO2^=Na2CO3+ H2O2OH- + CO2^=CO32- + H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH + CO2^=NaHCO3OH-+CO2^=HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2^=Na2SO3+ H2O2OH-+SO2^=SO32- + H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2^=NaHSO3OH-+SO2^=HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+ 6NaOH^=2Na3PO4+3H2OP2O5 + 6OH- ^=2PO43- + 3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH^=NaNO2+ NaNO3+ H2O2NO2 + 2OH-^=NO2- + NO3- + H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO + NO2+ 2NaOH^=2NaNO2+ H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2^=Na2SiO3+H2O2OH-+SiO2^=SiO32- + H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH^=Na2SO4+H2OSO3+ 2OH-^=SO42- + H2O16、盐酸和氢氧化钠溶液反应:HCl + NaOH^=NaCl + H2OH+ + OH-^=H2O17、醋酸和氢氧化钠溶液反应:CH3COOH + NaOH^=CH3COONa + H2OCH3COOH + OH-^=CH3COO- + H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH^=Na2S+2H2OH2s+2OH- =S2- + 2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2s+NaOH^=NaHS+H2OH2S + OH-^=HS- + H2O20、硫酸和氢氧化钠溶液反应:H2sO4+2NaOH^=Na2sO4+2H2OH+ + OH-^=H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH^=Na3PO4+3H2OH3PO4+3OH-^=PO43- + 3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH^=NaAlO2+ 2H2OAl(OH)3 +OH- =AlO2- + 2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+ NaOH^=AgOH ;+NaNO3Ag+ + OH- =AgOH ;24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH^=Na2sO4+Cu(OH)2;CU2+ + 2OH-^=Cu(OH)2 ;25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH^=Fe(OH)3;+3NaClFe3++3OH-^=Fe(OH)3 ;26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH^=Al(OH)3;+3NaClA13+ + 3OH- ==Al(OH)3 ;27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH^=NaAlO2+3NaCl +2H2OAl3++4OH- =AlO2- + 2H2OA28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4cl + NaOH^^=NaCl + NH3f+H2OANH4+ + OH;NH3f+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:ANH4HCO3+NaOH -------- N aHCO3 + NH3 f+H2OANH4++OH-二NH3T+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:ANH4HCO3+2NaOH ------- =Na2cO3+NH3f+2H2OANH4+ + HCO3- + OH-^^=CO32- + NH3f+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+ H2OHCO3- + OH-^=CO32- + H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH^=CaCO3 ;+NaHCO3 + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH^=CaCO3;+Na2CO3+ 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3 +CO32- + 2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH^=Mg(OH)2 ;+2NaHCO3Mg2+ + OH-^=Mg(OH)2 ;35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH^=Mg(OH)2 ;+Na2CO3+ 2H2OMg2+ + 2HCO32-+4OH-^=Mg(OH)2 ;+2CO32- + 2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3^AgCl ;+NaNO3Cl-+Ag+=AgCl ;A2、氯化钠固体和浓硫酸共热:NaCl + H2sO4^^=Na2so4+2HCl T电解3、电解饱和的氯化钠溶液:2NaCl +2H2O 2NaOH + H2T+Cl2T电解2Cl- +2H2O = 2OH- + H2T+Cl2T电解4、电解氯化钠的熔融液:2NaCl 2Na + Cl2T六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2cO3+ Ca(OH)2 ^=CaCO3 ;+2NaOHCO32- + Ca2+^=CaCO3;2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+ BaCl2^=BaCO3;+2NaClCO32- + Ba2+^=BaCO3 ;3、碳酸钠溶液呈碱性:Na2cO3+ H2O=NaHCO3+ NaOHCO32- + H2O^^ HCO3- + OH-4、碳酸钠溶液滴入少量的盐酸:Na2cO3+ HCl^=NaHCO3+NaClCO32- + H+^=HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2cO3+ 2HCl^=2NaCl + CO2T+H2OCO32- + 2H+^=CO2T+H2O6、碳酸钠溶液中加入醋酸:Na2cO3+ 2CH3COOH^=2CH3COONa + CO2T+H2OCO32- + 2CH3COOH^=2CH3COO- + CO2T+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+ H2O^=2NaHCO3CO32- + CO2+ H2O^=2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+H2O^=2NaHCO32Na+ + CO32- + CO2+H2O^=2NaHCO3;9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+ 2AlCl3+3H2O^=2Al(OH)3 ;+6NaCl + 3CO2 f3CO32- + 2Al3+ + 3H2O^=2Al(OH)3;+3CO2 f10、碳酸钠溶液与氯化铁溶液混合:3Na2cO3+ 2FeCl3+ 3H2O^=2Fe(OH)3;+6NaCl + 3CO2 f3CO32- + 2Fe3+ + 3H2O^=2Fe(OH)3;+3CO2 f七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+ H2O=H2cO3+ NaOHHCO3-+H2O^^ H2c O3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl^=NaCl + CO2f+H2OHCO3- + H+^=CO2f+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH^=CH3COONa + CO2f+H2OHCO3-+CH3COOH^=CH3COO-+CO2 f+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3^=Al(OH)3 ;+3NaCl+3CO2 f3HCO3-+Al3+^=Al(OH)3 ;+3CO2f5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+ FeCl3^=Fe(OH)3 ;+3NaCl + 3CO2 f3HCO3- + Fe3+^=Fe(OH)3 ;+3CO2 f6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+H2OHCO3-+OH-^=CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3;+NaOH + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3 + Ca(OH)2 =CaCO3; +Na2CO3 + 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3; +CO32- + 2H2OA9、碳酸氢钠受热分解:2NaHCO3^^Na2CO3+CO2 f +H20一、镁点燃1、镁在氧气中燃烧:2M g+O2==2M g O点燃2、镁在氯气中燃烧:Mg+CI2=^^MgCI2点物3、镁在氮气中燃烧:3Mg+N2^=Mg3N2点燃4、镁在二氧化碳中燃烧:2Mg+CO2^=2MgO + CA5、镁与硫共热:Mg+S :MgSA6、镁与水共热:Mg+2H2O^^=Mg(OH)2十% f7、镁和盐酸反应:Mg + 2HCI^=MgCI2 + H2 fMg + 2H+^=Mg2+ + H2 f8、镁和醋酸反应:Mg+2CH3COOH^=(CH3COO)2Mg+H2 fMg+2CH3COOH^=2CH3COO- + Mg2+ + H2 f9、镁和氯化镂溶液反应:Mg + 2NH4CI^MgCI2 + 2NH3 f +H2 fMg+2NH4+^=Mg2+ + 2NH3 f +H2 f 10、将少量的镁投入到氯化铁溶液中:Mg+2FeCI3^=2FeCI2 + MgCI2Mg+2Fe3+ Mg2+ + 2Fe2+ 11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCI3^=3MgCI2 + 2Fe3Mg+2Fe3+^=3Mg2+ + 2Fe 12、镁和硫酸铜溶液反应:Mg+CuSQ4^=MgSQ4+CuMg+Cu2+ Mg2+ + Cu13、镁和浓硫酸反应:Mg+2H2SQ4^=MgSQ4+SQ2f+2H2Q14、镁和浓硝酸反应:Mg+4HNQ3^=Mg(NQ3)2+2NQ2 f+2H2QMg+4H+ + 2NQ3-^=Mg2+ + 2NQ2 f+2H2Q15、镁和稀硝酸反应:3Mg+8HNQ3^=3Mg(NQ3)2+2NQ f+4H2Q3Mg+8H+ + 2NQ3-^=Mg2+ + 2NQ f+4H2Q二、氧化镁1、氧化镁与盐酸反应:MgQ + 2HCl^=MgCl2+ H2QMgQ + 2H+^=Mg2+ + H2Q2、氧化镁和醋酸反应:MgQ + 2CH3CQQH^=(CH3CQQ)2Mg+H2QMgQ + 2CH3CQQH^=Mg2+ + 2CH3CQQ- + H2Q3、氧化镁溶于氯化铵溶液中:MgQ + 2NH4Cl^=MgCl2+ 2NH3 f+H2QMgQ + 2NH4+ ^=Mg2+ + 2NH3 f+H2Q4、氧化镁投入到氯化铁溶液中:3MgQ + 2FeCl3+3H2Q^=3MgCl2+ 2Fe(QH)33MgQ + 2Fe3+ + 3H2Q^=3Mg2+ + 2Fe(QH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(QH)2+2HCl^=MgCl2+2H2QMg(QH)2+2H+^=Mg2+ + 2H2Q2、氢氧化镁和醋酸反应:Mg(QH)2+2CH3CQQH^=(CH3CQQ)2Mg+2H2QMg(QH)2+2CH3CQQH^=2CH3CQQ- + Mg2+ + 2H2Q 3、氢氧化镁溶于氯化铵溶液中:Mg(QH)2+ 2NH4Cl^=MgCl2 + 2NH3f+2H2QMg(QH)2+2NH4+^=Mg2+ + 2NH3f+2H2Q 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+^=3Mg2+ + 2Fe(OH)3一 A5、氢氧化镁受热分解:Mg(OH)2^^MgO + H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2 + 2AgNO3^2AgCl ;+Mg(NO3)2Cl-+Ag+==AgCl ;2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+ 2NaOH=Mg(OH)2 ;+2NaClMg2+ + 2OH-^=Mg(OH)2 ;3、氯化镁溶液加入氨水:MgCl2+ 2NH3-H2O^=Mg(OH)2 ;+2NH4ClMg2+ + 2NH3-H2O^=Mg(OH)2;+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+ 2NaAlO2+4H2O^=Mg(OH)2;+2Al(OH)3 ;+2NaClMg2+ + 2AlO2-+4H2O^=Mg(OH)2 ;+2Al(OH)3 ;电解5、电解氯化镁的熔融液:MgCl2 -------- Mg+Cl2f电解6、电解氯化镁的溶液:MgCl2+ 2H2O --------------Mg(OH)2 ;+H2 f+Cl2 f电解Mg2+ + 2Cl- +2H2O ,Mg(OH)2;+H2 f+Cl2 f五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+ 2HCl===MgCl2+ CO2f+H2OMgCO3+ 2H+===Mg2+ + CO2f+H2O2、碳酸镁与醋酸溶液反应:MgCO3+ 2CH3COOH===CH3cOO)2Mg+CO2f+H2OMgCO3+ 2CH3COOH===2CH3COO- + Mg2+ + CO2f+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+ H2O===Mg(HCO3)2MgCO3+ CO2+H2O===Mg2+ + 2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+ 2FeCl3+3H2O===3MgCl2+ 2Fe(OH)31+3CO2f3MgCO3+ 2Fe3++3H2O===3Mg2+ + 2Fe(OH)3 "3CO2f5、碳酸镁加入氯化铵溶液中:MgCO3+ 2NH4Cl===MgCl2+ 2NH3f+CO2fMgCO3+ 2NH4+===Mg2+ + 2NH3f+CO2f6、碳酸镁高温煅烧:MgCO3高温MgO + CO2f六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+ 2CO2f +2H2OHCO3- + H+==£O2T+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)J+2NaHCO3Mg2+ + 2OH-===Mg(OH)2;3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2l+Na2cO3+2H2OMg2+ + 2HCO3-+4OH-===Mg(OH)2; +2CO32- + 2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+ 2Ca(OH)2===Mg(OH)2l+2CaCO31+2H2OMg2+ + 2HCO3- + 2Ca2++4OH-===Mg(OH)2l +2CaCO3 1+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2MgCO3l+CO2T+H2O一、铝点燃1、铝在氧气中燃烧:4Al + 3O==2Al2O3点燃2、铝在氯气中燃烧:2Al + 3Cl2r=^=2AlCl3A3、铝和硫共热:2Al + 3S^=A12s34、铝与稀硫酸反应:2Al + 3H2sO4^=Al2(SO4)3+3H2 f2Al+6H+^=2Al3+ + 3H2 f5、铝和氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fA6、铝和浓硫酸共热:2Al + 6H2sO4^^=Al2(SO4)3+3SO2 f+6H2OA7、铝和浓硝酸共热:Al + 6HNO3=Al(NO3)3+3NO2 f+3H2OAAl + 6H+ + 3NO3- Al3+ + 3NO2f+3H2O 8、铝和稀硝酸反应:Al+4HNO3^=Al(NO3)3+NO f+2H2OAl+4H+ + NO3- =Al3+ + NO f+2H2O8、铝和硝酸银溶液反应:Al + 3AgNO3^=Al(NO3)3 +3AgAl + 3Ag+^=Al3+ + 3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4^=Al2(SO4)3+3Cu2A1 + 3CU2+^=2Al3++3Cu高温10、铝和氧化铁高温下反应:2A1 + Fe2O3一^A12O3+ 2Fe高温11、铝和四氧化三铁高温共热:8A1 + 3Fe3O4= 皿4A12O3+9Fe有温12、铝和氧化铜高温共热:2A1+3Cug^LA12O3+ 3Cu而温13、铝和二氧化镒高温共热:4A1+3MnO2= 皿2A12O3+ 3Mn二、氧化铝1、氧化铝与稀硫酸反应:A12O3+3H2SO4^=A12(SO4)3+3H2OA12O3 + 6H+^=2A13++3H2O2、氧化铝与氢氧化钠溶液反应:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O3、电解氧化铝的熔融液:2ALO_及生4A1 + 3O. f2 3冰晶石2三、氢氧化铝1、氢氧化铝与稀硫酸反应:2A1(OH)3 +3H2sO4^A12(SO4)3+6H2OA1(OH)3 +3H + =A13+ + 3H2O2、氢氧化铝与氢氧化钠溶液反应:A1(OH)3 +NaOH^=NaA1O2+ 2H2OA1(OH)3 +OH-^=A1O2- + 2H2OA3、加热氢氧化铝:2A1(OH)3 A12O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:A12(SO4)3+3BaC12^=2A1C13+3BaSO4;SO42- + Ba2+ ^=BaSO4 ;2、硫酸铝的水溶液呈酸性:A12(SO4)3+ 6H2O^^2A1(OH)3+3H2SO4A13+ + 3H2O^^A1(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:A12(SO4)3+6NaOH^=3Na2sO4+2A1(OH)3;A13+ + 3OH- =A1(OH)3 ;4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH^=2NaAlO2+ 3Na2SO4+4H2OA13++4OH- =AlO2- + 2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:A12(SO4)3+3Ba(OH)2 ^=2A1(OH)3 ;+3BaSO4 ;2A13++3SO42- + 3Ba2+ + 6OH-^=2A1(OH)3 ;+3BaSO4 ;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:A12(SO4)3+4Ba(OH)2 ^=Ba(A1O2)2 +3BaSO4 ;+4H2O2A13++3SO42- + 3Ba2+ + 8OH-^=2A1O2- + 3BaSO4 ;+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2 +2KA1(SO4)2 ^=2A1(OH)3 ;+3BaSO4 ;+K2SO43Ba2+ + 6OH- + 2A13++3SO42- ==3BaSO4 ;+2A1(OH)3 ;8、向明矶溶液中加入足量的氢氧化钡溶液:KA1(SO4)2+2Ba(OH)2 ^=KA1O2 + 2BaSO4 ;+2H2OA13+ + 2SO42- + 2Ba2++4OH- =A1O2- + 2BaSO4;+2H2O9、向硫酸铝溶液中加入氨水:A12(SO4)3+6NH3.H2O^=2A1(OH)3;+3(NH4)2SO4A13+ + 3NH3-H2O^=A1(OH)3;+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:A12(SO4)3+3Na2CO3+3H2O^=2A1(OH)3;+3Na2SO4+3CO2f2A13++3CO32- + 3H2O^=2A1(OH)3;+3CO2 f11、向硫酸铝溶液中加入碳酸氢钠溶液:A12(SO4)3+6NaHCO3^=2A1(OH)3;+3Na2SO4+6CO2 fA13+ + 3HCO3- =A1(OH)3;+3CO2f12、向硫酸铝溶液中加入硫化钠溶液:A12(SO4)3+3Na2S+6H2O^=2A1(OH)3 "3Na2sO4+3H2s f2A13++3S2- + 6H2O^=2A1(OH)3;+3H2S f13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O^=2Al(OH)3 "3Na2sO4+6H2s fAl3+ + 3HS- + 3H2O^=Al(OH)3 "3H2s f14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+ 6H2O^=2Al(OH)3 ;+3Na2SO4+3H2SiO3;2Al3++3SiO32- + 6H2O^=2Al(OH)3;+3H2SiO3 ;15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+ 12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+ 2H2O=AI(OH)3+NaOHAlO2- + 2H2O^^Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+ HCl + H2O^=Al(OH)3;+NaClAlO2- + H+ + H2O^=Al(OH)3;3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl^=NaCl+AlCl3+2H2OAlO2-+4H+=Al3+ + 2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+ 3H2O^=2Al(OH)3;+Na2CO32AlO2- + CO2+3H2O^=2Al(OH)3;+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+ CO2+ 2H2O^=Al(OH)3+NaHCO3AlO2- + CO2+ 2H2O^=Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+ NH4Cl + H2O^=Al(OH)3;+NaCl + NH3 fAlO2- + NH4+ + H2O^=Al(OH)3;+NH3 f8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+ FeCl3+6H2O^=3Al(OH)3;+Fe(OH)3 ;+3NaCl3AlO2- + Fe3+ + 6H2O^=3Al(OH)3;+Fe(OH)3 ;。
有关钠的所有化学方程式

《钠》和《钠的化合物》4Na+O2====Na2O2Na+O2====Na2O22Na+Cl2====2NaCl(常温下也反应)2Na+S====Na2S(可能爆炸)2Na+2H2O====2NaOH+H2↑2Na+2HCl====2NaCl+H2↑2NaOH+CuSO4====Na2S O4+Cu(OH)24Na+TiCl4====Ti+4NaClNa2O+H2O====2NaOHNa2O+2HCl====2NaCl+H2ONa2O+CO2====Na2CO32Na2O2+2H2O====4NaOH+O22Na2O2+2CO2====2Na2CO3+O2Ca(OH)2+CO2(少量)====CaCO3↓+H2OCa(OH)2+2CO2(过量)====Ca(HCO3)2CaCO3+CO2+H2O====Ca(HCO3)22NaOH+CO2(少量)====Na2CO3+H2ONaOH+CO2(过量)====NaHCO3Na2CO3+H2O+CO2====2NaHCO3Na2CO3+2HCl====H2O+CO2+2NaClNaHCO3+HCl====H2O+CO2+NaClNa2CO3+Ca(OH)2====2NaOH+CaCO3↓Na2CO3+CaCl2====CaCO3↓+2NaClNaHCO3+NaOH====Na2CO3+H2O2NaHCO3+Ca(OH)2(少量)====Na2CO3+CaCO3↓+H2O NaHCO3+Ca(OH)2(过量)====NaOH+CaCO3↓+H2O2NaHCO3====Na2CO3+H2O+CO21、钠在空气中放置4Na + O2 = 2 Na2O2、钠在空气中点燃2Na +O2 ===== Na2O23、钠和硫反应2Na + S =Na2S4、钠和水反应2Na + 2H2O =2NaOH +H2↑5、钠和硫酸铜溶液反应2Na + CuSO4 + 2H2O = Cu(OH)2 ↓+Na2SO4 +H2 ↑6、钠和乙醇反应2Na + 2CH3CH2OH = 2CH3CH2ONa +H2↑7、氧化钠和水反应Na2O + H2O = 2NaOH8、氧化钠和二氧化碳反应Na2O + CO2 = Na2CO39、氧化钠和盐酸反应Na2O + 2HCl = 2NaCl + H2O10、过氧化钠和水反应2Na2O2 + 2H2O = 4NaOH + O2↑11、过氧化钠和二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O212、过氧化钠和盐酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑13、碳酸氢钠受热分解2NaHCO3 △ Na2CO3 + CO2↑+ H2O14、碳酸钠和盐酸反应Na2CO3 +2HCl = 2NaCl + CO2↑ +H2ONa2CO3 +HCl = NaCl + NaHCO315、碳酸氢钠和盐酸反应NaHCO3 +HCl = NaCl + CO2↑ +H2O16、碳酸钠和氢氧化钙反应Na2CO3 +Ca(OH)2 = CaCO3 ↓+ 2NaOH17、碳酸氢钠和氢氧化钠反应NaHCO3 + NaOH = Na2CO3 + H2O18、碳酸氢钠和氢氧化钙反应2NaHCO3 + Ca(OH)2 = CaCO3↓+ Na2CO3 + 2H2ONaHCO3 + Ca(OH)2 = CaCO3↓+ NaOH + H2O。
钠及其重要化合物

钠及其重要化合物
钠(化学符号:Na)是一种常见的金属元素,属于碱金属。
它在自然界中以离子形式存在,主要存在于盐湖、海水和地壳中。
钠具有较低的密度和较低的熔点,是常见的金属元素之一。
钠及其重要化合物有很多广泛的应用,下面是一些重要的钠化合物:
氯化钠(NaCl):氯化钠是常见的盐,被广泛用作食盐和工业用途。
它在食品制备、腌制食品、润滑剂制备、冰融化剂等方面有重要的应用。
碳酸钠(Na2CO3):碳酸钠,又称为苏打灰或纯碱,是一种重要的化工原料。
它被广泛用于玻璃制造、肥皂制造、纺织工业、清洗剂制备、水处理等领域。
氢氧化钠(NaOH):氢氧化钠,也被称为烧碱,是一种强碱。
它在化学工业中用于中和酸、制造肥皂、纸浆和纺织品的处理、清洁剂的制备等。
亚硝酸钠(NaNO2):亚硝酸钠是一种重要的氧化剂和消毒剂。
它在食品工业中被用作食品防腐剂,还用于染料和材料的合成。
硝酸钠(NaNO3):硝酸钠被广泛用于肥料制造、火药工业和炸药制备。
乙酸钠(CH3COONa):乙酸钠是乙酸的钠盐,主要用于食品调味剂、制药和染料工业中。
这些化合物在工业、农业、食品加工、制药和化妆品等领域中发挥着重要的作用。
此外,钠还在生物体内发挥重要的生理功能,如维持水平衡、神经传递和肌肉收缩等。
但需要注意的是,钠是一种碱性金属,以纯形式或高浓度的化合物可能对人体和环境具有危害,需注意安全使用。
钠和钠的化合物方程式

《钠》和《钠的化合物》4Na+O2====Na2O2Na+O2====Na2O22Na+Cl2====2NaCl(常温下也反应)2Na+S====Na2S(可能爆炸)2Na+2H2O====2NaOH+H2↑2Na+2HCl====2NaCl+H2↑2NaOH+CuSO4====Na2SO4+Cu(OH)24Na+TiCl4====Ti+4NaClNa2O+H2O====2NaOHNa2O+2HCl====2NaCl+H2ONa2O+CO2====Na2CO32Na2O2+2H2O====4NaOH+O22Na2O2+2CO2====2Na2CO3+O2Ca(OH)2+CO2(少量)====CaCO3↓+H2OCa(OH)2+2CO2(过量)====Ca(HCO3)2CaCO3+CO2+H2O====Ca(HCO3)22NaOH+CO2(少量)====Na2CO3+H2ONaOH+CO2(过量)====NaHCO3Na2CO3+H2O+CO2====2NaHCO3Na2CO3+2HCl====H2O+CO2+2NaClNaHCO3+HCl====H2O+CO2+NaClNa2CO3+Ca(OH)2====2NaOH+CaCO3↓Na2CO3+CaCl2====CaCO3↓+2NaClNaHCO3+NaOH====Na2CO3+H2O2NaHCO3+Ca(OH)2(少量)====Na2CO3+CaCO3↓+H2ONaHCO3+Ca(OH)2(过量)====NaOH+CaCO3↓+H2O2NaHCO3====Na2CO3+H2O+CO21、钠在空气中放置4Na + O2 = 2 Na2O2、钠在空气中点燃2Na +O2 ===== Na2O23、钠和硫反应2Na + S =Na2S4、钠和水反应2Na + 2H2O =2NaOH +H2↑5、钠和硫酸铜溶液反应2Na + CuSO4 + 2H2O = Cu(OH)2↓+Na2SO4 +H2↑6、钠和乙醇反应2Na + 2CH3CH2OH = 2CH3CH2ONa +H2↑7、氧化钠和水反应Na2O + H2O = 2NaOH8、氧化钠和二氧化碳反应Na2O + CO2 = Na2CO39、氧化钠和盐酸反应Na2O + 2HCl = 2NaCl + H2O10、过氧化钠和水反应2Na2O2 + 2H2O = 4NaOH + O2↑11、过氧化钠和二氧化碳反应2Na2O2 + 2CO2 = 2Na2CO3 + O212、过氧化钠和盐酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑13、碳酸氢钠受热分解2NaHCO3△Na2CO3 + CO2↑+ H2O14、碳酸钠和盐酸反应Na2CO3 +2HCl = 2NaCl + CO2↑ +H2ONa2CO3 +HCl = NaCl + NaHCO315、碳酸氢钠和盐酸反应NaHCO3 +HCl = NaCl + CO2↑ +H2O16、碳酸钠和氢氧化钙反应Na2CO3 +Ca(OH)2 = CaCO3↓+ 2NaOH17、碳酸氢钠和氢氧化钠反应NaHCO3 + NaOH = Na2CO3 + H2O18、碳酸氢钠和氢氧化钙反应2NaHCO3 + Ca(OH)2 = CaCO3↓+ Na2CO3 + 2H2ONaHCO3 + Ca(OH)2 = CaCO3↓+ NaOH + H2O化学复习:元素化合物主要方程式总结来源:环球网校时间:2009-4-28 10:11:00 所属频道:高考元素化合物主要方程式说明:1、想学好元素化合物,请熟练掌握以上基本方程式,注意规范;。
能与钠反应的有机物条件

能与钠反应的有机物条件一、引言钠是一种活泼的金属元素,与许多有机物都能发生反应。
这些反应可以产生各种化合物,包括醇、酮、醛、烯烃等。
本文将介绍能与钠反应的有机物条件。
二、能与钠反应的有机物1. 烷基卤化物烷基卤化物是一类含有卤素(氯、溴或碘)的有机化合物,它们可以与钠反应生成相应的烷基钠。
例如,丙基溴可以和钠反应生成丙基钠:C3H7Br + Na → C3H7Na + Br烷基钠是一种非常重要的试剂,它可以用于合成各种有机化合物。
2. 醇醇也是一类能够与钠反应的有机化合物。
当醇和钠在乙醚中反应时,会生成相应的醇盐。
例如,乙醇和钠在乙醚中反应可以得到乙醇钠:C2H5OH + Na → C2H5ONa + 1/2 H2↑3. 酮和醛酮和醛也是一类能够与钠反应的有机化合物。
它们可以与钠反应生成相应的醇盐。
例如,丙酮和钠在乙醚中反应可以得到丙醇钠:(CH3)2CO + Na → (CH3)2C(OH)Na4. 烯烃烯烃也是一类能够与钠反应的有机化合物。
当烯烃和钠在液氨中反应时,会生成相应的共轭二元醇盐。
例如,1-丁烯和钠在液氨中反应可以得到1,4-丁二醇钠:C4H8 + 2Na → C4H6Na2 + H2↑5. 脂肪酸脂肪酸也是一类能够与钠反应的有机化合物。
当脂肪酸和钠在乙醇中反应时,会生成相应的脂肪酸盐。
例如,硬脂酸和钠在乙醇中反应可以得到硬脂酸钠:C17H35COOH + Na → C17H35COONa + 1/2 H2↑6. 碳酸盐碳酸盐也是一类能够与钠反应的有机化合物。
当碳酸盐和钠在水中反应时,会生成相应的碳酸钠。
例如,碳酸氢钠和钠在水中反应可以得到碳酸钠:NaHCO3 + Na → Na2CO3 + 1/2 H2↑三、总结本文介绍了能与钠反应的有机物条件。
这些有机化合物包括烷基卤化物、醇、酮和醛、烯烃、脂肪酸和碳酸盐。
这些反应可以产生各种化合物,包括醇、酮、醛、烯烃等。
这些有机化合物在有机合成中具有非常重要的作用。
钠及钠的化合物讲义
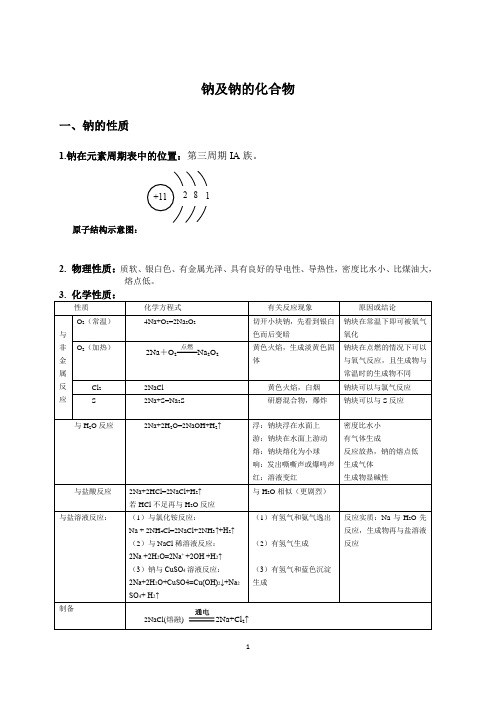
钠及钠的化合物一、钠的性质1.钠在元素周期表中的位置:第三周期IA族。
原子结构示意图:2. 物理性质:质软、银白色、有金属光泽、具有良好的导电性、导热性,密度比水小、比煤油大,熔点低。
二、钠的氧化物1.氧化钠和过氧化钠的性质比较2. 过氧化钠的氧化性:三、Na 2CO 3和NaHCO 31. Na 2CO 3和NaHCO 3的性质比较Na 2O 2与SO 2:Na 2O 2+SO 2Na 2SO 4与FeCl 2溶液现象:生成红褐色沉淀原理:3Na 2O 2+6FeCl 2+6H 2O 4Fe(OH)3↓+6NaCl+2FeCl 3与氢硫酸现象:溶液变浑浊原理:Na 2O 2+H 2S2NaOH+S↓与Na 2SO 3溶液:Na 2O 2+Na 2SO 3+H 2ONa 2SO 4+2NaOH与品红溶液:品红溶液褪色与酚酞试液:溶液先变红后褪色,同时产生无色气泡2. 区分Na 2CO 3和NaHCO 3的方法(1)若为固体,则加热,产生的气体能使澄清石灰水变浑浊的为NaHCO 3(2)若为液体,则可测试两种溶液的pH 值,pH 值大的为Na 2CO 3。
稀溶液(0.1mol /L )中碳酸钠溶液的pH 在12左右,而碳酸氢钠溶液的PH在8左右;或者取少量两种溶液于试管中,加入酚酞溶液,红色更深的为Na 2CO 3 (3)用盐酸进行鉴别:把NaHCO 3往盐酸中滴加与盐酸往NaHCO 3中滴加现象相同,都是立刻产生气体。
把Na 2CO 3往盐酸中滴加与盐酸往Na 2CO 3中滴加现象不同,具体现象为: ①把Na 2CO 3往盐酸中滴加:开始时,盐酸相对过量,即开始就有CO 2气体放出。
CO 32-+2H +=CO 2↑+H 2O②盐酸往Na 2CO 3中滴加:开始时,Na 2CO 3相对过量,发生反应:CO 32-+H + =HCO 3-,继续滴加发生进一步反应:HCO 3-+H +=CO 2↑+H 2O 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碱性氧化物 常温与O2反应
过氧化物(不属碱性氧化物) 燃烧或加热时与O2反应 供氧剂 、漂白剂
三、钠的碳酸盐和碳酸氢盐
1.俗名差异: 俗名纯碱、苏打、洗涤碱、 1.俗名差异:Na2CO3俗名纯碱、苏打、洗涤碱、 俗名差异 天然碱等; 俗名小苏打。 天然碱等;NaHCO3俗名小苏打。 2.溶解性差异:二者均溶解于水, 2.溶解性差异:二者均溶解于水,但Na2CO3的 溶解性差异 溶解度大于NaHCO 溶解度大于NaHCO3的。 问题:往饱和氢氧化钠溶液、饱和Na 问题:往饱和氢氧化钠溶液、饱和Na2CO3溶液 中通入过量CO 后有什么现象?原因? 中通入过量CO2后有什么现象?原因? 3.水解程度差异:二者均为弱酸盐, 3.水解程度差异:二者均为弱酸盐,水解使溶 水解程度差异 液显碱性, 水解程度大于NaHCO 液显碱性,但Na2CO3水解程度大于NaHCO3的。 水解原理应用如泡沫灭火剂、去油污等。 水解原理应用如泡沫灭火剂、去油污等。
氧化钠与过氧化钠的比较
名称 化学式 颜色状态 与水反应 与CO2反应 与酸反应 类别 生成条件 用途 氧化钠 Na2O(O为-2价) 白色固体
Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O
过氧化钠 Na2O2(O为-1价) 淡黄色固体
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=Na2CO3+O2↑ 2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O2与水反应的实验探究问题
问题1:设计实验验证过氧化钠与水反应的产物。 问题 :设计实验验证过氧化钠与水反应的产物。
问题2:用脱脂棉包住0.2g Na2O2粉末,置于 粉末, 问题 :用脱脂棉包住 石棉网上,往脱脂棉上滴水, 石棉网上,往脱脂棉上滴水,可观察到脱脂棉 燃烧起来。 燃烧起来。 由上述实验现象得出的结论是 。
返回
问题4的实验设计方案 问题 的实验设计方案
问题1:实验中不用测量产 实验中不用测量产 生氢气的体积, 生氢气的体积,就可以得到 钠的相对原子质量。 钠的相对原子质量。请问实 验中应该测量那些数据? 验中应该测量那些数据 问题2:干燥管的作用是什 干燥管的作用是什 问题 若不用, 么?若不用,测得的钠的相 对原子质量比实际值大还是 小?
返回
问题3的实验设计方案 问题 的实验设计方案
实验说明: 1.分液漏斗中加入水的体积必须大于烧 分液漏斗中加入水的体积必须大于烧 瓶容积的一半, 瓶容积的一半,这样流入烧瓶的水与原 烧瓶中的煤油充满烧瓶, 烧瓶中的煤油充满烧瓶,保证烧瓶中的 空气被完全排开, 空气被完全排开,不会给氢气的点燃带 来意外事故。 来意外事故。 2.烧瓶中煤油的体积不要超过烧瓶容积 烧瓶中煤油的体积不要超过烧瓶容积 的一半, 的一半,并且分液漏斗末端必须恰好接 触煤油液面,目的在于: 触煤油液面,目的在于:确保煤油能被 完全压回漏斗。 完全压回漏斗。保证烧瓶中保持一定体 积的水。 积的水。
1.钠的化学性质 钠的化学性质 ⑴钠与某些非金属单质的反应 ⑵钠与水的反应 ⑶钠与酸的反应 ⑷钠与盐的反应 ⑸钠与某些有机物的反应
钠与水反应的实验问题
问题1:请设计尽可能多的实验, 问题 :请设计尽可能多的实验,完成钠与水 的反应实验,并验证产物。 的反应实验,并验证产物。 问题2:请利用钠与水反应设计喷泉实验, 问题 :请利用钠与水反应设计喷泉实验,要 求喷出红色喷泉。 求喷出红色喷泉。 问题3:请设计完成钠与水的反应实验, 问题 :请设计完成钠与水的反应实验,要求 产生氢气必须缓慢并验证产物。 产生氢气必须缓慢并验证产物。 问题4: 问题 :请利用钠与水的反应设计测得钠的相 对原子质量的最简便实验,要求不测气体体积。 对原子质量的最简便实验,要求不测气体体积。碳酸钠与碳Biblioteka 氢钠的鉴别: 碳酸钠与碳酸氢钠的鉴别:
1、利用热稳定性不同;分别加热少量固体,若发生 、利用热稳定性不同;分别加热少量固体, 分解反应,将产生的气体通入澄清石灰水中, 分解反应,将产生的气体通入澄清石灰水中,石灰 水变浑浊的是碳酸氢钠,另一个是碳酸钠。 水变浑浊的是碳酸氢钠,另一个是碳酸钠。 2、利用和酸反应的速率不同:分别取一定量的固体, 、利用和酸反应的速率不同:分别取一定量的固体, 加入等浓度等体积的盐酸,反应快, 加入等浓度等体积的盐酸,反应快,产生气体相应 多的是碳酸氢钠,另一个是碳酸钠。 多的是碳酸氢钠,另一个是碳酸钠。 3、利用阴离子不同:分别取其稀溶液,滴加氯化钡 、利用阴离子不同:分别取其稀溶液, 稀溶液或氯化钙溶液,产生沉淀的为碳酸钠,另一 稀溶液或氯化钙溶液,产生沉淀的为碳酸钠, 是碳酸氢钠。 是碳酸氢钠。 4、利用溶液的酸碱性:测其稀溶液(0.1mol/L) 、利用溶液的酸碱性:测其稀溶液( / ) 左右, 的PH值,碳酸钠溶液的 在12左右,而碳酸氢钠溶 值 碳酸钠溶液的PH在 左右 液的PH在 左右 左右。 液的 在8左右。
7.氧化还原差异 Na2O一般不表现氧化性,但有一 氧化还原差异: 一般不表现氧化性, 氧化还原差异 一般不表现氧化性 定还原性如: 定还原性如: 2Na2O+O2=2Na2O2;Na2O2主要表现 氧化性(也就是H2O2的氧化性)由于过氧化钠有强 氧化性(也就是 的氧化性) 氧化性,熔融时遇到棉花、碳粉或铝粉会发生爆炸, 氧化性,熔融时遇到棉花、碳粉或铝粉会发生爆炸, 所以应小心使用。 所以应小心使用。 8.漂白作用的差异: Na2O无漂白作用, Na2O2是漂 漂白作用的差异: 无漂白作用, 漂白作用的差异 无漂白作用 白剂,能漂白织物、麦秆、羽毛、品红、酚酞等。 白剂,能漂白织物、麦秆、羽毛、品红、酚酞等。 9.制法差异:金属钠常温下跟空气里的氧气反应生 制法差异: 制法差异 成 Na2O钠在空气中受热后燃烧生成 Na2O2。 钠在空气中受热后燃烧生成 10.用途差异: Na2O用途不广泛, Na2O2用途比较 用途差异: 用途不广泛, 用途差异 用途不广泛 广泛,可做供氧剂、漂白剂、杀菌剂、消毒剂等。 广泛,可做供氧剂、漂白剂、杀菌剂、消毒剂等。
第1讲 钠及其重要化合物
钠及其化合物
复习目标
1、掌握Na及其化合物的性质 、掌握 及其化合物的性质 及其化合物 2、掌握Na及其化合物的相关实验及现象 、掌握 及其化合物的相关实验及现象 及其 3、掌握与 、钠的化合物的相关的计算。 、掌握与Na、钠的化合物的相关的计算。 学习重点:实验设计、过氧化钠的性质、 学习重点:实验设计、过氧化钠的性质、有 关混合物的计算。 关混合物的计算。
5.属类差异: 属于碱性氧化物,, 5.属类差异: Na2O属于碱性氧化物,, 2O2为复杂氧化 属类差异 属于碱性氧化物,,Na
物,过氧化物。 过氧化物。
6.化学性质差异: 6.化学性质差异: 化学性质差异 ①与水反应:Na2O+H2O=2NaOH 与水反应:
2Na2O2+2H2O=4NaOH+O2↑(标方向、数目) (标方向、数目) 反应: ②与CO2反应:Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2↑ ③与酸的反应: Na2O+2HCl=2NaCl+H2O 与酸的反应: 2Na2O2+4HCl=4NaCl+2H2O+O2↑ 对比以上反应,主要有二方面差异: 对比以上反应,主要有二方面差异: 参加的反应中有O 产生; ①反应产物差异,Na2O2参加的反应中有 2产生; 反应产物差异, ②反应类型差异, Na2O参与的反应为非氧化还原反应。 反应类型差异, 参与的反应为非氧化还原反应。 参与的反应为非氧化还原反应
返回
二、钠的氧化物
Na2O与Na2O2的十大差异: 的十大差异: 与
为白色固体, 淡黄色固体 1.颜色差异 Na2O为白色固体, Na2O2为淡黄色固体 颜色差异: 颜色差异 为白色固体 2.结构差异: Na2O和Na2O2都为离子化合物,但Na2O 结构差异: 都为离子化合物, 离子化合物 结构差异 和 中含有O 中含有O 过氧根离子 过氧根离子)。 中含有 2-,而Na2O2中含有 22-(过氧根离子 。 3.氧元素价态差异: 氧元素价态差异: 氧元素价态差异 4.稳定性差异: Na2O不稳定,能继续与氧气反应生 稳定性差异: 不稳定, 稳定性差异 不稳定 比较稳定。 成Na2O2,Na2O2比较稳定。
7.与石灰水等溶液反应差异:它们均能与石灰水、 7.与石灰水等溶液反应差异:它们均能与石灰水、Ba 与石灰水等溶液反应差异 (OH)2溶液反应,现象相同,但反应产物有差异, OH) 溶液反应,现象相同,但反应产物有差异, 与石灰水、 Ba(OH) NaHCO3与石灰水、 Ba(OH)2溶液还涉及量的问题 8.与 等溶液的反应差异:分别向Na 8.与CaCl2或BaCl2等溶液的反应差异:分别向Na2CO3 的溶液中加入CaCl 溶液, 和NaHCO3的溶液中加入CaCl2或BaCl2溶液, Na2CO3溶 液产生沉淀, 很难产生沉淀。 液产生沉淀,但NaHCO3很难产生沉淀。 故常用加入与CaCl 故常用加入与CaCl2或BaCl2等溶液的方法鉴别 Na2CO3和NaHCO3 9.用途差异: 广泛用于玻璃、制皂、造纸、 9.用途差异:Na2CO3广泛用于玻璃、制皂、造纸、 用途差异 纺织等工业及生活中的洗涤剂;NaHCO3用于泡沫灭 纺织等工业及生活中的洗涤剂; 火剂、发酵粉及医疗上中和胃酸过多。 火剂、发酵粉及医疗上中和胃酸过多。
继续
问题1的实验设计方案 问题 的实验设计方案
方法1 方法
方法2 方法
方法3 方法
返回
问题2的实验设计方案 问题 的实验设计方案
实验步骤及现象: 实验步骤及现象 在广口瓶内加适量蒸馏水 滴酚酞试液,如图 和2滴酚酞试液 如图 装置好 滴酚酞试液 如图2装置好 仪器。 仪器。在广口瓶胶塞的大头 针上扎一块比豆粒略大的金 属钠,立即盖上胶塞 立即盖上胶塞,, 属钠 立即盖上胶塞 ,接着形 成美丽的红色喷泉。 成美丽的红色喷泉。同时可 看到钠与水剧烈反应, 看到钠与水剧烈反应,钠熔 化成小球,在水面上四处游动 在水面上四处游动。 化成小球 在水面上四处游动。 喷泉可维持半分钟。 喷泉可维持半分钟。
