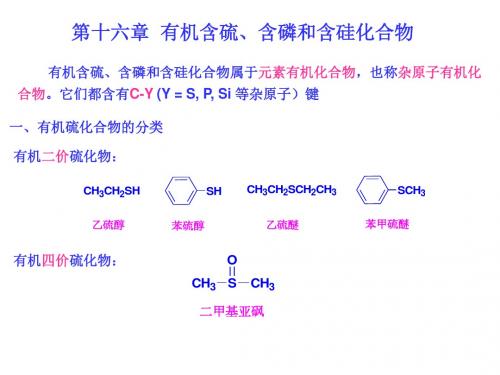
第十六章 有机含硫、含磷和含硅化合物
有机化学-含硫含磷化合物

锍盐与季铵盐类似。可用类似的方法制取锍碱,锍碱 的热分解与季铵碱也类似,遵循Hofmann规则。
C H 3C H C H 2C H 3 Δ C H 2 C H C H 2C H 3+S(C H 3)2 S(C H 3)2 O H -
+
硫醚的氧化反应:生成亚砜和砜。
O
H 2O 2(1:1)
C H 3 I+ C l - C H 3 C l+ I -
溶剂: 反应速度:
CH3OH 1
DMSO 106
H C l+ O SC H 3 H + O SC H 3+ C l-
C H 3
C H 3
二甲亚砜作温和的氧化剂。
O R C H 2 O H + C H 3 S C H 3 C 6 H 1 1 N H 3 P C O 4N C 6 H 1 1R C H O + C H 3 S C H 3
1 Raney镍脱硫反应
Raney镍是用50%镍和50%铝组成的合金,用氢氧化 钠溶液处理,把其中的铝溶去,剩下具有无数微孔的 镍,然后经水洗、醇洗而制成的。
RSR ' H 2 R H+R 'H
R an ey N i
R S RR an H ey 2N i R (C H 2)4R
CH3
CH2 S CH2
异硫脲盐
S O 2 C l
Z n,H 2 S O 4
Δ
S H
(2) 性质和应用 分子量低的硫醇具有极难聞的臭味。
乙硫醇在空气中浓度为10-11g/l即可觉察; 并非所有的含硫化合物都臭。
沸点、水溶性:比相应的醇、酚低得多。
CH3CH2OH CH3CH2SH
【有机化学】含硫、磷和硅的化合物

称为巯基,烃硫基
例:2-巯基丙醇 2-异丙硫基丁烷
练习
p581
二 物理性质
特点 1 硫醇、硫酚有特殊的恶臭味 用途
含九个碳原子以上的硫醇则有令人愉快的气味。
2 沸点:比分子量相近的醇低,比烃高。
醇〉硫醇〉烃 硫醚〉醚
? 3 溶解度: 硫醇在水中溶解度比醇小得多。 乙硫醇:b.p 37℃ 1.5g/100ml
TM
C H3O C 6H4C HO
Ph3+PC-HC N
TM
第三节 有机硅化合物
自习 有机硅试剂 TMS 四甲基硅烷
本章重点
1 有机硫化合物的命名、酸性比较。 如硫醇、硫酚、硫醚、砜、亚砜、磺酸及衍生物
2 硫醇、硫酚、硫醚的氧化、还原、脱硫反应 3 膦、季鏻盐、磷或膦酸及其酯衍生物的命名 4 季鏻盐的合成、反应及维悌希反应(机理) 5 判断锍盐、亚砜、叔膦的手性 6 用维悌希反应合成烯烃
sp3杂化轨道
碳硫双键较弱
硫的3p与碳的2p轨道形成的重叠较少所以∏键较弱
2 分类、命名 {有无对对应应氧氧化化物物的的硫硫化化物物
a.有对应氧化物的硫化物
命名在相应氧化物的类名前加硫字,如硫醇、 硫酚、硫醚
RSH
硫醇
thiols
ArSH
RSR
RSSR
硫酚
硫醚 二硫化物
thiophenols sulfides disulfides
O C H3
2 亚磷酸、亚膦酸 (三价)
OH
HO P OH
OH H P OH
H H P OH
亚磷酸 亚膦酸
次亚膦酸
Arbuzov- Michatlis 反应: 制备有机膦化合物
亚磷酸三酯与卤代烃或其它卤代物反应 在合成上应用广泛
16含磷、硫和硅有机化合物

O
例: Ph3P CHCH2CH3
CH3CCH3
CH3 C CH3 CHCH2CH3
反应的总结果:羰基中的氧被维悌希试剂中负性部分取代。 反应的总结果:羰基中的氧被维悌希试剂中负性部分取代。
Ph3P O C CH3
PPh3 O CH3CH2CH C CH3 CH3
CH3CH2
CH
CH3
Ph3 P CH3CH2CH
一、分类和命名: 分类和命名:
分子中含P-C或P-H键 膦——分子中含 分子中含 或 键 1. 膦、(亚)膦酸衍生物在相应的类名前加上烃基的名称命名。 、(亚 膦酸衍生物在相应的类名前加上烃基的名称命名。 2. 磷(膦)酸酯类化合物的命名,含氧酯基用 烃基表示。 酸酯类化合物的命名,含氧酯基用O-烃基表示 烃基表示。
第十九章
含硫、 含硫、磷和硅的化合物 一. 含硫化合物 二. 含磷化合物
1
第一节 有机硫化合物
有机硫化合物是碳和硫直接相连的化合物, 有机硫化合物是碳和硫直接相连的化合物,它在数量上 仅次于含氮和含氧有机化合物,是生物有机体的重要成分。 仅次于含氮和含氧有机化合物,是生物有机体的重要成分。 硫是继氮磷钾三大元素后农业作物所需的第四大营养素。 硫是继氮磷钾三大元素后农业作物所需的第四大营养素。 目前中国硫肥亏缺约120万吨 年。有些天然矿物可直接用来 目前中国硫肥亏缺约 万吨/年 万吨 杀伤有害生物,如硫磺、硫酸铜等。 杀伤有害生物,如硫磺、硫酸铜等。 酶的本质是蛋白质,蛋白质结构是多肽。 酶的本质是蛋白质,蛋白质结构是多肽。脢分子可能只 含一条多肽,也可能含数条多肽, 含一条多肽,也可能含数条多肽,并以双硫键连接在一起 。 而且,硫是细胞膜的组成元素。例如,胱氨酸、 而且,硫是细胞膜的组成元素。例如,胱氨酸、半胱氨酸存 在于蛋白质中,硫辛酸是一种辅酶, 在于蛋白质中,硫辛酸是一种辅酶,二烯丙基二硫化物存在 于芥子油中等。 于芥子油中等。
含硫、含磷有机化合物

硫醚类化合物具有醚的通性, 如容易水解、氧化等。
硫醚类化合物在许多化学反应 中具有重要的作用,如作为溶 剂、合成其他含硫化合物的原
料等。
硫醚类化合物在自然界中广泛 存在,如存在于生物体内的甲
硫氨酸和半胱氨酸等。
噻吩类
噻吩类化合物是指含有噻吩环的有机 化合物,其中噻吩环是由一个硫原子 和两个碳原子组成的五元环。
磷酸酯合成法是一种常用的合成含磷有机化合物的方法。该方法通常涉及 将磷酸酯与醇或酚反应,生成磷酸酯或磷酸酯的衍生物。
磷酸酯合成法的优点是反应条件温和,操作简单,适用于多种类型的含磷 有机化合物的合成。
然而,该方法也存在一些缺点,如反应过程中可能会产生有毒的副产物, 且产物的纯度较低。
亚磷酸酯合成法
磷酰胺类化合物通常由胺与磷酰氯或 磷酰酸反应生成,具有较高的化学稳 定性。在农药、医药和染料等领域有 广泛应用。
03 含硫、含磷有机化合物的 应用
医药领域
抗生素
含硫、含磷有机化合物是合成一些重要抗生素的 关键中间体,如磺胺类药物和青霉素等。
抗癌药物
含硫、含磷有机化合物在抗癌药物研发中具有重 要作用,如一些烷化剂和抗代谢药物。
硫化物合成法
硫化物合成法是一种常用的合成含硫有机化合 物的方法。该方法通常涉及将硫化物与有机卤 化物反应,生成含硫有机化合物。
硫化物合成法的优点是反应条件温和,操作简 单,适用于多种类型的含硫有机化合物的合成。
然而,该方法也存在一些缺点,如反应过程中 可能会产生有毒的副产物,且产物的纯度较低。
磷酸酯合成法
激素类药物
含硫、含磷有机化合物可用于合成一些激素类药 物,如甲状腺激素和肾上腺皮质激素等。
农药领域
杀虫剂
第十六章 有机含硫、含磷和含硅化合物

第十六章有机含硫、含磷和含硅化合物(nitrogenous compounds、sulfurous compounds and phosphorous compounds)授课对象:应用化学、化学工程与工艺,制药工程、药学教材:普通高等教育“十五”国家级规划教材《有机化学》第四版高鸿宾主编2005年5月一、教学目的与要求1、掌握有机含硫化合物的分类、硫醇、硫酚、硫醚、磺酸的制备和命名,硫醇、硫酚、硫醚、磺酸的化学性质;有机磷化合物的性质—Wittig反应,烷基膦的结构;有机硅化合物的结构,卤硅烷的制备和化学性质。
2、熟悉有机硅化合物在合成上的应用;有机磷农药的毒性;芳磺酰胺在合成磺胺类药物上的应用。
3、了解表面活性剂和离子交换树脂的类型及用途。
二、教学重点1、硫醇、硫酚、磺酸的化学性质;芳磺酰胺在合成磺胺类药物上的应用。
2、有机磷化合物的性质—Wittig反应。
三、教学难点1、磷叶立德(Wittig试剂)与醛、酮反应生成相应烯烃以及含有碳碳双键化合物的反应。
2、烷基膦和有机硅化合物的结构。
3、芳磺酰胺在合成磺胺类药物上的应用。
四、教学方法讲授法。
具体采用如下教学方法,突出重点,突破难点。
1、通过对比前面学习过的醇、酚、醚、羧酸的结构与性质,引出本章的学习重点和难点。
2、采用课堂练习的方法,帮助学生掌握苯磺酰胺、有机磷化合物及有机硅化合物在医药、农药及有机合成上的应用。
五、教具电脑、投影仪、Powerpoint课件、教鞭。
六、教学步骤及时间分配引言:有机含硫、含磷和含硅化合物属于元素有机化合物,也称杂原子有机化合物。
其分子结构中都含有C—Y键。
它们在生命科学和有机合成上有着广泛的用途。
16.1 有机硫化合物一、有机硫化合物的分类和命名(20分钟)有机硫化合物中都含有C-S键。
(一)分类分类:根据硫原子与烃基的连接方式不同,分为硫醇、硫酚、硫醚、磺酸等注意:伯、仲、叔胺与伯、仲、叔醇的区别。
(二)命名1、硫醇(mercaptan)和硫酚(thiophenols)可分别看成是醇和酚分子中的氧原子被硫原子替代后形成的化合物。
有机化学 含硫和含磷有机化合物

PH3
RPH2
R2PH
R3P
合物 [R4P]+I-
O HO P OH
OH
O
O
RO P OH RO P OR
OH
OH
O RO P OR
OR
磷酸 磷酸烷基酯 磷酸二烷基酯 磷酸三烷基酯
23:21
O R P OH
OH
O R PR
OH
O R PR
R
烷基膦酸 二烷基膦酸 氧化三烷基膦
O HO P OH
OH
磷酸
CH3 SH 甲硫醇
SH
C2H5 S S
C2H5
二硫化二乙基(二乙基二硫)
苯硫酚
C2H5 S C2H5
乙硫醚(二乙基硫)
23:21
-SH 巯(qiu)基,或硫氢基
1.2 物理性质
状态: 虽然相对分子质量大于水,但硫化氢 在常温下是气体(原因) 沸点: 硫醇沸点比相应的醇低得多(原因) 溶解度: 在水中的溶解度低 低极硫醇有毒,并有极难闻的臭气
23:21
S与O同族
P与N同族
差别主在在于电负性不同,含硫、磷的有机物与相 应的含氧、氮有机物相比稳定性更差,同时S、P 还可形成高价的有机物。
23:21
一 含硫有机化合物
含氧有机化合物 醇 R-OH 酚 Ar-OH 醚 R-O-R
醛,酮
羧酸
23:21
R CO
R'
O
R C OH
含硫有机化合物 R-SH 硫醇 Ar-SH 硫酚 R-S-R 硫醚
CH2-CH-CH2
23:21
SH SH OH
2.氧化 硫醇易被氧化
(O) RSH
( H)
有机、第十六章 有机含硫、含磷和含硅化合物

运城学院
§16.9.3 卤硅烷的化学性质 一、水解 Si-X键具有较强的极性,很活泼,极易水 解。反应需在中性介质中进行。
在酸或碱的作用下,硅醇脱水反应生成硅醚:
应用化学系
运城学院 二、醇解 卤硅烷与醇作用生成硅氧烷。 三、与金属有机化合物的反应 在Grignard试剂或有机锂试剂作用下,Si-X键断 裂,Si-C键生成。
Si-Si键的键能较C-C键小,Si=C, Si=C双键不 稳定。 常见的有机硅化合物有:有机硅烷、卤硅烷、 硅醇、硅氧烷和硅醚。
应用化学系
运城学院 PhSiH3 苯基硅烷 (CH3)4Si 四甲基硅烷 (CH3)2SiCl2 二甲基二氯硅烷 (CH3)3SiOSi(CH3)3 六甲基二硅氧烷
(CH3)3SiOH C2H5Si(OC2H5)3 三甲基硅醇 乙基三乙氧基硅烷
应用化学系
运城学院
§16.8
16.8.1 16.8.2 16.8.3 16.8.4
有机磷化合物
烷基磷的结构 有机磷化合物作为亲核试剂的反应 磷酸酯 有机磷农药
§16.9
16.9.1 16.9.2 16.9.3 16.9.4
有机硅化合物
有机硅化合物的结构 卤硅烷的制备 卤硅烷的化学性质 有机硅化合物在合成中的应用
三、磺基的反应
应用化学系
运城学院 磺基可被氢原子、羟基、氰基等取代。 1、水解
2、碱熔与其它亲核取代反应
其它亲核试剂有氰基、氨、胺等。
应用化学系
运城学院
§16.5
芳磺酰胺(sulfonamides)
制备:
糖精(saccharin): 磺胺药物(sulfa drugs):
氨基苯磺酰胺 (sulfanilamide)
含硫和含磷有机化合物

R-SH R-S-S-R
KMnO4 强氧化剂
R-SO3H
二.硫醇和硫酚
2.化学性质---氧化
.
硫醇的氧化
2R SH
硫醇
弱氧化剂 [H]
R S S R
二硫化物
强氧化剂
RSO3H
烷基磺酸
强氧化剂
强氧化剂
RSO2H
烷基亚磺酸
弱氧化剂:空气中的氧, I2, H2O2 等 强氧化剂: HNO3,KMnO4 等 例:
醚的氧化
O 硫醚的氧化 HNO3,CrO3 or H2O三.硫醚、亚砜、砜 2 R S R' 室温
. .
第二节 含硫有机化合物
硫醚的氧化
O O 室温 CrO3 or H2O2 发烟 HNO3,KMnO or RCOOOH 4 通式: R S R' R S R' R S R' 室温 高温 亚砜 硫醚 O 4 发烟 HNO3,KMnO or RCOOOH O 砜 O 高温 Hor2 RCOOOH 2O ,KMnO CH3 S CH3 S R' 3SCH3 4 R O 例: 高温 二甲亚砜 O3 H2O2 CH3 S CH3 CH3SCH O O 砜 O2 二甲亚砜 CH浓 HNOCH3 CH3 S CH3 S 3 SCH3 3 O 二甲亚砜 O 浓 HNO3 CH SCH CH S CH
弱氧化剂:空气中的氧, I2, H2O2 等 这种互相转化是生物体内非常重要的生理过程。 强氧化剂: HNO3,KMnO4 等 例: CH CH COOH
2
2CH2 CH COOH SH NH2
半胱氨酸
[O] [H]
NH2 S NH2 S CH2 CH COOH
《有机化学》(第四版)复习提纲

有机化学复习提纲《有机化学》(第四版)第一章绪论1、有机化合物的定义。
2、碳原子的SP、SP2、SP3杂化轨道的杂化原理和共价键的构成方式。
3、诱导效应的概念。
4、酸碱的概念。
第二章饱和烃:烷烃和环烷烃1、烷烃的命名。
脂环烃、桥环烃、螺环烃的命名方法。
2、环烷烃的环结构与稳定性的关系。
3、取代环已烷的稳定构象。
4、烷烃的卤代反应历程(自由基型取代反应历程)。
5、烷烃的卤代反应取向与自由基的稳定性。
6、脂环烃的取代反应。
7、脂环烃的环的大小与开环加成活性关系。
8、取代环丙烷的开环加成规律。
9、环烯烃的π键加成与α-氢的卤代反应区别。
第三章不饱和烃:烯烃和炔烃1、碳-碳双键、碳-碳三键的组成。
2、π键的特性。
3、烯烃、炔烃的命名;烯烃的Z,E-命名法,烯炔的命名。
4、烯烃、炔烃的加氢催化原理及其烯烃、炔烃的加氢反应活性比较。
5、炔烃的部份加氢——注意区分顺位部分加氢和反位部分加氢的条件或试剂。
6、何谓亲电加成?(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高,亲电加成活性越大)7、烯烃、炔烃可以与哪些试剂进行亲电加成,这些加成有哪些应用。
8、烯烃亲电加成反应机理。
9、亲电加成反应规律(MalKovniKov规律)。
10、烯烃、炔烃与HBr的过氧化物效应加成及其规律。
(惟一只有溴化氢才能与烯烃、炔烃存在过氧化物效应,其它卤化氢不存在过氧化物效应。
)11、烯烃亲电加成与炔烃亲电加成活性的比较。
12、不同结构的烯烃亲电加成活性的比较——不饱和碳上电子密度越高的烯烃或越容易生成稳定碳正离子的烯烃,亲电加成反应的活性越大。
13、碳正离子的结构和碳正离子的稳定性之间的关系——正电荷越分散,碳正离子就越稳定。
14、烯烃经硼氢化—氧化水解在合成醇上的应用;炔烃经硼氢化—氧化水解在合成醛或酮上的应用。
15、碳-碳双键的α-碳上有支链的烯烃与卤化氢加成时的重排反应。
(P88)16、烯烃与次卤酸加成及加成规律。
炔烃与水加成及重排产物。
第十六章有机含硫、含磷和含硅有机化合物

第十六章 有机含硫、含磷和含硅化合物有机含硫、含磷和含硅化合物:C Y Y : S ,P ,S i一、有机硫化合物的分类有机二价硫化物:C H 3C H 2S HSHC H 3C H 2S C H 2C H 3S C H 3乙硫醇乙硫醇 苯硫酚苯硫酚苯硫酚 乙硫醚乙硫醚乙硫醚 苯甲硫醚苯甲硫醚有机四价硫化物:C H 3S C H 3O二甲亚砜(DMSO )有机六价硫化物:C H 3C H 2S C H 2C H 3OOS C H 3OOO H S O OC lC H 3二乙砜二乙砜 对甲苯磺酸对甲苯磺酸对甲苯磺酸 甲磺酰氯甲磺酰氯二、硫醇和硫酚硫醇硫酚R S HA r S H丙硫醇 烯丙硫醇硫醇 苯硫酚C H 3C H 2C H 2S H C H 2C H C H 2S HS H1.硫醇和硫酚的命名2. 硫醇和硫酚的制备H 3O +N a O H ,H 2OC O H 2N H 2N+ C H 3C H 2S H90%R X + K O H + H 2SC H 3C H 2O HR S H + K X +H 2OC S H 2N H 2N+C H 3C H 2B rC H 3C H 2O HCS H 2N H 2NC H 2C H 3 B r95%硫脲S-乙基异硫脲盐S O 2C lS HZ n , H 2S O 40℃,91%4. 硫醇和硫酚的化学性质(1) 酸性C H 3C H 2S H 10.6p K aS H O HC H 3C H 2O H 15.9p K a 7.8103. 硫醇和硫酚的物理性质(略)R S H +N a O HN a + H 2OR S 溶于稀NaOH 溶液:与重金属成盐:2C H3C H2S H+H g O(C H3C H2S)2H g+H2O(2) 氧化反应在H2O2, O2, I2,NaOI 作用下:2R S H+I2C2H5O H,H2OR S S R+2H I工业上催化氧化法:2R S H+12O2磺化酞菁钴R S S R+H2O二硫化物在NaHSO3、Zn + HX等作用下还原成硫醇。
高鸿宾《有机化学》(第4版)课后习题-有机含硫、含磷和含硅化合物(圣才出品)

(8)N-(4-氨基苯磺酰基)乙酰胺
2.选择正确的 2-丁醇的对映体,由它通过使用对甲苯磺酸酯的方法制备(R)-2-丁硫 醇,写出反应式。
解:应选择(S)-2-丁醇制备(R)-2-丁硫醇:
3.给出下列反应的产物: (1)苄基溴+硫脲→ (2)(1)的产物
1/4
圣才电子书 十万种考研考证电子书、题库视频学习平台
(3)(2)的产物+H 2O2→ (4)(2)的产物+NaOH→ (5)(4)的产物+苄基溴→ 解:
4.“芥子气”是一种高效的发泡剂,在第一次世界大战中被用于化学武器中。它可由 环氧乙烷经下列步骤合成:
写出各步反应式。 解:
5.半胱氨酸是氨基酸的一种,其构造式如下所示:
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 16 章 有机含硫、含磷和含硅化合物
1.命名下列化合物:
解:(1)2,2,6-三甲基-4-庚硫醇 (2)2-硝基苯硫酚
(3)异丙基环己基硫醚
(4)1,2-二甲硫基苯
(5)4-硝基-3-氯苯磺酸
(6)对硝基苯磺酰氯
(7)6-甲基-2-萘磺酸
半胱亚磺酸 磺基丙氨酸
6.给出下列化合物 A、B、C 的构造式:
解: 7.以 2-甲基环己酮为原料,选择适当的硅试剂和其它试剂制备下列化合物: 解:
3/
圣才电子书 十万种考研考证电子书、题库视频学习平台
4/4
(1)它在生物氧化中生成胱氨酸
,试写出胱氨酸的构造式。
2/4
圣才电子书 十万种考研考证电子书、题库视频学习平台
(2)生物体中通过代谢作用,先将胱氨酸转化成半胱亚磺酸(C3H7NO4S),然后再转 化成磺基丙氨酸(C3H7NO3S)。写出这些化合物的构造式。
第十六章有机含硫含磷和含硅化合物

H
CH2SO3H 苄磺酸
CH2SO3H
16.4.3 磺酸的物理性质 16.4.3 磺酸的化学性质
①酸性: 强酸 ②磺基中的羟基反应
O
H3C
S OH + PCl5
O
自学
H3C
O S Cl O
+ POCl3 + HCl
180oC
2
SO3Na + POCl3
2
SO3Cl + NaCl + Na3PO3
CCl4 + 2ClSO3H 25oC,77%
SO3Cl + H2SO4 + HCl
③磺基反应
水解: 碱熔亲核取代
CH3 浓 H2SO4 回流
CH3 Cl2 Fe
SO3H
SO3Na
NaOH 300℃ 共熔
CH3 Cl H2O, HCl
CH3 Cl
SO3H
ONa
OH
HCl
④芳环上的亲电取代反应
磺酸基是第二类定位基, 致钝基团。
(1)直接法
CH3Cl + Si
Cu(10%) 300oC
(CH3)2SiCl2
+ CH3SiCl3 + CH3SiHCl2 + SiCl4
沸 点 70.2oC
66.1 oC
40.4oC
57.6 oC
(2)有机金属试剂同卤硅烷作用
CH3MgCl + SiCl4
CH3SiCl3 + MgCl2
CH3SiCl3 + CH3MgCl
Back
16.5 芳磺酰胺
芳磺酰胺可看成是芳磺酸分子中的羟基被氨基取代后的化合物, 通常由芳磺酰氯与氨或胺(伯、仲胺)反应得到。
有机含硫、含磷和含硅化合物

CH3CH2OH 15.9
OH 10
溶于稀NaOH溶液:
R S H + N a O HR S N a+H 2 O
与重金属成盐:
2 C H 3 C H 2 S H + H g O ( C H 3 C H 2 S ) 2 H g + H 2 O
(2) 氧化反应
在H2O2, O2, I2,NaOI 作用下:
C l H ~2 1 O 5,0 H ° C C l
C l
SO 3H
SO 3H
(b) 碱熔与其它亲核取代反应
C H 3 S O 3 N a ① ② N H a O 3 O H + , , 3 7 3 2 0 % ° C C H 3 O H
Nu: CN-, NH3, RNH2等 芳磺酸盐
亲核取代反应
磺基的反应
O
Ar S O H
酸性
芳环上亲电 O 取代反应 (1) 酸性 强酸
羟基的反应
SO 3H+ N aO H
SO 3N a+ H 2O
SO 3H+ N aC l
SO 3N a+ H C l
(2) 磺基中羟基的反应
OH 可被 X , N H 2 , O R 取代
ArSO3H 或 ArSO3Na 与P C l5 ,C lS O 3 H ,P O C l3
O R C R+CH2 CH2 H+
SH SH
R S CH2 C
R S CH2
H2/兰尼Ni RCH2R+ NiS + CH3CH3
与羧酸、酰卤或酸酐发生亲核加成–消除
反应,生成硫代S–酸酯:
O
O
16-有机硫、磷和硅的化合物
(b) 与碳碳重建的亲核加成反应
(CH3)3CSH+ CH2 CH C N CH3ONa CH3OH (CH3)3CS CH2 CH C N (CH3)3CS CH2 CH2 C N
(c) 硫醇与碳氧双键的亲核加成反应
O R C R + CH2 SH CH2 H+ SH R R S C S 硫缩酮 H2, Ni RCH2R + NiS + CH3CH3
O O + (C2H5O)2PCH2CO2C6H5 NaH
O CHCO2C2H5 + (C2H5O)2PONa
条件温和,产物以E型烯烃为主,易于分离
3. 磷酸酯
O RO P OH 磷酸单酯 OH RO O P OH O O P OH OH RO O P OH O O P OH 三磷酸单酯 O O P OH OH
乙二硫醇
羰基还原为亚甲基
三、硫醚
硫醚的命名与醚相似,只需在“醚”字之前加一个“硫”字
CH3CH2 S 乙硫醚 CH2CH3 CH3CH2 S 乙环基硫醚 S 二苯硫醚
1. 硫醚的制备
2CH3I + K2S CH3 S CH3 + 2KI
CH2=CHCHCH3 + NaCl SCH3 CH3OH
CH2=CHCHCH3 + CH3SNa Cl
硫醇和硫酚的命名与醇和酚的命名相似,只是在母体名称前加一个“硫”字
CH3CH2CH2SH 丙硫醇 CH2=CHCH2SH 烯丙硫醇 CH2SH 苯甲硫醇 苯硫醇 SH
2. 硫醇和硫酚的制备
H2N H2N C S + CH3CH2 Br C2H5OH H2N H2N H2N H2N 尿素 乙硫醇 C + S CH2CH3Br
有机化学 含硫和含磷有机化合物

苯硫酚
C2H5 S C2H5
乙硫醚(二乙基硫)
23:21
-SH 巯(qiu)基,或硫氢基
1.2 物理性质
状态: 虽然相对分子质量大于水,但硫化氢 在常温下是气体(原因) 沸点: 硫醇沸点比相应的醇低得多(原因) 溶解度: 在水中的溶解度低 低极硫醇有毒,并有极难闻的臭气
23:21
1.3 化学性质
一 含硫有机化合物
含氧有机化合物 醇 R-OH 酚 Ar-OH 醚 R-O-R
醛,酮
羧酸
23:21
R CO
R'
O
R C OH
含硫有机化合物 R-SH 硫醇 Ar-SH 硫酚 R-S-R 硫醚
R C
R'
S
RC
硫酮(醛) S (很少)
硫代羧酸
OH
硫酸、亚硫酸中的羟基被取代后生成如下的有机物
硫酸 磺酸
自然界中的含硫化合物
动物的防身武器:硫醇。植物中洋葱中含有的正 丙硫醇。大蒜素、蒜氨酸
23:21
2 磺酸
O HO S OH
O
O R S OH
O
状态:芳香磺酸都是固体
酸性:和硫酸一样,是强酸,有吸湿性
溶解性:易溶于水,不溶于一般有机溶剂
23:21
化学性质
1 磺酸基中的羟基的取代反应
H3C
+ SO3H
3511命名硫醇硫酚硫醚的命名与相应的含氧化合物相同只是在母体前加一个硫字ch苯硫酚二硫化二乙基二乙基二硫sh巯qiu基或硫氢基硫醇硫酚硫醚12
23:21
S与O同族
P与N同族
差别主在在于电负性不同,含硫、磷的有机物与相 应的含氧、氮有机物相比稳定性更差,同时S、P 还可形成高价的有机物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3
4–甲基 甲基–1,3–苯二磺酸 甲基 苯二磺酸 (4-methyl-1,3-disulfonic acid)
CH3
16.4.2 磺酸的制备 (1) 直接磺化法
CH3
SO3 △
CH3
(97%)
SO3H + CH3
(3%)
(2) 间接磺化法 含有活泼卤原子的有机卤化物 亚硫酸盐: 亚硫酸盐:Na2SO3,K2SO3,NaHSO3等 亲核取代反应 磺酸盐 酸化后 磺酸
CH3 CH3 S + CH3 I
THF
锍盐
S CH3I
CH3 CH3
锍盐可与Nu:进一步发生亲核取代反应: 进一步发生亲核取代反应: 锍盐可与 进一步发生亲核取代反应
CH3CH2CH2 NH2 + CH3 S(CH3)2 CH3CH2CH2 NH2 + CH3SCH3
16.4 磺酸 磺酸(sulfonic acids)
n–C4H9 C17H35COONa NaO3S C4H9–n C12H25OSO3Na
羧酸盐
磺酸盐(“拉开粉” 磺酸盐 拉开粉”) 拉开粉
(RO)PO3Na2 (RO)2PO2Na
硫酸酯盐
磷酸酯盐
(2) 阳离子表面活性剂 起表面活性作用的是阳离子 铵盐: 铵盐: [C18H37NH3]+Cl
十八胺盐酸盐
Cl NO2 NO2
Na2SO3
SO3H
SO3Na NO2 NO2
H3O
SO3H NO2 NO2
(98%)
16.4.3 磺酸的物理性质 16.4.4 磺酸的化学性质 反应部位: 反应部位: 磺基的反应 芳环上亲电 取代反应 (1) 酸性 强酸
SO3H + NaCl
酸性
O Ar S O O H
羟基的反应
R'SH RX
CH2
CH3SNa CHCHCH3 CH3OH 62% Cl
CH2
CHCHCH3 + NaCl SCH3
16.3.2 硫醚的性质 (1) 氧化反应 H2O2, NaIO4 亚砜
CH3 S CH3
H2O2
砜
O
发烟 HNO3
O CH3 S CH3
CH3
S O
CH3
(2) 锍盐的生成 RX 亲核取代反应
制备: 制备:
SO2Cl SO2Cl
NH3 H2NR
SO2NH2 SO2NHR
O
糖精(saccharin): : 糖精
S O
NH O
磺胺药物(sulfa drugs): 新诺明(SMZ): 磺胺药物
H2N SO2NH2
氨基苯磺酰胺
(sulfanilamide)
H2N
SO2NH N O
CH3
3–磺胺 –甲基异 唑 磺胺–5 甲基异 磺胺
(3) 磺基的反应 CN 等取代 SO3H 可被 H, OH, (a) 水解 酸催化 芳磺酸与水共热 脱去磺基 芳烃
CH3
H2SO4
△
CH3
Cl2
CH3
CH3
H2O,H
SO3H
(b) 碱熔与其它亲核取代反应 Na盐或 盐 NaOH 熔融 酚盐 酸化 酚 盐或K盐 盐或
烯丙硫醇 烯丙硫醇 (1-propene1-thiol)
苯硫酚
(thiophenols)
16.2.2 硫醇和硫酚的制备 卤代烷 硫脲 硫醇
H2N H2N C S + CH3CH2
① NaOH,H2O ② H3O+ 90%
CH3CH2OH Br 95%
H2N H2N
C
S CH2CH3 Br
H2N H2N
C
O + CH3CH2SH
卤代烷 硫氢化钾 硫醇
CH3CH2OH R X + KOH + H2S △
R SH + KX +H2O
Zn 还原 磺酰氯 硫酚
Zn, H2SO4 SO2Cl 0℃,91% ℃
SH
16.2.4 硫醇和硫酚的化学性质 pKa (1) 酸性
CH3CH2SH CH3CH2OH 10.6 15.9 SH OH
CH3
① NaOH,330 °C SO3Na ② H3O+, 72%
CH3
OH
Nu: CN-, NH3, RNH2等 芳磺酸盐 -
亲核取代反应
SO3Na
NaCN ~300 °C
CN
16.5 芳磺酰胺 芳磺酰胺(sulfonamides)
芳磺酰胺: 芳磺酰胺:
O 或 S NH2(或NHR,NR2) O
[RCOOCH2CH2NH(CH2CH2OH)2] HCOO
脂肪酸二羟乙氨基乙酯甲酸盐 氯化三甲基十二烷基铵
[C12H25N(CH3)3]+Cl 季铵盐: 季铵盐:
(3) 两性表面活性剂 由阴、 由阴、阳两种离子组成
C12H25N(CH3)2CH2COO Na
N C
N
CH2CH2OH CH2COO Na
S CH3CH2 S
乙硫醚
(diethyl sulfide)
二苯硫醚
(diphenyl sulfide)
乙环己硫醚 混硫醚
单硫醚
16.3.1 硫醚的制备 单硫醚: 单硫醚:K2S或Na2S 或
2CH3I + K2S
RX
CH3 S CH3 + 2KI
混硫醚: 混硫醚:与Williamson 合成法相似
与羧酸、酰卤或酸酐发生亲核加成 消除 与羧酸、酰卤或酸酐发生亲核加成–消除 反应,生成硫代S–酸酯 酸酯: 反应,生成硫代 酸酯
O CH3CH2SH + CH3C Cl O CH3C SCH2CH3 + HCl
16.3 硫醚
硫醚(sulfides): 硫醚
CH3CH2 S CH2CH3
R S
R(R')
(CH3)3SiCH2CH2COOH
C C C
3–三甲基硅丙酸 三甲基硅丙酸
N N
n
H2O CH3CH2S Na + (CH3)2CHCH2 Br 95%
(CH3)2CHCH2SCH2CH3 + NaBr
S Na + CH3 I
(b) 与碳碳重键的亲核加成反应 在碱的作用下 吸电子基团的碳碳双键 亲核加成反应
(CH3)3CSH + CH2 CH C
CH3OH 95%
96%
SCH3 + Na I
16.5 芳磺酰胺
16.6 烷基苯磺酸钠和表面活性剂
16.6.1 烷基苯磺酸钠 16.6.2 表面活性剂 (1) 阴离子表面活性剂 (2) 阳离子表面活性剂 (3) 两性表面活性剂 (4) 非离子表面活性剂 (5) 特殊类型的表面活性剂 16.7 离子交换树脂 16.7.1 阳离子交换树脂 16.7.2 阴离子交换树脂
C11H23
甜菜碱型
咪唑啉型
(4) 非离子表面活性剂 在水中不解离成离子 能与水形成氢键
C12H25O CH2CH2O n H
C8H17 O CH2CH2O n H
十二烷基聚氧乙烯醚 (平平加 平平加) 平平加
n = 2~20
辛基酚聚氧乙烯醚 (OP)
n = 2~20
聚氧乙烯醚型 (5) 特殊类型的表面活性剂
SO3H + NaOH
SO3Na + H2O SO3Na + HCl
(2) 磺基中羟基的反应 OR 取代 OH 可被 X, NH 2, ArSO3H 或 ArSO3Na 与 PCl5, ClSO3H, POCl3 作用, 作用,生成ArSO2Cl:
O O O CH3 S OH + PCl5 O CH3 S Cl + POCl3 + HCl
亲油的基团:烃基 亲油的基团:烃基R C8~C18, R 亲水的基团: 亲水的基团: 阴离子: 阴离子: COONa, SO3Na, OSO3Na, OPO3Na2 等 阳离子: 阳离子: N(CH3)3 非离子基团: 非离子基团: O , OH, CONH2 等 (1) 阴离子表面活性剂 起表面活性作用的是阴离子
N
CH3ONa
(CH3)3CS
CH2 CH C
N
(CH3)3CS
CH2 CH2 C N
(c) 硫醇与碳氧双键的亲核加成反应 醛和酮 加成反应 硫缩醛或硫缩酮 催化氢化 脱硫
O R C CH2 CH2 H+ R+ SH SH S CH2 R C R S CH2
H2 / 兰尼Ni
RCH2R + NiS + CH3CH3
磺胺药物的制备: 磺胺药物的制备:
NH2
(CH3CO)2O -CH3COOH
NHCOCH3
2ClSO3H 80 ° C
NHCOCH3
SO2Cl
NHCOCH3
RNH2 ①稀 HCl / 加热 ②NaOH
NH2
SO2NHR
SO2NHR
•乙酰基保护苯胺中的氨基 乙酰基保护苯胺中的氨基 •芳环上的亲电取代反应 芳环上的亲电取代反应 •与胺作用 与胺作用 • 脱保护基
二乙砜 对甲苯磺酸 甲磺酰氯 16.2 硫醇和硫酚 硫醇和硫酚(thiols and thiophenols) 硫醇: 硫醇: R SH 巯基 硫酚: 硫酚:Ar SH 16.2.1 硫醇和硫酚的命名 命名: 命名:“硫” + 母体
CH3CH2CH2SH CH2 CHCH2SH
SH
丙硫醇
(1–propane thiol)
有机含硫、 第十六章 有机含硫、含磷和 含硅化合物
16.1 有机硫化合物的分类 16.2 硫醇和硫酚 16.2.1 硫醇和硫酚的命名 16.2.2 硫醇和硫酚的制备 16.2.3 硫醇和硫酚的物理性质 16.2.4 硫醇和硫酚的化学性质 (1) 酸性 (2) 氧化反应 (3) 亲核反应 16.3 硫醚 16.3.1 硫醚的制备
