第十六章,有机化学
第十六章 杂环化合物

双烯合成。
O
OO
=
=
O+
O
△
O 90%
=
=
O 顺丁烯二酸酐
O
吡咯也可以与苯炔、丁炔二酸发生类似的反应
N-H
△
N-H +
C-COOH N-H +
△
C-COOH
N-H -COOH -COOH
噻吩芳香性强不发生反应
3. 吡咯的酸碱性
吡咯表面上 是个仲胺,但实 际上吡咯是一个 很弱的碱,碱性 比苯胺弱得多, 基本可以认为其 无碱性
S
+ (CH3CO)2O
H2PO4 或SnCl4
S
-COCH3 70%
2-乙酰基噻吩
呋喃、噻吩、吡咯进行烷基化反应很难得到一烷基取 代物。
呋喃、噻吩、吡咯亲电取代以α-位为主
2. 加成反应
呋喃、噻吩、吡咯分子中都有一个顺丁二烯型结构, 因此它们又具有不饱和性质:
稳定性增加
共振能
S
N
O
(KJ / mol)152 125.5 90.4 71.1 12.6
① 碱性和亲核性 碱性:叔胺 >> 吡啶 > 吡咯
叔胺
N
pKb: ~ 4
8.8
N
NH2
H
9.37
~ 14
碱性增强
+ HCl N
· Cl -
N+ H 吡啶盐酸盐
吡啶氮原子还可以作为亲核试剂与R-X、Br2等亲电 试剂反应形成吡啶盐
+ Br2 N
· Br N+ Br
② 亲电取代反应
亲电取代反应似硝基苯。
常见芳香性六元杂环化合物(单环、稠环)
(优选)基础有机化学第十六章脂肪胺与芳香胺

16.5 化学性质III——与亚硝酸反应
1.3级胺与HNO2反应
R3N + HNO2 R3NH NO2
NaNO2
(CH3)2N
HCl反应
CH3NH
NaNO2 CH3-N
HCl
NO
SnCl2 CH3NH HCl
3.1级胺与HNO2反应——生成重氮盐
RNH2
NaNO2 HCl
16.3 化学性质I——烷(酰)基化
NH3 + CH3Br
CH3NH2 CH3Br (CH3)2NH
CH3Br (CH3)3N CH3Br (CH3)4NBr
NH2 CH3I
NHCH3 CH3I
N(CH3)2
工业生产 N,N-二甲基苯胺
O
NH2
NHCCH3
NH2 CH3OH 高温高压 H2SO4
O
CH3
H
D
N
+ H2O
反式共平面
D
ph
的Hofmann
ph
CH3
消除
D (CH3)3N
ph 稳定构像上
OH 的反式消除 H CH3
ph
Hofmann彻底甲基化鉴别结构
N
N
1. CH3I 2. Ag2O
OH N
OH N
N
N
1. CH3I 2. Ag2O
OH N
OH N
1. O3 2. Zn
2 HCHO
16.4 化学性质II——氧化反应
CH3COOOH
CH3NH2
CH3NO
CH3
CH3
NH2 CH3COOOH CH3
NH2 MnO2 O
O
NH2 CF3COOOH CH3
第十六章-胺及其他含氮化合物

• 胺溶于水,可发生离解反应:
R-NH2 + H2O
RNH3+ + OH-
• 胺的碱强度也常用它的共轭酸RNH3+的离解常数Ka 或Kb表示:
R-NH3+ + H2O
RNH2 + H3O+
胺的Kb与其共轭酸的Ka有下列关系:
• 如一个胺的Kb值越大,或pKb越小,则此胺的碱性越强;如一
个胺的共轭酸的Ka值越大,或pKa越小,则此胺的碱性越弱。
• 工业上苯胺的甲基化反应:
过量
N-甲基苯胺 N,N-二甲基苯胺
(三)霍夫曼消除—— 季铵盐和季铵碱 (1)季铵盐的生成——叔胺和卤烷作用生成季铵盐:
• 季铵盐在加热时分解,生成叔胺和卤烷: • 具有长链的季铵盐可作为阳离子型表面活性剂。
(2)季铵碱的生成——季铵盐与强碱作用时,不能 使胺游离出来,而得到含有季铵碱的平衡混合物:
补充:取代芳胺碱性的强弱,取决于取代基的性质
N H2
(1)若取代基是供电子基团—碱性略强,如:
如发生在这
C H3
也一样
N H2
(2)若取代基是吸电子基团—碱性降低,如:
例如:比较下列化合物碱性大小
供电子基团
N H-CH3
N H2
>
>
N O2
吸电子基团
N H-CO C H3
O
>
NH
O
(二)胺的烷基化 • 可与卤烃或醇烷基化剂作用:
混合物,分离困难,在应用上有一定限制。
(2)芳香族卤化物和氨作用——困难,注意条件
(3)醇和氨反应——也能生成伯胺、仲胺和叔胺的混 合物:
例如: 甲胺、二甲胺和三甲胺的工业制备: • 得到的是混合物,以二甲胺、三甲胺为主。
有机化学第十六章杂环

按照英文字母顺序排列取代基,并按照取代基的数目和位置进行编 号。
编号顺序
按照取代基的编号顺序进行编号,取代基的编号越小,优先级越高。
分类方法
1
根据杂环母核的环状结构分类:分为单环、双环 和多环杂环化合物。
2
根据杂环母核中杂原子的种类分类:分为含氧、 含氮、含硫和含磷等杂环化合物。
3
根据杂环母核中碳原子和杂原子的成键情况分类: 分为碳-碳键和碳-杂原子键杂环化合物。
杂环化合物的特点
01
02
03
稳定性
杂环化合物通常比相应的 碳环化合物更加稳定,因 为杂原子可以提供额外的 电子,增加环的稳定性。
芳香性
有些杂环化合物具有芳香 性,其特点是具有特殊的 电子分布和化学性质。
反应性
杂环化合物的反应性取决 于其结构和取代基的性质, 有些杂环化合物容易进行 亲电或亲核反应。
THANKS
感谢观看
随着科学技术的发展,杂环化合物在 未来的应用将更加广泛和深入。
同时,随着人们对环境保护和可持续 发展的重视,开发环境友好型的杂环 化合物合成方法和技术也将成为未来 的重要研究方向。
未来发展的方向包括开发新的杂环化 合物合成方法、研究杂环化合物的生 物活性与作用机制、探索杂环化合物 在其他领域的应用等。
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。
详细描述
杂环化合物的取代反应机理通常涉及亲核和亲电取代反应。在亲核取代反应中,亲核试剂进攻杂环上 的碳原子,形成负离子中间体;在亲电取代反应中,亲电试剂进攻杂环上的碳原子,形成正离子中间 体。这些中间体可以进一步发生重排或水解,最终形成取代产物。
05
在材料科学中的应用
杂环化合物在材料科学中也有广泛的应用,如高分子材料、功能材料和复合材料等。
有机化学16类脂化合物

【基本要求】
1.掌握油脂的性质;掌握萜类的结构。 2.了解表面活性剂的概念及用途; 3.了解重要的甾体化合物。
有机化学——类脂化合物
类脂化合物(或称脂类) 包括一些由生物取得的,从化学结构上看
毫不相干的物质,如油脂,蜡,磷脂,萜,甾体化合 物等.只是由于这些物质都具有与油脂类似的 物态及物理性质,例如不溶于水,易溶于非极性 或弱极性有机溶剂.所以称为类脂化合物.
有机化学——类脂化合物
3、干性
某些油在空气中放置,能生成一层干燥而有韧性的
薄膜,这种现象叫做干化,具有这种性质的油叫干性油。
不具干性的油,叫做非干性油,有一定程度的干性,
但干性不强,介于干性油与非干性油之间,这些油叫做半
干性油。
4、酸败
油脂在空气中放置过久,便会产生难闻的气味,
这种变化叫做酸败,酸败是由空气中氧、水分或霉菌的
9,12,15-十八碳三烯酸(Δ9,12,15-十八碳三烯酸)
2. 甘油脂的命名
O
H2C OC(CH 2)16CH 3 O
CH OC(CH 2)16CH 3 O
H2C OC(CH) 16CH 3
三硬脂酸甘油酯(或甘油三硬脂酸酯)
O
α H2C OC(CH 2)16CH3
O
β CH OC(CH 2)14CH3
有机化学——类脂化合物
三、化学性质 1.皂化(水解)
将油脂用氢氧化钠(或氢氧化钾)水解,就得到脂
肪酸的钠盐(或钾盐)和甘油。高级脂肪酸的钠盐就是
肥皂。
H2C OOCR CH OOCR'
H2C OOCR''
+ H2O
280℃ 4~5MPa
第16章 有机含硫、含磷和含硅化合物-高鸿宾有机化学第四版

(2) 醇解 (3) 与金属有机化合物的反应 (4) 还原 16.9.4 有机硅化合物在合成中的应用 (1) (CH3)3Si基团作为辅助基团 (2) (CH3)3Si基团作为保护基团
有机含硫、含磷和含硅化合物:
C Y Y: S,P,Si
16.1 有机硫化合物的分类 有机二价硫化物:
SH CH3CH2SH CH3CH2SCH2CH3 SCH3
(diphenyl sulfide)
乙环己硫醚 混硫醚
单硫醚
16.3.1 硫醚的制备 单硫醚:K2S或Na2S
2CH3I + K2S
RX
CH3 S CH3 + 2KI
混硫醚:与Williamson 合成法相似
R'SH RX
CH2
CH3SNa CHCHCH3 CH3OH 62% Cl
CH2
CHCHCH3 + NaCl SCH3
CH CH2 + CH CH2 CH CH2
O O PhCOOCPh
CH CH2 CH CH2 CH CH2
CH CH2 CH CH2
16.7.1 阳离子交换树脂 解离的基团为磺基,能够交换阳离子
2 R SO3H + Ca
R
2+ 交换
再生
R SO3 2Ca + 2H+
离子交换树脂的骨架
16.7.2 阴离子交换树脂
芳磺酰胺:
O O S NH2(或NHR,NR2)
制备:
SO2Cl SO2Cl
NH3 H2NR
SO2NH2 SO2NHR
O
糖精(saccharin):
S O
NH O
磺胺药物(sulfa drugs): 新诺明(SMZ):
有机化学-第十六章 脂类

由甘油和磷酸生成甘油磷酸。
CH2OH HO H CH2OPO3H2
L-甘油磷酸
12
甘油磷酸与两分子脂肪酸生成磷脂酸。
CH2OCOR R'COO H CH2OPO3H2
磷脂酸
磷脂酸与另一种醇生成磷酸二酯,磷酸二酯叫磷脂。
CH2OCOR R'COO H O CH2O P OCH2CH2N+(CH3)3 O
动物脂肪中主要含:软脂酸、油酸和较多的硬脂酸。 细菌体内常含有带支链和丙烷环的酸。
7
工业上产量最大的8种脂肪酸为:油酸、亚油酸、软脂酸、亚 麻酸、硬脂酸、月桂酸、芥酸和肉豆蔻酸。
前列腺素(prostaglandins)是少量存于动物组织中的C(20) 羧酸,它们都含有一个五元环,在C(11)和 C(5)上含有 羟基,E系列的前列腺素在C(9)上有一个酮基,而在F系 列中C(9)上为羟基。 例:
5
CH3 COOH
(E)– 9 – 十八碳烯酸
反油酸
OH CH3 O
(Z)– 13 – 二十二碳烯酸 芥酸
6
多烯酸:含2-6个顺式烯键的羧酸,每两个双键之间都隔有 一个饱和碳原子。
COOH CH3
(Z,Z)-9,12-十八碳二烯酸 亚油酸 天然油脂中含有多种脂肪酸,但占主要地位的却只有几种。
高等植物主要含:软脂酸、油酸、亚油酸。
头 尾 头 尾
15
含有3个异戊二烯单位的称倍半萜。
含有4个异戊二烯单位的称二萜。 含有6个异戊二烯单位的称三萜。 萜由分为开链的和环状的两种。 例:
CH3 C H2C CH H2C C C H3C CH2 CH2
CH2OH
单环萜 宁烯
单环双萜醇
维生素A1
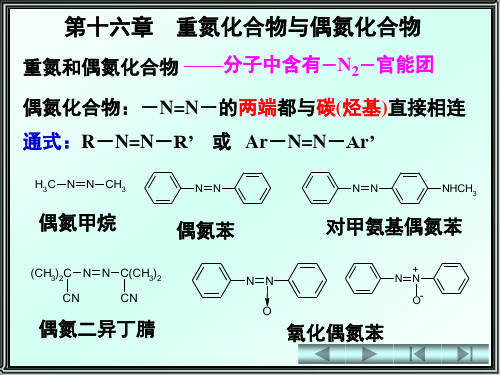
有机化学重氮和偶氮化合物

O
浅黄色
O
红色
24
2. 偶氮染料和指示剂
① 对位红
② 甲基橙
OH
+ ClN2
-
对位红
+
NO 2
N N OH
NMe 2
NO 2
H2N
SO3H
HNO 2 HCl
+N
2
SO3H
Me2N
N=N
SO3H
NaOH
Me2N
N=N 甲基橙(黄色)
SO3Na
甲基橙在pH4.4以上显黄色,在pH3.1以下显红色。 ③ 刚果红:可染色,但不是很好的染料。是常用的批 示剂,变色范围pH为3~5。 ④ 酚酞:常用的批示剂。变色范围pH为8.2~10之 间。
N N
+
Cl -
Ar N N
+
或 Ar-N=N
+
二、芳香族重氮盐的性质及在合成上的应用 重氮盐是一个非常活泼的化合物,可 发生多种反应,生成多种化合物,在有机 合成上非常有用。归纳起来,主要反应为 两类:
N2 Cl 去氮反应 (取代反应) 保留氮的反应 还原反应 偶联反应
1. 取代反应 (1)被羟基取代(水解反应) 当重氮盐和酸液共热时发生水解生成 酚并放出氮气。
HC=HC
HC=HC
11
黑紫色
② 在有机物共轭体系中引入助色基或生色基一般伴随着颜 色的加深
23
生色基: 可以造成有机物分子在紫外及可见光区域内 (200~700nm)吸收峰的基团。
常见的生色基有:—NO2 ,—NO, >C=O,>C=NH等
ON
无色 黄绿色
特点:生色基引起共轭体系中Π 电子流动性增加,结果使分子激 发能降低,化合物吸收向长波方 向移动,导致颜色加深。
《有机化学》(胡宏纹版)第十六章 脂肪胺与芳香胺0

机理
O O O -ClCH2-N=N R-C- CH2-N=N R-C- CH2-N=N R-C-Cl Cl
CH2-N=N
O R-C- CH-N=N
同步完成
C=C的形成 N2的脱出 R-的迁移
H 2O
O
O=C=C-R 烯酮
Ag2O RCH2-C-OH O ROH Ag2O RCH2-C-OR
2. 叠氮化钠(NaN3)(自学)
CH3NH2
O CH3C-NHCH3
Hinsberg反应——鉴别胺的级别
10胺与对-甲基苯磺酰氯反应 CH3 SO2Cl RNH2
CH3 SO2NHR
溶于NaOH 不溶于HCl
由于磺酸基吸电子使 NHR中的H具有酸性
20胺与对-甲基苯磺酰氯反应 CH3 SO2Cl R2NH
CH3 SO2NR2
不溶于NaOH 不溶于HCl
16.8 胺的合成
1. 由卤代烃制备
2. 由羧酸及衍生物制备
Gabriel法
O O NH3 O 邻苯二甲酸酐 O NH K2CO3 O NK O 亲核取代 RX -KX O 邻苯二甲酰亚胺 O
+ NR H3 O RNH 2
O
Hofmann降解
O R-C-NH2 Br2 NaOH
RNH2
3. 催化加氢
N(CH3)2 O (CH3)2N C H POCl3 O H-C N(CH3)2
芳香环直接醛基化反应:苯的Gattermann-Kohn反应; 酚的Reimer-Tiemann反应;
叔芳胺的Vilsmeier反应。
16.10 芳香胺的化学性质II ——重氮盐的反应
1.取代反应
a. Sandmeyer反应
有机、第十六章 有机含硫、含磷和含硅化合物

运城学院
§16.9.3 卤硅烷的化学性质 一、水解 Si-X键具有较强的极性,很活泼,极易水 解。反应需在中性介质中进行。
在酸或碱的作用下,硅醇脱水反应生成硅醚:
应用化学系
运城学院 二、醇解 卤硅烷与醇作用生成硅氧烷。 三、与金属有机化合物的反应 在Grignard试剂或有机锂试剂作用下,Si-X键断 裂,Si-C键生成。
Si-Si键的键能较C-C键小,Si=C, Si=C双键不 稳定。 常见的有机硅化合物有:有机硅烷、卤硅烷、 硅醇、硅氧烷和硅醚。
应用化学系
运城学院 PhSiH3 苯基硅烷 (CH3)4Si 四甲基硅烷 (CH3)2SiCl2 二甲基二氯硅烷 (CH3)3SiOSi(CH3)3 六甲基二硅氧烷
(CH3)3SiOH C2H5Si(OC2H5)3 三甲基硅醇 乙基三乙氧基硅烷
应用化学系
运城学院
§16.8
16.8.1 16.8.2 16.8.3 16.8.4
有机磷化合物
烷基磷的结构 有机磷化合物作为亲核试剂的反应 磷酸酯 有机磷农药
§16.9
16.9.1 16.9.2 16.9.3 16.9.4
有机硅化合物
有机硅化合物的结构 卤硅烷的制备 卤硅烷的化学性质 有机硅化合物在合成中的应用
三、磺基的反应
应用化学系
运城学院 磺基可被氢原子、羟基、氰基等取代。 1、水解
2、碱熔与其它亲核取代反应
其它亲核试剂有氰基、氨、胺等。
应用化学系
运城学院
§16.5
芳磺酰胺(sulfonamides)
制备:
糖精(saccharin): 磺胺药物(sulfa drugs):
氨基苯磺酰胺 (sulfanilamide)
《有机化学》徐寿昌-第二版-第16章-重氮化合物和偶氮化合物全文

16.1 重氮化反应—芳香族重氮盐的制备 ◆伯芳胺在低温及强酸(主要是盐酸或硫酸)水溶液
中,与亚硝酸作用生成重氮盐的反应,称为重氮化反应:
NH2 + HONO + HCl <5℃
N2Cl + 2 H2O
(NaNO2+HCl)
氯化重氮苯(重氮苯盐酸盐)
◆反应条件:
料的50%. 偶氮染料种类多,色调鲜艳,广泛应用于 棉、毛、丝、麻以及塑料、印刷、皮革、橡胶、食 品等产品的染色.
◆苏丹红:
苏丹红是一类人工合成的亲脂性偶氮染料,有致癌性和遗传 毒性,在食品中非天然存在,因此在食品中应禁用。
其品种主要包括苏丹红1号、2号、3号和4号,主要用于溶剂、 油、蜡、汽油增色以及鞋和地板等的增光。
◆三线态碳烯是个双游离基, 两个未成键电子分别在 两个原子轨道上,它的加成分两步进行:
由于中间体双游离基的碳碳单键能够旋转,所以最后生 成物有顺、反两种异构体:
例如:
◆ 碳烯与炔烃、环烯烃或苯的加成反应:
例1:
H
例2:
例3:
(2)插入反应
◆单线态碳烯还可插入C—H键之间,发生插入反应:
例如:丙烷与重氮甲烷在光照下作用:
◆重氮盐与伯胺或仲胺发生偶合反应,可以发生苯环上 的氢取代,也可以发生氨基上的氢取代:
重排
对氨基偶氮苯
◆若对位已有取代基,则重排生成邻氨基偶氮苯.
CH3 CH3
NH2
◆若重氮盐与间甲苯胺偶合,则主要发生苯环上的氢被 取代(因为甲基增加苯环的活泼性);重氮盐与间苯二胺 偶合也类似:
偶合发生在活 泼基团的对位
①低温(<5℃):重氮盐高温分解.
有机化学---第16章 重氮和偶氮化合物
②
H3 C
——Schiemann(希曼)反应
2、保留氮的反应
(1) 还原反应
+ Cl N2
SnCl2 + HCl
NHNH2 HCl
.
OH-
NHNH2
苯肼盐酸盐
+ Cl N2
苯 肼
HCl , H2O
100℃
Na2SO3
N N SO3Na H H
NHNH2 HCl
.
OH-
NHNH2
+ Cl N2
Zn + HCl
+ -H
.. ..
N N
G
由于重氮正离子中氮原子上的正电荷可以离域到 苯环上*,因此它是一个很弱的亲电试剂,只能与高度
活化的苯环才能发生偶合反应。
规 律:
对重氮盐而言,当芳环上连有-I、-C基团(如— NO2)时,将使其亲电能力↑,加速反应的进行;反之,
将不利于反应的进行。
+ N N:
δ+
+ N N:
N
N
OH
对位 偶合
+
OH
OH
NaOH (pH=8~10) 0℃
N
N
CH3
邻位 偶合
CH3
5-甲基-2-羟基偶氮苯
(ⅱ) 与芳胺的偶合 a: 叔芳胺 与酚相似,优先在对位偶合; 若对位已占,则在邻位偶合。
+ N N: N(CH3)2
+
CH3 COONa (pH=5~7) 0~5℃
N
N
N(CH3)2
对-(N,N-二甲氨基)偶氮苯 4-(N,N-二甲氨基)偶氮苯
b: 伯芳胺和仲芳胺
由于N上还保留着活泼H原子,因此偶合反应首先
、有机化学:杂环化合物(H)

SO3H 2-吡咯磺酸
N H
SO3H 2-呋喃磺酸
O
H2SO4
H2O
r.t S
SO3H S
S
2-噻吩磺酸:易 溶于水,该性质 可用来鉴别苯与
噻吩。
该反应常用来除去 粗苯中的噻吩,也可用 来提纯噻吩。
付-克反应
Ac2O
COCH3
N 150~200C N
H
H
2-乙酰基吡咯
Ac2O, BF3
COCH3
粱杆、棉子壳等为原料,用稀酸加热蒸煮制取。
玉米芯等 3~5%H2SO4 HOCH CHOH 3~5%H2SO4
农副产品
CH2 CHCHO
CHO + 3H2O O
HO OH
戊醛糖
糠醛
1.2 化学性质
氧化还原反应
CHO O
H2, CuO-Cr2O3 T.P
H2, RaneyNi T.P
CH2OH O
吡咯碘化镁
N-甲基吡咯
四、重要的五元杂环化合物的衍生物
1、糠醛(α- 呋喃甲醛) 糖醛最初是由米糠制得,故而得名之。它为无
色透明具有苦杏仁气味的油状液体,b.p162 ℃,略 溶于水,能和乙醇、乙醚等有机溶剂混溶。在空气 中,糠醛易被氧化而变色(黄色~棕褐色)。
其鉴别方法:
糠醛
苯胺 醋酸
呈鲜红色
1.1 制备 由农副产品如甘蔗渣、玉米芯、花生壳、高
NO2 +
N H
N H
2-硝基吡咯 3-硝基吡咯
(51%)
(13%)
CH3CO2NO2
O
Ac2O, -5~30C
O NO2 2-硝基呋喃(35%)
CH3CO2NO2
有机化学-重氮化合物

重氮盐的结构:
NN
NN
(1)
(2)
16.2 重氮盐在合成上的应用
(1)重氮盐的水解 (2)桑德迈耳反应和加特曼反应 (3)希曼反应 (4)重氮盐的还原 (5)偶合反应
N2 Cl
去氮反应 (取代反应) 保留氮的反应 还原反应
偶联反应
16.2.1 放出氮的反应
为强的制钝基团,间位定位。
CH3
相同点:反应一般对位发生;若对位占据,则邻位发生。 不同点:与酚偶联pH = 8-10,与芳胺偶联pH = 5-7
(3) 与伯(芳)胺、仲(芳)胺偶联
苯胺与重氮盐发生偶联反应先生成苯重氮氨基苯,如在 盐酸或苯胺盐酸盐溶液中加热30~400C则发生重排,生 成4-氨基偶氮苯:
Cu + HBr or Cu + HCl 加特曼反应
ArBr or ArCl
① HBF4 ② △ 希曼反应
KI
ArF ArI 引入I的很好方法
由苯制备间二溴苯和间氯溴苯。
4、被CN取代制苯腈,水解生成羧基。
+
Ar-N
N Cl -
KCN + CuCN (中性条件) 推广的桑德迈耳反应
Cu + KCN 推广的加特曼反应
NHOCCH3
NO2 NH2
CH3 NO2
3、被卤原子取代制卤苯:碘苯、氟苯必须用此方法, 特殊氯苯、溴苯必须用此方法。
若催化剂改为铜粉,反应也可以进行, 但产率低,称伽特曼反应。
桑德迈尔 反应
希曼反应(Schiemann)
定义:芳香重氮盐和冷的氟硼酸反应,生成溶解度较小, 稳定性较高的氟硼酸盐,经过滤、干燥,然后加 热分解产生氟苯。(1927年发现)
第16章 不饱和羧酸和取代羧酸

第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢 α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O② Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C CHCOHOO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法① α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2O HBr,NBSCHCCl O CHCOR O② β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起S N 2反应,生成α-取代羧酸。
ClCH 2COR O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。
有机化学 第16章 过渡金属-π配合物及其在有机合成中的应用

参与形成这类π 配合物的对称环状体系,原则上只要符
合休克尔规则(4n+2)的芳香环均可:
淮阴师范学院课程考核方法改革试点项目
第四节 过渡金属π配合物在有机合成中的应用
一、乙烯的催化氢化
H2与RhCl(PPh3)3进行加成,生成六配位的二氢化物,
然后它与乙烯配位而形成π 配合物,进而重排,H转移到
淮阴师范学院课程考核方法改革试点项目
二、其他不饱和烃π 配合物
淮阴师范学院课程考核方法改革试点项目
第三节 夹心结构π配合物
一、二茂铁
1. 制备
2. 结构特点 分子中两个环戊二烯基环平面互相平 行,铁原子被对称地夹在这两个环平 面中间。铁原子与整个环相连,而并 非只与环上的某个碳原子相连。
淮阴师范学院课程考核方法改革试点项目
淮阴师范学院课程考核方法改革试点项目
[PdCl4]2- + C2H4
Cl Cl
H2C Pd
CH2 Cl
-
+
H2O
Cl Cl
H2C Pd
CH2 Cl
-
+
Cl-
Cl Cl
H2C Pd
CH2 OH
-
+H+Cl ClH2C Pd
CH OH
-
H2O
Cl Cl
Pd
CH2 O+H
HC H
OH
-
H+ + Pd + 2Cl- + H2C CH OH CH3CHO
配位的乙烯上,变为乙基-铑配体,随后发生还原-消除反 应,另一个H迅速转移到乙基上,得氢化产物CH3CH3,并 再生RhCl(PPh3)3配合物。
有机化学第十六章 羧酸衍生物涉及碳负离子的反应及在合成中的应用

-I
-
C(CO2Et) 2 C(CO2Et) 2
CO2Et CO2Et CO2Et CO2Et
二、乙酰乙酸乙酯的烃基化及应用 乙酰乙酸乙酯的α-烷基化、α-酰基化
O
C2H5ONa
O
RCl
O R
RCOCl
O
CH3CCHCOC2H5
CH3CCHCOC2H5
O
O O O CH3CCHCOC2H5
CH3CCH2COC2H5
烯醇式 OH 1.α -H活性 CH3 -C=CH2 2.六员环结构 H
10-4
10-2
的分子内氢键 3.共轭体系
CH3C CH2 C OC2H5
7 76.5
100
O CH3-C
O C-OC2H5
O
O
CH O-H O CH3-C = CH-C-CH3 O H—C = CH-C—H O-H
CH3C CH2 C CH3
OH-
H+
2 CH3COOH + C2H5OH
在合成上的应用
O CH3CCH2COOC2H5 C2H5ONa O CH3CH2CH2Br CH3CCHCOOC2H5
O CH3CCHCOOC2H5 1) C2H5ONa CH2CH2CH3 2) CH3I
OCH3 CH3CCCOOC2H5 CH2CH2CH3
可以形成双钠盐
制备1,4-二官能团化合物
O CH3CCH2Cl + CH2(COOC2H5)2 1) OH 2) H
+ -
C2H5ONa
O CH3CCH2CH(COOC2H5)2
O CH3CCH2CH2COOH
利用丙二酸二乙酯可以制备含有
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HgCl2 RCH(SR')2 H2O
R2C S S
RCHO
H+ Ni RCH2R + C2H6 +H2S
HSCH2CHБайду номын сангаасSH H
+
硫汞键接近共价键,因为硫的给电子能力强。 RSH被氧化
SH
2
+ I2
S
S
+ 2HI
H2O2
H3C SH H3C SO3H
⑵硫醚 亲核能力强
O O
CH3SCH3
H2O2
-H2O 2(CH3)3SiCl + 2H2O
(H3C)3Si
OR Si OO R Si OO-
2(CH3)3SiOH
O Si(CH3)3
俗名:硅酮 随R的变化,可以改变其弹 性。
O-
R O Si R O-
硅油:
R
Si R
醇解:
HSiCl3 + CH3OH HSi(OCH3)3 + HCl
2 Si-H键,类似于H2 遇到氢气可以加成,催化剂,镍铂钯。
第十六章 含硫、磷、 硅 的有机化 合物
§1含硫化合物 ⑴硫醇RSH
RSH+RX→RSR+ RX→ R3SX
锍盐在高温条件下,可与碱(OH— 或RO—)作用发 生消除,生成Hofmann 烯烃:
R3SX
加热,类霍夫曼消除。 RSH+环氧乙烷→RSCH2CH2OH
H+ RCHO + 2R'SH
R2C=O
p-ClC6H4CH2Cl + HSiCl3 n-Pr3N CH3CN
R Si H + O C R' Si O CHRR'
p-ClC6H4CH2SiCl3
(C6H5)3P CH2CH2CH3Br
+
-
C6H5Li Et2O
(C6H5)3P+C-HCH2CH3 + C6H6 + LiBr ylide (C6H5)2P=CHCH2CH3 (ylene)
(2)
(CH3)3P +
O
(CH3)3P+O- + CH2=CH2
(3)P(OR)3
P(OR)3 + R'X high temprature
H3C S CH3
RCO3H
H3C
S O
CH3
or O2,NO2
⑶亚砜 新型脱氧剂,有机胺,有机硫 实验室常用的 溶剂DMSO,二甲亚砜,得电子得硫 醚,失电子得砜。 ⑷砜
DMSO C6H5CH2OH
O R CH2X +
C6H5CHO Base
CH3SCH3
RCHO + CH3SCH3
机理 ⑸亚磺酸,带有还原性质的酸试剂 制备砜的原料 ⑹磺酸
SO3H
290---320 C + NaOH
o
OH
H2SO4
SO3Na
ONa
290---320oC
+NaOH
OH
H2SO4
苯磺酸应用十分广泛,有机酸中酸性最强的有机化 合物,可用作酸试剂 ⑺连硫化合物 用于功能材料中, 橡胶硫化:有弹性。
S S
硫硫键断开,不改变原化合物的性质。 制备: §2含磷化合物 外层电子多,亲核能力强,与氧结合十分稳定。 ⑴PH3→ R3P 无氧发酵→PH3
PH3阴冷黑暗的条件下可以慢慢的从地底下渗出来鬼
火 ⑴和卤代烷的反应 ① (C6H5)3P + CH3I
Ph3P+
CHRR'X-
(C6H5)3P+CH3IPhP+ ylide
O CRR'
Ph3P=CRR' ylene
O
Ph3P
RHC
Ph3P
CHR
+
Ph3P
RHC
O
RCH=C
+ Ph3P=O
②
(C6H5)3P: + CH3CH2CH2Br
O-
(RO)2PR' +RX
阻燃剂
机理:
(RO)3P: + R'X
(RO)3P+R'X-
OR
OR
SN2
R O P OR R'
RX +
-
O
P OR
R'
X-
OCH3 P OCH3 OCH3 + CH3CH2I O
OCH3 P OCH3 OCH3 + O
OCH3 P OCH3 CH2CH3
§3含硅化合物 硅吸电子能力比碳弱,对生命体的刺激性弱。 1 Si-Cl SiCl4 RSiCl3 R2SiCl2 R3SiCl 易水解,氨解,醇解,和格氏试剂反应。 水解:
