鲁科版高一化学必修二知识点归纳
鲁科版化学必修2知识点总结

第三章 重要的有机化合物一.认识有机化合物绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO 、CO 2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
甲烷的性质与结构 1 .甲烷的物理化学性质物理性质 在通常状况下,甲烷是无色、无味的气体,密度比空气小,极难溶于水。
化学性质通常状况下,甲烷的性质比较稳定,与酸性KMnO 4溶液等强氧化剂不发生反应,与强酸、强碱等也不发生反应。
空间结构:正四面体,4个C-H 键的长度和强度相同,夹角相同。
来源: 天然气、沼气 、油田气 、煤矿坑道气的主要成分都是甲烷物性: 无色、无味的气体,密度0.717g/cm 3(标准状况),比空气的密度小,可用向下排空气法收集;极难溶于水----可用排水法收集。
稳定性:通常情况,甲烷比较稳定, 不能 被H +/KM n O 4、Br 2等氧化剂氧化,与强酸和强碱也不反应 甲烷的可燃性:氧化反应CH 4 + 2O 2 CO 2+2H 2O 注意:点燃甲烷时要验纯,条件不同,水的状态不同。
该反应为放热反应,伴有淡蓝色火焰。
甲烷的取代反应方程式:CH 4 + Cl 2 → CH 3Cl + HCl CH 3Cl + Cl 2 → CH 2Cl 2+ HCl CH 2Cl 2 + Cl 2 → CHCl 3+ HCl CHCl 3 + Cl 2 → CCl 4 + HCl①取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应 ②逐步取代:1molCl 2只能取代1molH 原子③取代反应的产物是混合物,5种产物都有(HCl ,还有各种取代产物)。
④:②产物的状态:HCl 、CH 3Cl 为 气体,CH 2Cl 2、CHCl 3和CCl 4为 液 体,甲烷的四种氯代产物都不溶于水。
不论CH 4 和 Cl 2的比例是多少,几种产物都有,n (HCl)最大,且 n (HCl)= n (参加反应Cl 2) 1.烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,称为烃。
化学高一鲁科必修二知识点

化学高一鲁科必修二知识点高一化学必修二知识点概述在高一学年的化学课程中,必修二是学生们接触到的第一个具体的化学专业课。
必修二以鲁科版教材为主要教材,内容丰富且涵盖广泛,囊括了化学的基础知识和一些重要的概念。
本文将对必修二中的一些重要知识点进行概述,帮助高一学生对这门学科有个整体的认识。
1. 物质的分类和性质必修二的第一章主要介绍了物质的分类和性质。
物质可以分为纯物质和混合物两大类。
纯物质又可以细分为元素和化合物。
元素是由同种原子组成,而化合物由不同元素的原子以一定的比例结合而成。
混合物则是由不同种类的物质以任意比例混合而成。
此外,物质还有一些常见的性质,如物质的质量、颜色、硬度、密度、电导率等。
2. 原子与元素周期表原子是物质的最小单位,是构成元素的基本粒子。
必修二第二章主要介绍了原子的结构和元素周期表。
原子由原子核和核外电子组成,原子核由质子和中子组成,而核外电子围绕原子核运动。
元素周期表是按照原子序数确定的,将元素按照一定的规律排列,使得具有相似性质的元素彼此相邻。
掌握了元素周期表的结构和特点,可以帮助我们更好地理解元素的性质和反应。
3. 原子与离子在第三章中,我们学习了原子和离子的相关知识。
原子可以失去或获得电子,形成带电的粒子,即离子。
失去电子形成正离子,获得电子形成负离子。
当正离子和负离子组合时,形成离子化合物。
离子在化学反应中起到了重要的作用,其提供了反应的基础。
4. 化学反应与化学方程式了解化学反应及其方程式对我们理解化学变化非常重要。
第四章中,我们学习了化学反应的基本概念和表示方法。
化学方程式是描述化学反应的物质变化的简明方式,由反应物和生成物组成。
通过化学方程式,我们可以分析和预测物质的变化。
5. 化学计量与化学反应的计算化学计量是进行化学反应计算的基础。
在第五章中,我们学习了一些用于计算化学反应中物质的量的方法。
化学计量涉及到物质量的关系和比例。
通过化学计量的应用,我们可以计算出化学反应中的物质的量,帮助我们更好地理解反应的过程和结果。
鲁科版高一化学必修二知识点归纳_doc

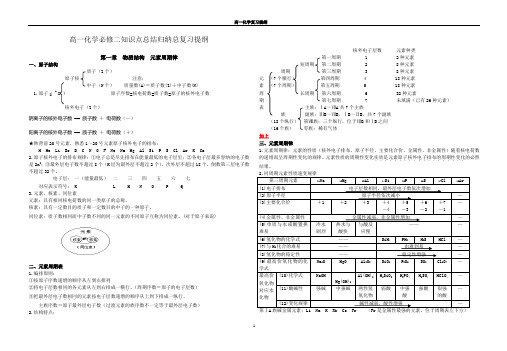
Z 高一化学必修二知识点总结归纳总复习提纲第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)阴离子的核外电子数== 质子数+电荷数(—)阳离子的核外电子数== 质子数- 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号:K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
鲁科版高一化学必修二知识点归纳

高一化学必修二知识点总结归纳总复习提纲第一章 物质结构 元素周期律一、原子结构质子(Z 个)原子核注意:中子(N 个)质量数(A)=质子数(Z)+中子数(N)1.X ) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)阴离子的核外电子数 == 质子数 + 电荷数(—)阳离子的核外电子数 == 质子数 - 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低)二 三 四 五 六 七 对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数) 2.结构特点:核外电子层数 元素种类第一周期1 2种元素短周期 第二周期 2 8种元素第三周期 3 8种元素元 (7个横行) 第四周期 种元素素 (7个周期) 第五周期5 18种元素周 长周期 第六周期 6 32种元素 期 第七周期 7 未填满(已有26种元素)表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间(16个族) 零族:稀有气体 三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
(完整版)鲁科版高一化学必修二知识点总结归纳总复习提纲
Z 高一化学必修二知识点总结归纳总复习提纲第一章物质结构元素周期律一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N)1.原子( A X )原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z个)阴离子的核外电子数== 质子数+电荷数(—)阳离子的核外电子数== 质子数+电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)第五周期 5 18种元素周长周期第六周期 6 32种元素期第七周期 7 未填满(已有26种元素)表主族:ⅠA~ⅦA共7个主族族副族:ⅢB~ⅦB、ⅠB~ⅡB,共7个副族(18个纵行)第Ⅷ族:三个纵行,位于ⅦB和ⅠB之间(16个族)零族:稀有气体加上三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
鲁科版化学必修2知识点总结

第三章重要的有机化合物一.认识有机化合物绝大多数含碳的化合物称为有机化合物,简称有机物。
像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
甲烷的性质与结构1 .甲烷的物理化学性质物理性质在通常状况下,甲烷是无色、无味的气体,密度比空气小,极难溶于水。
化学性质通常状况下,甲烷的性质比较稳定,与酸性KMnO4溶液等强氧化剂不发生反应,与强酸、强碱等也不发生反应。
空间结构:正四面体,4个C-H键的长度和强度相同,夹角相同。
来源:天然气、沼气、油田气、煤矿坑道气的主要成分都是甲烷物性:无色、无味的气体,密度0.717g/cm3(标准状况),比空气的密度小,可用向下排空气法收集;极难溶于水----可用排水法收集。
稳定性:通常情况,甲烷比较稳定,不能被H+/KM n O4、Br2等氧化剂氧化,与强酸和强碱也不反应甲烷的可燃性:氧化反应CH4 + 2O2 CO2+2H2O注意:点燃甲烷时要验纯,条件不同,水的状态不同。
该反应为放热反应,伴有淡蓝色火焰。
甲烷的取代反应方程式:CH4 + Cl2 → CH3Cl + HCl CH3Cl + Cl2 → CH2Cl2 + HClCH2Cl2 + Cl2 → CHCl3+ HCl CHCl3 + Cl2 → CCl4 + HCl①取代反应:有机物分子里的某些原子或原子团被其它原子或原子团所代替的反应②逐步取代:1molCl2只能取代1molH原子③取代反应的产物是混合物,5种产物都有(HCl,还有各种取代产物)。
④:②产物的状态:HCl、CH3Cl为气体,CH2Cl2、CHCl3和CCl4为液体,甲烷的四种氯代产物都不溶于水。
不论CH4和 Cl2的比例是多少,几种产物都有,n(HCl)最大,且 n(HCl)= n(参加反应Cl2)1.烃1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,称为烃。
(1)除甲烷外,还有一系列性质跟它很相似的烃,如乙烷(C2H6)、丙烷(C3H8)、丁烷(C4H10)等,这类烃称为烷烃。
鲁科版高一下化学必修二知识点总结期末复习提纲

高一化学必修二知识点总结归纳总复习提纲第一章 物质结构 元素周期律一、原子结构质子(Z 个)原子核 注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X ) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)阴离子的核外电子数 == 质子数 + 电荷数(—) 阳离子的核外电子数 == 质子数 + 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表 1.编排原则:①按原子序数递增的顺序从左到右排列 ②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数) 2.结构特点:核外电子层数 元素种类第一周期 1 2种元素短周期 第二周期 2 8种元素周期 第三周期 3 8种元素元 (7个横行) 第四周期 4 18种元素 素 (7个周期) 第五周期 5 18种元素 周 长周期 第六周期 6 32种元素期 第七周期 7 未填满(已有26种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间 (16个族) 零族:稀有气体 加上1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
鲁科版化学必修2知识点

Z 鲁科版化学必修2知识点归纳与总结 第一章 原子结构与元素周期律一、原子结构质子(Z 个)原子核 注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)1.原子( A X )核外电子(Z 个)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca 2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里; ②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一 二 三 四 五 六 七 对应表示符号: K L M N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说) 质量数:质子数与中子数之和,为整数,不同于相对原子质量。
含有10电子数目的微粒:Ne HF H 2O NH 3 CH 4 (五分子) Na + Mg 2+ Al 3+ H 3O + NH 4+(五阳离子)F - O 2- N 3- OH - NH 2- (五阴离子)含有18电子数目的微粒:Ar HCl H 2S PH 3 SiH 4 F 2 H 2O 2 N 2H 4 C 2H 6 CH 3OH K + Ca 2+Cl - S 2- P 3- HS -二、核外电子排布2.核外电子排布规律:① 最外层最多只能容纳8个电子(氦原子是 2 个); ② 次外层最多只能容纳 18 个电子;③倒数第三层最多只能容纳 32 个电子; ④ 每个电子层最多只能容纳 2n 2 个电子。
离核较近的区域内运动的电子能量较低,离核较远的区域内运动的电子能量较高。
另外,电子总是尽可能地先从内层排起,当一层充满后再填充下一层。
高一化学必修2(鲁科版)

第2章 化学键 化 学反应与能量
第2章 化学键 化 学反应与能量
第1节 化学键与化学反应 第2节 化学反应的快慢和限度 第3节 化学反应的利用
第3章 重要的 有机化合物
第3章 重要的有机 化合物
第1节 认识有机化合物 第2节 石油和煤 重要的烃 第3节 饮食中的有机化合物 第4节 塑料 橡胶 纤维 综合复习
高一化学必修2(鲁科版)
演讲人
202X-06-08
目录
01. 第1章 原子结构与元素周期律 02. 第2章 化学键 化学反应与能量 03. 第3章 重要的有机化合物
第1章 原子结构 与元素周期律
第1章 原子结构与 元素周期律
第1节 原子结构 第2节 元素周期律和元素周期表 第3节 元素周期表的应用
2020感谢聆听来自
高一化学鲁科版必修二第3章知识点总结

NO.1 烷烃 C n H2n+2特点:单键、链状1.烷烃C原子数越多,熔沸点越高;2.碳原子数相同时,支链越多,熔沸点越低室温25℃,C1~C4气体,C5~C17液体,C18固体代表物甲烷CH4正四面体,键角109°28′,电子式结构式球棍模型填充模型物理性质:无色无味,密度比空气小,难溶于水。
化学性质:1.甲烷化学性质稳定,不与强酸、强碱反应,也不与强氧化剂(KMnO4、H2O2)反应;2.氧化反应现象:火焰明亮,呈淡蓝色。
3.取代反应:有机物中的某些原子(或原子团)被其他原子(或原子团)代替的反应。
现象:试管内气体颜色(黄绿色)逐渐变浅;试管内壁有油状液体生成出现;试管中有少量白雾;试管内液面上升;水槽中有固体析出。
注意:CH4与Cl2(g),Br2(g)、I2(g)在光照条件下,发出取代反应CH4与氯水、溴水、碘水不反应。
NO.2 烯烃烯烃,通式C n H 2n 含官能团:碳碳双键炔烃,含官能团:碳碳叁键乙烯 分子式C 2H 4 结构简式 CH 2=CH 2电子式 结构式 球棍模型 填充模型物理性质:无色气体,稍有气味,难溶于水。
化学性质:1.氧化反应(1)现象:火焰明亮,有黑烟(2)碳碳双键不稳定,易被KMnO4氧化,使之退色(紫→无色)2.加成反应:有机化合物分子中双键上的碳原子与其原子(或原子团)直接结合生成新的化合物分子的反应。
乙烯能与溴水或溴 的CCl 4溶液发生反应,并使之退色(橙色→无色)3.取代反应:33Cl 422Cl 122CCl CCl Cl CH Cl CH CH CH 22-−−→−-−−→−=取代反应个加成反应个NO.3 苯 C 6H 6芳香烃:含苯环 , 只含有C 、H 元素CH 3苯 苯 甲(基)苯 结构式物理性质:无色液体,有特殊气味,密度小于水,难溶于水,有毒。
化学性质:苯平面结构,12个原子共面,键角120° 。
6个碳碳键完全相同,是一种介于碳碳单键和碳碳双键之间的特殊的化学键。
高中化学第二章 知识总结 鲁科版 必修2

第二章 知识总结一、化学键1.化学键的概念相邻的原子之间的强相互作用叫化学键。
注意:(1)只有相邻的原子之间而非距离较远的原子之间的相互作用。
(2)“强相互作用”,不是微弱的作用,而且包括相互吸引和相互排斥,而非“结合力”。
(3)化学反应的实质:化学反应过程,就是旧化学键的断裂和新化学键的形成的过程。
2.两种重要化学键的比较3.化学键与化学反应中的物质变化和能量变化的关系反应物吸收能量 E 1释放能量 E 2旧化学键断裂新化学键形成生成物反应吸收能量反应释放能量>E E 12>E E 12二、化学反应的快慢1.影响化学反应速率的本质原因(内因):物质本身的性质。
2.影响化学反应速率的外界因素及其影响规律:吸收能量E 1三、化学反应的限度1.可逆反应:在相同的条件下同时向正、反两个方向进行的反应称为可逆反应。
2.化学平衡:在一定条件下可逆反应进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,这种状态称化学平衡状态,简称化学平衡。
3.化学平衡的特征:可逆反应达到平衡状态表现的特征有:化学平衡状态是一个动态平衡,即正逆反应并没有停止;只是正反应速率和逆反应速率相等而已;反应混合物中各组分的百分含量不改变;但若外界条件变化,则会使化学平衡被破坏,发生移动。
4.化学平衡移动:一个处于平衡状态的可逆反应,如果改变影响平衡的条件,原来的化学平衡将被破坏,并在新的条件下建立起新的化学平衡,像这样,可逆反应从一个化学平衡状态变成另一个平衡状态,叫做化学平衡移动。
5.影响化学平衡的因素:温度、浓度、压强(气体反应)等。
四、化学反应的利用1.根据化学反应的物质变化进行物质制备:(2)其他物质的制备:如生铁、硫酸、氨、硝酸等。
2.根据化学反应的能量变化——为人类提供能源:(1)化学能与电能的转化:原电池及其工作原理。
①原电池的概念:把化学能转化成电能的装置。
例如,铜—锌(稀硫酸)原电池。
②原电池的工作原理:以铜—锌(稀硫酸)为例,由于锌的活泼性比铜强,锌失去电子,电子从锌极(负极)流出,经导线回到铜极(正极),氧化剂H+在铜(正极)上得到电子发生还原反应,同时,溶液里的阴离子向负极移动,阳离子向正极移动而是电流通过电解质溶液,这样,就完成了化学能向电能的转变过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
鲁科版高一化学必修二知识点归纳文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]高一化学必修二知识点总结归纳总复习提纲第一章 物质结构 元素周期律一、原子结构质子(Z 个)原子核注意:中子(N 个)质量数(A)=质子数(Z)+中子数(N)1.X ) 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)阴离子的核外电子数 == 质子数 + 电荷数(—)阳离子的核外电子数 == 质子数 - 电荷数(+)★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca 2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n 2;③最外层电子数不超过8个(K 层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二三 四 五 六 七对应表示符号: K LM N O P Q 3.元素、核素、同位素元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子....。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
(对于原子来说)二、元素周期表 1.编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同......的各元素从左到右排成一横行..。
(周期序数=原子的电子层数)③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数(过渡元素的族序数不一定等于最外层电子数) 2.结构特点:核外电子层数 元素种类 第一周期 1 2短周期 第二周期2 8种元素 周期第三周期3 8种元素元 (7个横行) 第四周期种元素素 (7个周期) 第五周期5 18种元素 周 长周期 第六周期6 32种元素期 第七周期7 未填满(已有26种元素)表 主族:ⅠA ~ⅦA 共7个主族 族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族(18个纵行) 第Ⅷ族:三个纵行,位于ⅦB 和ⅠB 之间(16个族) 零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质..是元素原子核外电子排布的周期性变化.................的必然结果。
2.同周期元素性质递变规律第ⅦA 族卤族元素:F Cl Br I At (F 是非金属性最强的元素,位于周期表右上方)★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe +CuSO 4=FeSO 4+Cu 。
⑤单质的还原性(或离子的氧化性)⑥原电池中正负极判断,金属腐蚀难易;(Ⅱ)同主族比较: (Ⅲ)注意:比较粒子(包括原子、离子)半径的方法:(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
元素化合价规律最高正价 == 最外层电子数,非金属的负化合价 == 最外层电子数-8,最高正价数和负化合价绝对值之和为8;其代数和分别为:0、2、4、6。
化合物氟元素、氧元素只有负价(-1、-2),但HFO中F为0价;金属元素只有正价;化合价与最外层电子数的奇、偶关系:最外层电子数为奇数的元素,其化合价通常为奇数,如Cl的化合价有+1、+3、+5、+7和-1价。
最外层电子数为偶数的元素,其化合价通常为偶数,如S的化合价有-2、+4、+6价。
第二章化学键化学反应与能量一、化学键化学键是相邻两个或多个原子间强烈的相互作用。
1.离子键与共价键的比较离子化合物:由离子键构成的化合物叫做离子化合物。
(一定有离子键,可能有共价键)共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键)极性共价键(简称极性键):由不同种原子形成,A-B型,如,H-Cl。
共价键非极性共价键(简称非极性键):由同种原子形成,A-A型,如,Cl -Cl。
2.电子式:电子式是用来表示原子或离子最外层电子结构的式子。
原子的电子式是在元素符号的周围画小黑点(或×)表示原子的最外层电子。
离子的电子式:阳离子的电子式一般用它的离子符号表示;在阴离子或原子团外加方括弧,并在方括弧的右上角标出离子所带电荷的电性和电量。
分子或共价化合物电子式,正确标出共用电子对数目。
离子化合价电子式,阳离子的外层电子不再标出,只在元素符号右上角标出正电荷,而阴离子则要标出外层电子,并加上方括号,在右上角标出负电荷。
阴离子电荷总数与阳离子电荷总数相等,因为化合物本身是电中性的。
④结构式:用一根短线来表示一对共用电子(应用于共价键)。
二、化学反应与能量1、化学键与化学反应中能量变化的关系⑴化学反应过程中伴随着能量的变化任何化学反应除遵循质量守恒外,同样也遵循能量守恒。
反应物与生成物的能量差若以热量形式表现即为放热反应或吸热反应(E反:反应物具有的能量;E生:生成物具有的能量):⑵化学变化中能量变化的本质原因⑶化学反应吸收能量或放出能量的决定因素:实质:一个化学反应是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量。
2、常见的放热反应和吸热反应常见的放热反应:①所有的燃烧与缓慢氧化。
②酸碱中和反应。
③金属与酸反应制取氢气。
④大多数化合反应(特殊:C +CO 2△2CO 是吸热反应)。
⑤铝热反应常见的吸热反应:①以C 、H 2、CO 为还原剂的氧化还原反应如:C(s)+H 2O(g)△+H 2(g)。
②铵盐和碱的反应如Ba(OH)2·8H 2O +NH 4Cl =BaCl 2+2NH 3↑+10H 2O③大多数分解反应如KClO 3、KMnO 4、CaCO 3的分解等。
3、能源的分类:[思考]一般说来,大多数化合反应是放热反应,大多数分解反应是吸热反应,放热反应都不需要加热,吸热反应都需要加热,这种说法对吗试举例说明。
点拔:这种说法不对。
如C +O 2=CO 2的反应是放热反应,但需要加热,只是反应开始后不再需要加热,反应放出的热量可以使反应继续下去。
Ba(OH)2·8H 2O 与NH 4Cl 的反应是吸热反应,但反应并不需要加热。
三、化学能与电能1、化学能转化为电能的方式:2、原电池原理(1)概念:把化学能直接转化为电能的装置叫做原电池。
(2)原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。
(3)构成原电池的条件:(1)电极为导体且活泼性不同;(2)两个电极接触(导线连接或直接接触);(3)两个相互连接的电极插入电解质溶液构成闭合回路。
(4)自发的氧化还原反应(4)电极名称及发生的反应:负极:较活泼的金属作负极,负极发生氧化反应,电极反应式:较活泼金属-ne-=金属阳离子负极现象:负极溶解,负极质量减少。
正极:较不活泼的金属或石墨作正极,正极发生还原反应,电极反应式:溶液中阳离子+ne-=单质正极的现象:一般有气体放出或正极质量增加。
(5)原电池正负极的判断方法:①依据原电池两极的材料:较活泼的金属作负极(K、Ca、Na太活泼,不能作电极);较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。
②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路流向原电池的正极。
③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。
④根据原电池中的反应类型:负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。
正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。
(6)原电池电极反应的书写方法:(i)原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应。
因此书写电极反应的方法归纳如下:①写出总反应方程式。
②把总反应根据电子得失情况,分成氧化反应、还原反应。
③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱介质和水等参与反应。
(ii)原电池的总反应式一般把正极和负极反应式相加而得。
(7)原电池的应用:①加快化学反应速率,如粗锌制氢气速率比纯锌制氢气快。
②比较金属活动性强弱。
③设计原电池。
④金属的腐蚀。
2、化学电源基本类型:①干电池:活泼金属作负极,被腐蚀或消耗。
如:Cu-Zn原电池、锌锰电池。
②充电电池:两极都参加反应的原电池,可充电循环使用。
如铅蓄电池、锂电池和银锌电池等。
③燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等)。
四、化学反应的速率和限度1、化学反应的速率(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
计算公式:v(B)=()c Bt∆∆=()n BV t∆•∆①单位:mol/(L·s)或mol/(L·min)②B为溶液或气体,若B为固体或纯液体不计算速率。
③以上所表示的是平均速率,而不是瞬时速率。
④重要规律:(i)速率比=方程式系数比(ii)变化量比=方程式系数比(2)影响化学反应速率的因素:内因:由参加反应的物质的结构和性质决定的(主要因素)。
外因:①温度:升高温度,增大速率②催化剂:一般加快反应速率(正催化剂)③浓度:增加反应物的浓度,增大速率(溶液或气体才有浓度可言)④压强:增大压强,增大速率(适用于有气体参加的反应)注:如果增大气体的压强时,不能改变反应气体的浓度,则不影响化学反应速率。
)⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率。
2、化学反应的限度——化学平衡(1)在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态。
在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。
通常把由反应物向生成物进行的反应叫做正反应。
而由生成物向反应物进行的反应叫做逆反应。
在任何可逆反应中,正方应进行的同时,逆反应也在进行。
可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0。
(2)化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0,即反应未停....止.。
