(完整版)电位滴定法中终点电位的确定方法
可用电位滴定法测定终点

电位滴定的优点: 电位滴定法一般具有较高的准确度和精密度,但分析时 间较长。由于电位滴定法测量的是随滴定剂加入而引起 的电池电动势的变化,而不是电动势的绝对值,即使电 极的斜率少有变化,也不影响测量结果。而其液接电位 和活度系数的变化很小,等当点附近电位突跃较大,容 易准确测定终点。 我的优势
一般酸碱滴定,沉淀滴定, 氧化还原滴定和络合滴定都 可采还原滴定: 参比电极一般使用饱和甘汞电极,在滴定 过程中氧化剂与还原剂之间发生电子转移, 电极电位是氧化剂(或还原剂)电对的氧化 型与还原型活度比的函数。指示电极常用铂、 金等惰性电极。 许多氧化还原反应都受pH影响,滴定曲线形 状依赖于pH,滴定时应控制合适的pH值。
④络合滴定: 参比电极一般使用饱和甘汞电极,指 示电极应根据不同络合反应选用不同 电极。 由于无机络合物多系分级络合,滴定过程 中无明显[Mz+]突跃或电位突跃,也缺乏 合适的指示剂,因而应用受到很大限制, 一般仅限于AgNO3或Hg(NO3)滴定CN-等。
一般由人工操作来 获得一条完整的滴 定曲线是非常麻烦 的。现在已开发出 自动电位滴定仪, 使滴定过程大为简 化。
甘汞电极:
表示式:Cl- | Hg2Cl2 , Hg 电极反应:Hg2Cl2+2e-==2Hg+2 ClRT ln aCl 电极电位: 0 F
甘汞电极电位随[Cl-]增大而减小, Cl-浓度 为1mol/L的甘汞电极称为标准甘汞电极。 Cl-浓度为4.2mol/L的称为饱和甘汞电极。
电位滴定法讲解

极,参比电极用甘汞电极); 用离子选择性电极作指示电极。
3.应用及计算示例
例题:二级微商法Vep? 指示电极:银电极 参比电极:双液接SCE 标准溶液0.10 mol/L AgNO3 滴定待测含Cl-试液得如下原始数据
滴加体积(mL) 24.10 24.20 24.30 24.40 24.50 24.60 24.70 电位 E (V) 0.183 0.194 0.233 0.316 0; /ml
0.09 24.10
0.11 24.20
0.39
24.30
0.83
24.40
0.24 24.50
0.11 24.60
0.07
Δ 2E/ Δ V2
0.2 2.8
4.4 -5.9
-1.3 -0.4
正负突变处24.30~24.40mL,内插法(线性插值)
Vep
24.30 (24.40 24.30)
E = E铂电极- E甘汞 = 0.77 + 0.059 lg([Fe3+]/[Fe2+])-0.2438
lg([Fe3+]/[Fe2+]) = (0.395+0.243-0.771) / 0.059 = -2.254
设有 X % 的 Fe2+ 氧化为 Fe3+,则: lg([Fe3+]/[Fe2+]) = lg X /(1-X)=-2.254 X/(1-X)=0.00557; X=0.557%; 即有约0.56%的Fe2+被氧化为Fe3+
特点:与直接电位法相比
测量电位变化,算出化学计量点体积 准确度和精密度高 E并没有直接用来计算待测物的c
仪器分析测试技术:电位滴定法

电位滴定法【任务分析】在化学滴定法中,实验的关键是选择一种合适的指示剂指示终点的到达。
例如当我们用重铬酸钾滴定Fe2+时可选用邻苯氨基苯甲酸作指示剂,在滴定终点时溶液颜色由无变为红色。
但是当样品溶液中有明显的颜色时如何指示终点?由于样品溶液有色,采用一般的指示剂无法指示终点。
可以对样品进行脱色,如吸附,萃取等方法使样品溶液退去颜色。
然后加指示剂滴定。
此方法操作繁琐,在脱色过程中可能引入污染或样品损失引起误差。
用其他的测定方法如原子吸收法、原子发射法等。
需要特殊的仪器设备。
采用电位滴定法简单、快捷。
【任务实施】1、准备仪器药品试剂(1)仪器:离子计(或精密酸度计);铂电极;双液接甘汞电极;电磁搅拌器;滴定管;移液管。
(2)试剂①c(1/6K2Cr207)=0.1000mol/L重铬酸钾标准溶液:准确称取在120℃干燥过的基准试剂重铬酸钾4.9033g,溶于水中后,定量移入lOOOmL容量瓶中,稀释至刻线。
②H2S04-H3P04混合酸(1+1)。
③邻苯氨基苯甲酸指示液2g/L。
④w(HN03) =10%硝酸溶液。
⑤硫酸亚铁铵试液。
2、任务内容(1)准备工作①铂电极预处理:将铂电极浸入热的叫(HN03) =10%硝酸溶液中数分钟,取出用水冲洗干净,再用蒸馏水冲洗,置电极夹上。
②饱和甘汞电极的准备:检查饱和甘汞电极内液位、晶体、气泡及微孔砂芯渗漏情况并作适当处理后,用蒸馏水清洗外壁;并吸干外壁上水珠,套上充满饱和氯化钾溶液的盐桥套管,用橡皮圈扣紧,再用蒸馏水清洗盐桥套管外壁,吸干外壁上水珠,置电极夹上。
③在洗净的滴定管中加入重铬酸钾标准滴定溶液,并将液面调至0.00刻线上,置已安装妥当的滴定管夹上。
④开启仪器电源开关,预热20min。
(2)试液中Fe2+含量的测定:移取20.00mL试液于250mL的高形烧杯中,加入硫酸和磷酸混合酸l0mL,稀释至约50mL左右。
加一滴邻苯氨基苯甲酸指示液,放人洗净的搅拌子,将烧杯放在搅拌器盘上,插入两电极。
电位滴定法

7
6 5 2 3 1 4
全自动电脑控制 无滴定管 自动给出Vep 多种工作模式
仪器分析与经典分析 相互融合
传统电位滴定方式
其他电分析化学方法(简介)
库仑分析法 极谱分析法
其他电分析化学方法(简介)
库仑分析法
原理:依据法拉第定律,由电解过程 中电极上通过的电量来确定电极上析 出的物质量的分析方法。
E E2 E1 V V2 V1
(c)二阶微商法(等于零点):又称二阶微分滴定曲 线,纵坐标Δ2Ε/ΔV 2=0的点即为滴定终点。通过后点 数据减前点数据的方法逐点计算二阶微商。 E E 2 E V 2 V 1 2 V V
内插法:取二阶微商的正、负转化处的两个点的 体积值V+,V-。
V V V终 V 2 E 2 E V 2 V 2 2 E V 2
2. 确定滴定终点的方法 二阶微商=0最常用
法拉第定律 m M it M Q n F n F
参比电极 (SCE)
电位计 阴极 (-)
R
A V
库仑计
e
(+) 阳极
辅助电极(Pt)
Mn+
O2 试液
工作电极(Pt) 图10-4 控制电位库伦分析装置示意图
其他电分析化学方法(简介)
极谱分析法
原理:以滴汞电极作工作电极,测定 电解过程中电流-电压的极化曲线并 进行分析。属于伏安分析法范畴。
续前: 表中的一级微商和二级微 商由后项减前项比体积差得 到,例:
E 0.316 0.233 0.83 V 24.40 24.30 2 E 0.24 0.88 5 .9 2 V 24.45 24.35
滴定终点的确定

04 滴定终点确定的影响因素
反应速率的影响
反应速率越快,滴定终点越容易 观察和判断。
反应速率慢时,滴定终点可能会 出现滞后现象,导致误差增大。
可以通过加入催化剂或升高温度 等方法提高反应速率,以便更准
确地观察滴定终点。
溶液浓度的影响
01
溶液浓度越高,滴定终点越难以判断。
02
溶液浓度过低时,滴定终点可能会出现提前到达的现象,导致
沉淀滴定
利用沉淀反应进行滴定,通过滴加标准溶 液(已知准确浓度的溶液)至待测溶液中 ,直到达到等当点(沉淀完全)为止。
络合滴定
利用络合反应进行滴定,通过滴加标准溶 液(已知准确浓度的溶液)至待测溶液中 ,直到达到等当点(络合完全)为止。
滴定终点的重要性
01
02
03
提高测定精度
准确的滴定终点能够减少 滴定误差,提高测定精度。
大气污染监测
通过滴定方法可以测定大气中某些有害气体或污染物的含量,如 二氧化硫、氮氧化物等。
土壤分析
滴定终点也可用于土壤分析中,以测定土壤中的某些离子或化学 成分。
在食品检测中的应用
食品添加剂检测
通过滴定方法可以检测食品中添加的某些物质,如防腐剂、色素 等。
营养成分分析
滴定终点可用于测定食品中的营养成分,如维生素C、矿物质等。
确定物质含量
通过滴定终点,可以准确测定溶液中特定离子的 含量,进而推算出待测物的质量或浓度。
反应进程监测
在化学反应过程中,滴定终点可用于判断反应是 否完成以及反应进行的程度。
反应机理研究
通过滴定终点确定,有助于研究化学反应的机理 和反应速度常数。
在环境监测中的应用
水质检测
滴定终点可用于检测水样中的特定离子或化学物质,如总碱度、 总酸度、硬度等,以评估水质状况。
电位分析法—电位滴定法(食品仪器分析课件)

二、一阶微商法
若E-V曲线较平坦,突跃不明显,则可绘制ΔVE/ΔV曲线。ΔE/ΔV是E的变化值与相应的加入滴定剂体积的增量之 比。如当加入滴定剂为 24.10~24.20mL,相应的E由183 mV 变至194mV,则
E 194183 110mV mL1 V 24.20 24.10
其对应的体积平均值
根据测得的一系列电动势(或pH)及其相应的消耗滴定 剂的体积确定滴定终点。
2.终点确定方法
电位滴定法确定终点的方法有E-V曲线法、一阶微 商法和二阶微商法。
E-V曲线
一阶微商曲线 二阶微商曲线
电位滴定终点确定方法
电位滴定法确定终点的方法有E-V曲线法、一阶微商 法和二阶微商法。
E-V曲线
一阶微商曲线 二阶微商曲线
最后根据滴定剂和待测组分反应的化学计量关系,由 滴定过程中消耗的滴定剂的量即可计算待测组分的含量。
二、终点确定方法
1.实验方法
进行电位滴定时,先称取一定量试样制成试液,用移液管移 取一定体积置于滴定池中,插入指示电极和参比电极,将标准溶 液(滴定剂)装入滴定管中,组装好装置。开启电磁搅拌器和毫 伏计,读取滴定前试液的电池电动势,并记录,然后开始滴定。
一、E-V曲线法
以滴定过程中测得的电池电动势为纵坐标,滴定消耗滴定剂 的体积为横坐标绘制E-V曲线。E-V曲线上的拐点(即曲线斜率最 大处)所对应的体积即为终点体积(Vep)。
确定拐点的方法是,作两条与横坐 标成45o角的E-V曲线的平行切线,并在 两条切线间作一与两切线等距离的平行 线,该线与E-V曲线的交点即为拐点。 即为终点体积(Vep)。
V 24.10 24.20 24.15 mL 2
将ΔE/ΔV对 V 作图,可得一峰形曲线,曲线最高点 由实验点连线外推所得,其对应的体积即为终点体积( Vep)。用此法作图确定滴定终点较为准确,但较烦琐。
电位分析法

内、外参比电极的电位值固定,且内充溶液中离子的活度 也一定,则电池电动势为:
RT EK ln ai nF
离子选择性电极的类型和结构
1976年IUPAC基于膜的特征,推荐将其分为以下几类
离子选择性电极(又称膜电极)
注意:离子活度系数保持不变时,膜电位才与log ci
呈线性关系。
总离子强度调节缓冲溶液简称TISAB
TISAB的作用:
①保持较大且相对稳定的离子强度,使活度系数恒定; ②维持溶液在适宜的pH范围内,满足离子电极的要求; ③掩蔽干扰离子。 典型组成(测F-): 1mol/L的NaCl,使溶液保持较大稳定的离子强度; 0.25mol/LHAc和0.75mol/LNaAc, 使溶液pH在5左右; 0.001mol/L的柠檬酸钠, 掩蔽Fe3+、Al3+等干扰离子。
公式使用时注意:对阳
离子,△E不变;对阴离子,△E
前加负号或取△E的绝对值。
优点:
(1)无须绘制标准曲线
(仅需一种浓度标液) (2)无需配制或添加 TISAB (3)操作步骤简单、快 速
3、直读法--pH测定原理与方法 ⑴ 直读法:对于被测溶液中
的某种成分能够在仪器上直接读 出其浓度的方法称为直读法。如 在pH计或pNa计上就能测定pH值
影响电位测定准确性的因素
(1) 测量温度:影响主要表现在对电极的标准电极电位、 直线的斜率和离子活度的影响上。 仪器可对前两项进行校正,但多数仅校正斜率。 温度的波动可以使离子活度变化,在测量过程中应尽量 保持温度恒定。 (2) 线性范围和电位平衡时间:一般线性范围在10-1~10-6 mol / L;平衡时间越短越好。测量时可通过搅拌使待测离子 快速扩散到电极敏感膜,以缩短平衡时间。 测量不同浓度试液时,应由低到高测量。
1电位滴定基本原理解析

Δ2E/ΔV 2 - V 曲线法
确定滴定终点的方法
E-V曲线法:取中点
但准确性稍差 ( 突越范围太小 , 变化不
明显)
一阶微商法 Δ E/Δ V - V曲线法 二阶微商法 Δ 2E/Δ V2 - V曲线法
确定滴定终点的方法 依据
滴定曲线上的化学计量点 在数学上为曲线的拐点
(上凹与下凹的交点)
拐点性质 一阶导数达max 二阶导数=0
1、E-V 曲线法
•以加入滴定剂的 体积V(ml)为横 坐标、对应的电动 h 势E(mv)为纵坐 标,绘制 E-V曲线, 曲线上的拐点所对 应的体积为滴定终 点。
2、△E/△V —V曲线
• 曲线的一部分用外延
法绘制,其最高点对
应于滴定终点时所消 耗滴定剂的体积。
4、△2E/△V2 — V曲线
• 以二阶微商值为纵坐 标,加入滴定剂的体 积为横坐标作图。 △2E/△V2 =0所对应 的体积即为滴定终点。
电位滴定法
电位滴定 (间接电位法)
在进行有色或混浊液的滴定时,使
用指示剂确以玻璃电极
为指示电极;氧化还原滴定以 Pt 为指示电
极;沉淀滴定可采用 Ag 电极作指示电极; 配合滴定以第三类电极为指示电极。 定义:在滴定液中插入指示电极和参比电 极,通过测量电池电动势在滴定过程中 pH 或电位的变化来确定终点的方法。如图所
实验数据
加入AgNO3的 体积V(ml) 24.10 24.20 24.30 24.40 E/V 0.183 0.194 0.233 0.316 △E/△V 0.11 0.39 0.83 0.24 2.8 4.4 -5.9 △2E/△V2
24.50
24.60 24.70 25.00 25.50
电位滴定法

电位滴定分析法的装置
1. 手动电位滴定装置
2. 自动电位滴定装置
电位滴定法的操作步骤
关键: 确定滴定反应至化学计量点时,所消耗的滴 定剂(标准溶液)的体积。 步骤: 1、根据预测定数据,取一定量的待测试液; 2、用标准溶液进行滴定,并记录相应的电 位; 3、根据所得数据,按上述普通作图法,一 阶、二阶导数法来确定终点。
乙炔基中氢置换 法
电位滴定法的应用及电极的选择(三)
硝酸汞滴定 铂电极,汞电极, 硫酸亚汞 铂电极可用10%() g/ml)硫代硫酸钠 溶液浸泡后用水清 洗,汞电极,硫酸 亚汞电极可用硝酸 溶液浸泡后用水清 洗。 铂电极用加有少量 三氯化铁的硝酸或 或用铬酸清洁液浸 洗。
永停滴定法
铂电பைடு நூலகம்-铂电极
进口产品的介绍
药典中收载的品种
非水滴 酸碱滴 硝酸汞 银量法 碘量法 永停滴 定 定 滴定 滴定 滴定 定法
92
26
2
5
5
24
非水滴定中的汞盐革除
1)加乙酸酐的高氯酸电位滴定法; 2)以醇类为溶剂的氢氧化钠电位滴定法;
加乙酸酐的高氯酸电位滴定法
与原来采用醋酸汞滴定的方法一致,只是 通过溶剂的选择,使终点突跃增大从而取 代汞盐的使用。由于适量乙酸酐的加入不 仅是溶质的碱性增强,而且使滴定突跃明 显增加,其结果是既革除了汞盐的污染, 又能排除人为因素的干扰。因此该方法也 是2010版药典中采用最多的方法,共有盐酸 二甲双胍等31个品种采用该方法。
电位滴定法的原理
电位滴定法是一种利用电极电位的突越来确定终 点的分析方法。进行电位滴定时,在溶液中插入 待测离子的指示电极和参比电极组成化学电池, 随着滴定剂的加入,由于发生化学反应,待测离 子浓度不断发生变化,指示电极的电位随着发生 变化,在计量点附近,待测离子的浓度发生突变, 指示电极的电位发生相应的突跃。因此,测量滴 定过程中电动势的变化,就能确定滴定反应的终 点,求出试样的含量。
电位滴定法的原理

电位滴定法的原理点击次数:817 发布时间:2009-8-5 11:30:29电位滴定法是在滴定过程中通过测量电位变化以确定滴定终点的方法,和直接电位法相比,电位滴定法不需要准确的测量电极电位值,因此,温度、液体接界电位的影响并不重要,其准确度优于直接电位法,普通滴定法是依靠指示剂颜色变化来指示滴定终点,如果待测溶液有颜色或浑浊时,终点的指示就比较困难,或者根本找不到合适的指示剂。
电位滴定法是靠电极电位的突跃来指示滴定终点。
在滴定到达终点前后,滴液中的待测离子浓度往往连续变化n个数量级,引起电位的突跃,被测成分的含量仍然通过消耗滴定剂的量来计算。
使用不同的指示电极,电位滴定法可以进行酸碱滴定,氧化还原滴定,配合滴定和沉淀滴定。
酸碱滴定时使用PH玻璃电极为指示电极,在氧化还原滴定中,可以从铂电极作指示电极。
在配合滴定中,若用EDTA作滴定剂,可以用汞电极作指示电极,在沉淀滴定中,若用硝酸银滴定卤素离子,可以用银电极作指示电极。
在滴定过程中,随着滴定剂的不断加入,电极电位E不断发生变化,电极电位发生突跃时,说明滴定到达终点。
用微分曲线比普通滴定曲线更容易确定滴定终点。
如果使用自动电位滴定仪,在滴定过程中可以自动绘出滴定曲线,自动找出滴定终点,自动给出体积,滴定快捷方便。
进行电位滴定时,被测溶液中插入一个参比电极,一个指示电极组成工作电池。
随着滴定剂的加入,由于发生化学反应,被测离子浓度不断变化,指示电极的电位也相应地变化。
在等当点附近发生电位的突跃。
因此测量工作电池电动势的变化,可确定滴定终点。
电位滴定的基本仪器装置包括滴定管、滴定池、指示电极、参比电极、搅拌器,测电动势的仪器。
电位滴定法是如何确定滴定终点的呢?用绘制电位确定曲线的方法。
电位滴定曲线即是随着滴定的进行,电极电位值(电池电动势)E对标准溶液的加入体积V作图的图形。
根据作图的方法不同,电位滴定曲线有三种类型,E-V曲线,普通电位滴定曲线,拐点e即为等当点。
药典三部(2015版)-通则-0701电位滴定法与永停滴定法

0701 电位滴定法与永停滴定法电位滴定法与永停滴定法是容量分析中用以确定终点或选择核对指示剂变色域的方法。
选用适当的电极系统可以作氧化还原法、中和法(水溶液或非水溶液)、沉淀法、重氮化法或水分测定法第一法等的终点指示。
电位滴定法选用两支不同的电极。
一支为指示电极,其电极电位随溶液中被分析成分的离子浓度的变化而变化;另一支为参比电极,其电极电位固定不变。
在到达滴定终点时,因被分析成分的离子浓度急剧变化而引起指示电极的电位突减或突增,此转折点称为突跃点。
永停滴定法采用两支相同的铂电极,当在电极间加一低电压(例如50mV)时,若电极在溶液中极化,则在未到滴定终点时,仅有很小或无电流通过;但当到达终点时,滴定液略有过剩,使电极去极化,溶液中即有电流通过,电流计指针突然偏转,不再回复。
反之,若电极由去极化变为极化,则电流计指针从有偏转回到零点,也不再变动。
仪器装置电位滴定可用电位滴定仪、酸度计或电位差计,永停滴定可用永停滴定仪或按图示装置。
电流计的灵敏度除另有规定外,测定水分时用10-6A/格,重氮化法用10-9A/格。
所用电极可按下表选择。
滴定法(1)电位滴定法将盛有供试品溶液的烧杯置电磁搅拌器上,浸入电极,搅拌,并自滴定管中分次滴加滴定液;开始时可每次加入较多的量,搅拌,记录电位;至将近终点前,则应每次加入少量,搅拌,记录电位;至突跃点已过,仍应继续滴加几次滴定液,并记录电位。
由于二阶导数计算法最准确,所以最为常用。
采用自动电位滴定仪可方便地获得滴定数据或滴定曲线。
如系供终点时指示剂色调的选择或核对,可在滴定前加入指示剂,观察终点前至终点后的颜色变化,以确定该品种在滴定终点时的指示剂颜色。
(2)永停滴定法用作重氮化法的终点指示时,调节R使加于电极上的电压约为50mV。
1取供试品适量,精密称定,置烧杯中,除另有规定外,可加水40ml与盐酸溶液(1→2)15ml,而后置电磁搅拌器上,搅拌使溶解,再加溴化钾2g,插入铂-铂电极后,将滴定管的尖端插人液面下约2/3处,用亚硝酸钠滴定液(0.1mol/L或0.05mol/L)迅速滴定,随滴随搅拌,至近终点时,将滴定管的尖端提出液面,用少置水淋洗尖端,洗液并人溶液中,继续缓缓滴定,至电流计指针突然偏转,并不再回复,即为滴定终点。
电位滴定法确定终点的方法

电位滴定法确定终点的方法
电位滴定法是一种使用电化学方法进行滴定分析的方法,其确定终点的方法有以下几种:
1. 观察电位变化。
当加入的滴定剂与样品中的分析物完全反应时,会出现电位变化,这表明滴定已经完成。
因此,观察电位变化是判断终点的主要方法。
2. 使用指示剂。
指示剂可以通过改变溶液的颜色或电位来指示滴定终点。
由于不同的指示剂的变色范围和响应时间不同,因此需要根据具体情况选择合适的指示剂。
3. 使用自动滴定仪。
自动滴定仪可以记录滴定过程中的电位变化,并计算出滴定终点。
这种方法不仅精度高,而且可以节约时间和人力成本。
确定滴定终点的方法

定义
滴定终点
在滴定分析中,当滴定剂ຫໍສະໝຸດ 被滴定物质完全反应时所达到的化学计量点。
确定滴定终点的方法
为了准确测定滴定终点,可以采用指示剂法、电位滴定法、光谱法等手段。
重要性
提高分析精度
准确测定滴定终点可以减少误差,提高分析结果 的精度和准确性。
指导实验操作
确定滴定终点有助于指导实验操作,确保实验过 程顺利进行。
误差控制方法
仪器校准
定期对使用的仪器进行校准,确保仪器准确 性。
环境控制
在恒温、恒湿的环境中进行实验,减少环境 因素对实验结果的影响。
规范操作
严格按照操作规程进行实验,避免操作过程 中引入误差。
使用高纯度试剂
选择高纯度试剂,降低试剂纯度对实验结果 的影响。
05
实际应用与案例分析
BIG DATA EMPOWERS TO CREATE A NEW
。
实验注意事项
01
02
03
04
试剂纯度
确保所使用的试剂纯度符合要 求,避免因试剂不纯导致误差
。
仪器校准
在使用前应检查和校准滴定管 、容量瓶等仪器的准确性和精
度。
环境控制
实验过程中应保持室内温度、 湿度的相对稳定,以减小误差
。
安全防护
对于有毒、有害、易燃易爆的 试剂和气体,应采取相应的安
全防护措施。
04
误差来源与控制
BIG DATA EMPOWERS TO CREATE A NEW
ERA
误差来源
仪器误差
滴定管、容量瓶等仪器 本身存在误差,需要定
期校准。
操作误差
环境因素
试剂纯度
操作过程中,如读数、 滴定速度控制等,可能
电位滴定法的基本原理

电位滴定法的基本原理电位滴定法是一种常用的化学分析方法,它通过测定滴定过程中电极电位的变化来确定被测物质的含量。
电位滴定法广泛应用于酸碱滴定、氧化还原滴定、络合滴定等领域,具有操作简便、准确性高的特点。
本文将介绍电位滴定法的基本原理,以帮助读者更好地理解和应用这一分析方法。
首先,电位滴定法的基本原理是基于电化学原理的。
在电位滴定法中,常用的电极有玻璃电极、铂电极、甚至是离子选择电极等。
这些电极在滴定过程中与被测溶液发生反应,产生电位变化。
通过测定电位的变化,可以确定被测物质的含量。
在滴定过程中,滴定剂以一定速率滴加到被测溶液中,同时用电位计测定电极的电位变化。
当滴定剂与被测物质完全反应时,电位出现明显变化,这一点称为终点。
通过记录滴定过程中电位的变化,可以确定滴定终点,从而计算出被测物质的含量。
其次,电位滴定法的原理还涉及滴定曲线的特征。
在电位滴定法中,通常绘制滴定曲线来表示滴定过程中电位的变化。
滴定曲线通常呈S形,其特点是在滴定终点处出现电位突变。
滴定曲线的斜率反映了滴定剂与被测物质的化学反应速率,而电位突变点则对应着滴定终点。
因此,通过分析滴定曲线的形状和特征,可以确定滴定终点,从而准确地测定被测物质的含量。
此外,电位滴定法的原理还与指示剂的选择有关。
在一些滴定分析中,为了更清晰地观察滴定终点,常常使用指示剂。
指示剂是一种能够在滴定过程中改变颜色的物质,它能够与滴定剂或被测物质发生化学反应,从而在滴定终点时显示颜色变化。
通过观察指示剂的颜色变化,可以确定滴定终点,进而计算出被测物质的含量。
总之,电位滴定法是一种基于电化学原理的分析方法,通过测定滴定过程中电极电位的变化来确定被测物质的含量。
它具有操作简便、准确性高的特点,广泛应用于化学分析领域。
在实际应用中,需要注意选择合适的电极和指示剂,合理设计滴定曲线,以确保准确地测定被测物质的含量。
希望本文能够帮助读者更好地理解电位滴定法的基本原理,并在实际分析中加以应用。
(完整版)电位滴定法中终点电位的确定方法
24.20
0.194
24.25
0.39
2.8
24.30
0.233
24.35
0.83
4.4
24.40
0.316
24.45
0.24
-5.9
24.50
0.340
24.55
0.11
-1.3
24.60
0.351
24.65
0.07
-0.4
24.70
0.358
24.85
0.050
-0.1
25.00
0.373
25.25
0.024
-0.065
25.50
0.385
25.75
0.022
-0.004
26.00
0.396
27.00
0.015
-0.0056
28.00
0.426
其中:
(1)作图法求终点
V/mL
E/V
5.00
0.062
15.0
0.085
20.0
0.107
22.0
0.123
23.0
0.138
23.50
0.146
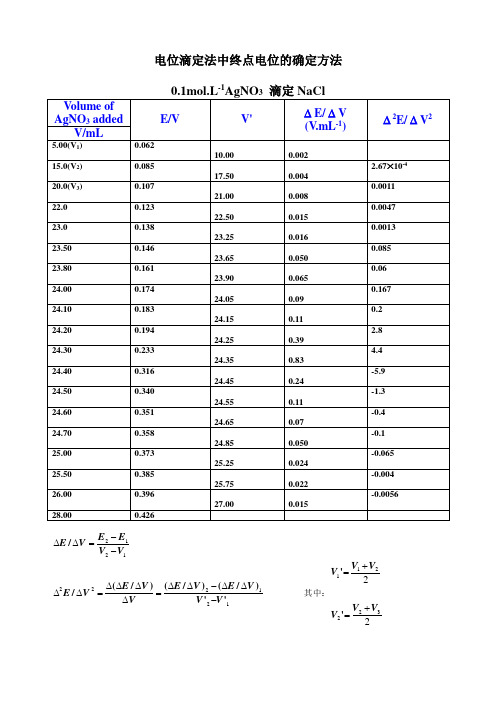
电位滴定法中终点电位的确定方法
0.1mol.L-1AgNO3滴定NaCl
Volume of AgNO3added
E/V
V'
E/V
(V.mL-1)
2E/V2
V/mL
5.00(V1)
0.062
10.00
0.002
15.0(V2)
0.085
17.50
0.004
2.67×10-4
20.0(V3)
0.107
电位滴定终点确定方法

– 沾有油污,可用5%~10%的氨水或丙酮清洗;在含蛋白 质溶液或胶质溶液中测定后,可用1mol/LHCl溶液清洗。 清洗电极时不可用脱水溶剂(如铬酸洗液、无水乙醇、 浓硫酸等),以免破坏电极的功能。
• 7. 玻璃电极不能用于含氟离子溶液的测定。
玻 AgCl / Ag 膜 AgCl / Ag K 0.0592 pH
– 故298.15K时,玻璃电极的电极电位为:
玻 K玻 0.0592 pH
– 与pH成线性关系,因而可用于测定溶液pH
24
(三)性能
• 1.只对H+有选择性响应,可以测定[H+]
• 2.转换系数或电极斜率:溶液中pH变化一个单位引起 玻璃电极的电位变化
43
氟电极测定时的干扰及消除
上述试液污染有时是不可避免的,但通常对测定影 响较小。但如果用此类参比电极测量K+、Cl-、Ag+ 、Hg2+ 时,其测量误差可能会较大。这时可用盐桥 (不含干扰离子的KNO3或Na2SO4)来克服
12
• (三)银-氯化银电极
AgCl e—
Ag Cl—
– 298.15K时电极电位为:
0 - 0.059lg Cl -
29
30
311
直接电位法
• 直接电位法(direct potentiometry) 是根据电 池电动势与待测组分的浓度之间的函数关系, 通过测定电池电动势而直接求得试样中待测 组分的浓度的电位法。 – 通常用于溶液的pH测定和其它离子浓度的 测定。
32
一、 溶液pH测定的原理
1.原理
电位滴定法的原理和装置

电位滴定法的原理和装置电位滴定法与直接电位法的不同在于,它是以测量滴定过程中指示电极的电极电位(或电池电动势)的变化为基础的一类滴定分析方法。
滴定过程Array中,随着滴定剂的加入,发生化学反应,待测离子或与之有关的离子活度(浓度)发生变化,指示电极的电极电位(或电池电动势)也随着发生变化,在化学计量点附近,电位(或电动势)发生突跃,由此确定滴定的终点。
因此电位滴定法与一般滴定分析法的根本不同是确定终点的方法不同。
电位滴定法的装置由四部分组成,即电池、搅拌器、测量仪表、滴定装置,如图2.17所示。
滴定终点的确定:有作图法和二级微商计算法两种1. 作图法―― 作φ~V 曲线(即一般的滴定曲线),以测得的电位φ(或电动势E )对滴定的体积V 作图得到图2.18(a )的曲线,曲线的突跃点(拐点)所对应的体积为终点的滴定体积V e 。
―― 作△φ/△V ~V 曲线(即一级微分曲线),对于滴定突跃较小或计量点前后滴定曲线不对称的,可以用△φ/△V (或△E /△V )对△V 相应的两体积的平均值(即)作图,得到图2.18(b )的曲线,曲线极大值所对应的体积为V e 。
―― 作△2φ/△V 2~V 曲线(即二级微商曲线),以△2φ/△V 2 (或 △2E /△V 2)对二次体积的平均值(即)作图,得到图2.18(c)曲线,曲线与V 轴交点,即△2φ/△V 2=0所对应的体积为V e 。
―― 作△V /△φ~V 曲线,只要在计量点前后取几对数据,以△V /△φ 对V 作图,可得到两条直线,图2.18(d )所示,其交点所对应的体积为V e 。
2. 二级微商计算法从二级微商曲线可见,当△2φ/△V 2 的两个相邻值出现相反符号时,两个滴定体积V 1,V 2之间,必有△2φ/△V 2=0的一点,该点对应的体积为V e 。
用线性内插法求得φe 、V e:自动电位的滴定以前及目前还有不少使用自动电位Array滴定的装置如图2.19所示。
电位滴定法确定滴定终点的方法

电位滴定法确定滴定终点的方法简介电位滴定法是一种常用的化学分析方法,用于确定溶液中某种物质的浓度。
它基于电位变化来判断滴定终点,通过测量溶液中的电位变化来确定反应的终点。
本文将详细介绍电位滴定法确定滴定终点的方法。
原理在电位滴定法中,我们通常使用指示剂和参比电极来监测溶液中的电位变化。
指示剂是一种能够在特定条件下改变颜色的物质,当反应达到滴定终点时,指示剂会发生颜色变化。
参比电极则用于提供一个稳定的参考电势,以便准确测量溶液中的电位。
在进行电位滴定时,我们首先需要根据所研究物质的性质选择合适的指示剂和参比电极。
然后,将待测溶液与标准溶液逐渐混合,并同时记录下测量得到的电位值。
当溶液中出现明显颜色变化时,并且伴随着突变式的电位变化时,可以判断滴定反应已经达到终点。
实验步骤以下是进行电位滴定法确定滴定终点的一般实验步骤:1.准备工作:选择合适的指示剂和参比电极,并进行校准,确保测量结果准确可靠。
2.准备标准溶液:根据所需测定物质的浓度,配制出一定浓度的标准溶液。
3.准备待测溶液:将待测溶液与适量的试剂混合,以达到滴定所需的反应条件。
4.开始滴定:使用滴定管将标准溶液缓慢加入待测溶液中,并同时记录下每次加入后的电位值。
5.监测颜色变化:注意观察溶液颜色的变化情况,在颜色发生明显改变时停止加入标准溶液,并记录下此时的电位值。
6.数据处理:根据实验数据绘制曲线图,分析曲线上出现突变式电位变化的位置,确定滴定终点。
注意事项在进行电位滴定法实验时,需要注意以下事项:1.选择合适的指示剂和参比电极,确保实验结果准确可靠。
2.控制滴定速度,避免过快或过慢导致滴定终点的判断错误。
3.注意观察溶液颜色的变化情况,及时停止加入标准溶液。
4.实验室操作要规范,注意安全。
应用领域电位滴定法广泛应用于化学分析和质量控制领域。
它可以用于测定酸碱度、氧化还原反应、络合反应等不同类型的滴定分析。
在环境监测中,电位滴定法可以用于测定水体中重金属离子的浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.161
24.00
0.174
24.10
0.183
24.20
0.194
24.30
0.233
24.40
0.316
24.50
0.340
24.60
0.351
24.70
0.358
25.00
0.373
25.50
0.385
26.00
0.396
28.00
0.426
V/mL
E/V
(V.mL-1)
10.00
0.2
24.20
0.194
24.25
0.39
2.8
24.30
0.233
24.35
0.83
4.4
24.40
0.316
24.45
0.24
-5.9
24.50
0.340
24.55
0.11
-1.3
24.60
0.351
24.65
0.07
-0.4
24.70
0.358
24.85
0.050
-0.1
25.00
0.373
0.008
22.0
0.123
22.50
0.015
0.0047
23.0
0.138
23.25
0.016
0.0013
23.50
0.146
23.65
0.050
0.085
23.80
0.161
23.90
0.065
0.06
24.00
0.174
24.05
0.09
0.167
24.10
0.183
24.15
0.11
0.022
27.00
0.015
V/mL
2E/V2
15.0
2.67×10-4
20.0
0.0011
22.0
0.0047
23.0
0.0013
23.50
0.085
23.80
0.06
24.00
0.167
24.10
0.2
24.20
2.8
24.30
4.4
24.40
-5.9
24.50
-1.3
24.60
-0.4
24.70
-0.1
25.00
-0.065
25.50
-0.004
26.00
-0.0056
(2)二阶微商法(代数法)确定终点
根据代数学原理,在终点体积时,二阶微商为零,从上图中可以看出,当滴定体积个24.30增加至24.40时,二阶微商由正值变为负值,表明终点体积应介于24.30mL ~ 24.40mL之间。因此可以通过下面的比例方程求得终点体积:
设当二阶微商由4.4减小至0时,滴定体积增加了xmL,则:
x= 0.04mL
故终点体积应为24.30 + 0.04 = 24.34 mL
又设终点电位为E/V,从原表数据中可以看到,当二阶微商由4.4改变至-5.9时,溶液电位值由0.233V增加至0.316V,故:
E = 0.267V
0.002
17.50
0.004
21.00
0.008
22.50
0.015
23.25
0.016
23.65
0.050
23.90
0.065
24.05
0.09
24.15
0.11
24.25
0.39
24.35
0.83
24.45
0.24
24.55
0.11
24.65
0.07
24.85
0.050
25.25
0.024
25.75
电位滴定法中终点电位的确定方法
0.1mol.L-1AgNO3滴定NaCl
Volume of AgNO3added
E/V
V'
E/V
(V.mL-1)
2E/V2
V/mL
5.00(V1)
0.062
10.00
0.002
15.0(V2)
0.085
17.50
0.004
2.67×10-4
20.0(V3)
0.107
21.00
25.25
0.024
-0.065
25.50
0.385
25.75
0.022
-0.004
26.00
0.396
27.00
0.015
-0.0056
28.00
0.426
其中:
(1)作图法求终点
V/mL
E/V
5.00
0.062
15.0
0.085
20.0
0.107
22.0
0.123
23.0
0.138
23.50
0.146
