蛋白质同源建模评价 共22页PPT资料
蛋白质三级结构预测(swiss-model同源建模)
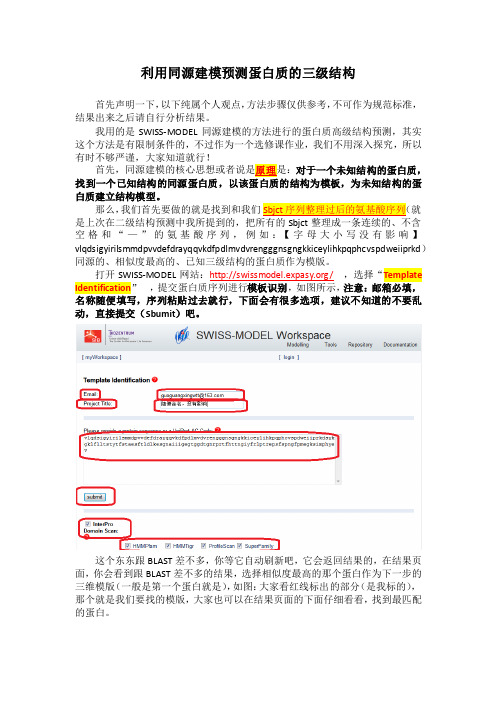
利用同源建模预测蛋白质的三级结构首先声明一下,以下纯属个人观点,方法步骤仅供参考,不可作为规范标准,结果出来之后请自行分析结果。
我用的是SWISS-MODEL同源建模的方法进行的蛋白质高级结构预测,其实这个方法是有限制条件的,不过作为一个选修课作业,我们不用深入探究,所以有时不够严谨,大家知道就行!对于一个未知结构的蛋白质,白质建立结构模型。
那么,我们首先要做的就是找到和我们空格和“—”的氨基酸序列,例如:【字母大小写没有影响】vlqdsigyirilsmmdpvvdefdrayqqvkdfpdlmvdvrengggnsgngkkiceylihkpqphcvspdweiiprkd)同源的、相似度最高的、已知三级结构的蛋白质作为模版。
打开SWISS-MODEL网站:/,选择“Template Identification,提交蛋白质序列进行模板识别,如图所示,注意:邮箱必填,名称随便填写,序列粘贴过去就行,下面会有很多选项,建议不知道的不要乱动,直接提交(Sbumit)吧。
这个东东跟BLAST差不多,你等它自动刷新吧,它会返回结果的,在结果页面,你会看到跟BLAST差不多的结果,选择相似度最高的那个蛋白作为下一步的三维模版(一般是第一个蛋白就是),如图:大家看红线标出的部分(是我标的),那个就是我们要找的模版,大家也可以在结果页面的下面仔细看看,找到最匹配的蛋白。
这里还有一点要作说明,就是上图标出的代码是PDB编号,前四个表示PDB- Code,最后一位表示Chain-ID,具体什么意思,大家有兴趣就去了解一些吧。
接下来,去NCBI串串门吧,在NCBI中搜索上面查到的蛋白的PDB号,一般输入前四位就行啦,注意:搜索蛋白库(Protein)。
找到以后,以FASTA格式显示。
接下来,我们再回到SWISS-MODEL,接下来就是重点和难点啦,在线提交序列进行同源建模分析,这个在线提交不是大家想象的那么容易,这个耗费了我大部分的时间,说到这里我就想画个圈圈诅咒它,大家注意啦~~~~~~~~~~~SWISS-MODEL 是一个自动化的蛋白质比较建模服务器,该服务器提供用户三种模式可选择:Automatic mode(简捷模式): 用于建模的氨基酸序列或是Swiss-Prot/TrEMBL (/sprot )编目号(accession)可以直接通过web界面提交。
蛋白质组学pptppt课件

精品课件
22
科技部已将疾病蛋白质组研究列入我国“973” 计划项目和“863”计划项目;国家自然科学基 金委员会也将“蛋白质组研究”列为重点项目。
我国在鼻咽癌、白血病、肝癌和肺癌蛋白质组 研究方面取得了较大的进展。
精品课件
23
第二节 蛋白质组表达模式的研究方法
精品课件
24
主要研究目标
研究蛋白质组组成成分、差异和功能
Genomics (基因组学) Post-genomic science (后基因组时代)
Functional genomics (功能基因组学) ▪ Transcriptomics( 转录组学) ▪ Proteomics (蛋白质组学) ▪ Metabolomics (代谢组学)
Structural genomics (结构基因组学)
明确各种蛋白质分子是如 何形成类似于电路的网络的;
描绘蛋白质的精确三维结构,揭 示其结构上的关键部位,如与药物结 合并且决定其活性的部位。
精品课件
10
蛋白质组研究包括两个方面:
Proteomics
表达蛋白组学
The study of global changes in protein expression
1994年由Williams和Wilkins提出,是一个动态的概念, 指的是不同细胞在不同时相表达不同的蛋白质。
精品课件
7
蛋白质组:
对应于基因组的所有蛋白质构成的整体,不是 局限于一个或几个蛋白质。
同一基因组在不同细胞、不同组织中的表达情 况各不相同 。
在空间和时间上动态变化着的整体。
精品课件
蛋白质组学
精品课件
1
背景
基因数量有限性和基因结构的相对稳定性 VS 生命现象的复杂性和多变性 从genomic到proteome
蛋白质同源建模评价

其他几个工具结果:
Verify3D 图像曲线:
除以上常用方法外,Molprobity 除以上常用方法外,Molprobity 也是一 种结构评估方法: Molprobity是个在线模型分析工具,地址 Molprobity是个在线模型分析工具,地址 为: / index.php 几乎所有的蛋白结构在发表之 前都会经过这个工具检测,目前成为结构 生物学中一个比较全面的蛋白结构检测工 具。
步骤一:上传文件 步骤一:上传文件
步骤二:加氢原子 步骤二:
步骤三:开始检测模型
步骤四:选择要分析的参数,一般采用默认 步骤四:选择要分析的参数, 值
第五步:查看结果, 第五步:查看结果,这里有图形分析和具体表格分 析。 图形分析讲形象地告诉你那些部位的残基存在问 题; 表格分析则给出具体残基的编号。
在线评估网址: Errat: Errat:/ERRATv2/ WhatWhat-if: http://swift.cmbi.ru.nl/servers/html/index.html 工具比较全的一个网址: /SAVES/ Molprobity : /i PROCHECK, PROCHECK,WHT_CHECK,ERRAT,VERIF Y_3D,PROVE等几个工具; Y_3D,PROVE等几个工具;
将同源建模所得的pdb文件进行上传,并运行, 将同源建模所得的pdb文件进行上传,并运行,即可得到 所要的结果: 其中ERRAT , 得到的打分值与使用ERRAT 自己的网址的 其中 ERRAT, 得到的打分值与使用 ERRAT自己的网址的 分值是相同的。 分值是相同的。 在这里展示一下单独ERRAT得到的评估结果: 在这里展示一下单独ERRAT得到的评估结果:
Errat平均打分值为91,同源结果打分值为 Errat平均打分值为91,同源结果打分值为 89.3,略微偏低。 89.3,略微偏低。
蛋白质组学PPT课件

代谢性疾病蛋白质组学研究通过对糖尿病、肥胖症等代谢 性疾病相关蛋白质的分析,发现了一些与代谢过程密切相 关的关键蛋白质。这些蛋白质涉及糖代谢、脂肪代谢等多 个方面,为药物研发和个体化治疗提供了新的思路和靶点 。同时,对代谢性疾病蛋白质组学的研究也有助于深入了 解疾病的发病机制,为疾病的预防和治疗提供科学依据。
蛋白质组学揭示基因表达 的复杂性
蛋白质组学研究关注基因表达的最终产物蛋白质,揭示了基因表达的复杂性和多样性 。蛋白质的表达和功能受到多种因素的影响 ,如翻译后修饰、蛋白质相互作用等,这些
因素在基因组学研究中难以全面考虑。
蛋白质组学与代谢组学的关系
代谢组学为蛋白质组学提供上下文
代谢组学研究生物体内小分子代谢物的变化,为蛋白质组学提供了上下文和背景。蛋白 质的功能和表达往往与代谢物的变化相互关联,了解代谢物的变化有助于更深入地理解 Nhomakorabea02
蛋白质组学研究技术
蛋白质分离技术
双向凝胶电泳技术
通过改变电泳的pH值和电场强度, 将复杂的蛋白质混合物分离成多 个有序的蛋白质带,以便后续的 鉴定和分析。
蛋白质芯片技术
将蛋白质固定在固相支持物上, 通过与特定的配体或抗体相互作 用,实现对蛋白质的快速、高通 量筛选和检测。
蛋白质免疫沉淀技
术
利用抗体与目标蛋白质的特异性 结合,将目标蛋白质从复杂的混 合物中分离出来,常用于蛋白质 相互作用的研究。
详细描述
癌症蛋白质组学研究通过对癌症细胞和正常细胞蛋白 质表达谱的比较,发现了一系列与癌症发生发展相关 的关键蛋白质。这些蛋白质涉及细胞信号转导、细胞 周期调控、细胞凋亡等多个方面,为癌症治疗提供了 潜在的药物靶点。
案例二:神经退行性疾病蛋白质组学研究
蛋白质组学PPT课件

.
22
.
23
谢谢!
.
24
蛋白质组学
152310景
• 基因数量有限性和基因结构的相对稳定性 VS 生命现象的复杂性和多变性
• 从genomic到proteome • 对蛋白质的数量、结构、性质、相互关系和生
物学功能进行全面深入的研究,其已成为生命 科学研究的迫切需要和重要任务。
.
2
主要内容
• 一、蛋白质组学的概念 • 二、主要研究内容 • 二、蛋白质组学的发展进展 • 三、蛋白质组学的相关技术及应用
.
16
染色
• 银染法:灵敏度高,可以在电泳图中找到含量较低的蛋 白,所需的上样量较少(每点仅需0.1 ng),可以检测 到小于1ng的蛋白点,但线性范围小于2个最高数量级。 对温度依赖性大,而且需要精确控时的操作
• 考马斯亮兰:灵敏度较低,检测限度约为每点10ng蛋白, 但可以染色多种蛋白质,并能与蛋白量呈两个最高数量 级的线性关系。
.
3
蛋白质组和蛋白质组学的概念
• 蛋白质组(proteome):基因组表达的所有蛋白质。 • 1994年由Williams和Wilkins提出,指的是不同细胞在不同时
相表达不同的蛋白质。 • 对应于基因组的所有蛋白质构成的整体,不是局限于一个或
几个蛋白质。 • 同一基因组在不同细胞、不同组织中的表达情况各不相同 。 • 在空间和时间上动态变化着的整体。
.
11
双向电泳流程图
.
12
样品制备:
样品制备主要包括溶解、变性、还原等步骤, 以充分破坏蛋白质之间的相互 作用, 并同时除去其中的非蛋白质组分如核酸等。
(1) 细胞培养、处理和收集; (2) 将细胞在 IEF 裂解缓冲液中溶解 (3) 将样品离心以去除不溶的细胞碎片和 DNA ,提取上 清, -80 ℃保存。
蛋白质ppt课件

目录
• 蛋白质简介 • 蛋白质的分类 • 蛋白质的合成与分解 • 蛋白质与健康 • 蛋白质的应用
01
蛋白质简介
Chapter
蛋白质的组成
氨基酸
蛋白质是由氨基酸组成的大分子化合物,不同氨基酸按照一定的顺序排列组成 蛋白质。
分类
根据氨基酸组成的不同,蛋白质可以分为单纯蛋白质和结合蛋白质。单纯蛋白 质仅由氨基酸组成,而结合蛋白质则包含氨基酸和其他非氨基酸成分。
01 02 03 04
心血管疾病
适量摄入高质量的蛋白质可以降 低心血管疾病的风险,因为蛋白 质有助于维持健康的血压和血脂 水平。
肥胖症
摄入适量的蛋白质可以增加饱腹 感,减少食欲,有助于控制体重 。
补充蛋白质的方法
食物来源
鱼、肉、蛋、奶制品和豆类是优质蛋 白质的主要来源。此外,坚果、种子 和某些蔬菜也含有丰富的蛋白质。
基因表达
某些基因的表达可影响蛋白质的合成与分解,如 肌肉生长抑制素基因可抑制肌肉蛋白质的合成。
04
蛋白质与健康
Chapter
蛋白质与疾病的关系
癌症
蛋白质摄入不足或质量不佳可能 增加癌症风险,因为蛋白质是细 胞生长和分裂所必需的。
糖尿病
对于糖尿病患者,摄入适量的蛋 白质可以帮助控制血糖和预防并 发症。
蛋白质的结构
一级结构
指蛋白质中氨基酸的排列顺序, 由肽键连接。一级结构决定了蛋
白质的生物活性和功能。
二级结构
指蛋白质分子中局部主链的折叠方 式,如α-螺旋、β-折叠等。二级结 构是蛋白质空间构象的基础。
三级结构
指整条肽链中全部氨基酸残基的相 对空间位置,即整条肽链的三维构 象。三级结构决定了蛋白质的形状 和功能。
SPDBV课件

同源建模初探
• 同源建模是基于同源物结构(实验证明了 的蛋白质结构,并保存在数据库中)对目 标序列进行3D结构模拟的过程。 • 目标序列是将要进行结构模拟蛋白的最初 序列。最初在graphic window以一段长的螺 旋状物质存在。 • 模板是对目标序列进行模拟的参照物。它 的结构已被实验(核磁共振等)证明,并 保存在各大数据库中。
• 例:Color
Secondary Structure
! 软件默认标 记helices为红色、 strands为黄色、 其他二级结构为 灰色。 ! Control Panel右侧Col方 格同时显示颜色 标记的氨基酸残 基
• 例:Color
Secondary Structure Succession
swissmodelswissmodel是expasy专门的蛋白质分析系统免费提供的一种能自动进行同源模拟的服务器同源建模的基本步骤首先注册一个swissmodel的工作空间下载所需的fasta文件用swissmodel的loadrawsequence打开在swissmodel的下拉菜单中选择submittemplatesearchrequestagainstexpdbcurrentlayer稍后出现一个对话框提示blast结果已经发送到你的工作空间登陆工作空间打开相应邮件可看到类似的界面如图运行magicfit以及generatestructuralalignment重叠所选择的模板序列用fitrawsequence指令比对目标序列和已重叠的模板序列生成一个暂时性的3d结构
测量二面角
• 按钮用于测量二面角 • 单击该按钮并选定一个原子,则该原子所 处的氨基酸残基的φ、ω、Ф角的值会依次 显示在信息栏里。
改变图像的显示方式
蛋白质 ppt课件

蛋白质缺乏症
蛋白质缺乏症是指由 于蛋白质摄入不足或 吸收障碍导致的营养 缺乏病。
在儿童中,蛋白质缺 乏症还可能导致生长 发育迟缓、智力发育 不良等。
ቤተ መጻሕፍቲ ባይዱ
症状包括体重减轻、 肌肉萎缩、贫血、免 疫力下降等。
蛋白质过量的危害
01
02
03
04
虽然蛋白质是人体必需的营养 素,但摄入过多也会对健康造
成负面影响。
蛋白质的分类
根据结构
可分为简单蛋白质和结合蛋白质。
根据功能
可分为酶、激素、抗体、载体、血红蛋白等。
蛋白质的结构与功能
结构
蛋白质的结构可分为一级、二级、三级和四级结构。一级结构是指蛋白质中氨基酸的排列顺序;二级 结构是指蛋白质中局部主链的构象;三级结构是指整条肽链中全部氨基酸残基的相对空间位置;四级 结构是指蛋白质分子中各个亚基的空间排布及相互作用。
蛋白质 PPT 课件
目录
CONTENTS
• 蛋白质简介 • 蛋白质的合成与分解 • 蛋白质与疾病 • 蛋白质在生物体内的应用 • 蛋白质研究的前沿与展望
01 蛋白质简介
定义与组成
定义
蛋白质是由氨基酸组成的大分子 有机化合物,是构成细胞和组织 的主要物质之一。
组成
蛋白质由20种不同的氨基酸通过 肽键连接而成,其分子量通常在 10,000道尔顿以上。
高蛋白饮食可能导致肾脏负担 加重,引发肾脏疾病。
过量的蛋白质在体内代谢过程 中会产生大量的氨和尿素,增 加肝脏负担,并可能导致肝病
。
此外,高蛋白饮食还可能引发 肥胖、心血管疾病等健康问题
。
04 蛋白质在生物体内的应用
蛋白质在食品工业中的应用
蛋白质作为食品添加剂
蛋白质结构解析Ppt讲课文档

1、样品制备
大量表达、分离和纯化目标蛋白
一般要求纯度大于97%, 浓度达到5mg/ml以上。
第30页,共117页。
2、蛋白质结晶和晶体生长
蛋白质结晶原理 与小分子结晶一样,蛋白质在溶液中处于 过饱和状态时,分子间可以规则的方式堆 积起来形成晶体析出
第31页,共117页。
蛋白质晶体生长的影响因素
子内层电子在高速运动电子流冲击下,产生跃 迁而发射的电磁辐射。
第11页,共117页。
A
一般由高速电子撞击金属产生。如图所示,是一种产生X射线的真
空管,K是发射电子的热阴极,A是由钼、钨或铜等金属制成的
阳极。两极之间加有数万伏特的高电压,使电子流加速,向阳极A
撞击而产生X射线。
第12页,共117页。
为“X射线” 。
图片出处:
伦琴实验室
第7页,共117页。
人类第一张X光照片
图片出处:
伦琴妻子之手
第8页,共117页。
1896年1月23日伦 琴将这一重大发现在维 尔兹堡物理医学会上报 告。Kolliker教授提议 将该射线命名为“伦琴 射线”,但伦琴却说: “我还没有彻底解释这 种射线的发生现象,还 是称它为X射线最恰当 。”
X射线衍射测定蛋白和核酸精细结构,为新药设计提供了全新方向
中国科学家研制抗癌新药首获瑞典爱明诺夫奖
第27页,共117页。
施一公抗癌抗乙肝病毒新药Birinapant,进入临床二期
第28页,共117页。
蛋白质X射线晶体结构测定程序
1、样品制备 2、蛋白质结晶和晶体生长 3、衍射数据收集和处理 4、位相求解 5、模型建立和修正
蛋白质结构解析Ppt
第1页,共117页。
蛋白质分析和蛋白质组学ppt课件
生物学途径是由分子功能有序地组成的,具有多个 步骤的一个过程。(细胞生长和维持、信号传导 、 嘧啶代谢或α-配糖基的运输 )。
cell division
gluconeogenesis
19
Biological Process
20
lipocalin
21
以树状图形式 显示的GO词汇 之间的关系
22
6
本体(ontology)
计算机科学对自然世界认知的形式化的表示,既是 可被计算机表示,解释和利用的知识的形式化的研 究—即本体 。本体是结构化的领域知识,并可以被 计算机解释和利用 。 实现对生命世界中这些概念理解上的共享,包括从 不同的视角,不同的术语分类, 不同的主体( 人和机 器)共享概念 --概念化的规范 Gene Ontology(GO)协会致力于这样一项工程: 编辑一组动态的而又可控的词汇来描述基因和基 因产物(主要是蛋白质)不同方面的性质。
酶的数目
1003 — — 1076 — 1125 356 156 126
子类的例子
作用于CH-OH基团 作用于醛类或氧络集团 转移—碳基团
38
Functional assignment of proteins: Clusters of Orthologous Groups (COGs)
39
Proteomics: High throughput protein analysis
蛋白质分析和蛋白质组学
DNA
RNA
protein
1
[1] Molecular biology
[3] Protein localization
protein [4] Protein function
蛋白质组学ppt课件

Typical Mass Spectrum
Relative Abundance
aspirin
120 m/z-for singly charged ion this is the mass
Resolution in MS
Resolution in MS
783.455
QTOF
784.465 785.475
2 Unknown masses 1 hit on P21234 3 hits on P12345
Conclude the query protein is P12345
Database search
PeptIdent (ExPasy) Mascot (Matrix Science) MS-Fit (Prospector; UCSF) ProFound (Proteometrics) MOWSE (HGMP)
3: 化学标志法—iTRAQ
iTRAQ法。 1:样本经过不同处置后, 提取蛋白质; 2:蛋白质经过复原,封锁 后胰蛋白酶酶切; 3:肽段混合物分别用不同 的iTRAQ标志; 4:等量混合各种iTRAQ试剂 标志的肽段; 5:MS/MS质谱检测及分析。
4: SILAC
SILAC法。 细胞培育条件下稳定同位素 标志技术(Stable isotope labeling with amino acids in cell culture,SILAC)
450 698
2098 1940 (trp)
500
1000
1500
2000
2500
Query vs. Database
Query Masses Database Mass List Results
蛋白质的通论PPT教案

(二)肽的重要理化性质
1. 熔点高。这说明它和氨基酸一样,是以偶极离 子形式形成离子晶格而存在的。
2. 具有酸碱两性性质和等电点。肽的酸碱性质主 要来自游离末端-NH2和游离末端-COOH以 及侧链R上可解离的基团。每一种肽都有其相应 的等电点。
3. 具有旋光性。这是由于肽中有不对称C原子存 在。一般短肽的旋光度约等于组成该肽中各个 氨基酸的旋光度的总和。但是较长的肽,其旋 光度则不等于其组成氨基酸的旋光度的简单加 和。
N-
(DNP-多肽或DNP-蛋白质)。
末 DNP-多肽在酸性条件下水解,只有N-末端氨基酸为 端 黄色DNP-氨基酸衍生物,其余的都是游离氨基酸。只
(三)天然存在的重要多肽
在生物体中,多肽最重要的存在形式是作为蛋 白质的亚单位。
但是,生物体也有许多分子量比较小的多肽以 游离状态存在。这类多肽通常都具有特殊的生 理功能,常称为活性肽(active peptide)。
如:脑啡肽;激素类多肽;抗生素类多肽;谷 胱甘肽;蛇毒多肽等。
OH
肽键(peptide bond)
0.127nm 键长=0.132nm
0.149nm
肽键的特点是氮原子上的孤对电子与羰基具有 明显的共轭作用。
组成肽键的原子处于同一平面。
肽键平面的形成
肽键
肽键中的C-N键具有部分双键性质, 不能自由旋转。C-N键约有40%的双 键性质,而C-O键具有40%单键性质 。
S
S
S
胰岛素
S
S
HO-CH2-CH2-S-巯H基乙醇
SH
SH
SH
SH
SH
SH
ICH2COOH
SCH2C00H SCH2C00H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
步骤一:上传文件 步骤二:加氢原子
步骤三:开始检测模型
步骤四:选择要分析的参数,一般采用默认 值
第五步:查看结果,这里有图形分析和具体表格分 析。
图形分析讲形象地告诉你那些部位的残基存在问 题;
表格分析则给出具体残基的编号。
以得到的同源建模结果为例: 图形分析结果:
/index.php
点击进入第二个网址,这个网址含有
PROCHECK,WHT_CHECK,ERRAT,VERIF Y_3D,PROVE等几个工具;
将同源建模所得的pdb文件进行上传,并运行,即可得到 所要的结果:
其中ERRAT,得到的打分值与使用ERRAT自己的网址的 分值是相同的。
说明: 途中红色部分为较为严重的过近接触 atom clashes 绿色的为不合理的二面角 紫色的球为不合理的Cb 橘黄色的残基为不合理的rotamer
表格分析:
说明: 点击表格第一行蓝色的各个项,即可现实详细信息 可以看到不合理的几个残基
同源建模模型评估结果
翟耀绪 2019-7-26
modeller同源建模后,使用chimera对模 型做了1500步的最速下降法,得到最终模 型。
在使用该模型前,需要对所得到的模型进 行评估;
最终的同源结构模型需要通过评估来确保其结构的特性符 合其生理生化规律。这包括检验Ф—ψ角度的异常性,键 长,紧密接触面等。另一种检验蛋白质结构模型质量的方 法是固定性考虑这些立体化学特性。这种方法可通过编辑 实验得到的蛋白质结构的空间特性和相互作用能的统计谱, 来发现模型的错误。通过比对统计参数与构建的模型,可 以知道哪些区域折叠正常,哪些是异常的。
在这里展示一下单独ERRAT得到的评估结果:
Errat平均打分值为91,同源结果打分值为 89.3,略微偏低。
Procheck结果:
Procheck所得到的Ramachandran图:
其中红色区域represent the residues in most favoured regions; 黄色区域represent the residues in additional allowed regions; 浅 黄 色 区 域 represent the residues in generously allowed regions;白色区域则是disall区域。
其他几个工具结果:
Verify3D 图像曲线:
除以上常用方法Βιβλιοθήκη ,Molprobity 也是一 种结构评估方法:
Molprobity是个在线模型分析工具,地址 为:
/index. php 几乎所有的蛋白结构在发表之前都会 经过这个工具检测,目前成为结构生物学 中一个比较全面的蛋白结构检测工具。
在线评估网址: Errat:/ERRATv2/
What-if:
swift.cmbi.ru.nl/servers/html/index.html 工具比较全的一个网址:
/SAVES/ Molprobity :
常用的评估程序有:Procheck 检测常用生理化学参数; WHAT IF 检验化学正确性;ANOLEA 使用统计算的方法; Verify3D Verify3D 使用统计计算的方法。
注意 ANOLEA 和Verify3D 虽然都使用统计方法,但它 们的阈值不同,并且分数高低代表的含义也不同: ANOLEA 分数越低模型越正确,而Verify3D 中分数越高 越正确。
