电解质溶液知识的图像问题
专题21电解质溶液图像分析(学生版)高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)

专题21 电解质溶液图像分析目录一、热点题型归纳.....................................................................................................................1 【题型一】溶液稀释图像............................................................................................................1 【题型二】水电离度图像............................................................................................................3 【题型三】物质滴定曲线............................................................................................................5 【题型四】浓度比型图像............................................................................................................7 【题型五】分布系数图像............................................................................................................9 二、最新模考题组练 (11)【题型一】溶液稀释图像【典例分析】【典例1】(河南省名校联盟2021~2022学年高三3月联考)常温时,浓度均为1mol ·L -1的CH 3NH 2和NH 2OH 两种碱溶液,起始时的体积都为10mL 。
2022年高考化学总复习第四篇突破思维障碍必须掌握的技法规律2电解质溶液常考图像问题解题策略

2.电解质溶液常考图像问题解题策略1.以酸碱中和滴定图像为载体【例1】常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1CH3COOH溶液所得滴定曲线如图1。
下列说法正确的是()A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)【解析】选D。
点①溶液中的溶质为0.001 mol CH3COOH和0.001 mol CH3COONa,根据物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+),根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),整理后得c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),A错误;点②溶液的pH=7,根据电荷守恒有c(Na+)+c(H+)=c(CH3COO-)+c(OH-),又因为c(H+)=c(OH-),则c(Na+)=c(CH3COO-),B错误;点③溶液中的溶质为0.002 mol CH3COONa,离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),C错误;滴定初期加入少量NaOH溶液时,溶液中溶质为CH3COOH(大量)、CH3COONa(少量),存在c(CH3COOH)>c(CH3COO-),根据电荷守恒,滴定过程中可以出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),D项正确。
方法小结:常见的酸碱中和滴定图像解题方法:抓五点、看溶质、判强弱、先电离、后水解、定离子、恒电荷、判性质、比大小。
化学易错题专题训练一电解质溶液图像含解析

电解质溶液图像【错题纠正】例题1、以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20。
00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如图所示。
[比如A2−的分布系数:δ(A2-)=c(A2-)]c(H2A)+c(HA-)+c(A2-)下列叙述正确的是A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1。
0×10−2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)【解析】根据图像,曲线①代表的粒子的分布系数随着NaOH的滴入逐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入逐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,第二步部分电离,曲线①代表δ(HA-),曲线②代表δ(A 2—),根据反应2NaOH+H 2A=Na 2A+2H 2O ,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0。
1000mol/L,据此分析作答。
A .根据分析,曲线①代表δ(HA —),曲线②代表δ(A 2-),A 错误;B .当加入40。
00mLNaOH 溶液时,溶液的pH 发生突变,说明恰好完全反应,结合分析,根据反应2NaOH+H 2A=Na 2A+2H 2O,c (H 2A)=0.1000mol/L ×40mL 2×20.00mL =0.1000mol/L ,B 错误;C .根据曲线当δ(HA -)=δ(A 2—)时溶液的pH=2,则HA —的电离平衡常数K a =c(A 2-)⋅c (H +)c (HA -)=c (H +)=1×10—2,C 正确;D .用酚酞作指示剂,酚酞变色的pH 范围为8.2~10,终点时溶液呈碱性,c (OH —)>c (H +),溶液中的电荷守恒为c (Na +)+c (H +)=2c (A 2-)+c (HA —)+c (OH -),则c (Na +)>2c (A 2—)+c (HA -),D 错误;答案选C 。
06电解质溶液的图像分析——对数曲线
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O )>0
C.若c(HC2O )>c(C2O )>c(H2C2O4),则pH范围为3.5<pH<5
D.NaHC2O4溶液中:c(H+)+c(C2O )=c(H2C2O4)+c(OH-)
4.25 ℃时,向0.1 mol·L-1HX溶液中逐渐加入NaOH固体,恢复至原温度后lg 与pH的关系如图所示(忽略溶液体积变化),下列有关叙述不正确的是()
C.c(HPO )=c(H3PO4)时,pH=4.68
D.Na2HPO4溶液中:c(OH-)+c(PO )=c(H+)+c(H2PO )+c(H3PO4)
6.25℃时,向1 Lc(HA)+c(A-)=0.1 mol·L-1的溶液中滴加盐酸或NaOH溶液,溶液中的H+、OH-、A-及HA的浓度的对数值lgc(X)与pH的关系如图所示(不考虑溶液温度变化),下列说法正确的是()
A.Ka(HA)的数量级为10-5
B.滴加NaOH溶液过程中, 保持不变
C.m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D.n点所示溶液中:c(Na+)=c(A-)+c(HA)
6.草酸(H2C2O4)是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合溶液中lgX[X表示 或 ]与pH的变化关系如图所示。下列说法不正确的是()
A.L1表示是溶液pH与lg 的关系
B.当混合溶液呈中性时: <
C.加入20 mL NaOH溶液时:c(Na+)+c(OH-)>c(X-)+c(Y-)+c(HX)+c(HY)+c(H+)
D.25℃时,0.1 mol·L-1的NaOH溶液与cmol·L-1的HY溶液等体积混合呈中性,则c=0.1
命题角度三 电解质溶液图像的综合判断

5.(2019·全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫 化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说 法错误的是( B )
A.图中 a 和 b 分别为 T1、T2 温度下 CdS 在水中的溶解度 B.图中各点对应的 Ksp 的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C.向 m 点的溶液中加入少量 Na2S 固体,溶液组成由 m 沿 mpn 线向 p 方向移动 D.温度降低时,q 点的饱和溶液的组成由 q 沿 qp 线向 p 方向移动
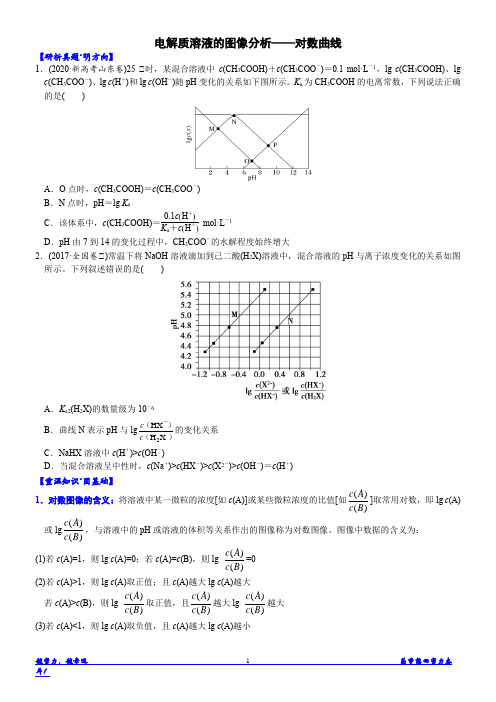
A.O 点时,c(CH3COOH)=c(CH3COO-) B.N 点时,pH=lgKa C.该体系中,c(CH3COOH)=K0a.+1ccHH++mol·L-1 D.pH 由 7 到 14 的变化过程中, CH3COO-的水解程度始终增大
【解析】 分析题图可知,N 点为 lgc(CH3COOH)与 lgc(CH3COO-)随 pH 变化曲线 的交点,此时 c(CH3COOH)=c(CH3COO-),Ka=cCcHC3CHO3COO-O·cHH +=c(H+),pH=- lgc(H+)=-lgKa,A、B 错误;题目中 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1,则 c(CH3COO-)=0.1 mol·L-1-c(CH3COOH),Ka=cCcHC3CHO3COO-O·cHH +,解得 c(CH3COOH) =K0a.+1ccHH++ mol·L-1,C 正确;pH 由 7 到 14 过程中,溶液中 c(OH-)逐渐增大,对 CH3COO -的水解平衡(CH3COO-+H2O CH3COOH+OH-)有抑制作用,故 CH3COO-的水解程 度不可能始终增大,D 错误。
发展素养(十四) 证据推理——电解质溶液的图像分析-2024 全品选考复习方案 化学

)
−
弱酸草酸的Ka1= (H2 C2 O4 )
>Ka2= (HC2 O4 )
,当溶液的
(HC2 O−
4)
lg
+
pH 相同时, c(H ) 相同,lg X:a
b,则a表示 (H2 C2O4 ) 与
>
(C2 O2−
4 )
lg
pH的变化关系,b表示 (HC2O−4 ) 与pH的变化关系
⇌
NH2CH2COO-+H+的平衡常数K'=10-9.78,
−
COO )
−9.78
10
(NH2 CH2
′
=
=
+
(NH3 CH2 COO− ) (H+ ) (H+ )
+
(NH3 CH2 COOH)
−)
(NH+
CH
COO
2
3
,则
−
COO )
−11.65
10
−9.78
10
(NH2 CH2
· +
c(CH3COOH)=c(CH3COO 势;当pH>4.2时,
-),即pH=pK
a
2−
C2O4 为主要存在形式
三元酸(以H3PO4为例)
当溶液的pH=2时
δ0=δ1,pH=7.1时
δ1=δ2,pH=12.2时δ2=δ3;当
pH<2时,H3PO4占优势;当
−
2<pH<7.1时,H2PO4 占优势;
当7.1<pH<12.2时,
若c(A)>c(B),则lg
(A)
(B)
(完整版)有关电解质溶液图像题的解题技巧Word版无答案

有关电解质溶液图像题的解题技巧解析解答此类图像问题要注意几点:①读图,弄清图像含义,经过观察弄清横坐标、纵坐标的含义及单位;搞清特别点的意义,如坐标轴的原点,曲线的起点、终点、交织点、极值点、转折点等;解析曲线的变化趋势如斜率的大小及起落。
②识图,进行信息提取,挖掘隐含信息、消除搅乱信息、提炼适用信息,在统摄信息的基础进步行逻辑推理或运用数据计算。
③用图,联想化学原理解答问题。
定―→ 要点点―→ 曲线图像问题解析—原因解析变――→曲线走势计算推理――→ 浓度等关系纵观历年高考试题,电解质溶液图像题越来越碰到命题者的喜欢。
题型一强、弱电解质加水稀释的变化曲线【解题策略】本质――→ 弱电解质在水溶液中电离程度不相同图像――→ pH 变化幅度大小强、弱电―→ 弱电解质盐溶液酸碱性变化解质加—水稀释延伸―→ 判断弱电解质强弱的方法弱酸溶液中加入强碱、强酸或水后―→的 pH 变化1室温下,将 10.00 mL 5.000 0 mol L -1醋·酸滴入 100.00 mL蒸馏水中,溶液中 c(H + )和温度随着醋酸体积变化曲线以下列图。
以下有关说法正确的选项是()A . a~ b 段,醋酸电离过程为放热过程B. c~ d 段, c(H +)增加,醋酸电离度增加C. c 点时,加入等体积等浓度的NaOH溶液则: c(Na+ )=c(CH 3COO -)+c(CH 3COOH)D. d 点时, c(H +3)>c(CH COOH)式题在体积均为 1 L ,pH 均等于 2 的盐酸和醋酸中,分别投入0.12 g 镁粉充分反应后,图中比较吻合反应事实的曲线是()题型二中和滴定曲线【解题策略】1.思路解析识图像:抓住坐标含义,理解点(起点、折点、―→ 中和 滴定 —图像找联系:将图像的点、线与溶液的酸碱性―→ 和pH 整合―→ 思原理:电荷守恒、物料守恒、质子守恒2.巧抓“四点”,打破“粒子”浓度关系(1) 抓反应“一半”点,判断是什么溶质的等量混杂。
高中化学二轮复习电解质溶液选择题通关六离子平衡图像的分析与应用

2.(酸碱中和反应曲线)常温下,用 0.100 mol·L-1 的 NaOH 溶液分别滴定 20.00 mL 0.100 mol·L-1 的盐酸和 0.100 mol·L-1 的醋酸,得到两条滴定曲 线,如图所示: 下列说法正确的是( ) A.滴定盐酸的曲线是图 2 B.两次滴定均可选择甲基橙或酚酞做指示剂
酸碱中和滴定图像分析
氢氧化钠溶液滴定等浓度等体积 盐酸滴定等浓度等体积的氢氧化
的盐酸、醋酸的滴定曲线
钠溶液、氨水的滴定曲线
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴 定强碱、弱碱的曲线,强碱起点高 突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变 化范围大于强碱与弱酸反应(强酸与弱碱反应) 室温下 pH=7 不一定是终点:强碱与强酸反应时,终点是 pH=7; 强碱与弱酸(强酸与弱碱)反应时,终点不是 pH=7(强碱与弱酸反应 的终点是 pH>7,强酸与弱碱反应的终点是 pH<7)
C.物质的量浓度c= = = mol/L,故C错误;
A.曲线①代表 δ(H A),曲线②代表 δ(HA ) 1【2.详下 解列】离综子合方分程析式工不艺正流确程的图是可知,试剂X只能是氢氧化钠溶液,Al2O3溶于氢氧化钠溶液得到NaAlO2-溶液,Fe2O3与氢氧化钠溶液不反应,所以反应①、过滤后所得溶液乙为
(4)①+6价的Cr具有氧化性,能氧化碘离子,生成单质碘,则BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式为2BaCrO4+6I-+16H+=3I2+2Ba2++2Cr3++8H2O;
【解析】
2-
比如A 的分布系数:δ(A )= c(A ) 1试,0.题所已分 以知析关某:闭+2①所价煤有离、化子2石工的-油企电等业子燃是排料不布的现式燃实为烧的1s产,22生不s2二符2p氧合6,化题该硫意元等.素有错在害误周气;期体③表,提中开倡所发使2属-新用的能一族源次是,性减发少泡矿塑物料燃餐料具的和燃塑烧 料,袋也,就会减造少成了白污色染污物染的,排不放符,合符题-合意题.意错.误正;确④;废②旧现电代池社属2会于-很电多子的污产染品,来开自发化生工产
专题7-电解质溶液图像题

专题7-电解质溶液图像题真题演练1. 【2021广东选择考适应性测试9】. 叠氮酸(HN 3)与NaOH 溶液反应生成NaN 3。
已知NaN 3溶液呈碱性,下列叙述正确的是A. 0.01 mol·L -1HN 3溶液的pH=2 B. HN 3溶液的pH 随温度升高而减小 C. NaN 3 的电离方程式: NaN 3= Na ++3N 3-D. 0.01 mol·L -1 NaN 3溶液中: c (H +)+ c (Na + )= c (N 3-)+ c (HN 3) 【答案】B【解析】A .由题意,NaN 3溶液呈碱性,叠氮酸根(N 3-)会发生水解,说明HN 3为弱酸,在水溶液中不能完全电离,故0.01 mol·L -1 HN 3溶液的pH>2,A 错误;B .HN 3为弱酸,电离方程式为HN 3=H + +N 3-,电离是吸热过程,升高温度促进HN 3的电离,c (H +)增大, pH 减小,B 正确;C .NaN 3是强电解质,完全电离出Na +和N 3-,电离方程式为 NaN 3= Na ++ N 3-,C 选项错误;D .0.01 mol·L -1 NaN 3溶液中:由物料守恒 c (Na +)= c (N 3-)+ c (HN 3),故D 错误。
2.2.【2021重庆市学业水平选择性考试13】 草酸H 2C 2O 4是二元弱酸。
向100 mL 0.40 mol/L H 2C 2O 4溶液中加入1.0 mol/L NaOH 溶液调节pH ,加水控制溶液体积为200 mL 。
测得溶液中微粒的δ(x)随 pH 变化曲线如图所示,δ(x)=-2-2242424c(x)c(H C O )+c(HC O )+c(C O ),x 代表微粒H 2C 2O 4、HC 2O -4或C 2O 2-4。
下列叙述正确的是A. 曲线Ⅰ是HC 2O -4的变化曲线 B. 草酸H 2C 2O 4的电离常数K= 1.0×10-1.22C. 在 b 点,c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +) D. 在c 点,c(HC 2O -4)=0.06 mol/L 【答案】B【解析】A .当酸性越强时,曲线Ⅰ表示的微粒的含量越高,可推知曲线Ⅰ是H 2C 2O 4的变化曲线,曲线Ⅱ是HC 2O -4的变化曲线,曲线Ⅲ是C 2O 2-4的变化曲线,A 错误;B .在a 点H 2C 2O 4的浓度和HC 2O -4的浓度相等,pH=1.22,则草酸H 2C 2O 4的电离常K =()()()-24224c HC O ?c H c H C O+=()c H +=10-1.22,则B 正确;C .在 b 点,c(C 2O 2-4)= c(HC 2O -4),且溶液呈酸性,若c(C 2O 2-4)+2c(OH -)= c(HC 2O -4)+c(H +),则2c(OH -)= c(H +),显然不成立,C 错误;D .在c 点,HC 2O -4的含量为0.15,而H 2C 2O 4的物质的量为0.1L× 0.40 mol/L=0.04 mol,则HC 2O -4的物质的量为0.15×0.04 mol=0.006 mol,溶液体积为0.2L ,c(HC 2O -4)=0.006 mol÷0.2L=0.03 mol/L,D 错误。
高考化学专题复习电解质溶液中微粒变化图像题课件

) )
-
得意时应善待他人,因为你失意时会需要他们。
a
丈夫志不大,何以佐乾坤。
加入NaOH,促进电2-离,Ka不变
+
c(A )·c(H ) 图中a点与b点Ag2CrO4溶度积相等
+
-2
=c(H )=1.0×10 ,C 项正确;滴定终点时溶液中存在的离子有 根据图中pH数据,图中A、B、-C、D、E、F各点对应的溶液中水的电离程度大小顺序图示:
2.(2019·课标全国Ⅰ,11)NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1= 1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图所示, 其中b点为反应终点。下列叙述错误的是( ) A.混合溶液的导电能力与离子浓度和种类有关 B.Na+与A2-的导电能力之和大于HA-的 C.b点的混合溶液pH=7 D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
项正确;cc((HXX2--))=1
时,即
c(X2-) lgc(HX-)
=0,pH=5.4,c(H+)=1×10-5.4 mol·L-1,Ka2=c(Hc(+)H·cX(-)X2-)≈1×10-5.4,A 正
确;NaHX 溶液中,c(HX-)>c(X2-),即cc((HXX2--))<1,lgcc((HXX2--))<0,此时溶液呈酸
人生各有5志.(。2017·课标全国Ⅰ,13)常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液
雄追心踪壮 着志鹿是的的茫猎茫人p黑是H夜看中不与的见北山离斗的星。子。 浓度变化的关系如图所示。下列叙述错误的是(
)
志正则众邪不生。
鹰爱高飞,鸦栖一枝。
A.K (H X)的数量级为 男儿不展同云志,空负天生八尺躯。
电解质溶液图像专题-例题+练习

电解质溶液图像专题电解质溶液的图像题,从知识载体的角度看:一可用于考查溶液中离子浓度的大小比较;二可考查溶液中离子浓度的守恒问题;三可考查有关电解质溶液的各种计算;四可结合生产和生活实际考查分离和提纯等具体的化学应用问题。
常见的图像题类型:1.pH(或pOH)—体积的变化曲线2.微粒分布分数(或系数)—pH(或pOH)的变化曲线3.浓度—浓度的变化曲线4.对数的变化曲线5.导电能力(或电导率) —体积(或浓度)变化曲线【练1】分布分数图:可以表示溶液中各种组分随pH的变化而变化的曲线。
1.25℃,c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。
下列有关离子浓度关系叙述正确的是()A.pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.W点表示溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)C.pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1D.向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(Na+)+c(H+)=c(CH3COOH)+c(OH-) +c(Cl-)2.草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O4-、C2O42-,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:(1)图中曲线1表示的分布系数变化;曲线3表示的分布系数变化.现有物质的量浓度均为0.1mol/L的下列溶液:①Na2C2O4 ②NaHC2O4 ③H2C2O4 ④(NH4)2C2O4 ⑤NH4HC2O4 已知NaHC2O4溶液显酸性.(2)Na2C2O4溶液中,c(Na+)/c(C2O42-) 2 (填“>”、“=”、“<”),原因是(用离子方程式表示).(3)常温下,向10mL 0.1mol/L H 2C 2O 4溶液中滴加0.1mol/L NaOH 溶液,随着NaOH 溶液体积的增加,当溶液中c (Na +)=2c (C 2O 42-)+c (HC 2O 4-)时,溶液显 性(填“酸”、“碱”或“中”),且V (NaOH ) 10mL (填“>”、“=”或“<”).(4)下列关于五种溶液的说法中,正确的是A .溶液②中,c (C 2O 42-)<c (H 2C 2O 4)B .溶液②中,c (H 2C 2O 4)+c (OH -)=c (C 2O 42-)+c (H +)C .溶液④⑤中都符合c (NH 4+)+c (H +)=c (HC 2O 4-)+2c (C 2O 42-)+c (OH -)D .五种溶液都符合c (H 2C 2O 4)+c (HC 2O 4-)+c (C 2O 42-)=0.1mol ·L -1.(5)五种溶液中c (H 2C 2O 4)由大到小排列的顺序是具体解法:“四看三联系一注意”:四看:(1)先看图像的面与线,面要看横坐标和纵坐标的含义,线要看各组分浓度随pH 的变化趋势(2)再看图像的点,点要看起点,终点和交点对应的pH(3)点还要看最高点和最低点对应的pH 和各组分存在的pH 范围(4)最后看各条曲线相互重叠程度的大小三联系: 找出某个pH 对应的成分后再联系电离平衡和水解平衡的规律进行判断;一注意: 答题时还要特别注意在图表中没有提供的信息或潜在信息。
高三化学二轮复习:电解质溶液图像类题目分析课件

NaHA Na2A H2A
4.沉淀溶解平衡曲线 (1)“曲线”溶解平衡图像的分析
BaSO4(s) Ba2+(aq)+SO42-(aq)
基本图像
AgCl(s)
Ag+(aq)+Cl-(aq)
Ksp(AgCl) = c(Ag+)×c(Cl-)
→
线上的任意点为平衡点,Ksp不变
对数直线图
MgCO3(s)
K2 HR K3 R-。向一定浓度的 H3RCl2 溶液中滴加 NaOH 溶液,溶液中 H3R2 + 、 H2R + 、 HR 和 R - 的 分 布 系 数 δ(X) 随 pH 变 化 如 图 所 示 。 已 知 δ(X) =
cH3R2++cH2cR+X+cHR+cR-,下列表述正确的是 A.KK21>KK32 B.M 点,c(Cl-)+c(OH-)+c(R-)=2c(H2R+)
SO24-(aq)的平衡常数 K=KKssppSSrrCSOO43 B.a=-6.5 C.曲线④代表含SrCO3(s)的1.0 mol·L-1
Na2CO3溶液的变化曲线
√D.对含SrSO4(s)且Na2SO4和Na2CO3初始浓度均为1.0 mol·L-1的混合溶液,pH
≥7.7时才发生沉淀转化
2.(2022·湖南,10)室温时,用0.100 mol·L-1的标准AgNO3溶液滴定15.00 mL 浓度相等的Cl-、Br-和I-混合溶液,通过电位滴定法获得lg c(Ag+)与 V(AgNO3)的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离 子浓度小于1.0×10-5 mol·L-1时,认为该离子沉淀完全。Ksp(AgCl)= 1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17)。下列说法正确 的是 A.a点:有白色沉淀生成 B.原溶液中I-的浓度为0.100 mol·L-1
电解质溶液的图像分析(原卷版)-高中化学

微考点 电解质溶液的图像分析目录 (1)1.高考真题考点分布 ................................................................................................................................... 1 2.命题规律及备考策略 . (1) (2)考法01 电解质溶液微粒变化图像............................................................................................................ 2 考法02 沉淀溶解平衡图像 .. (9) (15)1.高考真题考点分布【命题规律】高频考点从近几年全国高考试题来看,酸碱中和滴定、沉淀滴定、沉淀溶解平衡曲线、中和滴定曲线、对数曲线等仍是高考命题的热点。
【备考策略】【命题预测】预计2025年高考会以新的情境载体考查沉淀溶解平衡曲线、中和滴定曲线、对数曲线、分布曲线等知识,考查数形结合能力、信息整合能力,题目难度一般较大。
考法01 电解质溶液微粒变化图像1.滴定曲线特殊点的分析(1)强酸与强碱滴定过程中pH曲线(以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1盐酸为例)(2)强酸(碱)滴定弱碱(酸)pH曲线比较氢氧化钠滴定等浓度等体积的盐酸、醋酸的滴定曲线盐酸滴定等浓度等体积的氢氧化钠、氨水的滴定曲线曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应)案例:常温下,用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液所得滴定曲线如图:(3)pH—V 图 各特殊点粒子大小关系及变化趋势 点 溶质 离子浓度大小比较A CH 3COOHB(1∶1) CH 3COOH 、H 3COONa C(pH =7) CH 3COOH 、CH 3COONa D CH 3COONa E(2∶1) CH 3COONa 、NaOH F(1∶1)CH 3COONa 、NaOH(4)各特殊点对水电离程度的影响分布系数图及分析【分布曲线是指以pH 为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线】一元弱酸(以CH 3COOH 为例)二元弱酸(以草酸H 2C 2O 4为例)δ0为CH 3COOH 分布系数,δ1为CH 3COO -分布系数δ0为H 2C 2O 4分布系数、δ1为HC 2O -4分布系数、δ2为C 2O 2-4分布系数1.随着pH 增大,溶质分子浓度不断减小,离子浓度逐渐增大,酸根离子增多。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题一电解质溶液知识的图像问题电解质溶液知识的综合应用是高考必考的热点之一,近几年来,以图像问题分析考查电解质溶液的题目频频出现。
考查知识主要涉及:电离平衡和水解平衡、酸碱混合液pH的变化,溶液中微粒浓度的大小比较、溶液的导电性变化、水的离子积、水的电离程度变化等。
侧重考查考生数形结合、提炼关键信息等综合分析能力、数据处理与计算能力、知识的迁移应用能力。
顺利解答该类试题要注重以下两点:1.“有序思维”破解弱(强)酸与强(弱)碱混合的若干问题向弱酸(或强酸)溶液中逐滴滴入强碱(或弱碱)溶液,离子浓度、pH有一定的变化规律。
现以向CH3COOH溶液中逐滴加入NaOH溶液为例进行分析,以能够对该类试题有一个整体把握。
上图一目了然,可以很清楚地得出不同情况下溶液中的pH、离子浓度的关系。
2.掌握电解质溶液中微粒浓度大小判断的方法思路【解题技巧】抓“四点” 巧析酸碱混合或滴定图像题(1)抓反应“一半”点,判断是什么溶质的等量混合。
(2)抓“恰好”反应点,生成什么溶质,溶液呈什么性,是什么因素造成的。
(3)抓溶液“中性”点,生成什么溶质,哪种反应物过量或不足。
(4)抓反应“过量”点,溶质是什么,判断谁多、谁少还是等量。
【例题1】、25 ℃时,将0.1 mol ·L -1NaOH 溶液加入20 mL 0.1 mol ·L -1CH 3COOH 溶液中,所加入溶液的体积(V )和混合液的pH 的关系曲线如图所示。
下列结论正确的是( )A.①点时,c (CH 3COO -)+c (CH 3COOH)=c (Na +)B.对曲线上①、②、③任何一点,溶液中都有:c (Na +)+c (H +)=c (OH -) +c (CH 3COO -)C.③点时,醋酸恰好反应完,溶液中有:c (CH 3COO -)=c (Na +)>c (H +)=c (OH -)D.滴定过程中可能出现:c (H +)>c (Na +)>c (CH 3COO –)>c (OH –)【例题2】.(2017新课标1)常温下将NaOH 溶液添加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A .K a2(H 2X )的数量级为10-6B .曲线N 表示pH 与2(HX )lg (H X)c c 的变化关系C .NaHX 溶液中c(H +)>c(OH -)D .当混合溶液呈中性时,c(Na +)>c(HX -)>c(X 2-)>c(H +)=c(OH -)【例题3】.(2016新课标1)298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L -1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是( )A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0 mLC.M点处的溶液中c(NH+4)=c(Cl-)=c(H+)=c(OH-)D.N点处的溶液中pH<12【例题4】、(2015·全国卷Ⅰ)浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg VV0的变化如图所示。
下列叙述错误的是( ) A.MOH的碱性强于ROH的碱性B.ROH的电离程度:b点大于a点C.若两溶液无限稀释,则它们的c(OH-)相等D.当lg VV0=2时,若两溶液同时升高温度,则c M+c R+增大【例题5】.25℃时,将浓度均为0.1mol·L-1、体积分别为V a和V b的HA溶液与BOH溶液按不同体积比混合,保持V a+V b=100mL,V a、V b与混合液pH的关系如图所示。
下列说法正确的是A .K a (HA)=10-6mol ·L -1B .b 点时,c(B +)=c(A -)+c(HA) C .c 点时,)()()(HA c OH c A c ⋅--随温度升高而减小D .a →c 过程中水的电离程度始终增大 【巩固练习】1.常温下,向20 mL 某浓度的硫酸溶液中滴入0.1 mol ·L -1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图。
下列分析正确的是( )A .V=40B .c 点所示溶液中:c(H +)-c(OH -)=2c(NH 3·H 2O) C .d 点所示溶液中:c(NH 4+)=2c(SO 42-) D .NH 3·H 2O 的电离常数K=10-4mol ·L -12.某温度下,向一定体积0.1 mol/L 的氨水中逐滴滴加0.1mol/L 的盐酸,溶液中pH 与pOH[注:pOH =-lgc (OH -)]的变化关系如右图所示,则下列说法中错误的是( )A .M 点所示溶液中c( NH 4+)>c (Cl -) B .Q 点所示溶液的导电熊力强于M 点 C.Q 点消耗盐酸的体积等于氨水的体积 D .M 点和N 点所示溶液中水的电离程度相同3..电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随溶液体积变化的曲线如图所示。
下列说法正确的是()A.I表示NaOH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH:b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.a点水电离出的n(H+)大于c点水电离出的n(H+)4.某温度下,体积和pH都相同的盐酸和醋酸溶液加水稀释时的PH变化曲线如下图②所示,下列判断正确的是( )A.a、c两点溶液的导电能力相同B.醋酸的浓度为1.0×10-4mol•L‾1C.用等浓度NaOH溶液中和等体积b、c处溶液反应,消耗NaOH溶液体积V b=V。
D.a、b、c三点溶液水的电离程度a<b=c5.(2015·高考山东卷)室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
下列说法正确的是( )A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA)6.浓度均为0.1 mol·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg VV0的变化关系如图所示。
下列叙述正确的是( )A.HX、HY都是弱酸,且HX的酸性比HY的弱B.常温下,由水电离出的c(H+)·c(OH-):a<bC.lg VV0=3时,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则c(X-)c(Y-)减小D.相同温度下,电离常数K(HX):a>b7.25o C时,2amol·L-1氢氟酸水溶液中,用NaOH溶液调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如下图所示。
下列说法正确的是A.当pH=3时,溶液中c(F一)<c(Na+)B.当c(F一)>c(HF)时,溶液一定呈碱性C.当pH=3.45时,所加NaOH溶液恰好与HF完全反应D.当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2amol·L-18.常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1的CH3COOH 溶液和HCN溶液,滴定曲线如图所示。
下列说法不正确的是( )A.点①溶液的c(CN-)<点②溶液的c(CH3COO-)B.点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)C.点③溶液中,c(OH-)=c(H+)+c(CH3COOH)D.在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H +)>c(OH-)9.常温下,将0.20 mol·L-1H2X溶液与0.20 mol·L-1 NaOH溶液等体积混合,所得溶液pH=3.6,继续滴加NaOH溶液至pH=4.0时,部分粒子浓度如图所示。
下列说法错误的是( )A.图中a代表Na+,d代表H2X分子B.H2X为二元弱酸,HX-的电离程度大于水解程度C.混合溶液pH=3.6时:c(H+)+c(H2X)=c(X2-)+c(OH-)D.继续滴加NaOH溶液至pH=7.0时:c(Na+)>c(HX-)+2c(X2-)10.(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:(1)________________________________________________________________________ 。
(2)乙组混合溶液中c(A-)和c(Na+)的大小关系是________。
A.前者大B.后者大C.二者相等D.无法判断(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是________________________________________________________________________。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=________ mol/L。
(Ⅱ)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:(1)NH4Al(SO4)2可作净水剂,其理由是________________________________________________________________________ ________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH+4)________(填“等于”“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH+4)。
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
