SOPQC-CP014-00 地塞米松检验操作规程
地塞米松抑制试验常规

地塞米松抑制试验常规【护理评估】1.评估患者对地塞米松抑制试验了解程度2.评估患者是否做好试验准备。
(1)有急性感染、溃疡病急性期,不宜做本试验。
(2)试验前1周停用雌激素、ACTH、肾上腺皮质激素以及苯妥英钠、苯巴比妥、卡马西平等药物,以免影响试验结果。
3.检查试验用地塞米松药物是否准备。
4.检查留取24小时尿的容器及10ml浓盐酸防腐剂是否准备,并注明留尿日期。
【操作步骤】1.试验前向患者解释试验目的及注意事项,以取得患者的理解和合作。
2.遵医嘱准确进行不同要求的地塞米松试验。
(1)小剂量地塞米松试验(地塞米松总量为2mg)1)在口服地塞米松前一日上午800和下午16:00,分别采静脉血测血浆皮质醇,同时留取24小时尿测17-羟皮质类固醇(17OHCS)作对照。
2)试验日口服地塞米松0.5mg,每6小时1次,连服24小时。
服药第2日始再留24小时尿液测17-羟或游离皮质醇,第3日采血测血浆皮质醇。
(2)大剂量地塞米松试验(地塞米松总量为8mg):如果小剂量试验阴性,提示存在皮质醇增多症,进一步采用大剂量法鉴别为增生或肿瘤。
方法同前,但口服地塞米松剂量为2mg,每6小时1次,连服48小时。
(3)过夜地塞米松试验(午夜1次法)1)收集试验前一日夜24:00至次夜24:00的尿作17OHCS对照。
2)试验日上午8:00采血测血浆皮质醇作为对照;夜间24:00服地塞米松1mg,次晨8:00再采血测血浆皮质醇。
3.采取标本后及时送检。
【健康指导】1.交待患者留取尿标本期间必须连续收集全部尿液。
2.告知患者试验期间,不得远离试验区,以免影响服药及采集血标本。
地塞米松生产工艺验证文件

山东泰华生物科技有限公司GMP文件验证文件山东泰华生物科技有限公司2019年XX月验证方案起草、审查与批准6.验证方案起草、审核与批准6.1验证方案起草6.2 再验证方案审核6.3 再验证方案批准1. 验证概述2. 验证目的3. 验证范围4. 再验证依据标准5. 机构与职责5.1 验证机构5.2 验证职责6. 验证方式7. 验证准备7.1 设备设施准备7.2 仪器试剂准备7.3 原辅物料准备7.4 文件与培训7. 验证时间与计划8. 验证实施9.1 产品的工艺流程图9.2产品的工艺验证:9.2.1称量备料9.2.1.1目的9.2.1.2文件9.2.1.3检查项目及结果9.2.2 配制9.2.2.1 目的9.2.2.2 文件9.2.2.3 评估项目9.2.2.4 评估方法9.2.2.5 取样方法9.2.2.6配制试验数据9.2.3 灌装封尾9.2.3.1 目的9.2.3.2文件9.2.3.3评估项目9.2.3.4评估方法9.2.3.5灌装封尾检查数据9.2.4 成品抽样检验9.2.4.1 目的9.2.4.2 文件9.2.4.3 评估项目9.2.4.4 评估方法9.2.4.5产品检验报告复印件10. 偏差与处理.11. 结果与分析11.1 验证数据汇总(下表视情况修改)11.2 存在问题与措施11.3 风险与预防(本次验证活动确认后依然存在的风险)12. 验证结论12.1 验证结论12.2 验证评价与建议13. 验证周期14. 附件15.参考或引用文件1.概述:复方醋酸地塞米松乳膏为我司生产多年的乳膏剂品种,自10版GMP认证以来,地塞米松原料药生产线生产所用关键设备、生产工艺及工艺参数没有改变,为了验证在正常的生产条件和GMP文件管理体系下能生产出符合预定的规格及质量标准的产品,根据验证管理文件的要求,我们对醋酸地塞米松的生产工艺进行验证。
2.目的:在现行的GMP文件管理体系下,生产三批地塞米松原料药进行工艺验证: (1)确认关键工序质量监控点是否符合质量要求;(2)确认该产品质量是否符合预定成品的标准。
大剂量、小剂量地塞米松抑制试验怎么用?库欣综合征的诊断试验,这篇全了!

大剂量、小剂量地塞米松抑制试验怎么用?库欣综合征的诊断试验,这篇全了!从前念书时,库欣综合征的这堆试验就很令人头大,时至今日,依旧是很多同学的心头大患,今天就让我们跟着张艺医生,通过一个病例,学习一下吧~病例概要患者男,32 岁,农民,2 年前无明显诱因出现血压升高,最高达150/100 mmHg,未规律治疗,伴体重进行性增加,约 40 kg,以腹部、面部、背部为主。
发病以来无头痛、视力减退,无怕冷少汗、反应迟钝,无发作性心悸、出汗、饥饿感,无多尿多饮口干,大小便正常。
无特殊药物服用史。
无糖尿病、心血管病家族史、无肥胖家族史、无手术外伤史。
查体:心率 89 次/分,血压 140/95 mmHg,身高 172 cm,体重94 kg,BMI 31.7 kg/m²,腰臀比例1.08,向心性肥胖。
视力正常,视野检查未见异常。
满月脸,颈背部可见脂肪垫,皮肤稍粗糙伴有色素沉着,甲状腺不大,腹部有紫色条纹,双下肢无明显水肿,第二性征发育未见异常。
相关检查:空腹血糖受损、高血脂、血钾偏低,高血压5 项、甲功、激素六项均正常。
思考:根据病例,暂可排除醛固酮瘤、胰岛素瘤、甲状腺功能减退症、性腺功能减退症等疾病,首先考虑Cushing 综合征,进一步做哪些检查?库欣综合征,诊断 3 步骤又称皮质醇增多症,由Harvey Cushing 教授于1912 年首先报道。
是由多种病因引起肾上腺皮质分泌过量的糖皮质激素从而出现一系列临床症状和体征的综合征,主要表现为满月脸、水牛背、多血质外貌、向心性肥胖、痤疮、紫纹、高血压、继发性糖尿病和骨质疏松等。
库欣综合征的病因分类表源:作者提供步骤一:库欣综合征的筛查试验美国内分泌学会指南推荐对高度怀疑库欣综合征的患者,应同时进行下述至少两项试验作为初筛检查:24 小时尿游离皮质醇测定(至少2 次)、午夜唾液皮质醇测定(2 次)、血清皮质醇昼夜节律检测,初筛结果如正常可基本除外库欣综合征。
地塞米松磷酸钠检验操作规程

目的: 为检验地塞米松磷酸钠规定一个标准的程序,以便获得准确的实验数据。
范围: 适用于地塞米松磷酸钠的检验。
职责: 检验室主任、检验员。
规程:1. 性状 本品为白色或微黄色粉末,无臭,味微苦,有引湿性。
本品在水或甲醇中溶解,在丙酮或乙醚中几乎不溶。
1.1 比旋度取本品精密称取250mg 置25ml 量瓶中,加水溶解并稀释至刻度,摇匀,照旋光度测定法(SOP-QC-310-00) 检验,比旋度为+72°至+80°为符合规定。
计算 []()B w a a -⨯⨯=125a: 旋光仪读数; w: 样品称量(mg ); B: 水分含量(%); 2. 鉴别2.1 试剂与仪器2.1.1 硫酸,盐酸 2.1.2 硝酸 2.1.3 0.01mol/L 氢氧化钠溶液2.1.4 茜素氟蓝试液2.1.5 12% 醋酸钠的稀醋酸溶液2.1.6 硝酸亚铈试液2.1.7 氨试液 2.1.8 活性炭 2.1.9 醋酸氧铀锌试液 2.1.10 硝酸银 2.1.11 氯化铵镁试液 2.1.12 钼酸铵试液 2.1.13 烧杯,试管,量筒 2.1.14 电炉 2.1.15 电子天平(万分之一克)2.1.16 移液管(2ml ,1ml ,10ml )2.1.17 红外光谱仪 2.1.18 锥形瓶(500ml)2.1.19 漏斗,漏斗架,滤纸 2.1.20 酒精灯2.2 项目与步骤2.2.1 取本品约8mg,加硫酸2ml使溶解,放置数分钟,即显黄色或红棕色,将此溶液倾入10ml水中,即析出黄色絮状沉淀为符合规定。
2.2.2 取本品,按红外分光光度法(SOP-QC-302-00)检验,红外吸收图谱应与对照的图谱(光谱集141图)一致为符合规定。
2.2.3 有机氟化物的鉴别反应取供试品约7mg,照氧瓶燃烧法(SOP-QC-317-00)进行有机破坏,用水20ml与0.01mol/L 氢氧化纳溶液6.5ml为吸收液,俟燃烧完毕后,充分振摇,取吸收液2ml加茜素氟蓝试液0.5ml,再加12%醋酸钠的稀醋酸溶液0.2ml用水稀释至4ml,加硝酸亚铈试液0.5ml即显蓝色,同时做空白对照试验,为符合规定。
微生物限度检查法标准操作规程(参考Word)

1. 目的:建立微生物限度检查法标准操作规程2. 范围:适用于原辅料及成品的微生物限度检查。
3. 责任人:QC负责实施,QC主管负责监督。
4. 程序:4.1 检验依据《中华人民共和国药典》2005年版一部附录P704.2 检验规程4.2.1 微生物限度检查法总则4.2.1.1微生物限度检查法系指检查非规定灭菌制剂及其原、辅料受到微生物污染程度的方法。
检查项目包括细菌数、霉菌数、酵母菌数及控制菌的检查。
4.2.1.2微生物限度检查应在环境洁净度10000级下的局部洁净度100级的单向流空气区域内进行。
检验全过程必须严格遵守无菌操作,防止再污染。
4.2.1.3供试品检查时,如果使用了表面活性剂、中和剂或灭活剂,应证明其有效性及对微生物的生长和存活无影响。
4.2.1.4除另有规定外,本检查法中细菌培养温度为30~35℃,霉菌、酵母菌培养温度为23℃~28℃,控制菌培养温度为35~37℃。
4.2.1.5检验结果以1g、1ml、10g、10ml或10cm2为单位报告。
4.2.2 供试品的检验量:检验量即一次试验所用的供试品量(g、ml或cm2)。
除另有规定外,一般供试品检验量为10g 或10ml ;中药膜剂为50cm2,贵重药品、微量包装药品检验量可以酌减。
要求检查沙门菌的供试品,其检验量应增加10g或10ml。
检验时,应从2 个以上最小包装单位中抽取供试品,大蜜丸还不得少于4 丸,膜剂还不得少于4片。
一般应随机抽取不少于检验用量(2个以上最小包装单位)的3倍量。
4.2.3供试液的制备按供试品的理化特性与生物学特性可采取适宜的方法制备供试液。
供试液制备若需用水浴加温时,温度不应超过45℃。
供试液从制备至加入检验用培养基,不得超过1小时。
4.2.3.1液体供试品取供试品10ml,加PH7.0无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为1:10的供试液。
油剂可加适量无菌聚山梨酯80使供试品分散均匀。
水溶性液体制剂也可用混合的供试品原液作为供试液。
地塞米松抑制试验操作规范
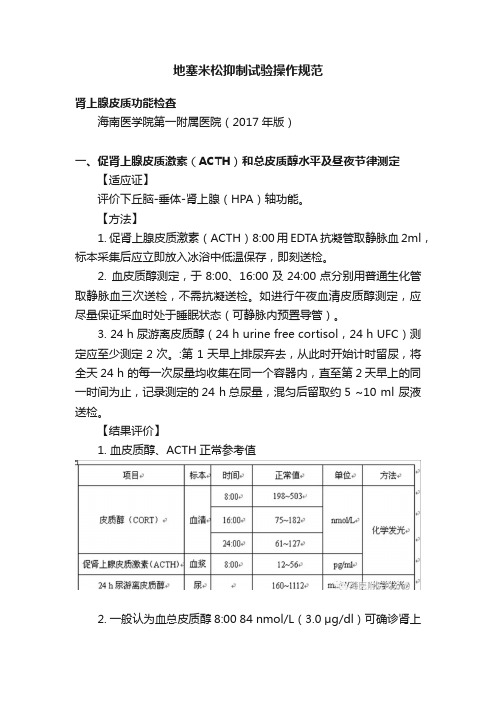
地塞米松抑制试验操作规范肾上腺皮质功能检查海南医学院第一附属医院(2017年版)一、促肾上腺皮质激素(ACTH)和总皮质醇水平及昼夜节律测定【适应证】评价下丘脑-垂体-肾上腺(HPA)轴功能。
【方法】1. 促肾上腺皮质激素(ACTH)8:00用EDTA抗凝管取静脉血2ml,标本采集后应立即放入冰浴中低温保存,即刻送检。
2. 血皮质醇测定,于8:00、16:00及24:00点分别用普通生化管取静脉血三次送检,不需抗凝送检。
如进行午夜血清皮质醇测定,应尽量保证采血时处于睡眠状态(可静脉内预置导管)。
3. 24 h尿游离皮质醇(24 h urine free cortisol,24 h UFC)测定应至少测定2次。
:第1天早上排尿弃去,从此时开始计时留尿,将全天24 h 的每一次尿量均收集在同一个容器内,直至第2天早上的同一时间为止,记录测定的24 h总尿量,混匀后留取约5 ~10 ml 尿液送检。
【结果评价】1. 血皮质醇、ACTH正常参考值2. 一般认为血总皮质醇8:00 84 nmol/L(3.0 μg/dl)可确诊肾上腺皮质功能减退症;血总皮质醇8:00 >420 nmol/L(150 μg/L)可除外诊断。
Addison病患者即使血总皮质醇在正常范围,血浆ACTH也常≥10 pg/ml(2.2 pmol/L)。
睡眠状态下的午夜血皮质醇<50 nmol/L(1.8 μg/dl)可排除库欣综合征,清醒状态下的午夜血皮质醇>207 nmol/L(7.5 μg/dl)高度怀疑库欣综合征。
3. 库欣综合征(Cushing Syndrome)的判断标准:①节律消失(午夜值明显升高);②24h尿游离皮质醇明显升高。
4. ACTH的意义:测定ACTH可用于库欣综合征患者的病因诊断,即鉴别ACTH依赖性和ACTH非依赖性库欣综合征。
如8:00~9:00的血ACTH<10 pg/ml(2.2 pmol/L)则提示为ACTH非依赖性库欣综合征;但某些肾上腺性库欣综合征患者的皮质醇水平升高不明显,不能抑制ACTH至上述水平;如ACTH>20 pg/ml(4.4 pmol/L)则提示为ACTH依赖性库欣综合征。
地塞米松磷酸钠注射液有关物质检验方法分析

地塞米松磷酸钠注射液有关物质检验方法分析摘要:目的:本次的研究的主要对象是地塞米松磷酸钠注射液有关物质,对本物质的君安眼方法进行详细的分析。
方法:该实验中主要是对4根色谱柱进行应用且这些色谱柱的规格和品牌不相同。
在此次的实验中是将三乙胺、甲醇、乙腈溶液结合后的溶液,并且对实验中产生的波长和流速的参数进行了基本的检测和记录。
结果:当色谱柱的温度达到了30度时,制备好的流动相作为本次实验中的溶液,并以地塞米松磷酸酯以及其制备系统所谓适用性溶液,在整个的实验过程中,充分的体现出了分离度高以及对称性强的特点和优势。
不过因为其杂质的保留时间因为本身存在其差异性,因此在本次实验中如果对保留时间进行定位很可能会导致很多不确定性的发生。
关键词:地塞米松磷酸钠注射液;有关物质;高效液相色谱法地塞米松磷酸钠注射液,其主要功能是对过敏性和自身免疫炎症性疾病进行治疗,主要包括了结缔组织病、活动性风湿病、类风湿性关节炎、红斑狼疮、严重支气管哮喘、严重皮炎、溃疡性结肠炎、急性白血病等,也可以对一些较为严重的感染和中毒等进行治疗。
治疗的范围虽然较为广泛但是出现不良反应的几率也较高。
地塞米松磷酸钠注射液的质量标准在《中国药典》中有详细的收载,在后期的《中国药典》中对有关物质的检测方法,其方法的名字叫做HPLC法。
而且我国的药品监督部门也对本药物的进行了研究和检测,其中就包括了地塞米松的含量,对其中杂质的限度以及用于治疗中的安全性等,不过研究人员对本药物进行研究时的检测方式是否存在科学性提出了质疑。
1仪器与试药在本次的实验中,所采用实验仪器主要是高效液相色谱以及液相色谱例子胼质谱联用仪等。
在对这些实验仪器进行使用前全部进行了严谨的检查工作,因为实验仪器的性能对实验的结果可以产生较大的影响,质量高的仪器可以是实验的有效保障。
在本次的实验中使用的试药较多,试药中包括了地塞米松磷酸钠的对照品,地塞米松对照品以及磷酸酯对照品,这些试药的规格均达到标准,并且这些药品均产自于较为著名的生产公司。
微生物限度检查操作规程

微生物限度检查操作规程1.目的建立一个微生物限度检查(包括细菌、霉菌、酵母菌)标准工作程序,规范QC微生物限度检查人员的微生物限度检查操作。
2.范围适用于本公司的细菌、霉菌、酵母菌的限度检测。
3.责任者QC微生物限度检查人员;质量管理部4.内容4.1检测准备4.1.1 QC人员接到微生物限度检查的《工作进程计划单》后,核对《取样指令》,确定微生物限度检查所需的容器具、试液、培养基等的项目和数量,执行微生物检查准备工作操作程序和培养基配制操作规程,进行微生物限度检查前的准备工作。
4.1.2 为了保证被检品在取样后规定的时间内完成检验,取样前应准备好检验需要的各种器皿(清洗→干燥→包裹)、培养基和稀释剂等(配制→分装→包裹),并灭菌备用。
4.2 供试液的制备4.2.1 供试液供试液是指按照供试品的理化特性与生物学特性,采取适宜的方法将供试品制成供试验用的均匀液体。
4.2.2 供试液的制备根据供试品的理化特性与生物需特性,采取适宜的方法制备供试液。
如果使用了乳化剂、分散剂、中和剂和灭活剂,其用量应证明是有效的,并对微生物的生长和存活无影响性。
4.2.2.1 可溶性液体供试品取供试品10ml,加pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,混匀,作为供试液。
可溶性液体制剂可用混合的供试品原液作为供试液。
4.2.2.2 非水溶性液体供试品油剂可先加入适量的无菌聚山梨酯80使供试品分散均匀,然后再加0.9%无菌氯化钠-蛋白胨缓冲液至100m,混匀,作为供试液。
4.2.2.3 水溶性固体、半固体或黏稠性供试品称取供试品10g,置PH7.0无菌氯化钠-蛋白胨缓冲液至100ml中,用匀浆仪或其他适宜方法,混匀,作为1:10供试液。
必要时可加适量的无菌聚山梨酯80,并置水浴中适当加温使供试品分散均匀。
4.2.2.4 非水溶性供试品取供试品5g(5m1),加入含溶化的(温度不超过45℃)5g司盘80、3g单硬脂酸甘油酯、10g聚山梨酯80无菌混合物的烧杯中,用无菌玻棒搅拌成团后,慢慢加入45℃pH7.0无菌氯化钠-蛋白胨缓冲液至100ml,边加边搅拌,使其充分乳化,作为1:20供试液。
醋酸地塞米松检验操作规程

目的: 为检验醋酸地塞米松规定一个标准的程序,以便获得准确的实验数据。
范围: 适用于醋酸地塞米松的检验。
职责: 检验室主任、检验员。
规程:1. 性状: 本品为白色或类白色的结晶或结晶性粉末, 无臭,味微苦。
本品在丙酮中易溶,在甲醇或无水乙醇中溶解,在乙醇或氯仿中略溶,在乙醚中极微溶解,在水中不溶。
1.1 熔点: 本品按熔点测定法(SOP-QC-307-00)测定,熔点为223-233℃,熔融时同时分解为符合规定。
1.2 比旋度: 取本品精密称取250mg 置25ml 量瓶中,加二氧六环溶解并定量稀释至刻度,摇匀,依法测定(SOP-QC-310-00),比旋度为+82°至88°为符合规定。
计算:[]()B w a a -⨯⨯=125a:旋光仪读数; w:样品称重量(g); B:水分含量(%)。
1.3 吸收系数: 取本品,精密称取150mg 置100ml 量瓶中,加乙醇溶解并稀释至刻度,摇匀,再精吸1ml 置100ml 量瓶中,加乙醇稀释至刻度,摇匀,照分光光度法(SOP-QC-301-00),在240nm 的波长处测定吸收度,吸收系数E 1cm 1%为343-371,为符合规定。
2. 鉴别 2.1 试剂与仪器2.1.1 甲醇 2.1.2 硫酸溶液(1→2) 2.1.3 碱性酒石酸铜 2.1.4 乙醇制氢氧化钾试液2.1.5 0.01mol/L氢氧化钠溶液 2.1.6 茜素氟蓝试液2.1.7 12%醋酸钠的稀醋酸溶液 2.1.8 硝酸亚铈试液2.1.9 移液管(2ml,1ml,10ml) 2.1.10 红外光谱仪2.1.11 电炉 2.1.12 试管,烧杯,量筒2.1.13 电子天平 2.1.14锥形瓶(500ml)2.1.15 小型三用水箱2.2 项目与步骤2.2.1 取本品约10mg加甲醇1ml微温溶解后,加热的碱性酒石酸铜试液1ml,即生成红色沉淀。
2.2.2 取本品50mg加乙醇制氢氧化钾试液2ml,置水溶中加热5分钟,放冷,加硫酸溶液(1→2)2ml缓缓煮沸1分钟,即发生醋酸乙酯的香气为符合规定。
乳及乳制品中地塞米松的快速检测原始记录表

乳及乳制品中地塞米松的快速检测原始记录表【原创版】目录一、引言二、乳及乳制品中地塞米松的检测方法1.酶联免疫吸附法2.液相色谱 - 质谱法3.气相色谱 - 质谱法三、地塞米松在乳及乳制品中的残留问题1.残留原因2.残留危害四、快速检测地塞米松的重要性1.保障食品安全2.保护消费者健康五、结论正文一、引言乳及乳制品是人们日常生活中不可或缺的食品,其质量和安全问题直接关系到广大消费者的身体健康。
近年来,随着养殖业的发展和饲料添加剂的广泛使用,乳及乳制品中激素残留问题逐渐引起人们的关注。
地塞米松作为一种糖皮质激素,被广泛应用于兽医临床和动物饲养业。
然而,地塞米松在乳及乳制品中的残留问题给食品安全带来了严重隐患。
为了保障食品安全和保护消费者健康,研究乳及乳制品中地塞米松的快速检测方法具有重要意义。
二、乳及乳制品中地塞米松的检测方法目前,乳及乳制品中地塞米松的检测方法主要有酶联免疫吸附法、液相色谱 - 质谱法和气相色谱 - 质谱法。
1.酶联免疫吸附法酶联免疫吸附法是一种灵敏、快速的检测方法,具有操作简便、仪器设备要求较低的优点。
该方法利用抗原和抗体的特异性结合反应,通过检测复合物的形成来判断样品中地塞米松的残留量。
2.液相色谱 - 质谱法液相色谱 - 质谱法是一种常用的分析方法,具有较高的分辨率和准确度。
该方法通过样品在液相色谱上的分离,再通过质谱检测器进行检测,从而实现对地塞米松的高效、准确检测。
3.气相色谱 - 质谱法气相色谱 - 质谱法也是一种高效的分析方法,适用于挥发性较强样品的检测。
该方法通过样品在气相色谱上的分离,再通过质谱检测器进行检测,实现对地塞米松的快速、准确检测。
三、地塞米松在乳及乳制品中的残留问题1.残留原因地塞米松在乳及乳制品中的残留主要源于养殖业中滥用激素添加剂。
为了提高奶牛的产奶量和预防疾病,部分养殖户违规使用地塞米松等激素,导致乳及乳制品中激素残留。
2.残留危害地塞米松在乳及乳制品中的残留对人类健康具有潜在危害,可能导致内分泌失调、生长发育障碍等问题。
药物分析实验标准操作规程(SOP)

药物分析实验标准操作规程(SOP)1.称量试验中供试品与试药等“称重”的量,均以阿拉伯数码表示,其准确度可根据数值的有效位数来确定,如称取“0.1g"系指称重量可为0。
06~0。
14;称取“2g”,系指称量重量可为1.5~2.5g;称取“2。
0g",系指称量重量可为1.95~2。
05g;称取2。
00g,系指称取重量可为1。
995~2.005g。
“精密称定”系指称取重量应准确至所取重量的千分之一;“称定”系指称取重量应准确至所取重量的百分之一;取用量为“约”若干时,系指取用量不超过规定量的±10%,如双氯芬酸钠含量测定中“取本品约0。
5g,精密称定”,则取样的范围应为0.4501~0.5499g。
电子天平使用时的注意事项:①读数时,一定要关闭天平两侧的门后再读数②称取药物时,防止药物洒在天平盘上,影响天平的测定精度。
2.清洗带刻度的玻璃器皿如容量瓶、移液管、滴定管,清洗时不可用毛刷,必须用洗液清洗。
清洗方法:洗涤时装入少量洗液,将仪器(或容器)倾斜转动,使管壁全部被洗液湿润。
转动一会儿后倒回原洗液瓶中,再用自来水把残留在仪器(或容器)中的洗液洗去,最后用少量的蒸馏水洗三次。
如果用洗液浸泡仪器或把洗液加热,其效果会更好。
使用洗液清洗时的注意事项:①使用洗液前最好先用水或去污粉将容器洗一下.②使用洗液前尽量把仪器内的水倒掉,以免把洗液稀释。
③洗液用完后应倒回原瓶内,可反复使用。
④不要用洗液洗涤具有还原性的污物(如某些有机物),这些物质能把洗液中的重铬酸钾还原为硫酸铬(洗液的颜色有原来的深棕色变成绿色)。
已变成绿色的洗液无氧化性,不能继续使用。
⑤洗液具有强的腐蚀性,会灼伤皮肤,破坏衣物,如不慎把洗液洒在皮肤、衣物和桌面上,应立即用水冲洗。
3. 定容容量瓶在使用之前先要检查其是否漏水.检查方法是:放入自来水至标线附近,盖好瓶塞,瓶口外水珠用布或滤纸擦拭干净,用左手按住瓶塞,右手手指顶住瓶底边缘,把瓶倒立2分钟,观察瓶周围是否有水渗出,如果不漏,将瓶直立,把瓶塞旋转约180°,再倒立过来试一次.检查两次非常必要,因为有时瓶塞与瓶口不是任何位置都密合的。
SOPQC-CP014-00----地塞米松检验操作规程

米松各项目的检验、计算方法和操作步骤。
范围:本规程适用于地塞米松的检验与质量控制。
职责:QC负责起草并审核;质量部主管批准;分析检验人员必须认真阅读和理解本操作规程,并严格按规程中所规定的要求进行检验,确保检验结果准确无误。
1 质量标准:2.1 性状取本品于有足够亮度的自然光或日光灯下直接目视观察。
2.2 溶解度称取研成细末的样品1.00g数份,分别置于适量的25℃±2℃的甲醇、乙醇、丙酮、二氧六环、三氯甲烷、乙醚及水中,每隔5分钟强烈振摇30秒钟;观察30分钟内的溶解情况,如无目视可见的溶质颗粒时,即视为完全溶解。
略溶:样品能在30~不到100ml溶剂中溶解;微溶:样品能在100~不到1000ml溶剂中溶解;极微溶解:样品能在1000~不到10000ml溶剂中溶解;几乎不溶:样品在10000ml溶剂中不能完全溶解。
2.3 比旋度2.3.1 试剂和仪器:1、4-二氧六环(AR)、旋光仪、分析天平(万分之一)、旋光测定管、容量瓶、超声清洗器等。
2.3.2 样品溶液制备:精密称取样品约500mg,置50mL容量瓶中。
加入已恒温(25℃)的1、4-二氧六环约30ml,放置超声设备上使完全溶解,再加已恒温的1、4-二氧六环稀释至刻度,摇匀。
2.3.3 测定:调节旋光仪测试室温度至25±0.5℃,用已恒温(25℃)的1、4-二氧六环对旋光仪作空白调零;每批样品溶液测定三次,记录样品的旋光度(a)。
2.3.4 计算:式中:a为测得的旋光度,°;V为最终稀释体积,用ml;W为样品的重量,用g表示;l为测定管长度,dm;h为样品的干燥失重,%。
2.4 吸收系数2.4.1 试剂和仪器:乙醇(AR)、紫外分光光度计、分析天平(万分之一)、石英比色管、容量瓶、超声清洗器等。
2.4.2 样品溶液配制:精密称取样品约10mg,置100ml容量瓶中,加乙醇50ml,放置于超声设备上2分钟至完全溶解,再以乙醇稀释至刻度,摇匀。
药品检验操作规程

一.目的:建立磺胺喹噁啉钠可溶性粉检验的标准操作程序,使操作过程规化。
二. 围:适用于磺胺喹噁啉钠可溶性粉的检验操作。
三.责任者:QC主管、检验人员四.正文1.性状取本品观察,本品为白色或微黄色粉末。
具有以上任何一种性状均符合规定。
2.鉴别2.1芳香第一胺类的鉴别反应2.1.1仪器及试剂天平、刻度吸管、漏斗、恒温干燥箱、可控温电炉、烧杯、滴管、漏斗架;醋酸、稀盐酸、亚硝酸钠溶液(0.1mol/L)、碱性β-萘酚试液。
2.1.2操作方法及结果判断取本品约1g,加水25ml溶解后,加醋酸2ml,即析出黄色沉淀;滤过,沉淀用水洗涤,在105℃干燥1小时,取干燥后沉淀50mg,加稀盐酸1ml,必要时缓缓煮沸使溶解,放冷,加0.1mol/L亚硝酸钠溶液3滴,滴加碱性β-萘酚试液3滴,生成由橙黄到猩红色沉淀,则判符合规定,反之,则判不符合规定。
2.2最大吸收2.2.1仪器及试剂紫外分光光度计、容量瓶、电子天平、烧杯、0.01mol/L氢氧化钠溶液。
2.2.2操作方法及结果判定取2.1.2项下105℃干燥1小时的沉淀,加0.01mol/L氢氧化钠溶液制成每1ml中含5µg 的溶液,照紫外分光光度法操作规程(SOP-JT00200)测定,在230~350nm的波长围测定,在252nm的波长处有最大吸收,吸收度约0.55。
则判符合规定,反之,则判不符合规定。
2.3钠盐鉴别反应2.3.1仪器及试剂铂丝、酒精灯、镊子、试管、滴管、试管架;盐酸、醋酸氧铀锌试液。
2.3.2操作方法及结果判断合规定,反之,则判不符合规定。
2.3.2.2取本品水溶液,加醋酸氧铀锌试液,生成黄色沉淀,则判符合规定,反之,则判不符合规定。
3.检查3.1干燥失重3.1.1仪器与用具扁形称量瓶(干燥至恒重)、电子天平、干燥箱、干燥器。
照干燥失重测定法操作规程(SOP-JT00500)依法检查,取本品1g ,置与供试品同样条件下干燥至恒重的扁形称量瓶中,精密称定,放入105℃的恒温干燥箱中进行干燥4小时,干燥后取出置干燥器中放冷至室温一般约30分钟,精密称定,记录数据。
澄清度检查法标准操作规程
澄清度检查法标准操作规程第 1 页共 2 页1. 目的:建立澄清度检查法标准操作规程2. 范围:适用于原辅料和药品的澄清度的检查3. 责任人:QC负责实施,QC主管负责监督。
4. 程序:4.1 检验依据《中华人民共和国药典》2005年版二部附录P614.2 检验规程4.2.1浊度标准液的制备4.2.1.1 浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4—6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存可在两个月内使用,用前摇匀。
4.2.1.2浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量置1cm吸收池中,照分光光度法在550nm的波长处测定,吸收度应在0.12~0.15范围内,本液应在48小时内使用,用前摇匀。
4.2.1.3浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
本液应临用时4.2.2 操作方法:除另有规定外在室温条件下,将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较;用以检查溶液的澄清度或其浑浊程度。
除另有规定外,供试品溶解后应立即检视。
“澄清”,系指供试品溶液的澄清度相同于所用益阳马王堆制药有限公司SOP-ZL-QC-014-00澄清度检查法标准操作规程第 2 页共 2 页溶剂,或未超过0.5号浊度标准液。
4.2.3注意事项:4.2.3.1澄清度检查用的浊度标准贮备液、原液和标准液,均应用澄清的水(可用0.45μm孔径滤膜或G5垂熔玻璃漏斗滤过而得)。
4.2.3.2浊度标准贮备液、浊度标准原液、浊度标准液,均应按规定制备、使用,否则影响结果。
微生物限度检查操作规程

微生物限度检查操作规程微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠1.目的微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠建立一个微生物限度检查(包括细菌、霉菌、酵母菌)标准工作程序,规范QC微生物限度检查人员的微生物限度检查操作。
微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠2.范围微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠适用于本公司的细菌、霉菌、酵母菌的限度检测。
微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠3.责任者微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠QC微生物限度检查人员;质量管理部微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠4.内容微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠4.1检测准备微生物限度检查操作规程第2页/共6页文件类型操作规程(SOP)文件编号编制人编制日期年月日编制部门审核人审核日期年月日审核部门批准人批准日期馋架丘墨症纫青嘴葫碟弱嫉亦幽两膳苍灾四绒才煌赠阎股能陵副谦熙之诉康楼稳凋较佣蕊鉴丫怠稀只兼渍肉琐腾斥玛许卉圾誉歧叙厕班夷翰挞琳狠4.1.1 QC人员接到微生物限度检查的《工作进程计划单》后,核对《取样指令》,确定微生物限度检查所需的容器具、试液、培养基等的项目和数量,执行微生物检查准备工作操作程序和培养基配制操作规程,进行微生物限度检查前的准备工作。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目的:建立地塞米松检验操作规程,确保检验操作规范、结果准确。
同时详细的规范了地塞米松各项目的检验、计算方法和操作步骤。
范围:本规程适用于地塞米松的检验与质量控制。
职责:QC负责起草并审核;质量部主管批准;分析检验人员必须认真阅读和理解本操作规程,并严格按规程中所规定的要求进行检验,确保检验结果准确无误。
1 质量标准:2 操作程序2.1 性状取本品于有足够亮度的自然光或日光灯下直接目视观察。
2.2 溶解度称取研成细末的样品1.00g数份,分别置于适量的25℃±2℃的甲醇、乙醇、丙酮、二氧六环、三氯甲烷、乙醚及水中,每隔5分钟强烈振摇30秒钟;观察30分钟内的溶解情况,如无目视可见的溶质颗粒时,即视为完全溶解。
略溶:样品能在30~不到100ml溶剂中溶解;微溶:样品能在100~不到1000ml溶剂中溶解;极微溶解:样品能在1000~不到10000ml溶剂中溶解;几乎不溶:样品在10000ml溶剂中不能完全溶解。
2.3 比旋度2.3.1 试剂和仪器:1、4-二氧六环(AR )、旋光仪、分析天平(万分之一)、旋光测定管、容量瓶、超声清洗器等。
2.3.2 样品溶液制备:精密称取样品约500mg ,置50mL 容量瓶中。
加入已恒温(25℃)的1、4-二氧六环约30ml ,放置超声设备上使完全溶解,再加已恒温的1、4-二氧六环稀释至刻度,摇匀。
2.3.3 测定:调节旋光仪测试室温度至25±0.5℃,用已恒温(25℃)的1、4-二氧六环对旋光仪作空白调零;每批样品溶液测定三次,记录样品的旋光度(a )。
2.3.4 计算:[])h -1(100100⨯⨯⨯⨯⨯=l W V a tD α 式中:a 为测得的旋光度,°;V 为最终稀释体积,用ml ;W 为样品的重量,用g 表示;l 为测定管长度,dm ;h 为样品的干燥失重,%。
2.4 吸收系数2.4.1 试剂和仪器:乙醇( AR )、紫外分光光度计、分析天平(万分之一)、石英比色管、容量瓶、超声清洗器等。
2.4.2 样品溶液配制:精密称取样品约10mg ,置100ml 容量瓶中,加乙醇50ml ,放置于超声设备上2分钟至完全溶解,再以乙醇稀释至刻度,摇匀。
精确移取上述溶液5.0ml 置50ml 容量瓶中,加乙醇稀释至刻度,摇匀,备用。
2.4.3 测定:将样品溶液用1cm 石英吸收池在240nm 波长处进行测定,每批样品溶液测定三次记录样品溶液吸光度, 取平均吸光度计算吸收系数。
测定前先用乙醇作空白校验。
2.4.4 计算:lh W A E ⨯-⨯⨯=)1(100%1cm 1 式中:E 为吸收系数;A 为吸光度;l 为液层厚度,cm ;W 为称取样品的量,g ;h为样品的干燥失重,%。
2.5 鉴别2.5.1 显色反应取约2mg样品加硫酸2ml振摇使溶解,5分钟内显淡红棕色,加水10ml混匀,颜色消失。
2.5.2 HPLC鉴别2.5.2.1试剂和仪器:见含量测定项下。
2.5.2.2 在含量测定项下记录的色谱图中,样品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2.5.3 红外鉴别2.5.3.1 试剂和仪器:地塞米松对照品、红外分光光度计(4000-1-400cm-1)、分析天平(万分之一)等。
2.5.3.2 测定:取样品约1~2mg,置玛瑙研钵中,加入预先干燥的溴化钾粉末约200~300mg,作为分散剂,充分研磨均匀,置于直径为13mm的压电模中,使铺布均匀,抽真空约2min,加压约8~10T/cm2,保持压力2min,撤去压力并放气后取出制成样品片,目视检测,片子应呈透明状,其中样品分布均匀,并无明显的颗粒状样品。
将供试片置红外分光光度计的样品光路中,另一参比光路中置一按同法制成的溴化钾空白片作为补偿,在4000-400cm-1范围内扫描检测,录制光谱图。
样品的红外光吸收图谱吸收应与对照的图谱一致。
2.5.4 有机氟化物鉴别2.5.4.1试剂和仪器:500ml燃烧瓶、无灰滤纸、刻度吸管等。
2.5.4.2 溶液制备2.5.4.2.1样品溶液制备:取样品约7mg,置于无灰滤纸中心,折叠后固定于燃烧瓶铂丝下端螺旋处,使尾部露出;在燃烧瓶内加入水20ml与0.01mol/L氢氧化钠溶液6.5ml为吸收液,并将瓶口用水湿润,小心急速通入氧气约1分钟,立即用表面皿覆盖瓶口,移至他处;点燃包有样品的滤纸尾部,迅速放入燃烧瓶内,按紧瓶盖,用少量水封闭瓶口,俟燃烧完毕(应无黑色碎片),充分振摇,使生成的烟雾完全吸入吸收液中,放置约15分钟。
2.5.4.2.2 空白溶液制备:取空的无灰滤纸,按上述同样的方法制备吸收液即可。
2.5.4.3 测定取吸上述样品和空白的吸收液各2ml分别置10ml刻度试管中,各加茜素氟蓝试液0.5ml,再加12%醋酸钠的稀醋酸溶液0.2ml,用水稀释至4ml,加硝酸亚铈试液0.5ml,样品溶液应显蓝紫色,空白溶液不得显色。
2.6 有关物质2.6.1 仪器:高效液相色谱仪、分析天平(十万分之一)、电脑、微量注射器、50 ml棕色容量瓶、50 ml烧杯等。
2.6.2 试剂:地塞米松对照品、倍他米松对照品、甲醇、乙腈、纯化水。
2.6.3 色谱参数:色谱柱:C18,250mm×4.6mm,5um检测波长:240 nm柱温:30℃流速:1.0 ml/min流动相:乙腈:水28:72 (V/V)稀释剂:甲醇(AR)进样量:20μ l2.6.4 积分参数:斜率灵敏度=1.000最小峰宽=0.100最小峰高=0.000肩峰= 关闭2.6.5 有关物质溶液的制备2.6.5.1样品溶液制备:精密称取地塞米松样品约25mg置50mL容量瓶中,加入约20ml甲醇,超声1分钟使溶解,再用甲醇稀释至刻度(C=0. 5mg/ml),摇匀。
2.6.5.2 对照溶液制备:精密称取倍他米松对照品约25mg置50mL容量瓶中,加入约20ml甲醇,超声处理1分钟使溶解,再用甲醇稀释至刻度,摇匀。
精密量取上述溶液1.0ml和样品溶液1.0ml置100ml容量瓶中,用甲醇稀释至刻度( 倍他米松C=0. 005mg/ml;地塞米松C=0. 005mg/ml),摇匀。
2.6.6 测定:俟仪器稳定后,按上述色谱条件,取对照溶液20ul 注入液相色谱仪,调节检测器灵敏度,使地塞米松色谱峰的峰高约为满量程的20%。
将对照溶液进样2次;随后,在同样色谱条件下,将样品溶液进样2次,运行时间为主成分保留时间的2倍。
2.6.7 验收标准:样品溶液色谱图中如出现与对照溶液中倍他米松相应的色谱峰和其他杂质的色谱峰,按平均峰面积根据下列外标法计算各杂质。
倍他米松含量不得过0.5%;其他单个杂质峰面积不得大于对照溶液中地塞米松峰面积(1.0%);各杂质峰面积的和不得大于对照溶液中地塞米松峰面积的2倍(2.0%);样品溶液色谱图中任何小于对照溶液中地塞米松峰面积0.01倍的峰可以忽略不计。
2.6.8 计算:2.6.8.1 XS B B BS X C A P C A ⨯⨯⨯=B 倍他米松含量 式中:A BX 为样品溶液中倍他米松平均峰面积;A BS 为对照溶液中倍他米松的平均峰面积;C X 为样品溶液的浓度,mg/ml ;C BS 为对照品溶液中倍他米松的浓度,mg/ml ;P B 为倍他米松对照品纯度,%。
2.6.8.2 XS S X C A C A ⨯⨯⨯=100其他杂质含量 式中:A X 为样品溶液中各其他杂质平均峰面积;As 为对照溶液中地塞米松的平均峰面积;Cx 为样品溶液的浓度,mg/ml ;Cs 为地塞米松对照溶液的浓度,mg/ml ;2.6.8.3 总(杂质总))总杂质(A 100A %⨯=式中:A (杂质总):为样品溶液中各其他杂质的总峰面积;A 总为样品溶液中总的峰面积2.7 干燥失重2.7.1 仪器:扁形称量瓶、分析天平(万分之一)、电热恒温干燥箱、干燥器等。
2.7.2 测定:将扁形称量瓶至105℃电热恒温干燥箱中干燥至恒重,精密称定后,取样品约1.0g ,混合均匀,平铺在上述已干燥至恒重的扁形称量瓶中,厚度不超过5mm ,精密称定。
然后置于同样条件下的干燥箱中进行干燥3小时,取出置干燥器中,放冷至室温,再称定称重,并计算减失重量。
2.7.3 计算: %干燥失重=100)(⨯-mtmo mt 式中: mt 为干燥前样品重量, g ;mo 为干燥后样品重量, g 。
2.8 炽灼残渣2.8.1 仪器与试剂:电阻炉、分析天平(万分之一)、浓硫酸(AR )、干燥器等。
2.8.2 测定:将坩埚置800︒C 电阻炉中炽灼置恒重,精密称定;取样品约1.0g ,置上述已炽灼至恒重的铂坩埚中,精密称定;于电炉上缓缓加热至完全炭化,放冷至室温;加1ml 浓硫酸使湿润,低温加热至硫酸蒸汽完全除尽后,再移入800︒C 的电阻炉中炽灼至完全灰化(约1小时),待稍冷后,移入干燥器内冷却至室温(约60min 左右),精密称重后,再在800︒C 炽灼30分钟,直至恒重,计算炽灼残渣量。
2.8. 3 计算: %100⨯=炽灼前重量炽灼后重量炽灼残渣2.9 含量 2.9.1 含量检测色谱条件与相关物质检测色谱条件相同。
2.9.2 系统适用性按HPLC 检测条件,待仪器稳定后,将稀释剂进样1次,取有关物质对照溶液20ul 注入液相色谱仪,调节检测器灵敏度,使地塞米松色谱峰的峰高约为满量程的20%。
并将对照溶液连续重复进样5次,记录色谱图。
出峰顺序依次为倍他米松峰与地塞米松峰,按地塞米松峰面积计算系统适用性的有关参数,并应符合如下验收标准后,方可进行含量检测。
2.9.3 含量测定溶液配制2.9.3.1 对照品溶液制备:精密称取地塞米松对照品约25mg 置50mL 容量瓶中,加入约20ml 甲醇,超声处理1分钟使溶解,再用甲醇稀释至刻度,摇匀。
精密量取上述溶液1.0ml 至10ml 容量瓶中,用甲醇稀释至刻度(C=0.050mg/ml ),摇匀。
2.9.3.2 样品溶液制备:精密称取地塞米松样品约25mg 置50mL 容量瓶中,加入约20ml 甲醇,超声处理1分钟使溶解,再用甲醇稀释至刻度,摇匀。
精密量取上述溶液1.0ml 至10ml 容量瓶中,用甲醇稀释至刻度(C=0.050mg/ml ),摇匀。
样品溶液必须重复制备2份(称样二次)。
2.9.4 测定2.9.4.1 在系统适用性符合要求后,按相关物质色谱条件,将对照品溶液进样2次。
在同样色谱条件下,将每个地塞米松样品溶液各进样1次,记录图谱和数据。
2.9.4.2 每一批样品的含量测定必须平行测定两份(称样二次),两份测定结果相对偏差应≤ 0.5%。
2.9.5 计算)1(A h Wx As P Ws x -⨯⨯⨯⨯=含量 式中:Ax 为样品峰面积;As 为对照品平均峰面积;Wx 为样品重量,mg ;Ws 为对照品重量,mg ;P 为对照品纯度,%;h 为样品的干燥失重,%。
