奥扎格雷对酪氨酸酶的抑制机理
奥扎格雷氨丁三醇及其组合物制备方法和用途

奥扎格雷氨丁三醇及其组合物制备方法和用途奥扎格雷氨丁三醇是一种常用的抗生素,广泛应用于医疗领域。
它具有广谱抗菌活性,抗菌机制主要是通过阻断细菌的蛋白质合成来实现的。
同时,奥扎格雷氨丁三醇也具有吸收快、生物利用度高、不易产生耐药性等特点。
近年来,其在抗生素领域的应用也得到了进一步的研究和开发。
本文将介绍奥扎格雷氨丁三醇及其组合物的制备方法、用途和未来发展趋势。
一、奥扎格雷氨丁三醇的制备方法目前,奥扎格雷氨丁三醇主要通过化学合成的方法进行制备。
其合成路线主要包括以下几个步骤:1.环化反应:首先,将一定比例的氮化钠和三丁胺溶于甲醇中,加入适量的溴乙酸乙酯,进行环化反应。
反应完成后,得到环化产物。
2.脱质子化反应:将环化产物溶于无水乙醚中,加入适量的氢氧化钠溶液,进行脱质子化反应。
反应完成后,进行酸化处理,得到终产物。
3.结晶纯化:通过适当的溶剂和结晶条件,对终产物进行结晶纯化,得到纯品。
值得注意的是,上述合成方法仅为一种例子,实际制备过程中还可以根据需要进行不同的修改和改进。
二、奥扎格雷氨丁三醇的用途此外,奥扎格雷氨丁三醇还可以应用于其他领域,如农业和动物医学。
在农业方面,奥扎格雷氨丁三醇可以用于预防和控制农作物病害,提高农作物的产量和质量。
在动物医学方面,奥扎格雷氨丁三醇可以用于治疗动物感染疾病,预防和控制动物疾病的传播。
三、奥扎格雷氨丁三醇的组合物除了单一的奥扎格雷氨丁三醇,还可以将其与其他药物或化合物进行组合,以提高治疗效果或扩大应用范围。
1.奥扎格雷氨丁三醇与β-内酰胺类抗生素的组合:奥扎格雷氨丁三醇与β-内酰胺类抗生素(如头孢菌素、青霉素等)的组合更广谱,可以同时对抗多种细菌感染。
此外,由于奥扎格雷氨丁三醇对耐药菌株的敏感性较高,该组合更适用于治疗耐药菌感染。
2.奥扎格雷氨丁三醇与非甾体类抗炎药的组合:奥扎格雷氨丁三醇与非甾体类抗炎药(如布洛芬、对乙酰氨基酚等)的组合可以提高治疗感染疾病的效果。
对羟基肉桂酸对酪氨酸酶催化反应的抑制机理

对羟基肉桂酸对酪氨酸酶催化反应的抑制机理如下:
- 对酪氨酸酶催化单酚底物L-酪氨酸和催化二酚底物L-多巴的抑制能力的研究表明,对羟基肉桂酸对单酚底物L-酪氨酸的抑制作用更强,半抑制浓度为0.096mmol/L。
- 紫外-可见光谱分析表明,对羟基肉桂酸能与Cu²⁺发生螯合,使光谱发生明显红移。
- 荧光光谱分析得到,对羟基肉桂酸在酪氨酸酶溶液中并没有出现荧光淬灭,反而随着对羟基肉桂酸浓度的增大荧光强度变强,说明对羟基肉桂酸被酪氨酸酶催化氧化成对应的醌类物质。
- 分子对接技术揭示了对羟基肉桂酸通过氢键和疏水作用竞争性地占据了单酚和二酚底物的空间位置,并与酪氨酸酶中双核铜离子螯合,从而抑制酪氨酸酶催化L-酪氨酸和L-多巴氧化的活性。
酪氨酸酶结构功能分析及其抑制物的设计

科技与创新┃Science and Technology&Innovation ·118·2017年第13期文章编号:2095-6835(2017)13-0118-02酪氨酸酶结构功能分析及其抑制物的设计熊东彦,李志远,黄丹,慕昕,刘桢(东北农业大学生命科学学院,黑龙江哈尔滨150030)摘要:黑色素生成与酪氨酸酶相关。
在保证健康的前提下,为了适当抑制黑色素生成,美白皮肤,我们使用生物信息学方法研究了酪氨酸酶的性质,并针对其性质设计了抑制分子。
利用遗传算法得到了不同物种的酪氨酸酶系统进化树,发现东非狒狒、猕猴等的酪氨酸酶与人类的具有较高的相似度。
在PDB数据库中预测到人类酪氨酸酶与巨大芽孢杆菌酪氨酸酶在空间结构上具有最大相似度。
N端与C端分别有1个β-折叠,N端与C端之间有多个α-螺旋。
由此发现,Zn2+和Cl-能够有效降低酪氨酸酶的活性。
黑色素合成受信号通路调控,JNK通路可以通过阻止cAMP应答元件结合蛋白来抑制酪氨酸酶的合成。
雌激素为黑色素合成的“第一信使”,其作用通过ER途径介导,由此寻找到抑制其活性的分子,比如埃克替尼、阿帕替尼。
关键词:酪氨酸酶;生物信息学;抑制分子;系统进化树中图分类号:S917.4文献标识码:A DOI:10.15913/ki.kjycx.2017.13.118黑色素是一种生物色素,能保护生物体免受紫外线伤害,过多的黑色素沉积易引发黑色素瘤。
黑色素合成受多个途径调控,其中,由酪氨酸酶参与的合成途径是黑色素合成的重要途径之一。
酪氨酸酶是一种氧化还原酶,广泛存在于各生物中,与生物体合成色素直接相关。
目前,酪氨酸酶在医疗美容方面的应用发展迅速。
随着生活水平的提高,人们对美的享受也越来越讲究,美白剂的开发随之成为化妆品行业关注的焦点之一。
目前,市场上的美白剂主要有熊果苷、曲酸等,文献表明这些物质均具有较好的美白功效,但这些物质具有一定的皮肤刺激性,或稳定性较差。
酪氨酸酶作用机理

酪氨酸酶作用机理
酪氨酸酶是一种重要的酶,在乳制品加工、医药、化妆品等领域
中具有广泛的应用。
其作用机理是指酪氨酸酶能够将牛奶中的酪蛋白
分解为较小的肽链和游离氨基酸,从而改变牛奶的物化特性。
下面将
分步骤阐述酪氨酸酶的作用机理。
第一步:定位酪氨酸酶的活性中心
酪氨酸酶的分子结构中包含一个活性中心,通常是一组氨基酸残基,能够催化酪蛋白的降解。
这个活性中心的位置和构成对酪氨酸酶
的催化活性和与其底物的亲和力有重要的影响。
第二步:结合底物
酪氨酸酶的活性中心能够与酪蛋白中的特定结构域结合,从而使
酪蛋白在水中分解为多肽和游离氨基酸。
酪氨酸酶催化的反应在酪蛋
白中产生裂解,释放出破碎的多肽和氨基酸。
第三步:酶催化作用
酪氨酸酶催化的反应分为两步:
第一步是水分子攻击酪蛋白中的肽键,断裂肽链,形成一个临时
的酰-酶过渡态。
第二步是氨基酸残基与酰-酶过渡态相互作用,并在酶的作用下
被氧化,释放氨。
第四步:酶与底物的解离
酶基本上是一种催化剂,可以加速特定化学反应的速率,但化学
反应后酶并不会消失。
在酪氨酸酶催化下,酪蛋白分解为多肽和游离
氨基酸,酶依然存在于反应体系中,并可以继续催化其他反应。
在酶
催化作用完成后,酶与底物解离,以便继续催化下一个反应。
综上所述,酪氨酸酶作用机理可以通过四个步骤来解释,即定位
酶的活性中心、结合底物、酶催化作用和酶与底物的解离。
这一过程
可以加速降低牛奶中的酪蛋白分子,从而改变牛奶的化学和物理性质,具有非常重要的工业和农业应用价值。
酪氨酸酶抑制及激活作用动力学的分析

❖ 酪氨酸酶是皮肤黑素生物合成的关键酶,它不仅决定黑素 合成的速率,还是黑素细胞分化成熟的特征性标志,因此 它给人体皮肤美白带来困难。酪氨酸酶的活性与黑素合成 量相关,控制其活力即可控制黑素生成量。因此,研究酪 氨酸酶的抑制,对防止水果、蔬菜的褐变,化妆品中的皮 肤增白,以及因酪氨酸酶催化产生黑色素引起的疾病(黄 褐斑、黑色素瘤等色素沉着性皮肤病等),具有非常重要 的治疗意义。
一、实验基本原理
酪氨酸酶(Tyraseosinase ,Tyrase)又称儿茶酚氧 化酶(Ec.1.14.18.1)属于 多酚氧化酶(漆酶和二酚 氧化酶)中的一种。它广 泛存在于红薯、香蕉、苹 果、蘑菇、马铃薯及人体 等动植物中,也存在于微 生物,特别是霉菌之中。
在动植物体内,酪氨酸酶 对酪氨酸和其它酚类化合 物的代谢以及黑色素的合 成起重要的催化作用。酪 氨酸酶可以催化两类不同 的反应:单酚羟基化形成 邻二酚和邻苯二酚氧化成 邻醌,这两类反应都必须 有氧分子的直接参与。
实验仪器和条件
北京普析通用UV-1901 紫 外可见分光光度计
实验条件: 缓冲液:0.1mol/LpH 6.8磷酸盐缓冲液。 底物:25mol/L 邻苯二 酚 化合物溶液的配制: 1-萘酚和二羟基二苯甲酮 用乙醇配成50mol/L。 2-萘酚和六羟基二苯甲酮 用乙醇配成10mol/L。 硫酸亚铁和硫酸铜用蒸馏 水配成50mol/L。
曲酸抑制酪氨酸酶机制

曲酸抑制酪氨酸酶机制
曲酸是一种天然存在的有机酸,它被发现具有抑制酪氨酸酶的
作用。
酪氨酸酶是一种酶类蛋白质,它在生物体内起着重要的生物
催化作用,参与酪氨酸的代谢过程。
曲酸对酪氨酸酶的抑制机制涉
及多个方面。
首先,曲酸可能通过竞争性抑制来影响酪氨酸酶的活性。
竞争
性抑制是指曲酸与酪氨酸酶的活性部位结合,从而阻止酪氨酸分子
与酶结合并发生化学反应,从而抑制了酶的活性。
其次,曲酸可能通过非竞争性抑制机制来影响酪氨酸酶的活性。
非竞争性抑制是指曲酸结合到酶的其他位点,改变了酶的构象或活性,导致酶失去对底物的亲和力或者失去催化作用。
此外,曲酸还可能通过影响酶的翻译或转录过程来抑制酪氨酸
酶的合成,从而降低酶的活性。
总的来说,曲酸抑制酪氨酸酶的机制是多方面的,涉及竞争性
抑制、非竞争性抑制以及对酶合成过程的影响。
这些机制共同作用,导致了曲酸对酪氨酸酶活性的抑制。
深入研究这些机制有助于我们
更好地理解曲酸在生物体内的作用,也有助于开发新的药物或治疗方法。
几种中药提取物对酪氨酸酶活性的抑制

几种中药提取物对酪氨酸酶活性的抑制
韩强;林惠芬
【期刊名称】《香料香精化妆品》
【年(卷),期】1998(000)004
【摘要】体外测定了几种中药提取物对酪氨酸酶活性的抑制作用,发现这些提取物均有抑制活性,其中甘草最强,其它为:川芎〉当归〉车前子〉茯苓。
【总页数】3页(P22-24)
【作者】韩强;林惠芬
【作者单位】上海日用化学工业研究所;上海日用化学工业研究所
【正文语种】中文
【中图分类】TQ658.2
【相关文献】
1.几种中药提取物对血管内皮细胞与单核细胞粘附的抑制作用 [J], 郝钰
2.几种天然植物提取物对酪氨酸酶活性的抑制作用 [J], 曹伟伟;朱晓娜;李明静
3.54味中药乙醇提取物对酪氨酸酶活性抑制作用的研究 [J], 刘之力;涂彩霞;史月君;刘新国
4.黑果枸杞果实提取物中花色苷对酪氨酸酶活性的抑制作用初探 [J], 黄佳楠; 管福琴; 李林蔚; 李晓莺; 禄璐; 米佳; 刘兰英; 陈雨
5.中药对黑素生物合成影响研究Ⅰ.82味中药乙醇提取物对酪氨酸酶活性的抑制作用 [J], 雷铁池;朱文元;夏明玉;张美华;范卫新
因版权原因,仅展示原文概要,查看原文内容请购买。
天然酪氨酸酶抑制剂的种类及其对酪氨酸酶抑制作用的研究进展

天然酪氨酸酶抑制剂的种类及其对酪氨酸酶抑制作用的研究进
展
毕云枫;宋凤瑞;刘志强
【期刊名称】《吉林大学学报(医学版)》
【年(卷),期】2014(040)002
【摘要】本文综述了几类天然植物来源的化合物,如黄酮及其衍生物、有机酸、苷类、萜类、醛类、酯类和香豆素类等天然产物成分对酪氨酸酶活力的抑制作用及其机制.其抑制作用可以分为竞争性抑制、非竞争性抑制和混合型抑制.同类化合物的抑制能力与化合物活性基团的种类、数量和位置有关联.许多化合物对酪氨酸酶的抑制能力强于当前的标准抑制剂.本文重点阐述了几类天然成分对酪氨酸酶的抑制机理,为酪氨酸酶在各个领域的应用提供依据.
【总页数】6页(P454-459)
【作者】毕云枫;宋凤瑞;刘志强
【作者单位】吉林农业大学食品科学与工程学院食品质量与安全教研室,吉林长春130118;中国科学院长春应用化学研究所化学生物学实验室长春质谱中心,吉林长春130022;中国科学院长春应用化学研究所化学生物学实验室长春质谱中心,吉林长春130022;中国科学院长春应用化学研究所化学生物学实验室长春质谱中心,吉林长春130022
【正文语种】中文
【中图分类】R915;O656
【相关文献】
1.天然源酪氨酸酶抑制剂研究进展 [J], 杨新玲;李纲
2.天然植物酪氨酸酶活性抑制剂研究进展 [J], 熊雄;单连海
3.几种天然植物提取物对酪氨酸酶活性的抑制作用 [J], 曹伟伟;朱晓娜;李明静
4.天然产物对酪氨酸酶抑制作用的研究进展 [J], 徐学涛;张焜;杜志云;韦星船;任清刚;朱华;邓运泉;竺琴
5.中药材中酪氨酸酶抑制剂筛选方法研究进展 [J], 徐敬朴;陶兴隆;郑丽亚
因版权原因,仅展示原文概要,查看原文内容请购买。
酪氨酸酶活性抑制实验方法

酪氨酸酶活性抑制实验方法一、试剂:酪氨酸酶、酪氨酸、磷酸二氢钠、磷酸氢二钠、阳性对照(熊果苷粉末)、样品、去离子水二、试剂配制:1、磷酸盐缓冲溶液(PH=6.8):先分别配制0.2M的磷酸二氢钠和0.2M的磷酸氢二钠。
0.2M磷酸二氢钠:称取 71.6g Na2HPO4-12H2O,溶于 1000ml 去离子水;0.2M磷酸氢二钠:称取 31.2g NaH2PO4-2H2O,溶于1000ml 去离子水;取51ML磷酸二氢钠+49ML磷酸氢二钠即得0.2M、PH=6.8的磷酸缓冲液。
2、L-酪氨酸溶液:称取L-酪氨酸25.6 g,用磷酸缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
3、酪氨酸酶溶液:将马铃薯洗净,于4℃预冷4h左右。
去皮,切成约1.0 cm3丁状,于-20℃冷冻过夜。
称重,按1:1(W:V )的比例加入4℃预冷的磷酸钠缓冲液,用组织捣碎机制成匀浆,3层纱布过滤,滤液于4000 r/min离心10min,上清液即为所得的酪氨酸酶粗酶液,4℃保存,2h内用完。
4、受试液的配制:将原先所配5mg/ml的溶液用甲醇稀释到1mg/ml.。
5、阳性对照:取熊果苷粉末0.01g,溶于10ml的甲醇溶液,即得1mg/ml的对照品溶液。
三、实验方法:依下表所示向试管中依次加入磷酸盐缓冲溶液、样品溶液、酪氨酸溶液,于35℃水浴10分钟。
然后加入酪氨酸酶液,混匀,再在35 ℃下孵育30min,迅速转移至比色皿中,在475nm处测定吸光值。
受试组用空白对照组1调零,阴性对照组用空白对照组2调零,阳性对照组用空白对照组3调零。
受试组吸光值为A1,阴性对照组吸光值为A2,阳性对照组吸光值为A3。
抑制率=1-[(A1-A2)/(A3-A2)]×100%=(A3-A1)/(A3-A2)×100% 注:受试液组共四种样品。
阻断黑色素运转的原理

阻断黑色素运转的原理黑色素(melanin)是一种由酪氨酸合成的天然色素,负责为皮肤、毛发和眼睛提供颜色。
然而,存在许多因素会导致黑色素的过度运转,例如紫外线照射、遗传因素、激素变化等。
阻断黑色素运转的原理是通过调节黑色素生成的关键环节,包括酪氨酸酶(tyrosinase)活性的抑制、酪氨酸合成途径的调控以及黑色素细胞分解的促进等。
首先,为了阻断黑色素运转,重要的一步是抑制酪氨酸酶活性。
酪氨酸酶是催化酪氨酸转化为多巴酚的关键酶,它参与了黑色素生成的起始步骤。
因此,通过抑制酪氨酸酶活性可以有效阻断黑色素生成。
研究表明,一些天然物质和化学物质具有抑制酪氨酸酶活性的能力,例如某些植物提取物(如白芨花提取物、蛇麻子提取物)和化妆品添加剂(如酪酸钾、阿魏酸等)。
这些物质通过与酪氨酸酶结合,阻止其催化反应的进行,从而降低黑色素生成的速度。
其次,调控酪氨酸合成途径也是阻断黑色素运转的关键。
酪氨酸的合成路径主要包括苯丙氨酸途径和酪氨酸途径。
苯丙氨酸途径主要是通过苯丙氨酸羟化酶催化苯丙氨酸转化为酪氨酸,而酪氨酸途径则是通过酪氨酸合酶催化苯丙氨酸转化。
因此,通过控制这两个途径的关键酶的表达和活性,可以调节黑色素生成的速度。
研究表明,某些化合物,如维生素C,可以抑制苯丙氨酸羟化酶的活性,从而降低黑色素生成。
此外,一些化妆品添加剂也具有调节酪氨酸合成途径的功能,如阿魏酸可以抑制酪氨酸合酶的活性。
最后,降解已生成的黑色素细胞也是阻断黑色素运转的一个重要策略。
黑色素细胞通过皮肤的脱落和代谢来减少其数量,从而降低黑色素的生成。
研究表明,一些物质,如类金胺酸(catecholamines)和类金胺酸酸(catecholaminergic acids),可以促进黑色素细胞的降解,从而减少黑色素的生成。
此外,某些化妆品添加剂也具有促进黑色素细胞降解的作用,如富马酸钾和芦荟提取物。
综上所述,阻断黑色素运转的原理涉及抑制酪氨酸酶活性、调控酪氨酸合成途径以及促进黑色素细胞降解等关键环节。
酪氨酸酶抑制剂的应用研究进展

酪氨酸酶抑制剂的应用研究进展胡泳华;贾玉龙;陈清西【摘要】酪氨酸酶是一类络合铜离子的金属酶类,广泛存在于动植物、微生物及人体中,是生物体合成黑色素、果蔬褐变的关键酶.酪氨酸酶的异常表现可能会出现黑色素瘤等,黑色素异常生成造成的色素沉着是动物衰老及果蔬褐变的重要表现.综述了酪氨酸酶抑制剂在美容保健、色素型皮肤病的治疗、病虫害防治以及食品保鲜等方面的应用,如:通过直接抑制酪氨酸酶活性以及调控细胞中酪氨酸酶的表达量来有效调控黑色素的生成,从而达到美白及治疗色素紊乱症的作用;抑制果蔬褐变,延长货架期;抑制昆虫蜕皮时的鞣化,达到杀灭农业害虫的目的;提高微生物对于紫外线及其他辐射的敏感度,进一步达到抑菌的目的.【期刊名称】《厦门大学学报(自然科学版)》【年(卷),期】2016(055)005【总页数】9页(P760-768)【关键词】酪氨酸酶抑制剂;医疗美容;害虫防治;保鲜;生物抗菌【作者】胡泳华;贾玉龙;陈清西【作者单位】厦门大学生命科学学院,福建厦门361102;厦门大学生命科学学院,福建厦门361102;厦门大学生命科学学院,福建厦门361102【正文语种】中文【中图分类】Q356.1酪氨酸酶(tyrosinase,EC 1.14.18.1)广泛分布于微生物、动植物及人体中,在植物中,酪氨酸酶一般称为多酚氧化酶;在昆虫中,一般称为酚氧化酶;在微生物和人体中,称为酪氨酸酶.酪氨酸酶是生物体合成黑色素、果蔬褐变的关键酶,在昆虫蜕皮时的鞣化过程和伤口愈合中起重要作用,细菌的黑色素能保护细菌细胞和孢子免受紫外线的伤害.酪氨酸酶具有单酚酶和二酚酶双重催化功能,在单酚酶的作用下,酪氨酸被羟基化成L-多巴(L-DOPA),在二酚酶的作用下,L-DOPA被氧化生成多巴醌,多巴醌再经过一系列的反应之后生成黑色素[1].酪氨酸酶表现异常,有可能会出现黑色素瘤及早发性老年痴呆疾病等,黑色素异常生成造成的色素沉着是动物衰老及果蔬褐变的重要表现[2].酪氨酸酶抑制剂应用广泛,涉及美容保健、色素型皮肤病治疗、病虫害防治以及食品保鲜等多个领域.黑素细胞中酪氨酸酶的基因转录是在小眼转录因子(microphthalmia transcription factor,MITF)的调控下进行的,MITF是黑素细胞增殖及黑素生成过程中起决定性作用的转录因子.现有研究表明,很多信号途径参与调节MITF的表达,例如:Wnt信号途径、cAMP(cyclic adenosine monophosphate)信号途径、P38及MAP(mitogen activated protein)激酶信号途径等[3],一些主要信号通路总结于图1所示.在阳光照射(即紫外线的刺激下),皮肤角化细胞中的黑色素体受到刺激,可以通过促使分泌促肾上腺皮质激素和α-MSH黑色素细胞刺激素激活ACTH(adreno cortico tropic hormone)和PGE2(prostaglandin E2)蛋白的活化,激活cAMP调节CREB和CRE复合体的形成,进一步激活通路下游的酪氨酸酶活化;CREB/CRE复合体也可以通过上游NOS活化导致PKG(protein kinase G)通路激活而完成,DAG调控的PKC(protein kinase C)通路同样可以达到活化复合体的作用.CREB/CRE复合体激活之后,调节黑色素信号通路中的关键因子MITF在细胞核内完成MBOX结合,激活酪氨酸酶、相关蛋白TRP-1和DCT的大量表达活化.在完成黑素合成相关基因转录后,黑素在黑素小体内主要通过酪氨酸酶的作用进行合成,在人体皮肤角化细胞中,黑色素的形成导致表皮褐变,产生黑斑.以酪氨酸酶抑制剂作为化妆品美白添加剂的作用靶点主要是通过抑制酪氨酸酶的活性和调节酪氨酸酶的转录.其中抑制酪氨酸酶活力的作用模式是目前市场上大多数美白化妆品类开发应用的依据[4].黑色素细胞树突生长障碍是造成白癜风的病因之一,Wang等[5]研究了Rnaset2在人体黑色素细胞中的作用,研究结果表明Rnaset2是调控色素细胞树突生成的关键蛋白之一.Ito等[6]研究诱变白斑病相关酚类发现其能被酪氨酸酶催化,但相应的酚类抑制剂却不能被催化,证实酚类酪氨酸酶抑制剂在开发时需要先检查其是否能够被酪氨酸酶催化.孙道权等[7]研究了水溶性丝胶蛋白能够有效抑制黑色素生成,丝胶粉能够抑制皮肤中的酪氨酸酶活性,从而抑制黑色素的生成,对皮肤起到一定美白作用.陈龙等[8]的研究发现鱼胶原肽能够有效地抑制酪氨酸酶活性,鱼胶原肽可作为无毒副作用的纯天然美白化妆品原料.成静等[9]的研究发现胶原三肽作为构成胶原的最小单位,能够很好地抑制酪氨酸酶活性,在小鼠的黑色素瘤B16细胞中,既能够很好地抑制黑色素生成,同时又对细胞毒性较低.刘琦等[10]研究了维生素C、乙基醚、烟酰胺、β-熊果苷等美白化妆品成分对酪氨酸酶活性的抑制作用,研究表明3种美白剂对于酪氨酸酶的抑制作用表现为非竞争型抑制机理,说明他们与酪氨酸酶的独立部位结合,而不会和底物竞争活性中心.张凤兰等[11]研究表明,熊果苷具有一定的毒性,但它能被人体皮肤表面分离的菌株代谢转变成氢醌类化合物,但转变程度不足以对人CHO (Chinese hamster ovary)细胞产生致畸作用.杨美花等[12]的研究表明L-半胱氨酸能够有效抑制酪氨酸酶的活性,并且能够被酪氨酸酶催化成一种无色底物,使酪氨酸酶不表现出活性,并在细胞水平上证明L-半胱氨酸能够作为一种安全无毒的美白化妆品有效成分.还有很多研究发现多种药用植物中能够提取出有效抑制酪氨酸酶活性的成分,从而极大地丰富了酪氨酸酶抑制剂来源.Bae等[13]从毛壳属植物中提取的毛壳素就能够很好地抑制酪氨酸酶活性并且抑制小鼠黑色素瘤中黑色素的生成.柯静霞[14]的研究表明,蛇婆子提取物在使用8周水平上,能够有效抑制酪氨酸酶活性,降低黑色素活性,并且有效降低黑色素生成量,从而具有一定的美白功效.罗倩仪等[15]通过酪氨酸酶抑制模型研究了几种美白祛斑复配配方的实际筛选和功能优化,实验证明壬二酸衍生物、红景天提取物能够具有一定的美白祛斑作用.Lin等[16]从台湾火刺木中分离的活性物质也能够高效低毒的对酪氨酸酶产生良好的抑制效果并且作为美白剂进行使用.铃木敏幸等[17]对美白化妆品的发展方向进行综述时也提到,通过酪氨酸酶的阻碍实验可以有效地评价美白剂的相关作用,并且能够反映化妆品降低黑素生成的能力.早在2005年刘之力等[18]提到,中药复方乙醇提取物对酪氨酸酶有时也会存在激活作用,但激活酪氨酸酶活力并不代表能够在动物试验中增加黑色素生成的作用.马秋华等[19]从商品化的药物筛选到壬二酸,发现其具有抑制酪氨酸酶活性,并且能够有选择性地抑制黑色素过多的异常化细胞,作为一种美白化妆品的原料.付晓磊等[20]基于商品化的酪氨酸酶抑制剂对苯二酚合成了一系列对苯二酚氨基酸缀合物,通过表征实验证明其能够有效地抑制酪氨酸酶活性,通过构效关系模型研究证实了其具有良好的抑制活性;宋长伟等[21]基于龙胆酸化合物设计合成了系列衍生物,也具有良好的抑制黑色素生成的作用.以上的研究结果显示,酪氨酸酶抑制剂在化妆品研制过程中作为美白添加剂,能够保护人体皮肤免受紫外线辐射.酪氨酸酶在植物体内广泛存在,其很早就被作为植物储藏期间色变腐烂的原因加以研究.果蔬体内多酚氧化酶主要存在于完整细胞的质体、线粒体等细胞器内膜和细胞膜上及细胞质中,而酚类底物存在于液泡中,这种区室化分布减少了酚类物质与酶的接触,避免了正常组织中酶促褐变的发生.果蔬等产品在受到机械损伤或处于低温、高温环境下,细胞膜的完整性被破坏,区室化分布受到损害,使得酚类物质与多酚氧化酶相接触,加速了正常组织的褐变过程[22-23].在多酚氧化酶作用下,果蔬内源性多酚类物质如酪氨酸、多巴等氧化形成醌,醌类物质再聚合形成类黑色素,从而导致产品变色,造成营养丢失及经济损失.早期,含硫化合物广泛应用于食品的抗褐变中,王伟等[24]发现亚硫酸氢钠对马铃薯多酚氧化酶具有显著的抑制作用及在马铃薯切片护色中具有防褐变功能.然而,这些含硫化合物由于硫的残留对人体的健康造成一定的影响逐步被限制使用.目前,普遍的保鲜方法大致可以分为以下几类:低温保鲜[25-26]、化学保鲜[27-28]、气调保鲜[29-30]、涂膜保鲜[31-32]、臭氧保鲜[33-34]以及辐射保鲜[35-36]等.这些方法虽然可以不同程度地对食品的保鲜起到一定的作用,但由于成本高、费用多等原因而不能得到广泛应用.因此寻求一种高效、简单、低价的保鲜方法显得十分的重要.Sato等[37]从Lentinula edodes中克隆了1 854 bp的Letyr基因,其编码618个氨基酸残基的分子质量为68 ku的蛋白.该基因在蘑菇采后保鲜过程中的表达量大量增加.Sakamoto等[38]采用抑制消减杂交的方法发现采后的Lentinula edodes中两个酚氧化酶基因(酪氨酸酶tyr和漆酶lcc4)的表达明显增加,并且鉴定出这是导致蘑菇褐变的主要原因.因此,可以通过抑制酪氨酸酶的活力达到抑制或延缓食品褐变的发生,而且酪氨酸酶还是各种微生物生命活动所必需的酶,抑制酪氨酸酶的活性还能抑制腐烂菌的生长,达到保鲜防腐的目的,且不影响食品的风味及口感. 常见的酪氨酸酶抑制剂如半胱氨酸、抗坏血酸、柠檬酸等已应用于食品的保鲜中[39-40].Dawley等[41]研究了4-己基间苯二酚对蘑菇酪氨酸酶的抑制作用,而4-己基间苯二酚已被应用于防止苹果片褐变[42]以及延缓虾类产品体内水溶性色原物质被氧化成黑色素而造成虾头胸部黑变[43].Lin等[28]研究了没食子酸丙酯对酪氨酸酶的作用,而后将其应用于龙眼的保鲜中,取得了很好的抗褐变效果.Xing等[44]发现铁取代磷酸盐(Na6PMo11FeO40)对酪氨酸酶是可逆的非竞争型抑制作用,并且其可以显著地延缓莲藕切片的褐变.植酸(又称为肌醇六磷酸)可以很好地抑制苹果汁中的多酚氧化酶活力从而可以显著地降低苹果汁在加工过程中褐变的发生[45].另外,冷冻处理、70 ℃热变性或者300~1 000 MPa高压处理也可以使酪氨酸酶活力失活[46],但这些处理可能对食品的品质造成一定的影响,因此从酪氨酸酶抑制剂出发寻找高效的保鲜剂不失为一种有效的手段.本研究采用酪氨酸酶抑制剂研究了抑制剂对马铃薯条、双孢蘑菇、龙眼及荔枝的抗褐变保鲜,研究结果如图2所示.由图2可知,对照组的马铃薯条比实验组褐变严重;对照组的蘑菇表皮褐变严重,出现腐烂现象;对照组的龙眼表皮褐变严重,有掉果及腐烂现象;而对照组的荔枝果实出现褐变、发霉现象.可见酪氨酸酶抑制剂可以很好地延缓果蔬褐变的发生.随着人口数量的不断增长及生活质量的不断提高,粮食短缺所带来的威胁也越来越严重,粮食产量受到自然灾害及病虫害的极大挑战.农药是控制病虫害、提高粮食产量的最有效手段之一.然而由于农药的广泛应用使得害虫的抗药性不断上升,农药本身的毒性亦不断上升,这对自然环境以及人类自身都构成了极大的威胁.面对这一严峻形势,研制新型、无公害、对环境友好的低毒高效杀虫剂已成为农业工业的第一目标,现有的农药品种远远不能满足粮食生产的需要,仍然需要大力加强农药新品种的研究与开发[47].早在1993年著名昆虫毒理学家张宗炳等[48]指出:探索新杀虫药剂的一条最有希望的途径是生物途径,其中酪氨酸酶抑制剂可列入首选.酪氨酸酶在昆虫的正常发育过程中具有重要的生理功能.它主要参与表皮的硬化、黑化过程;参与对外来侵染物的免疫防御反应;参与伤口愈合反应[49-51].在昆虫表皮硬化过程中,酪氨酸酶催化单酚羟化为二酚,然后氧化成醌,醌与表皮层中的角蛋白及几丁质相互作用,互相交联在一起,形成角质,高度硬化的角质可以阻断微生物和异物的入侵,形成保护昆虫的第一道屏障.此外,酪氨酸酶还可产生具有细胞毒杀作用的氧自由基和具有潜在细胞毒杀作用的半醌及三羟酚,进一步增强寄主的防御能力.在较高等的无脊椎动物如节肢动物中,酪氨酸酶除了参与角质的硬化和黑化外,还参与其他2种重要的生理过程,即防御反应(节肢动物免疫)和伤口愈合.对于小颗粒异物如细菌,宿主可通过吞噬作用加以消灭.当入侵的异物太大(如寄生虫),宿主便通过黑色素包被作用来抵抗和消灭寄生虫,而酪氨酸酶在这个过程中起重要作用.由于这些过程可能是害虫形成防御体系的重要反应,因此酪氨酸酶有可能作为害虫控制中的一个作用靶标.天然酪氨酸酶抑制剂将成为继几丁质酶抑制剂后的一类新的环境友好型的害虫生物调控剂.本实验室设计的酪氨酸酶抑制剂3,4-二羟基苯甲酸庚酯对于菜青虫(Pieris rapae L.)具有杀灭作用,将质量浓度分别为0,2.5,5,10,20,40 mg/mL的酪氨酸酶抑制剂和菜青虫饲料混合均匀,制成内吸型杀虫剂配方,对菜青虫喂养持续3 d,在第3天观察效果(图3)发现,5 mg/mL的质量浓度就可以有效抑制菜青虫幼虫的生长,这主要是通过抑制昆虫幼虫生长过程中的表皮糅化来达成的,可见这种质量浓度饲喂的幼虫大小明显小于对照组,而10 mg/mL的质量浓度以上,则可以完全杀灭菜青虫幼虫,说明了酪氨酸酶抑制剂可以有效抑制农业常见害虫幼虫的生长,在高浓度作用下,能够有效杀灭害虫幼虫,具有较好的研究价值和应用前景.Dong等[52]克隆了小菜蛾中的多酚氧化酶(PPO)并通过real-time PCR研究发现PPO存在于小菜蛾的不同发育阶段.Bhonwong等[53]比较了过表达PPO、抑制PPO表达以及正常的马铃薯叶喂养棉铃虫及甜菜夜蛾的生长情况,结果证实了PPO 在抑制棉铃虫及甜菜夜蛾的生长发育中起到重要的作用.Pan等[54]合成了系列的3,4-二羟基烷基酯,该系列化合物可以有效地抑制酪氨酸酶活力,并且发现其能使小菜蛾的生长明显受到抑制,进一步研究发现该系列化合物能使小菜蛾中PPO基因表达下降,从而抑制其生长.此外,曲酸[55]、缩氨基硫脲类化合物[56]、苯胺类席夫碱[57]以及α-巯基-β-取代苯基丙烯酸[58]等化合物对昆虫酚氧化酶具有很好的抑制作用,这为研究开发新型的“昆虫生命活动干扰剂”进行了有益探索.酪氨酸酶是合成黑色素的关键酶,其代谢产生的黑色素能够有效提高细菌对抗紫外线以及其他电离辐射作用[59].蔡信之等[60]甚至将高表达酪氨酸酶的基因转入苏云金芽胞杆菌中,用以增强细菌的抗紫外线以及抗辐射能力.因此,筛选出能够抑制微生物的酪氨酸酶活性便显得尤为重要.Basavegowda等[61]通过对青蒿素提取物进行纳米金属离子处理后,发现其不仅能够有效抑制酪氨酸酶,还能够表现出良好的抑菌活性.田敏等[62]通过对环境微生物进行筛选,以链霉菌X59为鉴定菌的黑色素生物合成抑制剂筛选模型,从4 000余种微生物中筛选出一株活性化合物产生菌,其代谢产物能够有效抑制黑色素的生物合成.黄晓冬等[63]研究了红树植物桐花树叶片多酚提取物能够抑制酪氨酸酶活性并对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌具有明显的抑制活性;鲁卫斌等[64]的研究表明直接从马铃薯中提取的酪氨酸酶用于处理羊毛,具有一定的抗菌功效,并且对金黄色葡萄球菌的抑菌率能达到76.32%.Xia等[65]的研究表明,5-羟基-4-乙酰基-2,3-萘二羧酸酐萘酚-呋喃能够有效地抑制酪氨酸酶活性,同时抑制细菌的生长.王聪慧等[66]的综述中也提到,茶多酚作为一种天然化合物,能够有效地抑制酪氨酸酶活性,同时具有很好的抑菌功效,对伤寒杆菌、副伤寒杆菌、痢疾杆菌、溶血性链球菌、金黄色葡萄球菌等均有明显的抑制作用;也有前人研究证实丁香酚能够在抑制酪氨酸酶活性的同时,对黄曲霉、烟曲霉、产黄青霉、桔青霉、粘红酵母的生长均有不同程度的抑制作用,是一种良好的天然防腐剂.张丽娟等[67]研究了3-羟基苯甲酸对酪氨酸酶的抑制机理以及几种常见腐败菌的抑制作用,证明了3-羟基苯甲酸具有很好的抑制酪氨酸酶及细菌生长的作用.陈祥仁等[68]研究了3,4-二羟基氰苯对于酪氨酸酶稳态酶活力以及酶促反应的迟滞时间有影响,同时能够很好地抑制大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌3种细菌和真菌白色假丝酵母的生长.本文中研究了酪氨酸酶抑制剂对细菌的抑制作用,研究结果如图4所示.4-苯基丁醇对克雷伯氏肺炎菌(图4(a))、根癌农杆菌(图4(b))和沙门氏菌(图4(c))均有一定的抑制作用并呈浓度依赖效应.3-羟基苯甲醛对克雷伯氏肺炎菌(图4(d))、根癌农杆菌(图4(e))和沙门氏菌(图4(f))有一定的抑制作用,但效果不如4-苯基丁醇明显.综上,酪氨酸酶抑制剂可以很好地应用于生物抗菌中.目前,酪氨酸酶抑制剂已经在医疗、农业抗虫、食品保鲜等多方面得到了广泛的应用,但就其在黑色素合成信号通路的作用、抑制农业害虫及微生物的生长以及食品的防褐变保鲜中的具体作用机制仍需进一步研究.【相关文献】[1] 陈清西,宋康康.酪氨酸酶的研究进展[J].厦门大学学报(自然科学版),2006,45(5):731-737.[2] 陈清西,林建峰,宋康康.酪氨酸酶抑制剂的研究进展[J].厦门大学学报(自然科学版),2007,46(2):274-282.[3] LEE H S,GOH M J,KIM J,et al.A systems-biological study on the identification of safe and effective molecular targets for the reduction of ultraviolet B-induced skin pigmentation[J].Sci Rep,2015,2(5):10305.[4] 孙蓓,李潇,卢永波.影响皮肤黑素沉着的美白制剂及其作用机制研究进展[J].中国美容医学,2015,24(22):82-85.[5] WANG Q,WANG X,LE Y,et al.Rnaset2 inhibits melanocyte outgrowth possibly through interacting with shootin1[J].J Dermatol Sci,2015,80 (1):25-32.[6] ITO S,WAKAMATSU K.A convenient screening method to differentiate phenolic skin whitening tyrosinase inhibitors from leukoderma-inducing phenols[J].J DermatolSci,2015,80(1):18-24.[7] 孙道权,庄愉,盛家镛,等.可用于化妆品中水溶性丝胶粉的性能研究[J].日用化学工业,2014,44(12):683-687.[8] 陈龙,陈栋梁,杨国燕,等.鱼胶原肽抑制酪氨酸酶活性能力的比较研究[J].中国美容医学,2008,17(10):1512-1515.[9] 成静,陈栋梁,江雪琼,等.胶原三肽对B16黑素瘤细胞黑素合成的影响[J].中国美容医学,2011,20(6):939-942.[10] 刘琦,刘洋,吴金昊,等.几种美白剂抑制酪氨酸酶活性的研究[J].日用化学品科学,2015,38(11):22-27.[11] 张凤兰,黄湘鹭,曹进,等.熊果苷的遗传毒性及人体表皮细菌对熊果苷代谢转化作用研究[J].中国药事,2014,28(4):375-380.[12] 杨美花,李智聪,刘凤娇,等.L-半胱氨酸作为化妆品美白添加剂的作用机理[J].厦门大学学报(自然科学版),2009,48(4):581-584.[13] BAE J S,HAN M,YAO C,et al.Chaetocin inhibits IBMX-induced melanogenesis inB16F10 mouse melanoma cells through activation of ERK[J].Chem BiolInteract,2015,245:66-71.[14] 柯静霞.蛇婆子提取物在化妆品中的应用及美白功效研究[J].日用化学品科学,2011,34(5):30-33.[15] 罗倩仪,钟理.美白祛斑剂的复配研究及在化妆品中的应用[J].广东化工,2012,39(15):10-11.[16] LIN R D,CHEN M C,LIU Y L,et al.New whitening constituents from taiwan-native Pyracantha koidzumii:structures and tyrosinase inhibitory analysis in human epidermal melanocytes[J].Int J Mol Sci,2015,16 (12):28598-28613.[17] 铃木敏幸,芋川玄尔.美白化妆品发展趋向[J].上海轻工业,1996(4):20-24.[18] 刘之力,李雅莉,刘俐,等.六种中药复方乙醇提取物对酪氨酸酶激活作用及动物致色素作用的研究[J].中国皮肤性病学杂志,2005,19(10):588-591.[19] 马秋华,汪峰,周春英.壬二酸衍生物抑制酪氨酸酶活性实验研究[J].中国麻风皮肤病杂志,2011,27(3):215-217.[20] 付晓磊,赵春晖,张翼轩,等.对苯二酚的氨基酸缀合物的合成、表征及美白活性[J].应用化学,2015,32(2):158-166.[21] 宋长伟,熊丽丹,王裕军,等.新型龙胆酸衍生物的合成及其抑制酪氨酸酶活性研究[J].有机化学,2012,32:1753-1758.[22] 林河通,席芳,陈绍军.果实贮藏期间的酶促褐变[J].福州大学学报(自然科学版),2002,30(增刊):696-703.[23] CIOU J Y,LIN H H,CHIANG P Y,et al.The role of polyphenol oxidase and peroxidase in the browning of water caltrop pericarp during heat treatment[J].FoodChemistry,2011,127(2):523-527.[24] 王伟,胡泳华,黄浩,等.亚硫酸氢钠在马铃薯切片过程中防褐变作用机理的研究[J].厦门大学学报(自然科学版),2010,49(2):256-259.[25] WANG C X,LV X N,LIU Y,et al.Influence of tempe-rature and relative humidity on aging of atmospheric plasma jet treatment effect on ultrahigh-modulus polyethylene fibers[J].Journal of Adhesion Science and Technology,2007,21(15):1513-1527.[26] LATTAB N,KALAI S,BENSOUSSAN M,et al.Effect of storage conditions (relative humidity,duration,and temperature) on the germination time of Aspergillus carbonarius and Penicillium chrysogenum[J].International Journal of FoodMicrobiology,2012,160(1):80-84.[27] GACCHE R N,ZORE G B,GHOLE V S.Kinetics of inhibition of polyphenol oxidase mediated Browning in apple juice by beta-cyclodextrin and L-ascorbate-2-triphosphate[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2003,18(18):1-5. [28] LIN Y F,HU Y H,LIN H T,et al.Inhibitory effects of propyl gallate on tyrosinase and its application in controlling pericarp browning of harvested longan fruits[J].J Agric FoodChem,2013,61:2889-2895.[29] GUILLAUME C,SCHWAB I,GASTALDI E,et al.Biobased packaging for improving preservation of fresh common mushrooms (Agaricus bisporus L.)[J].Innovative Food Science & Emerging Technologies,2010,11 (4):690-696.[30] BAN Z J,LI L,GUAN J F,et al.Modified atmosphere packaging (MAP) and coating for improving preservation of whole and sliced Agaricus bisporus[J].Journal of Food Science and Technology,2014,51(12):3894-3901.[31] JIANG T J.Effect of alginate coating on physicochemical and sensory qualities of button mushrooms (Agaricus bisporus) under a high oxygen modifiedatmosphere[J].Postharvest Biology and Technology,2013,76:91-97.[32] HONG K Q,XIE J H,ZHANG L B,et al.Effects of chitosan coating on postharvest life and quality of guava (Psidium guajava L.) fruit during cold storage[J].Scientia Horticulturae,2012,144:172-178.[33] DING T,RAHMAN S M E,OH D H.Inhibitory effects of low concentration electrolyzed water and other sanitizers against foodborne pathogens on oyster mushroom[J].Food Control,2011,22(2):318-322.[34] YUK H G,YOO M Y,YOON J W,et al.Effect of combined ozone and organic acid treatment for control of Escherichia coli O157:H7 and Listeria monocytogenes on enoki mushroom[J].Food Control,2007,18(5):548-553.[35] FERNANDES A,BARREIRA J C M,ANTONIO A L,et al.Study of chemical changes and antioxidant activity variation induced by gamma-irradiation on wildmushrooms:comparative study through principal component analysis[J].Food Research International,2013,54 (1):18-25.[36] FERNANDES A,ANTONIO A L,BARREIRA J C M,et al.Effects of gamma irradiation on the chemical composition and antioxidant activity of Lactarius deliciosus L.wild edible mushroom[J].Food and Bioprocess Technology,2013,6(10):2895-2903.[37] SATO T,KANDA K,OKAWA K,et al.The tyrosinase-encoding gene of lentinula edodes,letyr,is abundantly expressed in the gills of the fruit-body during post-harvest preservation[J].Bioscience Biotechnology and Biochemistry,2009,73(5):1042-1047. [38] SAKAMOTO Y,NAKADE K,SATO T.Characterization of the post-harvest changes in gene transcription in the gill of the Lentinula edodes fruiting body[J].Current Genetics,2009,55(4):409-423.[39] OZOGLU H,BAYINDIRLI A.Inhibition of enzymic browning in cloudy apple juice with selected antibrowning agents[J].Food Control,2002,13 (4/5):213-221.[40] ROJAS-GRAU M A,SOBRINO-LOPEZ A,TAPIA M S,et al.Browning inhibition in fresh-cut ′fuji′ apple slices by natural antibrowning agents[J].Journal of FoodScience,2006,71(1):S59-S65.[41] DAWLEY R M,FLURKEY W H.4-Hexylresorcinol,a potent inhibitor of mushroom tyrosinase[J].Journal of Food Science,1993,58(3):609-610.[42] ALVAREZ-PARRILLA E,DE LA ROSA L A,RODRIGO-GARCIA J,et al.Dual effect of beta-cyclodextrin (beta-CD) on the inhibition of apple polyphenol oxidase by 4-hexylresorcinol (HR) and methyl jasmonate (MJ)[J].Food Chemistry,2007,101(4):1346-1356.[43] MARTINEZ-ALVAREZ O,GOMEZ-GUILLEN C,MONTERO P.Effect of different chemical compounds as coadjutants of 4-hexylresorcinol on the appearance of deepwater pink shrimp (Parapenaeus longirostris) during chilled storage[J].International Journal of Food Science and Technology,2008,43 (11):2010-2018.[44] XING R,ZHENG A P,WANG F,et al.Functionality study of Na6PMo11FeO40 as a mushroom tyrosinase inhibitor[J].Food Chemistry,2015,175:292-299.[45] DU Y J,DOU S Q,WU S J.Efficacy of phytic acid as an inhibitor of enzymatic and non-enzymatic browning in apple juice[J].Food Chemistry,2012,135(2):580-582.[46] SULAIMAN A,SILVA F V M.High pressure processing,thermal processing and freezing of Camarosa strawberry for the inactivation of polyphenoloxidase and control of browning[J].Food Control,2013,33 (2):424-428.[47] 罗万春.世界新农药与环境——发展中的新型杀虫剂[M].北京:世界知识出版社,2002:1-5.[48] 张宗炳,冷欣夫.杀虫药剂毒理及应用[M].北京:化学工业出版社,1993:331-337.[49] THEOPOLD U,SCHMIDT O,SODERHALL K,et al.Coagulation inarthropods:defence,wound closure and healing[J].Trends in Immunology,2004,25 (6):289-294.[50] SUGUMARAN M,NELLAIAPPAN K.Characterization of a new phenoloxidase inhibitor from the cuticle of Manduca sexta[J].Biochem Biophys Res Commun,2000,268(2):379-383.[51] KRAMER K J,HOPKINS T L.Tyrosine metabolism for insect cuticle tanning[J].Archives of Insect Bioche-mistry and Physiology,1987,6(4):279-301.[52] DONG W,TANG B Z,SONODA S,et al.Sequencing and characterization of two cDNAs putatively encoding prophenoloxidases in the diamondback moth,Plutella xylostella (L.) (Lepidoptera:Yponomeutidae)[J].Applied Entomology and Zoology,2011,46 (2):211-221.[53] BHONWONG A,STOUT M J,ATTAJARUSIT J,et al.Defensive role of tomato polyphenol oxidases against cotton bollworm (Helicoverpa armigera) and beet armyworm (Spodoptera exigua)[J].Journal of Chemical Ecology,2009,35(1):28-38.[54] PAN Z Z,LI H L,YU X J,et al.Synthesis and anti-tyrosinase activities of alkyl 3,4-dihydroxybenzoates[J].J Agric Food Chem,2011,59(12):6645-6649.[55] 王树栋,罗万春,高兴祥,等.曲酸对小菜蛾酚氧化酶抑制作用的研究[J].中国农业科学,2004,37(9):1316-1321.[56] 李智聪,马素娟,潘志针,等.缩氨基硫脲化合物的合成及对菜青虫酚氧化酶抑制作用研究[J].厦门大学学报(自然科学版),2009,48(5):623-626.。
效应物对蘑菇酪氨酸酶的抑制作用及其抑制机理的研究的开题报告

效应物对蘑菇酪氨酸酶的抑制作用及其抑制机理的研究的开题报告一、选题背景及意义蘑菇酪氨酸酶是一种重要的催化剂,广泛存在于大量生物中。
它能够催化酪氨酸和其它芳香族氨基酸的氧化反应,生成对应的酮酸和氨基酸。
酪氨酸酶在生物学、化学以及食品工业中有着广泛的应用,例如可以用于酸奶的发酵、生物传感器的制造等。
因此,对于蘑菇酪氨酸酶的研究,不仅有着科学意义,而且有着实际应用价值。
然而,在某些情况下,酪氨酸酶的催化活性会受到抑制,这不仅会影响生物体内相关代谢过程的正常进行,也会降低它在应用中的效率。
因此,开展对蘑菇酪氨酸酶效应物对其抑制作用以及抑制机理的研究,对于深入了解酪氨酸酶催化的机理和普适性,提高其应用和价值,具有重要意义。
二、研究内容和方法本研究拟选取几种具有不同效应的物质,对于蘑菇酪氨酸酶的活性进行测定,分析效应物是否对酶的催化反应有抑制作用,并探究其抑制机理。
具体实验范围包括:1.选择2-苄基-3-甲基-4-氧代吲哚(BOI)作为活性度测定剂,确定酪氨酸酶活性的条件和催化反应特征。
2.发现具有不同结构的小分子化合物对于酪氨酸酶活性的影响情况,对每一种效应物测量其对酶的抑制能力,并比较不同效应物之间的差异和共性。
3.利用荧光光谱、差示扫描量热法等手段,探究效应物与酶之间的作用机理,如化学键的结合、电化学反应等等。
三、预期结果和意义通过对蘑菇酪氨酸酶效应物的抑制机理研究,可以深入掌握其催化反应的机理和规律,从而更好地利用这种酶开展应用的研究。
同时,这项研究将为寻找其它小分子抑制剂提供更有力的理论支持,有望为蘑菇酪氨酸酶的开发和利用提供新的思路和方法。
最终,本研究预期可以为生物科学、化学和食品加工等领域的技术进步和产品研发提供有力的支持。
酪氨酸抑制性测定实验方案

熟地黄提取液对酪氨酸酶的抑制作用研究一、仪器和药品:仪器:分光光度计、微量移液器(1ml)、电子天平、容量瓶(10ml、50ml、250ml)、回流装置一套、沸石、抽滤装置、旋转蒸发仪、水浴恒温箱、烧杯和量筒若干。
药品:熟地黄粉末(约50g)、体积分数50%的乙醇(200ml)、磷酸氢二钠、磷酸二氢钠、L-酪氨酸、酪氨酸酶、去离子水若干。
二、实验方案:A、熟地黄有效成分的提取:1、干燥熟地黄粉末10.0 g + 体积分数50%的乙醇100mL,室温浸泡24 h。
2、烧瓶+沸石+上述浸泡液,回流提取3 h,冷却后抽滤取滤液。
残渣再次加50%乙醇100mL 回流提取3 h,冷却抽滤取滤液,合并两次滤液。
(回流温度约80℃。
)3、将滤液置于旋转蒸发仪上60-65℃浓缩回收溶剂,得膏状提取物。
4、称取适量膏状提取物+去离子水配置成1 mg/mL 溶液备用。
B、磷酸缓冲溶液(PBS)的配制:1、称取磷酸氢二钠13.3984 g,加去离子水溶解,转移至250mL 容量瓶中定容得a液;另称取磷酸二氢钠6.9011 g,加去离子水溶解,转移至250mL容量瓶中定容得b液。
2、分别移取a、b两溶液各50mL至250mL容量瓶中,加去离子水定容,即得pH=6.8的磷酸缓冲溶液。
C、L-酪氨酸溶液和酪氨酸酶溶液的配制:1、称取L-酪氨酸25.6 g,用PBS缓冲液定容于50mL容量瓶中,即得L-酪氨酸溶液。
2、称取酪氨酸酶0.3502 g,用PBS缓冲液定容于10mL容量瓶中,即得酪氨酸酶溶液。
(冰水浴中操作、保存。
)D、酪氨酸酶活力的测定:(分光光度法测A475)用微量移液器分别按表一剂量准确移取a、b、c、d四组样液,置于37℃水浴中恒温10 min后,各加入0.40mL酪氨酸酶溶液,混匀,37℃温育反应10 min,迅速移入比色皿中,测得在475nm处的吸光度A a、A b、A c、A d ,然后按下面的公式计算熟地提取液对酪氨酸酶的抑制率:抑制率=[1-(A d-A c)/(A b-A a)]×100%其中:a:既无底物也无提取物的待测液;b:有底物但无提取物的待测液;c:无底物但有提取物的待测液;d:既有底物也有提取物的待测液。
天然产物对酪氨酸酶的抑制及抑制机理的研究进展

天然产物对酪氨酸酶的抑制及抑制机理的研究进展
李航;赵国华;阚建全;陈宗道
【期刊名称】《日用化学工业》
【年(卷),期】2003(33)6
【摘要】介绍了酪氨酸酶的结构及酶促褐变机制;重点阐述了对酪氨酸酶抑制的特征及抑制机理.酪氨酸酶的抑制特征为可逆抑制,分为竞争性、非竞争性、混合型及缓慢结合型4种.其抑制的主要机理分别为:底物类似物结合酶的活性中心从而抑制酶活性;抑制剂与酶活性中心以外的氨基酸残基结合及抑制剂对过氧自由基的清除作用;抑制剂对酶活性中心的内源桥基的影响;抑制剂与酶快速形成复合物,此后经历一个缓慢的可逆异构化过程.
【总页数】4页(P383-386)
【作者】李航;赵国华;阚建全;陈宗道
【作者单位】西南农业大学,食品科学学院,重庆,400716;西南农业大学,食品科学学院,重庆,400716;西南农业大学,食品科学学院,重庆,400716;西南农业大学,食品科学学院,重庆,400716
【正文语种】中文
【中图分类】TQ658
【相关文献】
1.天然酪氨酸酶抑制剂的种类及其对酪氨酸酶抑制作用的研究进展 [J], 毕云枫;宋凤瑞;刘志强
2.天然产物对酪氨酸酶抑制作用的研究进展 [J], 徐学涛;张焜;杜志云;韦星船;任清刚;朱华;邓运泉;竺琴
3.晚期糖基化终末产物的抑制机理及抑制剂的研究进展 [J], 吴茜;陈亨业;胡贝;吕哲娟;谢笔钧;孙智达
4.两种天然产物对B16F10细胞增殖及黑色素合成抑制机理研究 [J], 程杏安;张淑明;周晓武;吴波;林贤伟;秦湘静;黄素青;刘展眉;蒋旭红
5.植物提取物对晚期糖基化终产物抑制机理的研究进展 [J], 韩喻;扈莹莹;贺菁蕾;王辉;陈倩;秦立刚
因版权原因,仅展示原文概要,查看原文内容请购买。
天然酪氨酸酶抑制剂研究进展

天然酪氨酸酶抑制剂研究进展天然酪氨酸酶抑制剂是一类能够抑制酪氨酸酶活性的化合物,具有潜在的药理学和生物学应用。
酪氨酸酶在多种生物过程中起着重要的调节作用,包括神经传导、免疫反应、细胞增殖和分化。
因此,研究天然酪氨酸酶抑制剂具有重要的科学和临床意义。
近年来,有一些重要的天然酪氨酸酶抑制剂被发现,并被广泛研究。
其中一类天然酪氨酸酶抑制剂是儿茶素类化合物,包括儿茶素和表儿茶素。
这些化合物具有多种生物活性,包括抗氧化、抗炎、抗肿瘤和抗肥胖等。
儿茶素类化合物的酪氨酸酶抑制活性主要通过与酪氨酸酶结合并抑制其活性来实现。
有研究表明,这些化合物能够结合酪氨酸酶的活性中心,并与其形成氢键和范德华力。
这种结合能够阻断酪氨酸酶与底物之间的相互作用,从而减少酪氨酸酶的活性。
除了儿茶素类化合物之外,还发现了一些其他天然酪氨酸酶抑制剂。
例如,人参总皂苷被发现具有抑制酪氨酸酶的活性,其抑制机制可能涉及与酪氨酸酶的亲合作用。
此外,多肽类化合物和天然产物也被发现具有酪氨酸酶抑制活性。
研究表明,天然酪氨酸酶抑制剂的应用具有潜在的药理学和临床意义。
例如,酪氨酸酶被认为在肿瘤发生和发展中扮演重要角色,因此,抑制酪氨酸酶的活性可能成为肿瘤治疗的一种新策略。
此外,酪氨酸酶抑制剂也被认为对于预防和治疗其他疾病,如炎症、肥胖和神经退行性疾病等,具有潜在作用。
总结来说,天然酪氨酸酶抑制剂研究进展非常迅速。
儿茶素类化合物和其他天然产物被广泛研究,并发现具有抑制酪氨酸酶活性的作用。
这些化合物的抑制机制主要涉及与酪氨酸酶的亲合作用。
酪氨酸酶抑制剂具有潜在的药理学和临床意义,包括肿瘤治疗、炎症控制和神经退行性疾病的治疗等。
几种美白剂抑制酪氨酸酶活性的研究

几种美白剂抑制酪氨酸酶活性的研究
刘琦;刘洋;吴金昊;陶丽莉;王楠;赵华
【期刊名称】《日用化学品科学》
【年(卷),期】2015(0)11
【摘要】对几种美白剂抑制酪氨酸酶活性的作用进行测定.以L-酪氨酸为底物,测定一定质量分数下的美白剂对酪氨酸酶活性具有良好的抑制效果;选用α-熊果苷测定实验方法的重现性与精密度,相对标准偏差分别为1.3%与0.96%;几种美白剂对酪氨酸酶活性具有抑制效果,抑制作用为可逆抑制,抑制类型为非竞争性抑制.
【总页数】6页(P22-26,30)
【作者】刘琦;刘洋;吴金昊;陶丽莉;王楠;赵华
【作者单位】北京日化协会,北京100048;中国香料香精化妆品工业协会,北京100079;北京日化协会,北京100048;北京日化协会,北京100048;北京市植物资源研究开发重点实验室,北京 100048;北京工商大学中国化妆品研究中心,北京100048;北京市植物资源研究开发重点实验室,北京 100048;北京工商大学中国化妆品研究中心,北京 100048
【正文语种】中文
【中图分类】TQ658
【相关文献】
1.几种美白活性物质对酪氨酸酶活性的体外抑制作用及细胞毒性 [J], 张春香;尹鸿萍;王旻
2.4种美白剂对B-16细胞内酪氨酸酶活性抑制的研究 [J], 李玲;宋伟民;周华
3.皮肤化学美白剂抑制酪氨酸酶活性的研究 [J], 刘宇红;董银卯;李才广
4.化妆品植物原料(Ⅱ)——抑制酪氨酸酶活性的植物美白原料的研究与开发 [J], 任倩倩;吴华;金建明
5.三种美白剂对酪氨酸酶活性的抑制 [J], 陆晔;周名权;翁康生;刘国星
因版权原因,仅展示原文概要,查看原文内容请购买。
酪氨酸酶活性抑制实验及其在祛斑美白化妆品功效评价中的应用

酪氨酸酶活性抑制实验及其在祛斑美白化妆品功效评价中的应用杜孝元;刘玮;史飞;张萍【期刊名称】《中国美容医学》【年(卷),期】2005(14)6【摘要】目的:建立评价祛斑美白化妆品功效的体外实验方法.方法:根据酪氨酸酶催化底物发生反应的原理,研究建立和优化了一种酪氨酸酶活性抑制实验系统,并采用不同浓度的曲酸溶液作为标准对照.结果:应用本方法进行测试,分别得出3.0%的熊果苷、4.0%的曲酸双棕榈酸脂、0.5%的氢醌对酪氨酸酶活性的抑制率分别为58.21%、92.92%、126.01%.对未知成分的数种化妆品样品也进行了同样测试,抑制率在3.1 5%~47.69%.结论:本研究为祛斑美白化妆品的功效评价提供了一种体外实验方法.【总页数】3页(P740-742)【作者】杜孝元;刘玮;史飞;张萍【作者单位】解放军空军总医院皮肤科,北京市,100036;解放军空军总医院皮肤科,北京市,100036;解放军空军总医院皮肤科,北京市,100036;解放军空军总医院皮肤科,北京市,100036【正文语种】中文【中图分类】R977.3【相关文献】1.外感受抑制实验在紧张型头痛中枢调控机制研究中的应用 [J], 梁瑞华;张素平2.口服神经氨酸酶抑制剂奥司他韦在人实验性流行性感冒中的应用随机对照预防试验和治疗试验 [J], Frederick G. Hayden, MD;John J. Treanor MD ;R. Scott Fritz, PhD3.应用酶催化动力学——吸光光度法评价美白化妆品功效实验中几个问题的解决方法 [J], 杜孝元;赵广;蔡瑞康;刘玮4.甲醛挥发抑制剂在解剖实验教学中的应用 [J], 郭连军;田秀兰5.性视频刺激加5型磷酸二酯酶抑制剂激发阴茎勃起实验在勃起功能障碍诊治中的应用 [J], 朱选文;郭君平;张峰彬;钟达川;方家杰;李方印因版权原因,仅展示原文概要,查看原文内容请购买。
3种Dawson型杂多酸对酪氨酸酶的抑制作用

3种Dawson型杂多酸对酪氨酸酶的抑制作用谢乐芳;李莉莉;陈丙年;王力【期刊名称】《食品研究与开发》【年(卷),期】2017(038)019【摘要】合成3种Dawson型杂多酸H8[P2Mo17Zn(OH2)O61]、H8[P2Mo17Cu(OH2)O61]和H7[P2Mo17Fe(OH2)O61](分别简写为P2Mo17Zn、P2Mo17Cu和P2Mo17Fe),并用红外和紫外光谱进行结构表征.进而用酶动力学方法研究3种化合物对酪氨酸酶二酚酶的抑制作用(包括抑制效果、抑制机理、抑制类型).结果表明:P2Mo17Zn、P2Mo17Cu和P2Mo17Fe 3种化合物对酪氨酸酶二酚酶均有明显的抑制效果,对应的IC50值分别为0.3462、0.3615、0.3831 mmol/L.3种化合物均属于可逆竞争型,抑制常数KI分别为0.1068、0.0682、0.0572 mmol/L.综合比较,3种化合物的抑酶效果依次是P2Mo17Zn>P2Mo17Cu>P2Mo17Fe.【总页数】5页(P175-179)【作者】谢乐芳;李莉莉;陈丙年;王力【作者单位】集美大学食品与生物工程学院,福建厦门361021;集美大学食品与生物工程学院,福建厦门361021;厦门大学附属中山医院演武分院,福建厦门361005;集美大学食品与生物工程学院,福建厦门361021【正文语种】中文【相关文献】1.Keggin型和Dawson型杂多酸的制备及其催化氧化性能比较研究 [J], 蒋小平;丁满花2.钒取代的Dawson型磷钼酸对酪氨酸酶的抑制作用 [J], 李莉莉;邓阳阳;谢乐芳;王力3.Dawson结构的多金属氧酸盐对酪氨酸酶的抑制作用 [J], 李莉莉;陈丙年;邓阳阳;谢乐芳;邢蕊;王力4.Dawson型砷钨基多酸阴离子修饰的杂化材料的合成及性质研究 [J], 王丹;苏占华;宋瑶5.Dawson型砷钨基多酸阴离子修饰的杂化材料的合成及性质研究 [J], 王丹;苏占华;宋瑶因版权原因,仅展示原文概要,查看原文内容请购买。
奥扎格雷对酪氨酸酶的抑制机理
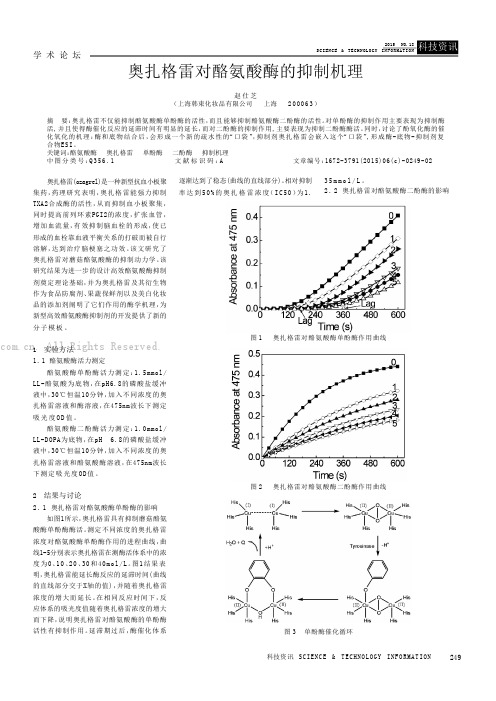
学 术 论 坛249科技资讯 SC IENC E & T ECHNO LOGY INFO RMAT ION 奥扎格雷(ozagrel)是一种新型抗血小板聚集药,药理研究表明,奥扎格雷能强力抑制TXA2合成酶的活性,从而抑制血小板聚集,同时提高前列环素PGI2的浓度,扩张血管,增加血流量,有效抑制脑血栓的形成,使已形成的血栓靠血液平衡关系的打破而被自行溶解,达到治疗脑梗塞之功效。
该文研究了奥扎格雷对蘑菇酪氨酸酶的抑制动力学。
该研究结果为进一步的设计高效酪氨酸酶抑制剂奠定理论基础,并为奥扎格雷及其衍生物作为食品防腐剂、果蔬保鲜剂以及美白化妆品的添加剂阐明了它们作用的酶学机理,为新型高效酪氨酸酶抑制剂的开发提供了新的分子模板。
1 实验方法1.1酪氨酸酶活力测定酪氨酸酶单酚酶活力测定:1.5mmol/LL-酪氨酸为底物,在pH6.8的磷酸盐缓冲液中,30℃恒温10分钟,加入不同浓度的奥扎格雷溶液和酶溶液,在475nm波长下测定吸光度O D 值。
酪氨酸酶二酚酶活力测定:1.0mmol/LL-DOPA为底物,在pH 6.8的磷酸盐缓冲液中,30℃恒温10分钟,加入不同浓度的奥扎格雷溶液和酪氨酸酶溶液,在475nm波长下测定吸光度OD 值。
2 结果与讨论2.1奥扎格雷对酪氨酸酶单酚酶的影响如图1所示,奥扎格雷具有抑制蘑菇酪氨酸酶单酚酶酶活。
测定不同浓度的奥扎格雷浓度对酪氨酸酶单酚酶作用的进程曲线,曲线1-5分别表示奥扎格雷在测酶活体系中的浓度为0、10、20、30和40mo l/L。
图1结果表明,奥扎格雷能延长酶反应的延滞时间(曲线的直线部分交于X轴的值),并随着奥扎格雷浓度的增大而延长。
在相同反应时间下,反应体系的吸光度值随着奥扎格雷浓度的增大而下降,说明奥扎格雷对酪氨酸酶的单酚酶活性有抑制作用。
延滞期过后,酶催化体系逐渐达到了稳态(曲线的直线部分)。
相对抑制率达到50%的奥扎格雷浓度(I C50)为1.35m m o l /L 。
一种酪氨酸酶活性抑制剂及其应用[发明专利]
![一种酪氨酸酶活性抑制剂及其应用[发明专利]](https://img.taocdn.com/s3/m/f57b9eff10a6f524cdbf857c.png)
专利名称:一种酪氨酸酶活性抑制剂及其应用专利类型:发明专利
发明人:陈瑞,张志刚,张磊
申请号:CN201810309813.7
申请日:20180409
公开号:CN108420074A
公开日:
20180821
专利内容由知识产权出版社提供
摘要:本发明属于生物领域,具体涉及生物酶,涉及一种酪氨酸酶活性的抑制剂,以及该抑制剂在抑制酪氨酸酶活性方面的应用。
本发明所提供的具有酪氨酸酶抑制活性的化合物可应用于制备抗果蔬酶促褐变抑制剂、化妆品美白剂以及其他需要抑制酪氨酸酶活性的病症的药物中,可以作为活性成分,不加或加入食品添加剂辅料、化妆品辅料或药剂上接受的辅料,按照相应剂型的制备方法制成食品或保健品,也可以用于果蔬保鲜液。
申请人:江西牧威利元生物科技有限公司
地址:332200 江西省九江市瑞昌市经开区南区
国籍:CN
更多信息请下载全文后查看。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
奥扎格雷对酪氨酸酶的抑制机理
摘要:奥扎格雷不仅能抑制酪氨酸酶单酚酶的活性,而且能够抑制酪氨酸酶二酚酶的活性。
对单酚酶的抑制作用主要表现为抑制酶活,并且使得酶催化反应的延滞时间有明显的延长,而对二酚酶的抑制作用,主要表现为抑制二酚酶酶活。
同时,讨论了酚氧化酶的催化氧化的机理:酶和底物结合后,会形成一个新的疏水性的“口袋”,抑制剂奥扎格雷会嵌入这个“口袋”,形成酶-底物-抑制剂复合物ESI。
关键词:酪氨酸酶奥扎格雷单酚酶二酚酶抑制机理中图分类号:Q356.1 文献标识码:A 文章编号:
1672-3791(2015)06(c)-0249-02
奥扎格雷(ozagrel)是一种新型抗血小板聚集药,药理研究表明,奥扎格雷能强力抑制TXA2合成酶的活性,从而抑制血小板聚集,同时提高前列环素PGI2的浓度,扩张血管,增加血流量,有效抑制脑血栓的形成,使已形成的血栓靠血液平衡关系的打破而被自行溶解,达到治疗脑梗塞之功效。
该文研究了奥扎格雷对蘑菇酪氨酸酶的抑制动力学。
该研究结果为进一步的设计高效酪氨酸酶抑制剂奠定理论基础,并为奥扎格雷及其衍生物作为食品防腐剂、果蔬保鲜剂以及美白化妆品的添加剂阐明了它们作用的酶学机理,为新
型高效酪氨酸酶抑制剂的开发提供了新的分子模板。
1 实验方法
1.1 酪氨酸酶活力测定
酪氨酸酶单酚酶活力测定:1.5mmol/LL-酪氨酸为底物,在pH6.8的磷酸盐缓冲液中,30℃恒温10分钟,加入不同浓度的奥扎格雷溶液和酶溶液,在475nm波长下测定吸光度OD值。
酪氨酸酶二酚酶活力测定:1.0mmol/LL-DOPA为底物,在pH 6.8的磷酸盐缓冲液中,30℃恒温10分钟,加入不同浓度的奥扎格雷溶液和酪氨酸酶溶液,在475nm波长下测定吸光度OD值。
2 结果与讨论
2.1 奥扎格雷对酪氨酸酶单酚酶的影响
如图1所示,奥扎格雷具有抑制蘑菇酪氨酸酶单酚酶酶活。
测定不同浓度的奥扎格雷浓度对酪氨酸酶单酚酶作用的进程曲线,曲线1-5分别表示奥扎格雷在测酶活体系中的浓度为0、10、20、30和40mol/L。
图1结果表明,奥扎格雷能延长酶反应的延滞时间(曲线的直线部分交于X轴的值),并随着奥扎格雷浓度的增大而延长。
在相同反应时间下,反应体系的吸光度值随着奥扎格雷浓度的增大而下降,说明奥扎格雷对酪氨酸酶的单酚酶活性有抑制作用。
延滞期过后,酶催化体系逐渐达到了稳态(曲线的直线部分)。
相对抑制
率达到50%的奥扎格雷浓度(IC50)为1.35mmol/L。
2.2 奥扎格雷对酪氨酸酶二酚酶的影响
以L-DOPA为底物测定酪氨酸酶二酚酶酶活,反应进程曲线如图2 (曲线0-5)。
在测活条件体系中,加入酶液后,反应迅速进入稳态,产物与时间呈线性递增,直线部分为酶催化底物反应级数为一级反应,随着时间的延长,酶受到奥扎格雷的抑制,导致酶活下降,从而反应级数逐渐的由一级反应转变为零级反应。
在不同的奥扎格雷浓度条件下,随着奥扎格雷浓度的增加,一级反应区域(曲线直线部分)的斜率逐渐减小,即奥扎格雷对酪氨酸酶二酚酶酶活的抑制程度增大。
2.3 催化机理
在氧气存在条件下,酪氨酸酶的基本功能有两个:作为单酚酶羟基化单酚生成邻二酚(图3);作为双酚酶氧化邻二酚生成醌(图4)。
该酶具有包含两个铜离子位点的活性中心,并与不同数目的氧原子配位结合具有三种不同状态,分别为氧化态Eoxy,还原态Emet和脱氧态Edeoxy。
氧化态Eoxy 兼具单酚酶和二酚酶的活性;还原态Emet具有二酚酶的活性,不具有单酚酶活性,但是和单酚底物具有亲和作用,所以还原态Emet是延滞效应产生的原因;脱氧态Edeoxy的作用是只能结合氧。
所以,酪氨酸酶催化单酚类底物都是从Eoxy开始,Emet和Edeoxy均不与单酚类底物反应,Eoxy
和Emet两者都可以催化多酚类底物。
奥扎格雷能够延长单酚酶的延滞时间,降低单酚酶和二酚酶的稳态速率,说明奥扎格雷能够可逆的抑制酪氨酸酶并阻止多巴色素的生成,进而能够遏制黑色素的生成。
并且,对于二酚酶体系而言,奥扎格雷不仅能和还原态酶Emet和氧化态酶Eoxy结合分别形成对应的酶-抑制剂复合物EmetI 和EoxyI,而且还能和酶-底物复合物EmetI和EoxyI分别形成对应的酶-底物-抑制剂复合物EmetSI和EoxySI。
同时,根据奥扎格雷对酪氨酸酶二酚酶的混合型抑制机理,这一过程可表示为:(如图5所示)
其中E(Emet,Edeoxy和Eoxy)、D、I和P分别表示酶的三种形态、底物L-DOPA、奥扎格雷和产物,EI、ES和ESI分别表示酶-抑制剂复合物、酶-底物复合物和酶-底物-抑制剂复合物。
从酪氨酸酶角度分析,该酶存在两个结合位点,一个可与底物结合,另一个与抑制剂结合。
当底物与酶结合过程中,酶的天然构象会发生一些形变,在这个变化过程中,酶的疏水性的“口袋”会变大。
然后,酶和底物结合后,会形成一个新的疏水性的“口袋”,抑制剂奥扎格雷会嵌入这个“口袋”形成酶-底物-抑制剂复合物ESI。
可以推断出,酶和底物-抑制剂复合物ES容易形成并且结合力更强。
而比较竞争性和反竞争性的强弱,则可通过单酚酶的测试来旁证,在单酚酶测活体系中,延滞现象很容易被观察到。
延滞期过
后,反应体系才达到稳态。
反推之,若奥扎格雷只与游离酶起作用,那样不仅降低稳态反应速率而且延长延滞时间;若奥扎格雷只与酶-底物复合物ES起作用,奥扎格雷仅降低稳态反应速率,而且不会延长延滞时间,但是奥扎格雷不仅降低了稳态反应速率,而且延长了延滞时间,则说明竞争性抑制效应要强于反竞争性抑制效应。
参考文献
[1] 臧荣春,夏凤毅.微生物动力学模型[M].北京:化学工业出版社,2004.
[2] A.G.Marangoni(著),赵裕蓉,张鹏(译).酶催化动力学―方法与应用[M].北京:化学工业出版社,2007.
[3] Y.Shi,Q.-X.Chen,Q.Wang,K.-K. Song,L. Qiu.Inhibitory effects of cinnamic acid and its derivatives on the diphenolase activity of mushroom (Agaricusbisporus)tyrosinase[J].Food chemistry,2005,92(4):707-712.。
