化工原理第八章第一节讲稿.
制药化工原理课件2012-第08章 蒸馏

制药化工原理
第八章 蒸馏
6/156
1
制药化工原理‐第八章 蒸馏
2012/12/9
一. 溶液的蒸气压及拉乌尔定律
1. 饱和蒸汽压 在某一温度下,液体与其液面 上的蒸气呈平衡状态时,蒸气 所产生的压力称为饱和蒸汽压 所产生的压力称为饱和蒸汽压。 2. 理想溶液与非理想溶液 由组分A和组分B混合而成的溶液,既无热效应,也无体积效 应,这种溶液称为理想溶液。如:苯-甲苯,甲醇-乙醇。 由组分A和组分B混合而成的溶液,产生热效应和体积效应, 这种溶液称为非理想溶液。如:硝酸-水,乙醇-水。
2 .5 x x 1 ( 1) x 1 1.5 x
yA
po 180.3 0.225 Ax 0 .895 P 101 .3
117.8 p0 A 2 .56 0 46 pB
⑵用相对挥发度计算气液平衡数据 t =85℃时:
t = 85℃时: y
x 2 .5 x 2 .5 0 .770 0 .893 1 ( 1) x 1 1 .5 x 1 1.5 0.77 x 2 .5 x 2 .5 0 .255 0 .461 1 ( 1 ) x 1 1 .5 x 1 1 .5 0 .255
制药化工原理 第八章 蒸馏
P
露点 两相区
气相区
P
露点线
相平衡曲线 对角线
t/C
泡点 泡点线 液相区
y x
1.0
0
xA xF x(y)
轻重组分得到 一定程度分离
yA
平衡线与对角线 之间的距离越大
苯-甲苯混合液的 x- y 图
11/156 制药化工原理 第八章 蒸馏
化工原理课件(天大版)第八章 干燥

t 湿球温度计
天津商学院本科生课程 化工原理
12/22
§8.1 湿空气的性质及湿度图
6.绝热饱和温度tas 在与外界绝热情况下,空气 与大量水经过无限长时间接触后, 空气温度与水温相等,称这一稳 定的温度为湿空气的绝热饱和温 度,用tas表示。
tas
补充水 tas 饱和空气
tas,Has, Ias
天津商学院本科生课程 化工原理
2/22
§8 概述
传导干燥 热能通过传热壁面以传导方式传给物料,产生的湿 分蒸气被气相(又称干燥介质)带走,或用真空泵 排走。例如纸制品可以铺在热滚筒上进行干燥。 对流干燥
以干燥介质:热空气、 湿分:水为例
干 燥 法
热能以对流方式加入物料,产生的蒸气被干燥介质所带走。
cH cg cv H 1.01 1.88 H
c H f H
天津商学院本科生课程 化工原理
9/22
§8.1 湿空气的性质及湿度图
4.湿空气的焓I
kJ/kg 干气
焓----kJ/kg
I I g Iv H
cg cv H t r0 H
1.01 1.88H t 2490H
50% 为宜;室温达18℃ 时,相对湿 度应控制在30%—40% 。 7/22
pv p s H 0.622 0.622 相对湿度代表湿空气的不饱和程度。 P p s P pv
天津商学院本科生课程 化工原理
§8.1 湿空气的性质及湿度图
1kg干空 气的体积 Hkg水气 体积 H 1kg干空 气
传质、传热同时发生
本章重点讨论以空气作干燥介质,以水为湿份的对流干燥过程。
天津商学院本科生课程 化工原理
8-1 气液相平衡、扩散及相际传质

相界面 气相主体 溶解
吸收剂
气相主体
相界面
液相主体
液相主体
y
界面 x
y yi xi x
气相扩散
液相扩散
气体 气相扩散
液相扩散
图:气-液相际传质过程
物质传递的机理包括两种形式: 1.分子扩散: 分子无规则微观运动使组分由浓度高处传至浓度低处。 类同于传热中由温度差引起的热传导,从高温向低温 传递热量。只要存在温差、浓差和压差都会产生分子 扩散。 2.对流传质: 流体宏观流动导致物质传递。类同于对流传热中流体 与固体壁面之间的传热,通常指流体与界面(气液界
反之,若 y = 0.05 的含氨混合气
与液相 x = 0.1 的氨水接触,
x=0.1 则 y < ye , 或 x > xe , 发生 解吸
y=0.05
此时液相中部分氨将转入气相
注意点:要搞清实际浓度与平衡浓度,二者不能混淆。 结论: 不平衡的两相相互接触必将进行吸收或解吸过程, 过程进行方向以达到平衡为最后极限。
y ye y
x x xe
作业P44:4、5
第三节 扩散和单相传质
任何过程都需解决两个基本问题:过程的极限和过程速率,
吸收过程的极限决定于吸收的相平衡关系。本节将讨论吸收
过程的速率问题。 物质传递三个步骤:气相 界面 液相
气相主体→ 界面:气相内的物质传递 界面溶解 :界面处气液相平衡 界面→ 液相主体: 液相内的物质传递
ye=0.94×0.05 = 0.047,
x=0.05 y=0.1 可见实际气相浓度y > 平衡气相浓度ye。 因此,两相接触时将有部分氨自气相
进入液相,发生吸收过程。
从另外一个角度分析,该吸收过程可理解为:
化工原理 第八章 固体干燥.

第八章固体干燥第一节概述§8.1.1、固体去湿方法和干燥过程在化学工业,制药工业,轻工,食品工业等有关工业中,常常需要从湿固体物料中除去湿分(水或其他液体),这种操作称为”去湿”.例如:药物,食品中去湿,以防失效变质,中药冲剂,片剂,糖,咖啡等去湿(干燥) 塑料颗粒若含水超过规定,则在以后的注塑加工中会产生气泡,影响产品的品质. 其他如木材的干燥,纸的干燥.一、物料的去湿方法1、机械去湿:压榨,过滤或离心分离的方法去除湿分,能耗底,但湿分的除去不完全。
2、吸附去湿:用某种平衡水汽分压很低的干燥剂(如CaCl2,硅胶,沸石吸附剂等)与湿物料并存,使物料中水分相续经气相转入到干燥剂内。
如实验室中干燥剂中保有干物料;能耗几乎为零,且能达到较为完全的去湿程度,但干燥剂的成本高,干燥速率慢。
3、供热干燥:向物料供热以汽化其中的水分,并将产生的蒸汽排走。
干燥过程的实质是被除去的湿分从固相转移到气相中,固相为被干燥的物料,气相为干燥介质。
工业干燥操作多半是用热空气或其他高温气体作干燥介质(如过热蒸汽,烟道气)能量消耗大,所以工业生产中湿物料若含水较多则可先采用机械去湿,然后在进行供热干燥来制得合格的干品。
二、干燥操作的分类1、按操作压强来分:1)、常压干燥:多数物料的干燥采用常压干燥2)、真空干燥:适用于处理热敏性,易氯化或要求产品含湿量很低的物料2、按操作方式来分:1)、连续式:湿物料从干燥设备中连续投入,干品连续排出特点:生产能力大,产品质量均匀,热效率高和劳动条件好。
2)、间歇式:湿物料分批加入干燥设备中,干燥完毕后卸下干品再加料如烘房,适用于小批量,多品种或要求干燥时间较长的物料的干燥。
3、按供热方式来分:1)、对流干燥:使干燥介质直接与湿物料接触,介质在掠过物料表面时向物料供热,传热方式属于对流,产生的蒸汽由干燥介质带走。
如气流干燥器,流化床,喷雾干燥器。
2)、传导干燥:热能通过传热壁面以传导方式加热物料,产生的蒸汽被干燥介质带走,或是用真空泵排走(真空干燥),如烘房,滚筒干燥器。
化工原理-第8章 气体吸收

8.3 扩散和单相传质
① 溶质由气相主体传递到两相界面,即气相内的物质传递;
② 溶质在相界面上的溶解,由气相转入液相,即界面上发生 的溶解过程
③ 溶质自界面被传递至液相主体,即液相内的物质传递。 通常,第②步即界面上发生的溶解过程很容易进行,其阻力很小
( 传质速率 小,
=
传质推动力 传质阻力
)故认为相界面上的溶解推动力亦很
8.1概述
①溶剂应对被分离组分(溶质)有较大的溶解度,或者说在 一定的温度与浓度下,溶质的平衡分压要低。这样,从平衡角度 来说,处理一定量混合气体所需溶剂量较少,气体中溶质的极限 残余浓度亦可降低;就过程数率而言,溶质平衡分压↓,过程推 动力大,传质数率快,所需设备尺寸小。
②溶剂对混合气体中其他组分的溶解度要小,即溶剂应具备 较高的选择性。若溶剂的选择性不高,将同时吸收混合物中的其 他组分,只能实现组分间某种程度的增浓而不能实现较为完全的 分离。
⑷工业吸收流程(见旧讲稿) 由流程图可见,采用吸收操作实现气体混合物的分离必须解决下 列问题: ①选择合适的溶剂,使能选择性比溶解某个(或某些)被分离组 分; ②提供适当的传质设备(多位填料塔,也有板式塔)以实现气液 两相的接触,使被分离组分得以从气相转移到液相(吸收)或气相 (解吸);
8.1概述
注意:此时并非没有溶质分子继续进入液相,只是任何瞬间 进入液相的溶质分子数与从液相逸出的溶质分子数恰好相等,在 宏观上过程就象是停止了。这种状态称为相际动平衡,简称相平 衡。
8.2.1平衡溶解度
⑴溶解度曲线
对 单 组 分 物 理 吸 收 的 物 系 , 根 据相律 ,自 由度数F 为F=CΦ+2=3-2+2=3(C=3,溶质A,惰性组分B,溶剂S,Φ=2,气、液两 相),即在温度 t ,总压 p ,气、液相组成共4个变量中,由3个自 变量(独立变量),另1个是它们的函数,故可将平衡时溶质在气
化工原理 第八章 传质过程导论.doc
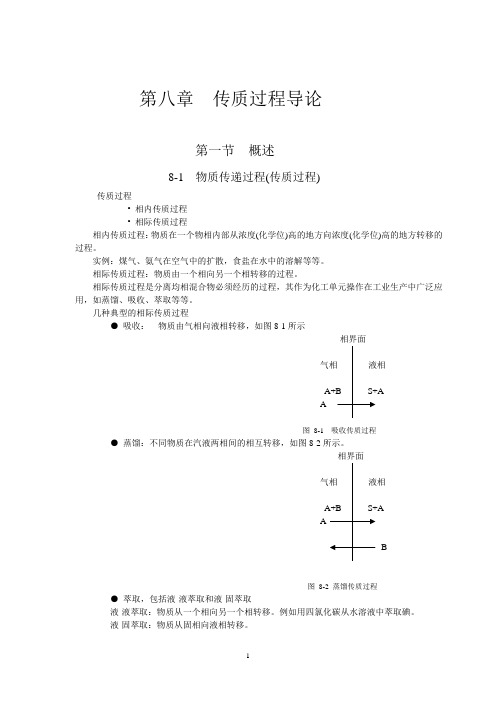
第八章传质过程导论第一节概述8-1 物质传递过程(传质过程)传质过程• 相内传质过程• 相际传质过程相内传质过程:物质在一个物相内部从浓度(化学位)高的地方向浓度(化学位)高的地方转移的过程。
实例:煤气、氨气在空气中的扩散,食盐在水中的溶解等等。
相际传质过程:物质由一个相向另一个相转移的过程。
相际传质过程是分离均相混合物必须经历的过程,其作为化工单元操作在工业生产中广泛应用,如蒸馏、吸收、萃取等等。
几种典型的相际传质过程●吸收:物质由气相向液相转移,如图8-1所示A图8-1 吸收传质过程●蒸馏:不同物质在汽液两相间的相互转移,如图8-2所示。
相界面AB图8-2 蒸馏传质过程●萃取,包括液-液萃取和液-固萃取液-液萃取:物质从一个相向另一个相转移。
例如用四氯化碳从水溶液中萃取碘。
液-固萃取:物质从固相向液相转移。
●干燥:液体(通常为水)由固相向气相转移其它相际传质过程:如结晶、吸附、气体的增湿、减湿等等。
传质过程与动量传递、热量传递过程比较有相似之处,但比后二者复杂。
例如与传热过程比较,主要差别为: (1)平衡差别传热过程的推动力为两物体(或流体)的温度差,平衡时两物体的温度相等;传质过程的推动力为两相的浓度差,平衡时两相的浓度不相等。
例如1atm,20ºC 下用水吸收空气中的氨,平衡时液相的浓度为0.582 kmol/m3 ,气相的浓度为3.28×10 - 4kmol/m3 ,两者相差5个数量级。
(2)推动力差别传热推动力为温度差,单位为ºC ,推动力的数值和单位单一;而传质过程推动力浓度有多种表示方法无(例如可用气相分压、摩尔浓度、摩尔分数等等表示),不同的表示方法推动力的数值和单位均不相同。
8-2浓度及相组成的表示方法1. 质量分数和摩尔分数● 质量分数:用w 表示。
以A 、B 二组分混合物为例,有w A = (8-1)● 质量分数:用x 或y 表示。
以A 、B 二组分混合物为例,有x A = (8-2)2. 质量比与摩尔比 ● 质量比:混合物中一个组分的质量对另一个组分的质量之比,用w 表示。
北京化工大学_《化工原理》_课件_第八章_干燥

返回
北京化工大学化工原理电子课件
本章主要讨论对流干燥,干燥介质是热 空气,除去的湿分是水分。
对流干燥是传热、传质同时进行的过程,
但传递方向不同,是热、质反向传递过程: 传热 方向 气 固 固 传质 气
推动力
温度差
水汽分压差
5
返回
北京化工大学化工原理电子课件
干燥过程进行的必要条件: * 物料表面水汽压力大于干燥介质中水汽分压;
空气—水体系,
kH 空气—甲苯体系,
cH
, t w t as
kH
c H ,tw tas
当空气为不饱和状态:t tw (tas) td; 当空气为饱和状态: t = tw (tas) = td。
30
返回
北京化工大学化工原理电子课件
8.1.2 空气的湿度图及其应用
11
pw pS
100%
即:
f ( pw,t )
返回
北京化工大学化工原理电子课件
当 φ =1时:
pw = ps,湿空气达饱和,不可作为干燥介质;
当 φ <1时:
pw < ps,湿空气未达饱和,可作为干燥介质。
φ越小,湿空气偏离饱和程度越远,干燥能力越大。
结论:
湿度 H 只能表示出水汽含量的绝对值,而
别被加热到50℃和120℃,求值 。
13
返回
北京化工大学化工原理电子课件
三、湿空气的比热与焓 1、湿比热(湿热)cH [kJ/kg干气•℃]
定义:在常压下,将1kg干空气和其所带有的Hkg水
汽升高温度1℃所需的热量。
cH cg cv H 1.01 1.88 H f ( H )
化工原理

最终需综合考虑,一般以“经济性”为指标考虑,往后可能转 变为“环境性”“安全性”等。
1.4 吸收的类型与例子
分类:
1. ① 多组分吸收:A1,A2…——同时被吸收(计算关键组分); ② 单组分吸收:
其型式与描述动量传递过程的牛顿粘性定律、描述 热量传递过程的傅利叶热传导定律相类似。
双组分一维稳定的分子扩散
1、等分子反向扩散:
N
A=J
A=-D
dCA dZ
N B=J B=-J A
N=N A+N B=0
气相:N
=
A
D
RT
PA1-PA2
液相:N
AL=
D
L
CA1-CA2
L
双组分一维稳定的分子扩散
x
=
A
nA n
=
A
mA m
(无量纲)
2、摩尔比、质量比(以二元为例)
xA= nA nB
A= mA
mB
3、摩尔浓度、质量浓度
(无量纲)
CA=
nA V
(kmol/m3)
CA=
mA V
(kg/m3)
第一节 传质过程概述
研究传质过程的四个工具:
1、传质速率方程--传质过程的快慢
传质速率=传质推动力=传质系数 传质阻力
静止流体或与层流运动方向相垂直的方向上可认为是单纯的 分子扩散。
❖ 对流传质:(与对流传热类似)
由分子扩散和涡流扩散共同作用的流体与相界面之间的传质。 涡流扩散是由于宏观流体流动而实现的物质传递现象。
化工原理:干燥

热空气
L , H1
W G1 G2 G(X1 X 2 ) L(H2 H1)
G G1(1 w1) G2 (1 w2 )
汽化W kg湿分所消耗绝干气体量 L
W
H2 H1
绝干气体比消耗
结论:
l L 1 W H2 H1
1.绝干气体比只与空气前后的湿度差有关,与空气经过的途 径无关. 2.从湿物料中需要除去的水分量W决定于物料的初始含水量 X1和干燥程度X2。干燥要求X2一定的情况下,初始含水量 X1愈高,W愈大,需要L愈大,操作费用愈高,因此,通常 湿物料在干燥之前先用能耗低的机械去湿法脱水,尽量降低 X1,以降低干燥操作费用。
湿度 H
解 : 由 t=62℃ 的 等 温 线 和 H=0.092 的 等 湿 度 线 可 以 确 定一个交点P:过P点的等 线上读得 =60%;
cH kJ/(kg绝干气
1.18
体·K)
cH ~ H = 100% = 60%
过P点的绝热冷却线与
=100%的等相对湿度线的交 点在横坐标上对应的值即为绝
cH cg 1 cv H
式中:cg — 绝干气体的比热,J/(kg绝干气体·℃); cv — 湿份蒸汽的比热,J/(kg湿份蒸汽·℃) 。
对于空气-水系统:
cg=1.005 kJ/(kg·℃),cv=1.884 kJ/(kg·℃)
cH 1.01 1.88H
6、湿空气的焓iH ( 或干基湿焓)
第八章 干 燥
第一节、概述
在工业生产中所得到的固态产品或半成品往往含有过多的水分 或有机溶剂 (湿份),要制得合格的产品需要除去固体物料中多 余的湿份。这种除去湿分的操作称为去湿。 例如: 制盐工业中,在过饱和的氯化钠溶液中生成的食盐晶粒; 塑料工业中,氯乙烯单体在水相中聚合制成的塑料颗粒; 食品工业中,由鲜牛奶制奶粉。
化工原理下 第八章 吸收(卓越)

一、全塔物料衡算 吸收操作时,表征吸收程度 有两种方式: (1) 吸收的目的是为了回收有用物 质,用吸收率η表示: η =被吸收的溶质/进塔气中的溶质 =(Yb-Ya)/Yb=1-Ya/Yb (2) 吸收的目的是为了除去气体混 合物中的有害物质,直接规定出 塔气体有害物质的浓度Ya
若干气体在水中的亨利常数E之值
E, MPa 气体 氦 氢 氮 空气 一氧化碳 氧 甲烷 一氧化氮 乙烷 乙烯
0°C 5°C 10°C 15°C 20°C 25°C 30°C 35°C 40°C 50°C 60°C 80°C 13100 12800 12700 12600 12300 11600 5870 6160 6440 6700 6920 7160 7390 7520 7610 7750 7750 5360 6050 6770 7480 8140 8760 9360 9980 10500 11400 12200 4380 4940 5560 6150 6730 7290 7810 8340 8810 9580 10230 3570 2580 2270 1710 1280 560 4010 2950 2620 1530 1570 662 4480 3310 3010 2210 1920 778 4950 3690 3410 2450 2290 907 5430 4060 3810 2670 2660 5880 4440 4180 2910 3060 6280 4810 4550 3140 3460 6680 5140 4920 3350 3880 7050 5420 5270 3570 4290 7710 5960 5850 3950 5070 8320 6370 6340 4230 5720 100 °C
8.2 吸收过程相平衡基础 8.2.1 气液相平衡关系
化工原理第八章第一节讲稿

Solvent Extraction 第一节 概述
一、液液萃取简介 二、液液萃取在工业上的应用 三、液液萃取的基本流程
2019/3/31
一、液液萃取简介
1、萃取原理
在欲分离的液体混合物中加入一种与其不溶或部分互溶 的液体溶剂,经过充分混合,利用混合液中各组分在溶剂中 溶解度的差异而实现分离的一种单元操作。 溶质 A :混合液中欲分离的组分 混合液中的溶剂 稀释剂(原溶剂)B: 萃取剂S: 所选用的溶剂
3)混合液含热敏性物质(药物)
4、萃取操作的特点
•选择适宜的溶剂是一个关键问题 •两个液相应具有一定的密度差 •溶质与萃取剂的沸点差大有利
2019/3/31
二、液液萃取在工业上的应用
1、液液萃取在石油化工中的应用
•分离轻油裂解和铂重整产生的芳烃和非芳烃混合物
•用酯类溶剂萃取乙酸,用丙烷萃取润滑油中的石蜡 •以HF-BF3作萃取剂,从C8馏分中分离二甲苯及其同分异构体
2、在生物化工和精细化工中的应用
•以醋酸丁酯为溶剂萃取含青霉素的发酵液 •香料工业中用正丙醇从亚硫酸浆废水中提取香兰素 •食品工业中TBP从发酵液中萃取柠檬酸
3、湿法冶金中的应用
用溶剂LIX63-65等螯合萃取剂从铜的浸取液中提取铜
2019/3/31
三、液液萃取的基本流程
单级萃取或并流接触萃取
多级错流萃取 单组分萃取
2019/3/31
2、基本过程描述
•加料 •混合 •分相 •排除 •纯化和回收 萃取相 (S+A+B) 萃余相 (B+A+S) 混合液 A+B 搅拌 萃取剂 (溶剂S)
2019/3/31
3、分离对象
化工原理第八章固体流态化

或
式中: u0 —ξ—= Cd分2 布阻板力小系孔数气(速当开孔率≤10 % 查图 6-12 P334)
为了增大△P干, 工业上常在开孔率一定下(0.4~1.4 %), 采用小孔布 气
2. 内部构件: 3. 型式: 挡网、档板 4. 作用: ① 抑制气泡成长和产生大气泡(“腾涌流化”) 5. ② 减小返混程度 6. ③ 增强两相接触 7. 粒度分布: 8. 主要影响临界流化速度umf及操作弹性比ut /umf,床层膨胀比L /Lmf及床层压降△P 9. 因此: 工业中常用小直径且粒径分布较宽的颗粒进行流化作业,粉粒可在其中起“润滑”
, ut , dp表示事出颗粒最小粒 径
3. 操作范围: (ut/umf)—— 亦可称操作弹性 比对于微细颗粒: 当 Rep<1 时,
对于大颗粒: 当 Re>1000 时,ξ = 0.44
1-4. 流化过程的主要影响因素 1. 分布板结构形式(开孔率、孔径等)作用: ① 支承颗粒、防止漏料 ② 使气体均匀分布 ③ 分散气流,形成小气泡 要求: 分布板的干板压降足够大(≥3.5Kpa)以保障气体的均布(或△P干 / △P总≥10 %)
关系: 气体的放(吸)热 = 固体颗粒吸(放) 热
在微分床层高度dH内: 故:
即: 以
对H作图, 由斜率
G —— 质量流速 Kg/m2·s at —— 单位体积床层颗粒比表面
可求得α值
b.非定态法 假定: ① 任一时刻床层中气体温度等于其离开床层时温度(Tf离 = Tf1)
② 床层中任一时刻τ的颗粒温度Ts分布均匀,但随时间变化。 ③ 无热损失。(床层表面不散失热量)
第八章 固体流态化
第一节 流化(固体流态化)
《化工原理》8传质过程导论1.

D RT
dpA dz
将上式中的p、z 对应积分,整理得:
D
NA RTz (pA1 pA2 )
同理,组分B有
D
NB
JB
RTz
pB1 pB2
若为液相,则有
D
N A z cA1 cA2
D
NB z cB1 cB2
例1. 氨气(A)与氮气(B)在一等径管两端相互扩散,管 子各处的温度均为298K,总压均为1.013×105Pa。在端点 1处,氨气的摩尔分数yA1=0.15;在端点2处,yA2=0.06, 点1、2间的距离为1m。已知此时扩散系数DAB=2.3×105m2/s。试求A组分的传质通量。
§8-1-2 相组成的表示方法
1、质量分数和摩尔分数
质量分数
wA
mA m
wB
mB m
wi 1
摩尔分数
xA
nA n
xB
nB n
xi 1
相互换算关系:
wA
xA M A
wi
i Mi
(一般液相用x,气相用y)
wA xAM A
xi M i
i
2、质量比和摩尔比(常见于双组分物系)
扩散:物质在单一相内的传递过程
流体中物质扩散的基本方式:
扩散方式 分子扩散 涡流扩散
作用物 流体分子 流体质点
作用方式 热运动 湍动和旋涡
作用对象 静止、滞流
湍流
分子扩散:
推动力 浓度差 物质传递 简称为扩散
终点: 浓度差为〇
扩散快慢?
College of Power Engineering NNU WANG Yanhua
化工原理(第四版)谭天恩 第八章 传质过程导论-dm

靠分子或原子的无规则热运动
A B A B B A 组分B的扩散量JB,z A B 质量中心面 B B A B 组分A的扩散量JA,z B B B
JA,z------相对扩散通量,kmol/m2s
A
11/36
《化工原理》电子教案/第八章
第二节 分子扩散
二.菲克定律
表示扩散方向与浓度梯度方向相反
组分A的扩散量JA,z A B A B A A B 质量中心面 B B A B A B 14/36 B A A
组分B的扩散量JB,z
《化工原理》电子教案/第八章
一.菲克定律
说明: (3)DA,B是物性。
DA, B f ( P , T , x)
转下页
DA,B(气) 10-5m2/s DA,B(液) 10-9m2/s DA,B(固) <10-10m2/s (4)对二元体系,扩散系数的下标 可去掉。即 对气体体系有:DA,B= DB,A 对液体体系有:DA,B DB,A
dcA DAB dz
13/36
《化工原理》电子教案/第八章
一.菲克定律
说明: (1)JA,z、 JB,z是相对扩散通量 (绝对扩散通量用NA,z表示) 组分A移走后,出现空位,其他 分子(可能是A也可能是B)将会 补位,若A、B分子量不等,那么 质量中心会局部发生漂移。JA,z、 JB,z是为了使JA,z+ JB,z=0而定义的 ,即JA,z、 JB,z是相对于一个移动的 扩散面而定义的扩散通量。 (2)JA,z=- JB,z 由JA,z+ JB,z=0可证得。
18/36
《化工原理》电子教案/第八章
二.双组分、一维稳态分子扩散举例
1.等摩尔相互扩散
特点:N A, z N B, z 常数
化工原理(第八章传质基础)

3、生物物质的扩散系数 化 工 原 理 对于水溶液中生物溶质扩散系数的估算,当溶质的分子量 小于1000或其分子体积小于500 cm3/mol 时,可用下式计 算:
DAB
1/ T (φM B )T2 −15 = 7.4 ×10 µVA0.6
m2 / s
吉 首 大 学
吉 首 大 学
JA pA1 pB1 JB pA2 pB2
由于总压p=pA+pB为常数,微分则有:0=dpA+dpB DAB=DBA=D
二、扩散系数 化 工 原 理 扩散系数是衡量物质扩散能力的物理性质,单位:m2/s 1、气体中的扩散系数 气体中的扩散系数与其系统、温度和压力有关,其数量级为 10-5m2/s 对于二元气体扩散系数的估算,通常使用富勒(Fuller)公 式:
固相 C
固相 B+A
气相 C+A
液相 A
汽相 精 馏
干 燥
B+A A+B B
三、相组成的表示方法 化 工 原 理 1.质量分率和摩尔分率 混合物中某组分A的质量mA占混合物总重量m的分率,称为 组分A的质量分率 。即: wA= mA/m 混合物中某组分A的摩尔数nA占混合物总摩尔数n的分率,称 为组分A的质量分率 。即: xA= nA/n 2.质量比和摩尔比 以B为参照组分,则质量比:w = mA/mB,摩尔比:X = nA/nB 3.质量浓度和摩尔浓度 单位体积溶液中溶质的质量,称为质量浓度,即: CA=mA/V 单位体积溶液中溶质的摩尔数,称为摩尔浓度,即: cA=nA/V
C (C -C ) A Ai CBm
CA CAi CAi’
δ δ’
’ D’ C (C’ C ) Ai- ’ A C’ δ’ Bm
化工原理课件第八章

第一节 概述
6.其他 吸收剂还应具有较好的化学稳定性,不易产生泡沫, 无毒性,不易燃,凝固点低,价廉易得等经济和安全条件. 实际生产中,满足上述全部条件的吸收剂是很难找到 的,往往要对可供选择的吸收剂进行全面的评价以做出经 济合理的选择.
第二节 吸收过程的相平衡关系
一,吸收中常用的相组成表示法
在吸收操作中气体的总量和液体的总量都随操作的进 行而改变,但惰性气体和吸收剂的量始终保持不变.因此, 在吸收计算中,相组成以比质量分数或比摩尔分数表示较 为方便. 1.比质量分数与比摩尔分数 (1)比质量分数 混合物中某两个组分的质量之比称为 比质量分数,用符号表示.即: w wA (8-1) WA = A = KgA / KgB
wB 1 wA
第二节 吸收过程的相平衡关系
(2)比摩尔分数 混合物中某两个组分的摩尔数之比 称为比摩尔分数,用符号(或)表示.即: x xA kmolA/kmolB (8-2a) XA = A =
xB 1 xA
如果混合物是双组分气体混合物时,上式则用与的关 系表示为: y yA kmolA/kmolB (8-2b) YA = A =
第二节 吸收过程的相平衡关系
表8-1某些气体水溶液的亨利系数值(E×10-6/kPa)
由表8-1中的数值可知:不同的物系在同一个温度下 的亨利系数不同;当物系一定时,亨利系数随温度升高而 增大,温度愈高,溶解度愈小.所以亨利系数值愈大,气 体愈难溶.在同一溶剂中,难溶气体的值很大,而易溶气 体的值很小. (2)亨利定律的其他表达形式 由于互成平衡的气, 液两相组成各可采用不同的表示法,因而亨利定律有不同 的Байду номын сангаас达形式.
第二节 吸收过程的相平衡关系
采取降温措施, 以增大其溶解度. 所以,加压和降温 对吸收操作有利. 反之,升温和减压 则有利于解吸.对 于同样浓度的溶液, 易溶气体在溶液上 方的气相平衡分压 小,难溶气体在溶 液上方的平衡分压 大.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
多级逆流萃取 萃取
连续逆流萃取
双组分萃取(回流萃取)
2018/9/17
3)混合液含热敏性物质(药物)
4、萃取操作的特点
•选择适宜的溶剂是一个关键问题 •两个液相应具有一定的密度差 •溶质与萃取剂的沸点差大有利
2018/9/17
二、液液萃取在工业上的应用
1、液液萃取在石油化工中的应用
•分离轻油裂解和铂重整产生的芳烃和非芳烃混合物
•用酯类溶剂萃取乙酸,用丙烷萃取润滑油中的石蜡 •以HF-BF3作萃取剂,从C8馏分中分离二甲苯及其同分异构体
2018/9/17
2、基本过程描述
•加料 •混合 •分相 •排除 •纯化和回收 萃取相 (S+A+B) 萃余相 (B+A+S) 混合液 A+B 搅拌 萃取剂 (溶剂S)
2018/9/17
3、分离对象
——液液混合物
1)相对挥发度等于或者接近1 (烷烃/芳烃)
2)重组分 含量少,轻组分含量多(水-HAc)(含酚废水处理)
2、在生物化工和精细化工中的应用
•以醋酸丁酯为溶剂萃取含青霉素的发酵液 •香料工业中用正丙醇从亚硫酸纸浆废水中提取香兰素 •食品工业中TBP从发酵液中萃取柠檬酸
3、湿法冶金中的应用
用溶剂LIX63-65等螯合萃取剂从铜的浸取液中提取铜
2018/9/17
三、液液萃取的基本流程
单级萃取或并流接触萃取
多级错流萃取 单组分萃取
第八章 液液萃取
Solvent Extraction 第一节 概述
一、液液萃取简介 二、液液萃取在工业上的应用 三、液液萃取的基本流程
2018/9/17
一、液萃取简介
1、萃取原理
在欲分离的液体混合物中加入一种与其不溶或部分互溶 的液体溶剂,经过充分混合,利用混合液中各组分在溶剂中 溶解度的差异而实现分离的一种单元操作。 溶质 A : 混合液中欲分离的组分 混合液中的溶剂 稀释剂(原溶剂)B: 萃取剂S: 所选用的溶剂
