合工大高鸿宾有机化学第四版课件9章 醇和酚
醇和酚中小学PPT教学课件

怎样制备 无水乙醇
5、醇的化学性质——与乙醇相似
布置作业 P.55 1、2、3
宝黛初会
曹雪芹
曹雪芹,名 霑,字梦阮,号 雪芹、芹圃、芹 溪,大约于1715 年生,卒于1763 年。
高鹗(约1738- 约1815年)字兰 墅,别署“红楼 外史”。乾隆六 十年进士,官至 翰林院侍读。
曹雪芹的祖先原是汉人,但很早就成了内务府的 “包衣”,入了满籍。从他曾祖开始,三代世袭江宁 织造。祖父曹寅做过康熙侍读,两个女儿都被选为王 妃。雍正继位后,曹雪芹的父亲因与皇家派别斗争有 牵连,以及在担任江宁织造任期内财款亏空等原因, 被罢官,抄家,家道从此衰落。
第三章 烃的含氧衍生物
第一节 醇和酚(1)
第三章 烃的含氧衍生物
第一节 醇和酚(1)
教学目标:
1.掌握乙醇的主要化学性质 2.掌握乙醇 的工业制法和用途 3.了解醇的分类和命名 4.了解醇类的一般通性和典型 醇的用途 重点: 乙醇的化学性质
1.什么叫烃的衍生物? 如果烃分子中的氢 原子被-OH取代产物是什么? 2.溴乙烷在氢氧化钠水溶液中加热生成?
水
C2H5-Br+NaOH △ C2H5-OH+NaBr 烃分子中的氢原子被含有氧的原子团
取代得到的化合物称为烃的含氧衍生物。
醇 链烃基与羟基相连而成 羟基化合物
酚 苯环与羟基直接相连而成
可分为一元羟基化合物和多元羟基化合物
一、醇
1、醇的分类:
醇
Hale Waihona Puke 一元醇饱和一元醇: CnH2n+1OH 不饱和一元醇
注意事项:1)反应温度:170℃ 2)加碎②瓷①片
3)V乙醇:V浓硫酸=1:3 4)④检查气密性
9《有机化学》(第四版)高鸿宾_华南理工大学课件(共十四章)
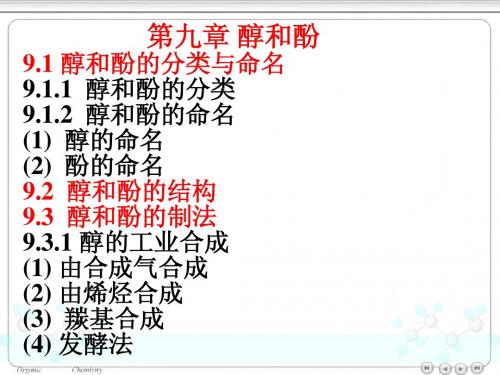
(3) 羰基合成
钴催化剂 CH3CH CH2 + CO + H2 130~175℃ ~25 MPa
CH3CH2CH2CHO + CH3CHCHO
CH3
H2, Ni 或 Cu △,~5 MPa
CH3CH2CH2CH2OH + CH3CHCH2OH CH3
(4) 发酵法 乙醇的制备: 淀粉
淀粉酶
麦芽糖 麦芽糖酶 葡萄糖
OH OH HO OH OH
叔醇
酚:按分子中所含羟基的数目分类:
OH
一元酚
二元酚
三元酚
9.1.2 醇和酚的命名
(1) 醇的命名 (a) 普通命名法:——用于简单的醇。 烃基的名称 + ―醇”
CH3 CH3 CHCH2OH
CH2 CHCH2 OH
CH2OH
异丁醇
烯丙醇
苯甲醇 苄醇
CH2=CHCH2OH
R2SO4 + H2O 2 ROH + H2SO4 △ O O + H ROH + R-C-OH △ R-C-OR + H2O
ROH + CH3 ( TsCl)
δ+
SO2Cl
N
△
O RO-S CH3 + O ( ROTs)
N
. HCl
ROO2S
二甲亚砜
CH3 KCN RCN + CH3 SO3K ( TsK) NaBr RBr + TsONa
弱酸 H2CO3 PKa值 6. 38
9. 89 15.5
弱酸
PKa值
15 .74 15.9 18.0 25.0
OH CH3OH
H2O CH3CH2OH (CH3)3COH HC≡CH
醇和酚的相对酸性: 碳酸>苯酚>水>乙醇
高鸿宾《有机化学》教材精讲及典型真题解析考研考点讲义

碳原子 sp2、sp杂化轨道及乙烯乙炔的空间结构 — 1—
sp2sp杂化轨道 乙烯、乙炔分子模型
3.有机化学反应
有机化合物的性质通过有机化学反应来体现,并取决于有机物结构中的特殊官能团
4.有机化学反应类型
有机化学反应分为自由基型取代和加成,离子型亲电取代、加成和亲核 取代与加成,氧化与还原, 降解,重排,缩合,消去反应,周环反应等
③把双键碳或参键碳看成以单键和多个原子相连。
例如:—C≡N> —C≡CH> —CHCH2 (5)写出全称,用 1,2,3…表示取代基的位次,用一、二、三……表示取代基的个数,用“,”将阿拉
伯数字隔开,用半字线“-”将阿拉伯数字与汉字隔开。
師 師
例:Cl師 帪SO3H
Br
CH3CHCHCH2OH CH3 OH
H
(CH2)3CH3
CC
CH3CH2
H
2.烯炔的亲电加成概论
(1)环正离子中间体机理(反式加成)适用于加溴、氯、次卤酸 (2)碳正离子中间体机理(反式或顺式加成) (3)烯烃亲电加成试剂:X2,HX,H2SO4,HOX,BH3/H2O2,H2O, Hg2 +/H2SO4 重点在于分清试剂中的正电部分和负电部分。产物分布符合马氏规则。注意加成过程中的碳正 离子重排对产物结构的判断。 烯烃亲电加成(立体化学)
3.小环烷烃的开环反应
环烷烃活性分析:小环不稳定易开环,中环稳定,大环较稳定,性质与链烃同。
开环反应为离子型反应机理。
环丙烷与 H2,Br2,HBr,HI,H2SO4等开环反应。 环丁烷只与 H2,Br2开环, 环戊烷在较高温度下加氢开环。
多环物质注意开环位置
H3CCHCH2 +HBr→ CH3CHCH2CH2
有机化学课图文课件ppt第9章

9.1 醇
3. 与无机含氧酸的反应
醇与无机含氧酸(如硫酸、硝酸和磷酸等)作用,脱去水生成 的产物称为无机酸酯。醇与浓硝酸作用可得到硝酸酯,多数硝 酸酯受热后能猛烈分解而爆炸。
例如,甘油与硝酸反应所得的产物为三硝酸甘油酯,其俗名 为硝化甘油,是一种炸药。
例如:
叔醇没有α-H,因此不能发生脱氢反应。
9.1 醇
9.1.4 重要的醇 1. 甲醇
甲醇(CH3OH)是一种无色、透明、易燃、易挥发的有 毒液体,略有酒精气味,沸点为64.5℃,能与水、乙醇、乙醚、 苯、酮、卤代烃和许多其他有机溶剂相混溶,遇热、明火或氧 化剂易燃烧。甲醇用途广泛,是基础的有机化工原料和优质燃 料。甲醇主要用于制造甲醛、醋酸、氯甲烷、甲氨、硫酸二甲 酯等多种有机产品,也是生产农药、医药的重要原料之一。甲 醇在深加工后可作为一种新型清洁燃料,加入汽油中掺烧。甲 醇有一定的毒性。
\
③根据醇分子中羟基的数目,分为一元醇、二元醇和多元醇。
9.1 醇
2. 醇的命名
(1)简单结构醇的命名
简单结构的醇通常采用习惯命名法,将与羟基直接相连的 烃基的名称写于“醇”字前即可。例如:
9.1 醇
(2)复杂结构醇的命名
对于复杂结构的醇,一般 采用系统命名法,遵循以下原则:
①选择连有羟基的最长碳 链作为主链,将支链看做取代基, 按主链所含碳原子数叫做“某 醇”。
9.ቤተ መጻሕፍቲ ባይዱ 醇
2. 乙醇
乙醇(CH3CH2OH)又称酒精,为无色透明液体,易挥发, 有辛辣味,易燃烧,沸点为78.5℃,能与水以任意比例混溶。
有机化学(高鸿宾 第四版)第九章__氨基化

+NH3 氨解
H H +NH3 氨解 NH2 SO3NH4 胺式加成物 NH4HSO3
H H NH 互变异构 亚胺式
NH2
萘胺
二.萘酚衍生物的氨解 •即萘酚在酸式亚硫酸盐的存在下,醇式 经过磺酸衍生物与氨水反应生成 +NH3 萘胺的反应叫Bucherer反应。
氨解 互变异构
酮式
NH4HSO3 加成
烯醇式异构为酮式,与2分子亚硫酸氢铵加成生成醇式加 成物,与氨的氨解反应生成物胺式加成物,消除脱去2亚 硫酸氢铵生成亚胺式的2-萘胺,互变异构为2-萘胺。
OH 烯醇式
H H 互变异构 酮式 H H O NH HSO 4 3 加成
NH4HSO3 加成
OH SO3NH4 H H H SO3NH4 醇式加成物
环氧乙烷分子中的环氧结构化学活性很强。 它容易与氨、胺、水、醇、酚或硫醇等亲核物质作用,发 生开环加成反应而生成乙氧基化产物。 乙醇胺的制备 环氧乙烷与20%~30%氨水发生放热反应可生成三 种乙醇胺的混合物。
9.4 芳环上卤基的氨解
一.反应历程
卤基氨解属于亲核取代反应,非催化氨解为SN2型. 当芳环上没有强吸电基(例如硝基、磺基或氰基)时,卤基不够活泼, 它的氨解需要很强的反应条件,并且要用铜盐或亚铜盐作催化剂。
CuSO4,210-218 C 5MPa,5-10h
o
O NH2 O
O NH2 + NH4Cl O
+ NH4Cl
2-氨基蒽醌是还原染料的中间体; 在造纸工业中用作催化剂以节约烧 碱。
9.5 酚类的氨解
一.苯系酚类的氨解
1.苯胺的制备
OH + NH3 气-固相接触催化法 NH2 + H2O
高鸿宾《有机化学》(第4版)章节题库题-醇和酚(圣才出品)

第9章醇和酚1.异构的环己醇用铬酸氧化总是直立式羟基比平伏式的反应快。
例如,反-4-叔丁基环己醇比顺式异构体迟钝(相差3.2倍)。
而顺式和反式-3,3,5-三甲基环己醇的差别更大,反式比顺式活泼35倍。
这些数据与F.A·凯里的《高等有机化学(B卷)》(王积涛译)第274页上所给的机理是否一致?对以上数据有无更多的反应机理细节?试解释之。
解:铬酸氧化环己醇时,首先形成铬酸酯,然后进行消除,因此其反应速度由两个因素决定:①基态醇的能量;②过渡态的能量反(顺)-4-叔丁基环己醇的氧化:顺式醇B的基态能量比反式醇A高,但是在过渡态时,由于Tb的两个直立的氢排斥铬酸酯基,对氧化有空间加速的作用,降低了过渡态的能量,其降低的能量小于基态的能量差,因此其活化能小,反应速度快。
对于顺(反)-3,3,5-三甲基环己醇:由于甲基与酯基的排斥力更大,对氧化成酮的加速作用更大,因此更大地降低了过渡态的活化能,从而造成了更大的速度差。
从上面的实验事实可进一步看出,在铬酸氧化醇的历程中,A醇快于B醇,空间因素起决定作用。
2.推测下列化合物的结构与高碘酸无反应。
解:3.比较下来化合物的酸性强弱:解:酚羟基具有酸性,当苯环上连有吸电子基团时,酸性增强,吸电子基团越多,酸性越强。
给电子基团,使酸性减弱,给电子能力越强,酸性越弱。
硝基是强的吸电子基团,甲基是弱地给电子基团,甲氧基是强的给电子基团。
酸性由大到小的顺序是:(3)>(4)>(6)>(2)>(1)>(5)。
4.除一氧化碳之外,氰化钠或二氟氯甲烷也能作为一个碳的片段把三烷基硼转化为三烷基甲醇。
前一种情况,硼烷与氰化钠反应,所得加成物再用三氟乙酸酐处理;在二氟氯甲烷的情况,试剂需用叔丁氧钾,氧化一步(过氧化氢)得产物,试列出每一体系的机理。
解:(1)与CO的反应:(2)与HCF2Cl在KOCR3的反应:(3)与的反应:5.将下列各醇与HBr反应的相对速率由快到慢排列次序,并说明理由。
合工大高鸿宾有机化学第四版课件9章醇和酚

ONa 。 Cl Cl Cl
酸化
OH Cl Cl Cl
醇和酚的工业制法
(3) 磺化碱熔法
+ £ ¨H2SO4
NaOH(£ ££)
SO3H ONa
H+
NaOH(£ ££)
SO3Na
£ 320 C
OH
+ £ ¨H2SO4
NaOH(£ ££) ££
酚有芳环上的位置异构和侧链上的碳架异构
OH CH3 CH3 间甲苯酚 邻甲苯酚 CH3 对甲苯酚 CH2CH2CH3 4-丙基苯酚 CH(CH3)2 4-异丙基苯酚 OH OH OH OH OH CH3 CH2CH3 2-甲基-4-乙基苯酚
9.1 醇和酚的分类、同分异构和命名
9.1.3 醇和酚的命名 (1) 醇的命名
H2O2/OH-
RCH2CH2OH 。 1 醇
特点:顺加、反马、不重排!
B2H6 H2O2/OH-
OH H H CH3
+
H HO CH3 H
CH3
(顺加、反马)
(CH3)3C-CH=CH2
B2H6
H2O2/OH-
(CH3)3C-CH2-CH2OH (反马、不重排)
硼氢化反应操作简单,产率高,是制备伯醇的好办法。
有习惯命名法、衍生物命名法、系统命名法。
系统命名法:以醇为母体。选择含有-OH的最长碳链为主 链,从靠近-OH的一端开始编号,把支链看成取代基。例:
1 2 3 4 5 6
CH3CH-CH-CH2CH2CH3 OH CH CH CH
2 2 3
4 3
2
1
CH3CH2CH2CHCH2CH2CH2OH CH=CH2
有机化学_高鸿宾_第四版_答案__第九章 醇和酚习题
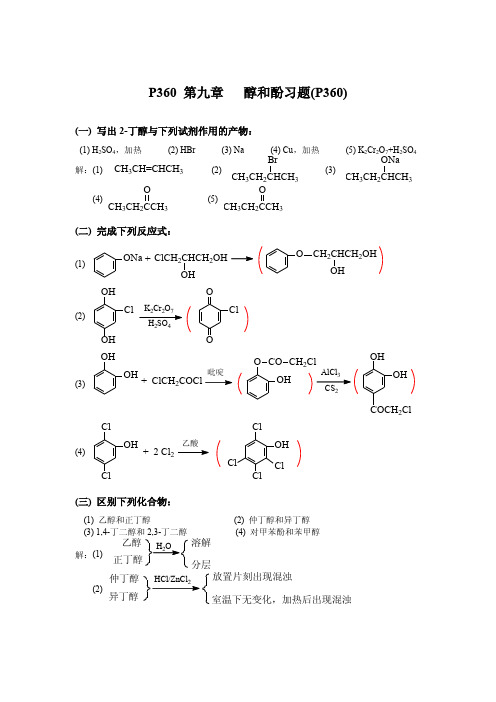
NO2 )具有最小的 pKa 值。
(六) 完成下列反应式,并用 R,S-标记法命名所得产物。
(1) (R)-2-己醇
浓HX SN2
CH3
解:
H C OH CH3(CH2)3
(R)-2-己醇
浓HX SN2
CH3 C X H (CH2)3CH3
(S)-2-卤己烷
浓HX
(2) (R)-3-甲基-3-己醇
C2H5 H3C C OH 解: CH3(CH2)2
归属 O–H(酚)伸缩振动 苯环上对二取代
Cl Cl O O Cl Cl
2,3,7,8-TCDD 是二恶英类化合物中毒性最强的一种,其毒性比 NaCN 还大,且 具有强致癌性,以及生殖毒性、内分泌毒性和免疫毒性。由于其化学稳定性强, 同时具有高亲脂性和脂溶性,一旦通过食物链进入人和动物体内很难排出,是 一种持续性的污染物, 对人类危害极大。 因此, 有的国家已经控制使用 2,4,5-T。 试写出由 1,2,4,5- 四氯苯,氯乙酸及必要的原料反应,分别生成 2,4,5-T 和 2,3,7,8-TCDD 的反应式。
Cl OH + 2 Cl2
乙酸
OH Cl Cl Cl
Cl
(三) 区别下列化合物:
(1) 乙醇和正丁醇 (3) 1,4-丁二醇和 2,3-丁二醇 (2) 仲丁醇和异丁醇 (4) 对甲苯酚和苯甲醇
乙醇
解:(1)
H2O
溶解 分层 放置片刻出现混浊 室温下无变化,加热后出现混浊
正丁醇 仲丁醇
HCl/ZnCl2
CH3CH2CHCH2CH3 OH
PBr3
CH3CH2CHCH2CH3 Br
CH3CH2CHCH2CH3 OH
TsCl 吡啶
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ca(OH) 60 C
。
2
CH 2 -CH-CH O Cl
环氧氯丙烷 3-氯-1,2-环氧丙烷 (制环氧树脂)
2
NaHCO
3 /H 2 O
甘油还可通过油脂水解得到。
醇和酚的工业制法
(3) 羰基合成法
CH3 C H 3C H 2C H 2C H O + C H 3C H C H O 正丁醛 CH3 C H 3C H 2C H 2C H 2O H + C H 3C H C H 2O H 正丁醇 异丁醇 异丁醛
C H 2O H 季 戊 四 醇 (四 元 醇 )
(2) 酚的分类
根据分子中酚羟基的多少,分为一元酚、二元酚、多元酚等。
OH CH3 OH HO OH HO 对 甲 苯 酚 (一 元 酚 ) 对 苯 二 酚 (二 元 酚 ) OH
均 苯 三 酚 (三 元 酚 )
9.1 醇和酚的分类、同分异构和命名
第九章 醇和酚
第九章 醇和酚
9.1 醇和酚的分类、同分异构和命名
9.2 醇和酚的结构
9.3 醇和酚的制法 第九章 目 录 9.4 醇和酚的物理性质 9.5 醇和酚的波谱性质 9.6 醇和酚的化学性质―醇和酚的共性 9.7 醇羟基的反应―醇的个性
9.8 酚的化学性质―酚的个性
第九章
醇和酚的分子中都含有羟基。
醇和酚的工业制法 乙二醇(俗称甘醇)的工业制法:
Cl 2 +H 2 O 70-80 C H 2 O,NaHCO
。
CH 2 Cl
CH 2 OH
Ca(OH)
2
3
CH 2 OH
CH 2 OH
CH 2 =CH
2
O 2 ,Ag 250-280 C
。
CH 2 O
。
CH 2
H 2O H 或OH
+ -
CH 2 OH
¼ Ó ±²
CH3 NO2 ä ³±Ó ¶ õ ù ¼ Ó » » ¼ ² Ô Ï º ±² m-» ±² p-Ï º ±² ³¼ Ó õ ù ¼ Ó
OH OH
Á Ó Ý ² Á Ó 1Ý ²
Ý ² Á Ó 2Ý ² Á Ó
OH
OH
OH Cl COOH NH2 对氨基苯酚 对硝基苯酚 NO2 CH3 4 -甲 基 -2 -氯 苯 酚 对羟基苯甲醛 CHO 邻羟基苯甲酸 水杨酸
££
OMgX R'-C R R" OMgX R'-CH-R R-CH2-OMgX R-CH2-CH2-OMgX
H2O/H+
OH R'-C R R" ££ OH R'-CH-R R-CH2-OH
££
£££££££ £££££££
R-CH2-CH2-OH
OH
例:
O C H 3( C H 2) 3M g C l + C 6H 5- C - C H 3
9.1 醇和酚的分类、同分异构和命名 ③ 按分子中醇羟基的个数:一元醇、二元醇、多元醇… …
C H 2O H C H 3O H H O C H 2C H 2O H CHOH C H 2O H 甲 醇 (一 元 醇 ) 乙 二 醇 (二 元 醇 ) 丙 三 醇 (三 元 醇 ) HOCH2 C H 2O H C C H 2O H
醇羟基连在饱和碳上: C H 3C H 2O H 乙醇 酚羟基连在芳环上: OH
醇和酚
OH 环己醇
C H 2O H 苯 甲 醇 (苄 醇 )
OH OH
苯酚
萘 酚
萘 酚
9.1 醇和酚的分类、同分异构和命名
9.1 醇和酚的分类、同分异构和命名 9.1.1 醇和酚的分类 (1) 醇的分类
① 按与-OH相连的碳原子的类型分:伯、仲、叔醇。
酸式硫酸酯 H 2O
RC H = C H 2 + 浓 H 2 S O 4
( R = H , C H 3)
OH R C H - C H 3 + H 2S O 4( 稀 ) (马氏规则)
RCH=CH
(R=H,CH
2
+ H 2O
H 3 PO 4 /硅藻土
RCH-CH OH
3
(马氏规则)
3)
乙醇也可由农副产品(淀粉、甘蔗糖蜜)发酵生产 。
ONa 。 N O 2 H 2S O 4
OH NO2
Cl Cl Cl Cl
N aO H ,C H 3 O H
ONa 。 Cl Cl Cl
酸化
OH Cl Cl Cl
1 3 0 ~ 1 5 0 C , 0 .5 ~ 1 .4 M P a
醇和酚的工业制法
(3) 磺化碱熔法
+ £H2SO4 ¨
NaOH(££) £
甲苯自由基氯化得
醇的实验室制法
(2) 从Grignard试剂制备
O ¨ £ ª © R'-C-R" Í £ O ¨© © R'-C-H£ È £ R MgX + O H-C-H£ » È £ ¨³© © H2C CH2 O ¨²õ £ º Ñ Ò Í £ é ©
NaOH/H2O
£ ROH ¨ £3 RX££££ ¬ £ £ (1 £ ) 2
NaOH/H2O or Na2CO3/H2O
例: CH2=CH-CH2Cl
ª£¬£££££ £ £ õ
CH2=CH-CH2OH
C H 2C l + N a2C O 3 + H 2O
95 C 74%
。
C H 2 O H + 2N aC l + CO 2
2
1
C H 3C H 2C H 2C H C H 2C H 2C H 2O H CH=CH2
5 6
3-丙 基 -2-己 醇
4-丙 -5-己 烯 -1-醇
(选 择 含 -OH和 双 键 的 长 碳 链 为 主 链 )
9.1 醇和酚的分类、同分异构和命名
3
2
1 2 OH
OH CH-CH1 2源自2 31CH=CH-CH
CH 2 OH
工业上丙三醇(俗称甘油)可由丙烯制取:
CH 2 =CH-CH
3
+ Cl
500 C
2
CH 2 =CH-CH
2 Cl
Cl 2 +H 2 O 25-30 C
。
CH 2 -CH-CH 2 Cl OH Cl CH 2 -CH-CH 2 OH OH OH
甘油
+
CH 2 -CH-CH 2 OH Cl Cl
9.1.2 醇和酚的构造异构
醇有碳架异构和官能团位置异构。
OH C H 3C H 2C H 2C H 2O H 正丁醇 C H 3C H C H 2C H 3 仲丁醇 CH3 C H 3C H C H 2O H 异丁醇 碳架异构 CH3 CH3 C OH
CH3 叔丁醇
位置异构
酚有芳环上的位置异构和侧链上的碳架异构
CH3CH2CH2CH2OH ® » ° ´ OH CH3CH2CHCH3 Ù » Ö ´ CH3 CH3£C£OH £ CH3 å » Ê ´
② 按-R的不同:饱和醇、不饱和醇、芳香醇。
OH CH3CH2CH2CH2OH ±¹ ´ ¥ Í » CH3CH=CHCH2OH º ±¹ ´ ° ¥ Í » » ã » ²Ï ´ OH CH2OH
CH3 M g B r + H 2C O CH2
(1) 干 醚 ( 2 ) H 2O / H +
C H 3C H 2C H 2C H 2- C - C H 3 C 6H 5
CH3 C H 2C H 2O H
(1 ) 纯 醚 (2 ) H 2 O , H +
醇的实验室制法
(3) 由烯烃制备
(a) 硼氢化-氧化反应
9.1 醇和酚的分类、同分异构和命名
£ ££«£ OH OH
OH
OH OH
OH
OH
OH
OH HO OH OH OH Ú ¼ þ ² ¶ ¼ ¶ ² Á ±¶ Ó Ô ±þ Ó ¬ ¼ ý Ó Á ±È ² « ¼ ý Ó Æ ±È ² ù ¼ ý Ó ½ ±È ² ¼ þ Ó ¼ ý Ó ¼ ý Ó o-±¶ ² p-±¶ ² 1,2,3-±È ² 1,2,4-±È ² 1,3,5-±È ² ¼ þ Ó ¼ ý Ó
普 通 碳 -氧 单键的性质
酚分子中的氧原子采取不等性sp2杂化,具有平面三角构型:
有部分双键性质, 键长短,不易断裂! 杂化 O p 轨道 s 轨道 p 轨道 sp 轨 道
2
有酸性! H
多 电 子 p - 共 轭
9.2 醇和酚的结构
由于羟基连在不同杂化态的碳原子上,醇和酚的极性不同, 理化性质不同!
整个分子的偶极矩 只有-I H
-3 0 = 5 .7 x 1 0 C m
-I <<+C = 5 .3 4 x 1 0 O
-3 0
C m
H H
C
O H 酸性小于水
H 酸性大于水
9.3 醇和酚的制法
9.3.1 醇的工业合成 (1) 由合成气合成 (2) 由烯烃合成 (3) 羰基合成法 9.3.2 酚的工业合成 (1) 异丙苯氧化法 (2) 从芳卤衍生物水解 (3) 磺化碱熔法
钴催化剂
C H 3C H = C H 2 + C O + H 2
。
130~175 C 20~30M Pa
H 2 , N i或 C u ,P
醇和酚的工业制法
9.3.2 酚的工业合成
(1) 异丙苯氧化法
CH 3 -CH-CH + CH 3 -CH=CH
