第五章:立体化学
立体化学基础
Cl大 HOCH2
Cl
键上,纸面 走向与实际
CH2Cl 走 向 相 同 ,
S-2,3-二氯丙醇
R-2,3-二氯丙醇
顺时针为R型, 逆时针为S型。
直接根据Fischer投影式命名的简便方法介绍
Problem 6: Give the names of the following compounds。(by R/S nomenclature)
有相等的距离。实物与镜像的关系叫对映关系。
镜面
实物与镜像
若实物与其镜像能够完全重合,则实物与镜像所 代表的两个分子为同一个分子。
OH
OH
CH H
CH3
HC H
CH3
OOHH
HH
CC HH 所有基团都重合 CCHH3 3
乙醇分子模型的重叠操作
对于某些分子,两个互为实物与镜像关系的分 子不能重合,如乳酸。
CO2H
CO2H
CO2H
NH2
NH2
H CH3
NH2 H
CH3 H
CO2H
CH3
H
NH2
CH3
即:固定*C上某个基团,其它三基团顺序轮换,不 改变其构型。
Problem 3: 下列Fischer式是否表示同一化合物?
COOH
CH2OH
H
OH
HO
H
--
CH2OH
COOH
镜 像
1
2
关
旋转180℃后可重叠
丙酸分子 的对称面
分子的对称面 具有对称面的分子为非手性分子
四、判断对映体的方法
1、看分子和它的镜像能不能重合。如果 不能重合,就具有对映异构现象。
2、寻找对称面和对称中心。如果分子没 有对称因素(对称面和对称中心),就 具有对映异构现象。
立体化学

(2) 第二个手性中心的产生
如果在一个旋光性分子里生成第二个手性碳原子, 生成非对映体的量是不相等的。
例如:
CH3 H Cl H H CH3
(2S)-氯丁烷 手性环境
Cl2
CH3 H Cl Cl H CH3
(2S,3S)-二氯丁烷
CH3 + H H Cl Cl CH3
(2S,3R)-二氯丁烷
29%
第五章
立体化学
立体化学是研究分子中原子或原子团在空 间的排列状况,以及不同的排列对分子的 物理和化学性能的影响。 立体化学中主要讨论顺反异构、对映异构、 构象异构。
§5-1顺反异构
顺反异构(cis-trans isomerism)是讨论分 子旋转受双键或环的限制引起的异构现象。 属于几何异构。 一.含有碳碳双键的顺反异构
Ö Ô Ö Ó Ê Ð ·×
基团空间位阻之和>0.29nm时有手性
有手性面的化合物:手性面是通过分子的 平面,在它两侧的取代基是不同的 。 如柄型化合物:
(CH2) n
O R
O
当R=COOH时:n≥10,自动消旋化; n=9,加热时慢慢消旋化; n≤8,有对映体,是手性分子
螺旋型化合物:
赤式
CHO HO H H OH CH2OH
苏阿糖
CH3 Cl H H OH CH3
苏式
相同的原子在同侧
相同的原子不在同侧
沿C—C键轴观看,相同或相似的原子或基 按相同方向出现者为赤型,以相反方向出现时 为苏型。例如:
H H Cl H3C OH 苏式 前 后 前 CH3 CH3 H3C H 苏式 后 前 H Cl OH HO H Cl CH3 赤式 后 前 H CH3 H3 C HO H 赤式 后 H Cl CH3
手性分子
纸面上旋转180° 纸面上旋转180° 180
= HO
CH3 H
OH
COOH
COOH
H
纸面上旋转90° 纸面上旋转90° 90
H CH3 OH H3C OH COOH
投影式不能离开纸面进行翻转。 2、 Fischer 投影式不能离开纸面进行翻转。 3、如果使Fischer 投影式中的一个基团保持 如果使Fischer 固定, 固定,而把另外三个基团顺时针或逆时针调换 位置,不会改变原化合物的构型。 位置,不会改变原化合物的构型。
外消旋体:等量左旋体与右旋体的混合物。 外消旋体:等量左旋体与右旋体的混合物。无 混合物 旋光性。 用 (±) 、RS或 (dl)表示。 旋光性。 ± 或 表示。 表示 (±) –乳酸 ± 乳酸
原因:一对映体,旋光度相等,旋光方向相反。 原因:一对映体,旋光度相等,旋光方向相反。 性质: 性质:外消旋体的物理性质与纯的单一对映体 比较有所不同。 比较有所不同。
课堂练习:问题 - 课堂练习:问题5-2
第二节
一、投影方法
费歇尔投影式
COOH
HO
H
CH3
把主链竖 立,编号 最小碳放 在上端
划十字线, 划十字线, 交点代表手性 横键向前, 碳,横键向前,竖键向 。
含有两个手性碳的手性分子的投影
CH3 HO
HO C C OH CH3 H
H OH CH3
H
H H3 C
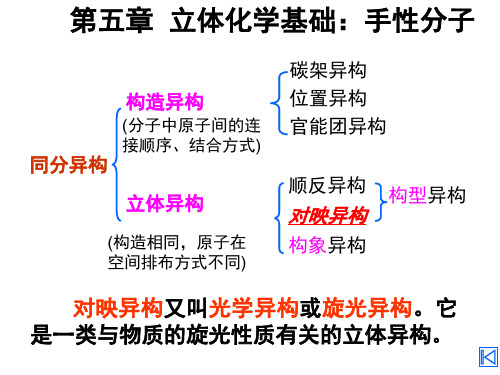
立体化学基础: 第五章 立体化学基础:手性分子
碳链异构 位置异构 构造异构 同分异构 立体异构 构象异构 官能团异构 互变异构 构型异构 对映异构 顺反异构
构造异构:分子组成相同而原子( 构造异构:分子组成相同而原子(团)相互连接方 异构 式和顺序不同 空间排列方式不同 立体异构:分子中原子( 立体异构:分子中原子(团)在空间排列方式不同
立体化学第五章立体异构体的分离鉴别方法

+ (S,S)-丁 二 醇
C4H9 H
H 3 O+
O C4H9
分
H H H3C O O CH 3 H O
离
O
+ (S,S)-丁 二 醇
C4H9 H
H 3 O+
O C 4H 9 H
缩酮易逆反应得到对应体!
5-8,9
注意:避免二个对映体的反应速度可能不同引起的分离不完全
3)化学拆分是经典方法,在工业上很重要.如分离半合成青霉素
2)
H
C
H3C
C
(1) (2)
CH3
H(1)与H(2)非对映的(化学环境不同)
H
O
3)
H3C
(1)
(2)
C
N CH3
-CH3(1)和 -CH3(2)中的质子是非对映的
5-2
4)
2 H 3H
1 H
6 H 4H
7 H
2 H
1 H H4
6 H
7 H H5
H 3
H 5 H 4 H 5
H 3 H 3 H 4
方法2:两个非对映体混合物可用NMR谱估计比例。 大多数的非对映体的1H、13C是磁不等性的(非对映 的),NMR谱有区别,由信号的积分曲线估计两组成。 决定d、l%; 方法3:对映体与手性试剂作用转化成非对映体,再用 NMR谱。常用的手性试剂是顺磁性金属衍生物的可溶 于有机溶剂中的物种。
这个手性试剂称为手性位移试剂。
5-8
一、基于基态非对映体性质的分离 1.化学法拆分: 1)将一对外消旋体(±)A 如酸与一个不对称试剂B (拆分剂)如(R)-B作用,形成非对映体盐,再用 分步结晶、分馏、色谱等方法分离,得到(R)-A和 (S)-A。
立体化学 第5章 环烷烃
1,2,4-三甲基环己烷
C. 必要时须注明立体构型;
D. 复杂化合物也可将环的部分当作取代基。
顺-1,2-二甲基环丙烷 反-1,3-二甲基环丁烷
4-环戊基庚烷
(2) 多环化合物的命名:
(命名较为复杂, 以二环化合物为例). A. 参加成环的总碳原子数作为母体烃; 如有8个碳原子,则称为辛烷 B. 简单桥环可用“二环”、“三环”等作词头; C. 二环“连接”处的碳原子为桥头碳原子; D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的碳原子 数写入方括号中(注意:桥头C原子都不可计入)。
2) 环戊烷的构象
环戊烷的结构是以拆叠的形式存在,四个C原子基本在一 平面上,另一个C则在平面之外,这种构象称为信封式构象。 环戊烷由于以“信封式”构象存在,使分子张力较小,化学性 质较稳定。
3) 环己烷的构象及构象分析
i) 椅式和船式构象
椅式
船式
船式构象相对能量较高, 不稳定,通过C-C键扭曲, 使其成为扭曲式(或称为扭 船型)。这种构象相对于船 式能量低。
角张力---由于键角偏离正常键角 而产生的张力。
环丙烷的三个C在同一平而上,相邻两个C上的C-H键都是重叠式构象, 相互拥挤,产生排斥,也具有较高的能量。
扭转张力---由于重叠式构象而产生的张力。
4. 环烷烃的构象和构象分析
1) 环丁烷的构象
环丁烷的四个C不在同一平面上,形如蝴蝶。即通过C-C键的扭转而以 一个拆叠的碳环存在。 环丁烷的三个C原子分布在同一平面,另一个C取于平面之外。 环丁烷的这种存在形式可使环的张力降低,但仍然是一个不稳定分子。
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类与分子对称轴平行,即垂直于环平面,称为
第五章 立体化学

四、判断对映体的方法
有三种方法可以用来判断一个分子是否 存在对映体: 1.建造一个分子和它的镜像的模型,如果 两者不能重合,就存在对映体。 2. 如果分子有对称面,那么它和其镜像 就能重合,就不存在对映体。 3.如果一个分子有一个手性碳原子,它就 具有对映异构现象,有一对对映体。
第二节 费歇尔(Fischer)投影式
D-(-)-甘油酸
D-(-)-乳酸
D.L命名法的使用有一定的局限性,它只适用与甘油醛结构 类似的化合物.目前,仍用于糖类和氨基酸的构型命名
二、 R.S构型命名法
R/S 构型标记法分为两步:
(1) 按次序规则确定与手性碳相连的四个原子 或基团的优先次序(或称为“大小” 次序)
3
CH3 C H4 Br1
对称面
内消旋酒石酸分子
问题:内消旋体是否显旋光性?为什么? 答案:不显旋光性。因为内消旋体有一对 称面,互为对称的两部分对偏振光的影响 相互抵消,使整个分子不表现旋光性。
第六节 构型命名
一、D.L命名法 规则:以甘油醛为标准,Fischer投影式中C* 上羟基处于右侧的为D-构型;反之为L-构型
CH3 H C6H5
S构型
CH3
Br
HO H
S构型
C6H5
COOH HO H
R构型
COOH H3C Cl C6H5
R构型
CH2OH
问题:判断下列手性碳的R、S构型。
R
HO COOH C H
R
H H
CO2H OH OH CH3
CH3
R
R-乳酸
2R,3R-2,3-二羟基丁酸
实物与镜像不重合
不含 对称中心 对称面
CO2H H HO C C OH H HO H
第五章 立体化学基础

第五章立体化学基础:手性分子1.将1.5g的旋光物质溶解在乙醇中,配成50ml溶液:(1)假如该溶液在10 cm 旋光仪管中观察旋光度为+2.79°时,求出20℃时的钠光(D线)下的比旋光度;(2)假如上述溶液在5 cm 旋光管中测定,那么测得的旋光度是多少?(3)若将此溶液由50ml稀释到150ml 且在10cm管中进行测定,旋光度又是多少?2.比旋光度是+40°的某物质,在1分米的旋光管中测得的旋光值为+10°。
试问此物质溶液的百分浓度为多少?3.判断下列分子是否具有对称中心、对称轴或对称面?(1)反1,2-二甲基环丙烷(2)环己烷的船式构象(3)乙烷的交叉式构象(4)丁烷的对位交叉式构象(5)乙烷的重叠式构象4.(S)-(-)-1-氯-2-甲基丁烷二氯代后所得产物的分子式为C5H10Cl12 。
试预测能有几种馏分,画出各馏分化合物的结构,各馏分有无旋光性?5.分别列举一对互为构造异构体,构象异构体和顺反异构体的实例(用结构式表示)。
构象异构体通常能分离吗?6.下列分子哪些是手性分子?7.将(—)、(+)和内消旋酒石酸三者等量的混合物进行分步结晶,可得到两部分均无旋光性的结晶。
哪两部分?8.解释下列概念⑴手性分子;⑵手性碳原子;⑶对映体;⑷非对映体;⑸内消旋化合物;⑹外消旋体;⑺旋光性;⑻旋光性化合物。
9.化合物(+)-丙氨酸和(-)-丙氨酸在下述性质方面有哪些异同?⑴熔点;⑵密度;⑶折光率;⑷旋光性能;⑸水中溶解度。
10.若测得一蔗糖溶液,旋光度为+90°,怎么能确知它的旋光度不是-270°?11.下列化合物,各有几个手性碳原子?12.下列化合物中,哪些存在内消旋化合物?⑵,3-二溴戊烷 2⑶,4-二溴戊烷⑴,3-二溴丁烷 2213.用R/S构型命名法标记下列分子构型14.用R/S构型命名法命名下列各个化合物的构型;并说明哪对是互为对映体?哪对互为非对映体?15.指出下列各组中两个化合物的关系(相同化合物?对映体?非对映体?)16.(S)-2-甲基-1-氯丁烷在光的作用下,与控制量的氯气发生取代反应,生成二氯代产物的混合物,分离得到A:2-甲基-1,4-二氯丁烷和B:2-甲基-1,2-二氯丁烷。
第五章立体化学基础:手性分子

(二)、比旋光度 )、比旋光度
规定用一分米长的旋光管, 规定用一分米长的旋光管,待测物质 的浓度为1g.ml-1时所测得的旋光度,称 时所测得的旋光度, 的浓度为 为比旋光度, α 表示。 为比旋光度,用[α]Dt表示。
α l:旋光管的长度(分米) 旋光管的长度(分米) 旋光管的长度 C:溶液的浓度(g.ml-1) 溶液的浓度( 溶液的浓度 l×C × ɑ:实验观察旋光值(度数 实验观察旋光值 度数) t: 测定时温度(℃) 测定时温度( 公式:[α]Dt== 公式: α
有一个手性碳原子时,则有一对( 有一个手性碳原子时,则有一对(二个 立体异构体)对映体; 立体异构体)对映体;有二个手性碳原 子时,则有二对(四个立体异构体) 子时,则有二对(四个立体异构体)对映 有三个手性碳原子时,则有四对( 体;有三个手性碳原子时,则有四对(八 个立体异构体) 个立体异构体)对映体 …… 可见:含有 个手性碳原子时,有2n个 可见 含有n个手性碳原子时 有 含有 个手性碳原子时 立体异构体. 立体异构体
存在对称面就不存在对映体 ⑵、寻找对称面:存在对称面就不存在对映体 寻找对称面 存在对称面就不存在
⑶、寻找手性碳原子:有一个手性碳原 寻找手性碳原子: 就具有一对对映体。 子,就具有一对对映体。有二个或 二个以上手性碳原子时, 二个以上手性碳原子时,有例外情 。(有对称面则没有对映体 有对称面则没有对映体)。 况。(有对称面则没有对映体)。
CHO OH CH2OH HO
CHO H CH2OH
D-(+)-甘油醛 ( ) 甘油醛
L-(-)-甘油醛 ( ) 甘油醛
(+);(-)只表示旋光方向 和构型没有一定 ) ( )只表示旋光方向,和构型没有一定 的关系。 的关系。
第五章:立体化学

O H C H2 C H2 C H2 C H
3
【TM】 】
O H O H C H2 C H2 C H2 C H
3
O H
O
3
【逆推】 逆推】
C H2 C H2 C H2 C H
3
C H2 C H2 C H2 C H
3
C H2 C H2 C H2 C H
O H O M g B r 1 . + 2 . H3 O H3 P O
4
1 . B H
2 2 6
_ 2 . H O2 / H O
T M 1 1 0
【合成】 合成】
5. 烯烃与卤素加成 烯烃与卤素加成 烯烃与卤素加成是反式加成 烯烃与卤素加成是反式加成
B r B r
2
B r
比较: 比较: 6. 卤代烷的E2消除 卤代烷的 消除 卤代烷的E2消除是反式消除 卤代烷的 消除是反式消除 查依采夫规则 消除是
2
C O
2
E t
E t C O
2
E t
O O
+
C O E t
2
【逆推】 逆推】
H
C O
2
E t H H C O
2
F G A
E t O C O H
2
C O
2
E t
O
+
C O
2
E t E t
H H C O 2 E t C O 2 E t O
H / P d +
O C O 2 E t H C O 2 E t H
有机合成中立体化学 立体化学的控制 第五章 有机合成中立体化学的控制
1. 炔烃的还原 炔烃的催化氢化是顺式加氢,而在液氨中用金属钠还原则为反式加氢 炔烃的催化氢化是顺式加氢,而在液氨中用金属钠还原则为反式加氢 顺式加氢 液氨中用金属钠 OH
有机化学第五章知识点总结

第五章立体化学基础
1. 概述:
旋光异构与顺反异构都属于立体异构;
碳架异构,官能团异构和位置异构都属于构造异构;
立体异构和构造异构属于同分异构。
2. 右旋+d;左旋–l;
手性原子(即上面连有4个不同的原子或基团)是引起化合物产生手性最普遍的原因,但不能将是否含有手性原子作为产生手性分子的绝对条件,产生手性的必要和充分条件是分子与其镜像不能重叠(即分子的不对称性)。
有些分子虽然不含任何手性原子,但具有手性;
3. 凡具有对称面或对称中心,一定是非手性的,无对应异构体,无旋光性;
即无对称面又无对称中心的化合物,一定是手性化合物,具有旋光性。
4. 费歇尔投影式:与手性碳原子相结合的两个横键指向平面前方,两个竖键向后。
5. DL命名法:甘油醛,羟基在右边(费歇尔投影式中),右旋甘油醛,为D构型。
6. RS命名法:最次的放在后面,若剩下的由大到小顺时针为R;逆时针为S;
7. 赤藓糖:相同原子团在同侧为赤型;
苏阿糖:相同原子团在异侧为苏型;。
立体化学的内容

立体化学的内容
立体化学是化学的一个分支学科,主要研究分子的三维空间排列及其对分子性质的影响。
它主要分为静态立体化学和动态立体化学两部分。
静态立体化学研究分子的构型和构象,即分子中的原子或基团在空间的排列方式和相对位置。
动态立体化学则研究分子构型的异构体及其在化学反应中的行为。
立体化学的一个重要分支是对手性分子的研究,手性分子在立体化学中占有极其重要的地位。
手性是指一个物体不能与其镜像相重合,例如人的双手,左手和右手互为镜像,但它们无法重合。
在化学中,手性分子是指具有手性特征的分子,即它们与其镜像不重合。
立体化学还涉及到有机分子和无机分子的结构和反应行为的研究,尤其是在有机化合物中,由于共价键具有方向性特征,立体化学在有机化学中占有更重要的地位。
总的来说,立体化学是从三维空间揭示分子的结构和性能的学科,它不仅对理解物质的性质和反应机制具有重要意义,也对药物设计、材料科学等领域有着广泛的应用价值。
《有机化学》第五章 立体化学基础 - 副本
COOH H C OH
COOH H C OH
HO C H
HO C H
COOH
COOH
Pers酒pec石tiv酸e projection Fischer projection
Tartaric acid (carboxyl group at top)
CHO
H OH [O]
CH2OH D-(+)-甘油醛
COOH
H OH [H]
CH2OH
D-(-)-甘油酸
COOH H OH
CH3 D-(-)-乳酸
1951年,J.M.Bijvoet 用X-衍射技术测定了(+)-酒石酸铷钾 盐的绝对构型之后,确定了原来人为规定的D-(+)-甘油醛的构型 (相对构型)刚巧就是它的真实构型(绝对构型)。
第五章 立体化学基础 第四节 构型标记法 (R/S构型标记法)
R/S 构型命名法举例:
CH3
H
OH
CH2CH3
S-2-丁醇
CHO HO H
H OH CH2OH
CH3
H
H
OH 转动使H
HO
远离视线
CH3
C2H5
C2H5
CHO
S 构型
HO SC H RC
H
2S,3R-2,3-二羟基丁醛
OH
CH2OH
人民卫生电子音像出版社
第五章 立体化学基础:手性分子
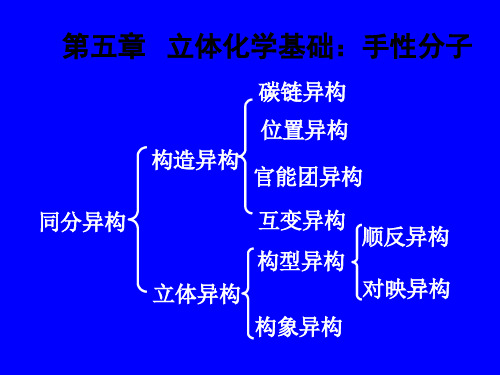
碳架异构
同分异构
构造异构
(分子中原子间的排 列顺序、结合方式)
位置异构 官能团异构
立体异构
顺反异构
对映异构 构型异构
第五章立体化学基础(手性分子)

第五章 立体化学基础(手性分子) 一、选择题1.下列化合物具有旋光性的是( )。
CH 2OHHO HCH 2OH3HA .B .C .D .33COOHH2.3-氯-2,5-二溴己烷可能有的对映体的个数是( )。
A .3对 B .1对 C .4对 D .2对3.下列羧酸最稳定的构象是( )。
COOHCH 3H 3C H 3CCOOHCH 3A .B .C .D .4.下列化合物构型为S 型的是( )。
A .B .C .D .CH 3BrHNH 2CH 3HOH CH 2CH 3CH 2OHClH OHCOOHHOH CH 2OH5.具有手性碳原子,但无旋光活性的是( )。
A.E-1,2-二甲基环丁烷B.Z-1,2-二甲基环丁烷C.1,2-二氯丁烷D.1,3-二氯丁烷E.1,4-二氯丁烷 6.下列化合物的绝对构型为( )。
COOH H OHCH 2CH 3A .B .C .D .D-L-R-S-型型型型7.下列化合物构型为S 型的是( )。
A .B .C .D .CH 3BrHNH 2CH 3HOH CH 2CH 3CH 2OHClH OHCOOHHOH CH 2OH8.下列互为对映体的是( )。
H HO COOH H OH COOHH OHOH H COOH HHOOCOH H HO COOH OHH COOH HHOCOOH (1)(3)(4)(2)(1)(3)(4)(2)(1)(3)(2)和和和和(3)A .B .C .D .9.3R ,4R-3,4-二苯基戊酸的最稳定构象是( )。
A .B .C .D .3C 6H 56H 5HOOCH 23C 6H6H 53C 6H H C 6H65H 3H C 6H10.下列分子没有手性的是( )。
A .顺-1-甲基-3-乙基环戊烷B .反-1-甲基-3-乙基环戊烷C .顺-1-甲基-2-乙基环丙烷D .反-1-甲基-3-乙基环丁烷 11.下列化合物的Newman 式对应的费歇尔投影式为( )。
第5章立体化学基础

CH3
CH3
H
OH
异丙醇
H
OH
H CH3
OH
2,32,3-丁二醇
CH3
H
CH3
H
CH3
CH3
H
1,11,1-二氯乙烷
H
顺-1,2-二甲基环丙烷 二甲基环丙烷
四、判断对映体的方法
1. 最直接的方法是建造一个分子及其镜像的模型。 最直接的方法是建造一个分子及其镜像的模型。 如果两者能重合,说明分子无手性, 如果两者能重合,说明分子无手性,没有对映异构现 象;如果两者不能重合,则为手性分子,有对映异构 如果两者不能重合,则为手性分子, 现象,存在对映体。 现象,存在对映体。 2. 考察分子有无对称面。如果分子有对称面, 考察分子有无对称面 如果分子有对称面, 对称面。 则该分子与其镜像就能重合,没有对映异构现象。 则该分子与其镜像就能重合,没有对映异构现象。 3. 大多数情况下,可根据分子中是否存在手性碳 大多数情况下,可根据分子中是否存在手性碳 原子(或手性中心 来判断分子是否有手性。 原子 或手性中心) 来判断分子是否有手性。 或手性中心
COOH COO H
CO OH H HO C CH 3
H OH CH 3 CH 3 OH H
COO H C H3 C H OH
-
二者的关系:互为镜象(实物与镜象关系, 二者的关系:互为镜象(实物与镜象关系,或 者说左、右手关系)。二者无论如何也不能完全重 者说左、右手关系)。二者无论如何也不能完全重 )。 叠。这种呈物体与镜像关系,彼此又不能重叠的性 这种呈物体与镜像关系, 呈物体与镜像关系 质称为手性。 质称为手性。
COOH COOH
H OH CH3 CH3 OH
H
有机化学PPT第五章 立体化学基础课件

南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
含有一个手性碳原子的化合物,在空间有2种不同构
型, 它们彼此构成一对对映体。
CH3C* HCOOH
COOH
OH
乳酸
HO C H
CH3
COOH H C OH
CH3
有一个手性碳的化合物必定 是手性化合物,只有一对对映体。
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
问题:下列化合物哪些含手性碳原子?
1. CH2Cl2
2. CHCl3 3.CH3CHClCH2CH3
4. CH3-CH-CH2CH3 CH2CH3
H
6.
CH3 7.
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
第一节 手性分子和对映体
一、手 性
观察自己的双手, 左手与右手有什么联系和区别?
南京医科大学康达学院化学教研室 有机化学
南京医科大学康达学院 博学至精 明德至善
左右手互为镜像与实物关系(称为对映关 系),彼此又不能重合的现象称为手性。
H
2 COOH
H3C3 1Cl
H 1OH
2 CH2CH3
3CH3
竖,顺,R南-京型医科大学康达学院化学教横研室,有逆机化,学 R-型
南京医科大学康达学院 博学至精 明德至善
课堂练习:根据Fischer投影式命名。
2
CO2H
H
OH 1
3 CH3 R-(-)-乳酸
HOCH2 3
第五章 立体化学原理3

Cl
分子中所有的原子都在同一平面上,这个面就是分子的对成面。
有对称面的分子能和它的镜像重合, 没有手性。
(2) 对称中心: 从分子中任何一个原子或基团向中心引
一条直线, 再延长到对面等距的地方, 总有一个相同的原 子或基团。
对称中心
翻转180度
有对称中心的分子能和它的镜像重合, 没有手性。
(3)对称轴(旋转轴):分子中有一条直线,当分子以
五、手性化合物的获得与产生
1.从天然资源中分离;
2.外消旋体的拆分 3.酶及微生物合成
4.手性合成
外消旋体的拆分
将外消旋体拆分成左旋体和右旋体的过程,称为 外消旋体的拆分。
(+)
(±)
( -)
a、 结晶机械分离法
1848年Pasteur在研究酒石酸钠铵晶体的时候,发现酒
石酸钠铵有两种不同的晶体,这两种晶体互为镜像。
有些不含手性碳原子的化合物,由于分子结构中
不存在对称因素,也属于手性分子。
(环状化合物,轴手性、面手性和螺手性化合物)
三、对映、非对映异构体的理化性质比较 对映异构体:
② 化学性质:非手性条件下相同;手性条件下不相同。 ③ 对映异构体的生理活性不同 。
① 物理性质: 除比旋光度值相同, 方向相反外,其它相同。
则分子有对称面,没有对映异构。
O2 N
COOH
O2N
C(CH3)3
联苯和联萘
H Br F
F
F F
H Br
HO HO
H H
镜面
面手性化合物:
平面手性的立体模型
面手征性:分子就一个平面来区别手征性,该面即为 手性面.
手柄类化合物
环蕃类化合物
立体化学第五章立体异构体的分离鉴别方法

-
消旋化作用
(S)(+)PhCH(NH 2)COOH· (+)CSA (溶液中)
*
O
(R,S)(±)PhCH(NH 2)COOH + (+)CSA
+
CMe 2
(R)(-)PhCH(NH 2)COOH· (+)CSA (结晶物)
*
(+)CSA
O H NH 2 C HN H Ph O N H S
5-1
二 . NMR谱
1 . 影响化学位移σ的因素 1) 电负性原子的诱导效应
质子 CH3-(烷基)3 CH3CH2O- CH3CH=CH2 CH3CO2R CH3-环己基 σ 0.9 1.3 1.71 2.3 2.3 质子 –CH2OR σ 3.4
–CH2Cl –CH2Br -CH2NO2 CH2-CH2 H-ph CH3-OR
方法2:两个非对映体混合物可用NMR谱估计比例。 大多数的非对映体的1H、13C是磁不等性的(非对映 的),NMR谱有区别,由信号的积分曲线估计两组成。 决定d、l%; 方法3:对映体与手性试剂作用转化成非对映体,再用 NMR谱。常用的手性试剂是顺磁性金属衍生物的可溶 于有机溶剂中的物种。
这个手性试剂称为手性位移试剂。
OH 处理
CH 3 CH 3 H COOH H
-
H N H
S
CH 3 CH 3
(+)CSA +
COOR NH 2
Ph
N O
COOR H
(R)-
Ampicilin
6-APA
5-9’
4)向(±)六螺苯外消旋体中加一个不对称的络合 剂,其中一个对映体先结晶出来。 5)三-(2-甲基-5-异丙基苯甲酸-2-酚酯)在苯溶液中, 一个对映体能从d.l溶液中先结晶出来,同时溶液中 外消旋体迅速转化,保持平衡,一直可使全部d.l-体 以一种晶体分离出来。 2.色谱法分离(分析规模): 手性填料的GC、HPLC色谱柱,在分析规模上分离 对映体。 1)原理:静止手性填料与流动相中(±) 对映体形成 (化学键)非对映体络合物过渡态,吸附程度不同, 流动速度不同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
补充:绝对构型(R/S)确定法
分大小:按照次序规则排列手性原子上四个不同基团的优先顺序; 找位置:根据最不优先基团离视线最远的原则,确定观察位置;
定方向:离视线近的三个基团由大至小顺时针为“R”,逆时针为 “S”。
A D C C B S A
CHO Br H H Cl Cl Br CH3 H H H
【合成】
O
H O+ 3 MgBr
OH
H PO 3
B H
6 24_ H 来自 /HO 2 2TM5.
烯烃与卤素加成
烯烃与卤素加成是反式加成
Br2
Br Br
6. 卤代烷的E2消除 卤代烷的E2消除是反式消除 查依采夫规则
Br
比较:
R H
H
R'
" R
t-BuOK R C
H C R'
" R
7. Cram规则 如果醛或酮的手性α-碳原子上结合的三个不同的基团有大(L)、中(M)、小 (S)的区别,发生亲核加成反应时,应当具有优势构象:
观察方向
B D C C R
观察方向
CH3 Br C H Cl H
CH3 C
CHO OH OH OH CH2 OH
S-
R-
S-,R-
R-,R-,R-,
8. 卡宾反应的立体化学 ① 卡宾(carbenes)的产生
② 卡宾的结构
单线态较不稳定,常常是在分解初期首先产生的形式,在液相中最初形 成的卡宾;在气相中,尤其在惰性气体(N2或Ar)存在下单线态经碰撞 而失去能量后转变为三线态,三线态能量比单线态低42KJ/mol。
比较:SN1反应是分 步进行的,卤代烷先 电离出烷基正离子, 烷基正离子再与亲核 试剂结合;前一步反 应较慢,决定整个反 应的速率。
反应速度不仅与溴甲烷的浓度有关,也与碱的浓度成正比
【TM】
Cl CH CH 3 CH CH 3 H 2 2
H CO H 2 H CH CH 3 CH CH 3 Cl
【逆推】
M
O
S R' LR or
O
L
R S
M R'
R-L 重叠构象
OH S
全交叉构象
OH S R
M R
M R'
R'
L
L
主产物
次产物
H C
3
OH C C C H 5 2
【TM】
H Ph
H
【逆推】
H3C H Ph C
OH C C2H5 H
H H5C2
OH CH3 H
O CH3
H _ C2H5 H Ph Ph
【合成】 使用(s)-2-苯基丙醛与乙基溴化镁反应,然后酸化即可得到TM
CH OH CH OH 2
CO Et CO Et 2 2 +
CO Et 2
2
EtO C
2
【合成】(略)
H CO E t 2
【TM】
H CO Et 2
O H CO E t 2
H CO Et 2 O H CO Et 2 O H CO Et 2 +
【逆推】
H CO Et 2 O H CO Et 2 O +
O
O H O H O
H +
H O
O
H + EtO C 2
CO Et 2
H
CO Et 2
H
H
CO Et 2
【TM】
O CH
CH O
3
HC
3 + H
H O O
3
【逆推】
O
O
H C 3
H
OEt
【合成】
+ H O
heat
CH HO 3 CO Et 2 + H TM
【TM】
CH OH CH OH 2 2
【逆推】
CO Et 2
CO Et 2
【合成】 略
Comprehensive excises
O O O O O EtO O CO2Et EtO2C Me
O
CO2Me OMe
O
EtO2C CO2Et
参加反应的卡宾是三线态,非立体选择性
2.插入反应(insertion)
卡宾能把自身插入到大多数分子的C-H键中去
在饱和和不饱和的C-H键中发生插入反应,在希望进行加成时, 插入反应将是一个副反应
9. Diels – Alder 反应的立体化学 Diels – Alder 反应是同步发生的(协同反应),以致二烯和亲二烯体均 不可能围绕单键进行旋转;故顺式亲二烯体给出顺式产物,反式亲二烯 体给出反式产物。
3
2
3
2.
CH CH I 2
O
OH
【EX】
H
H C C CH CH 2 3
【合成】
HC
CH
1.NaNH2 CH3CH2I 2.
OH CH3CH2C CH 1.NaNH2 2. O C C CH2CH3
Na/NH3(l)
TM108
2. 构型反转
仲卤代烷的SN2反应一般为构型反转
亲核试剂 总是从溴 的背面进 攻碳原子
③ 卡宾的反应 ⑴ 与C=C双键的加成:
在液态顺-2-丁烯中,卡宾的加成只生成顺-1,2-二甲基环丙烷, 对反-2-丁烯加成只生成反-1,2-二甲基环丙烷,这种立体专一的顺式 加成结果表明它是同时连接到双键的两个碳原子上去的。
在气态,卡宾与2-丁烯(顺式或反式)的加成产物是等量的顺和反1,2-二甲基环丙烷的混合物
HC OH 3 HC 3 OH H H OH HC 3 C HC C 3 H H + RCO H 3 3 H + H OH OH H CH
3
【 e.g. 】 由乙炔合成
CH
3
HC OH
【逆推】
HC
H
【合成】 用过氧酸氧化顺-2-丁烯,然后酸性开环可得上述目标分子。
3
H
CH 3
H OH OH CH 3
H CH CH 3 2 CO H
Cl CH CH
2
2 CN
H
H SO 2 2 H CH CH 3 4
2
【合成】
KCN CH CH DMSO 3
H CN
2
3
2 H
2
H O,heat
CO H 2
3. 烯烃二羟基化 烯烃以四氧化锇或碱性高锰酸钾氧化得到顺式二羟基化合物;烯 烃通过环氧化,然后酸性开环得反式二羟基化合物 。
4. 烯烃硼氢化-氧化水解反应
烯烃的硼氢化-氧化水解反应总结果为顺式水合,而且遵循反马氏规则
OH CH CH CH CH
2
2
2
3
【TM】
OH CH CH CH CH 2 2 2 3
OH
【逆推】
CH CH CH CH 2 3 2 2 CH CH CH CH 2 2 2 3
OH
CH CH CH CH 3 2 2 2 O
第五章 有机合成中立体化学的控制
1. 炔烃的还原 炔烃的催化氢化是顺式加氢,而在液氨中用金属钠还原则为反式加氢
OH
【TM】 【切断】
OH OH CH CH I + HC 2 3 CH + O
【合成】
HC CH 1. NaNH 2. 3 1. NaNH CH CH C CH 2 2 CH CH C 2 CCH CH OH 2 2 H /Pd/BaSO 2 4 TM
