化学必修2同步习题-第一章 原子结构与元素周期率 检测
下学期高一化学鲁科版化学必修二第一章《原子结构与元素周期律》测试题

第一章《原子结构与元素周期律》测试题一、单选题1.23592U是重要的核工业原料,下列有关23592U的说法中正确的是A.23592U原子核中含有92个中子B.23592U原子核外有143个电子C.23592U与23892U互为同位素D.23592U与23892U互为同素异形体2.第116号元素Lv的名称为鉝.关于的叙述错误的是A.原子序数为116 B.中子数为177 C.核外电子数为116 D.原子质量为2933.下列递变情况中,正确的是A.Na、Mg、Al原子的最外层电子数依次减少B.Si、P、S元素的最高正价依次降低C.C、N、O的原子半径依次减小D.Li、Na、K的金属性依次减弱4.科学家最近合成了117294Uus。
下列关于117294Uus的说法正确的是()A.质量数是177B.中子数是117C.核外电子数117D.质子数是1775.下列有关化学用语的说法正确的是( )A.氯原子的结构示意图:B.中子数为6、质子数为6的碳原子:66CC.1H与2H互称同位素D.230Th和232Th的化学性质不相同6.X、Y、Z、W四种短周期主族元素的原子序数依次增大。
X、Y原子的最外层电子数之比为2∶3,Z+与Y2-核外电子排布完全相同,常温下,W的一种单质为淡黄色固体。
下列说法不正确的是A.简单离子半径:W2->Z+>Y2-B.简单气态氢化物的热稳定性:H2Y>H2WC.Y能分别与X、Z、W形成两种或两种以上的化合物D.Z与Y形成的化合物溶于水,溶液均呈碱性7.YBa2Cu8O x(Y为钇元素)是磁悬浮列车中的重要超导材料,关于的说法正确的是A.钇在周期表中的位置是第4周期IIIB族B.属于非金属元素C.和是两种不同的核素D.中子数为39R ,则元素R的原子序数是( )。
8.已知某粒子A nZA.Z B.A-Z C.Z-n D.Z+n9.几种短周期元素的原子半径及主要化合价如下表下列说法不正确的是A.由元素X和Q组成的化合物可能含有共价键B.X、Z、R的最高价氧化物对应水化物可彼此反应C.离子半径:r(M2+)<r(R3-)D.Z和Y形成的化合物为离子化合物10.砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是(、A.砹是有色固体B.非金属性:At、IC.HAt非常不稳定D.I2可以从At的可溶性的盐溶液置换出来11.一般情况下,前者无法决定后者的是A.原子核外电子排布——主族元素在周期表中的位置B.物质内部储存的能量高低——化学反应的热效应C.分子间作用力的大小——分子稳定性的强弱D.金属活泼性——金属的冶炼方法12.已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,Y、Z、R三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;Z与W在元素周期表中相邻,X的单质是空气的主要成分之一,且其氢化物的水溶液能使酚酞变红。
鲁科版高中化学必修2第一章《原子结构与元素周期律》检测题(含答案)

《原子结构与元素周期律》检测题一、单选题1.下列结论正确..的是()①粒子半径:K+>Al3+>S2->Cl-②氢化物的酸性:HCl>HBr>HI③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>SiA.①④⑤B.③⑥C.④⑤⑥D.②④⑤⑥2.下列元素的最高价氧化物对应的水化物中碱性最强的是A.Al B.Li C.Na D.Mg3.短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K 层电子数;若往E单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。
下列说法不正确...的是( )A.5种原子中,C的原子半径最大B.某物质焰色反应呈黄色,该物质不一定是含C的盐C.向D单质与沸水反应后的溶液中滴加酚酞,溶液变红D.E的氧化物的水化物的酸性比B的强4.有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是A.WZ沸点高于W2Y的沸点B.含Z的两种酸反应可制得Z的单质C.W2Y2是由极性键和非极性键构成的非极性分子D.X的含氧酸一定为二元弱酸5.下列关于碘元素(原子序数53)的放射性同位素131I的叙述中正确的是( ) A.一个此碘原子中含有131个质子B.131I位于元素周期表中第4周期ⅦA族C.其氢化物为HI,比HCl的稳定性弱D.最高价氧化物的水化物为HIO4,比HClO4的酸性强6.X原子的核电荷数为a,它的阴离子X m-与Y原子的阳离子Y n+的电子层结构相同,则Y原子的核电荷数为()A.a+m+n B.a-m-n C.m+n-a D.m-n-a7.X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。
鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)

鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)1 / 101 / 101 / 101 / 101 / 101 / 101 / 101 / 101 / 10第一章《原子结构与元素周期律》测试题一、单选题(每小题只有一个正确答案) 1.下列关于元素周期表应用的说法正确的是A .为元素性质的系统研究提供指导,为新元素的发现提供线索B .在金属与非金属的交界处,寻找可做催化剂的合金材料C .在IA 、IIA 族元素中,寻找制造农药的主要元素D .在过渡元素中,可以找到半导体材料 2.下列递变情况中,正确的是A .Na 、Mg 、Al 原子的最外层电子数依次减少B .Si 、P 、S 元素的最高正价依次降低C .C 、N 、O 的原子半径依次减小D .Li 、Na 、K 的金属性依次减弱 3.同种元素的不同微粒,它们的: A .核外电子数一定相等 B .中子数一定相等 C .质子数一定相等D .化学性质不一定相同4.下列有关化学用语使用正确的是A .硫离子的结构示意图:B .原子核内有10个中子的氧离子:O 188C .NH 4Cl 的电子式:D .乙烯的结构简式C 2H 45.已知A 、B 、C 、D 为短周期元素,简单离子A +、B 2+、C ﹣、D 2﹣具有相同的电子结构,下列关系正确的是:A .质子数:A >B >C >D B .离子半径:C ﹣>D 2﹣>A +>B 2+ C .氢化物的稳定性:H 2D >HC D .离子的氧化性:B 2+>A + 6.几种短周期元素的原子半径和主要化合价见表:下列说法正确的是A.在化学反应中,M原子既不容易失去电子,又不容易得到电子B.等物质的量的X、Y的单质与足量盐酸反应,生成的氢气一样多C.Y与Q形成的化合物不可能跟氢氧化钠溶液反应D.Z的氢化物的稳定性强于L的氢化物的稳定性7.原子序数依次增大的四种短周期主族元素A、B、C、D,A元素的一种同位素原子核内无中子;B元素形成的化合物种类最多;C、D元素同主族且最外层电子数为偶数。
鲁科版高中化学必修2第一章《原子结构和元素周期律》检测题(含答案)

《原子结构与元素周期律》检测题一、单选题1.硒(Se)的原子序数为34,与氧、硫同主族,下列说法错误的是A.硒的最高价是+6价,所以只有一种氧化物SeO3B.H2Se的热稳定性比H2S差,且还原性较强C.氧、硫、硒三种元素的电负性递减D.原子序数为33的元素是砷(As),则砷原子的第一电离能大于硒原子的第一电离能2.X、Y、Z和R分别代表4种元素,如果a X m+、bY n+、cZ n-、dR m-四种离子的电子层结构相同,则下列关系正确的是()A.a-c=a-n B.a-b=n-m C.c-d=m+n D.b-d=m+n3.短周期元素X、Y、Z、M的原子序数依次增大, X原子的最外层电子数是内层电子数的2倍,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。
下列说法正确的是()A.原子半径:M>Z>Y>X B.4种元素中Y的金属性最强C.Z的最高价氧化物的水化物是强酸D.元素X可与元素M形成离子化合物XM24.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍,X、Y的核电荷数之比为3∶4,W-的最外层为8电子结构,金属单质Z在空气中燃烧生成的淡黄色化合物。
下列说法不正确的是()A.XY2能与Z的最高价氧化物对应的水化物发生反应B.元素Z与W形成的化合物ZW是厨房常用调味品C.Y、Z、W的简单离子核外电子数相同D.W的单质可用于自来水消毒5.A、B两元素分别为某周期第ⅡA族、第ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为()①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32A.①②③B.③④⑤C.①③⑤D.②④⑥6.下列不能..说明氯的非金属性比硫强的事实是()①HClO酸性比H2SO4弱②HCl比H2S稳定③HCl和H2S 的水溶液,前者的酸性强④Cl2能与H2S 反应生成S⑤Cl原子能得1个电子变成稳定离子而S原子能得2个电子⑥HCl 比H2S更易溶解于水中A.①⑤⑥B.③⑥C.②④D.①③⑤⑥7.某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断()A.R气态氢化物化学式为H2RB.R一定是ⅥA族元素C.R的气态氢化物比同周期其他元素气态氢化物稳定D.R一定是第四周期元素8.下列关于元素周期表的说法中,错误的是( )A.元素原子的最外层电子数等于其所在族的序数B.元素原子的电子层等于其所在周期的序数C.同一主族元素的原子最外层电子数相同,化学性质相似D.元素周期表是元素周期律的具体表现形式9.随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。
第1章 原子结构元素周期律 检测题-高一下学期化学鲁科版(2019)必修第二册

第1章《原子结构 元素周期律》检测题一、单选题(共13题) 1.下列说法正确的是A .红磷转化为白磷,属于物理变化B .石墨导电、金刚石不导电,故二者不是同素异形体C .2O 和3O 分子式不同,化学性质相同D .单质硫有2S 、4S 、6S 等,它们都是硫的同素异形体 2.下列有关物质的用途不正确...的是 A .用铁罐车贮存浓硫酸、浓硝酸、浓盐酸B .高纯度的硅可用于制作计算机的芯片和太阳能电池C .碳酸氢钠可用作焙制糕点的发酵粉,也可用作治疗胃酸过多的药剂D .金属镁常用来制造信号弹和焰火,氧化镁是优质的耐高温材料3.某酸根离子-3RO 的电子数比硝酸根离子-3NO 的电子数多10,则下列说法中正确的是A .R 与N 原子电子层数相同B .R 与N 原子最外层电子数相同C .R 与N 的简单负离子所带的电荷数相同D .-3RO 中R 元素与-3NO 中N 元素的化合价相同4.前20号元素M 、N 、R 、Q 、Z 的原子序数依次递增,M 与Z 、N 与Q 分别同主族,M 、N 形成的常见化合物有M 2N 、M 2N 2,由该5种元素组成的某结晶化合物X 常用作净水剂。
下列叙述错误的是( ) A .化合物X 中含有离子键和共价键B .简单离子半径由大到小的顺序为Z˃R˃Q˃NC .N 、Q 分别与Z 形成化合物的水溶液均呈碱性D .R 、Q 、Z 的最高价氧化物的水化物间能相互反应5.2019年度诺贝尔化学奖颁给了三位科学家,以表彰他们在锂离子电池领域做出的贡献。
锂元素的一种原子中质子数为3,中子数为4,该锂原子的核外电子数为A .3B .4C .6D .76.下列有关物质的性质与用途均正确,且具有对应关系的是 A .硅酸钠易溶于水,可用作木材防火剂 B .小苏打能与碱反应,可用作膨松剂 C .氯气具有漂白性,可用作自来水消毒剂 D .液氨气化时要吸收大量的热,可用作制冷剂 7.下列说法中正确的是①质子数相同的微粒一定是同种元素 ①同位素的化学性质基本相同①某种元素的相对原子质量取整数,就是其质量数 ①电子数相同的微粒不一定是同一种原子 A .①①B .①①C .①①D .①①8.下列说法正确的是A .SO 2能使酸性KMnO 4溶液褪色,故SO 2有漂白性B .NO 2与水反应生成HNO 3,故NO 2是酸性氧化物C .H 2SiO 3的酸性弱于H 2CO 3,故非金属性C 强于SiD .CaCO 3难溶于水,故CO 2能与CaCl 2溶液反应9.五种短周期元素X 、Y 、Z 、M 、W 的原子序数与其常见化合价的关系如图所示,则下列有关的叙述中,不正确的是A .元素X 可能为锂B .原子半径大小:(M)(W)r rC .元素气态氢化物的稳定性:Y>MD .2X W 中各原子均达到8电子稳定结构10.原子序数依次增大的短周期元素X 、Y 、Z 、W 、M 可形成a 、b 两种化合物(如图),a 为磁共振氢谱中常用的参照物,b 为有机合成中的一种还原剂。
鲁科版高中化学必修2第一章《原子结构和元素周期律》检测题(含答案)

《原子结构与元素周期律》检测题一、单选题1.不能说明X的非金属性比Y强的是A.X单质可以把Y从其氢化物中置换出来B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强C.与H2化合时X单质比Y单质容易D.X原子的最外层电子数比Y原子的最外层电子数多2.同主族元素所形成的同一类型的化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中不正确的是()A.在加热时此化合物可以分解B.它是一种离子化合物C.这种化合物不能跟强碱发生化学反应D.该化合物在一定条件下由PH3与HI化合而成3.若把元素周期表原先的主、副族号取消,由左到右按原顺序编为18列。
如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法中不正确的是 ( )A.第14列元素所形成的化合物种类最多B.第10列元素全部是金属元素C.第3列所含元素的种类最多D.只有第2列元素的原子最外层有2个电子4.下列各组中化合物的性质比较,不正确的是A.酸性:HClO4>HBrO4>HIO4B.碱性:NaOH>Mg(OH)2>Al(OH)3C.稳定性:PH3>H2S>HCl D.非金属性:F>O>S5.四种短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数2倍,Y、W同主族且能形成两种常见的化合物,Y、W质子数之和是Z质子数的2倍.则下列说法中正确的()A.X的氢化物的沸点可能高于Y的氢化物的沸点B.原子半径比较:X<Y<Z<WC.X2H4与H2W都能使溴水褪色,且褪色原理相同D.短周期所有元素中,Z的最高价氧化物的水化物碱性最强6.下表是部分短周期元素的原子半径及主要化合价,根据表中的信息,判断下面叙述正确的是A.L2+与R2-的核外电子数相等B.M与T形成的化合物具有两性C.单质与同浓度的稀盐酸反应的速率为Q>LD.R与T的氢化物熔沸点高低为H2R>H2T7.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是A.原子序数:X<Y B.原子半径:X<YC.非金属性:X>Y D.电负性:X<Y8.下列关于Li、Na、K、Rb、Cs的叙述中不正确的是()A.金属性最强的是铯B.密度随核电荷数的增加而增大C.单质的熔、沸点随核电荷数的增加而降低D.最高价氧化物的水化物的碱性随核电荷数的增加而增强9.下列叙述中正确的是A.发生化学反应时,失去电子越多的金属原子,其还原能力越强B.目前已发现118种元素,即已发现118种原子C.核外电子总数相同的粒子,必定是同种元素的原子D.同一元素的各种同位素的化学性质基本相同10.下列说法不正确的是A.12C与14C为不同核素B.石墨和C60互为同素异形体C.H2O和D2O互为同位素D.3517X与3717Y为同种元素11.下图为元素周期表截取的短周期的一部分,即四种元素均为非稀有气体元素。
鲁科版高中化学必修二第一章《原子结构与元素周期律》测试题(含答案解析)

第一章《原子结构与元素周期律》测试题一、单选题(每小题只有一个正确答案)1.元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。
则下列判断正确的是( )A.非金属性:Z<T<X B. R与Q的电子数相差26C.气态氢化物稳定性:R<T<Q D.最高价氧化物的水化物的酸性:T<Q2.下列微粒中,各电子层电子数都达到2n2(n为电子层序数)的是( )A. Ne、Ar B. Al3+、S2- C. F-、Na+ D. Ne、Cl-3.下列元素中原子半径最大的是( )A.钠 B.氯 C.铝 D.氟4.下列关于原子序数的说法正确的是( )A.原子序数是按照元素在周期表中的顺序给元素所编的号码B.元素的原子序数一定等于其原子相对质量C.元素的原子序数一定等于其最外层电子数D.元素的原子序数一定等于其核内中子数5.下列原子结构示意图所表示的元素与表示的元素属于同一主族的是( )A. B. C. D.6.短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是( )A. a是一种活泼的非金属元素 B. c的最高价氧化物的水化物是一种弱酸C. b的氢化物很稳定 D. b元素的最高化合物为+7价7.下列说法正确的是( )A. I的原子半径大于Br,HI比HBr的热稳定性强B. P的非金属性强于Si,H3PO4比H2SiO3的酸性强C.ⅠA族元素的金属性一定比ⅡA族元素的金属性强D.ⅥA族元素的氢化物中,稳定性最强的氢化物的沸点最低8.元素R的最高价含氧酸的化学式为H n RO2n-2,则在气态氢化物中R元素的化合价为( )A. 12-3n B. 3n-12 C. 3n-10 D. 6-3n9.与氢氧根离子具有相同的质子数和电子数的微粒是( )A. CH4 B. NH C. NH D. Cl-10.已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )A.气态氢化物的稳定性:HX>H2Y>ZH3 B.非金属活泼性:Y<X<ZC.原子半径:X>Y>Z D.原子最外层电子数:X<Y<Z11.已知铍的原子序数为4,下列对铍及其化合物的叙述中,正确的是( )A.铍的金属性比钠强 B.氯化铍的氧化性比氯化锂弱C.氢氧化铍的碱性比氢氧化钙弱 D.单质铍易跟冷水反应生成H212.俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。
高一化学必修二同步检测:第一章 物质结构元素周期律 含答案
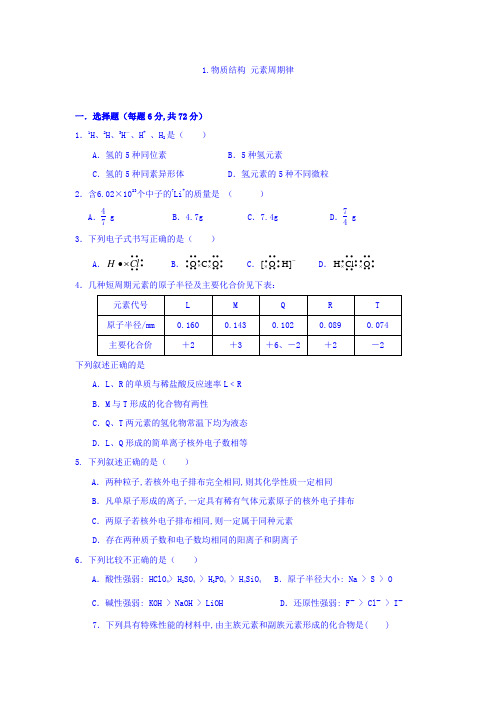
1.物质结构 元素周期律一.选择题(每题6分,共72分) 1.1H 、2H 、3H -、H +、H 2是( )A .氢的5种同位素B .5种氢元素C .氢的5种同素异形体D .氢元素的5种不同微粒 2.含6.02×1023个中子的7Li +的质量是 ( ) A .47g B .4.7gC .7.4gD .74g 3.下列电子式书写正确的是( )A .••••••⨯•Cl H B .•••••••⨯•⨯••••••O C O C .-•••••••⨯]H O [ D .•••••••⨯•••••••⨯O Cl H4.几种短周期元素的原子半径及主要化合价见下表:元素代号 L M Q R T 原子半径/mm 0.160 0.143 0.102 0.089 0.074 主要化合价+2+3+6、-2+2-2下列叙述正确的是A .L 、R 的单质与稀盐酸反应速率L ﹤RB .M 与T 形成的化合物有两性C .Q 、T 两元素的氢化物常温下均为液态D .L 、Q 形成的简单离子核外电子数相等 5. 下列叙述正确的是( )A .两种粒子,若核外电子排布完全相同,则其化学性质一定相同B .凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布C .两原子若核外电子排布相同,则一定属于同种元素D .存在两种质子数和电子数均相同的阳离子和阴离子 6.下列比较不正确的是( )A .酸性强弱: HClO 4> H 2SO 4 > H 3PO 4 > H 4SiO 4B .原子半径大小: Na > S > OC .碱性强弱: KOH > NaOH > LiOHD .还原性强弱: F - > Cl - > I - 7.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )A .半导体材料砷化镓B .吸氢材料镧镍合金C .透明陶瓷材料硒化锌D .超导材料K 3C 608.有X 、Y 两种元素,原子序数≤20,X 的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m,n 均为正整数)。
鲁科版高中化学必修2第一章《原子结构与元素周期律》单元检测题(含答案)

《原子结构与元素周期律》单元检测题一、单选题1.同主族元素形成的同一类型化合物,往往其结构和性质相似。
PH 4I 是一种白色晶体,下列对于PH 4I 的叙述中正确的是( )A .它是一种共价化合物B .25℃ 时,它的水溶液pH=7C .它不可能与 NaOH 溶液反应D .它受热分解时可能会产生有色气体2.已知a A +、b B 2+、c C ﹣、d D 2﹣四种离子均具有相同的电子层结构,关于A 、B 、C 、D 四种元素的叙述正确的是A .原子半径:A >B >C >D B .原子序数:b >a >c >dC .离子半径:D >C >B >A D .a+1=d-23.W 、X 、Y 、Z 均为短周期主族元素,原子序数依次增加,X 、Y 同周期,W 、Z 同主族,且X 、Y 最外层电子数之和是W 、Z 最外层电子数之和的6倍。
下列说法正确的是( )A .简单离子半径:Y <ZB .氢化物的稳定性:X >YC .原子失电子能力:W <ZD .X 与Y 形成的简单化合物为离子化合物4.甲~辛等元素在周期表中的相对位置如表。
甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是A .丙与庚的原子序数相差3B .气态氢化物的热稳定性:戊>己>庚C .乙所在周期元素中,其简单离子的半径最大D .常温下甲的单质在水中反应要比乙剧烈很多5.X 、Y 、Z 为短周期非金属元素,其相关性质如下,下列叙述正确的是A .Z 的氢化物分子间存在氢键B .最外层电子数Z>YC .气态氢化物的稳定性Y>XD .Y 的含氧酸均为强酸6.下列情况中不能说明X的非金属性比Y强的是A.同主族时X原子的电子层数比Y原子的电子层数少B.X2+H22HX ,Y2+H22HYC.气态氢化物水溶液的酸性X比Y强D.X的单质能将Y从NaY溶液中置换出来7.下列有关叙述:①非金属单质M能从N的盐溶液中置换出非金属单质N;②M原子比N原子容易得到电子;③单质M形成的气态氢化物比N形成的气态氢化物稳定;④气态氢化物水溶液的酸性Hm M>HnN;⑤氧化物对应水化物的酸性HmMOx>HnNOy;⑥熔点M>N。
鲁科版高中化学必修2第一章《原子结构与元素周期律》检测题(含答案)

《原子结构与元素周期律》检测题一、单选题1.短周期元素离子a A2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述正确的是( )A.原子半径A>B>D>C B.原子序数d>c>b>a C.离子半径C>D>B>A D.单质还原性A>B>D>C 2.下列能说明氯的非金属性强于溴的事实是A.HClO 酸性强于 HBrOB.常温下,Br2为液体,而Cl2为气体C.向溴化亚铁溶液中滴入少量氯水,溶液颜色变黄D.BrCl+H2O=HBrO+HCl 是非氧化还原反应3.下列事实不能用元素周期律解释的是( )A.热稳定性:NaHCO3<Na2CO3B.与水反应的剧烈程度:K>MgC.还原性:I->Br-D.酸性:H3PO4<HC1O44.下列各组化合物的性质比较中,不正确...的是()A.酸性:H2SO4>H3PO4B.碱性:NaOH>Mg(OH)2C.稳定性:H2O>HF D.半径:F->Na+5.短周期主族元素X、Y、Z、W、R的原子序数依次增大,X原子核外最外层电子数是次外层的3倍,X、W同主族,Y原子半径在同周期中最大,Z的M层电子数比K层多1。
下列说法中正确的是()A.最简单气态氢化物的沸点:X<WB.Y、Z、W最高价氧化物对应的水化物相互之间可发生反应C.W氧化物对应的水化物是一种强酸D.最简单气态氢化物的热稳定性:W>R6.下列有关同位素的说法正确的是A.18O的中子数为8 B.16O和18O质子数相差2C.16O与18O核电荷数相等D.1个16O与1个18O质量相等7.下列有关化学用语表示正确的是A.中子数为10的氧原子:108OB.的结构示意图:C.硫化钠的电子式:D.HCl的形成过程:8.下列分子中所有原子都满足最外层8电子结构的是A.NCl3 B.BF3C.SF6D.HCl9.下列物质对应的电子式书写正确的是( )A.NH4Br:[NH4+][∶Br∶]- B.CaCl2:∶Cl∶-[Ca2+]∶Cl∶-C.N2:N⋮⋮N D.Na2O2:Na+[∶∶∶]2-Na+10.下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )①单质的氧化性减弱②单质的颜色加深③气态氢化物的稳定性增强A.①②B.①②③C.②③D.①③11.属于道尔顿近代原子论的观点有A.原子还可由其他更小的微粒构成B.原子中正电荷是均匀分布在整个原子中C.原子在化学变化中保持其不可再分性D.电子在原子核外空间做高速运动12.下列关于碱金属元素的叙述中正确的是( )A.单质的化学性质活泼,易失电子发生还原反应B.碱金属单质具有强还原性,形成的离子具有强氧化性C.除锂外都以化合态存在于自然界中D.化合物中碱金属元素的化合价都为+1价二、实验题13.实验探究是体验知识的产生和形成过程的基本途径。
鲁科版高中化学必修2第一章《原子结构与元素周期律》单元检测题(解析版)

《原子结构与元素周期律》单元检测题一、单选题1.下列对碱金属性质的叙述不正确的是( )A.单质都是银白色的柔软金属,密度都较小B.单质在空气中燃烧生成的都是过氧化物C.碱金属单质与水剧烈反应生成碱和氢气D.单质的熔沸点随着原子序数的增加而降低2.元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。
若发现119号元素,请在“元素大厦”中安排好它的“房间”()A.第七周期第0族 B.第六周期ⅡA族C.第八周期ⅠA族 D.第七周期ⅦA族3.元素周期表中第ⅢA族至0族区域内的五种元素原子序数关系如下图所示:下列关于五种元素所属周期的判断正确的是( )A.图①中五种元素位于第一、二、三周期B.图②中五种元素位于第二、三、四周期C.图③中五种元素位于第三、四、五周期D.图③中五种元素位于第四、五、六周期4.等物质的量的钠和过氧化钠分别与足量的水作用,生成的气体的体积比是( ) A.3∶1 B.1∶1 C.2∶1 D.1∶25.下列说法中正确的是( )A.质子数相同的粒子一定属于同种元素B.原子序数相同的微粒电子数一定相同C.原子序数相同的两种粒子,性质一定相同D.电子数相同的粒子不一定是同一种元素6.关于铯及其化合物的以下各种说法中不正确的是( )A.氢氧化铯是一种强碱,比氢氧化钾的碱性强B.铯与水或酸溶液反应剧烈,都生成氢气C.铯的还原性比钠强,钠离子的氧化性比铯离子强D.铝的金属性大于铯的金属性7.如图中横坐标均表示11~17号元素按由小到大顺序排列的原子序数。
根据图像变化趋势判断,纵坐标表示其最高化合价的是( )A. B. C. D.8.元素周期表可分为周期和族,其中0族元素又称作( )A.稀有气体 B.卤族元素 C.碱金属元素 D.过渡元素Ⅶ9.下列元素中金属性最强的是( )A.钾 B.钠 C.铝 D.镁10.根据原子结构示意图不能确定的是( )A.元素的化学性质 B.相对原子质量C.原子序数 D.元素种类11.下列微粒的结构示意图,正确的是( )A. Mg2+: B. Cl: C. Ar: D. K:12.四种短周期元素在周期表中的位置如右图,其中只有M为金属元素。
鲁科版高中化学必修2第一章《原子结构与元素周期律》单元检测题(含答案)

《原子结构与元素周期律》单元检测题一、单选题1.下列结论正确..的是()①粒子半径:K+>Al3+>S2->Cl-②氢化物的酸性:HCl>HBr>HI③离子的还原性:S2->Cl->Br->I-④氧化性:Cl2>S>Se>Te⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>SiA.①④⑤B.③⑥C.④⑤⑥D.②④⑤⑥2.有五种元素X、Y、Z、Q、T。
X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。
下列叙述不正确的是A.元素Y和Q可形成化合物Y2Q 3B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强C.X和Q结合生成的化合物为离子化合物D.ZQ2是极性键构成的直线形分子3.已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸④若四种元素只有一种为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中不正确的说法有几项A.1项B.2项C.3项D.4项4.我国是世界上唯一能够制造实用化的深紫外全固态激光器的国家,其核心材料为KBe2BO3F2(K位于ⅠA族)。
下列有关说法错误..的是A.金属性:K>Be B.非金属性:B<O<FC.原子半径:K>Be>B>O>F D.五种组成元素均位于短周期5.X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。
下列说法错误的是A.简单离子半径:Y< W B.最高价氧化物对应水化物的酸性:Z < WC.R为氧元素 D.X与Z可以形成正四面体结构的分子6.已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是()A.(A-n+8)mol B.(A-n+10)mol C.(A-n+2)mol D.(A-n+6)mol 7.X、Y、Z、W四种短周期元素,它们在元素周期表中的相对位置如图所示,已知W的最高正价与最低负价代数和为6。
(完整word)高一化学必修2第一章原子结构与元素周期律单元测试题

第一章原子结构与元素周期律可能用到的原子量:H 1 O 16 Mg 24 Si 28 Cl 35.5一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)1、某粒子含有6个质子,7个中子,电荷为0,则它的化学符号是CA.13Al B.13Al C.13 C D.13 C2、对于AZ X和A+1ZX+两种粒子,下列叙述正确的是A.质子数一定相同,质量数和中子数一定不同A B.化学性质及乎相同C.一定都由质子、中子、电子构成D.核电荷数,核外电子数一定相同3、含6.02×1023个中子的Li+的质量是A、47gB、4.7gC、 7.4gD、74g4、根据下列微粒结构示意图的共同特征,可以把三种微粒归为一类。
下列微粒中可以归为一类的是5A.原子半径:Cl>S>O B.还原性:Na>Mg>AlC.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO46、下列各组元素性质递变情况错误的是BA.Li、Be、B原子最外层电子数逐渐增多 B.N、O、F原子半径依次增大C.P、S、Cl最高正价依次升高 D.Li、Za、K、Rb的金属性依次增强7、H218O和D2O分子中的中子数,前者和后者的关系是A.大于 B.小于 C.等于 D.无法确定8、1999年曾报道合成和分离了含高能量的N5+的化合物N5AsF6,下列叙述错误的是CA.N5+具有34个电子 B.N5+中氮-氮之间是以共价键结合C.化合物N5AsF6中As的化合价为+1 D.化合物N5AsF6中F的化合价为-19、已知质量为数为A的某阳离子R n+,核外有X个电子,则核内中子数为BA.A-x B.A-x-n C.A-x+n D.A+x-n10、与氢氧根具有相同的质子数和电子数的微粒是CA.CH4 B.NH4+ C.NH2- D.Cl-二、选择题(本题包括10小题,每小题3分,共30分,每小题有1-2个正确答案)11、57号镧元素(La)是一种活泼性比铁还强的金属元素,La的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,La的氯化物、硝酸盐均易溶于水,下列各组物质中不能直接反应得到LaCl3的是A .La 2O 3+HClB .La+Cl 2C .A(OH)3+HClD .La(NO 3)3+HCl12、水的状态除了气、液、固外,还有玻璃态。
人教版高一化学必修二同步练习:第一章物质结构、元素周期律单元检测及答案

人教版高一化学必修2同步练习第一章物质结构元素周期律单元检测(考试时间:90分钟全卷总分:100分)相对原子质量:H-1 C-12 Cl-35.5一、单选题(本大题共18小题,每题3分,共51分)1.下列各组物质中,都含有共价键,却又都不属于共价化合物的一组()A. Na2O2Na2OB. KClO NaOHC. Br2 HBrD. HF H2O2.南京大屠杀死难者国家公祭鼎用青铜铸造,关于铜的一种核素 2964Cu下列说法正确的是()A. 2964Cu的核电荷数为29B. 2964Cu的质子数为35C. 2964Cu的中子数为64D. 2964的核外电子数为643.关于下列粒子的描述不正确的是()A. PH3的电子式为,其热稳定性不如NH3B. HS−的电子式为,是含有极性键的18电子的粒子C. CH2Cl2的电子式为,是分子结构呈四面体的分子D. KF的电子式为K+,它是易溶于水的离子化合物4.下列有关物质性质的比较顺序中,不正确的是()A. 热稳定性:HF<HCl<HBr<HIB. 微粒半径:K+>Na+>Mg2+>Al3+C. 酸性:HClO4>H2SO4>H3PO4>H2SiO3D. 最外层电子数Li<Mg<Si<Ar5.第ⅡA族元素具有相似的化学性质,是由于它们的原子具有相同的()A. 原子半径B. 电子层数C. 核外电子数D. 最外层电子数6.下列说法错误的是()A. 11H、 12H、H+和H2是氢元素的四种不同粒子B. 2040Ca和 2042Ca、石墨和金刚石均为同位素C. 11H和 12H是不同的核素D. 12C和 14C互为同位素,物理性质不同,但化学性质几乎完全相同7.X、Y、Z、W、R属于短周期主族元素.X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m−n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述错误的是()A. X与Y形成的两种化合物中阴、阳离子的个数比均为1:2B. Y的氢化物比R的氢化物稳定,熔沸点高C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>ZD. RY2、WY2通入Ba(NO3)2溶液中均无白色沉淀生成8.下列说法正确的是()①离子化合物含离子键,也可能含极性键或非极性键②H2SO3的酸性>H2CO3的酸性,所以非金属性S>C③含金属元素的化合物不一定是离子化合物④由非金属元素组成的化合物一定是共价化合物⑤熔融状态能导电的化合物是离子化合物⑥由分子组成的物质中一定存在共价键A. ①③⑤⑥B. ②④⑥C. ①②③⑤D. ①③⑤9.N A代表阿伏加德罗常数的值,下列说法正确的是()A. 12 g金刚石中含有化学键的数目为4N AB. 18 g的D2O中含有的质子数为10N AC. 28 g的乙烯(C2H4)和环己烷(C6H12)混合气体中所含原子总数为6N AD. 1 L 1mol⋅L−1的NH4Cl溶液中NH4+和Cl−的数目均为1N A10.下列有关物质性质与用途具有对应关系正确的是()A. Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂B. ClO2具有还原性,可用于自来水的杀菌消毒C. SiO2硬度大,可用于制造光导纤维D. NH3易溶于水,可用作制冷剂11.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。
高一化学必修二第一章原子结构与元素周期律测试题及答案 (2)

一、选择题(本题包括15个小题,每小题3分,每小题只有一个正确选项,共45分)1.我国稀土资源丰富。
下列有关稀土元素144 62Sm与150 62Sm的说法正确的是( )A.144 62Sm与150 62Sm互为同位素B.144 62Sm与150 62Sm的质量数相同C.144 62Sm与150 62Sm是同一种核素D.144 62Sm与150 62Sm的核外电子数和中子数均为62解析144 62Sm与150 62Sm互为同位素,其质量数不相同,是两种不同的核素,其核外电子数相同,而中子数不同。
答案 A2.根据原子结构及元素周期律的知识,下列推断正确的是( )A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.核外电子排布相同的微粒化学性质也相同C.Cl-、S2-、Ca2+、K+半径逐渐减小D.3517Cl与3717Cl得电子能力相同解析同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱,A项错误;核外电子排布相同的微粒化学性质不一定相同,如Ar、Cl-、K+化学性质不同,而互为同位素的原子化学性质相同,如3517Cl和3717Cl,B项错误,D项正确;Cl-、S2-、Ca2+、K+核外电子排布相同,质子数越大,半径越小,故半径大小关系应为:Ca2+<K+<Cl-<S2-<,C项错误。
答案 D3.据报道我国最近合成新的同位素,其中一种是185 72Hf(铪),它的中子数是( )A.72 B.113C.185 D.257解析中子数(N)=质量数(A)-质子数(Z)=185-72=113答案 B4.某氖原子的质量为a g,一个12C原子质量为b g,NA表示阿伏加德罗常数,则下列说法中正确的是( )A.氖元素的相对原子质量一定是12a/bB.W g该氖原子的物质的量一定是W/(aNA)molC.该氖原子的摩尔质量是aNA gD.W g该氖原子所含的质子数是10 W/(aNA)解析元素的相对原子质量是按各种天然同位素原子所占的一定比例算出来的平均值,A项不正确;摩尔质量的单位是g•mol-1,C项不正确;W g该氖原子中所含质子数为10 W/a,D项不正确。
鲁科版高中化学必修2第一章《原子结构与元素周期律》单元检测题(含答案)

《原子结构与元素周期律》单元检测题一、单选题1.X、Y、Z、W、R五种短周期主族元素原子序数依次增大。
X原子是所有原子中半径最小的,Y、W同主族,Z、W、R同周期,Y原子的最外层电子数是次外层电子数的3倍,Z是常见的金属,电子层数等于主族序数。
下列说法正确的是A.WR2中各原子最外层达到了8电子稳定结构B.X、Y、Z、W、R的原子半径依次增大C.简单氢化物稳定性:W>RD.熔沸点:X2W>X2Y2.下列说法正确的是()A.NaCl与浓H2SO4加热可制HCl,推测NaI与浓H2SO4加热可制HIB.SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4C.FeCl3能腐蚀Cu刻制印刷电路板,是因为铁比铜金属性强D.P的非金属性强于Si,H3PO4比H2SiO3的酸性强3.下列说法不正确的是( )① N2H4分子中既含极性键又含非极性键② 若 R2-和 M+ 的电子层结构相同,则原子序数:R>M③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高④ NCl3、PCl3、CO2、CS2分子中各原子均达到 8e- 稳定结构⑤干冰升华会破坏共价键⑥HF 分子很稳定是由于 HF 分子之间能形成氢键⑦Na2O2固体中的阴离子和阳离子个数比是1∶2⑧由于非金属性 Cl > Br > I,所以酸性 HCl > HBr > HI A.②⑤⑥⑧ B.①③④⑤ C.②④⑤⑦ D.③⑤⑦⑧4.N A为阿伏加德罗常数,下列叙述错误的是( )A.46gNO2和N2O4混合气体中含有原子总数为3N AB.常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1N AC.12g金刚石中含有的共价键数为2NAD.2.1gDTO中所含中子数为NA5.短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大,A、E同主族,B、C、D同周期相邻。
鲁科版化学必修二第一章《原子结构与元素周期律》测试试题(含答案)

第一章《原子结构与元素周期律》测试题一、单选题(每小题只有一个正确答案)1.下列四种元素中,与其他三种不在同一周期的元素的是A.Cl B.Mg C.H D.Si2.三种核素:2H、15N、18O常被用作陆地生态分析研究,下列说法正确的是( )A.1H218O的摩尔质量为20 B.2H+的核外电子数为0C.18O的中子数为8 D.15N和18O互为同位素3.吸入人体内的O2有2%转化为活性氧(如),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。
下列说法中不正确的是()A.Se为ⅣA族元素B.消除活性氧时,Na2SeO3是还原剂C.一定条件下,O2能置换出单质Se D.H2Se的稳定性比HBr弱4.下列化学用语表示正确的是()A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑B.三氟化氮的电子式:C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4-D.质量数为137的钡原子5.硫原子与氯原子半径的比较中合理的是A.小于 B.等于 C.大于 D.无法比较6.下列关于化学观或化学研究方法的叙述中,错误的是()A.在化工生产中应遵循“绿色化学”的思想B.在过渡元素中寻找优良的催化剂C.在元素周期表的金属和非金属分界线附近寻找半导体材料D.根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4 7.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能为()①x+2 ②x+4 ③x+8 ④x+18 ⑤x+32A.①⑤B.②C.③D.④8.利用下列装置或操作进行实验,能达到目的的是()置于光亮处A.A B.B C.C D.D9.对于ⅣA族元素,下列叙述中不正确的是( )A.CO2在常温下是气体,SiO2在常温下是固体B.C、Si、Ge的最外层电子数都是4,次外层电子数都是8C.CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应D.该族元素的主要化合价是+4和+210.短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。
高中化学必修2人教版本第一章《物质结构 元素周期律》检测题

第一章《物质结构元素周期律》检测题一、单选题(共15小题)1.有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列说法不正确的是() A. M与R的质子数之和一定等于19B. M、R可能分别处于第二周期和第三周期C. M、R可能分别处于第三周期和第二周期D. M和R的质子数之差可能等于72.下列性质的递变规律不正确的是()A. HCl、HBr、HI稳定性依次减弱B. Na、Mg、Al的原子半径依次增大C. NaOH、KOH、CsOH碱性依次增强D. Li、Na、K、Rb、Cs单质的失电子能力依次增强3.某共价化合物分子的球棍模型如图所示。
已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。
下列有关说法中错误的是()A. X可能为第ⅤA族元素B. Y一定为第ⅤA族元素C.该分子中,既含极性键,又含非极性键D.从圆球的大小分析,该分子可能为N2F44.下列叙述正确的是()A.氧气分子间存在着非极性共价键B.二氧化碳分子内存在着极性共价键C.三氧化硫与水反应的产物是离子化合物D.盐酸中含有H+和Cl-,氯化氢为离子化合物5.230Th和232Th是钍的两种核素,232Th可以转化成233U。
下列有关Th的说法正确的是() A. Th元素的质量数是232B.230Th和232Th的化学性质相同C.232Th转化成233U是化学变化D.230Th和232Th互为同素异形体6.短周期中三种元素a、b、c在周期表中的位置如图,下列有关这三种元素的叙述正确的是()A. a是一种活泼的非金属元素B. c的最高价氧化物的水化物是一种弱酸C. b的氢化物很稳定D. b元素的最高化合物为+7价7.某元素的原子最外层只有一个电子,它与卤素原子结合时,所形成的化学键()A.一定是离子键B.一定是共价键C.可能是离子键也可能是共价键D.以上说法都不正确8.某元素原子的最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为()A. 3B. 7C. 8D. 109.X、Y、Z、W是原子序数依次增大的四种短周期元素,其中只有一种是金属元素,X、W同主族且能形成一种离子化合物WX;Y的气态氢化物、最高价氧化物的水化物可反应生成一种盐;Z原子的最外层电子数与其电子总数之比为3Ⅴ4。
鲁科版高中化学必修2第一章《原子结构和元素周期律》检测题(含答案)

《原子结构与元素周期律》检测题一、单选题1.短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。
K是无色气体,是主要的大气污染物之一,丙的浓溶液是具有强氧化性的酸溶液,上述物质的转化关系如图所示。
下列说法正确的是( )A.原子半径:W<X<YB.元素的非全属性:Z>Y>XC.由W、X、Y、Z构成化合物中只含共价键D.K、L、M中沸点最高的是M2.下列有关物质性质的比较,结论正确的是A.碱性:LiOH<RbOH B.溶解度:Na2CO3<NaHCO3C.还原性:HF>H2O>NH3D.沸点:C2H5OH<C2H5SH3.下列说法正确的是( )A.图Ⅰ所示装置用于 Cu 和浓 H2SO4制取少量的 SO2气体B.图Ⅱ装置可验证非金属性:Cl>C>SiC.图Ⅲ可用于收集气体 H2、CO2、Cl2、NH3D.图Ⅳ表示将 SO2气体通入 H2S 水溶液中,所得溶液的 pH 变化4.下列有关碱金属铷(Rb)的叙述中,正确的是( )A.灼烧氯化铷时,火焰有特殊颜色B.硝酸铷是共价化合物,易溶于水C.在钠、钾、铷三种单质中,钠的金属性最强 D.氢氧化铷是弱碱5.下列物质组别,属于同素异形体的是( )A.白磷和红磷 B.Na2O2和Na2O C.氯气和液氯 D.H2O2和H2O6.五种短周期元素X、Y、Z、M、N,其原子半径与原子序数的关系如图,下列说法错误..的是A.非金属性:X>MB.气态氢化物的稳定性:M<NC.X和Y形成的化合物只可能含离子键D.M最高价氧化物对应的水化物是一种弱酸7.元素X、Y、Z 位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是A.原子序数:X>Y>Z B.原子半径:X>Y>ZC.稳定性:HX>H2Y>ZH3D.酸性由强到弱:HXO4>H2YO4>H3ZO48.目前,元素周期表的第七周期已被填满。
高中化学必修2同步习题:第一章 原子结构与元素周期率

第一章原子结构与元素周期率检测题(时间:90分钟分值:100分)一、选择题(本题包括15个小题,每小题3分,共45分。
每小题仅有一个选项符合题意)1.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )A.钡与水反应不如钠与水反应剧烈B.钡可以从KCl溶液中置换出钾C.氧化性:K+>Ba2+>Na+D.碱性:KOH>Ba(OH)2>NaOH2.下列各组元素性质递变情况错误的是( )A.PH3、H2S、H2O的稳定性依次增强B.P、S、Cl元素最高正化合价依次升高C.Li、Na、K、Rb的金属性依次增强D.HClO4、H2SO4、H3PO4、H2CO3的酸性依次增强3.短周期主族元素的原子,前者一定大于后者的是( )A.中子数、质子数B.质量数、核电荷数C.最高正化合价数、负化合价数D.核外电子数、其阳离子核外电子数4.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n 为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是( ) A.N层B.M层C.L层D.K层5.元素的原子结构决定其性质和在周期表中的位置。
下列说法正确的是( )A.元素原子的最外层电子数等于元素的最高化合价B.多电子原子中,在离核较近的区域内运动的电子能量较高C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素6. W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。
下列说法正确的是( ) A.单质的沸点:W>XB.阴离子的还原性:W>ZC.氧化物的水化物的酸性:Y<ZD.X与Y不能存在于同一离子化合物中7.下列事实不能作为实验判断依据的是( )A.钠和镁分别与冷水反应,判断金属活动性强弱B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱C.酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱8.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z中最简单氢化物稳定性最弱的是YB.Z元素氧化物对应水化物的酸性一定强于YC.X元素形成的单核阴离子还原性大于YD.Z元素单质在化学反应中只表现氧化性9.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章原子结构与元素周期率检测题(时间:90分钟分值:100分)一、选择题(本题包括15个小题,每小题3分,共45分。
每小题仅有一个选项符合题意)1.已知钡的活动性介于钠和钾之间,下列叙述正确的是( )A.钡与水反应不如钠与水反应剧烈B.钡可以从KCl溶液中置换出钾C.氧化性:K+>Ba2+>Na+D.碱性:KOH>Ba(OH)2>NaOH2.下列各组元素性质递变情况错误的是( )A.PH3、H2S、H2O的稳定性依次增强B.P、S、Cl元素最高正化合价依次升高C.Li、Na、K、Rb的金属性依次增强D.HClO4、H2SO4、H3PO4、H2CO3的酸性依次增强3.短周期主族元素的原子,前者一定大于后者的是( )A.中子数、质子数B.质量数、核电荷数C.最高正化合价数、负化合价数D.核外电子数、其阳离子核外电子数4.在原子的第n电子层中,当n为最外层时,最多容纳电子数与(n-1)层相同;当n为次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10,则n层是( )A.N层B.M层C.L层D.K层5.元素的原子结构决定其性质和在周期表中的位置。
下列说法正确的是( ) A.元素原子的最外层电子数等于元素的最高化合价B.多电子原子中,在离核较近的区域内运动的电子能量较高C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素6. W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。
下列说法正确的是( )A.单质的沸点:W>XB.阴离子的还原性:W>ZC.氧化物的水化物的酸性:Y<ZD.X与Y不能存在于同一离子化合物中7.下列事实不能作为实验判断依据的是( ) A.钠和镁分别与冷水反应,判断金属活动性强弱B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱C.酸性H2CO3<H2SO4,判断硫与碳的非金属性强弱D.F2与Cl2分别与H2反应,判断氟与氯的非金属性强弱8.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )A.X、Y、Z中最简单氢化物稳定性最弱的是YB.Z元素氧化物对应水化物的酸性一定强于YC.X元素形成的单核阴离子还原性大于YD.Z元素单质在化学反应中只表现氧化性9.中国科学技术名词审定委员会已确定第116号元素Lv的名称为。
关于293116Lv 的叙述错误的是( )A.原子序数116 B.中子数177C.核外电子数116 D.相对原子质量29310.下列有关物质性质的比较正确的是( )①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高②元素的非金属性越强,气态氢化物的热稳定性越弱③单质与水反应的剧烈程度:F2>Cl2>Br2>I2④元素的非金属性越强,它的气态氢化物水溶液的酸性越强⑤还原性:S2->Se2-⑥酸性:HNO3>H3PO4A.①③B.②④C.③⑥D.⑤⑥11.X、Y、Z均为元素周期表中前20号元素,X a+、Y b-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )A.已知m X a+与n Y b-,得m+a=n-bB.离子半径:Y b->Z(b+1)->X a+C.Z(b+1)-的还原性一定大于Y b-Z一定大于H b YD.气态氢化物的稳定性H b+112.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb等的磷酸盐)中,查明有尚未命名的116、124、126号元素。
试判断116号元素应位于周期表的( )A.第6周期第ⅣA族B.第7周期第ⅥA族C.第7周期第Ⅶ族D.第8周期第Ⅵ族13.(2015·山东卷)短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。
已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )A.原子半径:X<Y<ZB.气态氢化物的稳定性:X>ZC.Z、W均可与Mg形成离子化合物D.最高价氧化物对应水化物的酸性:Y>W14.下表是元素周期表的一部分,有关说法不正确的是( )A.元素b的单质不能与酸性氧化物发生化学反应B.a、b、d、f四种元素的离子半径:f>d>a>bC.元素c的氧化物既能与酸反应又能与碱反应D.a、c、e的最高价氧化物对应的水化物之间能够相互反应15.根据表中提供的部分短周期元素原子半径及主要化合价的信息,判断以下叙述中正确的是( )A.22B .单质与稀盐酸反应的速率为L<Q C .M 与T 形成的化合物具有两性 D .L 2+与R 2-的核外电子数相等二、非选择题(本题包括5个小题,共55分)16.(10分)如图是部分元素在元素周期表中位置,根据下列要求回答问题:(1)下列关于4820Ca 、249 97Bk(锫)、293117Uus 和294117Uus 的说法中不正确的是________(填字母,下同)。
A .117号元素的相对原子质量为293.5B.293117Uus 和294117Uus 互为同位素C.4820Ca 、249 97Bk 表示两种原子、两种元素D .上述元素都位于长周期中(2)根据元素周期表结构推知,117号元素在周期表中的位置是________。
A .第7周期第ⅣA 族 B .第7周期第ⅦA 族 C .第6周期第ⅣA 族D .第6周期第ⅦA 族(3)117号元素Uus 属于________(填“金属元素”或“非金属元素”),它的气态氢化物稳定性比砹的气态氢化物稳定性________(填“强”或“弱”);它的最高价氧化物的化学式为________________。
(4)下列关于上述元素及其化合物的判断正确的是________(填字母)。
A.13153I 、13455Cs 和13755Cs 放射性元素变成其他元素,发生了化学变化 B .he 3分子和ha 3分子结构相同C .j 元素与d 元素组成化合物的颜色相同D .加碘食盐中“碘”不是碘131 53I17.(10分)A 、B 、C 、D 四种元素,它们原子的核电荷数均小于18,且依次递增,A 原子核内仅有一个质子;B 原子的电子总数与D 原子的最外层电子数相等;A 原子与B 原子的最外层电子数之和与C 原子的最外层电子数相等;D 原子有两个电子层,最外层电子数是次外层电子数的3倍。
(1)试推断它们各是什么元素,写出它们的元素符号:A________,B________,C________,D________。
(2)画出D的离子结构示意图________。
(3)由这四种元素组成的三核10电子的分子为________,四核10电子的分子是________。
18.(12分)A、B、C、D四种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8。
A原子的L层电子数与K、M层电子数之和相等,D 原子的K、L层电子数之和等于电子总数的一半。
请回答下列问题:(1)四种元素的元素符号依次是A________,B________,C________,D________。
它们的原子半径由大到小的顺序是____________________________,简单离子半径由大到小的顺序是_________________________________________________________。
(2)A、B最高价氧化物对应水化物的化学式分别是_____________________,它们酸性的强弱顺序是______________________。
(3)A、B气态氢化物的稳定性强弱顺序是:_________________。
19.(13分)(2015·天津卷)随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:(1)f在周期表中的位置是________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:______________。
Ⅱ.4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:(1)元素x在周期表中的位置是第________周期、第________族。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是________,碱性最强的是________(填化学式)。
20.(10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T 所处的周期序数与主族序数相等。
请回答下列问题:(1)T的原子结构示意图为________。
(2)元素的非金属性(原子的得电子能力):Q________W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为________。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是________________________________________________________________________________。
(5)R有多种氧化物,其中甲的相对分子质量最小。
在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________。
答案1D 2D 3D 4B 5C 6B 7B 8A 9D 10C 11C 12B13C 14A 15C16 (1)A (2)B (3)金属元素弱Uus2O 7(4)BD17 (1)H C N O (2)(3)H2O NH318 (1)S Cl K Ca r(K)>r(Ca)>r(S)>r(Cl) r(S2-)>r(Cl-)>r(K+)>r(Ca2+) (2)H2SO4、HClO4HClO4>H2SO4(3)HCl>H2S19 Ⅰ. (1)第3周期第ⅢA族(2)r(O2-) r(Na+) HClO4>H2SO4Ⅱ.(1)3ⅡA(2)HNO3Al(OH)320(1)(2)弱于(3)S+2H2SO4(浓)=====△3SO2↑+2H2O (4)2H2O2=====MnO22H2O+O2↑(5)NaNO2。
