基元反应动力学练习题(精品)
(整理)第11章动力学练习题

第十一章动力学练习题一、是非题(对的画√错的画×)1、反应速率系数k A 与反应物A 的浓度有关。
( )2、反应级数不可能为负值。
( )3、一级反应肯定是单分子反应。
( )4、对二级反应来说,反应物转化为同一百分数时,若反应物的初始浓度越低,则所需时间越短。
( )5、对同一反应,活化能一定,则反应的起始温度愈低,反应的速率系数对温度的变化愈敏感。
( )6、阿累尼乌斯活化能的定义是dTkd RT Ea ln 2=。
( ) 7、对于元反应,反应速率系数部随温度的升高而增大。
( ) 8、若反应A →Y ,对A 为零级,则A 的半衰期 AA k C t 20,21=.。
( )9、设对行反应正方向是放热的,并假定正逆都是元反应,则升高温度更利于增大正反应的速率系数。
( )10、连串反应的速率由其中最慢的一步决定,因此速率控制步骤的级数就是总反应的级数。
( ) 11、鞍点是反应的最低能量途径上的最高点,但它不是势能面上的最高点,也不是势能面上的最低点。
( )12、过渡态理论中的活化络合物就是一般反应历程中的活化分子。
( ) 13、催化剂只能加快反应速率,而不有改变化学反应的标准平衡常数。
( )14、复杂反应是由若干个基元反应组成的,所以复杂反应的分子数是基元反应的分子数之和.。
( )15、质量作用定律只适用于元反应。
( )16、某反应,若其反应速率方程式为υA =κA B ,则当c B,0>>c A,0时,反应速率方程可约化为假二级反应。
( )17、若反应+Z 的速率方程为 υ= kc A c B , 则该反应是二级反应,且肯定是双分子反应。
( )18、对于反应 2NO + Cl 2 −→− 2NOCl ,只有其速率方程为:υ=k {c (NO)}2c (Cl 2),该反应才有可能为元反应。
其他的任何形式,都表明该反应不是元反应。
( )19、 知道了反应物和产物可写出化学反应方程式, 但不能由配平的化学反应式直接写出反应级数和反应分子数。
物理化学—动力学练习题及参考答案1

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。
【精品】第07章基元反应动力学习题及答案

第七章基元化学反应动力学习题及答案1.N 2O 5在25℃时分解反应的半衰期为5.7h,且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应111216.07.56932.06932.021-===h t k t k y 1)11ln(=-h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-= 即完成90%所需时间为18。
9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1=5。
4×1011exp(-122474J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101325Pa ,问多长时间后,丙烯酮的分压可达54kPa ?解:k /S -1=5。
4×1011exp[-122474/8。
314×(150+273)]=4。
055×10-4据题意:kt p p t=0lnt 410005.454000101325101325ln-⨯=-t =1877S3.双分子反应2A (g )−→−k B (g)+D(g),在623K 、初始浓度为0.400moldm -3时,半衰期为105s,请求出(1)反应速率系数k(2)A(g)反应掉90%所需时间为多少?(3)若反应的活化能为140kJmol—1,573K时的最大反应速率为多少?解:(1)r=k[A]2,t0.5=1/(2k[A]0),k=0.012dm3mol—1s-1(2)1/[A]–1/[A]0=2kt,t=945s(3)ln(k/k')=(E a/R)(1/T’-1/T),573K时k=0。
00223dm3mol—1s-1,最大反应速率r max=k[A]02=3。
6×10-4moldm—3s—1.4.450℃时实验测定气相反应3A+B→2C的速率数据如下;实验初压/Pa初速率-dp B/dt/(Pa/h)P A,0P B,01.1001。
第07章基元反应动力学习题及答案

第07章基元反应动力学习题及答案第07章基元反应动力学习题及答案3第七章 基元化学反应动力学习题及答案1. N 2O 5在25℃时分解反应的半衰期为5.7h, 且与N 2O 5的初始压力无关。
试求此反应在25℃条件下完成90%所需时间。
解:由题意知此反应为一级反应 111216.07.56932.06932.021-===h t kt k y1)11ln(=-h k y t 9.181216.0/)%9011ln(/)11ln(1=-=-=即完成90%所需时间为18.9h 。
2.异丙烯醚气相异构化成丙烯酮的反应是一级反应,其反应速率系(常)数与温度的关系为:k /s -1 =5.4×1011exp(-122 474 J ·mol -1/RT ),150℃下,反应开始时只有异丙烯醚,其压力为101 325 Pa ,问多长时间后,丙烯酮的分压可达54 kPa ?解:k /S-1=5.4×1011exp[-122474/8.314×(150+273)] =4.055×10-4据题意:ktppt=0ln4t410005.454000101325101325ln-⨯=-t =1877S3. 双分子反应2A(g)−→−kB(g) + D(g),在623K 、初始浓度为0.400mol dm -3时,半衰期为105s,请求出(1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol -1, 573K 时的最大反应速率为多少? 解:(1) r = k [A]2 , t 0.5= 1/(2 k [A]0) , k = 0.012dm 3mol -1s -1 (2) 1/[A] – 1/[A]0 =2 k t , t = 945 s(3) ln(k/k ’)=(E a /R )(1/T ’-1/T ) , 573K 时k = 0.00223dm 3mol -1s -1,最大反应速率r max = k [A]02=3.6×10-4 moldm -3s -1.4. 450℃时实验测定气相反应3A + B →2C 的速率数据如下;实验 初压 / Pa 初速率-dp B / dt / (Pa/h) P A,0 P B,01. 100 1.00 0.0100 2. 200 1.00 0.0400 3. 400 0.50 0.0800 (1)若反应的速率方程为r = kP A x P B y ,求x 、y 及k 。
基元反应动力学练习题

基元反应动力学练习题7-1 双分子反应2A(g) B(g) + D(g),在623K、初始浓度为0.400mol dm-3时,半衰期为105s,请求出(1) 反应速率系数k(2) A(g)反应掉90%所需时间为多少?(3) 若反应的活化能为140 kJ mol-1, 573K时的最大反应速率为多少?解:(1) r = k[A]2 , t0.5= 1/(2 k[A]0) , k = 0.012dm3mol-1s-1(2) 1/[A]– 1/[A]0 =2 k t , t = 945 s(3) ln(k/k’)=(E a/R)(1/T ’-1/T) , 573K时k = 0.00223dm3mol-1s-1,最大反应速率r max = k[A]02=3.6×10-4 moldm-3s-1.7-2 500K时气相基元反应A + B = C,当A和B的初始浓度皆为0.20 mol dm-3时,初始速率为5.0×10-2 mol dm-3 s-1(1) 求反应的速率系数k;(2) 当反应物A、B的初始分压均为50 kPa(开始无C),体系总压为75 kPa时所需时间为多少?解:(1) r0 = k[A]0 [B]0 , k =1.25 dm3 mol-1 s-1(2) p0(A) = p0(B) , r = k p p (A) 2 , p =2 p0(A) - p (A) , p (A)= p0(A)/ 2 , k p = k/(RT) ,t1/2 =1/[ k p p0(A)] = 66 s7-3 已知在540―727K之间和定容条件下,双分子反应CO(g)+ NO2(g)→CO2(g)+NO(g)的速率系数k表示为k / (mol-1 dm3 s-1) = 1.2×1010exp[E a /(RT)],E a= -132 kJ mol-1。
若在600K时,CO和NO2的初始压力分别为667和933Pa,试计算:(1) 该反应在600K时的k值; (2) 反应进行10 h以后,NO的分压为若干。
第七章 化学动力学习题

第七章化学动力学习题一、填空题1. 基元反应A+2B =2C, 反应物的消耗速度率和产物的生成速率的速率常数分别为k 、k 和k ,则三者之间的关系为k = .2. 已知反应2A --> P, A 的半衰期与其初始浓度成正比,此反应为 级.3. 催化剂可加快反应速率的主要原因是降低活化能或 .4. 质量作用定律表述为: .5. 某一级反应,在20 ℃时反应物浓度减少为原来的一半需要用10分钟, 此反应的速率常数为 .6. 催化剂只能改变 而不能改变 .7. 反应aA →产物, 若为一级反应,以 对时间t 作图可得直线;若为二级反应,以 对t 作图可得直线.8. 某对行反应在室温下的正、逆反应速率常数和平衡常数分别为k、k'和K;加入催化剂后,正、逆反应的速率常数和平衡常数分别为k 、k '和K .已知k =10k,则k '= k'及K = K.9. 基元反应2Br·───> Br , k 为用Br·浓度表示的反应速率常数. Br 的生成速率d[Br ]/dt = .10. 某一级反应的半衰期t = 0.01 s,则其反应速率常数k = .二、选择题1. 下列反应中有可能是基元反应的是反应 .A. 2NH ─────-> N + 3HB. CH I + HI───> CH + IC. Pb( C H ) ──> Pb + 4C H ·D. 2H + 2O ────> H O2. 某反应速率常数为0.099 min ,反应物初浓度为0.2 mol.dm , 则反应物的半衰期为 .A. 1.01 min;B. 4.04 min;C. 7.0 min;D. 50.5 min.3. 某反应 a A ──> P, 分别以A 的初浓度[A] = 0.05 mol/L 和[A] = 0.10 mol/L 进行反应, 测得半衰期分别为15 min和30 min, 此反应为 级反应.A. 零,B. 一,C. 1.5,D. 二4. 某反应 a A ──> P, 分别以A 的初浓度[A] = 1.0 mol/L 和[A] = 0.10 mol/L 进行反应, 测得半衰期分别为 1 min 和10 min, 此反应为 级反应.A. 零,B. 一,C. 二,D. 三5. 反应A ─-> P 的速率常数为k =6.93 min . 反应物浓度由0.50 mol/L降到0.25mol/L 所需的时间为 min.A. 0.1,B. 0.2,C. 1.0,D. 106. 反应A + 2 B ─-> P, 以A 的浓度变化和B 的浓度变化表示的速率常数分别为k 和k , 则 .A. 2 k = k ,B. k = 2 k ,C. k = k ,D. k = k7. 反应A + 2 B ─-> P, 以A 的浓度变化和B 的浓度变化表示的反应速率分别为v 和v , 则 .A. v = 2 v ,B. v = 2 v ,C. v = v ,D. v = v8. 某反应的速率常数k = 3.0 mol .dm .min , 此反应为 级反应.A. 零,B. 0.5,C. 1.5,D. 二9. 反应a A ─-> P 的速率常数为0.02 min , 反应物A 的初浓度[A] =1.0 mol.dm .反应的半衰期为 min.A. 25,B. 34.7,C. 41,D. 5010. 某化学反应方程式2A ─> P, 则表明该反应为 .A. 二级反应,B. 双分子反应,C. 基元反应,D. 以上都无法确定三、计算题1. 在恒容容器中发生一级反应4A ─> B+6C (各组分可视为理想气体),反应开始时只有A,压力为13.3 kPa,在1000 K时, 反应40分钟, 测得压力为20 kPa.(1)求反应速率常数k(1000K);(2)若800K时, k(800K) =3.5×10 min ,求活化能Ea.2.某温度下物质A 与等量物质B 混合,反应到1000秒时, A 已反应掉一半.计算反应2000秒后, A 的转化率:(1) 按零级反应计算;(2) 按对A 为一级,对B 为零级计算;(3) 按对A 及B 均为一级计算.3. 反应A+B→P. A 与B 按等摩尔比混合,反应10分钟后, A 反应掉75 %.计算15分钟后, A 反应掉多少?(1)按一级反应; (2)按二级反应; (3)按零级反应.4. 某反应的速率常数为:温度25 ℃35 ℃k 3.46×10 s 1.35×10 s计算该反应的活化能与指前因子.5. 某物质A 的分解反应为一级反应,当初浓度为0.1 mol.dm 时, 经50分钟分解20 %.求:(1) 反应速率常数k;(2) 半衰期t ;(3) 起始浓度为0.02 mol.dm 时,分解20 %所需时间.。
物理化学—动力学练习题及参考答案1

动力学1A 一、选择题 1. 连串反应 Ak 1Bk 2C 其中 k 1= 0.1 min -1, k 2= 0.2 min -1,假定反应开始时只有 A ,且浓度为 1 mol ·dm -3 ,则 B 浓度达最大的时间为: ( )(A) 0.3 min (B) 5.0 min (C) 6.93 min (D) ∞ 2. 平行反应 Ak 1B (1); Ak 2D (2),其反应 (1) 和(2) 的指前因子相同而活化能不同,E 1为 120 kJ ·mol -1,E 2为 80 kJ ·mol -1,则当在 1000K 进行时,两个反应速率常数的比是: ( )(A) k 1/k 2= 8.138×10-3 (B) k 1/k 2= 1.228×102(C) k 1/k 2= 1.55×10-5 (D) k 1/k 2= 6.47×104 3. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是: O 3→ O + O 2 (1) O + O 3→ 2O 2 (2) 请你指出这个反应对 O 3而言可能是: ( )(A) 0 级反应 (B) 1 级反应 (C) 2 级反应 (D) 1.5 级反应4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: ( ) (A) 对任何反应在任何温度范围内 (B) 对某些反应在任何温度范围内 (C) 对任何反应在一定温度范围内 (D) 对某些反应在一定温度范围内5. 如果反应 2A + B = 2D 的速率可表示为:r = -12d c A /d t = - d c B /d t = 12d c D /d t则其反应分子数为: ( )(A) 单分子 (B) 双分子 (C) 三分子 (D) 不能确定3 (A) kp H 23 p N 2 (B) kp H 22p N 2(C) kpH2pN2(D) kpH2pN227. 在反应 A k1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择: ( )(A) 较高反应温度 (B) 较低反应温度(C) 适中反应温度 (D) 任意反应温度8. [X]0 [Y][Z] 增加 0.0050 mol·dm-3所需的时间/ s0.10 mol·dm-3 0.10 mol·dm-3 720.20 mol·dm-3 0.10 mol·dm-3 180.20 mol·dm-3 0.05 mol·dm-3 36对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: ( )(A) 对 X 和 Y 均为一级 (B) 对 X 一级,对 Y 零级(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级9. 一级反应,反应物反应掉 1/n所需要的时间是: ( )(A) -0.6932/k (B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n (D) (2.303/k) lg(1/n)10. 关于反应速率理论中概率因子P的有关描述,不正确的是: ( )(A) P与∆≠S m有关(B) P体现空间位置对反应速率的影响(C) P与反应物分子间相对碰撞能有关(D) P值大多数<1,但也有>1的二、填空题12. 60Co广泛用于癌症治疗, 其半衰期为5.26 a (年), 则其蜕变速率常数为:_________________, 某医院购得该同位素20 mg, 10 a后剩余 ______________mg。
7 练习题动力学

、
双分子反应和三分子反应。
17. 某一个 1-1 级对峙反应,其正向反应速率常数为 k+,逆向反应速率常数为 k-,则该反
应的平衡常数 K 与正向反应速率常数 k+和逆向反应速率常数 k-的关系是:
。
18. 动力学二级反应的速率常数的量纲是:
。
19. 一个反应由多个基元步骤组成的反应是
反应。
20. 相同条件下,化学反应的活化能 Ea 越高的反应反应速率越 ______ _______。
5、平行反应的速控步骤是快步骤;连串反应的速控步骤是慢步骤。对吗?答:对。 6、阀能的物理意义是什么?它与阿累尼乌斯经验活化能在数值上的关系如何?答:阀能 Ec 是两个相对分子的相对平动能在连心线上的分量必须超过的临界值,此时的碰撞才是有效碰 撞。Ea=Ec+1/2RT 7、为什么在简单碰撞理论中,要引入概率因子 P?答:为了校正计算值与实验值的偏差。
一、填空题
1. 基元反应中各反应物分子个数之和称为__
______。
2. 活化能 Ea 较__ ___的反应对温度更敏感一些,通过选择合适的催化剂加快反应速度,
其主要原因是___
_____________。
3. 质量作用定律只适于__
__ __反应。
4. 写出温度对反应速率影响的阿伦尼乌斯公式表达式
(b) 只能是 1、2、3 这三个正整数
(c) 也可是小于 1 的数值
(d) 可正,可负,可为零
14. 反应1与反应2的指前因子相同,活化能不同,E2> E1,若温度都由T1变化到T2,则反
应1与反应2哪个反应速率变化大?
(
)
(a) 反应2
(b) 反应1
(c) 一样大
动力学习题

一、判断题1.单分子反应一定是基元反应。
2.零级反应的反应速率不随反应物浓度变化而变化。
3.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
4.一个化学反应的级数越大,其反应速率也越大。
5.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
k1BA┤,k1/k2 的比值不随温度的变化而变化。
6.平行反应 Ck27.复杂反应的速率取决于其中最慢的一步。
8.碰撞理论成功处之一,是从微观上揭示了质量作用定律的本质。
9.光化学反应的初级阶段 A + hv P 的速率与反应物浓度无关。
10.按照光化当量定律,在整个光化学反应过程中,一个光子只能活化一个分子,因此只能使一个分子发生反应。
二选择1.某一反应在有限时间内可反应完全,所需时间为c0/k,该反应级数为:(A) 零级;(B) 一级;(C) 二级;(D) 三级。
2.某反应,其半衰期与起始浓度成反比,则反应完成87.5%的时间t1 与反应完成50%的时间t2 之间的关系是:(A) t1 = 2t2 ;(B) t1 = 4t2 ;(C) t1 = 7t2 ;(D) t1 = 5t2 。
3.起始浓度都相同的三级反应的直线图应是(c 为反应物浓度,n 为级数) :4.反应 A + B → C + D 的速率方程为r = k[A][B] ,则反应:(A) 是二分子反应;(B) 是二级反应但不一定是二分子反应;(C) 不是二分子反应;(D) 是对A、B 各为一级的二分子反应。
5.右图绘出物质[G] 、[F] 、[E] 的浓度随时间变化的规律,所对应的连串反应是:(A) G F E ;(B) E F G ;(C) G E F ;(D) F G E 。
6.乙酸高温分解时,实验测得CH3COOH(A) 、CO(B) 、CH=CO(C) 的浓度随时间的变化曲线如下图,由此可以断定该反应是:(A) 基元反应;(B) 对峙反应;(C) 平行反应;(D) 连串反应。
化学反应动力学练习题1
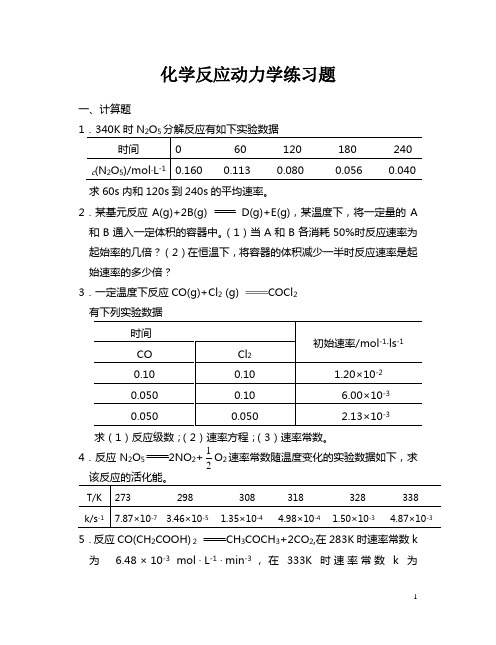
化学反应动力学练习题一、计算题1.340K 时N 2O 5分解反应有如下实验数据求60s 内和120s 到240s 的平均速率。
2.某基元反应A(g)+2B(g)D(g)+E(g),某温度下,将一定量的A 和B 通入一定体积的容器中。
(1)当A 和B 各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl 2 (g) COCl 2有下列实验数据求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O 52NO 2+21O 2速率常数随温度变化的实验数据如下,求该反应的活化能。
5.反应CO(CH2COOH) 2 CH 3COCH 3+2CO 2,在283K 时速率常数k 为 6.48×10-3 mol 〃L -1〃min -3,在333K 时速率常数k 为3.29mol 〃L -1〃min -1。
求303K时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol〃L-1,cB=0.3mol〃L-1时的反应速率为0.72mol〃L-1〃s-1,若温度不变增大反应物浓度,使 cA=1.2mol〃L-1,cB=0.6mol〃L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol〃L-1,c(O2)=0.080 mol〃L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
试计算C2H6(g) 的压强为1.33×104 Pa 时的起始分解速率υ9.295K时,反应 2 NO + Cl2→ 2 NOCl,反应物浓度与反应速率关系的数据如下:(2)写出反应的速率方程。
第十一章化学动力学基础1练习题

第十一章化学动力学基础1练习题第十一章化学动力学基础(1)练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10. 下列说法是否正确:(1) H2+I2=2HI 是2 分子反应;(2) 单分子反应都是一级反应,双分子反应都是二级反应。
;(3) 反应级数是整数的为简单反应(4) 反应级数是分数的为复杂反应。
11.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
12.若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下k 1一 定小于k 2。
13.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
14.对平衡反应A Y ,在一定温度下反应达平衡时,正逆反应速率常数相等。
15.平行反应C B A 21−→−−→−kk ┤,k 1/k 2的比值不随温度的变化而变化。
16.复杂反应的速率取决于其中最慢的一步。
17.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
18.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O 2 2O 3,其速率方程 -d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t = k '[O 3]2[O 2],那 么k 与k '的关系是:(A) 2k = 3k ' ; (B) k = k ' ; (C) 3k = 2k ' ; (D) ½k = ⅓k ' 。
【2019年整理】化学反应动力学习题(可打印修改) (2)

二、 选择题 1.(C);2.(B);
三、 填空题 1. 一、是非题 下列各题中的叙述是否正确?正确的选“√”,错误的选“×”。
√ × 1. 设对行反应正方向是放热的,并假定正、逆都是元反应,则升高温度更利 于增大正反应的速率系数。
√ × 2.若反应 A
Y,对 A 为零级,则 A 的半衰期
。
二、选择题
2. 3. kA=0.01 mol-1×dm3×s-1 t1/2=100 s
4. t1/2=15min 5. k(310K)/k(300K)=25.36
1. 二甲醚的气相分解是一级反应:CH3OCH3(g)
CH4(g)+ H2(g) + CO(g)
504℃时把二甲醚充入真空的定容反应器内,测得时间 t 时总压力 pt, 总数据如下:
N2O2 (快);
N2O2+O2
2NO2 (慢)。
又已知 2NO
U Δ N2O2 的 r m <0。试导出总反应的动力学方程式,并解释其反应级数及
对比实验 1, 2:
B 过量: 实验 1: 实验 3
则 b=2。
两式相除,得 4=4×2a-1,则 a=1。反应速率方程为:-dpA/dt=kApApB2
由实验 1 数据,
=1.13×10-10 Pa2×h-1。
4.[题解]:(1)据 Arrhenius 方程的不定积分式: 给 kA=f(T)的经验式对比,得
在以下各小题的“
”处填上答案。
1.链反应的一般步骤是(i)
;(ii)
;(iii)
。
答案:一、是非题 1. √; 2. √;
二、选择题 1.(B); 2.(B); 3.(C);
三、填空题 1.链的引发 链的传递 链的终止
动力学(全)

化学动力学基础练习题一 选择1 基元反应的分子数取值为( C )A 可以为 0、1、2、3B 只能是 1、2、3;C 可以是小于1的数值;D 可正、可负、可为0。
2 基元反应中反应级数与反应分子数的关系( D )A 反应级数与反应分子数一致B 反应级数大于反应分子数C 反应级数小于反应分子数D 反应级数小于或等于反应分子数3 对于一个化学反应,测得的浓度与时间成直线关系,则该反应为(B )A 一级反应B 零级反应C 二级反应D 不确定4 光化反应与黑暗反应的相同之处在于( A )A 反应都需要活化能B 温度系数小C 反应都向ΔG (恒温恒压,W ˊ=0时)减少的方向进行D 平衡常数可用通常的热力学函数计算5 按照光化当量定律(C )A 在整个光化过程中,一个光子只能活化一个原子或分子B 在光化反应的初级阶段,一个光子活化1moL 原子或分子C 在光化反应的初级阶段,一个光子活化一个原子或分子D 在光化反应的初级阶段,一个爱因斯坦的能量活化一个原子或分子6 对于复杂反应,一下说法中不正确的是( AC )A 复杂反应无反应级数而言B 复杂反应至少包括两个基元步骤C 复杂反应的级数不会是正整数D 反应级数为分数的反应一定是复杂反应 7 放射性元素P b 201的半衰期为8小时,1克放射性P b 20124小时后还剩下( D )A 1/2 gB 1/3 gC 1/4 gD 1/8 g8 两个H ·与M 粒子同时相碰撞,发生下列反应H ·+H ·+M →H 2 (g) + M 此反应的活化能E a 是(B )A 大于零B 等于零C 小于零D 不能确定9 对于1100m U kJ mol -∆=⋅的某吸热反应,其逆反应的活化能符合下列哪种情况( C )A 一定小于100kJ/moL C 可能小于100kJ/moL ,也可能大于100kJ/moLB 一定大于100kJ/moL D 一定大于正反应的活化能10 某反应的速率常数K =4.62×10-2min -1,初始浓度为0.1moL/dm 3,则该反应的半衰期t 1/2为( B )A 221min 6.93100.1-⨯⨯B 15 minC 30 minD 21min 4.62100.1⨯⨯ 11 某反应A →Y ,其速率系数k A =6.93min -1,则该反应物A 的浓度从1.0 moL/dm 3变到0.5moL/dm 3所需的时间是(B )A 0.2minB 0.1minC 1min12 基元反应:H + Cl 2 → HCl + Cl 的反应分子数是(B )A 单分子反应B 双分子反应 D 四分子反应13 某反应速率常数与各基元反应速率常数的关系为121242k k k k ⎛⎫= ⎪⎝⎭,则该反应的表观活化能与各基元反应活化能的关系是( B )A 21412a E E E E =+-B ()21412a E E E E =+-C ()122142a E E E E =+- 14 一反应,如果起始浓度减少一半,半衰期缩短一半,则反应级数为(C )A 1B 2C 0D 1.515 平行反应:A (g)已知反应①的活化能E a1=80KJ mol -1 ,反应②活化能E a2=40KJ mol -1,为有利于产物B (g)的生成,应当采用( B )的方法。
化学动力学练习题

化学动力学练习题(一)填空题1 .物理吸附的吸附热与气体的 相近。
2 .基元反应 H.+Cl 2 —> HCl + Cl-的反应分子数是为100kJ.mol -i 和70 k 『mol -i ,当反应在1000 K 进行时,两个反应的反应速率 系(常)数之比幺=。
k24 .复合反应 2A 点产 B 「口 Y 其 —d c A = ______________________________________ ;" 山以= ;g=。
d t d t5 .将反应物A 和B 置于抽空密闭容器中于等温等容下进行气相反应 3 A +B — 2Y ,此反应的—d P (总)=( )d P (Y )。
d t ---------- d t6 .对元反应 A _JU 2Y,贝U d cj d t = ___ ,一d cj d t = ______ 。
YA.7 .对反应A —P ,实验测得反应物的半衰期与与初始浓度c A ,0成反比,则该反应 为级反应。
8 .建立动力学方程式所需的实验数据是。
处理这些实验 数据以得到反应级数和反应速率常数,通常应用以下三种方法,即 法、 法和 法。
9 .对反应A - P ,反应物浓度的对数ln c A 与时间t 成线性关系,则该反应为 级反应。
10 .直链反应由三个基本步骤组成,即、、。
11 .质量作用定律只适用于 反应。
12 .某化合物与水相作用时,该化合物初浓度为1 mol ・dm -3, 1 h 后其浓度为0.8mol *dm -3, 2 h 后其浓度为0.6 mol *dm -3,则此反应的反应级数为, 此反应的反应速率系(常)数k =。
13 .气相基元反应2A - B 在一恒定的容器中进行,P 为A 的初始压力,P 为 o t反应1和反应2的指前因子(参量)相同,活化能分别3.平行反时间t 时反应体系的总压力,此反应的速率方程dP t / dt =14 .某化学反应在800 K 时加入催化剂后,其反应速率系(常)数增至500倍,如果 指前因子(参量)不因加入催化剂而改变,则其活化能减少。
【免费下载】物理化学—动力学练习题及参考答案1

20. 在 300 K 时, 鲜牛奶 5 h 后即变酸, 但在 275 K 的冰箱里,可保存 50 h,
牛奶变酸反应的活化能是__________________________。 21. 采用 32P 标记的五氯化磷 t1/2 为 14.3 d, 经___________d 后, 放射性衰 变到起始值的 1/1000。
的指前因子相同而活化能不同,E1 为 120 kJ·mol-1,E2 为 80 kJ·mol-1,则
当在 1000K 进行时,两个反应速率常数的比是:
(A) k1/k2= 8.138×10-3
(C) k1/k2= 1.55×10-5
3. 如果臭氧 (O3) 分解反应 2O3→ 3O2 的反应机理是:
36
对于反应 X + 2Y → 3Z,[Z] 增加的初始速率为: (
)
(A) 对 X 和 Y 均为一级
(B) 对 X 一级,对 Y 零级
(C) 对 X 二级,对 Y 为一级 (D) 对 X 四级,对 Y 为二级
9. 一级反应,反应物反应掉 1/n 所需要的时间是: (
)
(A) -0.6932/k
(B) (2.303/k) lg[n/(n-1)]
O3→ O + O2
O + O3→ 2O2
请你指出这个反应对 O3 而言可
(1)
(2)
4. 化学反应速率常数的 Arrhenius 关系式能成立的范围是: (
(A) 对任何反应在任何温度范围内
(B) 对某些反应在任何温度范围内
(C) 对任何反应在一定温度范围内
动力学 1A 一、选择题
1. 连串反应 A k1 B k2 C 其中 k1= 0.1 min-1, k2= 0.2 min-1,假
动力学题库及解

《动力学部分》题库及题解一、填空题:1.何为具有简单级数的反应:反应速率只与浓度有关,且组分级数和反应总级数为零或正整数,某反应A+B=P为基元反应,则该反应的反应级数为:二级,该反应的反应速率与反应物浓度的关系可表示为r=k[A][B] ,得此关系的理由是基元反应遵守质量作用定律,该反应的分子数为:二,得此结论的理由是基元反应的反应级数等于反应分子数。
B,其正反应的速率可表示为:r正=k1[A] ;逆2.对峙反应 A反应的速率为:r逆=k-1[B] ,该对峙反应的净速率可表示为:r= r正-r逆=k1[A]-k-1[B] ;当反应达到平衡时,正、逆反应速率常数之间的关系可表示为k1[A]-k-1[B] 或k1/ k-1 = [B]/ [A] =K 。
3.阿累尼乌斯经验式为:k = Aexp(-E a/RT)或lnk= -E a/RT+lnA ;从式中可以得出活化能越大,反应速率越慢。
阿累尼乌斯的活化能意义是对基元反应有明确的意义,活化分子的平均能量与所有分子平均能量之差,此意义适用于基元反应(基元反应、非基元反应、都适用?)。
实验测定活化能的方法是:测不同温度下的速率常数k ,作lnk~1/T 关系图,通过斜率求得活化能。
4.某气体反应A+B—→3C的速率方程为r ==kCαA CβB,为确定α、β值在常温=102Pa,P B,0=105Pa时,作反应的lnP A~t(时间)下进行实验,当初始压力为P A,0= P B,0=5×102Pa时,仍作反应的lnP A~t图仍为一图为一直线,当初始压力为P A,0直线,则α= 1 ,β= 0 。
(lnc~t成直线关系的是一级反应)5.何为基元反应由反应物直接变为产物的反应(一步完成的反应),基元反应的速率与反应物浓度的关系符合质量作用定律定律。
如果反应2A+B=P为基元反应,则反应速率与浓度的关系可表示为:r=k[A]2[B] ,该反应的反应级数为:三级,反应的分子数为:三分子反应。
化学反应动力学练习题1

化学反应动力学练习题一、计算题1.340K时N2O5分解反应有如下实验数据时间0 60 120 180 240c (N2O5)/mol·L-10.160 0.113 0.080 0.056 0.040求60s内和120s到240s的平均速率。
2.某基元反应A(g)+2B(g) D(g)+E(g),某温度下,将一定量的A和B通入一定体积的容器中。
(1)当A和B各消耗50%时反应速率为起始率的几倍?(2)在恒温下,将容器的体积减少一半时反应速率是起始速率的多少倍?3.一定温度下反应CO(g)+Cl2 (g) COCl2有下列实验数据时间初始速率/mol-1·ls-1 CO Cl20.100.10 1.20×10-20.0500.10 6.00×10-30.0500.050 2.13×10-3求(1)反应级数;(2)速率方程;(3)速率常数。
4.反应N2O52NO2+21O2速率常数随温度变化的实验数据如下,求该反应的活化能。
T/K273 298 308 318 328 338k/s-17.87×10-7 3.46×10-5 1.35×10-4 4.98×10-4 1.50×10-3 4.87×10-35.反应CO(CH2COOH)2CH3COCH3+2CO2,在283K时速率常数k为 6.48×10-3 mol·L-1·min-3,在333K时速率常数k为3.29mol·L-1·min-1。
求303K 时反应的速率常数。
6.密闭容器中进行的某基元反应A(g)+2B(g) 2C(g)当反应物的起始浓度分别为cA =0.2mol·L-1,cB=0.3mol·L-1时的反应速率为0.72mol·L-1·s-1,若温度不变增大反应物浓度,使 cA=1.2mol·L-1,cB=0.6mol·L-1,此时反应速率多大?为原来反应速率的多少倍?7.某温度下反应2NO(g)+O2(g) 2NO2(g)的实验数据如下:初始浓度/mol·L-1初始速率/mol·L-1·s-1 c(NO)C(O2)1 2 30.0200.0100.0100.0200.0200.0102.0×10-25.0×10-32.5×10-3(1)写出该反应的速率方程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=0.15mol·L-1,c(O2)=0.080 mol·L-1时反应速率是多少?8.反应C2H6→ C2H4+ H2,开始阶段反应级数近似为3/2级,910 K时速率常数为1.13 dm3/2·。
动力学习题

y2 36% (存放14天,药物分解36%)。
2.实验测出热分解反应 2N2O(g) k2N2(g) O2(g) 不同温度时的起始压力和半衰期如下:
反应温度T/K 967 967 1030 1030
起始压 p0/kPa 156.787 39.197 7.066 47.996
3 2
p0
1 2
p
p 3p0 2 p总 34.0kPa
11 1
1
11
t
k"
(
p
p0
)
9.828 108
( 34
) 54
110.8s
③
半衰期与初始浓度成正比。t1/ 2
a 2k0
2.一级反应
微分形式:
r
dx dt
k1 (a
x)
积分形式:
ln
a
a
x
k1t
特点:
① k1的单位 [时间]-1
② ln(a x) ~t呈线性关系
③ 半衰期与初始浓度无关。
t1/ 2
ln 2 k1
3.二级反应
(1) 初始浓度相同
微分形式:r
dx dt
四、反应级数和反应分子数
1.反应级数:表示反应速率对浓度的依赖关系。 (宏观概念)
2.反应分子数:直接参与反应,真正相互作 用而引起化学变化所需的最少的分子数目。 (微观概念)
五、速率方程的表达式
1.零级反应
微分形式:r
dx dt
k0
积分形式:x=k0t
特点:
① k0的单位[浓度][时间]-1
② x~t呈线性关系
k2 (a
x)2
反应动力学 习题及答案

反应动力学 习题一、判断题:1、催化剂只能改变反应的活化能,不能改变反应的热效应。
.........................( )2、质量作用定律适用于任何化学反应...............................................( )3、反应速率常数取决于反应温度,与反应物、生成物的浓度无关。
................( )二、选择题:1.若 反 应:A + B → C 对 A 和 B 来 说 都 是 一 级 的, 下 列 叙 述 中正 确 的 是....( )。
(A) 此 反 应 为 一 级 反 应;(B) 两 种 反 应 物 中, 当 其 中 任 一 种 的 浓 度 增 大 2 倍, 都 将 使 反 应 速 率 增 大 2 倍;(C) 两 种 反 应 物 的 浓 度 同 时 减 半, 则 反 应 速 率 也 将 减 半;(D) 该 反 应 速 率 系数 的 单 位 为 s -1。
2. 反 应 A + B → 3D 的 E a ( 正 ) = m kJ·mol -1,E a ( 逆 ) = n kJ·mol -1, 则 反 应 的△r H m = ............ ( )。
(A) (m -n ) kJ·mol -1; (B) (n -m ) kJ·mol -1; (C) (m -3n ) kJ·mol -1; (D) (3n -m ) kJ·mol -1。
3. 下 列 关 于 催 化 剂 的 叙 述 中, 错 误 的 是................................................( )。
(A) 在 几 个 反 应 中, 某 催 化 剂 可 选 择 地 加 快 其 中 某 一 反 应 的 反 应 速 率;(B) 催 化 剂 使 正、 逆 反 应 速 率 增 大 的 倍 数 相 同;(C) 催 化 剂 不 能 改 变 反 应 的 始 态 和 终 态;(D) 催 化 剂 可 改 变 某 一 反 应 的 正 向 与 逆 向 的 反 应 速 率 之 比。
