臭氧-ozone
臭氧的基本知识

臭氧的基本学问字体大小:大I中I小2006-06-20 10:10 -阅读:237 -评论:0臭氧的英文名字叫OZONE,分子式03,分子量为48,是氧气(02)的同素异形体,由三个氧原子组成,常温下臭氧是淡蓝色,鱼腥味气体,IPPm臭氧=1.963mg∕m3臭氧密度p=2.144g∕I,空气密度=1.293 g/L臭氧在水中的溶解度大约是氧的IO-15倍,在水中稳定性较差。
臭氧具有不稳定性和很强的氧化力量。
臭氧是由一个氧分子携带一个氧原子[O]组成,是一种暂存的状态。
臭氧与人们常用的几种消毒物质还原电位的比较如下:臭氧易分解,不稳定参比状态下臭氧的半衰期为22~25分钟,一个小时的衰退率为61%,在1%的臭氧水溶液中半衰期为16分钟,且温度越高,湿度越大,半衰期越短。
国际卫生组织对其灭菌功效曾归纳比较,臭氧与其它性质杀菌剂对大肠杆菌的杀灭效果依次为:臭氧一〉次氯酸一〉二氧化氯一〉银离子一〉次氯酸根一)高铁酸盐一)氯胺臭氧灭菌介绍臭氧灭菌机理:臭氧灭菌的过程属于生物化学反应,臭氧灭菌有以下三种形式:①臭氧氧化分解了细菌内部氧化葡萄糖氧化酶;②直接与细菌、病毒发生作用,破坏其细胞壁DNA和RNA,分解蛋白质、脂质类和多糖等大分子聚合物,使细菌的物质代谢生长和繁殖过程遭到破坏;③渗透细胞膜组织,侵入细胞膜内作用于外膜脂蛋白和内部的脂多糖,使细胞发生通透性畸变,导致细胞的溶解死亡,并且将死亡菌体内的遗传基因,寄生菌种、寄生病毒粒子、噬菌体、枝原体及热原(细菌病毒代谢产物、内毒素)等溶解变性灭亡。
由水落石出,臭氧灭菌属于溶菌,是一种灭菌方式中最彻底的形式。
既然臭氧能杀死病毒、细菌,那么会不会也把健满面的细胞杀死呢?不会,由于健康细胞具有强人的平衡酶系统,因而臭氧对健康细胞无害。
臭氧具有的强氧化性,有四大功用:灭菌、氧化、脱色、除味;臭氧灭菌具有广谱性、高效性、环保性、操作便利、使用经济和性能稳定、寿命长等特点;臭氧制造方法:*人类制造臭氧主要是通过模拟自然界产生臭氧的方法而来。
臭氧的性质

臭氧的性质臭氧(OZONE),分子式O 3 ,分子量47.9982(≈48),在常温下为蓝色气体,有类似鱼腥的气味。
臭氧的理化数据:在标准状况下,密度 2.144g/L。
由于接近地面的干燥空气,密度为1.293g/L,因此臭氧密度是空气的1.658倍。
在-195.4 0 C时,液态臭氧密度为1.164g/ml。
临界温度为-12.1 0 C,临界压力为5.45×10 6 帕。
在冷水中的溶解度比氧气约大10倍。
空气中含有0.02PPm左右的臭氧。
一般情况下,空气中1PPm臭氧可取2.14mg/m 3 ,水中1PPm臭氧为1mg/L。
长期呼吸>0.1PPm臭氧,对人体有害。
臭氧浓度在0.02PPm时,嗅觉敏锐者能感觉到,称“感觉临界点”;0.15PPm时,一般人能嗅出,称“嗅觉临界值”(亦为卫生标准点);1-10PPm为“刺激范围”;10PPm以上为“中毒范围”。
臭氧不稳定,在高温时会迅速分解,在常温下会缓慢分解为(氧气),在1%的臭氧水溶液中半衰期约16分钟,在空气中的半衰期约25分钟。
臭氧的不稳定性使其很难实现瓶装贮存,一般只能利用臭氧发生器现场生产,随产随用。
臭氧是比氧气更强的氧化剂,且可以在较低温度下进行氧化。
所以,臭氧的一切应用(消毒、灭菌、水净化、漂白、作氧化剂等)本质上都是利用其强氧化能力。
由上可知,臭氧的强氧化性、常温作用性,特别是其“工作”后能还原为氧气,是其应用经久不衰,备受人类青脒的三大原因。
纯臭氧在受撞击、磨擦时会发生爆炸而分解,含高浓度臭氧溶液加热时易发生爆炸,但只要注意避免,此类事故即不易发生(至于臭氧对人体的毒害,臭氧问世150余年来,尚无一例中毒死亡的报告)。
臭氧用于空气消毒时,消毒现场不应有高浓度易燃易爆气体。
臭氧与水同存时为强烈漂白剂,其作用比氯气(Cl 2 )、双氧水(H 2 O 2 )、二氧化硫(SO 2 )快得多。
臭氧的获得:臭氧可通过高压放电、电晕放电、化学等方法获得。
臭氧的性质

臭氧的性质臭氧(OZONE),分子式O 3,分子量47.9982(≈48),在常温下为蓝色气体,有类似鱼腥的气味。
臭氧的理化数据:在标准状况下,密度2.144g/L。
由于接近地面的干燥空气,密度为1.293g/L,因此臭氧密度是空气的1.658倍。
在-195.4 0 C时,液态臭氧密度为1.164g/ml。
临界温度为-12.1 0 C,临界压力为5.45×10 6帕。
在冷水中的溶解度比氧气约大10倍。
空气中含有0.02PPm左右的臭氧。
一般情况下,空气中1PPm臭氧可取2.14mg/m 3,水中1PPm臭氧为1mg/L。
长期呼吸>0.1PPm臭氧,对人体有害。
臭氧浓度在0.02PPm时,嗅觉敏锐者能感觉到,称“感觉临界点”;0.15PPm时,一般人能嗅出,称“嗅觉临界值”(亦为卫生标准点);1-10PPm为“刺激范围”;10PPm以上为“中毒范围”。
臭氧不稳定,在高温时会迅速分解,在常温下会缓慢分解为(氧气),在1%的臭氧水溶液中半衰期约16分钟,在空气中的半衰期约25分钟。
臭氧的不稳定性使其很难实现瓶装贮存,一般只能利用臭氧发生器现场生产,随产随用。
臭氧是比氧气更强的氧化剂,且可以在较低温度下进行氧化。
所以,臭氧的一切应用(消毒、灭菌、水净化、漂白、作氧化剂等)本质上都是利用其强氧化能力。
由上可知,臭氧的强氧化性、常温作用性,特别是其“工作”后能还原为氧气,是其应用经久不衰,备受人类青脒的三大原因。
纯臭氧在受撞击、磨擦时会发生爆炸而分解,含高浓度臭氧溶液加热时易发生爆炸,但只要注意避免,此类事故即不易发生(至于臭氧对人体的毒害,臭氧问世150余年来,尚无一例中毒死亡的报告)。
臭氧用于空气消毒时,消毒现场不应有高浓度易燃易爆气体。
臭氧与水同存时为强烈漂白剂,其作用比氯气(Cl 2)、双氧水(H 2 O 2)、二氧化硫(SO 2)快得多。
臭氧的获得:臭氧可通过高压放电、电晕放电、化学等方法获得。
臭氧的基本知识

应,经碰撞合为分子。
优点:产量大。
缺点:会伴随有。
依据电晕放电法原理的发生器件:平行板、陶瓷片、电真空管等。
臭氧发生器类型介绍:(1)空气型臭氧发生器,它由臭氧发生器系统、送风系统、定时系统、控制系统四部分组成。
空气型臭氧发生器应用中有以下几个特点:放置高处,臭氧比重在空气中较大,易下降,放在高处利于其散播。
湿度适当,臭氧灭菌效果在湿度50~80%条件最理想。
(2)水处理臭氧发生技术及配套技术:主要包括气源预处理、发生、气水混合一大基础部分电控系统、结构系统五大方面技术。
在气源预处理中包括:过滤、增压、泠却、干燥四个过程,气水混合方法通常有曝气法、方丘里法、涡轮负吸法、混合塔法等四种方法。
臭氧浓度检测的方法大致可分为化学分析法和仪器法两大类:化学分析法中最常用的的碘化钾法,硼酸碘化钾吸光光度法和靛兰二磺酸钠分光光度法。
仪器法检测臭氧的浓度的原理是采用化学发光法和紫外线吸收法,仪器法检测臭氧的优点在于灵敏度高,重复性好,对操作者水平要求也不高,是一种较好的方法。
应用臭氧时注意事项:禁止在有导电气体或爆炸性介质存在的环境中使用,因为臭氧发生器一般采用高频高压电源供电。
臭氧发生器件在高温或杂质油类含量较高的气体环境下工作时,特别是开放型发生器器件容易沾污或衍生斑垢,多了会影响发生量,应及时清洗。
要求使用环境:空气湿度〈95%。
臭氧的发生用纯氧气源或光谱方法、水解方法时,臭氧的纯正度较高。
不会对人体健康产生危害,但如果用普通空气发生臭氧,电介质材料或器件选用不当时会伴随产生NOx。
臭氧具有强氧化能力,使用时要注意使橡胶制品、钢铁等物品远离它,以免被腐蚀。
另外臭氧会刺激人的呼吸系统,严重会造成伤害。
文献报告,臭氧浓度在0.02ppm时,为感觉临界值;臭氧浓度在0.15ppm时,为嗅觉临界值,一般人能嗅出;臭氧浓度达到1-10ppm时,为刺激范围;臭氧浓度在10ppm以上时,为中毒极限。
①重污染水和顽性汗水,投放量和作用时间须由预先的试验得出。
臭氧的主要作用

臭氧的主要作用
臭氧的英文名字叫OZONE ,分子式O3,分子量48 ,是由一个氧分子(O2)携带一个氧原子(O)组成,是氧气的同素异形体。
又称富氧、三子氧、超氧。
具有很强的氧化能力,主要是灭菌消毒。
臭氧具有很高的能量,在常温、常压下很快自行分解为氧(O2)和单个氧原子(O),单个氧原子具有很强的活性,对细菌、病毒、病原体等微生物具有较强的氧化作用。
净化空气:迅速分解装修污染气体、去除异味:迅速除掉装修材料释放出的甲醛、苯、甲苯、氢气等各种有害气体及其异味如空气中的烟味、腥味、臭味等异味,并能同时杀灭空气中的细菌,悬浮在空气中的微细灰尘都带正电。
负离子能消除静电,吸引聚集悬浮的微细灰尘降落地面,净化空气,促使正负离子趋向平衡。
起到迅速净化室内空气的作用。
消毒杀菌:可以迅速杀灭细菌繁殖体、芽孢真菌、病菌等一切病原微生物,对室内空气和物品达到彻底的消毒效果。
保健作用:臭氧可迅速还原成氧,大量增加室内氧气浓度和负离子,促进人体细胞活化、改善血液循环和新陈代谢,预防疾病发生。
空气中缺少负离子将会使人感到呼吸急促、情绪低落、疲劳、焦虑、头晕、恶心;还可诱发哮喘,感昌、失眠、心血管病及免疫力下降等症状。
用上空调的封闭结构的室内正离子更容易上升。
负离子就能改变空调病的困扰和危害。
医学研究证明,负离子被人体吸入,进入人体循环,可调节人体植物神经、改善大脑皮层的功能、强血管毛纤活动、促进胃液分泌、增加红细胞、血小板、白细胞,中和肌酸、消除疲劳等功效。
迅速恢复室内空气自然状态,防治空调病。
臭氧的知识

臭氧的知识臭氧(ozone,O3)是一种强氧化剂和催化剂,具有广谱、高效的杀菌作用。
臭氧用于消毒已有近百年的历史,最初用于水消毒,现已成为重要的消毒方法。
目前臭氧主要用于饮水消毒、污水处理、空气消毒、食品保鲜、冷藏冷冻物品除菌、医院消毒、家庭消毒等方面,在工农业中的应用也日趋广泛和深入。
一、理化性质臭氧是由三个氧原子组成的氧(O2)的同素异形体,三个氧原子呈三角排列,夹角为116°49,±30“),O-O键长为0.1278±0.0003nm,常态下为淡蓝色气体,有特殊的刺激性,高压下可变成深褐色液体,臭氧在水中的溶解度为3% ,是O2的10倍,臭氧不稳定,易分解,在水中臭氧的半衰期与温度和PH值有关,PH值越高,分解越快;温度越高,分解也越快,在20。
C,PH为7.6时半衰期约为21~22min 。
臭氧具有极强的氧化能力,其标准氧化还原电位达 2.07V,仅次于氟(2.87V),大大高于过氧化氢(1.78V)、二氧化氯(1.50V)和氯(1.36V).这种强氧化性对微生物具有较强的杀灭作用.由于臭氧的不稳定性和毒性使其应用受限,现在新型臭氧发生方法的产生使它在消毒领域内的应用范围不断拓宽.二、对微生物的杀灭作用臭氧是一种高效消毒剂,可以杀灭各种微生物.(一)对细菌繁殖体臭氧对细菌繁殖体具有较好的杀灭作用.但不同细菌对臭氧的抵抗力不同,一般认为较敏感的菌有:枯草杆菌、肠系膜杆菌、金黄色葡萄球菌、大肠杆菌等;普通变形杆菌的抵抗力稍强;无色杆菌、假单细胞菌的抵抗力最强。
敏感菌和抗力强的细菌之间杀灭浓度相差2倍。
也有把大肠杆菌作为抵抗力稍强的细菌。
臭氧对G-菌的效果优于G+菌,对细菌的效果优于酵母菌。
臭氧对空气中人工污染的微生物的杀灭效果较好,对自然菌的杀灭率则差。
有研究报道,用无声放电法产生的臭氧对空气中人工污染的白色葡萄球菌,作用3min,臭氧浓度为51.4mg/m3,杀灭率就达到99.99% 。
MSDS-臭氧 CAS 10028-15-6

臭氧MSDS第一部分化学品标识中文名: 臭氧英文名: ozone; triatomic oxygen第二部分成分/组成信息主要成分: 纯品CAS 号: 10028-15-6相对分子质量: 48.00分子式: O3化学类别: 空气(氧气)第三部分危险性概述危险性类别:危险性综述: 本品助燃,具刺激性。
侵入途径: 吸入。
健康危害: 本品具有强氧化能力,对眼睛结膜和整个呼吸道有直接刺激作用。
吸入后引起咳嗽、咯痰、胸部紧束感,高浓度吸入引起肺水肿。
长期接触可引起支气管炎,细支气管炎,甚至发生肺硬化。
第四部分急救措施皮肤接触:眼睛接触:吸入: 迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:第五部分消防措施燃烧性: 助燃闪点(℃): 无意义引燃温度(℃): 无意义爆炸下限[%(V/V)]: 无意义爆炸上限[%(V/V)]: 无意义最小点火能(mJ): 无意义最大爆炸压力(MPa):危险特性: 具有强氧化性。
与易燃物(如苯)和可燃物(如糖、纤维素等)接触会发生剧烈反应,甚至引起燃烧。
受热、接触明火、或受到摩擦、震动、撞击时可发生爆炸。
灭火方法: 本品不燃。
消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
迅速切断气源,用水喷淋保护切断气源的人员,然后根据着火原因选择适当灭火剂灭火。
尽可能将容器从火场移至空旷处。
喷水保持火场容器冷却,直至灭火结束。
第六部分泄漏应急处理迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。
建议应急处理人员戴自给正压式呼吸器,穿防毒服。
从上风处进入现场。
尽可能切断泄漏源。
喷雾状水稀释。
漏气容器要妥善处理,修复、检验后再用。
第七部分操作处置与储存操作处置注意事项:密闭操作,全面通风。
操作人员必须经过专门培训,严格遵守操作规程。
建议操作人员佩戴自吸过滤式防毒面具(全面罩),戴化学安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。
臭氧生物活性炭技术11

A
17 饮用水深度处理应用效果
常规处理水厂氨氮处理效果
常规水处理工艺中混凝 沉淀对氨氮有一定的去 除作用,但主要靠砂滤 池微生A 物作用去除
18
饮用水深度处理应用效果
三卤甲烷生成潜能比较
预臭氧后三卤甲烷总量有所增加。
整个工艺去除三卤甲烷生成潜能的最关键部分是生物活性炭滤 池,其对三卤甲烷生成潜能的去除率达到52.9%,出水后三卤甲烷生 成潜能仅为519μg·L-1,大大降低了消毒出水中过量消毒副产物产 生的风险。
与过滤配合使用——生物活性炭前需设过滤,不能将生物活性 炭作为过滤器来运行。一般生物活性炭进水的浊度<5NTU。
换炭再生——使用一定时间后必须更换新炭,饱和炭进行就地再 A生或是外运委托再生,否则将影响出水水质。
10
工艺应用条件与设计参数
设计参数:
吸附容量(qe);高出单纯活性炭4~20倍 通水倍数(n):根据水质确定 空塔速度(LV):4-5m/h,满足足够的接触时间,微生物降解 炭层高度(Hc):一般1~2m,不宜过高 气水比:炭层内应有足够溶解氧(>1mg/L),4~6:较为合
炼油废水
隔油 浮选 生物曝气 后浮选 生物活性炭工艺。生物活性炭的吸 附容量已达到2.52 gCOD/kg炭。
A
22
其他应用——生活污水深度处理
宝钢厂采用SBR 生物活性炭工艺,分别在各厂区陆续建成十多套 800 m3/d的综合污水处理及再生装置。
A
23
已连续运行2年以上,没有更换过新炭,处理出水达到中水水质标 试验
臭氧氧化一生物活性炭的第一次联合使用是1961年在德国 Dusseldorf(杜塞尔多夫)市Amstaad水厂中开始的,它的成 功引起了德国以及西欧水处理工程界的重视。
臭氧

臭氧层空洞威胁人类生存
10多年来,经科学家研究;大气中的臭氧每减少1%。照射 10多年来,经科学家研究;大气中的臭氧每减少1 到地面的紫外线就增加2%,人的皮肤癌就增加3 到地面的紫外线就增加2%,人的皮肤癌就增加3%,还受 到白内障、免疫系统缺陷和发育停滞等疾病的袭击。现在 居住在距南极洲较近的智利南端海伦娜岬角的居民,已尝 到苦头,只要走出家门,就要在衣服遮不住的肤面,涂上 防晒油,戴上太阳眼镜,否则半小时后,皮肤就晒成鲜艳 的粉红色,并伴有痒痛;羊群则多患白内障,几乎全盲。 据说那里的兔子眼睛全瞎,猎人可以轻易地拎起兔子耳朵 带回家去,河里捕到的鲜鱼也都是盲鱼。 推而广之,若 臭氧层全部遭到破坏,太阳紫外线就会杀死所有陆地生命, 人类也遭到“灭顶之灾” 人类也遭到“灭顶之灾”,地球将会成为无任何生命的不 毛之地。可见,臭氧层空洞已威胁到人类的生存了。臭氧 层破坏对植物产生难以确定的影响。
臭氧层空洞概述
• 氧层空洞是大气平流层中臭氧浓度大量减
少的空域。臭氧层是大气平流层中臭氧浓 度最大处,是地球的一个保护层,太阳紫 外线辐射大部被其吸收。臭氧在大气中从 地面到70千米的高空都有分布,其最大浓 地面到70千米的高空都有分布,其最大浓 度在中纬度24千米的高空,向极地缓慢降 度在中纬度24千米的高空,向极地缓慢降 低,最小浓度在极地17千米的高空。20世 低,最小浓度在极地17千米的高空。20世 纪50年代末到70年代就发现臭氧浓度有减 50年代末到70年代就发现臭氧浓度有减 少的趋势。
臭氧是否越多越好?
•
大气中臭氧层对地球生物的保护作用现已广为 人知——它吸收太阳释放出来的绝大部分紫外线, 人知——它吸收太阳释放出来绝大部分紫外线, 使动植物免遭这种射线的危害。为了弥补日渐稀 薄的臭氧层乃至臭氧层空洞,人们想尽一切办法, 比如推广使用无氟制冷剂,以减少氟利昂等物质 对臭氧的破坏。世界上还为此专门设立国际保护 臭氧层日。由此给人的印象似乎是受到保护的臭 氧应该越多越好,其实不是这样,如果大气中的 臭氧,尤其是地面附近的大气中的臭氧聚集过多, 对人类来说臭氧浓度过高反而是个祸害。
臭氧的中心原子的孤电子对数

臭氧的中心原子的孤电子对数
臭氧的中心原子的孤电子对数
臭氧(ozone)是由三个氧原子组成的一种混合物,它具有臭浓的气味,是点和气态的形态,是在层地平面上的空气中的主要组分之一,在臭氧的中心原子中存在三个孤立的电子对,它们在电子结构上是隔离的。
臭氧可以有效抑制太阳光中有害的紫外线,保护大气层,维护地球生态平衡。
人类也可以利用臭氧的化学性质从而发挥多种用途,如杀菌、杀虫、杀人、杀传染病等,使得生活变得更加舒适、健康、安全。
臭氧的分子结构十分稳定,具有双重键和三重键结构,它可以阻挡大气中的氯气等有害成分,保护大气环境。
臭氧分子中有三个孤立的电子对,这些电子对在电子结构上是隔离的,有效地保护了臭氧分子免受紫外线等破坏,使臭氧能够在大气中稳定存在。
臭氧是把大气中有害成分完全吸收,完全可以抵御紫外线伤害,从而提供更大的保护,使地球大气质量得以维护。
它的存在让我们的生活变得更安全、健康和舒适。
供热臭味剂成分

供热臭味剂成分热臭味剂是指用于消除或减少物体、环境或设备散发的异味的化学成分。
它们主要用于消除火灾、炉灶、化学工厂等地方散发出的热臭味。
以下是热臭味剂的几种常见成分。
1. 臭氧(Ozone):臭氧是一种有很强氧化性的气体,可以通过氧化和分解有机物质来消除异味。
它可以通过臭氧发生器产生,通常被用于空气净化器和消毒设备中。
2. 活性炭(Activated Carbon):活性炭是一种碳材料,表面具有许多微孔和大量有机官能团。
它可以吸附有机物质,包括异味分子,从而减少它们的浓度和散发。
活性炭通常被用于空气净化器和水处理设备中。
3. 氧化剂(Oxidizing agents):氧化剂是一类具有强氧化性的化学物质,可以通过氧化异味物质来消除它们。
常见的氧化剂包括氯化氯(Chlorine bleach)、双氧水(Hydrogen peroxide)、次氯酸钠(Sodium hypochlorite)等。
这些氧化剂常用于清洁剂和漂白剂中。
4. 酶(Enzymes):酶是一类生物大分子催化剂,可以加速化学反应。
某些酶具有降解有机物质的能力,可以通过分解异味物质来消除异味。
酶通常用于清洁剂和除臭剂中。
5. 香精(Fragrance):香精是一类用于产生香气的化学物质,可以掩盖异味分子,使其不易被人察觉。
香精常被添加到空气清新剂、香氛燃烧器和洗涤剂中。
除了这些常见的成分,热臭味剂中可能还包含其他化学物质,如糖基化合物、脂肪酸盐类和硅酮等。
这些成分的选择取决于异味物质的性质和所需的除臭效果。
需要注意的是,热臭味剂是用于减少或消除异味的化学物质,而不是真正的清洁剂。
对于产生臭味的物体或环境,必要的清洁措施是不可或缺的。
热臭味剂的使用应谨慎,并遵循使用说明,以确保安全使用。
同时,热臭味剂应储存在干燥、阴凉的地方,远离火源和易燃物质。
总而言之,热臭味剂的成分包括臭氧、活性炭、氧化剂、酶和香精等。
它们的作用是消除或降低物体和环境散发的异味,从而提供更加舒适和宜人的环境。
臭氧-ozone

分布
大气臭氧(O3) 主要存在于平流层 中,平流层中臭氧 占整个臭氧总量的 90%以上,另外约 有10%存在于对流 层。O3浓度的峰值 出现在距地球表面 20~25km处,称为 臭氧层。
臭氧是氧的同素异形体分子式为o是一种具有刺激性特殊气味的淡蓝色气体分子结构呈三角形键角为116其密度是氧气的15倍在水中的溶解度是氧气的10倍臭氧是一种不稳定的气体接触热光大气中的有机物及水等容易分解成氧
大连理工大学
大连理工大学环境化学课程报告
臭氧—ozone
By--王晶、多加﹒其米格
性质、分布、D.U. 臭氧生成机理 臭氧损耗机理
人为途径——
汽车尾气排放的氮氧化物,复印机、高压电线 释放物等在一定条件下都可以转化为臭氧。其中之 一为NO2的光化学过程:
NO2 + hv NO + O (λ < 420 nm)
O + O 2 + M O3 + M
三、臭氧损耗(Ozone Depletion)机理
天然途Байду номын сангаас——
其中之一为O3 的光离解:
.
. . . . . .. . . . .. . . .. . . . . . . .. . .
.
150 1956 1960 1964 1968 1972 1976 1980 1984 1988
二、臭氧生成机理
天然途径——
平流层中O3的生成是由O2在短波紫外辐射作用 下光解引发的,主要发生在距地球表面25km以上的 大气中:
一、性质、分布和D.U.
性质
臭氧是氧的同素异形体,分子式为O3,是一种具有刺 激性特殊气味的淡蓝色气体,分子结构呈三角形,键 角为116°,其密度是氧气的1.5倍,在水中的溶解度 是氧气的10倍[1]。 臭氧是一种不稳定的气体,接触热、光、大气中的有 机物及水等容易分解成氧。臭氧是一种强氧化剂,它 在水中的氧化还原电位为2.07V,仅次于氟(2.5V), 其氧化能力高于氯(1.36V)和二氧化氯(1.5V)因 此具有消毒、杀菌、除臭、防腐等作用[2]。
臭氧
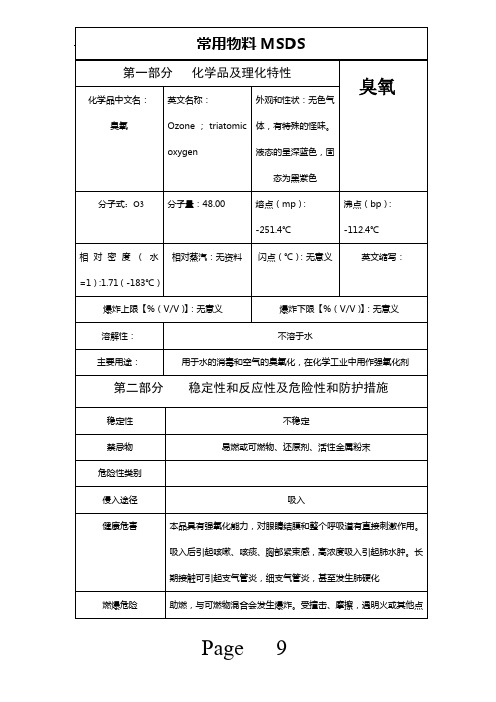
第一部分
化学品中文名: 臭氧
化学品及理化特性
外观和性状:无色气 体,有特殊的怪味。 液态的呈深蓝色,固 态为黑紫色 熔点(mp) : -251.4℃ 闪点(℃) :无意义
英文名称: Ozone ; triatomic oxygen 分子量:48.00 相对蒸汽:无资料
臭氧
分子式:O3 相 对 密 度 ( 水 =1):1.71(-183℃)
燃爆危险 皮肤接触 眼睛接触 吸入 食入 灭火方法 操作注意事项
储存注意事项
Page
9
吸入 本品具有强氧化能力,对眼睛结膜和整个呼吸道有直接刺激作用。 吸入后引起咳嗽、咳痰、胸部紧束感,高浓度吸入引起肺水肿。长 期接触可引起支气管炎,细支气管炎,甚至发生肺硬化 助燃,与可燃物混合会发生爆炸。受撞击、摩擦,遇明火或其他点 火源极易爆炸。 不会通过该途径接触 不会通过该途径接触 迅速脱离现场至空气新鲜处,保持呼吸道通畅,如呼吸困难,给吸 氧,就医 不会通过该途径接触 本品不燃,根据着火原因选择适当灭火剂灭火。 密闭操作,全面通风,操作人员必须经过专门培训,严格遵守操作 规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩) ,戴化学 安全防护眼镜,穿防毒物渗透工作服,戴橡胶手套。 本品不宜储存,现产现用。
沸点(bp) : -112.4℃ 英文缩写:
爆炸上限【%(V/V):无意义 】 溶解性: 主要用途:
爆炸下限【%(V/V):无意义 】 不溶于水
用于水的消毒和空气的臭氧化,在化学工业中用作强氧化途径 健康危害
稳定性和反应性及危险性和防护措施
不稳定 易燃或可燃物、还原剂、活性金属粉末
臭氧基础知识培训

一、臭氧基础知识1.什么是臭氧臭氧(O3)英文臭氧(Ozone)臭氧又名活氧或强氧,分子符号O3,英文名称OZONE;常温、常压下无色,有特臭的气味,其浓度高时呈淡蓝色,具有强氧化作用;液态臭氧深蓝色,固态臭氧紫黑色。
2.臭氧特性:臭氧性质比氧(O2)活泼,比重为氧气的1.7倍,氧化能力仅次于氟,杀菌率为氯的3000倍。
臭氧能于短时间内将空气及水中的浮游细菌消灭,并能中和、分解各种有毒物质,去除一切恶臭,并能漂白澄清水中污染杂质。
3.臭氧性质物理性质:在常温常压下,较低浓度的臭氧是无色气体,当浓度高(达到 15%)时,呈现出淡蓝色。
臭氧可溶于水,在常温常压下臭氧在水中的溶解度比氧高约13倍,比空气高25倍。
性状:气态臭氧厚层带蓝色,有刺激性腥臭气味,浓度高时与氯气气味相像;液态臭氧深蓝色,固态臭氧紫黑色.化学性质:臭氧很不稳定,在常温下即可分解为氧气。
臭氧、氯和二氧化氢,臭氧在处理水中是氧化力量最强的一种.臭氧极易分解,很不稳定.它不溶于液态氧,四氯化碳等.有很强的氧化性,在常温下可将银氧化成氧化银,将硫化铅氧化成硫酸铅。
比较:O2:无色无味、易燃、稳定O3:淡蓝色、腥臭味、不稳定、易还原成O24.人工产生臭氧的方法分为:光化学、电化学、原子辐射和电晕放电4.1光化学法:即紫外光使氧气分子O2分解并聚合成臭氧O3,大气上空的臭氧就是由此产生。
4.2电化学法:利用直流电源电解含氧电解质产生臭氧气体的方法4.3电晕放电法:利用交变高压电场使含氧气体产生电晕放电,电晕中的自由高能电子离解O2分子,经三体碰撞反应又聚合成O3分子,即:O2+e-1 2O+e—1O+O2+M O32+Me-1—自由高能电子M-气体中任何其他气体分子由于电晕放电型臭氧发生器相对能耗较低,单机臭氧产量大,所以市场占有率最高.二、臭氧发生器的结构与类型1.电晕放电型臭氧发生器基本构成有:高压电极、地电极、介电体与放电气隙四部分.2.电晕放电器件按形状分为:管式和板式;管式:玻璃管、陶瓷管和搪瓷管板式:陶瓷片但因散热效果和使用寿命等因素,玻璃管和陶瓷片都渐渐被淘汰了各种臭氧管质的分别、优缺点、广泛应用场合。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
㈠、NOx
NOx的来源:
平流层中NO、NO2的主要天然来源是N2O的转化:
人为来源是超音速飞机排放的NO。
NOx损耗臭氧:
(二)、HOx
HOx的来源:
平流层HOX主要是由H2O, CH4 或H2与激发态O反应而生成 的:
HOx损耗臭氧:
(三)、ClOx
ClOx的来源:
平流层中ClOx的天然来源是海洋生物产生的CH3Cl:
与
动态平衡:上述过程中,O3
生成和耗损的速率相同,臭
氧的浓度保持恒定(臭氧层 没被污染)。
人为途径——
臭氧层耗损
Ozone Depletion
由于水蒸气、 NOx、氟氯烃等 污染物进入平流 层,它们能加速
假设可催化臭氧分解的物质为Y,则有如下反应:
臭氧耗损过程,
破坏臭氧层的稳 定状态。
已知的Y物种有:
CH3Cl+hv
• C H3+ • Cl
人为来源是制冷剂,如F-11(CFCl3)和F-12(CF2Cl2), 它们在波长175-220 nm的紫外光照射下会产生•Cl:
ClOx损耗臭氧:
Thank you!
D.U.
20世纪80年代中期, 人们发现南极春季臭 氧层浓度大幅度下降 ,形成了所谓的“臭 氧洞”。 通常用D.U.表示臭氧 层的厚度,并将0。C 标准海平面压力下, 10-5m后的臭氧定义为 1D.U.
Total ozone (Dobson units)
350 325 300 275 250 225 200 175
人为途径——
汽车尾气排放的氮氧化物,复印机、高压电线 释放物等在一定条件下都可以转化为臭氧。其中之 一为NO2的光化学过程:
NO2 + hv NO + O (λ < 420 nm)
O + O 2 + M O3 + M
三、臭氧损耗(Ozone Depletion)机理
天然途径——
其中之一为O3 的光离解:
大连理工大学
大连理工大学环境化学课程报告
臭氧—ozone
By--王晶、多加﹒其米格
性质、分布、D.U. 臭氧生成机理 臭氧损耗机理
一、性质、分布和D.U.
性质
臭氧是氧的同素异形体,分子式为O3,是一种具有刺 激性特殊气味的淡蓝色气体,分子结构呈三角形,键 角为116°,其密度是氧气的1.5倍,在水中的溶解度 是氧气的10倍[1]。 臭氧是一种不稳定的气体,接触热、光、大气中的有 机物及水等容易分解成氧。臭氧是一种强氧化剂,它 在水中的氧化还原电位为2.07V,仅次于氟(2.5V), 其氧化能力高于氯(1.36V)和二氧化氯(1.5V)因 此具有消毒、杀菌[2]苑宝玲,王洪杰.《水处理新技术与应用》.2006.
分布
大气臭氧(O3) 主要存在于平流层 中,平流层中臭氧 占整个臭氧总量的 90%以上,另外约 有10%存在于对流 层。O3浓度的峰值 出现在距地球表面 20~25km处,称为 臭氧层。
.
. . . . . .. . . . .. . . .. . . . . . 1968 1972 1976 1980 1984 1988
二、臭氧生成机理
天然途径——
平流层中O3的生成是由O2在短波紫外辐射作用 下光解引发的,主要发生在距地球表面25km以上的 大气中:
