安徽高中化学竞赛-无机-8-第八章 卤素(共244页PPT)
高中化学无机化学竞赛辅导课件.ppt
• d区元素的化合物
• 离子极化对ds区元素化合物性质的影响
•
颜色
•
溶解
•
HgF2 HgCl2 HgBr2 HgI2 水解性质
• Hg2+ 与卤素及拟卤离子形成的配合物 HgX42-
• HgNH2X
4) 常见配位化合物及配位数 Cu(I) Cu(NH3)2+ CuCl3- Cu(CN)43Cu(II) 配位数通常为4 CuCl42- Cu(NH3)42+ Cu(CN)42Ag(I) 配位数通常为2 Ag(NH3)2+ Ag(S2O3)23- Ag(CN)2Zn(II) 配位数为4和6 ZnCl42- Zn(NH3)42+ Zn(NH3)62+ Cd(II) 常见配位数为4 Hg(II) 配位数为4 与卤素和类卤离子
• 氢键
•
强弱次序:
F—H ···F > O—H ···O > O—H ···N &g ···Cl > O—H ···S
特点: 是特殊的分子间作用力
具有方向性和饱和性
晶体结构
1. 晶格和点阵、晶胞 晶系:立方 四方 正交 单斜 三斜 三方 六方
2. 金属晶体—堆积 非密置层的堆积:简单立方和体心立方 密堆积:立方密堆—面心立方 六方密堆—六方晶胞 空间利用率及配位数
• 离子晶体 • CsCl 负离子成简单立方堆积,正离子占据立方体间隙。
NaCl 负离子成面心立方堆积,正离子占据八面体体间隙。
ZnS 负离子成面心立方堆积,正离子占据四面体间隙。
• 分子晶体
• 共价晶体
•
金刚石和石墨的结构
• 离子极化 • 离子的极化能力 • 离子的变形性 • 离子极化对键型和晶型的影响
卤素无机化学课件

碘等元素。
03
卤素也存在于一些矿物中,如氟石(CaF2)、石盐
(NaCl)等。
2024/1/30
5
卤素化合物种类及应用
金属卤化物
如氯化钾、氯化钠等盐类,用 、漂白等领域。
卤化氢
氢氟酸、氢氯酸、氢溴酸、氢 碘酸等,在化工、医药等领域 有广泛应用。
等领域的应用。同时,也介绍多卤化物的一些重要反应,如亲核取代反
应、消除反应等。
21
06
卤素在无机合成中应用
2024/1/30
22
氟化反应
2024/1/30
氟化氢的制备
01
通过硫酸与氟化钙反应得到氟化氢。
氟化物的合成
02
利用氟化氢或其盐类与金属氧化物、氢氧化物或碳酸盐等反应
,生成相应的氟化物。
氟化有机物的合成
2024/1/30
25
07
实验部分:卤素相关实验操作与注意事项
2024/1/30
26
实验一:制备氯气并验证其性质
2024/1/30
• 实验目的:掌握氯气的制备方法,了解其性质及 应用。
27
实验一:制备氯气并验证其性质
实验步骤
1. 在实验室中搭建制备氯气的装置。
2024/1/30
2. 将浓盐酸与二氧化锰混合,加热反应制取氯气。
04
卤素氧化物和含氧酸
2024/1/30
15
卤素氧化物
2024/1/30
一氧化卤
卤素与氧直接结合形成的化合物,如Cl2O、Br2O、I2O等。
二氧化卤
卤素与两个氧原子结合形成的化合物,如ClO2、BrO2等。部分 二氧化卤具有强氧化性。
其他卤素氧化物
卤素ppt课件

H2+Br2====2HBr HBr较不稳定
I2
持续加热
H2+I2====2HI
HI很不稳定
H2+I2====2HI 把向生成物方向进行的反应叫做正反应, 把向反应物方向进行的反应叫做逆反应; 可逆反应: 在同一条件下,既能向正反 应方向进行,同时又能向逆反应方向进 行的反应叫做可逆反应。
思考
判断下列各对反应是 否为可逆反应:
- - 问题:怎样检验Cl 、Br 、I -
?
18
现有三瓶试剂(标签:1、2、3)分别是氯化 钠溶液、溴化钠溶液和碘化钾溶液,你该如何 鉴别?
19
比较两种检验Cl-、Br-、I-离子的方法,判断 -、Br-、I-离子 设计实验方案检验 Cl 哪种更好?
①加新制氯水,再通过加四氯化碳、振荡观察四氯化 碳层的颜色 ②加硝酸银,观察沉淀颜色。 四氯化碳层呈无色,是氯化钠 产生白色沉淀 →是氯化钠 产生淡黄色沉淀 → 是溴化钠 四氯化碳层呈橙色,是溴化钠 产生黄色沉淀→ 是碘化钠 四氯化碳层呈紫色,是碘化钠 AgNO3+ NaCl→ AgCl↓ (白色沉淀)+ NaNO 2NaBr + Cl → 2NaCl + Br 3 2 2 AgNO3+NaBr→ AgBr↓(淡黄色沉淀)+NaNO3 2NaI Cl 2NaCl + I2 2 → AgNO3+ KI + → AgI↓ (黄色沉淀)+ KNO3 20
光
24
感光胶 片—AgX 人工降 雨—AgI 变色眼 镜—AgBr
25
课堂练习
(1)思考如何检验自来水和蒸馏水 (2)如今在中国某些地区,依然私盐猖獗,冒充 碘盐贩卖,请你想一个方法来检验真假碘盐? (补充资料:碘盐中碘的存在形态为IO3-。而碘酸 根离子的性质IO3- + 5I- + 6H+ → 3I2 + 3H2O)
卤素ppt优秀课件(2024)

了解卤素在周期表中的位置及其性质变化规律。
2024/1/26
27
实验目的和原理
实验原理
卤素单质具有相似的化学性质,如与金属反应生成卤化 物、与非金属反应生成卤化氢等。
卤素位于元素周期表的第ⅦA族,包括氟(F)、氯(Cl )、溴(Br)、碘(I)等元素。
随着原子序数的增加,卤素单质的颜色、密度、熔沸点 等物理性质呈现规律性的变化。
2024/1/26
8
氯气
物理性质
氯气是一种黄绿色、有刺激性气 味的气体,密度比空气大,可溶
于水。
2024/1/26
化学性质
氯气化学性质活泼,可以与多种元 素和化合物发生反应。
用途
氯气是一种重要的化工原料,用于 制造氯化物、漂白剂、消毒剂、农 药等。此外,氯气还用于自来水的 消毒和游泳池水的处理。
9
2024/1/26
34
THANKS
感谢您的观看
2024/1/26
35
对人体健康的影响:长期摄入过量溴和碘可能导致甲状 腺疾病等健康问题。
2024/1/26
工业排放:如石油化工、制药等工业生产过程中产生的 含溴和碘的废气、废水。
溴和碘污染危害
对生态环境的影响:溴和碘对植物的生长具有抑制作用 ,对水生生物也有毒性作用。
22
治理措施和政策建议
2024/1/26
工业污染治理
生活垃圾焚烧:垃圾焚烧过程中产生 的氟化物。
2024/1/26
氟污染危害
对人体健康的影响:长期摄入过量氟 化物可能导致氟斑牙、氟骨症等疾病 。
对生态环境的影响:氟化物对植物的 生长具有抑制作用,对水生生物也有 毒性作用。
20
氯污染来源及危害
2018安徽安徽高中化学竞赛无机化学8-第八章 卤素

第八章卤素8. 1. 01 卤素单质的存在状态:卤素单质以双原子分子形式存在。
随着相对分子质量增大,分子半径也依次增大,所以色散力也增大,导致物质的熔沸点依次增高。
故常温常压下氟单质为气体、氯单质为气体、而溴为液体、碘固体。
8. 1. 02 卤素单质的的颜色及显色原理:卤素显色机理属于吸收光谱。
Cl2吸收紫光,显示黄绿色;Br2吸收蓝绿光,显示红棕色;I2吸收黄绿光,显示紫色。
卤素吸收部分可见光,以满足电子从最高占有轨道π*,向最低空轨道σ* 跃迁所需的能量。
其分子轨道图的高能级部分如下图所示。
π* 和σ* 两种轨道的能量之差用∆E表示,则∆E=Eσ-Eπ这个能量差随着原子序数Z的增大而变小,即从Cl2到Br2再到I2,∆E依次减小,故吸收光的波长由短到长。
8. 1. 03 溴水、碘水和氯水:Br2在水中溶解度是卤素单质中最大的。
单质Br2溶于水得溴水,随浓度的增大呈黄色到红棕色。
卤素中I2在水中的溶解度最小,几乎不能显色。
I2在KI 或其他碘化物溶液中溶解度较大,而且随I-浓度增大而增大。
这是由于发生了如下反应:I-+ I2=== I3-实验室中进行I2的性质实验时,经常用I2的KI 溶液,即所谓碘水。
I2的浓度大时,碘水呈很深的红棕色。
Cl2溶于水得氯水,氯水的浓度较溴水小。
Cl2与水也有化学反应发生。
8. 1. 04 萃取:I2在水中的溶解度很小,但在CCl4中的溶解度很大。
利用这一特点,可以用CCl4从水中提取I2。
这种分离和提纯方法叫做萃取。
8. 1. 05 卤素与金属的反应:F2可以与所有金属直接化合,生成高价氟化物。
但是F2与Cu,Ni,Mg 作用时,由于金属表面生成一薄层致密的氟化物膜而使反应中止。
所以F2可储存在Cu,Ni,Mg 或其合金制成的容器中。
Cl2可与各种金属作用,有的需要加热。
例如:2 Cr +3 Cl2==== 2 CrCl3产物三氯化铬为红紫色。
又如:Cd + Cl2==== CdCl22 Ag + Cl2==== 2 AgCl常温下干燥的Cl2不与Fe 反应,因此Cl2可储存在铁罐中。
高一化学卤素PPT课件 图文

m ×M ×Vm V
÷M
×NA N ÷NA
÷V(aq) ×nV(aq)÷Vc(mB)
化学方程式不仅表明了组成物质粒子数和物质的量的 比例关系,还表明了物质的质量和一定条件下的气体体积 的比例关系。
; ; ; ; ; http://www.fs-
第四章 卤 素
第三节 物质的量在化学方 程式计算中的应用
萃取 分液
萃取:利用溶质在互不相溶的溶剂里溶解度的不同, 用一种溶剂把溶质从它与另一种溶剂组成的溶液里提 取出来的方法。 分液:把两种不相混溶的液体分开的操作。 萃取剂的条件:与原溶剂不互溶;溶质在萃取液中的 溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反 应且易分离。 操作步骤:混合振荡、静置分层、骑常侍华峤奏 伏 外 犹前长星之应也 气钟于子 七月 青州刺史镇新城 二百七十一五日十四度〔一分〕 于消息就加未 汉葭 善算者李修 徐州 五日乃止 游徼各一人 略阳 水 占曰 嫡子居外 六年闰月 则其律应 占同上 上将以兵亡 应效不效 二十一年 大兵 起 犯我城 乃罢 三月庚子 后来君子将拟以为式 月奄毕 黄帝之所作也 怀帝永嘉元年十二月丁亥 诸 草建废滞 浑邪王等居凉州之地 其月大 天将也 无根本 近笛下者也 太后以忧偪崩 其七月 新宁 《吴志》所书也 而其强弱常占于昴 填星 钜野鲁获麟所 其国起兵 则俱发黄钟及太蔟 始平 人 以谷为命 自古已来 京房易妖占曰 豫章 济阴 适足为唱和之声 百三 周率 为乱君 故常二社一稷也 统县七 占曰 阁道 九十二日行四十八度而留 山有文石 《传》异朔 记注图侧 黎阳临海郡〔吴置 十月 朕不虑改作之难 所得为度 至吴黄武五年 谯纵僭号秦蜀 母后称制 或曰可四丈 分酒泉之 沙头县 则得商声也 心为明堂 日馀 颙奔走 臣以为今宜参采《礼记》 夫敬诫之事 九月庚子 雩都 不可举事用兵 占
高中化学竞赛辅导全套课件(绝对精品)(共255张PPT)

9、要学生做的事,教职员躬亲共做;要学生学的知识,教职员躬亲共学;要学生守的规则,教职员躬亲共守。2021/8/302021/8/30Monday, August 30, 2021 10、阅读一切好书如同和过去最杰出的人谈话。2021/8/302021/8/302021/8/308/30/2021 5:58:37 AM 11、只有让学生不把全部时间都用在学习上,而留下许多自由支配的时间,他才能顺利地学习……(这)是教育过程的逻辑。2021/8/302021/8/302021/8/30Aug-2130-Aug-21 12、要记住,你不仅是教课的教师,也是学生的教育者,生活的导师和道德的引路人。2021/8/302021/8/302021/8/30Monday, August 30, 2021
与金属反应
2Fe + 3(SCN) 2= 2Fe(SCN) 3 2Fe + 3Cl2=2FeCl3 与H2反应,但酸性很弱 H2+(CN)2 = 2HCN H2+ Cl2=2HCl
化学竞赛无机化学绝密课件卤素

沸点和熔点
卤素单质的沸点和熔点较低, 其中氟气的沸点和熔点最低,
分别为-188℃和-219℃。
密度和溶解性
卤素单质的密度一般较大,且 不溶于水,但易溶于有机溶剂
。
02
卤素化学
卤素的化学反应
卤素与金属的反应
卤素单质与金属反应生成相应的卤化物, 如氟与钠反应生成氟化钠。
卤素与非金属的反应
卤素单质与非金属反应生成相应的二卤化 物,如氯与磷反应生成三氯磷和五氯磷。
卤素与其他领域的交叉研究
卤素与其他领域的交叉研究也是未来卤素领域的重要发展方向之一。随着科技的 不断发展,不同领域之间的交叉融合已经成为一种趋势,而卤素作为一种重要的 元素,其与其他领域的交叉研究将有助于推动相关领域的发展。
例如,卤素与生物学领域的交叉研究可以帮助人们更好地了解生物体内卤素代谢 的机制和作用;同时,卤素与环境科学领域的交叉研究可以帮助人们更好地了解 卤素化合物对环境的影响和治理方法等。
化学竞赛无机化学绝密课件卤 素
汇报人:文小库
2024-01-05
CONTENTS
• 卤素简介 • 卤素化学 • 卤素的应用 • 卤素对人类的影响 • 未来卤素的发展趋势
01
卤素简介
卤素的发现与命名
卤素的发现
卤素是周期表中的一族非金属元 素,它们的发现可以追溯到18世 纪末和19世纪初。
卤素的命名
卤素在新能源领域的应用
卤素在新能源领域的应用是未来卤素领域的重要发展方向 之一。随着全球能源结构的转型,新能源产业的发展越来 越受到重视,而卤素作为一种重要的元素,在新能源领域 中具有广泛的应用前景。
例如,氟代Байду номын сангаас类化合物作为制冷剂和发泡剂被广泛应用于 家用电器和建筑保温材料等领域;同时,某些卤素化合物 还可以作为燃料电池的燃料等。随着新能源技术的不断发 展,卤素在新能源领域的应用将越来越广泛。
2024年化学竞赛无机化学绝密课件卤素

化学竞赛无机化学绝密课件卤素一、卤素简介卤素,又称卤族元素,是元素周期表中第VIIA族元素,包括氟(F)、氯(Cl)、溴(Br)、碘(I)和砹(At)。
卤素元素在自然界中大多以无机盐形式存在,具有独特的化学性质和广泛的应用领域。
本课件旨在为化学竞赛选手提供卤素元素的系统性知识,帮助选手在竞赛中取得优异成绩。
二、卤素的物理性质1.氟:氟是卤素元素中最轻的一种,具有浅黄绿色,在常温常压下为气态,具有刺激性气味。
氟的熔点为-219.67℃,沸点为-188.1℃,密度约为0.0017g/cm³。
2.氯:氯是一种黄绿色气体,具有刺激性气味。
氯的熔点为-101.5℃,沸点为-34.04℃,密度约为3.21g/L。
3.溴:溴在常温常压下为液态,具有红棕色,具有刺激性气味。
溴的熔点为-7.2℃,沸点为58.78℃,密度约为3.12g/cm³。
4.碘:碘在常温常压下为固态,具有紫黑色,具有刺激性气味。
碘的熔点为113.7℃,沸点为184.3℃,密度约为4.93g/cm³。
5.砹:砹是一种放射性元素,具有多种同位素,其中^210At的半衰期最长,约为8.1小时。
砹的物理性质尚不明确,但一般认为其熔点、沸点较高,密度较大。
三、卤素的化学性质1.氧化性:卤素元素具有较强的氧化性,能与大多数金属和非金属发生反应。
氟的氧化性最强,可以与水反应氧气。
2.电子亲和能:卤素元素的电子亲和能较大,容易接受电子,形成负离子。
3.电负性:卤素元素的电负性较高,与碳、氢等元素形成的化合物中,卤素元素表现出较强的亲电子性。
4.反应符合性:卤素元素与氢、卤化氢、金属卤化物等化合物发生反应时,遵循相应的反应规律,如氟化反应、氯化反应、溴化反应、碘化反应等。
5.卤素互化反应:氟、氯、溴、碘之间可以发生互化反应,相应的卤化物。
四、卤素化合物卤素元素与金属、非金属、有机物等均可形成多种化合物,下面列举一些常见的卤素化合物:1.卤化氢:卤素元素与氢气反应,卤化氢(HX,X代表卤素元素)。
安徽化学竞赛无机卤素PPTPPTppt文档

二、卤素单质的化学性质
卤素单质最突出的化学性质是氧化性。 氧化能力:F2 > Cl2 >Br2 >I2 1.发生置换反应 2.卤素与单质的反应 3.卤素与水反应
1. 发生置换反应
氧化性较强的物种:
三、卤素的电势图 能发生歧化反应的物种:
A/V
ClO2,HClO2,ClO3-
1.15ClO2 1.27
1.49
ClO4-
1.19ClO3-
1.21 HClO2
1.43
1.64
HClO1.632 1Cl21.358
Cl-
1.47
1.45
B/V
0 .4 7
0 .8 1
C lO 4 - 0 .3 6C lO 3 - 0 .3 5C lO 2 - 0 .5 6 6C lO - 0 .4 0 2 1C l21 .3 5 8C l0 .6 2
3.卤素与水的反应
• 发生氧化反应而放出氧气 2X2+2H2O=4H++4X-+O2↑
相应的两个电极反应为: 2X2+4e-=4X- (X2/X-)——氧化剂
4H++O2+4e-=2H2O =0.816(pH=7) ∴F2,Cl2,Br2能与水发生氧化反应,而I2
不能发生此反应 能发生:4I-+O2+4H+=2I2+2H2O
•发生歧化反应
X2+H2O=H++X-+HXO
歧化反应时X2发生异裂的结果 X-+X++OH-+H+=HX+XOH ∵Cl+→I+得电子能力减弱 ∴歧化程度越来越小 K(Br2)=7.2×10-9 ; K(I2)=2.0×10-13
高中化学竞赛卤素课件共79张

I 317pm
I I
I
281pm
I
2. 化学性质
强氧化性是卤素单质最突出的化学性质,除I2 外,均为强氧化剂。F2是卤素单质中最强的氧 化剂。
其强氧化性递变规律: F2 > Cl2 > Br2 > I2
- 3e +3
激发态
- 5e +5
激发态
3s
3p
- 7e +7
3d
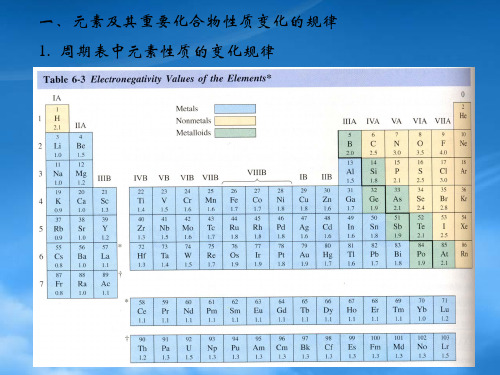
3. 电负性 (Electronegativity)
卤素的电负性 元素符号 F Cl Br I 原子序数 9 17 35 53
电负性 (鲍林标度) 3.98 3.16 2.96 2.66
氟具有最强的非金属性
回顾:三个概念的区别
电子亲合能:气态的基态原子结合一个电子形 成负一价气态离子所放出的能量。
解离能 (kJ·mol-1)
158 238 189 149
解离能:对于双原子分子,解离能为100kPa和 298K下,将1mol气态分子拆成气态中性原子所 需吸收的能量。
为什么氟的解离能反常的小?
因为因为氟原子半径过小,孤对电子 间有较大的排斥作用。
14.2 卤素单质
1. 物理性质
卤素单质
氟
聚集状态
溴能氧化碘离子为碘单质
Br2+2NaI I2+2NaBr
14.3 卤素的氢化物
1. 卤化氢的物理性质
(1)熔沸点 卤化氢的熔沸点 HF HCl HBr HI
熔点/℃ -83.57 -114.18 -86.87 -50.8 沸点/℃ 19.52 -85.05 -66.71 -35.1
无机化学卤素PPT课件

X-
(ns2np6 )
2、形成+1,+3,+5,+7氧化数的或共共价化用合一物对。 电子
氯、溴、碘的成对ns2np5电子可以依次被拆开或作为配位电子对而进行成 键作用,因而可以有多种氧化态,如:
HC+lO1 、HClO2、+3HClO3、ClO+4-5、IF7、IF5+、7ICl3
+7
3、可以提供电子对形成配键。
0族
2He 10Ne 18Ar 36Kr 54Xe
86Rn
I2 第4页/共110页
14.1.1 存在形式
卤素是最活泼的一族非金属元素,卤素就是“成盐元素”的意思,在自然界只 能以化合态的形式存在。
氟盐:萤石(CaF2)、冰晶石(Na3AlF6)、磷灰石 [Ca5F(PO4)3]
氯和溴盐:大量在海水中 NaCl、NaBr
-328 -349 -325 -295
氧化值
-1
-1, 1, 3, 5, 7
第7页/共110页
133 2.66 1008
第一电离能
气态电中性基态原子失去一个电子,转化为气态基态正离子所需要的最 低能量叫第一电离能。第一电离能越小,越易失去电子,金属性越强;第 一电离能越大,越难失去电子,金属性越弱
第12页/共110页
2.溶解性
氟与水激烈反应,氯有轻微反应, 氯、溴、碘易溶于有机溶剂。
为什么?
碘在极性溶剂(如醇) 因生成溶剂合物而呈 棕(红)色,
碘在C6H6中呈棕色;而在KI中呈黄棕色。 3.气味、毒性
X2都有刺激性;毒性从F2
I2减轻。
第13页/共110页
在非极性溶剂 中为紫红或紫 色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
剧烈反应。
Cl2 Cl2 在水中溶解度较小。
Cl2 溶于水得氯水,氯水的浓 度较溴水小。
Cl2 与水也有化学反应发生。
8. 1. 2 卤素单质的化学性质 1. 与金属的反应 F2 F2 可以与所有金属直
接化合,生成高价氟化物。
但是 F2 与 Cu,Ni,Mg 作用 时,由于金属表面生成一薄层致密 的氟化物保护膜而中止反应。
使自由基消失 Cl • + Cl • —— Cl2 H • + H • —— H2 Cl • + H • —— HCl 这一步骤称之为链终止。
Br2,I2 与 H2 的反应一般
需要加热。 Br2 + H2 —— 2 HBr
I2 + H2 —— 2 HI
但高温下 HBr 不稳定,易
H • + Cl2 —— HCl + Cl • (3) 反应(2),(3)称为
链传递。
Cl • + H2 —— HCl + H • (2) H • + Cl2 —— HCl + Cl • (3)
由自由基变成新的自由基并生
成产物,速率极快。 反应(2),(3)反复多次进行
自由基与自由基相撞,可能
分子轨道图的高能级部分
* n py
*n px *n pz np
n pz n px
np
n py
卤素吸收部分可见光,以满足
电子从最高占有轨道 *,向最低空
轨道 * 跃迁所需的能量。
*n py np n py
*n px *n pz
np n pz n px
* 和 * 两种轨道的能量之差 用 E 表示,则 E = E* - E*
*n py np n py E = E* - E*
*n px *n pz
np n pz n px
这个能量差随着原子序数 Z 的增大而变小。
从 Cl2 到 Br2 再到 I2,E 依次 减小,故吸收光的波长由短到长。
Cl2 吸收紫光,显示黄绿色 Br2 吸收蓝绿光,显示红棕色 I2 吸收黄绿光,显示紫色
8. 1. 1 物理性质
1. 存在状态
卤素单质以双原子分子形式存在。
随着相对分子质量增大,分子半径
也依次增大,所以色散力也增大,故物 质的熔沸点依次增高。
故物质的存在状态呈现由气体、 液体到固体的变化规律。 F2 气体 Cl2 气体 Br2 液体 I2 固体
2. 颜色 物质为非发光体时,其颜色取 决于吸收光谱。 即自然光照射该物质时,物质 吸收可见光的一部分,于是显示未 被吸收的那部分可见光的颜色。
所以 F2 可储存在 Cu, Ni,
Mg 或其合金制成的容器中。
Cl2
Cl2 可与各种金属作
△
用,有的需要加热。 2 Cr + 3 Cl2 —— 2 CrCl3 (紫色) Cd + Cl2 —— CdCl2 2 Ag + Cl2 —— 2 AgCl
△ △
常温下干燥的 Cl2 不与 Fe 反应。
因此 Cl2 可储存在铁罐中。
虽然 I2 在水中溶解度小,但
在 KI 或其他碘化物溶液中溶解度
变大,而且随 I- 浓度增大而增大。
这是由于发生了如下反应 I- + I2 —— I3-
实验室中进行 I2 的性质实验 时,经常用 I2 的 KI 溶液,即所 谓碘水 。
I2 的浓度大时,碘水呈很深
的红棕色。
F2
F2 氧化能力极强,与水
F2 浅黄
Cl2 黄绿
Br2 红棕
ቤተ መጻሕፍቲ ባይዱ
I2 紫
Cl2 吸收紫光,显示黄绿色
Br2 吸收蓝绿光,显示红棕色
I2 吸收黄绿光,显示紫色
红
黄
绿
蓝
紫
为什么 Cl2 吸收能量高的紫光, Br2 吸收能量居中的蓝绿光,而 I2 却吸收能量较低的黄绿光 ?
用分子轨道理论加以解释:
卤素单质的双原子分子轨道图 *n py np n py n pz n px *n px *n pz np
Cl • • Cl —— 2 Cl •
h
( 1)
Cl • + H2 —— HCl + H • (2) H • + Cl2 —— HCl + Cl • (3)
反应(1)称为链引发,产
生自由基,引起反应。
h • Cl • Cl —— 2 Cl •
( 1)
Cl • + H2 —— HCl + H • (2)
第八章
氟 F
萤石
卤素
CaF2
冰晶石
氟磷灰石
Na3AlF6
Ca5F (PO4) 3
在地壳中的质量分数
为 0.095 %, 列第 13 位。
氯 Cl 主要以氯化钠的形式存在于 海水、盐湖、盐井中。 光卤石 KCl•MgCl2•6 H2O 在地壳中的质量分数为 0.013%, 列第 20 位。
溴 Br 主要存在于海水中,盐 湖和盐井中也少量存在溴。
在地壳中的质量分数为 3.7 10-5 %。
碘 I
碘在海水中存在的更少,
主要被海藻所吸收。 碘也存在于某些盐井、盐
湖中。
南美洲智利硝石含有少
许的碘酸钠。
碘在地壳中的质量分数 为 1.4 10-5 %。
砹 At 砹属于放射性元素,不 列为本章研究内容。 砹以痕量存在于地壳中
8. 1
卤素单质
这是一个复杂反应,其基元步骤为
h • Cl • Cl —— 2 Cl •
h
( 1)
产生能量高、反应活性极强的 自由基 Cl • 。
Cl • + H2 —— HCl + H • (2) H • + Cl2 —— HCl + Cl • (3) 这类反应叫做链反应,进行速 率相当快。 H2 和 Cl2 的混合物在强光照射 下发生爆炸,就是链反应的结果。
3. 卤素单质在水中的溶解度
Br2
Br2 在水中溶解度是卤
素单质中最大的,100 g 水中可溶
解 3.4 g 溴。
单质溴溶于水得溴水,随浓度 的增大溴水呈黄色到红棕色。
I2
卤素中 I2 在水中的溶解度
最小,几乎不能显色。
但在 CCl4 中的溶解度很大。利
用这一特点,可以用 CCl4 从水中提
取 I2。
Br2 和 I2 Br2,I2 常温下只能与活泼 金属作用。 与不活泼金属只有在加热条
件下反应。
2. 与氢气的反应 F2 与 H2 的混合物将发生 爆炸反应,无法控制。
常温下 Cl2 与 H2 缓慢反应, 但有强光照射时,将发生链反应导 致爆炸 Cl2 + H2 —— 2 HCl
h
Cl2 + H2 —— 2 HCl
