第六单元课题三二氧化碳和一氧化碳(第2课时)
27 第六单元课题三 二氧化碳和一氧化碳 第二课时
现象:
化学方程式:
2、一氧化碳的还原性
实验步骤:
现象:
化学方程式:
注意事项:
[设问]该实验装置不同于碳还原氧化铜装置的一个主要部位是:用酒精灯点燃尾气。为什么?
讨论:在做一氧化碳还原氧化铜的实验时,应如何处理尾气,减少对大气的污染?请对一氧化碳还原氧化铜的装置进行改进。
四、小结反思
深州市第二中学导学案主备人:王玉倩
课题
课题3二氧化碳和一氧化碳
第2课时(总27课时)
教
材
分
析
知识与
地位
本节课位于第六单元课题3,在此之前,我们已经学习了碳燃烧的反应,知道碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳,这些都为本节课的学习起到了铺垫的作用;通过实验探究推导出一氧化碳的性质及在生产生活中的运用,可以进一步强化学生学习化学的科学方法,同时也为后续元素化合物的学习奠定坚实的基础。
1、小结本节课所学内容,完善知识树。
2、评选优胜小组。
五、布置作业
1、在一氧化碳还原氧化铜发的实验中还可以怎样改进实验尾气装置?
2、课本123页1、7、8
创设情境,激发学生学习兴趣
提高课堂教学的高效性
培养学生自学和总结能力
激发学生学习兴趣
培养学生观察能力和语言表达能力
激发学生学习兴趣
培养学生应用知识的能力。
2、是否听说过煤气中毒呢?煤气是什么气体呢?它为什么可以使中毒呢?
(三)合作交流,解读探究
一、一氧化碳的物理性质(与CO2相比较)
阅读教材P121第一段,从颜色、状态、密度、溶解性等方面比较一下CO和CO2的物理性质
物质性质
颜色
课题3二氧化碳和一氧化碳(第二课时)
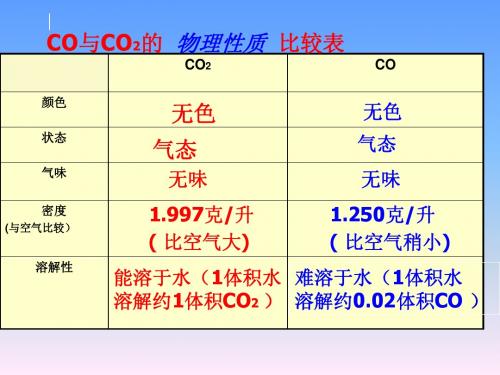
2、CO化学性质
CO 具有还原性
操作:
将纯净的 CO 通过灼热的CuO,再将生成的气体 通入澄清的石灰水中。并对尾气处理。
⑴黑色的CuO粉逐渐变成红色。 现象: ⑵产生的气体使澄清石灰水变浑浊。
结论:
⑴ CO具有还原性;CO + CuO
△
Cu + CO2
⑵ CO2 + Ca(OH)2 CaCO3↓+ H2O ⑶此套装置中增添了尾气处理装置。
CO2
高温
C + 2CuO
2CO
2Cu+CO2
CO
2CO + O2
点燃 2CO2 CO + CuO Cu + CO2
H2
2H2 + O2
点燃
2H2O
H2 + CuO
Cu + H2O
【小复习3】除杂质
CO CO2
CO
怎样除去CO中的CO2
石灰水
CO
怎样除去CO2 中的CO CO 2
CuO
CO2
【练习与思考】
A
B
C
收集CO的方法: 收集 CO只能用排水法。
⒉CO化学性质 操作: ⑴点燃纯净的CO。 ⑵在火焰上方罩一内壁涂有石 灰水的烧杯。 现象:⑴CO燃烧,产生蓝色火焰,放出热量。 ⑵澄清石灰水变浑浊。 点燃 结论:⑴CO具有可燃性。 2CO + O2 2CO2 ⑵CO燃烧的产物是CO2。 CO2 + Ca(OH)2 CaCO3↓+ H2O
物 质 有利的一面(用途) 不利的一面 示例:
H2
可用作高能燃料
使用不当容易引起爆炸
O2
广泛用于支持燃烧; 造成食物的腐烂; 供动植物呼吸 钢铁的锈蚀 可用于民用或工业 燃料 植物的光合作用; 灭火;人工降雨
人教版九年级化学上册第六单元课题3二氧化碳和一氧化碳 第2课时 教案

人教版九年级化学上册第六单元课题3二氧化碳和一氧化碳第2课时教案二氧化碳和一氧化碳教学目标1.知识与技能(1)从一氧化碳和二氧化碳分子组成不同,了解这两种氧化物在性质上的差异。
(2)知道一氧化碳还原氧化铜的原理及一氧化碳使人中毒的原因。
2.过程与方法通过化学实验及其分析,使学生了解一氧化碳的可燃性和还原性。
3.情感态度与价值观:(1)了解CO的物理性质及用途;(2)了解一氧化碳的物理性质,一氧化碳的毒性及其对环境的污染,加强环境保护意识。
教学重点CO的可燃性、还原性以及毒性CO的还原性二氧化碳是学生继氧气之后要学习的又一重要气体。
该气体与日常生活联系非常紧密,学生在前期的学习中就有所接触,但对CO2的性质和用途未必有科学的认识。
由于学生在学习O2时已经形成了一定的学习方法,教材中关于CO2的基础知识,学生大都能通过预习来掌握。
然而,多年来的接受式学习,使学生的科学探究意识较为缺乏,看问题多停留于表面,缺乏深思的习惯。
例如,当看到CO2通入石蕊试液中,石蕊试液变红,他们就会得出CO2能使石蕊试液变红的错误结论。
储气装置、铁架台(附铁夹)、酒精灯、集气瓶、硬质玻璃管、石灰水、氧化铜、火柴。
导学过程学习过程备注[引入](电脑展示燃烧的煤炉)煤炭在不同的条件下燃烧可生成两种氧化物——CO、CO2,(显请阅读课本P117第一段,归纳CO的物理性质[归纳]CO的学生观察实验与小组讨自主学习示化学方程式)CO 分子比CO2分子少一个O原子(显示分子模型)。
这种分子构成上的差异,会给两种碳的氧化物的性质带来什么差异呢?令人谈之色变的煤气中毒的罪魁祸首的庐山真面目有时怎样的呢?这节课让我们揭开CO的神秘面纱,研究CO的性质。
一、 CO的物理性质[讲述]我们研究物质的性质总是从它的物理性质开始,学习CO也不例外。
(展示一瓶CO气体)请阅读课本P117物理性质,与CO2对比(用电脑逐步显示下表)物质性质CO状态无色、无气体密度1. 25克比空气溶解性难溶于(1:0.学生观察并回答现象:燃烧时发出蓝色的火焰,放出热量,生成能使论结合合作共建知能应用巩固小结第一段,归纳CO的物理性质,提示:从色、态、味、密度、溶解性等方面比较。
初三化学第六单元课题3第2课时:一氧化碳的性质

三、一氧化碳的化学性质
【想一想】煤炉里的煤在燃烧过程中,发生了哪些化学反应?
点燃
2CO + O2
2CO2
点燃
2C + O2
2CO
高温
C + CO2
2CO
点燃
C + O2
CO2
液化气、天然气等含 碳燃料在不充分燃烧 时都会有CO生成。
【思考】向一盆燃烧旺盛的炭火中洒少量的水,火焰更旺且为蓝色;但洒入较多的水,炭火熄灭,为什么?
4.区别CO2、CO、O2三种气体,最简便的方法是( B )
A.用带火星的木条
B.用燃着的木条
C.用澄清石灰水
D.用灼热的氧化铜
六、课堂小结
一、一氧化碳的物理性质 无色无味的气体、密度比空气略小、难溶于水。 二、一氧化碳的化学性质 (1)一氧化碳的毒性 (2)一氧化碳的可燃性: 2CO + O2 点燃 2CO2 (3)一氧化碳的还原性: CuO + CO 高温 Cu + CO2 三、一氧化碳的用途 (1)气体染料 (2)冶炼金属
解毒方法:如果发生一氧化碳中毒,轻度的应立即撤离中毒环境,呼 吸大量新鲜空气或氧气,严重的应进行人工呼吸并立即到医院进行治疗。
防止措施:①冬天用煤火取暖时一定要装烟囱,并且注意室内通风, 防止一氧化碳中毒。②CO通常状况下为无色、无味的气体,煤气泄漏时不 易被人察觉,所以煤气厂在家用煤气中掺入微量具有难闻气味的气体,使 人在煤气泄漏时及早察觉。如果发现煤气泄漏,应立即关闭阀门,然后开 窗通风。
还原性或氧化性
二氧化碳
不能燃烧 , 一般也不能支持燃烧 ,也 不能供给呼吸
跟水反应 CO2 + H2O = H2CO3
第六单元碳和碳的氧化物课题3二氧化碳和一氧化碳课时2一氧化碳20232024九年级上化学人教知识必备

第六单元 碳和碳的氧化物(学用)课题3 二氧化碳和一氧化碳课时2 一氧化碳一、知识必备 知识点1 一氧化碳的性质和用途1. 一氧化碳的物理性质:无色、无味的气体,难溶于水,密度比空气略小。
一氧化碳只能用排水法收集,不能用向下排空气法收集。
2. 一氧化碳的化学性质(1)一氧化碳具有可燃性:2CO+O 22CO 2【燃烧的现象】① 发出蓝色火焰; ② 放热; ③ 生成能使澄清石灰水变浑浊的气体。
煤炉从上至下,常发生的三个反应:2CO+O 22CO 2、CO 2+C 2CO 、C+O 2CO 2(2)一氧化碳具有毒性。
原因:一氧化碳极易与血液中的血红蛋白结合,造成生物体内缺氧,严重时会危及生命。
正常的血液呈深红色,当通入一氧化碳后,血液由深红色变成浅红色。
(3)一氧化碳具有还原性。
3. 一氧化碳的用途:⏹ 可燃性:作气体燃料(2CO+O 22CO 2)。
⏹ 还原性:冶炼金属(3CO+Fe 2O 32Fe+3CO 2、CO+CuO Cu+CO 2)。
知识点2 一氧化碳的还原性1. 一氧化碳还原氧化铜的实验:【实验装置】见下图(这是整套装置,但只需掌握虚线框中内容,并且下文的操作、现象、结论仅针对虚线框内的实验装置)。
1稀盐酸 2大理石 3碳酸氢钠溶液 4浓硫酸 5木炭 6氧化铜 7氢氧化钙溶液【实验操作】① 先通入一氧化碳,在加热前必须先检验一氧化碳的纯度;② 点燃酒精灯给玻璃管内的物质加热;③ 实验完毕,先熄灭酒精灯;④ 再通入一会儿一氧化碳直到试管冷却。
【实验现象】黑色粉末变成红色,生成的气体使澄清的石灰水变浑浊。
【实验结论】一氧化碳能使氧化铜还原成铜,同时生成二氧化碳。
② ① ③ ④ ⑤ ⑥ ⑦【化学方程式】CO+CuO Cu+CO2【注意事项】①检验一氧化碳纯度的目的:防止加热空气和一氧化碳的混合气体引起爆炸。
②一氧化碳“早来晚走”,酒精灯“迟到早退”。
③一氧化碳“早来”,酒精灯“迟到”的目的:排净装置内的空气,防止加热空气和一氧化碳的混合气体引起爆炸。
第六单元课题3二氧化碳和一氧化碳第2课时
回答:①相同的② 不同的。并说出理 由
△ 有助于培养学 生独立思维的能 力。
总体要求:1.“统一”设计“分段”教学;2.围绕“三维”落实“三问” 3.充实“心案”活化“ ; 充实 。 总体要求:1.“统一”设计“分段”教学;2.围绕“三维”落实“三问” 3.充实“心案”活化“形案” 围绕
教
分 课 时
学 活 动
流
程
△设计 活 动
◇资源准备 □评价○反思 △ 培养观察能力 表达能力。
【活动与探究】 】 【实验 6--7】一氧化碳的燃烧 】 现 结 象 论
观察现象,填写表 格 书写化学方程式 2CO + O2 2CO2
小结: 一氧化碳是一种没有颜色、 没有气 味的气体, (补充难溶于水,密度比空气 小)它能燃烧,燃烧时放出大量的热,火 焰呈蓝色。 【问题与情景】 】 ①在煤炉的上方,我们常常看到蓝 色火焰出现, 请问这是什么气体燃烧的结 果?你能写出煤炉中产生该气体的有关 化学方程式吗?由此性质可知一氧化碳 有什么用途? 2C + O2 第 一 课 时 C + O2 2CO CO2;2C + CO2 2CO
学情 分析
学生已经知道了二氧化碳能使澄清石灰水变浑浊,以及一氧化碳能使人中毒,但是不知道具 体原因,本课题因为比较紧密的练习实际,所以学生学习起来会充满兴趣。
教 学 目 标
知识技能
了解自然界中的碳循环,了解温室效应。知道二氧化碳用途。了解一氧化碳的性质和用途。 知道一氧化碳有损人体健康。
过程方法
通过对一氧化碳和二氧化碳的结构、 性质、 用途相关知识的学习, 学会观察和描述化学现象; 进一步认识物质的结构决定其性质,物质的性质决定其用途的化学学习方法。
人教版九年级化学上册教案设计:第六单元 课题3 二氧化碳和一氧化碳(第2课时)

课题3 二氧化碳和一氧化碳第二课时一氧化碳【知识目标】1.了解一氧化碳的性质。
2.说出一氧化碳的还原性,以及还原氧化铜的装置及操作顺序。
【情感目标】1.增强学生对有害气体的认识,激发学习化学的兴趣;培养大胆、细致、勇于实践的科学精神。
2.让学生体验化学的魅力,从而热爱化学、钻研化学。
【教学重点】一氧化碳的化学性质。
【教学难点】一氧化碳的化学性质【情景创设引入新课】【新课导入】一冬天用煤炉取暖,门窗紧闭,排烟不良时,常发生煤气中毒事件。
煤气中毒时病人最初感觉为头痛、头昏、恶心、呕吐、软弱无力,当他意识到中毒时,常挣扎下床开门、开窗,但一般仅有少数人能打开门,大部分病人迅速发生昏迷,两颊、前胸皮肤及口唇呈樱桃红色,如救治不及时,可很快因呼吸抑制而死亡。
煤气中毒就是一氧化碳中毒。
【新课导入】二猜谜语:(1)似雪没雪花,叫冰没冰碴,无冰可制冷,细菌难安家。
(干冰)(2)左侧半圆,右侧整圆,“半圆”取暖,“整圆”助燃,来去无影,有毒能燃。
(一氧化碳) [过渡语] 碳的氧化物有一氧化碳和二氧化碳两种。
1个CO2分子比1个CO分子多1个氧原子,这就使得它们的性质有很大的不同。
【提出问题进行探究】探究点一:一氧化碳的性质及用途一、一氧化碳的物理性质无色、无味的气体,密度比空气略小,难溶于水。
二、一氧化碳的化学性质1.一氧化碳有剧毒CO中毒的原理:一氧化碳极易与血液中的血红蛋白结合,从而使血红蛋白不能很好地与氧气结合,造成生物体内缺氧,所以会出现上述现象,严重时会危及生命。
[讨论] (1)在什么条件下容易发生煤气中毒?(煤气泄漏,室内通风不良,或生煤炉火的房间不装烟囱)(2)有人用煤火取暖,又担心煤气中毒,临睡前在煤炉上和地上放两大盆冷水,这样做能预防煤气中毒吗?(水不能预防煤气中毒,因为CO难溶于水)(3)煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体?如发生煤气泄漏应当怎么办?(便于煤气泄露易被察觉;关闭煤气阀门,然后开窗通风。
九年级化学上册《第六单元课题3二氧化碳和一氧化碳(第二课时)》课件

第六页,共二十七页。
跳过
5、 农业科技人员向农民建议(jiànyì):在利用温 室生产时,可向温室中通入适量的二氧化碳。 这是因为( D )
A、CO2可使害虫窒息死亡,从而防止病虫害 B、CO2可产生温室效应,从而提高室温 C、CO2能灭火,施用后可防止火灾 D、施用CO2,可促进植物的光合作用
第十六页,共二十七页。
3、CO具有 还原 (jùyǒu)
性
C
co
cuo
A
澄清的
石灰水 B
CO +CuO = Cu + CO2
CO还原性试验(shìyà n)
第十七页,共二十七页。
思考 实验结束(jiéshù)时,是先熄灭酒精灯,还是先停
止通入CO气体?为什么?
C
co
cuo
A
澄清的
石灰水 B
答:应 先 熄灭酒精灯,等玻璃管冷却后再停止(tíngzhǐ)通 入 CO气体。
__黑___色
___红__色。
4、宣传科学知识,揭露伪科学是化学(huàxué)工作者 的义务。下列各项中,属于为科学的是( )A D
A、用液态氢作燃料发射火箭
B、用干冰进行人工降雨
C、用催化剂把水变成汽油
D、CO气体可用来冶炼金属
第二十三页,共二十七页。
跳过
5、机动车排放的尾气中,含有碳氢 化合物, CO,CO2,和氮的氧化物(如NO)等物质, 因而是城市空气污染源之一。
生产时,可向温室中通入适量的二氧化碳。(3)既可用向上排空气法又可用排水法收。1、CO 有剧毒,那么冬天房间里用煤或木炭取暖时应该怎样做,才能防止发生煤气中毒事件
Image
九年级化学上册 第6单元 课题3 二氧化碳和一氧化碳(第2课时)一氧化碳课件

能(填够“推支断持出”生或成支“物持不中(z支hī含ch持í)有”一)氧,化请碳说,出你你是的否理支由持:小芳的观点:
只要根据氧化铜由黑色变为红色,就可判断三
小芳认为,从种环氧保化的物角中度一看定,含“有实一验氧二化碳”装置有一个缺陷,请
你指出该缺陷:
。
缺少尾气处理,装处置理(chǔlǐ)的方法是
将尾气通到酒精灯的火焰上
澄清(chéngqīng)石灰水变浑浊
第九页,共十二页。
【假设二】生成物中有一氧化碳
证明生成物中含有
一氧化碳。请回答:
CuO
A装置中黑色固体粉末是 A装置中的实验现象是
黑色固(填体化(gù学tǐ)变式为),红色。
⑶ 讨论交流: 小芳认为,小明的“实验二”不需要B装置也
仅生成三种氧化物。某校研究性学习小组对此展开探究:
⑴ 小明首先根据草酸中含有
元素,可推测生成
物中含有水。
氢(或氢和氧)
⑵ 小明对分解生成的其他产物进行猜测、验证:
【假设一】生成物中有二氧化碳
实验(shíyàn)一:将生成的气体通入澄清的石灰水,实验(shíyàn)现象
是
,小明据此判断生成物中含有二氧化碳。
物理性质:
通常情况下,一氧化碳(yīyǎnghuàtàn)是无色无味的气体,密度比空 气略小,难溶于水。
问题:有人说在煤炉上放一壶水就能防止一氧化碳中毒,你认 为这种说法对吗?为什么? 不对。因为一氧化碳难溶于水,在通常状况下,1体积的水仅 能溶解约0.02体积的一氧化碳。
化学性质(huàxué xìngzhì):1、可燃 性一。氧化碳与二氧化碳不同,一氧化碳在空气里能够燃烧生 成二氧化碳,燃烧时发出蓝色的火焰。
4、温室
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题3 二氧化碳和一氧化碳(第2课时)
蒿中李晓玲
学习目标:
1、通过预习和自主探究,让学生能说出一氧化碳的性质和用途;
2、通过思考和讨论,让学生初步会用所学的知识解释一氧化碳中毒的有关问题。
3、通过观看视频和研讨,能归纳出一氧化碳的可燃性、还原性,并理解记忆一
氧化碳还原氧化铜的实验注意事项。
重点:1.一氧化碳的物理性质;
2.一氧化碳的毒性、可燃性、还原性。
难点:一氧化碳的还原性。
自主学习:
1、写出碳单质完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳的化学方程式。
2、在煤炉的上方,我们常常看到蓝色火焰出现,请问这是什么气体燃烧的结果?
你能写出煤炉中产生该气体的有关化学方程式吗?
3、一氧化碳是一种无色无味有毒的可燃气体,是煤气的主要成分,为了让人知
道是否泄露,可采取什么措施?一旦发生泄漏,怎么办?
4、怎样防止一氧化碳中毒?
合作交流:
一、一氧化碳的性质
1、物理性质:(提示:从颜色、状态、密度、溶解性等方面描述)
2、化学性质
(1)可燃性(与碳比较)
小结:一氧化碳和氢气都具有可燃性,属于可燃性气体,点燃应检验气体的纯度。
(2)、一氧化碳的还原性(与碳单质比较)
△
原理:CuO + CO Cu + CO2
(3)、一氧化碳的毒性
讨论:①煤气中毒的生理过程?
②有人用炉火取暖,为防止煤气中毒,在火炉在放一盆水,这样做行吗?
③有人说他不会煤气中毒,一闻到煤气味就把火炉搬出去,这种说法对吗?
随堂检测:
某同学设计如上图所示的实验装置,进行一氧化碳还原氧化铜的实验。
试回答: (l)该装置存在的一个主要问题是
你的改进方法是
(2)实验开始时,是先给氧化铜加热,还是先通人一氧化碳?
(3)实验过程中,图中A处能观察到的实验现象是
发生反应的化学方程式为
B处观察到的实验现象是
(4)实验过程中,一氧化碳和氧化铜反应不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O)。
如果要对反应后A处残留固体的组成进行探究,试猜想残留固体的组成有哪几种可能? 。
