有机合成365条路线
有机合成路线设计(全)

逆合成分析法 (Retrosynthesis)
合成路线设计是有机合成的关键
1、有机合成:利用化学反应,将简单的有机化合物制成 比较复杂的有机物的过程。
对于同一目标化合物(Target Molecule,TM)可以有 多条合成路线,不同路线在合成效率上(反应步数、总 产率、反应条件、原料来源、反应时间、中间体和产物 纯度等)存在明显的差别,这些路线都是合理的,但不 一定是适用的,适用的路线须根据实际情况确定。然而, 适用的路线必须来自合理的路线。
醇失水;炔烃部分还原;Wittig反应;Hofmann消除;
羧酸酯的热消除等几种,烯烃的合成反应中,最常见的莫
过于烯烃顺反双键的建立和端烯的合成,一般顺反双键的
建立大多通过炔烃部分还原得到,端烯一般由Wittig反应
制备。
2、醇与醚
• 醇的制备方法很多,可由烯烃水和、羟汞化-脱汞反应、 硼氢化反应等反应来制备;可以由卤代烃出发制备;可由 羰基化合物还原或与格氏试剂反应制备;也可由酯还原制 备。邻二醇一般用烯烃氧化制备。醚的合成相对简单些, 一般用醇分子间失水或Williamson反应来制备,前者主 要用来合成对称醚,后者主要用来合成混合醚,要注意混 合醚中碳氧键的切断位置。
浓盐酸
O
CO
Br
CH3COCl AlCl3
①NaBH4 ②PBr3
①Mg, Et2O
②CO2 ③H2O
COOH
例16
HO
Br
+
O
HO
CH3CHO + Br
Br
O
+
O
CO2Et
C2H5O Br
Br
①Mg, Et2O ② CH3CHO
高考化学专题复习有机合成路线

R-CH2COOH
⑧ 魏悌希试剂与醛酮的反应
R//
- R/
C=O + (ph)3P CH
R///
季膦盐 R
R//
R/
C=C
R///
R
R、 R/、R//、 R///可以为 –H、-R、-Ar、-COOR等
● 碳链的减短
① 不饱和烃的氧化
RCH=CHR/ KMnO4 RCOOH + R/COOH
H+
R-C=CH2 R/
CH2 C —2H5 (CH2)n
CH2C-OC2H5 O
① OH-
C2H5ONa -C2H5OH
CH2
CH2 (CH2)n C=O
CH COOC2H5
② H+
(CH2)n C=O 其中:n = 2,3
⑤ 傅克酰基化反应 CH2
O +O
O
=
= =
AlCl3
O
HO O C Zn-Hg
O
OH -
CH=CH-C-C(CH3)3
△
⑥ 格氏试剂与羰基化合物反应
= = =
O
R/-C-H(R//)
① RMgX / 无水乙醚 ② H2O / H+
R R/ C OH
H(R//)
O
R/-C-X
① RMgX / 无水乙醚 ② H2O / H+
O
=
R/-C-R
① RMgX / 无水乙醚 ② H2O / H+
KMnO4 H+
R-C CH KMnO4
H+
CH2CH2CH3
R-C=O + CO2 R/
RCOOH + CO2 COOH
有机合成路线设计总结

R-CN
RCOOH CH2Cl
其中:R-X为脂肪族伯卤代烃 Y
④ + HCHO + HCl 其中:Y为供电子基 ⑤
AlCl3
或ZnCl2
Y CHO
AlCl3
+ CO + HCl
或ZnCl2
⑥
R H
C O
HCN
R
H
C
OH CN
H2 O H+
α -氰 醇
H R C COOH OH
α -羟 基 酸
C 应用范围:醛、甲基脂肪酮 、 8以下环酮
② H2 O / H
R R/ C OH H(R//)
O O R ① RMgX / 无水乙醚 /-C-X ① RMgX / 无水乙醚 /-C-R R R R/ C OH ② H2 O / H + ② H2 O / H+ R
O O R ① RMgX / 无水乙醚 /-C-OR// ① RMgX / 无水乙醚 /-C-R R R R/ C OH ② H2 O / H + ② H2 O / H+ R 其中:R、R/、R// 为烷基、芳基 X 为Cl、Br = = = =
X2 FeX3 或Fe H2SO4 + HNO3
-X
-NO2
Fe + HCl
-NH2
H2SO4 · 3 SO
-SO3H
或浓H2SO4
R-X AlCl3 O R-C-X AlCl3
-R O -C-R
● 官能团的相互转化
1. 卤素、羟基、氨(胺)、羰基、羧基的转换
[O]
R-OH
R-MgX
H2O / OH- PX3 Mg NH3 R-NH2 [H]
有机合成设计路线

+
+
-
X=COOEt,CN…
+
二
例 试设计 的合成路线 +
1,6-双官能团化合物
Diels-Alder
+
+
+ 分析 例 试设计 的合成路线
+ 分析 例 试设计 的合成路线
5 碳环切断与合成路线设计
三元环(插入反应) 四元环 五元环 六元环 中环和大环
活性亚甲基两次烷基化 电环化2+2环加成
分子内羟醛缩合 酮酯缩合
Diels-Arden Robinson Frider-Crafts
反合成分析,就是通过切断(dis)、连接(con)、 重排(rearr)等骨架转换及官能团转换实现的
(4)反合成子(retron)
为区别合成子/合成中间体,引入反合成子概念
反合成子: 反合成分析中进行某一转化 所必须的结构单元
转化所必须 的结构单元
转化将要得到的 结构单元
Diels-Alden环加成反应 Robinson成环反应
Diels-Alder反应
01
Robinson成环
02
Fridel-Craftrs反应
03
合成依据:
六元环
例 试设计 的合成路线 分析 合成:略
中环和大环
01
α,ω-二元酸酯
02
酮醇缩合(还原)
(5)合成树
A(TM)
B
C
D
E
C
F
G
H
I
J
K
L
M
N
O
P
Q
前体的前体
TM的前体
合成路线的构成
有机合成路线-第四章

例1:合成 :
O Ph
dis
O Br Ph
此拆开应合理,因二者都是常见原料,且二者都有α 位活泼的活性 此拆开应合理,因二者都是常见原料,且二者都有α-位活泼的活性 基团,但在合成时,收率却很低, 基团,但在合成时,收率却很低,主要是丙酮羰基两边的甲基是等同
O Ph 。为了获得 为了获得TM,即 的,因而两边上两个苄基,得到 Ph 因而两边上两个苄基, , 只有丙酮的一边引入苄基,这就需引入导向基使两个甲基的活性产差异, 只有丙酮的一边引入苄基,这就需引入导向基使两个甲基的活性产差异, 若在某端甲基上引入一个乙氧羰基,从而使这个甲基上的氢得到活化, 若在某端甲基上引入一个乙氧羰基,从而使这个甲基上的氢得到活化, 此时丙酮成了乙酰乙酸乙酯, 此时丙酮成了乙酰乙酸乙酯,且引入的酯基又容易去掉只要在碱性条件 下水解再酸化,高温加热,即可脱羧。 下水解再酸化,高温加热,即可脱羧。
NO2 NH2 NH2
混酸 55℃ NaNO2,H2SO4 H2O,0~5℃
Br
Fe,HCl,
N2HSO4 Br
Br2,H2O Br
Br Br Br
Br
还原
Br
Br
所以—NH2基既便于引入,引入又起导向作用,又便于去掉, 基既便于引入,引入又起导向作用,又便于去掉, 所以 基可作为此合成的导向基。 故—NH2 基可作为此合成的导向基。 在有机合成中,常用的导向基办法有三种: 活化导向, 在有机合成中,常用的导向基办法有三种:①活化导向,②钝化导 向,③封闭待定位置导向。 封闭待定位置导向。
① 加HOCl ② OH ,-HCl [O2 ,Ag, △ ] C C O O CH3COOH C H2O2,[OH ] C H2O2,[OsO4] 或[WO3] C C O C C C 适合于酸性条件 适合于α ,β -不饱羰基化合物 可以使用,但催化剂较贵 C C 适合碱性条件
有机合成路线设计

官能团转化的目的
•以提高化学选择性、区域选择性、立体选择性。 •采用比TM更易合成的前体化合物或易得的原料
•为作dis,con,rearr等反合成分析所必须 •添加导向基(活化基、钝化基、阻断基、保护基),
反合成分析过程就是通过切断(dis)、连接(con)、
重排(rearr)等骨架转换及官能团转换实现的。
O C
O OH
O * *
COOC2H5
OH
COOC2H5
偶姻反应
O O O
O
O
O O
O O
Diels-Alden
(2)切断(dis)、连接(con)、重排(rearr)
disconnection connection rearrangement
CN
CN dis
+
CHO CHO
O
con
OH C NH rearr N
颠茄酮的合成
1). 1896年,德国化学家 Willstatter (1915年获Noble 化学奖)
Willstatter 在1896年合成, 21步反应,总收率0.75%。
颠茄酮的合成
2)1917年,英国化学家 Robinson (1947年获Noble 化学奖)
3 steps, overall yield 90% Robinson为什么能发现这条合成路线?根据下面的新反应。
有机合成的历史回顾
尿素的合成
(1828年,德国化学家, Friedrich Wohler)
O NH 4OCN H2N NH2
尿素的合成打破了当时固有观点中有机物只能 由有生命力的动植物合成,从而揭开了人工合成 有机物的序幕,标志着有机化学的开始。
有机合成基本路线
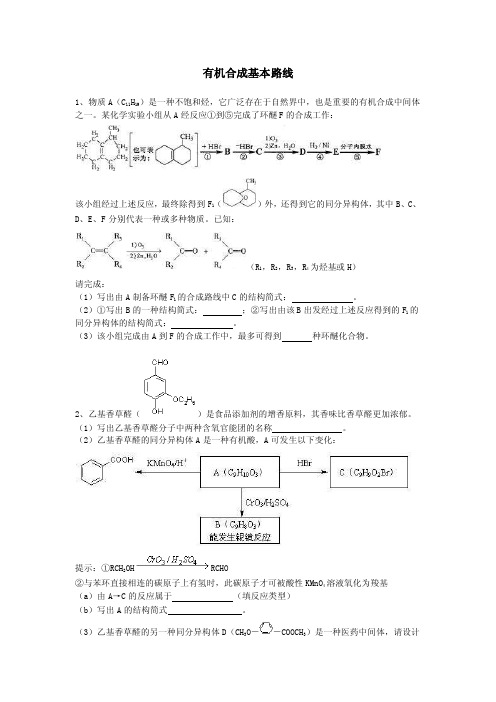
有机合成基本路线1、物质A(C11H19)是一种不饱和烃,它广泛存在于自然界中,也是重要的有机合成中间体之一。
某化学实验小组从A经反应①到⑤完成了环醚F的合成工作:该小组经过上述反应,最终除得到F1()外,还得到它的同分异构体,其中B、C、D、E、F分别代表一种或多种物质。
已知:(R1,R2,R3,R4为烃基或H)请完成:(1)写出由A制备环醚F1的合成路线中C的结构简式:。
(2)①写出B的一种结构简式:;②写出由该B出发经过上述反应得到的F1的同分异构体的结构简式:。
(3)该小组完成由A到F的合成工作中,最多可得到种环醚化合物。
2、乙基香草醛()是食品添加剂的增香原料,其香味比香草醛更加浓郁。
(1)写出乙基香草醛分子中两种含氧官能团的名称。
(2)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:提示:①RCH2OH RCHO②与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性KMnO4溶液氧化为羧基(a)由A→C的反应属于(填反应类型)(b)写出A的结构简式。
(3)乙基香草醛的另一种同分异构体D(CH3O--COOCH3)是一种医药中间体,请设计合理方案用茴香醛(CH3O--CHO)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件)。
例如:-Br3、M5纤维是美国开发的一种超高性能纤维,据报道,美国士兵佩带的头盔、防弹背心和刚性前后防护板中含M5纤维。
M5纤维是刚杆形又有强力分子间氢键的聚合物。
下面是M5纤维的合成线路:(有些反应未注明条件)请填写下列空白:(1)合成M5的单体的结构简式F ,G ;(2)反应类型:A→B:;B→C:;(3)在生成A的反应中,对二甲苯与氯气按物质的量之比1:2发生反应,生成A的同时可能生成的A的同分异构体(写结构简式);(4)写出化学反应方程式:C→对苯二甲酸:。
4、煤的“气化”是使煤变成清洁能源的有效途径之一,其主要反应为:C+H2O(g) CO+H2。
有机合成路线设计总结

② 武慈反应
R-X + R-X Na R-R 其中:R/ 最好为伯烷基
X 为Cl、Br、I
③ 铜锂试剂反应
R-X Li R-Li CuI R2CuLi R/X R-R/
其中:R/ 最好为伯烷基; R 一般无限制 X 为Cl、Br、I
④ 傅-克反应
烷基化:
R
+ R-X AlCl3
(或烯、醇)
R ≥3 时重排产物为主
OH
α -氰 醇
α -羟 基 酸
应用范围:醛、甲基脂肪酮 、C8以下环酮
2. 增加二个碳原子的反应
R MgX + CH2 CH2 O
R CH2CH2 H3O+ RCH2CH2OH OMgX
3. 增加多个碳原子的反应
① R-C CH NaNH2 R-C CNa R/X R-C C-R/
其中:R/ 为伯卤代烃 X 为Cl、Br、I
R-X
OO
CH3-C-CH-C-OC2H5 R
① 浓OH-, △ ② H+
① 稀OH② H+, △
=
O R-CH2C-OH
酸式分解
=
O CH3-C-CH2-R 酮式分解
CH2(COOC2H5)2 C2H5ONa
-+
CH(COOC2H5)2 Na
R-X
R-CH(COOC2H5)2
①
-
OH /
H2O
② H+ ,△
R C OCH3 H OCH3
缩醛酮:对还原剂 氧化剂、碱、格氏试剂稳定; 但对酸不稳定;
4 羧基的保护
R-COOH
5 氨基的保护
CH3OH / H+ H2O / H+或OH-
有机合成路线设计总结

R-C
③ RCH2CH2-OH
=
二缩乙二醇
C-R/
或Lindlar试剂
Na + NH3液 或Pd / C H2SO4
~170℃
R R/ 顺式加成 C=C H H H R/ 反式加成 C=C R H
H2 Ni
R-CH=CH2
RCH2CH3
O 7. 芳环上引入-X、-NO2、-NH2、-SO3H、-R、-C-R
② H2O2 / OH
②
R-C=O R-CH-OH /) [ O ] H(R H(R/) [ H ] = LiAiH4 、NaBH4 、 H2 / Ni、Pt、Pd等
R-COOR/
[H]
③
R-CH2OH + R/OH
[ H ] = LiAiH4 、C2H5OH + Na 、 H2 / Ni、Pt、Pd等
稀、冷KMgO4 或OsO4 H2O / H+
② H2 O / H ② H2 O / H
R R/-C-OH R// OH OH C—C
顺式产物
R-CH-CH2 O
=
OH R-CH-CH2 反式产物 OH
4. 引入羰基
① HC
R-C
CH + H2O
CH + H2O
HgSO4
H2SO4 HgSO4 H2SO4
X2 FeX3 或Fe H2SO4 + HNO3
-X
-NO2
Fe + HCl
-NH2
H2SO4 · 3 SO
-SO3H
或浓H2SO4
R-X AlCl3 O R-C-X AlCl3
-R O -C-R
● 官能团的相互转化
有机合成方法大全(第二章p1-12)
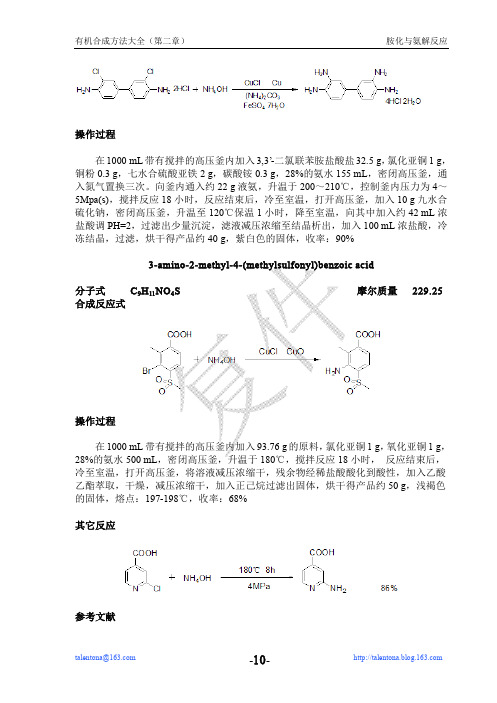
操作过程在1000mL带有搅拌的高压釜内加入3,3’-二氯联苯胺盐酸盐32.5g,氯化亚铜1g,铜粉0.3g,七水合硫酸亚铁2g,碳酸铵0.3g,28%的氨水155mL,密闭高压釜,通入氮气置换三次。
向釜内通入约22g液氨,升温于200~210℃,控制釜内压力为4~5Mpa(s),搅拌反应18小时,反应结束后,冷至室温,打开高压釜,加入10g九水合硫化钠,密闭高压釜,升温至120℃保温1小时,降至室温,向其中加入约42mL浓盐酸调PH=2,过滤出少量沉淀,滤液减压浓缩至结晶析出,加入100mL浓盐酸,冷冻结晶,过滤,烘干得产品约40g,紫白色的固体,收率:90%3-amino-2-methyl-4-(methylsulfonyl)benzoic acid分子式C9H11NO4S摩尔质量229.25合成反应式操作过程在1000mL带有搅拌的高压釜内加入93.76g的原料,氯化亚铜1g,氧化亚铜1g,28%的氨水500mL,密闭高压釜,升温于180℃,搅拌反应18小时,反应结束后,冷至室温,打开高压釜,将溶液减压浓缩干,残余物经稀盐酸酸化到酸性,加入乙酸乙酯萃取,干燥,减压浓缩干,加入正己烷过滤出固体,烘干得产品约50g,浅褐色的固体,熔点:197-198℃,收率:68%其它反应参考文献参考文献[1]Jack(Jianhua)Cao unpublished result[2]Chand,Pooran;Kotian,Pravin L.;Morris,Philip E.;Bantia,Shanta;Walsh,David A.;Babu,Yarlagadda S.;Bioorganic&Medicinal chemistry,13(7),2005,2665-26782.1.8用六亚甲基四胺(乌络托品)制备(4-bromophenyl)methanamine分子式C7H8BrN摩尔质量186.05合成反应式操作过程向500mL反应瓶内加入15.4g乌络托品和120mL的氯仿,油浴升温于50℃,开始滴加25g的对溴溴苄,搅拌反应24小时后,反应结束后,冷至室温,过滤,得中间体,将中间体加入250mL反应瓶内,搅拌下加入73mL的浓盐酸,升温回流并蒸出,收集馏出物,向其中加入约50mL的40%氢氧化钠水溶液,分出油层,水层用THF 萃取,合并干燥,减压浓缩干,得产品约15.8g,黄色的油状物,收率:85%2.1.9二苄基胺为胺化试剂N,N-dibenzyl-2-chloro-5H-pyrrolo[3,2-d]pyrimidin-4-amine分子式C20H17ClN4摩尔质量348.83合成反应式操作过程第二章胺化与氨解反应用氨或伯胺、仲胺与有机物作用生成胺的过程称为氨解胺化反应。
高中化学有机合成路线设计
8个C
官能 团的 变化
CC ||
-COO-C≡N
CC
||
引入羧基;在羧基的α碳上 引入卤素;通过取代羧基 变为酯基、卤素变为氰基; 最后再引入-CH2OH,消去 反应得碳碳双键
【实战演练1】尝试设计
请分析设计由CH3CH2CH2Br到CH3CH(OH)CH3的 合成路线。
【实战演练2】尝试设计
RCH=CH2→二卤代烃→二元醇→二元醛→二元羧 酸→酯(链酯、环酯、聚酯) 。(二元合成路线 )
3、由甲苯合成苯甲酸苯甲酯。(无机试剂任选)
—CH3
—CH2Cl
—CH2OH
—COOH
(芳香族化合物合成路线)
跟踪练习
1.均有C、H、O三种元素组成的有机物A、B、C、D, 它们之间存在如下转化关系:
O CH
CH3 CHCl2
CH2OH
CH2Cl
任务2:找出可能的合成路线
CH3 Cl2
光
CH2Cl NaOH
H2O
KM nO4
CH2 OH
O C OH
浓硫酸
O C O CH2
CH3 Cl2
光
CH3 KM nO4
LiAlH4
CH2Cl NaOH
H2O
氧化剂
O C OH
浓硫酸
CH2 OH
浓硫酸
O C OH
一元醇―→一元醛―→一元羧酸―→酯. (2)二元合成路线:CH2===CH2―X―2→二元卤代物―→二元
醇―→二元醛―→二元羧酸―→酯(链酯、环酯、聚酯).
(3)芳香化合物的合成路线:
【实战演练3】尝试设计
1:利用逆推法设计乙二酸二乙酯的合成路线
设计背景
乙二酸二乙酯为无色油状液体,有芳香气味。主要用作溶剂、染料 中间体及油漆、药物的合成 。
有机合成路线设计

有机合成路线设计 【考试要求】1、掌握烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和主要性质。
2、能利用不同类型有机化合物之间的转化关系设计合理路线合成简单有机化合物。
【命题趋势】根据已经学过的有机反应以及题目给出的信息进行有机化合物的合成路线设计。
【要点梳理】1.有机合成的原则:(1)起始原料要廉价易得,低毒性、低污染。
(2)应尽量选择步骤最少的合成路线。
(3)原子经济性高,具有较高产率。
(4)有机合成反应要操作简单、条件温和、能耗低、易于实现。
2.表达方式:合成路线图 3.有机合成方法:多以逆推为主,其思维途径是(1)首先确定要合成的有机物属于何种类型,以及题中所给的条件与所要合成的有机物之间的关系。
(2)以题中要求最终物质为起点,考虑这一有机物如何从另一有机物甲经过一步反应制得。
若甲不是所给已知原料,需再进一步考虑甲又是如何从另一有机物乙经一步反应制得,过程中需要利用给定(或隐藏)信息,一直推导到题目给定得原料为终点。
(3)在合成某产物时,可能会产生多种不同方法和途径,应当在兼顾原料省、产率高的前提下选择最合理、最简单的方法和途径。
4.有机合成中官能团引入与转化的常见方法A B C 反应物反应条件反应物 反应条件 ……D基引入双键例1.化合物H是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:已知:。
化合物是合成抗癌药物美发伦的中间体,请写出以和为原料制备该化合物的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:【答案】:1.敌草胺是一种除草剂。
它的合成路线如下:已知:,写出以苯酚和乙醇为原料制备的合成路线流程图(无机试剂任用)。
合成路线流程图例如下:2.常见氨基酸中唯一不属于α-氨基酸的是脯氨酸。
它的合成路线如下:HOOCCH 2CH 2CHCOOH NH 2C 2H 5OOCCH 2CH 2CHCOOHNH 2N H COOH N HCOOH·C 6(OH)Cl 5乙醇、浓硫酸KBH 4、H 2O脯氨酸25 ℃A BCD五氯酚分离氨水①N HCOOH ②③④C分离已知:R -NO 2Fe 、HClR -NH 2,写出以甲苯和乙醇为原料制备CH 3NCH 2CH 3CH 2CH 3的合成路线流程图(无机试剂任选)。
有机合成路线与设计New

O s O4
OH OH
H+
OH
H2O
OH
17
b.酚 Ar—OH 异丙苯氧化法; 氯苯水解法; 磺化碱熔法; 重氮盐水解法。
N2+
H2O
OH
H+ ,△
18
c.醚 C—O—C
三、转换官能团的反应
RX + R'ONa
ROR'
2ROH ROH
-H2O CH2N2
ROR ROCH3
d. 醛、酮
积二卤代烃水解 烃的氧化 醇的脱H或氧化 羧酸的还原 芳烃的酰基化 乙酰乙酸乙酯合成酮类
素易氢解为烃
21
四、有机合成路线的设计
• 基本要求: • · 原料易得,最好无毒 • · 反应步骤较少 • · 实验操作方便安全 • · 反应产率高,付反应少,后处理简单
(易纯化)
22
Retrosynthetic Approach
23
1.增长碳链
四、有机合成路线的设计
例1 C6H5CH=CH 2
CH 3
CH3CH2COOH
CH3CH2OH
H+
CH3ONa
CH3-CH-COOC 2H5
CH3CH2COOC2H5
酯缩合
COCH2CH3
CH3ONa CH2=CHCH2Cl
COCH 2CH3 CH 3-C-COOC 2H5
CH2-CH=CH2
COCH 2CH3
H+
- CO2
△
CH 3-CH
CH2-CH=CH 2
H2O2
RCH2CH2CH2Br 反马氏规则
NBS 或Br2/高温
RCHBrCH=CH2 α -取代
有机合成路线-第一章

目的:熟悉合成的分类,了解到合成路线可以有多种, 目的:
但具体哪一种合适,要具体分析。
1.5
书写合成路线的通则
书写合成路线,一般应遵守下列七条常见原则: 书写合成路线,一般应遵守下列七条常见原则: ①、每一步可用示意式表示(不必写完整的方程式),箭号“→”表示 每一步可用示意式表示(不必写完整的方程式),箭号“ ” ),箭号 反应,原料写在箭号尾部,主要产物写在箭号头端,副产物可以不写; 反应,原料写在箭号尾部,主要产物写在箭号头端,副产物可以不写;或写 在箭号的下边,其左冠以减号“ 在箭号的下边,其左冠以减号“-” 试剂、催化剂或其他反应条件,写在箭号的上边。有时, ②、试剂、催化剂或其他反应条件,写在箭号的上边。有时,箭号的上 边写不完时,也可写在箭头的下边,但不写“ 、 号 边写不完时,也可写在箭头的下边,但不写“+、-”号 不写温度和压力数值时,表示常温、常压下进行; ③、不写温度和压力数值时,表示常温、常压下进行; 使用任何无机试剂,不必写其制法, ④、使用任何无机试剂,不必写其制法,如NaOH、HCl、KMnO4等可 、 、 直接用。 直接用。 常用的简单有机化合物,如甲醛、乙醇、丙酮等,没特别指明, ⑤、常用的简单有机化合物,如甲醛、乙醇、丙酮等,没特别指明,可 以不必写制法。 以不必写制法。 为节省时间和篇幅,两步以上的简单反应,可合在一个箭头上写出, ⑥、为节省时间和篇幅,两步以上的简单反应,可合在一个箭头上写出, 但必须标明,各步次序①②③ ①②③等 但必须标明,各步次序①②③等; 若反应得到几种异构体(最好不选用此反应), ),应写明分离异构体 ⑦、若反应得到几种异构体(最好不选用此反应),应写明分离异构体 的步骤。 的步骤。
为什么要采取“以退为进”的手段呢? 为什么要采取“以退为进”的手段呢?
