MDS-MPN类型及其诊断(WHO,2016)解读
2016年MDS的WHO新分型标准

2016年MDS的WHO新分型标准2016年WHO有关骨髓增生异常综合症亚型更改预告基于临床顾问委员会的建议,该版修订将把MDS中影响疾病分型的一些新的发现进行整合。
WHO分型中基本诊断原则不变,但提出了一些亚型的改变。
分型命名:在WHO分类中,MDS分型主要强调的是发育异常和原始细胞计数,而不是血细胞减少,但“血细胞减少”或“贫血”在MDS几乎各个亚型的名称中均存在,且在IPSS-R预后积分系统中有着重要意义。
另外,在难治性血细胞减少伴单系发育异常中,发育异常的类型并非总与血细胞减少的系别相一致。
因此难治性贫血、难治性中性粒细胞减少和难治性血小板减少这些亚型将被统一命名为MDS伴单系发育异常,难治性贫血伴环状铁粒幼红细胞更名为MDS伴环状铁粒幼红细胞伴单系发育异常,难治性血细胞减少伴多系发育异常重新分类为MDS伴环状铁粒幼红细胞伴多系发育异常及MDS伴多系发育异常。
形态学:目前对于发育异常仍采用10%的标准,但有更为详尽的各系特异性发育异常的形态学标准。
关于原始细胞相关分类的修订提议亦无改变,尽管IPSS-R预后分型提出采用2%原始细胞比例来界定不同的危险组,但因实际工作中将0~2%原始细胞比例与>2%~<5%的比例区分开相对困难,可重复性差。
不过仍强调骨髓报告中应指出具体原始细胞比例,而不是<5%。
此外,还有提议将MDS诊断中原始细胞比例从<20%修订为<30%,因为这部分低原始细胞比例的白血病患者进展慢,且部分患者应用类似MDS的治疗有效。
但是,临床顾问委员会并未采纳,这可能还需要在急性髓系白血病中进一步临床验证。
MDS,未分类:在伴有单系/多系发育异常的MDS-U中,外周血原始细胞为1%这个临界值在临床实践中常未得到重现。
因此,委员会提出1%的外周血原始细胞必须是在至少2个不同的时间测量而得,才能将单系/多系发育异常的MDS归为MDS-U。
另外,MDS-U还包括MDS伴有单系发育异常但全血细胞减少(ANC<1.8×10^9/L,HGB <10g/dl,PLT<100×10^9/L)以及MDS相关细胞遗传学异常联合血细胞减少,原始细胞比例外周血<1%,骨髓<5%,且任一系列细胞发育异常比例<10%。
《骨髓增生异常综合征中国诊断与治疗指南》要点

《骨髓增生异常综合征中国诊断与治疗指南》要点1.定义和分类:骨髓增生异常综合征是一组骨髓造血干细胞异常克隆性增生疾病,通常包括骨髓增生异常综合征(MDS)、骨髓增生异常综合征与浆细胞病(MDS/MPN)、骨髓增生异常综合征伴发实质性纤维化(MDS/SF)和骨髓增生异常综合征伴发急性髓样白血病(MDS-AML)等亚型。
2.诊断要点:根据WHO分类标准,结合病史、临床表现、骨髓形态学、细胞遗传学和分子遗传学等指标进行诊断。
对于高度怀疑MDS而骨髓形态学不支持诊断的患者,可以根据细胞遗传学和分子遗传学结果进行诊断。
3.分子遗传学检测:建议对MDS患者进行分子遗传学检测,以帮助病情评估、预后预测和治疗指导。
常见的异常基因包括SF3B1、DNMT3A、TET2、ASXL1和TP53等。
4.风险分层和预后评估:将MDS患者根据细胞遗传学和分子遗传学结果、骨髓形态学和临床指标等进行风险分层,有助于预测患者的预后和制定个体化治疗方案。
5.治疗策略:治疗目标是改善生存质量和延长生存期。
治疗策略主要包括支持性治疗、药物治疗和造血干细胞移植。
6.支持性治疗:包括贫血治疗、感染预防和治疗、止血治疗等。
其中贫血治疗是重点,可以采用红细胞输注、造血生长因子、铁剂和抗贫血药物等。
7.药物治疗:根据不同的亚型、风险分层和患者的整体情况,选择合适的药物治疗方案。
常用的药物包括酸类核苷类似物、克隆性抗体、低剂量化疗药物和靶向治疗药物等。
8.造血干细胞移植:对于高风险和低风险有高危因素的MDS患者,可以考虑进行造血干细胞移植。
对于老年患者或有严重合并症的患者,可以考虑非关联供体或半相合移植。
9.治疗后随访和复发治疗:在治疗后需要进行定期随访,并根据患者的病情进行复发治疗。
总结起来,《骨髓增生异常综合征中国诊断与治疗指南》给出了该疾病的定义和分类,提供了诊断和分层的指导,给出了支持性治疗、药物治疗和造血干细胞移植等治疗策略,并针对不同人群、不同风险分层和不同亚型进行了指南和建议。
第5版who中mds分型诊断标准

第5版who中mds分型诊断标准第 5 版 WHO 中 MDS 分型诊断标准骨髓增生异常综合征(MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,以及高风险向急性髓系白血病转化。
世界卫生组织(WHO)对于 MDS 的分型诊断标准不断更新完善,第 5 版 WHO 中的 MDS 分型诊断标准在临床实践中具有重要的指导意义。
首先,我们来了解一下 MDS 常见的临床表现。
患者通常会出现贫血症状,如乏力、气短、头晕等;也可能有出血倾向,如皮肤瘀点瘀斑、鼻出血、牙龈出血等;还可能伴有感染,表现为发热、咳嗽、咳痰等。
血常规检查往往显示一系或多系血细胞减少。
在第 5 版 WHO 中,MDS 的诊断主要基于以下几个方面。
一是细胞形态学。
通过对骨髓涂片和外周血涂片的观察,评估造血细胞的发育异常情况。
发育异常的特征包括:红细胞系的核出芽、核碎裂、多核、巨幼样变等;粒细胞系的核分叶过少或过多、胞浆内颗粒减少或缺乏、假性 PelgerHuët 畸形等;巨核细胞系的小巨核细胞、单圆核巨核细胞、多圆核巨核细胞等。
需要注意的是,发育异常的细胞应达到一定的比例才能支持 MDS 的诊断。
二是细胞遗传学。
染色体核型分析对于 MDS 的诊断和预后评估具有重要意义。
常见的染色体异常包括-5、-7、5q、+8、20q 等。
某些特定的染色体异常与特定的 MDS 亚型相关。
三是分子生物学。
近年来,随着分子生物学技术的发展,一些基因突变在 MDS 的诊断中也发挥了重要作用。
例如,SF3B1 基因突变在环形铁粒幼细胞性 MDS(MDSRS)中较为常见;TP53 基因突变与不良预后相关等。
接下来,我们详细了解一下第 5 版 WHO 中 MDS 的具体分型。
MDS 伴单系发育异常(MDSSLD):主要表现为一系血细胞减少,且骨髓中该系细胞存在发育异常。
如果原始细胞<5%,环形铁粒幼细胞<15%,则可诊断为 MDSSLD。
骨髓增殖性疾病的诊断和分型

PMF
prePMF
overtPMF
CML加速期诊断标准
ELN、WHO加速期诊断标准中 均强调Ph+中期分裂相中出现
克隆性染色体异常提示AP
在2016修订的WHO指南中, 保留了上述Ph+中期分裂相中
核型演变的概念
提出初诊时Ph+中期分裂相中 出现主要类型附加染色体异常 、复杂核型、3q26重排,提示 加速期诊断
William Dameshek发现很多PV患者伴 有全血细胞增殖,并最终进展为骨 髓纤维化。
4
. Dameshek W. Some speculations on the myeloproliferative syndromes. Blood. 1951;6:372-375
MPN的演化
Ann Rev Pathol Mech Dis. 2016. 11:101–26.
MPN
SM
CMML JMML aCML
PCM1-JAK2
MDS/MPN-RS-T MDS/MPN-u
classic
CML
ET PV
non-classic
CNL
CEL-NOS MPN-u
PMF
prePMF
overtPMF
骨髓增殖性肿瘤的分类 (WHO-2016)
MPN-Eo
• MPN的分类更新概述(WHO-2016)
• MPN的更新
• MPN-Eo的更新 • MDS/MPN的更新
骨髓增殖性肿瘤的分类 (WHO-2016)
MPN-Eo
MDS/MPN
PDGFRA重排
PDGFRB重排
FGFR1重排
MPN
SM
第5版who中mds分型诊断标准

第5版who中mds分型诊断标准近年来,随着医学科技的不断进步,对于骨髓增生异常综合征(MDS)的认识也在不断深化。
为了更准确地诊断和治疗MDS,世界卫生组织(WHO)于2016年发布了第5版MDS分型诊断标准。
MDS是一种由于造血干细胞异常而导致的骨髓造血功能障碍性疾病。
根据WHO的分类标准,MDS可以分为以下几个亚型:骨髓增生异常综合征-单系细胞(MDS-SLD)、骨髓增生异常综合征-多系细胞(MDS-MLD)、骨髓增生异常综合征-未分类(MDS-U)、骨髓增生异常综合征-轻度纤维化(MDS-RS-S)、骨髓增生异常综合征-中度至重度纤维化(MDS-RS-T)、骨髓增生异常综合征-转化为急性髓系白血病(MDS-AML)。
MDS-SLD是指骨髓增生异常综合征中,造血干细胞只分化为一种细胞系,通常是红系或粒系。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较低。
MDS-MLD是指骨髓增生异常综合征中,造血干细胞分化为多种细胞系,包括红系、粒系和巨核系。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较高。
MDS-U是指骨髓增生异常综合征中,无法明确分化为单一细胞系或多种细胞系。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较高。
MDS-RS-S是指骨髓增生异常综合征中,骨髓纤维化程度较轻。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较高。
MDS-RS-T是指骨髓增生异常综合征中,骨髓纤维化程度较重。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较高。
MDS-AML是指骨髓增生异常综合征转化为急性髓系白血病。
这种亚型的患者通常表现为贫血、出血倾向和感染,骨髓中的幼稚细胞比例较高。
根据第5版WHO中MDS分型诊断标准,医生可以根据患者的临床表现、骨髓形态学、细胞遗传学和分子遗传学等方面的信息来确定MDS的亚型。
MDS诊断标准解读2016年

神经递质变化和弥散张量成像 5. 相似的前驱期:如原发性RBD 6. 相似的基因:如家庭成员具有α-突触核蛋白二倍或
三倍体且葡糖脑苷酯酶突变 7. 相似的病理:脑干和皮质的α-突触核蛋白病理
Berg D, et al. Mov Disord. 2014 Apr;29(4):454-62.
Hawkes et al., Parkinsonism and Related Disorders 16 (2010) 79–84
新版帕金森病诊断标准的发布
国际运动障碍协会(MDS)成立 工作小组重新制定PD的诊断标准
谁来决定什么是PD和 “最终”诊断的金标准是 什么?
什么样的临床特征符合PD 的诊断?是否需要包括PD 亚型诊断?是否某些临床诊 断具备特异性?
Ⅰ 单侧震颤肌
强直 运动不能
Ⅱ 双侧发病
Ⅲ 平衡 障碍
Ⅳ
Ⅴ
跌到 坐轮椅或卧床
依赖他人
痴呆
认知功能衰退
病理
肠壁神经丛 嗅球 脑神经Ⅹ
蓝斑 尾状核 巨细胞网状核
交感神经系统
黑质 杏仁核 马特奈基底核 脚桥核
颞叶
TEC CA-2神经层 丘脑核
Braak 分期
前额皮层 第三感觉联 合区
第二;然后 第一运动感 觉区
障碍 • 锥体束征阳性(Babinski征+) • CT扫描可见颅内肿瘤或交通性脑积水 • 用大剂量左旋多巴治疗无效(除外吸收障碍) • MPTP接触史一种阿片类镇痛剂的衍生物
确诊帕金森病需要至少符合3个 以上(含3个)
• 单侧起病 • 静止性震颤 • 逐渐进展 • 发病后多为持续性的不对称
世卫组织(WHO)骨髓瘤和急性白血病临床分型(2016版)

世卫组织(WHO)骨髓瘤和急性白血病临床分型(2016版)整理:血液科那条鱼来源:肿瘤资讯自2008年世卫组织(WHO)血液肿瘤和淋巴瘤临床分型公布之后,骨髓瘤和急性白血病的某些特异性生物学标志物有了长足研究发展,包括基因表达分析和下一代基因测序,对完善疾病的诊断标准以及治疗策略帮助巨大。
因此,WHO纳入最新的临床研究、预后研究、形态学研究、免疫学研究和基因研究等数据,对2008版骨髓瘤和急性白血病临床分型进行修正和更新。
骨髓肿瘤和急性白血病WHO分型骨髓增生性肿瘤(MPN)慢性髓系白血病,BCR-ABL1阳性慢性中性粒细胞白血病真性红细胞增多症原发性骨髓纤维化(PMF)原发性骨髓纤维化,纤维化前期/早期阶段原发性骨髓纤维化,纤维化明显期原发性血小板增多症慢性嗜酸粒细胞白血病,未另作规定(NOS)骨髓增生性肿瘤,未归类肥大细胞增多症髓系/淋系肿瘤伴嗜酸性粒细胞增多和PDGFRA、PDGFRA或FGFR1基因异常,或伴PCM1-JAK2髓系/淋系肿瘤伴PDGFRA基因重组髓系/淋系肿瘤伴PDGFRB基因重组髓系/淋系肿瘤伴FGFR1基因重组暂时分型:髓系/淋系肿瘤伴PCM1-JAK2骨髓增生异常/骨髓增生性肿瘤(MDS/MPN)慢性粒单核细胞白血病(CMML)不典型慢性髓系白血病,BCR-ABL1阴性幼年型粒单核细胞白血病骨髓增生异常综合征/骨髓增生性肿瘤伴环状铁粒幼红细胞和血小板增多(MDS/MPN-RS-T)骨髓增生异常综合征(MDS)MDS伴单系发育异常MDS伴环状铁粒幼红细胞MDS伴单系发育异常和环状铁粒幼红细胞MDS伴多系发育异常MDS伴原始细胞过多MDS伴异常核型del(5q)未分类MDS暂时分型:儿童难治性血细胞减少骨髓肿瘤伴生殖细胞倾向急性髓系白血病(AML)和相关肿瘤AML伴重现型遗传异常AML伴t(8;21)(q22;q22.1);RUNX1-RUNX1T1AML伴inv(16)(p13.1q22) 或t(16;16)(p13.1;q22);CBFB-MYH11AML伴PML-RARAAML伴t(9;11)(p21.3;q23.3); MLLT3-KMT2AAML伴t(6;9)(p23;q34.1); DEK-NUP214AML伴inv(3)(q21.3q26.2) 或t(3;3)(q21.3;q26.2); GATA2,MECOMAML(巨核细胞)伴t(1;22)(p13.3;q13.3); RBM15-MKL1暂时分型:AML伴BCR-ABL1AML伴NPM1突变AML伴CEBPA等位基因突变暂时分型:AML伴RUNX1突变急性髓系白血病伴脊髓发育异常相关改变治疗相关骨髓肿瘤急性髓系白血病,NOSAML伴微分化型AML伴未成熟型急性粒-单核细胞白血病急性单核细胞白血病纯红系白血病急性巨核细胞白血病急性嗜碱性粒细胞性白血病急性全髓白血病伴骨髓纤维化骨髓肉瘤唐氏综合征相关性骨髓增生一过性骨髓细胞生成异常唐氏综合征相关性髓系白血病系列不明性急性白血病急性未分化性白血病混合表型急性白血病伴t(9;22)(q34.1;q11.2); BCR-ABL1 混合表型急性白血病伴t(v;11q23.3); MLL重组混合表型急性白血病,B/髓系,NOS混合表型急性白血病,T/髓系,NOSB淋巴细胞白血病/淋巴瘤B淋巴细胞白血病/淋巴瘤,NOSB淋巴细胞白血病/淋巴瘤伴重现性细胞遗传学异常B淋巴细胞白血病/淋巴瘤伴t(9;22)(q34.1;q11.2);BCR-ABL1B淋巴细胞白血病/淋巴瘤伴t(v;11q23.3);KMT2A重组B淋巴细胞白血病/淋巴瘤伴t(12;21)(p13.2;q22.1); ETV6-RUNX1B淋巴细胞白血病/淋巴瘤伴超二倍体核型B淋巴细胞白血病/淋巴瘤伴亚二倍体核型B淋巴细胞白血病/淋巴瘤伴t(5;14)(q31.1;q32.3) IL3-IGHB淋巴细胞白血病/淋巴瘤伴t(1;19)(q23;p13.3);TCF3-PBX1暂时分型:BCR-ABL1样B淋巴细胞白血病/淋巴瘤暂时分型:B淋巴细胞白血病/淋巴瘤伴iAMP21T淋巴细胞白血病/淋巴瘤暂时分型:早期前T细胞淋巴细胞白血病暂时分型:自然杀伤(NK)细胞淋巴细胞白血病/淋巴瘤慢性髓系白血病加速期的诊断标准符合下列至少1项血液学/细胞学指标或TKI治疗响应条件·白细胞计数持续性增加(>10 x 10^9/L),且治疗无效。
2016年MDS的WHO新分型标准

2016年WHO有关骨髓增生异常综合症亚型更改预告? ?基于临床顾问委员会的建议,该版修订将把MDS中影响疾病分型的一些新的发现进行整合。
WHO分型中基本诊断原则不变,但提出了一些亚型的改变。
分型命名:在WHO分类中,MDS分型主要强调的是发育异常和原始细胞计数,而不是血细胞减少,但“血细胞减少”或“贫血”在MDS几乎各个亚型的名称中均存在,且在IPSS-R预后积分系统中有着重要意义。
另外,在难治性血细胞减少伴单系发育异常中,发育异常的类型并非总与血细胞减少的系别相一致。
因此难治性贫血、难治性中性粒细胞减少和难治性血小板减少这些亚型将被统一命名为MDS伴单系发育异常,难治性贫血伴环状铁粒幼红细胞更名为MDS伴环状铁粒幼红细胞伴单系发育异常,难治性血细胞减少伴多系发育异常重新分类为MDS伴环状铁粒幼红细胞伴多系发育异常及MDS伴多系发育异常。
? ? 形态学:目前对于发育异常仍采用10%的标准,但有更为详尽的各系特异性发育异常的形态学标准。
关于原始细胞相关分类的修订提议亦无改变,尽管IPSS-R预后分型提出采用2%原始细胞比例来界定不同的危险组,但因实际工作中将0~2%原始细胞比例与>2%~<5%的比例区分开相对困难,可重复性差。
不过仍强调骨髓报告中应指出具体原始细胞比例,而不是<5%。
此外,还有提议将MDS诊断中原始细胞比例从<20%修订为<30%,因为这部分低原始细胞比例的白血病患者进展慢,且部分患者应用类似MDS的治疗有效。
但是,临床顾问委员会并未采纳,这可能还需要在急性髓系白血病中进一步临床验证。
MDS,未分类:在伴有单系/多系发育异常的MDS-U中,外周血原始细胞为1%这个临界值在临床实践中常未得到重现。
因此,委员会提出1%的外周血原始细胞必须是在至少2个不同的时间测量而得,才能将单系/多系发育异常的MDS归为MDS-U。
另外,MDS-U还包括MDS伴有单系发育异常但全血细胞减少(ANC<1.8×10^9/L,HGB <10g/dl,PLT<100×10^9/L)以及MDS相关细胞遗传学异常联合血细胞减少,原始细胞比例外周血<1%,骨髓<5%,且任一系列细胞发育异常比例<10%。
WHO2016年骨髓增殖性肿瘤解读

WHO2016年骨髓增殖性肿瘤解读骨髓增殖性肿瘤(MPNs)MPNs包括慢性髓性白血病(CML)、真性红细胞增多症(PV)、原发性骨髓纤维化(PMF)、原发性血小板增多症(ET)、慢性嗜酸细胞白血病(CEL)、慢性中性粒细胞白血病(CNL)和肥大细胞增多症。
1、CML CML诊断依然有赖于Ph染色体及BCR-ABL融合基因,骨髓穿刺必做,并行染色体检查,定期监测BCR-ABL融合基因负荷。
主要更新在加速期的标准:与治疗无关的白细胞计数进行性升高(>10×10^9/L);与治疗无关的血小板持续性减少(9/L)或增多(>1000×10^9/L);与治疗无关的脾脏进行性肿大;外周血中嗜碱粒细胞≥20%;原始细胞在血和(或)骨髓有核细胞中占10%~19%;新增的染色体异常如“主要路径异常[+Ph,+8,i(17q),+19]”,复杂核型或3q26.2异常;治疗过程中Ph阳性克隆出现新的染色体异常。
专门强调了累及主要路径的染色体异常重要意义。
CML已经处在酪氨酸激酶抑制剂(TKI)时代,因此也暂时建议在TKI抵抗情况时考虑CML进入加速期:对第1个TKI血液学抵抗(或对第1个TKI未获得血液学缓解);或任何血液学、细胞遗传学、分子生物学指标提示对两个序贯使用的TKI抵抗;在TKI治疗期间BCR-ABL1出现2个以上基因突变。
2、PV 由于基因检测广泛开展,新标准降低了对血红蛋白、红细胞压积的要求(一),男性Hb和HCT分别由185g/L、55.5%降至185g/L、55.5%,女性则由165g/L、49.5%降至160g/L、48.5%。
甚至在显著红系增生且JAK2基因突变时,不必骨髓涂片检查就能诊断PV,但鉴于诊断时骨髓纤维化仅能通过骨髓病理发现(约占诊断PV时的20%),而这类患者将明显更快的进展至post-PV MF,故骨髓活检是必须的。
一、真性红细胞增多症(PV) WHO 2016诊断标准确诊需要满足3项主要标准,或者前2项主要标准及1项次要标准主要标准1、Hb >165 g/L(男性),Hb >160g/L (女性)或HCT > 49%(男性), HCT > 48%(女性)或者红细胞容积在正常预测均值的基础上升高> 25%。
2016年世界卫生组织(WHO)髓系肿瘤新分类
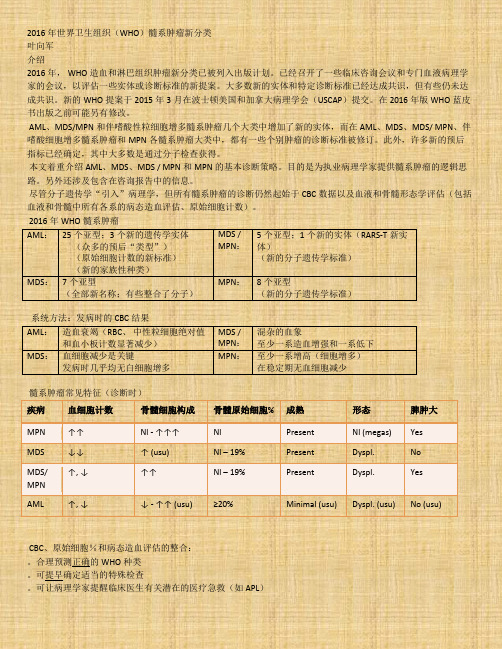
2016年世界卫生组织(WHO)髓系肿瘤新分类叶向军介绍2016年, WHO造血和淋巴组织肿瘤新分类已被列入出版计划。
已经召开了一些临床咨询会议和专门血液病理学家的会议,以评估一些实体或诊断标准的新提案。
大多数新的实体和特定诊断标准已经达成共识,但有些仍未达成共识。
新的WHO提案于2015年3月在波士顿美国和加拿大病理学会(USCAP)提交。
在2016年版WHO蓝皮书出版之前可能另有修改。
AML、MDS/MPN和伴嗜酸性粒细胞增多髓系肿瘤几个大类中增加了新的实体,而在AML、MDS、MDS/ MPN、伴嗜酸细胞增多髓系肿瘤和MPN各髓系肿瘤大类中,都有一些个别肿瘤的诊断标准被修订。
此外,许多新的预后指标已经确定,其中大多数是通过分子检查获得。
本文着重介绍AML、MDS、MDS / MPN和MPN的基本诊断策略。
目的是为执业病理学家提供髓系肿瘤的逻辑思路。
另外还涉及包含在咨询报告中的信息。
尽管分子遗传学“引入”病理学,但所有髓系肿瘤的诊断仍然起始于CBC数据以及血液和骨髓形态学评估(包括血液和骨髓中所有各系的病态造血评估、原始细胞计数)。
2016年WHO髓系肿瘤AML:25个亚型;3个新的遗传学实体(众多的预后“类型”)(原始细胞计数的新标准)(新的家族性种类)MDS /MPN:5个亚型;1个新的实体(RARS-T新实体)(新的分子遗传学标准)MDS:7个亚型(全部新名称;有些整合了分子)MPN:8个亚型(新的分子遗传学标准)系统方法:发病时的CBC结果AML:造血衰竭(RBC、中性粒细胞绝对值和血小板计数显著减少)MDS /MPN:混杂的血象至少一系造血增强和一系低下MDS:血细胞减少是关键发病时几乎均无白细胞增多MPN:至少一系增高(细胞增多)在稳定期无血细胞减少髓系肿瘤常见特征(诊断时)疾病血细胞计数骨髓细胞构成骨髓原始细胞% 成熟形态脾肿大MPN ↑↑ Nl - ↑↑↑ Nl Present Nl (megas) Yes MDS ↓↓ ↑ (usu) Nl – 19% Present Dyspl. NoMDS/MPN↑, ↓ ↑↑ Nl – 19% Present Dyspl. Yes AML ↑, ↓ ↓ - ↑↑ (usu) ≥20% Minimal (usu) Dyspl. (usu) No (usu)CBC、原始细胞%和病态造血评估的整合:。
2016年MDS的WHO新分型标准

2016年WHO有关骨髓增生异常综合症亚型更改预告基于临床顾问委员会的建议,该版修订将把MDS中影响疾病分型的一些新的发现进行整合。
WHO分型中基本诊断原则不变,但提出了一些亚型的改变。
分型命名:在WHO分类中,MDS分型主要强调的是发育异常和原始细胞计数,而不是血细胞减少,但“血细胞减少”或“贫血”在MDS几乎各个亚型的名称中均存在,且在IPSS-R预后积分系统中有着重要意义。
另外,在难治性血细胞减少伴单系发育异常中,发育异常的类型并非总与血细胞减少的系别相一致。
因此难治性贫血、难治性中性粒细胞减少和难治性血小板减少这些亚型将被统一命名为MDS伴单系发育异常,难治性贫血伴环状铁粒幼红细胞更名为MDS伴环状铁粒幼红细胞伴单系发育异常,难治性血细胞减少伴多系发育异常重新分类为MDS伴环状铁粒幼红细胞伴多系发育异常及MDS伴多系发育异常。
形态学:目前对于发育异常仍采用10%的标准,但有更为详尽的各系特异性发育异常的形态学标准。
关于原始细胞相关分类的修订提议亦无改变,尽管IPSS-R预后分型提出采用2%原始细胞比例来界定不同的危险组,但因实际工作中将0~2%原始细胞比例与>2%~<5%的比例区分开相对困难,可重复性差。
不过仍强调骨髓报告中应指出具体原始细胞比例,而不是<5%。
此外,还有提议将MDS诊断中原始细胞比例从<20%修订为<30%,因为这部分低原始细胞比例的白血病患者进展慢,且部分患者应用类似MDS的治疗有效。
但是,临床顾问委员会并未采纳,这可能还需要在急性髓系白血病中进一步临床验证。
MDS,未分类:在伴有单系/多系发育异常的MDS-U中,外周血原始细胞为1%这个临界值在临床实践中常未得到重现。
因此,委员会提出1%的外周血原始细胞必须是在至少2个不同的时间测量而得,才能将单系/多系发育异常的MDS归为MDS-U。
另外,MDS-U还包括MDS伴有单系发育异常但全血细胞减少(ANC<1.8×10^9/L,HGB <10g/dl,PLT<100×10^9/L)以及MDS相关细胞遗传学异常联合血细胞减少,原始细胞比例外周血<1%,骨髓<5%,且任一系列细胞发育异常比例<10%。
2016年髓系肿瘤和急性白血病的WHO分类

2016年髓系肿瘤和急性白血病的WHO分类骨髓增殖性肿瘤慢性粒细胞白血病,BCR-ABL1阳性慢性中性粒细胞白血病真性红细胞增多症原发性骨髓纤维化原发性骨髓纤维化,纤维化前/早期原发性骨髓纤维化,明显纤维化期特发性血小板增多症慢性嗜酸粒细胞性白血病,NOS骨髓增殖性肿瘤,无法分类肥大细胞增多症伴嗜酸粒细胞增多和PDGFRA,PDGFRB或FGFR1异常,或伴PCM1-JAK2的髓系或淋系肿瘤伴PDGFRA重排的髓系或淋系肿瘤伴PDGFRB重排的髓系或淋系肿瘤伴FGFR1重排的髓系或淋系肿瘤临时病种:伴PCM1-JAK2的髓系或淋系肿瘤骨髓增生异常/骨髓增殖性肿瘤(MDS / MPN)慢性粒单细胞白血病不典型慢性粒细胞白血病,BCR-ABL1阴性幼年型粒单细胞白血病伴环形铁粒幼细胞和血小板增多的骨髓增生异常/骨髓增殖性肿瘤(MDS/MPN-RS-T)骨髓增生异常/骨髓增殖性肿瘤,无法分类骨髓增生异常综合征(MDS)伴单系病态造血的MDS伴环形铁粒幼细胞的MDS伴环形铁粒幼细胞和单系病态造血的MDS伴环形铁粒幼细胞和多系病态造血的MDS伴多系病态造血的MDS伴原始细胞过多的MDS伴孤立del(5q)的MDSMDS,不能分类临时病种:儿童期难治性血细胞减少症伴胚系素因的髓系肿瘤急性髓系白血病和相关肿瘤伴重现性遗传学异常急性髓系白血病AML伴t(8;21)(q22;q22.1); RUNX1-RUNX1T1AML伴inv(16)(p13.1q22) 或t(16;16)(p13.1;q22); CBFB-MYH11APL 伴PML-RARAAML伴t(9;11)(p21.3;q23.3); MLLT3-KMT2AAML 伴t(6;9)(p23;q34.1); DEK-NUP214AML 伴inv(3)(q21.3q26.2)或t(3;3)(q21.3;q26.2); GATA2, MECOMAML (原始巨核细胞) 伴t(1;22)(p13.3;q13.3); RBM15-MKL1临时病种: AML伴BCR-ABL1AML伴突变的NPM1AML伴CEBPA双等位基因突变临时病种: AML 伴RUNX1突变伴骨髓增生异常相关改变急性髓系白血病治疗相关髓系肿瘤急性髓系白血病,NOSAML微分化型AML不伴成熟型AML伴成熟型急性粒单细胞白血病急性原始单核细胞/单核细胞白血病纯红系白血病急性原始巨核细胞白血病急性嗜碱粒细胞白血病急性全髓增殖伴骨髓纤维化髓系肉瘤唐氏综合征相关髓系增殖暂时异常的髓系造血唐氏综合征相关髓系白血病系列未明急性白血病急性未分化型白血病混合表型急性白血病伴t(9;22)(q34.1;q11.2); BCR-ABL1混合表型急性白血病伴t(v;11q23.3); MLL重排混合表型急性白血病,B /髓系,NOS混合表型急性白血病,T /髓系,NOSB原始淋巴细胞白血病/淋巴瘤B原始淋巴细胞白血病/淋巴瘤,NOSB原始淋巴细胞白血病/淋巴瘤伴重现性遗传学异常B原始淋巴细胞白血病/淋巴瘤伴t(9;22)(q34.1;q11.2);BCR-ABL1B原始淋巴细胞白血病/淋巴瘤伴t(v;11q23.3);KMT2A重排B原始淋巴细胞白血病/淋巴瘤伴t(12;21)(p13.2;q22.1); ETV6-RUNX1B原始淋巴细胞白血病/淋巴瘤伴超二倍体B原始淋巴细胞白血病/淋巴瘤伴低二倍体B原始淋巴细胞白血病/淋巴瘤伴t(5;14)(q31.1;q32.3) IL3-IGHB原始淋巴细胞白血病/淋巴瘤伴t(1;19)(q23;p13.3);TCF3-PBX1临时病种:B原始淋巴细胞白血病/淋巴瘤,BCR-ABL1样临时病种:B原始淋巴细胞白血病/淋巴瘤伴iAMP21T原始淋巴细胞病/淋巴瘤临时病种:早期T细胞前体原始淋巴细胞白血病临时病种:自然杀伤(NK)细胞原始淋巴细胞白血病/淋巴瘤。
MDS-MPN类型及其诊断(WHO,2016)解读

MDS-MPN类型及其诊断(WHO,2016)解读MDS-MPN(骨髓增生异常-骨髓增殖性肿瘤)为MDS/MPN (myelodysplastic/myeloproliferativeneoplasms)的中文译名。
它是一组临床、实验室和形态特征上既有骨髓增生异常综合征(MDS)又有骨髓增殖性肿瘤(MPN)相互重叠或复合的髓系肿瘤。
根据积累的分子学异常证据,在MDS-MPN不能分类组中的一种临时病种——难治性贫血伴环形铁粒幼细胞和血小板明显增多(RARS-T),被认可为一个正式病种(类型),称为MDS-MPN伴环形铁粒幼细胞和血小板增多(MDS-MPNwithringsideroblastsandthrombocytosis,MDS-MPN-RS-T)。
表1 MDS - MPN类型慢性粒细胞白血病(CMML)不典型慢性粒细胞白血病,BCR-ABL1阴性(aCML)幼年型粒单细胞白血病(JMML)MDS-MPN伴环形铁粒幼细胞和血小板增多*,即2008年版的临时病种“RARS-T”骨髓增生异常-骨髓增殖性肿瘤,不能分类型(MDS-MPN,U)*为转正的“新”病种(类型)在髓系肿瘤中,靶向测序突变基因,发现慢性粒单核细胞白血病(CMML)及其他MDS-MPN患者中有高的阳性率。
CMML最常突变的基因是SRSF2,TET2和(或)ASXL1(> 80%病例)。
频率较低的其他突变有SETBP1,NRAS / KRA S,RUNX1,CBL和EZH2。
在疑难病例中,这些指标可以成为有用的辅助诊断,尤其在常为正常核型的CMML中。
但是,这一些突变也见于健康老年人,即所谓不确定潜在影响的克隆性造血(clonalhematopoiesisofindeterminate potential,CHIP),故不宜单独用作肿瘤诊断的证据。
ASXL1是侵袭性疾病行为的预测指标,同核型及临床病理参数被一起纳入CMML预后评分系统。
2016年who颁布的mds诊断和分型标准

2016年who颁布的mds诊断和分型标准下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor.I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!2016年WHO MDS诊断与分型标准:一次里程碑式的更新在2016年,世界卫生组织(WHO)发布了一项关于骨髓增生异常综合征(MDS)的全新诊断和分型标准,这是对这一复杂疾病理解的又一重大进展。
WHO2016年骨髓增殖性肿瘤解读

WHO2016 年骨髓增殖性肿瘤解读骨髓增殖性肿瘤(MPNs )MPNs包括慢性髓性白血病(CML)、真性红细胞增多症(PV)、原发性骨髓纤维化(PMF)、原发性血小板增多症(ET))慢性嗜酸细胞白血病(CEL)、慢性中性粒细胞白血病(CNL)和肥大细胞增多症。
1、CML CML 诊断依然有赖于Ph 染色体及BCR-ABL融合基因,骨髓穿刺必做,并行染色体检查,定期监测BCR-ABL 融合基因负荷。
主要更新在加速期的标准:与治疗无关的白细胞计数进行性升高(>10 X 10A9/L );与治疗无关的血小板持续性减少(9/L、或增多(>1000X 10A9/L );与治疗无关的脾脏进行性肿大;外周血中嗜碱粒细胞》20%原始细胞在血和(或)骨髓有核细胞中占10%~19%;新增的染色体异常如“主要路径异常[+Ph , +8 , i (17q), +19]”,复杂核型或3q26.2 异常;治疗过程中Ph 阳性克隆出现新的染色体异常。
专门强调了累及主要路径的染色体异常重要意义。
CML已经处在酪氨酸激酶抑制剂(TKI)时代,因此也暂时建议在TKI 抵抗情况时考虑CML 进入加速期:对第 1 个TKI 血液学抵抗(或对第 1 个TKI 未获得血液学缓解);或任何血液学、细胞遗传学、分子生物学指标提示对两个序贯使用的TKI 抵抗;在TKI 治疗期间BCR-ABL1 出现2 个以上基因突变2、PV 由于基因检测广泛开展,新标准降低了对血红蛋白、红细胞压积的要求(一),男性Hb 和HCT 分别由185g/L 、55.5%降至185g/L 、55.5%,女性则由165g/L 、49.5% 降至160g/L 、48.5%。
甚至在显著红系增生且JAK2 基因突变时,不必骨髓涂片检查就能诊断PV,但鉴于诊断时骨髓纤维化仅能通过骨髓病理发现(约占诊断PV 时的20%),而这类患者将明显更快的进展至post-PV MF ,故骨髓活检是必须的。
MDS类型及其诊断(WHO,2016)解读80224

MDS类型及其诊断(WHO,2016)解读一、修订的MDS类型MDS是一组以无效造血、病态形态和外周血细胞减少为特征的克隆性髓系肿瘤。
修订后的MDS分类类型,见表1。
MDS的病名变化很大,在形态学解释和血细胞减少评估上有了改进,同时增加了积累的遗传学信息对MDS的影响。
血细胞减少是任何MDS分类和诊断之前的一个“必要条件”,以前MDS 病种的命名包括“血细胞减少”或特定类型的血细胞减少(例如“难治性血细胞减少症”、“难治性贫血”)。
不过,WHO分类和诊断的主要依据是以病态造血的程度和原始细胞的比例为基础。
在MDS病例中,有显著形态学异常(病态造血)的系列与外周血血细胞减少的系列常不相符。
因此,在成人MDS中,诸如“难治性贫血”和“难治性血细胞减少”等术语的称呼被删除,取而代之的是“骨髓增生异常综合征(MDS)”后跟适当的修饰:如MDS伴单系与多系病态造血、环形铁粒幼细胞、原始细胞增多(过多),或del(5q)细胞遗传学异常(表1)。
MDS类型的病名变化是这次修订的最大变化。
MDS伴环形铁粒幼细胞(MDS-RS)分为两个类型:MDS伴单系病态造血和环形铁粒幼细胞(MDS-RS-SLD)和MDS伴多系病态造血和环形铁粒幼细胞(MDS-RS-MLD)。
MDS-RS-SLD即为2008年分类的难治性贫血伴环形铁粒幼细胞(RARS),MDS-RS-MLD即为2001年的伴多系病态造血和环形铁粒幼细胞难治性血细胞减少症(RCMD-RS),而在2008年分类中被删除(并入RCMD)的类型。
儿童MDS的内容无变化,儿童难治性血细胞减少症仍然是这一类别中的临时病种。
表1 MDS分类类型及其外周血、骨髓和细胞遗传学所见名称病态造血系列细胞减少系列*环形铁粒幼细胞%骨髓和外周血原始细胞常规核型分析MDS伴单系病态造血(M DS-SLD)11或2<15%或<5%**骨髓<5%,外周血<1%,无Auer小体任何核型,但不符合伴孤立del(5q)MDS标准MDS伴多系病态造血(M DS-MLD)2或31~3<15%或<5%**骨髓<5%,外周血<1%,无Auer小体任何核型,但不符合伴孤立del(5q)MDS标准MDS伴环形铁粒幼细胞(MDS-RS)MDS-RS-SLD11或2≥15%或≥5%**骨髓<5%,外周血<1%,无Auer小体任何核型,但不符合伴孤立del(5q)MDS标准MDS-RS-MLD2或31~3≥15%或≥5%**骨髓< 5%,外周血<1%,无Auer小体任何核型,但不符合伴孤立del(5q)MDS标准MDS伴孤立del(5q)1~31或2任何比例骨髓<5%,外周血<1%,无Auer小体仅有del(5q),可以伴有1个其他异常(-7或del(7q)除外)MDS伴原始细胞增多(MDS-EB)MDS-EB-10~31~3任何比例骨髓5%~9%或外周血2%~4%,无Auer小体任何核型MDS-EB-20~31~3任何比例骨髓10%~19%或外周血5%~19%或有Auer小体任何核型MDS,不能分类型(MDS-U)血中有1%的原始细胞1~31~3任何比例骨髓<5%,外周血=1%***,无Auer小体任何核型单系病态造血并全血细胞减少13任何比例骨髓<5%,外周血<1%,无Auer小体任何核型根据定义的细胞遗传学异常01~3<15%△骨髓<5%,外周血<1%,无Auer小体有定义MDS的核型异常儿童难治性血细胞减少症1~31~3无骨髓<5%,外周血<2%任何核型*血细胞减少的定义为血红蛋白<100g/L,血小板计数<100×109/L,中性粒细胞绝对计数<1.8×109/ L;极少情况下,MDS可见这些水平以上的轻度贫血或血小板减少;外周血单核细胞必须<1×109/L;**如果存在SF3B1突变;***外周血1%的原始细胞必须有两次不同场合检查的记录;△若环形铁粒幼细胞≥15%的病例有红系明显病态造血,则归类为MDS-RS-SLD二、MDS类型诊断与鉴别诊断MDS类型外周血、骨髓和细胞遗传学所见,见表1。
MDS诊断标准解读2016年

Postuma RB,et al. Mov Disord. 2015 Oct;30(12):1591-601.
Centrality of Motor Syndrome Parkinsonism and PD
• Since its original description, the clinical diagnosis of PD has centered on a defined motor syndrome.
障碍 • 锥体束征阳性(Babinski征+) • CT扫描可见颅内肿瘤或交通性脑积水 • 用大剂量左旋多巴治疗无效(除外吸收障碍) • MPTP接触史一种阿片类镇痛剂的衍生物
确诊帕金森病需要至少符合3个 以上(含3个)
• 单侧起病 • 静止性震颤 • 逐渐进展 • 发病后多为持续性的不对称
性受累 • 对左旋多巴的治疗反应非常
• In this criteria, the centrality of the motor syndrome remains the core feature.
• Like previous criteria, the MDS criteria use a two-step process of PD diagnosis.
• 多巴胺能药物治疗具有明确且显著的有效应答 • 出现左旋多巴诱导的异动症
• 存在嗅觉丧失或心脏MIBG闪烁显像法显示 存在心脏去交感神经支配
如何定义对多巴胺能治疗有明显应答?
A
在初始治疗期间,患者的功能恢复正常或接近正常水平
B
在没有明确记录的情况下,初始治疗显著应答可分为以下两种情况:
1
药物剂量增加时症状显著改善,减少时症状显著加重;不包
解读骨髓增生异常综合征WHO(2016)分型的修订

解读骨髓增生异常综合征WHO(2016)分型的修订浦权【期刊名称】《新医学》【年(卷),期】2017(048)003【摘要】World Health Organization(WHO)published the 3rd and 4th editions of the classification of tumors of hematopoietic and lymphoid tissues in 2001 and 2008. Over the previous 8 years of scientific and clinical research,considerable progression has been achieved in terms of the recognition of specific biomarkers related to myelodysplastic syndrome (MDS)and other myeloid neoplasms. The 4th edition of the classification scheme requires further revisions. In this article,the revised WHO classification of myelodysplastic syndromes was summarized to provide the evidence for revisions.%在2001年和2008年,WHO相继发表了造血和淋巴组织肿瘤WHO分型的第3和第4版本.此后,经过8年的科学和临床研究,与骨髓增生异常综合征(MDS)和其它髓细胞系肿瘤相关的特异性生物标记物的识别均已取得长足进展.由此,笔者有感现有的第4版本分型系统确须加以修订,遂总结了MDS WHO(2016)分型修订的主要内容,并提供修订理由.【总页数】6页(P137-142)【作者】浦权【作者单位】200438 上海,上海市东医院浦权MDS西医与汉方结合诊治基地【正文语种】中文【相关文献】1.2016版《建筑防水卷材生产许可证实施细则》修订要点解读 [J], 朱志远2.ERS 2016:中国哮喘防治指南2016修订版解读 [J],3.特殊类型的骨髓增生异常综合征(附:WHO关于骨髓增生异常综合征的新分型) [J], 朱蕾;卢兴国4.基于2016 WHO分型和IPSS-R危险分层的老年骨髓增生异常综合征分析 [J], 韩旗;马金龙;顾岩;宋慧慧;高冲;陈宝安;葛峥5.日本幽门螺杆菌感染管理指南(2016修订版)解读 [J], 王芬因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
MDS-MPN类型及其诊断(WHO,2016)解读
MDS-MPN(骨髓增生异常-骨髓增殖性肿瘤)为MDS/MPN (myelodysplastic/myeloproliferativeneoplasms)的中文译名。
它是一组临床、实验室和形态特征上既有骨髓增生异常综合征(MDS)又有骨髓增殖性肿瘤(MPN)相互重叠或复合的髓系肿瘤。
根据积累的分子学异常证据,在MDS-MPN不能分类组中的一种临时病种——难治性贫血伴环形铁粒幼细胞和血小板明显增多(RARS-T),被认可为一个正式病种(类型),称为MDS-MPN伴环形铁粒幼细胞和血小板增多(MDS-MPNwithringsideroblastsandthrombocytosis,MDS-MPN-RS-T)。
表1 MDS - MPN类型
慢性粒细胞白血病(CMML)
不典型慢性粒细胞白血病,BCR-ABL1阴性(aCML)
幼年型粒单细胞白血病(JMML)
MDS-MPN伴环形铁粒幼细胞和血小板增多*,即2008年版的临时病种“RARS-T”
骨髓增生异常-骨髓增殖性肿瘤,不能分类型(MDS-MPN,U)
*为转正的“新”病种(类型)
在髓系肿瘤中,靶向测序突变基因,发现慢性粒单核细胞白血病(CMML)及其他MDS-MPN患者中有高的阳性率。
CMML最常突变的基因是SRSF2,TET2和(或)ASXL1(> 80%病例)。
频率较低的其他突变有SETBP1,NRAS / KRA S,RUNX1,CBL和EZH2。
在疑难病例中,这些指标可以成为有用的辅助诊断,尤其在常为正常核型的CMML中。
但是,这一些突变也见于健康老年人,即所谓不确定潜在影响的
克隆性造血(clonalhematopoiesisofindeterminate potential,CHIP),故不宜单独用作肿瘤诊断的证据。
ASXL1是侵袭性疾病行为的预测指标,同核型及临床病理参数被一起纳入CMML预后评分系统。
值得注意的是,NPM1突变少见于CMML(3%~5%),似乎也预示着较为侵袭的临床经过。
一、慢性粒单细胞白血病(CMML)
诊断CMML要求外周血(PB)单核细胞持续增多≥1×109/ L,且占白细胞分类≥10%。
由于所谓CMML 的“增殖型”(白细胞计数> 13×109/ L)和“增生异常型”(WBC <13×109/ L)之间的分子和临床,存在差异,特别是与RAS / MAPK信号传导途径异常有关的差异,故有必要加以区分。
CMML的诊断标准见表2。
表2 慢性粒单核细胞白血病(CMML)诊断标准
①外周血单核细胞持续增多(≥1×109/L),单核细胞比例≥10%
②不符合WHO关于BCR-ABL1阳性CML、PMF、PV或ET的诊断标准*
③无PDGFRA,PDGFRB或FGFR1基因重排,或PCM1-JAK2融合证据(在嗜酸粒细胞增多病例中应予以排除)
④外周血和骨髓中原始细胞比例<20%**
⑤髓系细胞≥1系病态造血
无或极少病态造血时,如果符合以下标准仍可以作出CMML的诊断
⑥造血细胞存在获得性克隆性细胞遗传或分子异常***,或者
⑦单核细胞增多(定义如前)持续3个月以上,并排除导致单核细胞增多的其他原因
* MPN可以伴有单核细胞增多,或者在疾病过程中出现,而类似CMML。
在这些少数病例中,先前的MPN史排除CMML,而骨髓中存在MPN特征和(或)MPN相关的突变(JAK2,CALR或MPL)支持MPN伴单核细胞增多的诊断,而不是CMML
**幼单核细胞属于单核细胞前体,在CMML中是计入原始细胞等同意义的细胞。
幼单核细胞有丰富的浅灰色或稍嗜碱性胞质伴有少许零星、纤细的淡紫色颗粒,细致分布的点状核染色质,核仁不定,轻微的核折叠或折皱。
外周血和骨髓可以出现的异常单核细胞,则不能计数为原始细胞的等同意义细胞
***在疑难病例中,检出常与CMML相关的基因突变(例如TET2,SRSF2,ASXL1,SETBP1),可以支持CMML诊断。
需要注意的是,这些突变可以是与年龄相关或存在亚克隆,在解释这些遗传学结果时需要慎重
在第3版中提出CMML中,原始细胞比例高低有明确的预后价值并在第4版得到了肯定。
最近证据表明,基于原始细胞的3个亚型可以获得更好的预后评判。
这三个亚型的诊断标准见表3。
表3 慢性粒单细胞白血病(CMML)3个亚型诊断标准
亚型外周血骨髓
CMML-0 原始细胞<2%原始细胞<5%
CMML-1 原始细胞2%~4%原始细胞5%~9%
CMML-2 原始细胞5%~19%和
(或)有Auer小体原始细胞10%~19%和(或)有Auer小体
CMML-0外周血和骨髓中的原始细胞比例都要符合;CMML-1外周血和(或)骨髓中的原始细胞比例符合;CMML-2外周血和(或)骨髓中的原始细胞比例符合,和(或)有Auer小体
在2016年修订中,将CMML-0(新类型)纳入分类方案。
区分幼单核细胞(原始细胞等同意义细胞)与单核细胞很重要,形态学检查是评估的重要方法,并适当整合流式细胞免疫表型、细胞遗传学及分子学检查的信息。
其他要求见本微信公众号本次感想谈中的第一篇——2016年WHO髓系肿瘤分类修订概要解读。
在作出CMML诊断之前,必须排除其他疾病。
所有病例应排除
BCR-ABL1,有嗜酸粒细胞增多者还需要排除PDGFRA,PDGFRB,FGFR1重排或PCM1-JAK2融合基因。
通常还需要排除MPN中的一些类型(见本微信公众号本次感想谈中的第四篇——MPN类型与诊断,WHO,2016)。
二、不典型CML,BCR-ABL1阴性(aCML)
MDS-MPN的罕见亚型,aCML的分子特征被基本阐明。
现在,可以较容易地与一种类似中性粒细胞增多特征的罕见MPN类型——慢性中性粒细胞白血病(CNL)作出区别。
CNL与CSF3R突变显著相关,而在aCML中这一突变少见(<10%)。
相反,1/3的aCML患者与SETBP1和(或)ETNK1突变有关。
在aCML中,还通常缺乏所谓MPN相关驱动型基因(JAK2,CALR,MPL)的突变。
aCML诊断标准见表4。
表4 不典型慢性粒细胞白血病(aCML)诊断标准
外周血白细胞增高,中性粒细胞及其前体细胞(早幼粒细胞,中幼粒细胞,晚幼粒细胞,占白细胞比例≥10%)增多
粒细胞生成异常,包括染色质凝集异常
嗜碱性粒细胞绝对数不(明显)增多,嗜碱性粒细胞比例<2%
单核细胞绝对数不(明显)增多,单核细胞比例<10%
骨髓有核细胞增多,粒细胞增殖和粒系病态造血,伴或不伴有核红细胞和巨核细胞病态造血
外周血和骨髓原始细胞比例<20%
无PDGFRA,PDGFRB,或FGFR1重排,或PCM1-JAK2融合的证据
不符合WHO规定的CML,PMF,PV或ET诊断标准*
* MPN病例中,尤其是加速期和(或)真性红细胞增多症后或特发性血小板增多症后骨髓纤维化期,如中性粒细胞增多可与aCML类似。
MPN既往史,骨髓有MPN特征和(或)MPN相关基因(JAK2,CALR或MPL)突变者可以排除aCML的诊断;相反,存在SETBP1和(或)ETNK1突变者则支持aCML的诊断。
aCML少见CSF3R突
变,若存在时应及时认真复核形态学,以排除CNL 或其他髓系肿瘤
三、幼年型粒单核细胞白血病(JMML )
JMML 是以粒单2系细胞增殖为特征的婴幼儿侵袭性克隆性造血肿瘤。
大约90%患者携带PTPN11,KRAS ,NRAS ,CBL 或NF1基因的体细胞或胚系突变。
这些遗传学异常在很大程度上是相互排斥的,并激活RAS /MAPK 途径。
与WHO 第4版(2008年)相比,JMML 的临床和病理所见基本上无变化。
不过,分子诊断参数更加细化。
更新后的诊断参数见表5。
表5 幼年型粒单细胞白血病(JMML )诊断标准
1. 临床和血液学特征(需要满足全
部4项)
●外周血单核细胞计数≥1×109/L
●外周血和骨髓原始细胞比例<20% ●脾肿大
●Ph 染色体(BCR-ABL1)阴性
2. 遗传学特征(满足其中1项即
可)
●PTPN11*,或 KRAS *,或NRAS *体细胞突变
●临床诊断为I 型神经纤维瘤或NF1基因突变● CBL 基因胚系突变和CBL 基因杂合性缺失
**
3. 无遗传学特征患者,除了需要符
合第1部分的临床和血液学特征外,
还需要满足右侧所列的标准 ●染色体7或任何其他染色体异常
或者至少符合以下2条标准:
●血红蛋白F 随年龄增长
●外周血涂片发现髓系或红系前体细胞
●克隆分析发现GM-CSF 超敏性
●STAT5高度磷酸化
*需要排除胚系突变(指努南综合征);**偶有杂合子剪接位点突变病例
四、MDS-MPN 伴环形铁粒幼细胞和血小板增多
MDS-MPN-RS-T,以前称为RARS-T,也为保留名。
诊断标准包括:血小板增多(≥450×109/ L)伴难治性贫血,骨髓红系病态造血伴环形铁粒幼细胞占红系前体(幼红细胞)的15%以上,骨髓活检有类似于PMF或ET的巨核细胞特征。
