标准病理制片流程
病理科免疫制片核对制度及流程

病理科免疫制片核对制度及流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!病理科免疫制片核对制度及流程是一项重要的质控措施,旨在确保病理标本的准确性和可靠性。
动物病理组织免疫组化制片操作规程

动物病理组织免疫组化制片操作规程1、取材选材部位以病灶与正常组织交界处的组织标本为好,取材要完整,要尽可能注意到整个器官的结构特点。
大小一般是1cm×1 cm×0.5 cm为宜。
在夹取组织时不要用力压、挤、揉等以免损坏组织。
2、固定以10%中性福尔马林固定液(固定液的量应为组织块的10-20倍)固定时间24-36小时。
组织长时间固定,固定液中的福尔马林含有的杂质会产生一种酸,影响核的染色,整个组织显得非常陈旧。
3、全自动脱水机:包括脱水、透明、浸蜡等步骤3.1、脱水组织经固定后,内含大量水分,须除尽水分才利于透明、浸蜡。
常用酒精为脱水剂,逐级提高酒精浓度,以防组织过度收缩、变脆或脱水不完全而影响制片效果。
脱水一般在室温下进行,由60%酒精、70%酒精、80%酒精、90%酒精、95%酒精、100%酒精I、100%酒精II组成。
组织块在酒精中时间不宜过长,否则组织块容易变硬。
如切片后的蜡块中央呈灰白粗糙而不透亮,放置一段时间后蜡块中央出现一陷窝,此即表明组织脱水不够彻底,组织面暴露后水分蒸发,蜡块中央收缩形成陷窝,严重时难以切出完整切片。
注意定时更换新的脱水剂,一般在使用到1500个脱水盒(含组织块)后即可考虑更换脱水液。
3.2、透明在室温下,组织块采用二甲苯或TO透明剂中进行透明。
一般透明剂分为I、II两个试剂缸。
组织在二甲苯或TO透明剂中贮留时间必须严格掌握,时间稍长,则组织脆硬易碎;时间过短,石蜡不易渗透进去,使浸蜡不完全。
3.3、浸蜡恒温杯内温度应调至58-60℃为宜,使石蜡熔化完全。
石蜡分为I、II两个缸。
尽量控制组织块在石蜡中的浸泡时间,时间过长组织易碎;时间过短,石蜡未渗透进去,组织不能切片。
附:自动脱水机使用操作规程4、包埋将温箱中熔化好的石蜡倒进包埋框内,迅速用热镊子将组织放入包埋模具内,将要切的面朝下并摆正位置,多块的小的组织应集中放在一起,处于一个水平面上,管状组织如血管、气管、肠道等须立起来包埋,然后压上塑料盒,再注入少量的石蜡液,将其移放室温下一定时间后,再转移至冰冻台上冰冻固定,待其蜡块完全凝结后,取出蜡块,修切去抱抱盒周边浓度余蜡。
组织病理切片的制作流程

---------------------------------------------------------------最新资料推荐------------------------------------------------------组织病理切片的制作流程组织病理切片的制作流程 1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1) 材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2) 组织块的大小:所取组织块较理想的体积为 2. 0cm 2. 0cm 0. 3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取 0. 1~0. 2cm 即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取 0. 3 ~0. 5cm,这样可以同一蜡块制作出较多的教学切片。
(3) 勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
1/ 17夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4) 规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5) 选好组织块的切面: 根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6) 保持材料的清洁: 组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7) 保持组织的原有形态: 新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
病理主要工作流程图
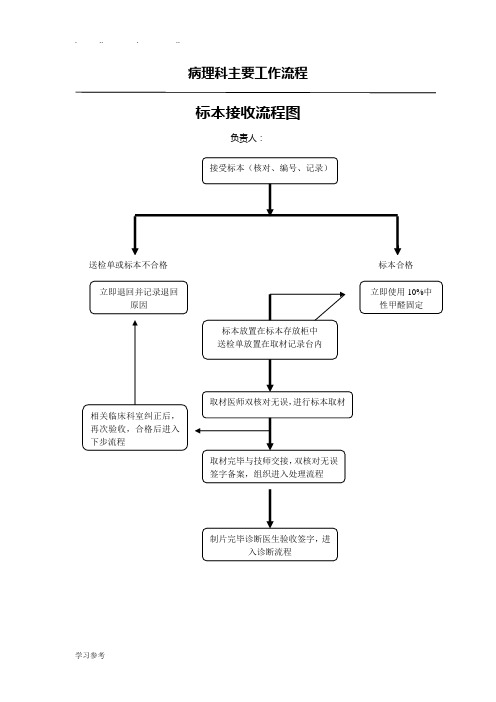
病理科主要工作流程标本接收流程图负责人:标本处理流程图组织病理检查与快速病理诊断工作流程组织病理检查包括病灶局部穿刺、咬取、切取活检和手术切除标本,通过活检为临床提供定性诊断。
活检组织从患者病灶处取下后,到获得最后病理诊断结果过程中,主要工作流程如下:病灶处取下组织标本↓临床医师详细填写病理诊断申请单(包括病史、体征、术中所见、其它辅助检查结果、申请要求等)↓临床支持中心送达病理科↓病理标本的接收与确认(送检人与接收人核对签字备案)↓病理医师取下检测组织块(取材医生与技术人员核对签字备案)↓组织固定、脱水、透明、浸蜡、包埋↓石蜡组织切片、染色(病理医生与技术人员核对签字备案)↓病理医师阅片,分析病变特征,确定诊断结果↓采集病理改变特征性图象,描述病变特征,填写病理诊断报告↓上级病理医师审核病理报告后签发↓(病理收发人员与临床人员核对签字备案)免疫组织化学(免疫组化)检查流程病理诊断医师详细填写免疫组化工作单(包括病理号、组织块号码、检查项目、检查要求等)↓免疫组化工作单的接收与确认(送检人与接收人核对签字备案)↓技术人员准备组织块(再次核对检查项目,实验者填写工作记录单)↓组织切片、染色(病理医生与技术人员核对签字备案)↓病理医师阅片,记录免疫组化实验质量,如有问题填写改进意见,交免疫组化实验室↓免疫组化实验技术人员与诊断医生讨论,提出改进措施↓↓(免疫组化实验人员与诊断医生核对签字备案)(免疫组化检测的主要目的有两个方面:①确定肿瘤的组织发生和肿瘤分型:主要用于一些疑难疾病的确认,如胃肠道平滑肌瘤与间质瘤、神经鞘膜细胞瘤、间皮瘤的鉴别,恶性淋巴瘤的组织学分型。
②肿瘤预后评估与治疗方案相关免疫组化检测:免疫组化检查可用于疾病的预后评估、治疗方案的选择、可能出现的肿瘤耐药基因,如P53、Ki-67检测评价恶性肿瘤的预后,PR、ER、Her-2、VEGF检测选择治疗方案,gp100、GST-π检查是否表达肿瘤耐药基因。
病理制片技1

病理制片技术——常用特殊染色一、六胺银染色1.第一步准备工作:配制六胺银染液,将10%硝酸银2.5ml倒入干净的染色缸内,加入2%硼砂5ml,液体呈乳白色,再加入3%乌洛托品40ml,染液逐渐呈透明状。
2.第二步染色过程:事先把温箱调至60℃备用,切片经脱蜡至水,用1%过碘酸氧化10 min,水洗,然后切片放人六胺银染液放置60℃温箱1 h,染真菌时间要相对短一些,一般情况下肉眼看到染液变色,切片呈棕色时从温箱取出染色缸,倒掉染液,自来水冲洗1min,用0.25%氯化金调色1 min,水洗后,用3%硫代硫酸钠染5min,水洗,用苏木精染液浅染,水洗、分化、冲水返蓝,伊红染10 s,最后经脱水、透明、封固。
3.图示结果:基底膜与毛细血管间质性物质、真菌呈棕黑色,核呈蓝色。
4.注葸事项(1)掌握染色温度和时间,如60℃染1 h,80℃染30~40 min。
(2)真菌类染色时间相对要短,染色时间过长,切片染色过深,可用分色剂处理。
二、黏液卡红染色1.第一步准备工作:配制黏卡染液,将称好的胭脂1 g、氢氧化铝1 g倒入瓶内,加入5 0%L醇100 rnl混合摇匀,再加入氯化铝0.5g,水浴加温逐渐煮沸并搅动液体,使其充分溶解(注意染液容易外溅),数分钟后,染液由红色变成透明深紫红色,冷却后将液体倒入量筒,再加入50%乙醇至原量,过滤,放人冰箱备用。
2.第二步染色方法:染液使用时原液与蒸馏水比例为1:4稀释.切片厚5 um,脱蜡至水,经苏木精染色2 min、水洗、分化、返蓝后进人黏卡液染色2 h以上,染液可以重复使用多次,但要适当延长染色时间.切片水洗后,脱水、透明、封固。
3.图示结果:黏液为红色,胞核为蓝色.4.注意事项(1)染液使用时比例为1份黏卡原液,4份蒸馏水。
(2)用酶消化对照染色特异性很大,消化时间为20 min。
(3)配制黏卡染液时要防止液体溅出。
三、石碳酸品红染色1.第一步准备工作(1)配制盐基性品红饱和液:盐基性品红溶于乙醇内。
组织病理切片制作流程(完整版)

组织病理切片的制作流程1.取材组织取材的方法是制作切片的一个重要程序,根据教学、科研及外检的具体要求取自人体(外科手术切除标本、活检标本、尸检标本)或动物,并确定取材的部位和方法。
取材者需要掌握解剖学、组织学、病理学的基本理论知识,还要掌握实际操作技术,每个组织器官的取材都有一定的部位和方法,不能任意切取组织作为制片材料,不然,无法达到教学、科研和临床诊断的目的,具体要求如下:(1)材料新鲜:取材组织愈新鲜愈好,人体组织一般在离体后,动物组织在处死后迅速固定,以保证原有的形态学结构。
(2)组织块的大小:所取组织块较理想的体积为2.0cm×2.0cm×0.3cm,以使固定液能迅速而均匀地渗入组织内部,但根据制片材料和目的不同,组织块的较理想体积也不同,如制作病理外检、科研切片,其组织块可以薄取0.1~0.2cm即可,这样可以缩短固定脱水透明的时间,若制作教学切片厚取0.3 ~0.5cm,这样可以同一蜡块制作出较多的教学切片。
(3)勿挤压组织块: 切取组织块用的刀剪要锋利,切割时不可来回锉动。
夹取组织时切勿过紧,以免因挤压而使组织、细胞变形。
(4)规范取材部位: 要准确地按解剖部位取材,病理标本取材按照各病变部位、性质的不同,根据要求规范化取材。
(5)选好组织块的切面:根据各器官的组织结构,决定其切面的走向。
纵切或横切往往是显示组织形态结构的关键,如长管状器官以横切为好。
(6)保持材料的清洁:组织块上如有血液、污物、粘液、食物、粪便等,可用水冲洗干净后再放入固定液中。
(7)保持组织的原有形态:新鲜组织固定后,或多或少会产生收缩现象,有时甚至完全变形。
为此可将组织展平,以尽可能维持原形。
2.固定(1)小块组织固定法:这是最常用的方法,从人体或动物体取下的小块组织,须立即置入液态固定剂中进行固定,通常,标本与固定液的比例为1:4~20,但组织块不宜过大过厚,否则固定液不能迅速渗透。
故取组织块的大小一般为2.0cm×2.0cm×0.3cm。
第07章病理制片

一般的脱水顺序是:70%、 80%、 90%、 95%①、95%②、无水乙醇①、 无水乙醇②。只有脱水充分才能在透 明剂中透明。
2、丙酮(Acetone)
沸点为56℃。脱水作用比乙醇强,但是 对组织的收缩较大,而价格较高,故一般 少用于组织的脱水,主要用于快速脱水或 固定兼脱水。脱水时间1—3h。
第六章 组织块的处理
第一节 组织洗涤
一、洗涤的目的
组织在固定后一定要把渗透到里面的固定液洗 去,然后再进行下一步过程。为防止组织中留有 较多的固定液而影响脱水剂,甚至可在组织中发 生沉淀物或结晶而影响观察,特别是对陈旧性标 本更应注意流水冲洗,尽可能减少组织中的酸性 程度和甲醛色素。对混合性固定液,更应及时洗 涤,有利于脱水直至切片和染色。
3、苯
苯的用途与二甲苯相似,对组织有较小 收缩,是较好的透明剂。但也易挥发,易 燃。吸入苯能引起中毒,可以较小使用。
4、氯仿
即三氯甲烷。其透明能力比二甲苯及 苯差,透明时间长达24h。不易使组织变 脆,能溶于醇、醚、苯等,微溶于水、极 易挥发。多用于大块组织的透明。
5、香柏油
对组织收缩及硬化程度比任何透明剂小, 但透明时间长,小块组织至少12h以上,缺 点它不能溶解石腊,透明以后还需二甲苯 补充透明。
等组织在脱水后即可直接浸蜡,不比经过
中间溶剂如二甲苯之类的试剂。
脱水种类可根据须要选择,目前在病 理诊断和实验性动物研究中,较多地采用 乙醇脱水、二甲苯透明和石蜡浸透组织。
脱水方法甚多,最重要的是不应骤然 进行,不能操之过急,否则可引起组织强 烈收缩,或使组织发生变形,而得不到满 意切片。
三、常用脱水剂的使用方法
第二节 组织脱水
一、脱水的目的和原则
病理诊断报告发放流程

病理诊断报告发放流程病理诊断报告是临床诊断和治疗的重要依据,其准确性和及时性对于患者的治疗方案制定和预后评估至关重要。
为了确保病理诊断报告能够准确、及时地发放到临床医生和患者手中,我们制定了一套严格的发放流程。
一、标本接收与登记当临床科室采集的病理标本送达病理科时,接收人员会首先对标本进行仔细的核对和检查。
包括患者的基本信息(如姓名、性别、年龄、住院号/门诊号等)、标本的来源(手术、活检、穿刺等)、标本的数量和质量等。
确认无误后,接收人员会在病理标本登记本上详细记录标本的相关信息,并为其分配一个唯一的病理编号。
二、标本处理与制片接收后的标本会被立即送往病理技术室进行处理。
技术人员会根据标本的类型和要求,选择合适的处理方法,如固定、脱水、包埋、切片等。
经过一系列的处理步骤后,制作出高质量的病理切片,以供病理医生进行诊断。
三、病理诊断病理医生在显微镜下仔细观察病理切片,结合临床病史、症状、体征等信息,对病变进行诊断。
诊断过程中,病理医生可能会需要查阅相关的文献资料、与其他医生进行讨论或进行特殊的染色和免疫组化等辅助检查,以确保诊断的准确性。
四、报告书写病理医生根据诊断结果,按照规定的格式和内容书写病理诊断报告。
报告中通常包括患者的基本信息、标本的来源和类型、镜下所见、病理诊断意见、诊断依据以及必要的建议等。
报告的书写要清晰、准确、规范,避免使用模糊或含糊不清的词汇。
五、报告审核完成书写的病理诊断报告需要经过上级医生的审核。
审核医生会对报告的内容进行仔细的检查,包括诊断的准确性、完整性、逻辑性以及语言表达的规范性等。
如有问题,审核医生会与报告医生进行沟通和修改,确保报告的质量。
六、报告打印与签名审核通过后的病理诊断报告由专门的打印人员进行打印。
打印完成后,报告医生和审核医生会在报告上分别签名,并注明报告的日期。
七、报告发放病理诊断报告的发放通常有以下几种方式:1、直接送达临床科室:由病理科的工作人员将报告直接送达相关的临床科室,并与临床医生进行交接和沟通。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 脱蜡、至水、染色:
•
脱蜡剂:二甲苯
•
脱水剂:酒精ຫໍສະໝຸດ •染色剂:苏木精水溶液,酒精伊红染
• 染色液
• 染色前,须用二甲苯脱去切片中的石蜡,再经由高浓度到低浓度 酒精,最后入蒸馏水,就可染色。
•
苏木精(Hematoxylin,H)是一种碱性染料,可将细胞核和
细胞内核糖体染成蓝紫色,被碱性染料染色的结构具有嗜碱性。
• 工具/原料
• 固定液——甲醛(福尔马林) • 脱水剂——酒精 • 透明剂——二甲苯 • 石蜡 • 脱蜡剂:二甲苯 • 至水剂:酒精 • 染色剂:苏木精水溶液,酒精伊红染色液 • 生理盐水、蒸馏水、PBS实验必备溶剂
适用范围 组织学、胚胎学、病理学教学与科研。
• he染色实验具体步骤
• 1 取材,固定:固定液——甲醛(福尔马林)
标准病理制片流程
谢谢聆听~~
• HE染色操作步骤
• 苏木精 — 伊红染色法 ( hematoxylin-eosin staining ) ,简称HE染色法 ,石蜡切片技术里常 用的染色法之一 。苏木精染液为碱性 ,主要使细 胞核内的染色质与胞质内的核酸着紫蓝色 ;伊红 为酸性染料 ,主要使细胞质和细胞外基质中的成 分着红色 。HE染色法是组织学、胚胎学、病理学 教学与科研中最基本、使用最广泛的技术方法。
• 浸蜡,包埋:石蜡
• 将已透明的组织块置于已溶化的石蜡中,放入溶蜡箱保温。待石蜡完全 浸入组织块后进行包埋,冷却凝固成块即成。包埋好的组织块变硬,才 能在切片机上切成很薄的切片。
• 切片、展片、烤片:
• 将包埋好的蜡块固定于切片机上,切成薄片,一般为5—8微米厚。切下 的薄片往往皱折,要放到加热的水中烫平,再贴到载玻片上,放45℃恒 温箱中烘干。
伊红(Eosin,E)是一种酸性染料,能将细胞质染成红色或淡红色,
被酸性染料染色的结构具有嗜酸性。
• HE染色过程:
•1 • 将已入蒸馏水后的切片放入苏木精水溶液中染色数分钟。 •2 • 酸水及氨水中分色,各数秒钟。 •3 • 流水冲洗1小时后入蒸馏水片刻。 •4 • 入70%和90%酒精中脱水各10分钟。 •5 • 入酒精伊红染色液染色2—3分钟。
•脱水、透明:
•染色后的切片经纯酒精脱水,再经二甲苯使切片透明。
•封片
•将已透明的切片滴上树胶,盖上盖玻片封固。待树胶略干后,贴 上标笺,切片标本就可使用。
请观看视频~~~ 谢谢聆听~~
谢谢观赏
• 从人或动物新鲜尸体上取下组织块(一般厚度不超过0.5 厘米)投入预先配好的固定液中(10%福尔马林,Bouin氏 固定液等)使组织、细胞的蛋白质变性凝固,以防止细胞 死后的自溶或细菌的分解,从而保持细胞本来的形态结 构。
• 修剪,脱水,透明:脱水剂——酒精
•
透明剂——二甲苯
• 不同组织固定时间不同,固定成功后需要修剪25px*25px*5px, 放入包埋盒中,流水冲洗(去除组织中的固定液)30分钟。至于 不同浓度的酒精脱水,一般用由低浓度到高浓度酒精作脱水剂, 逐渐脱去组织块中的水份。再将组织块置于既溶于酒精,又溶于 石蜡的透明剂二甲苯中透明,以二甲苯替换出组织块的中酒精, 才能浸蜡包埋。
