北京市顺义区2014届高三第二次统练(化学)
北京市顺义区高三理综第二次统练试题(顺义二模,化学部分)新人教版

顺义区2013届高三第二次统练化学测试可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Sn 1196.化学与生活密切相关。
下列说法不正确...的是 A .NH 3可用作制冷剂 B .硅胶可用作干燥剂 C .BaCO 3可用作钡餐透视D .Na 2S 可除去废水中Hg 2+、Pb 2+等重金属离子7. 下列说法正确的是 A .煤的气化过程是物理变化 B .棉花、合成橡胶都属于合成材料 C .蚕丝、羊毛完全燃烧只生成CO 2和H 2O D .甲苯、植物油均能使酸性KMnO,溶液褪色8. 已知X 、Y 、Z 、W 、R 是原子序数依次增大的短周期主族元素,X 元素的最高价与最低 价绝对值相等,Y 与W 的最外层电子数均是最内层电子数的3倍,Z 的核电荷数是X 的2 倍。
下列说法不正确...的是 A .原子半径:Z > R B .离子的还原性:R > W C .气态氢化物的热稳定性:Y > XD .Z 与Y 、Z 与R 形成的化学键类型完全相同 9. 下列解释事实的离子方程式正确的是A .向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu + 4H + + SO 42- Cu 2++ SO 2↑ + 2H 2OB. 向Ca(HCO 3)2溶液中加入过量NaOH 溶液,有白色沉淀生成:Ca 2++ HCO 3-+ OH - == CaCO 3↓+ H 2OC. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H + + 4I -+ O 2 ==2 I 2 + 2H 2OD. 服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO 3溶液:+ 2 HCO 3-→ + 2 CO 2↑ + 2 H 2O10. 用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是OH COOHO -COO -OHCOOH11. 一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。
2014年高考全国二卷化学试题答案解析

2014年高考新课标Ⅱ卷理综化学试题赏析7.下列过程没有发生化学反应的是A.用活性炭去除冰箱中的异味B.用热碱水清除炊具上残留的油污C.用浸泡过高锰酸钾溶液的硅藻土保存水果D.用含硅胶、铁粉的透气小袋与食品一起密封包装【答案】A【解析】考察化学变化的概念。
活性炭除去冰箱中的异味是物理吸附作用.热碱溶液有利于酯类物质的水解,可用热碱液除去油污;酸性高锰酸钾溶液吸收乙烯可以用来保存水果;铁粉可防止食品被氧化,硅胶可使食品保持干燥。
选择A。
【知识点】8.四联苯的一氯代物有A.3种B.4种C.5种D.6种【答案】C【解析】考察同分异构体种类。
根据四联苯的两个对称轴,联苯的一氯代物有5种结构.选择C。
【知识点】9.下列反应中,反应后固体物质增重的是A.氢气通过灼热的CuO粉末B.二氧化碳通过Na2O2粉末C.铝与Fe2O3发生铝热反应D.将锌粒投入Cu(NO3)2溶液【答案】B【解析】考察化学反应中固体质量改变的分析。
氢气通过灼热的CuO粉末后,CuO→Cu固体的质量减小;二氧化碳通过Na2O2粉末后生成Na2CO3,固体的质量增大;铝与Fe2O3发生铝热反应生成Al2O3, 固体的质量不变;将锌粒投入Cu(NO3)2溶液置换出铜,Zn→Cu, 固体的质量减小。
选择B。
【知识点】【答案】D【解析】考察实验基本操作。
解析:A错,玻璃棒应靠在滤纸的三层处;B错,固体加热试管口应朝下;C错,进气管应长, 进入溶液中.D正确,是乙酸乙酯的实验室制法。
选择D.【知识点】11.一定温度下,下列溶液的离子浓度关系式正确的是A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10-5 mol·L—1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c(HC2O4-)D.pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③【答案】【解析】考察离子浓度的关系.A错,由电荷守恒,c(H+)=c(HS-)+c(OH-)+2c(S2-);B错,弱碱溶液稀释电离平衡正向移动,稀释10倍, 溶液的pH减小小于1;C错,c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)+2c(C2O42-)。
北京市各区2014年高三(二模)理综化学试题实验题

① B 中观察到的主要现象是 ,F 装置的作用是 ② 在反应前,打开弹簧夹,通入一段时间 N2,目的是 ③ 充分反应后,检验 D 装置中发生反应的实验是 。
。 。
28. (15 分) Ⅰ.猜想 1:Cu(OH)2 ; (2 分) 猜想 2:CuCO3 ; (2 分) Ⅳ.现象:B 中白色固体变蓝,C 中无明显现象;(2 分) (若猜想 1 为 CuCO3,则现象为:B 中无明显现象,C 中产生白色沉淀。 ) ⑴ 用酒精灯微热横玻璃管,若 C 中有气泡逸出,撤灯冷却一段时间,C 中导管内形成水柱,则证明此装 置气密性良好;(3 分) ⑵ ① Ba(OH)2 溶解度大于 Ca(OH)2 ,能充分吸收 CO2 ;(2 分)且 M(BaCO3)大于 M(CaCO3),测量误差小;(2 分) ② Cu5(OH)6(CO3)2 (或:2CuCO3•3Cu(OH)2 )。(2 分) 28.(14分) (1)还原性 (2)① 6H+ + Al2O3 == 2Al3+ + 3H2O ② a.NO2 b. 对比实验,排除氧气使湿润的淀粉 KI 试纸变蓝的可能 c. 1,1,4H+,1,1,2H2O (3)① NH3 ② 8Al +3NO3- + 5OH- + 2H2O == 3NH3↑+ 8AlO2(4)2Al +2NaOH + 2H2O == 2NaAlO2 + 3H2↑ 27. (14 分) (1)MnO2+4HCl(浓) (2)除去氯气中的氯化氢
Ⅳ. 【问题讨论】 能证明猜想 1 成立的实验现象是 ; (1)检查上述虚线框内装置气密性的实验操作是:关闭 K, ; (2)若在上述装置 B 中盛放无水 CaCl2,C 中盛放 Ba(OH)2 溶液,还可以测定所得沉淀的组成。 ①C 中盛放 Ba(OH)2 溶液,而不使用澄清石灰水的原因是 ; ②若所取蓝绿色固体质量为 27.1 g,实验结束后,装置 B 的质量增加 2.7 g,C 中产生沉淀的质量为 19.7 g 则该蓝绿色固体的化学式为 。 朝阳 一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-” ,加入铝粉后, 只产生 H2,问该无色溶液中能大量存在哪几种离子。 (1)加入铝粉产生 H2,说明铝具有______(填“氧化性”或“还原性” ) 。 + (2)该同学分析:若 H 大量存在,则 NO3 就不能大量存在。 设计实验证实如下: 装 置 现 象 ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾
北京市各区2014年高三(二模)理综化学试题选择题

H3O +SO 3
+
+
2-
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO 3 =Ag +NO↑+H2O 9.下列有关化学概念或原理的论述中,正确的是 A.任何一个氧化还原反应都可以设计为电池,输出电能 B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 C.电解饱和食盐水的过程中,水的电离平衡正向移动 D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 10.已知 X、Y、Z、W 为短周期主族元素,在周期表中的相对位置如图所示,下列说 法正确的是 A.若四种元素均为非金属,则 W 的最高价氧化物对应的水化物一定是强酸 B.若 HmXOn 为强酸,则 X 的氢化物溶于水一定显酸性(m、n 均为正整数) C.若四种元素均为金属,则 Z 的最高价氧化物对应的水化物一定为强碱 D.若四种元素中只有一种为金属,则 Z 与 Y 的最高价氧化物对应的水化物能反应 11.下列说法中正确的是 A.生成物总能量一定低于反应物总能量 B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的 H 不同 C.一定条件下,0.5 mol N2 和 1.5 mol H2 置于某密闭容器中充分反应生成 NH3 气,放热 19.3 kJ, 其热化学方程式为 N2(g)+3H2(g) 2NH3(g) H =-38.6 kJ/mol D.一定条件下 4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当 1 mol O2 反应放出 115.6 kJ 热量,键能如右表所示,则断裂 1 mol H-O 键与断裂 1 mol H-Cl 键所需能量差为 31.9 kJ 12.下列根据实验操作和现象所得出的结论正确的是 选项 A 实 验 操 作 向两份蛋白质溶液中分别滴加饱和 NaCl 溶液和 CuSO4 溶液 实验现象 均有固体析出 结 论 X Z Y W
2014年高三文科综合能力第二次统练(顺义区)

2014届高三第二次统练(顺义区)文科综合能力测试本试卷分为两部分,第一部分为选择题;第二部分为非选择题,共300分。
考试时长150分钟。
考生务必将答案做在答题卡上,在试卷上作答无效。
考试结束后,学生将答题卡上交。
第一部分 (选择题 共140分)本部分共35小题,每小题4分,共140分。
在每小题列出的四个选项中,选出最符合题目要求的一项。
我国第二大瀑布—壶口瀑布位于图1(a )中甲地,其奔腾汹涌的气势是中华民族精神的象征。
图1(b )为某游客拍摄的壶口瀑布照片。
读图,回答第1—3题。
图11. 图1(a )中,冬季太原比大同气温高,其原因是太原①晴天较多,大气逆辐射作用强 ②位于河谷,冬季风影响小 ③纬度较低,正午太阳高度角大 ④海拔较低,太阳辐射较弱 A .②③ B .①② C .③④ D .①④ 2.图1(a )中A .铁路线走向与山脉走向平行B .太行山脉是季风区、非季风区的分界线C .黄河流经秦晋交界段有凌汛现象D .铁路线连接主要煤炭产地,利于煤炭外运 3.壶口瀑布①具有非凡性和可创造性 ②流水侵蚀作用明显 ③乘船观赏,感悟意境 ④有较高的科学价值、美学价值 ⑤此照片拍摄的季节可能是夏季 A .①②④ B .②④⑤ C .②③④ D .①③⑤ 图2为我国某山地的垂直带谱示意图。
读图,回答第4、5题。
4. 图中所示山地A .各自然带的界线随季节变化而移动B .同一海拔高度,北坡比南坡降水多C .南北坡山麓的水分不同造成基带不同D .南坡热量条件好,垂直自然带数目多海拔(米)400030002000针阔混交林带针阔混交林带针叶林带针叶林带灌丛草甸带南坡北坡5.该山地位于A. 秦岭B. 太行山脉C.南岭D. 阴山山脉图3为2014年3月19日08时海平面气压分布图(单位:百帕),读图,回答第6题。
图36.图3中A.①地风向为西北风,风速比④地大 B.③地比④地云量多,日出早,白昼长C.②地被冷气团控制,气温比③地低 D.②地比①地气压低,正午太阳高度小读图4,回答第7、8题。
北京市顺义区2014届高三第二次统练数学理试题

正视图俯视图左视图北京市顺义区2014届高三4月第二次统练(二模)数学(理科)试卷2014.4 本试卷共4页,150分.考试时长120分钟.考生务必将答案答在答题卡上,一、选择题共8个小题,每小题5分,共40分.1.复数(1)i i-等于A.1i+ B. 1i-+ C.1i-- D.1i-2.已知2log3a=,12log3b=,123c-=,则A.c b a>> B. c a b>> C.a b c>> D.a c b>>3.已知向量(1,1)a =,(1,1)b=-,若ka b-与a垂直,则实数k=A.1- B. 0 C.1 D.24.如图所示,一个空间几何体的正视图和左视图都是边长为2的正方形,俯视图是一个直径为2的圆,那么这个几何体的侧面积为A.8πB. 4πC.2πD.π5.“0ϕ=”是“函数sin()y xϕ=+为奇函数”的A.充分不必要条件 B.必要不充分条件C.充要条件 D.既不充分也不必要条件6. 执行如图所示的程序框图,若输入2x=,则输出y的值是 A.2 B.5 C.11 D.237.已知双曲线2221xya-=(0a>),与抛物线24y x=的准线交于,A B两点,O为坐标原点,若AOB的面积等于1,则a=A.1 C.2D.128.已知函数[]0,()(1)0,x x x f x f x x -≥⎧=⎨+<⎩其中[]x 表示不超过x 的最大整数, (如[ 1.1]2-=-,[]3π=,⋅⋅⋅).若直线(1)(0)y k x k =+>与函数()y f x =的图象恰有三个不同的交点,则实数k 的取值范围是A .11[,)54B .11[,)43C . 11[,)32D .(0,1]二、填空题:本大题共6小题,每小题5分,共30分. 把答案填在答题卡上. 9.在极坐标系中,点(2,)6π到极轴的距离是______.10.已知等比数列{}n a 的各项均为正数,若11a =,34a =,则2________;a = 此数列的其前n 项和__________.n S =11.如图,AB 是圆O 的直径,2AB =,D 为圆O 上一点,过D 作圆O 的切线交AB 的延长线于点C .若DA DC =, 则________;BDC ∠=__________.BC =12.对甲、乙、丙、丁4人分配4项不同的工作 A 、B 、C 、D ,每人一项,其中甲不能承担A 项工作,那么不同的工作分配方案有_________种.(用数字作答)13.在ABC 中,角,,A B C 所对的边分别为,,a b c .若a c ==sin 2B =, 则cos _______;B =________.b =14.已知点(,)M a b 在由不等式0,0,2,x y x y ≥⎧⎪≥⎨⎪+≤⎩确定的平面区域内,则点(,)N a b a b -+所在的平面区域面积是________.三、解答题:本大题共6小题,共80分.解答应写出文字说明,演算步骤或证明过程. 15. (本小题满分13分)已知函数()sin cos cos 2f x a x x x =-的图象过点(,0)8π.C A(Ⅰ)求实数a 的值; (Ⅱ)求函数()f x 的最小正周期及最大值.16. (本小题共13分)甲、乙两名运动员参加“选拔测试赛”, 在相同的条件下,两人5次测试的成绩(单位:分)记录如下:甲 86 77 92 72 78乙 78 82 88 82 95 (Ⅰ)用茎叶图表示这两组数据;(Ⅱ)现要从甲乙二人中选派一名运动员参加比赛,你认为选派谁参赛更好?说明理由(不用计算); (Ⅲ)若将频率视为概率,对运动员甲在今后三次测试成绩进行预测,记这三次成绩高于80分的次数为X ,求X 的分布列和数学期望EX .17. (本小题共14分)如图:在四棱锥P ABCD -中,底面ABCD 是正方形,2PA AB ==,PB PD ==E 在PD 上,且13PE PD =.(Ⅰ)求证:PA ⊥平面ABCD ; (Ⅱ)求二面角E AC D --的余弦值; (Ⅲ)证明:在线段BC 上存在点F ,使PF ∥平面EAC ,并求BF的长.18. (本小题共13分)已知函数2()xx ax af x e++=,其a 中为常数,2a ≤. (Ⅰ)当1a =时,求曲线()y f x =在点(0,(0))f 处的切线方程;(Ⅱ)是否存在实数a ,使()f x 的极大值为2?若存在,求出a 的值;若不存在,说明理由.19. (本小题共14分)已知椭圆E 的两个焦点分别为(1,0)-和(1,0),离心率2e =. (Ⅰ)求椭圆E 的方程;(Ⅱ)设直线:l y x m =+(0m ≠)与椭圆E 交于A 、B 两点,线段AB 的垂直平分线交x 轴于点T ,当m 变化时,求TAB 面积的最大值.20. (本小题共13分)已知集合{}123,,,n A a a a a =⋅⋅⋅,123(0,,3)n a a a a n N n +≤<<<⋅⋅⋅<∈≥ 具有性质P :对任意的,i j (1)i j n ≤≤≤,,j i j i a a a a +-至少有一个属于A . (Ⅰ)分别判断集合{}0,2,4M =与{}1,2,3N =是否具有性质P ; (Ⅱ)求证:①10a =;②1232n n na a a a a +++⋅⋅⋅+=; (Ⅲ)当3,4n =或5时集合A 中的数列{}n a 是否一定成等差数列?说明理由.EPADBC高三数学(理科)试卷参考答案及评分标准9.1;10.2, 21n -;11. 030,1;12.18;13.,314. 4三、15.解:(Ⅰ)由已知函数()sin cos cos 2f x a x x x =-sin 2cos22ax x =- ————3分 ()f x 的图象过点(,0)8π,∴sin cos 0244a ππ-=,————5分解得2a =————7分(Ⅱ)由(Ⅰ)得函数()sin 2cos 2)4f x x x x π=-=-———9分∴最小正周期22T ππ==,———11分 ————13分 16.解:(Ⅰ)茎叶图(Ⅱ)由图可知,乙的平均成绩大于甲的平均成绩,且乙的方差小于甲的方差,且乙的最高分高于甲的最高分,因此应选派乙参赛更好. (Ⅲ)记甲“高于80分”为事件A ,∴2()5P A =∴X B 2(3,)5,3322()()(1)55k k k P x k C -==-————8分X 的可能取值为0,1,2,3.分布列为:5EX = 17.解:(Ⅰ)证明:2P A A B ==,PB =,∴222PA AB PB +=∴PA AB ⊥,同理PA AD ⊥—2分又ABAD A =,∴PA ⊥平面ABCD .———4分(Ⅱ)以A 为原点,,,AB AD AP 分别为,,x y z 轴建立空间直角坐标系,则24(0,0,0),(2,0,0),(2,2,0),(0,2,0),(0,0,2),(0,,)33A B C D P E ———6分 平面ACD 的法向量为(0,0,2)AP =,6257882287298乙甲EPADBC设平面EAC 的法向量为(,,)n x y z = ———7分24(2,2,0),(0,,)33AC AE ==,由0n AC n AE ⎧⋅=⎪⎨⋅=⎪⎩,∴020x y y z +=⎧⎨+=⎩,取221x y z =⎧⎪=-⎨⎪=⎩∴(2,2,1)n =-,设二面角E AC D --的平面角为θ1cos 3||||n AP n AP θ⋅==⋅,∴二面角E AC D --的余弦值为13.———10分(Ⅲ)假设存在点F BC ∈,使PF ∥平面EAC , 令(2,,0)F a ,(02)a ≤≤ ———12分∴(2,,2)PF a =- 由PF ∥平面EAC ,∴0PF n ⋅=,解得1a = ∴存在点(2,1,0)F 为BC 的中点,即1BF =. ———14分18.解:(Ⅰ)1a =,21()xx x f x e++=,∴(0)1f =,———1分 22'2(21)(1)(1)()x x x x xx e e x x x x x x f x e e e+-++-+--===,∴'(0)0f =———3分 则曲线在(0,(0))f 处的切线方程为1y =.———5分(Ⅱ)2'2(2)()[(2)]()x x x xx a e e x ax a x x a f x e e+-++---== '()0f x =的根为0,2a -,———6分2a ≤,∴20a -≥当2a =时,2'()0x x f x e-=≤,∴()f x 在(,)-∞+∞递减,无极值;——8分当2a <时,20a ->,()f x 在(,0),(2,)a -∞-+∞递减,在(0,2)a -递增;∴2(2)(4)a f a a e --=-为()f x 的极大值,———10分令2()(4)a u a a e-=-,(2)a <,'2()(3)0a u a a e-=->∴()u a 在(,2)a ∈-∞上递增,∴()(2)2u a u <=, ∴不存在实数a ,使()f x 的极大值为2.———13分19.解:(Ⅰ)由已知椭圆的焦点在x 轴上,1c =,2c a =,∴a =1b =,—2分∴椭圆E 的方程为2212x y +=———4分(Ⅱ)2212y x m x y =+⎧⎪⎨+=⎪⎩,消去y 得2234220x mx m ++-= 直线l 与椭圆有两个交点,∴0>,可得23m <(*)———6分设11(,)A x y ,22(,)B x y∴1243m x x +=-,212223m x x -=,弦长||AB =8分 AB 中点2(,)33m mM -, 设(,0)T x ,∴1AB MT k k ⋅=-,∴31123m m x ⋅=---, ∴3m x =-∴(,0)3m T -,|||3m TM =———11分∴1||||2S AB MT ===23m <,∴232m =时,max S =,——14分(或:1||||2S AB MT ===29≤==""=当且仅当232m =时成立,max S =.(用其它解法相应给分) 20.解:(Ⅰ)202,422,404,000,220,440,-=-=-=-=-=-=∴集合M 具有性质P ,336A +=∉,330A -=∉,∴集合N 不具有性质P .———3分(Ⅱ)由已知120n a a a ≤<<⋅⋅⋅<,∴2n n n a a a A +=∉, 则0n n a a A -=∈,仍由120n a a a ≤<<⋅⋅⋅<知10a =;———5分∴1210n n n n n n n a a a a a a a a --=-<-<-<⋅⋅⋅<- ,n n i n a a a -+>(1,2,32)i n =⋅⋅⋅-,∴n n i a a A --∈,∴1211,,n n n n n n a a a a a a a a a -=-=-⋅⋅⋅=-———6分将上述各式两边相加得12312()n n n a a a a na a a a +++⋅⋅⋅=-++⋅⋅⋅+∴1232()n n a a a a na +++⋅⋅⋅=,即1232n n na a a a a +++⋅⋅⋅=;———8分 (Ⅲ)当3n =时,集合A 中的数列123,,a a a 一定是等差数列. 由(Ⅱ)知10a =,且1230a a a =<<,∴323a a a A +>∉ 故32a a A -∈,而这里323a a a -≠,反之若不然210a a ==这与集合A 中元素互异矛盾,∴只能322a a a -=,即2333120a a a a a ==+=+∴123,,a a a 成等差数列. ———9分当4n =时,集合A 中的元素1234,,,a a a a 不一定是等差数列. 如{}0,1,2,3A =,A 中元素成等差数列,又如{}0,2,3,5A =,A 中元素不成等差数列;———11分 当5时,集合A 中的元素12345,,,,a a a a a 一定成等差数列 证明:155545352510a a a a a a a a a a a ==-<-<-<-<- 令12540,a a a a ==-①353a a a =-② ②-①有4332a a a a -=-,且由①245a a a +=43425a a a a a +>+=,∴43a a A +∉ ∴43a a A -∈∴1433230a a a a a a =<-=-<,∴4332221a a a a a a a -=-==-又254a a a =-,∴5443322210a a a a a a a a a -=-=-=-=-。
北京市各区2014年高三(二模)理综化学试题工艺流程与化学原理

惰 性 电 阳离子 交换膜
浓 缩 室 阴离子 交换膜
惰 性 电
0.1mol•L-1 H2SO4 溶液
稀 HA 溶液
垃圾发酵液 (含 A-离子)
① 阳极的电极反应式为 。 ② 简述浓缩室中得到浓乳酸的原理: 。 ③ 电解过程中,采取一定的措施可控制阳极室的 pH 约为 6-8,此时进入浓缩室的 OH-可忽略不计。400mL 10 g•L-1 乳酸溶液通电一段时间后,浓度上升为 145 g•L-1(溶液体积变化忽略不计) ,阴极上产生的 H2 在标
②用 MnO2 与水的悬浊液吸收上述尾气并生产 MnSO4 i.得到 MnSO4 的化学方程式是 ii.该吸收过程生成 MnSO4 时,溶液的 pH 变化趋势如图甲,SO2 的吸收率与溶液 pH 的关系如图乙。
图甲中 pH 变化是因为吸收中有部分 SO2 转化为 H2SO4 生成 H2SO4 反应的化学方程式是____;由图乙 可知 pH 的降低 SO2 的吸收(填“有利于”或“不利于” ) ,用化学平衡移动原理解释其原因 是 。 西城 26. (13 分)海水是巨大的化学资源宝库。 Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。 (1)Cl2 的电子式是 。 (2)已知:X2 (g)+H2(g) 2HX(g) (X2 表示 Cl2、Br2 和 I2)。 右图表示平衡常数 K 与温度 t 的关系。 ①ΔH 表示 X2 与 H2 反应的焓变,ΔH 0。 (填“>” 、 “<”或“=” ) ② 曲线 a 表示的是 (填“Cl2” 、 “Br2”或“I2” )与 H2 反应时 K 与 t 的关系。 Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。 (1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。 (2)用下图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。
北京市各区2014年高三(二模)理综化学试题有机题
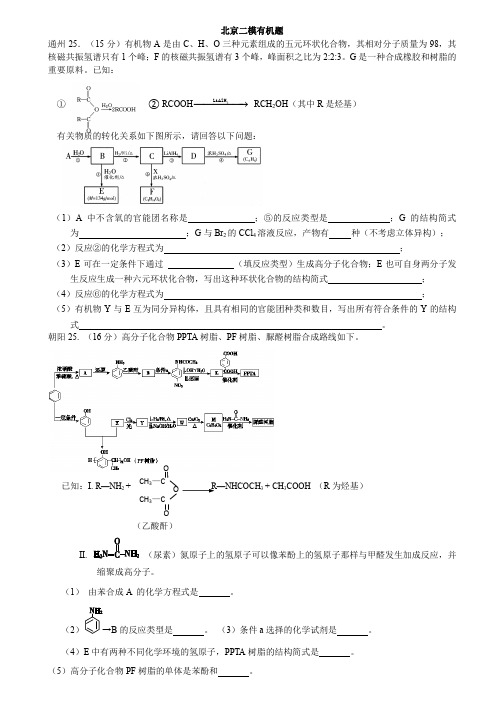
(6)E 有多种芳香族同分异构体,其中红外光谱显示分子中含“-COO-”,核磁共振氢 谱显示 3 个吸收峰,且峰面积之比为 1︰1︰1 的同分异构体有 式: 。 。 种,写出其中任一种的结构简
(7)⑦的化学方程式是
西城 25. (17 分)铃兰醛具有甜润的百合香味,常用作肥皂、洗涤剂和化妆品的香料。合成铃兰醛的路线
(4)F 的结构简式是 (6)设计 D→E 和 F→G 两步反应的目的是
。 。
(7)1,4-二苯基-1,3-丁二烯有多种同分异构体,写出符合下列条件的所有同分异构体的结构简式: a.结构中有两个苯环,无其它环状结构 b.苯环上的一硝基取代产物有两种
顺义 25.( 17 分)高分子化合物 G 是作为锂电池中 Li+迁移的介质,合成 G 的流程如下:
苯酚 催化剂 甲醛 催化剂
OH H CH2 OH n C(CH3) 3 (3 分)
CH2=CCH3
C(CH3) 3
( 8)
(物质 2 分;其他物质全对,少写水得 1 分;配平 1 分,其他物质写错方程式为 0 分) 25. (16 分) (1)羟基 羧基 (2)光照;取代反应 ( 3) 注:各 1 分,见错为 0 分。
…… (2 分) ( 8) b c d …………………………………………………………………… (3 分)
生反应生成一种六元环状化合物,写出这种环状化合物的结构简式
(5)有机物 Y 与 E 互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的 Y 的结构 式 朝阳 25. (16 分)高分子化合物 PPTA 树脂、PF 树脂、脲醛树脂合成路线如下。
O
已知:I. R—NH2 +
CH3—C CH3—C O
14届高三第2次联考化学(附答案)

“十二校”2013——2014学年度高三第2次联考理科综合试题本试卷共15页,共36题,满分300分。
考试用时150分钟。
注意事项:1. 答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号、试室号、座位号填写在答题卡上,并用2B铅笔在答题卡上的相应位置填涂考生号。
2. 选择题每小题选出答案后,用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,答案不能答在试卷上。
3. 非选择题必须用黑色字迹钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用铅笔和涂改液。
不按以上要求作答的答案无效。
考生必须保持答题卡的整洁。
一、单项选择题:本大题共16小题,每小题4分,共64分。
在每小题给出的四个选项中,只有一个选项符合题目要求,选对的得4分,选错或不答的得0分。
7.下列微粒在水溶液中能大量共存的是()A.Fe3+、H+、I-、Na+ B. Al3+、Na+、AlO2-、SO42-C.K+、NH4+、H+、CO32—D.Cu2+、SO42—、Al3+、Cl—8. 下列说法正确的是()A.煤经处理变为气体燃料的过程属于物理变化B. 淀粉、油脂和蛋白质都是高分子化合物C. 乙烯和乙醇均可使酸性KMnO4溶液褪色D. 乙酸乙酯和植物油均可水解生成乙醇9. 下列措施不合理...的是()A. 用饱和Na2CO3溶液除去乙酸乙酯中的乙酸B. 用酸性高锰酸钾溶液鉴别苯和甲苯C. 实验室用稀盐酸与MnO2混合加热制备Cl2D. 用CCl4萃取碘水中的碘10. 设N A为阿伏加德罗常数的数值,下列说法正确的是()A.1molH2O2中含有的电子数为16N AB. 标准状况下,11.2L Br2中含Br—Br键数为0.5N AC. 1 mol Fe与足量稀HNO3反应,转移3 N A个电子D. 1 L 0.1 mol ·L-1NaHCO3溶液中含有0.1N A 个HCO3 —11. 下列陈述I、II正确并且有因果关系的是()12.A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)B.pH=2的醋酸中:c(H+)=0.02mol•L-1C.0.1 mol•L-1氯化铵溶液中:c(H+)> c(OH-)> c(Cl-)> c(NH4+)D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4)13.下列说法正确的是()A.核反应23592U+1n→ZAX+9438Sr +12n是核聚变反应,反应过程中会释放能量B.天然放射现象与原子核内部变化有关C.用比值法定义物理量是物理学研究常用的方法。
北京市顺义区高三第二次统一练习理综(化学部分)

北京市顺义区2008届高三第二次统一练习理科综合(化学部分)5.下列说法正确的是A.用饱和的Na2SO4溶液使蛋清液发生盐析,进而分离、提纯蛋白质B.淀粉和纤维素的组成都可用(C6H10O5)n表示,它们互为同分异构体C.医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关D.食用植物油的主要成分是高级饱和脂肪酸甘油酯,是人体的营养物质6.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是A . 2Na218O2 + 2H2O == 4Na18OH + O2↑B . 2KMnO4 + 5H218O2 + 3H2SO4 == K2SO4 + 2MnSO4 + 518O2↑ + 8H2OC . NH4Cl + 2H2O NH3·2H2O + HClD . K37ClO3 + 6HCl == K37Cl + 3Cl2↑+ 3H2O7.为了提纯下列物质(括号内为杂质),所选用的除杂试剂与除杂方法都正确的是8. ....A.向铁粉中加入稀硝酸B.向稀NaOH中滴入少量的AlCl3溶液C.向NaOH溶液中通入SO2气体D.向MgSO4、H2SO4的混合液中滴入过量的Ba(OH)2溶液9.甲、乙两种物质的溶解度曲线如右图所示,下列说法一定正确的是A . A点表示T1℃时甲的溶液已经饱和,乙的溶液未饱和B . B点表示T2℃时甲、乙两物质的溶液均饱和,且两溶液的物质的量浓度一定相等C. B点表示T2℃时甲、乙两物质的溶液溶质的质量分数相等D. B点表示T2℃时甲、乙两物质的溶液密度一定相等10.室温时,有下列四种溶液:①0.1mol/L氨水②0.1mol/LNH4CI溶液③0.2mol/L盐酸和0.2mol/LNH4Cl溶液等体积混和④0.2mol/LNaOH溶液和0.2mol/L氨水等体积混和。
四种溶液中,c(NH4+)由大到小排列正确的是A ②③④①B ④①②③C ①④②③D ③②①④11.向一定量的Na2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。
北京市顺义区2014届高三第一次统练考试化学试卷(带解析)

北京市顺义区2014届高三第一次统练考试化学试卷(带解析)1.下列物质的有效成分及用途对应不正确的是【答案】C【解析】试题分析:A、沼气的主要成分是甲烷,甲烷常用作燃料,正确;B、漂白液的有效成分是次氯酸钠,常用作消毒剂,正确;C、单晶硅是硅单质,常用作计算机芯片,错误;D、食醋对有效成分是醋酸,常用作调味剂,正确,答案选C。
考点:考查对物质对成分及用途的理解应用2.下列各组实验现象可用同一原理解释的是A.品红溶液中分别通入SO2和Cl2,品红均褪色B.溴水分别滴入植物油和裂化汽油中,溴水均褪色C.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低D.鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出【答案】B【解析】试题分析:A、品红溶液中分别通入SO2和Cl2,品红均褪色,褪色原理不同,二氧化硫是与品红溶液中的有色物质结合成不稳定的无色物质,氯气使品红褪色是利用了次氯酸的强氧化性,错误;B、植物油与裂化汽油中都存在不饱和键,与溴发生加成反应而褪色,正确;C、浓硫酸浓度降低是浓硫酸的吸水性,浓盐酸的浓度降低是浓盐酸易挥发,错误;D、加入氯化钠溶液有固体析出是蛋白质的盐析,而加入氯化铜溶液有固体析出属于蛋白质的变性,错误,答案选B。
考点:考查对同一现象的实验原理分析3.常温下,下列各组离子在指定溶液中一定能大量共存的是A.0.1mol/L KMnO4溶液:K+、Na+、I-、Cl-B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-C.加入KSCN显红色的溶液:K+、Mg2+、Cl-、SO42-D.水电离出c(OH-)=10-5mol/L的溶液:Na+、Fe2+、Cl-、NO3-【答案】C【解析】试题分析:A、KMnO4具有强氧化性,与I-离子发生氧化还原反应,不能大量共存,错误;B、能溶解Al2O3的溶液为酸性或碱性,HCO3-在酸性或碱性条件下都不能大量共存,错误;C、加入KSCN显红色的溶液,说明溶液中存在铁离子,但铁离子与其余四种离子都不反应,可以大量共存,正确;D、水电离出c(OH-)=10-5mol/L大于1×10-7,说明是水解的盐溶液,该溶液呈碱性或酸性,Fe2+、NO3-在该条件下不能大量共存,错误,答案选C。
2014顺义高考化学二模

2014顺义高考化学二模一、选择题(共7小题,每小题3分,满分21分)1.(3分)下列物质及用途对应不正确的是()A.A B.B C.C D.D2.(3分)解释下列事实的化学用语正确的是()A.将NH3通入滴有酚酞的水中,溶液变红:NH3+H2O⇌NH3•H2O⇌NH4++OH﹣B.铜与浓硫酸共热产生气体:Cu+H2SO4(浓)Cu2++SO42﹣+H2↑C.CH3COONa的水溶液呈碱性:CH3COO﹣+H2O═CH3COOH+OH﹣D.用NaOH溶液吸收Cl2:Cl2+2OH﹣═2Cl﹣+H2O3.(3分)铜锌原电池装置(见图),下列分析正确的是()A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小B.原电池工作时,Cu电极流出电子,发生氧化反应C.原电池工作时的总反应为Zn+Cu2+═Zn2++CuD.盐桥中装有含氯化钾的琼脂,其作用是传递电子4.(3分)下列进行性质比较的实验,不合理的是()A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0mol•L﹣1的盐酸中5.(3分)实验:①0.1mol•L﹣1 MgCl2溶液和0.2mol•L﹣1 NaOH溶液等体积混合得到浊液a,取少量浊液a过滤得到滤液b和白色沉淀c;②向浊液a中滴加0.1mol•L﹣1 FeCl3溶液,出现红褐色沉淀.下列分析不正确的是()A.滤液b的pH=7B.②中颜色变化说明Mg(OH)2转化为Fe(OH)3C .实验可以证明Fe (OH )3的溶解度比Mg (OH )2的小D .浊液a 中存在沉淀溶解平衡:Mg (OH )2(s )⇌Mg 2+(aq )+2OH ﹣(aq )6.(3分)实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是 ( )A .AB .BC .CD .D7.(3分)第三周期元素,浓度均为0.01mol/L 的最高价氧化物对应水化物的pH 与原子半径的关系如图所示.则下列说法正确的是( ) A .气态氢化物的稳定性:N >RB .Z 的最高价氧化物对应的水化物能溶于稀氨水C .Y 和R 形成的化合物既含离子键又含共价键D .X 和M 两者最高价氧化物对应的水化物反应后溶液的pH >7二、填空题(共4小题,每小题13分,满分59分)10.(13分)利用工业炼铜后的炉渣(含Fe 2O 3、FeO 、SiO 2、Al 2O 3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na 2FeO 4).其工艺流程如下(部分操作和条件略): Ⅰ.用稀盐酸浸取炉渣,过滤;Ⅱ.向滤液中加入过量NaClO 溶液,调pH 约为3,过滤;Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,…得到聚合氯化铝. Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO 和NaOH 反应,生成高铁酸钠. (1)稀盐酸溶解Fe 2O 3的离子方程式是 . (2)验证炉渣中含有FeO 必要的化学试剂为 . (3)已知:生成氢氧化物沉淀的pH①步骤Ⅱ中加入过量NaClO ,反应的离子方程式是 . ②根据表中数据解释步骤Ⅱ中,调pH 约为3的目的是 .(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是.(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是.(6)在步骤Ⅳ中,若该反应生成166g Na2FeO4转移3mol电子,则参加反应的还原剂和氧化剂的物质的量之比是.11.(14分)某些资料认为:NO、NO2不能与Na2O2反应.某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:假设Ⅰ.过氧化钠氧化二氧化氮假设Ⅱ.二氧化氮氧化过氧化钠(1)小组甲同学设计实验如下(图1):①试管A中反应的化学方程式是.②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃.甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是.③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃.得出结论:假设Ⅰ正确.NO2和Na2O2反应的方程式是.(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化.查阅资料:①2NO+Na2O2═2NaNO2②6NaNO2+3H2SO4═3Na2SO4+2HNO3+4NO↑+2H2O;③酸性条件下,NO或NO2﹣都能与MnO4﹣反应生成NO3﹣和Mn2+丙同学用如图2所示装置(部分夹持装置略)探究NO与Na2O2的反应.①B中观察到的主要现象是,F装置的作用是.②在反应前,打开弹簧夹,通入一段时间N2,目的是.③充分反应后,检验D装置中发生反应的实验是.14.(14分)工业废气、汽车尾气排放出的SO2、NO x等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.(1)SO2在烟尘的催化下形成硫酸的反应方程式是.(2)NO x和SO2在空气中存在下列平衡:2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣12SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3.①写出NO2和SO2反应的热化学方程式为.②随温度升高,该反应化学平衡常数变化趋势是.(3)提高2SO2+O2⇌2SO3反应中SO2的转化率,是减少SO2排放的有效措施.①T温度时,在1L的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是.②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是(填字母).a.温度和容器体积不变,充入1.0mol Heb.温度和容器体积不变,充入1.0mol O2c.在其他条件不变时,减少容器的体积d.在其他条件不变时,改用高效催化剂e.在其他条件不变时,升高体系温度(4)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图①电解饱和食盐水的化学方程式是.②用溶液A吸收含二氧化硫的废气,其反应的离子方程式是.③用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是.17.(18分)高分子化合物G是作为锂电池中Li+迁移的介质,合成G的流程如下已知:①②(1)B的含氧官能团名称是.(2)A→B的反应类型是.(3)C的结构简式是.(4)D→E反应方程式是.(5)G的结构简式是.(6)D的一种同分异构体,能发生分子内酯化反应生成五元环状化合物,该同分异构体的结构简式是.(7)已知:M→N的化学方程式是.(8)下列说法正确的是(填字母).a.E有顺反异构体b.C能发生加成、消去反应c.M既能与酸反应,又能与碱反应d.苯酚与 C反应能形成高分子化合物e.含有﹣OH和﹣COOH的D的同分异构体有2种.参考答案与试题解析一、选择题(共7小题,每小题3分,满分21分)1.【解答】A.氢氧化铝为弱碱,可与盐酸反应,可用于中和胃酸,故A正确;B.碳酸钠水解呈碱性,加热条件下有利于除去油污,故B正确;C.氢氧化钠具有腐蚀性,不能用作调味品,故C错误;D.油脂在碱性条件下水解可制造肥皂,故D正确.故选C.2.【解答】A.氨气和水反应生成一水合氨,一水合氨是弱电解质,电离出氢氧根离子而使溶液呈碱性,无色酚酞遇碱变红色,其离子方程式为NH3+H2O⇌NH3•H2O⇌NH4++OH﹣,故A正确;B.铜和浓硫酸加热反应生成二氧化硫,离子方程式为:Cu+2H2SO4(浓)Cu2++SO42﹣+SO2↑+2H2O,故B错误;C.盐类水解要写可逆号,离子方程式为CH3COO﹣+H2O⇌CH3COOH+OH﹣,故C错误;D.氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,故D错误;故选A.3.【解答】A.Zn为负极,被氧化生成Zn2+,则工作一段时间后,硫酸锌溶液中c(Zn2+)增大,故A错误;B.锌为负极,铜为正极,锌电极流出电子,发生氧化反应,铜极发生还原反应,故B错误;C.反应中Zn被氧化,Cu2+被还原,反应的总方程式为Zn+Cu2+═Zn2++Cu,故C正确;D.电子不能经过溶液,盐桥中阳离子向正极移动,阴离子向负极移动,故D错误.故选C.4.【解答】A.发生反应:Cu+2Fe3+=Cu2++2Fe2+,根据反应只能判断Cu还原性强于Fe2+,不能判断Cu、Fe的还原性,故A正确;B.发生反应:2NaBr+Cl2=2NaCl+Br2,氧化性:氯气大于溴单质,所以非金属性:氯大于溴,故B错误;C.发生反应:2KMnO4+16HCl=2MnCl2+5Cl2+2KCl+8H2O,KMnO4是氧化剂,Cl2是氧化产物,故氧化性前者大于后者,故C错误;D.镁带和铝片都能与盐酸反应生成氢气,但是镁带与盐酸反应更剧烈,产生氢气更快,故还原性镁大于铝,故D 错误;故选A.5.【解答】将0.1mol•L﹣1MgCl2溶液和0.2mol•L﹣1NaOH溶液等体积混合得到氢氧化镁和氯化钠的混合物,氢氧化镁存在沉淀溶解平衡:Mg(OH)2(s)⇌Mg2+(aq)+2OH﹣(aq),A、将①中所得浊液氢氧化镁过滤,氢氧化镁存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH﹣,所得滤液中含少量OH﹣,显碱性,即pH>7,故A错误;B、氢氧化镁的悬浊液中滴加氯化铁会生成氢氧化铁沉淀,所以②中颜色变化说明Mg(OH)2转化为Fe(OH)3,故B正确;C、沉淀向着更难溶的物质转化,所以实验能说明Fe(OH)3比Mg(OH)2难溶,故C正确;D、氢氧化镁属于难溶电解质,在悬浊液中存在沉淀溶解平衡:Mg(OH)2⇌Mg2++2OH﹣,故D正确.故选A.6.【解答】A、氨气的密度比空气密度小,应该采用向下排空气法收集,装置c中的导管应改为短进长出,故A错;B.用MnO2和浓盐酸制取氯气时需要加热,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收,故B错误;C.铜与稀硝酸反应生成产物为一氧化氮,一氧化氮易与空气中氧气反应生成二氧化氮,不能用排空气法收集,氢氧化钠不能吸收一氧化氮气体,故C错误;D.浓硫酸可以与亚硫酸反应,生成二氧化硫,SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收装置中要防倒吸,图示收集装置和完全吸收装置都合理,故D正确;故选D.7.【解答】元素的金属性越强,其对应最高价氧化物的水化物碱性越强则该溶液的pH越大,元素的非金属性越强,其最高价氧化物的水化物酸性越强则该溶液的pH越小,根据图象知,从R到X,最高价氧化物的水化物碱性逐渐增强、酸性逐渐减弱,X、Y、Z、M、N、W、R分别为Na、Mg、Al、Si、P、S、Cl元素.A.元素的非金属性越强,其氢化物越稳定,R的非金属性大于N,则气态氢化物的稳定性:N<R,故A错误;B.Z的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝能溶于强碱但不能溶于弱碱,所以不能溶于稀氨水,故B 错误;C.Y和R形成的化合物是MgCl2,氯化镁中氯离子和镁离子之间只存在离子键,故C错误;D.X和M两者最高价氧化物对应的水化物反应后的物质是Na2SiO3和H2O,硅酸钠是强碱弱酸盐,硅酸根离子水解导致溶液呈碱性,所以硅酸钠溶液的pH>7,故D正确;故选D.二、填空题(共4小题,每小题13分,满分59分)10.【解答】(1)稀盐酸与Fe2O3反应生成铁离子和水,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;故答案为:Fe2O3+6H+=2Fe3++3H2O;(2)检验FeO,先加稀硫酸溶解形成亚铁离子的溶液,再加KMnO4溶液,若KMnO4溶液褪色,说明含有亚铁离子,即炉渣中含有FeO;故答案为:稀硫酸、KMnO4溶液;(3)①NaClO具有氧化性在酸性条件下能把亚铁离子氧化物铁离子,其反应的离子方程式为:2Fe2++ClO﹣+2H+=2Fe3++Cl﹣+H2O;故答案为:2Fe2++ClO﹣+2H+=2Fe3++Cl﹣+H2O;②pH约为3时亚铁离子不能形成沉淀,而三价铁离子能转化为沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;故答案为:pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;(4)酸性条件下ClO﹣与Cl﹣反应生成氯气,其反应的离子方程式为:ClO﹣+Cl﹣+2H+=Cl2+H2O;故答案为:ClO﹣+Cl﹣+2H+=Cl2+H2O;(5)步骤Ⅲ中从溶液中提取溶质,操作为减压蒸发、浓缩至饱和、冷却结晶;故答案为:浓缩至饱和、冷却结晶;(6)在步骤Ⅳ中发生反应3NaClO+4NaOH+2Fe(OH)3=2Na2FeO4+3NaCl+5H2O,生成166 g Na2FeO4转移3 mol电子,则消耗的Fe(OH)3为1mol,消耗的NaClO为1.5mol,则参加反应的还原剂Fe(OH)3和氧化剂NaClO的物质的量之比是2:3;故答案为:2:3.11.【解答】(1)①Cu与浓硝酸反应生成二氧化氮、硝酸铜和水,其反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;②Cu与浓硝酸反应生成二氧化氮中含有水蒸气,水蒸气能与过氧化钠反应生成氧气,所以要在A、B之间增加一个装置干燥装置,除去生成NO2气体中混有的水蒸气;故答案为:除去生成NO2气体中混有的水蒸气;③若过氧化钠氧化二氧化氮,则生成硝酸钠,其反应的化学方程式为:Na2O2+2NO2=2NaNO3;故答案为:Na2O2+2NO2=2NaNO3;(2)①在B装置中二氧化氮与水反应生成稀硝酸,稀硝酸与Cu反应生成NO,所以B中观察到的主要现象是:铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;NO是有毒气体要进行尾气处理,由题中的信息可以NO能被酸性高锰酸钾吸收;故答案为:铜片逐渐溶解,溶液变为蓝色,有无色气泡产生;吸收未反应的NO;②空气中的氧气能氧化NO,实验时要排尽装置中的空气,所以在反应前,打开弹簧夹,通入一段时间N2,目的是:将装置中的空气排出;故答案为:将装置中的空气排出;③亚硝酸钠中加盐酸会生成NO,NO遇到空气中的氧气会变为红棕色,则检验D装置中物质的方法为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠,反之为硝酸钠;故答案为:取D装置中产物少许,加入稀盐酸,若产生无色气体,遇到空气变为红棕色,产物是亚硝酸钠,反之为硝酸钠.14.【解答】(1)SO2在烟尘的催化下形成硫酸是首先二氧化硫与水反应生成亚硫酸,然后亚硫酸发生氧化反应SO2+H2O=H2SO3,2H2SO3+O2═2H2SO4,故答案为:SO2+H2O=H2SO3,2H2SO3+O2═2H2SO4;(2)①根据盖斯定律来求解,2NO(g)+O2(g)⇌2NO2(g)△H=﹣113.0kJ•mol﹣1 ①;2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196.6kJ•mol﹣1②然后用(②﹣①)÷2得:NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJ•mol﹣1,故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g)△H=﹣41.8 kJ•mol﹣1;②因为正反应为放热反应所以升高温度平衡常数减小,故答案为:减小;(3)①则1L密闭容器在5min内各物质浓度发生的变化如下:2SO2(g)+O2(g)═2SO3(g),起始浓度(mol/L) 2 1 0变化浓度(mol/L) 1 0.5 1平衡浓度(mol/L) 1 0.5 1该反应的平衡常数为K==2故答案为:2;②a.温度和容器体积不变,充入1.0mol He,平衡不移动,SO2的转化率不变,故a不选;b.温度和容器体积不变,充入1.0mol O2,平衡正向移动,SO2的转化率提高,故选b;c.在其他条件不变时,减少容器的体积,相当于增大压强,平衡正向移动,SO2的转化率提高,故选c;d.在其他条件不变时,改用高效催化剂,平衡不移动,SO2的转化率不变,故d不选;e.在其他条件不变时,升高体系温度,平衡逆向移动,SO2的转化率变小,故e不选;故答案为:b c;(4)①电解饱和食盐水所得溶液为氢氧化钠溶液和氯气以及氢气,2NaCl+2H2O 2NaOH+H2↑+Cl2↑(5)故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑;②二氧化硫和氢氧化钠反应生成NaHSO3,SO2+OH﹣=HSO3﹣(或SO2+2OH﹣=SO32﹣+H2O),故答案为:SO2+OH﹣=HSO3﹣(或SO2+2OH﹣=SO32﹣+H2O);③阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应,SO2+Cl2+H2O=4H++SO42﹣+2Cl﹣,故答案为:SO2+Cl2+H2O=4H++SO42﹣+2Cl﹣.17.【解答】据F的结构简式结合A→B→C→D的反应条件可知C4H8的结构为:与溴发生加成反应生成A,A为,A在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为HOCH2C(OH)(CH3)2,B催化氧化生成C,C氧化生成D,结合已知②知C为OHCCH2C(OH)(CH3)2,则D为HOOCC(OH)(CH3)2,综合分析E→F反应即F的结构简式中含有碳碳双键,知D在浓硫酸作用下生成E,E与环氧乙烷反应生成F,结合F的结构可知,E为CH2=C (CH3)COOH,F在只能通过加聚反应生成高分子化合物G.(1)B为HOCH2C(OH)(CH3)2,所含官能团每名称为羟基,故答案为:羟基;(2)A为,A在氢氧化钠水溶液、加热条件下发生水解反应生成B,故答案为:水解反应(或取代反应);(3)B为HOCH2C(OH)(CH3)2,B催化氧化生成C,C氧化生成D,结合已知②知C为,故答案为:如上;(4)D为HOOCC(OH)(CH3)2,综合分析E→F反应即F的结构简式中含有碳碳双键,知D在浓硫酸作用下生成E,反应方程式为:,故答案为:如上;(5)通过分析F的结构简式可知,F在只能通过碳碳双键的加聚反应生成高分子化合物G,则G为,故答案为:如上;(6)D为HOOCC(OH)(CH3)2,其同分异构体能发生分子内酯化反应生成五元环状化合物,则其结构只能是,故答案为:;(7)C为,结合已知反应推断M应为(CH3)2C(OH)CH(NH2)COOH,可推知生成多肽N的反应方程式为:,故答案为:如上;(8)E为CH2=C(CH3)COOH,a、E的碳碳双键的一个C是连有两个H原子,故不存在顺反异构,故a错误;b、C为,醛基可发生加成反应,羟基和临位H可发生消去反应,故b正确;c、M是氨基酸,既有氨基又有羧基,所以M既能与酸反应,又能与碱反应,故c正确;d、C为醛,有醛基能和苯酚发生类似于甲醛与苯酚生成电木的反应,故d正确;e、D为HOOCC(OH)(CH3)2,含有﹣OH和﹣COOH的D的同分异构体有,和羟基连在第二个C上、第三个C上,至少3种以上,故e错误.故选:bcd.第11页共11 页。
北京市2014-2015年2年高三化学真题 Word版含解析.pdf

2014年北京市高考化学试卷 一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项. 6.(6分)(2014?北京)下列试剂中,标签上应标注和的是( ) A.C2H5OHB.HNO3C.NaOHD.HCl 考点:硝酸的化学性质..专题:氮族元素.分析:警示标记标注和说明该物质具有强的氧化性和腐蚀性,据此解答.解答:解:A.C2H5OH为易燃品,不具有强的氧化性和腐蚀性,故A错误; B.硝酸具有强的氧化性和腐蚀性,应标注和,故B正确; C.NaOH具有腐蚀性,但是不具有氧化性,故C错误; D.盐酸具有腐蚀性,但是不具有强的氧化性,故D错误; 故选:B.点评:本题考查硝酸的性质及警示标记,题目难度不大,明确警示标记的含义,熟悉硝酸的性质,是解答本题的关键. 7.(6分)(2014?北京)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( ) A.KB.NaC.FeD.Al 考点:铝的化学性质..专题:几种重要的金属及其化合物.分析:由表面自然形成的氧化层能保护内层金属不被空气氧化可知,只有氧化铝为致密的结构,可保护内层金属,以此来解答.解答:解:由表面自然形成的氧化层能保护内层金属不被空气氧化可知,只有氧化铝为致密的结构,可保护内层金属,而K、Na、Fe的氧化物均不是致密的结构, 故选D.点评:本题考查Al的化学性质,为高频考点,把握氧化铝为致密的氧化物结构可保护内层金属为解答的关键,注意金属及其氧化物的性质,题目难度不大. 8.(6分)(2014?北京)下列电池工作时,O2在正极放电的是( ) A. 锌锰电池B. 氢燃料电池C. 铅蓄电池D. 镍镉电池 考点:真题集萃..专题:电化学专题.分析:A.锌锰干电池中,负极上锌失电子发生氧化反应、正极上二氧化锰得电子发生还原反应; B.氢燃料电池中,负极上氢气失电子发生氧化反应、正极上氧气得电子发生还原反应; C.铅蓄电池中,负极上铅失电子发生氧化反应、正极上二氧化铅得电子发生还原反应; D.镍镉电池中,负极上Cd失电子发生氧化反应,正极上NiOOH得电子发生还原反应.解答:解:A.锌锰干电池中电极反应式,负极:Zn2eZn2+、正极2MnO2+2NH4++2e=Mn2O3+2NH3+H2O,所以不符合题意,故A错误; B.酸性氢氧燃料电池电极反应式为2H24e=4H+、O2+4H++4e=2H2O,碱性氢氧燃料电池电极反应式为2H24e+4OH=4H2O、O2+2H2O+4e=4OH,所以符合题意,故B正确; C.铅蓄电池放电时负极电极反应:Pb2e+SO42=PbSO4 ,正极电极反应:PbO2+2e+4H++SO42=PbSO4+2H2O,所以不符合题意,故C错误; D.镍镉电池放电正极:2NiOOH+2H2O+2e=2Ni(OH)2+2OH、负极:Cd+2OH2e=Cd(OH)2,所以不符合题意,故D错误; 故选B.点评:本题考查了原电池原理,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,题目难度中等. 9.(6分)(2014?北京)下列解释事实的方程式不正确的是( ) A.测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH B.将Na块放入水中,产生气体:2Na+2H2O2NaOH+H2↑ C.用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl D.Al片溶于NaOH溶液中,产生气体:2Al+2OH+2H2O2AlO2+3H2↑ 考点:化学方程式的书写;电离方程式的书写..专题:离子反应专题;几种重要的金属及其化合物.分析:A.一水合氨为弱电解质,溶液中部分电离出铵根离子和氢氧根离子; B.钠化学性质比较活泼,钠与水反应生成氢氧化钠和氢气; C.氯化铜为电解质,溶液中电离出铜离子和氯离子,所以溶液能够导电; D.金属铝能够与氢氧化钠溶液反应生成偏铝酸钠和氢气.解答:解:A.测0.1 mol/L氨水的pH为11,溶液显示碱性,原因是一水合氨为弱碱,溶液中部分电离出铵根离子和氢氧根离子,其电离方程式为:NH3?H2O?NH4++OH,故A正确; B.将Na块放入水中,钠能够与水反应生成氢气,反应的化学方程式为:2Na+2H2O2NaOH+H2↑,故B正确; C.用CuCl2溶液做导电实验,灯泡发光,氯化铜为强电解质,溶液中完全电离出铜离子和氯离子,电离过程不需要通电,氯化铜的电离方程式为CuCl2=Cu2++2Cl,故C错误; D.铝溶于NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH+2H2O2AlO2+3H2↑,故D正确; 故选C.点评:本题考查了化学方程式、电离方程式的书写判断,题目难度中等,注意掌握化学方程式、电离方程式的书写原则,能够正确书写常见反应的化学方程式,明确强弱电解质的概念,并且能够正确书写电离方程式. 10.(6分)(2014?北京)下列说法正确的是( ) A.室温下,在水中的溶解度:丙三醇>苯酚>1氯丁烷 B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3 C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同 考点:有机物的鉴别;相似相溶原理及其应用;油脂的性质、组成与结构..专题:有机物的化学性质及推断.分析:A.含OH越多,溶解性越大,卤代烃不溶于水; B.HCOOCH3中两种H,HCOOCH2CH3中有三种H; C.CH3COOH与碳酸钠溶液反应,而CH3COOCH2CH3不能; D.油脂在酸性条件下水解产物为高级脂肪酸和甘油,碱性条件下水解产物为高级脂肪酸盐和甘油.解答:解:A.含OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度:丙三醇>苯酚>1氯丁烷,故A正确; B.HCOOCH3中两种H,HCOOCH2CH3中有三种H,则用核磁共振氢谱能区分HCOOCH3和HCOOCH2CH3,故B错误; C.CH3COOH与碳酸钠溶液反应气泡,而Na2CO3溶液与CH3COOCH2CH3会分层,因此可以用Na2CO3溶液能区分CH3COOH和CH3COOCH2CH3,故C错误; D.油脂在酸性条件下水解产物为高级脂肪酸和甘油,碱性条件下水解产物为高级脂肪酸盐和甘油,水解产物不相同,故D错误; 故选A.点评:本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及鉴别方法为解答的关键,注意溶解性与OH的关系、油脂不同条件下水解产物等,题目难度不大. 11.(6分)(2014?北京)用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是( ) ①中实验②中现象A铁粉与水蒸气加热肥皂水冒泡B加热NH4Cl和Ca(OH)2混合物酚酞溶液变红CNaHCO3固体受热分解澄清石灰水变浑浊D石蜡油在碎瓷片上受热分解Br2的CCl4溶液褪色 A.AB.BC.CD.D 考点:真题集萃;氨的实验室制法;乙烯的化学性质;铁及其化合物的性质实验;探究碳酸钠与碳酸氢钠的性质..专题:实验题.分析:A.试管中空气也能使肥皂水冒泡; B.氯化铵和氢氧化钙混合加热生成氨气,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使溶液呈红色; C.二氧化碳能使澄清石灰水变浑浊; D.不饱和烃能使溴的四氯化碳褪色.解答:解:A.加热过程中的热空气、铁和水蒸气反应生成的氢气都能使肥皂水冒泡,所以肥皂水冒泡该反应不一定发生,故A错误; B.NH4Cl+Ca(OH)2NH3↑+CaCl2+H2O、NH3+H2O?NH3?H2O?NH4++OH,氨水溶液呈碱性,所以能使酚酞试液变红色,故B正确; C.2NaHCO3Na2CO3+CO2↑+H2O,二氧化碳能使澄清石灰水变浑浊,如果②中澄清石灰水变浑浊,则①中一定发生反应,故C正确; D.溴的四氯化碳褪色说明有不饱和烃生成,所以①中一定发生化学反应,故D正确; 故选A.点评:本题考查了物质的性质及实验基本操作及反应现象,明确实验原理是解本题关键,再结合物质的性质分析解答,题目难度不大. 12.(6分)(2014?北京)一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解.不同时刻测得生成O2的体积(已折算为标准状况)如下表. t/min0246810V(O2)/mL0.09.917.222.426.529.9下列叙述不正确的是(溶液体积变化忽略不计)( ) A.0~6min的平均反应速率:v(H2O2)≈3.3×102mol/(L?min) B.6~10min的平均反应速率:v(H202)<3.3×102mol/(L?min) C.反应至6min时,c(H2O2)=0.30mol/L D.反应至6min时,H2O2分解了50% 考点:反应速率的定量表示方法..专题:化学反应速率专题.分析:根据化学反应速率之比等化学计量数之比进行计算,根据化学反应的定义进行计算,得出正确结论.解答:解:2H2022H2O+O2↑, A.0~6min产生的氧气的物质的量n(O2)=×103=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=≈3.3×102mol/(L?min),故A正确; B.=3.73,=1.88,3.73>1.88,故单位时间内产生的氧气,0~6min大于6~10min,故6~10min的平均反应速率:v(H202)<3.3×102mol/(L?min),故B正确; C.6min时,c(H2O2)=0.40=0.20mol/L,故C错误; D.6min时,H2O2分解的分解率为:=50%,故D正确, 故选C.点评:本题考查化学反应速率的相关计算,把握化学反应速率之比等化学计量数之比为解答的关键,难度不大. 二、非选择题:共4小题,共180分 25.(17分)(2014?北京)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下: 已知:i. .RCH=CHR′RCHO+R′CHO (R、R′代表烃基或氢) (1)CH2=CHCH=CH2的名称是 1,3丁二烯 . (2)反应Ⅰ的反应类型是(选填字母) a .a、加聚反应b、缩聚反应 (3)顺式聚合物P的结构式是(选填字母) b . (4)A的相对分子质量为108. ①反应Ⅱ的化学方程式是 2CH2=CHCH=CH2 . ②1mol B完全转化成M所消耗H2的质量是 6 g. (5)反应Ⅲ的化学方程式是 . (6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式 . 考点:真题集萃;有机物的合成..专题:有机物的化学性质及推断.分析:根据转化关系知,1,3丁二烯发生聚合反应I得到顺式聚合物P为聚顺1,3丁二烯,则P的结构简式为,由信息i知,在加热条件下发生反应II生成A,A的结构简式为,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为,则C的结构简式为HCHO,再结合题目分析解答.解答:解:根据转化关系知,1,3丁二烯发生聚合反应I得到顺式聚合物P为聚顺1,3丁二烯,则P的结构简式为,由信息i知,在加热条件下发生反应II生成A,A的结构简式为,A发生反应生成B和C,B和氢气发生加成反应生成M,则B的结构简式为,C和二氯苯酚发生反应生成N,C为醛,根据N中碳原子个数知,一个C分子和两个二氯苯酚分子发生反应生成N,N的结构简式为,则C的结构简式为HCHO, (1)CH2=CHCH=CH2的名称是1,3丁二烯,故答案为:1,3丁二烯; (2)通过以上分析知,反应Ⅰ的反应类型是加聚反应,故选a; (3)通过以上分析知,顺式聚合物P的结构式是,故选b; (4)①A的相对分子质量为108,1,3丁二烯的相对分子质量是54,则A的结构简式为,则 反应Ⅱ的化学方程式是2CH2=CHCH=CH2, 故答案为:2CH2=CHCH=CH2; ②B的结构简式为,1mol B完全转化成M所消耗H2的物质的量是3mol,则氢气的质量是6g,故答案为:6; (5)C是甲醛,甲醛和二氯苯酚反应生成N,所以反应Ⅲ是C和二氯苯酚反应生成的化学方程式是, 故答案为:; (6)根据以上分析知,B是、C是HCHO,A的某些同分异构体在相同的反应条件下也能生成B和C,符合条件A的同分异构体有,故答案为:.点评:本题考查了有机物的推断,根据1,3丁二烯为突破口结合题给信息、M和N的结构简式确定发生的反应,注意理解题给信息中有机物的断键和成键物质及服饰,难点是同分异构体结构简式的判断,题目难度中等. 26.(14分)(2014?北京)NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示. (1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是 4NH3+5O24NO+6H2O . (2)Ⅱ中,2NO(g)+O2(g)?2N02(g).在其它条件相同时,分别测得NO的平衡转化率在不同压强(p1,p2)下随温度变化的曲线(如图2). ①比较p1,p2的大小关系: p1<p2 ②随温度升高,该反应平衡常数变化的趋势是 减小 . (3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸. ①已知:2NO2(g)?N2O4(g)△H1 2NO2(g)?N2O4(l)△H2 图3中能量变化示意图中,正确的是(选填字母) A . ②N2O4与O2、H2O化合的化学方程式是 2N2O4+O2+2H2O=4HNO3 . (4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 NH3 ,说明理由: 根据反应8NO+7H2O3NH4NO3+2HNO3,电解生成的HNO3多 . 考点:化学平衡常数的含义;反应热和焓变;化学平衡的影响因素;电解原理..专题:化学反应中的能量变化;化学平衡专题;电化学专题.分析:(1)氨气与氧气在催化剂加热的条件下生成NO与水; (2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,根据压强对平衡的影响分析; ②根据图象2判断该反应正方向是放热还是吸热,再判断K随温度的变化; (3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)?N2O4(l)为放热反应,同种物质液态时能量比气态时能量低; ②N2O4与O2、H2O化合生成硝酸,根据得失电子守恒和原子守恒写出反应的方程式; (4)根据电解NO制备NH4NO3的反应方程式分析判断.解答:解:(1)氨气与氧气在催化剂加热的条件下生成NO与水,反应方程式为:4NH3+5O24NO+6H2O; 故答案为:4NH3+5O24NO+6H2O; (2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知P2时NO的转化率大,则P2时压强大, 即P1<P2; 故答案为:P1<P2; ②由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K减小; 故答案为:减小; (3)①降低温度,将NO2(g)转化为N2O4(l)说明反应2NO2(g)?N2O4(l)为放热反应,所以在图象中该反应的反应物的总能量比生成物的总能量高,同种物质气态变液态会放出热量,即液态时能量比气态时能量低,则N2O4(l)具有的能量比N2O4(g)具有的能量低,图象A符合,故A正确; 故答案为:A; ②N2O4与O2、H2O化合生成硝酸,其反应的化学方程式为:2N2O4+O2+2H2O=4HNO3; 故答案为:2N2O4+O2+2H2O=4HNO3; (4)电解NO制备NH4NO3,阳极反应为NO3e+2H2O=NO3+4H+,阴极反应为:NO+5e+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3; 故答案为:NH3;根据反应8NO+7H2O3NH4NO3+2HNO3,电解生成的HNO3多.点评:本题考查了化学方程式书写、影响平衡及平衡常数的因素、能量变化图的分析等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握. 27.(12分)(2014?北京)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定. (1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2. ①气体a的成分是 SO2、CO2、O2 . ②若钢样中碳以FeS形式存在,A中反应:3FeS+5O21 Fe3O4 +3 SO2 . (2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量. ①H2O2氧化SO2的化学方程式: H2O2+SO2=H2SO4 ②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数: . (3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量. ①气体a通过B和C的目的是 排除二氧化硫对二氧化碳测定的干扰 ②计算钢样中碳的质量分数,应测量的数据是 二氧化碳前后吸收瓶的质量 . 考点:真题集萃;含硫物质的性质及综合应用;探究物质的组成或测量物质的含量..专题:实验探究和数据处理题.分析:(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余; ②若钢样中S以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁; (2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水; ②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数; (3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰; ②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量.解答:解:(1)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2,故答案为:SO2、CO2、O2; ②若钢样中S以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁,所以反应方程式为3FeS+5O2Fe3O4+3SO2, 故答案为:Fe3O4;SO2; (2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和水,反应方程式为H2O2+SO2=H2SO4,故答案为:H2O2+SO2=H2SO4; ②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,硫的质量分数为=,故答案为:; (3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰,B装置可氧化二氧化硫,C装置可以吸收二氧化硫,所以装置B和C的作用是氧化二氧化硫、除去二氧化硫,故答案为:排除二氧化硫对二氧化碳测定的干扰; ②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量,所以需要测定吸收二氧化碳前后吸收瓶的质量,故答案为:二氧化碳前后吸收瓶的质量.点评:本题考查了C、S含量的测定,涉及氧化还原反应、方程式的配平等知识点,明确实验原理是解本题关键,结合物质的性质来分析解答,题目难度中等. 28.(15分)(2014?北京)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a,b,c代表电压值): 序号电压/V阳极现象检验阳极产物Ⅰx≥a电极附近出现黄色,有气泡产生有Fe3+、有Cl2Ⅱa>x≥b电极附近出现黄色,无气泡产生有Fe3+,无Cl2Ⅲb>x>0无明显变化无Fe3+,无Cl2(1)用KSCN溶液检测处Fe3+的现象是 溶液变红 . (2)Ⅰ中Fe3+产生的原因可能是Cl在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应: 2Cl2e=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl . (3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有 还原 性. (4)Ⅱ中虽未检验处Cl2,但Cl在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照试验,记录如下: 序号电压/V阳极现象检验阳极产物Ⅳa>x≥c无明显变化有Cl2Ⅴc>x≥b无明显变化无Cl2①NaCl溶液的浓度是 0.2 mol/L. ②Ⅳ中检验Cl2的实验方法: 取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色 ③与Ⅱ对比,得出的结论(写出两点): 通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl放电 . 考点:电解原理;二价Fe离子和三价Fe离子的检验..专题:电化学专题.分析:(1)依据铁离子的检验方法和试剂颜色变化分析; (2)依据电解原理,氯离子在阳极失电子生成氯气,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色; (3)Fe3+产生的原因还可能是Fe2+在阳极放电,依据氧化还原反应分析Fe2+具有还原性; (4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行分析判断; ②依据检验氯气的实验方法分析; ③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,生成铁离子的两种可能.解答:解:(1)检验铁离子的试剂是硫氰酸钾溶液,用KSCN溶液检测处Fe3+的现象是溶液变红色,故答案为:溶液变红; (2)依据电解原理,氯离子在阳极失电子生成氯气,电极反应为:2Cl2e=Cl2↑,氯气具有氧化性氧化亚铁离子生成铁离子溶液变黄色,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl; 故答案为:2Cl2e=Cl2↑,Cl2+2Fe2+=2Fe3++2Cl; (3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,元素化合价升高,依据氧化还原反应分析Fe2+具有还原性,故答案为:还原性; (4)①电解pH=1的0.1mol/L FeCl2溶液,电解pH=1的NaCl溶液做对照试验,探究氯离子是否放电,需要在难度相同的条件下进行,所以氯化钠溶液的浓度为0.2mol/L,故答案为:0.2; ②依据检验氯气的实验方法分析,取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色证明生成氯气,否则无氯气生成, 故答案为:取少量阳极附近的溶液,滴在淀粉碘化钾试纸上,试纸变蓝色; ③依据图表数据比较可知,电解pH=1的NaCl溶液做对照试验与Ⅱ对比,通过控制电压证明了亚铁离子还原性大于氯离子优先放电,说明生成铁离子的两种可能,一是二价铁失电子变成三价铁,二是氯离子失电子变成氯气,氯气再氧化二价铁变成三价铁.对于补充的那个实验,实验四的电压高,氯气放电,实验五电压低,氯气不放电,而实验二氯气皆放电; 故答案为:通过控制电压,证实了产生Fe3+的两种原因,通过控制电压,验证了Fe2+先于Cl放电.点评:本题考查了离子检验方法和现象分析,电解原理的分析应用,电解反应,电极产物的理解应用,掌握基础是关键,题目难度中等. 2015年北京市高考化学试卷 一、选择题 6.(2015?北京)下列我国古代的技术应用中,其工作原理不涉及化学反应的是( ) A.火药使用B.粮食酿酒C.转轮排字D.铁的冶炼 A.AB.BC.CD.D 7.(2015?北京)下列有关性质的比较,不能用元素周期律解释的是( ) A.酸性:H2SO4>H3PO4B.非金属性:Cl>Br C.碱性:NaOH>Mg(OH)2D.热稳定性:Na2CO3>NaHCO3 8.(2015?北京)下列关于自然界中氮循环(如图)的说法不正确的是( ) A.氮元素均被氧化 B.工业合成氨属于人工固氮 C.含氮无机物和含氮有机物可相互转化 D.碳、氢、氧三种元素也参加了氮循环 9.(2015?北京)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下: 下列说法正确的是( ) A.CO和O生成CO2是吸热反应 B.在该过程中,CO断键形成C和O C.CO和O生成了具有极性共价键的CO2 D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 10.(2015?北京)合成导电高分子材料PPV的反应: 下列说法正确的是( ) A.合成PPV的反应为加聚反应 B.PPV与聚苯乙烯具有相同的重复结构单元 C.和苯乙烯互为同系物 D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度 11.(2015?北京)某消毒液的主要成分为NaClO,还含有一定量的NaOH.下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)( ) A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OHClO+Cl?+H2O B.该消毒液的pH约为12:ClO+H2O?HClO+OH? C.该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl+ClOCl2↑+H2O D.该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClOHClO+CH3COO? 12.(2015?北京)在通风橱中进行下列实验: 步骤现象Fe表面产生大量无色气泡,液面上方变为红棕色Fe表面产生少量红棕色气泡后,迅速停止Fe、Cu接触后,其表面均产生红棕色气泡下列说法不正确的是( ) A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O22NO2 B.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 C.对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 二、解答题 25.(2015?北京)“张烯炔环异构化反应”被《Name Reactions》收录,该反应可高效构筑五元环状化合物: (R、R′、R表示氢、烷基或芳基) 合成五元环有机化合物J 的路线如下: 已知: (1)A属于炔烃,其结构简式是 . (2)B由碳、氢、氧三种元素组成,相对分子质量是30.B的结构简式是 . (3)C、D含有与B相同的官能团,C是芳香族化合物.E中含有的官能团是 . (4)F与试剂a反应生成G的化学方程式是 ;试剂b是 . (5)M和N均为不饱和醇.M的结构简式是 . (6)N为顺式结构,写出N和H生成I(顺式结构)的化学方程式: . 26.(2015?北京)氢能是一种极具发展潜力的清洁能源.以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法.其反应过程如图1所示: (1)反应Ⅰ的化学方程式是 . 反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层含低浓度I2的H2SO4层和含高浓度I2的HI层. (2)①根据上述事实,下列说法正确的是 (选填序号). a.两层溶液的密度存在差异 b.加I2前,H2SO4溶液和HI溶液不互溶 c.I2在HI溶液中比在H2SO4溶液中易溶 ②辨别两层溶液的方法是 . ③经检测,H2SO4层中c(H+):c(SO42)=2.06:1.其比值大于2的原因是 . (3)反应Ⅱ: 2H2SO4(I)+2SO2(g)+O2+2H2O(g)△H=+550kJ?mo11. 它由两步反应组成: .H2SO4(I)=SO3(g)+H2O(g),△H=+177kJ?mo11; .SO3(g)分解. L (L1,L2),X 可分别代表压强或温度.图2表示L一定时,中SO3(g)的平衡转化率随X的变化关系. ①X代表的物理量是 . ②判断L1、L2的大小关系,并简述理由: . 27.(2015?北京)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域. (1)溶于海水的CO2主要以4种无机碳形式存在.其中HCO3占95%.写出CO2溶于水产生HCO3的方程式: . (2)在海洋碳循环中,通过如图所示的途径固碳. ①写出钙化作用的离子方程式: . ②同位素示踪法证实光合作用的化学方程式如下,将其补充完整: + (CH2O)n+x18O2+xH2O (3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础.测量溶解无机碳,可采用如下方法: ①气提、吸收CO2.用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下).将虚线框中的装置补充完整并标出所用试剂. ②滴定.将吸收液吸收的无机碳转化为NaHCO3,再用x mol?L1HCl溶液滴定,消耗ymLHCl溶液.海水中溶解无机碳的浓度=mol?L1. (4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量. ①结合方程式简述提取CO2的原理: . ②用该装置产生的物质处理室排出的海水,合格后排回大海.处理至合格的方法是 . 28.(2015?北京)为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“2Fe3++2I?2Fe2++I2”反应中Fe3+和Fe2+的相互转化.实验如图1所示: (1)待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ目的是使实验Ⅰ的反应到达 . (2)是的对比实验,目的是排除中 造成的影响. (3)和的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化.用化学平衡移动原理解释原因: . (4)根据氧化还原反应的规律,该同学推测I中Fe2+向Fe3+转化的原因:外加Ag+使c(I)降低,导致I的还原性弱于Fe2+.用图2装置(a、b均为石墨电极)进行实验验证. ①K闭合时,指针向右偏转,b作 极. ②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液.产生的现象证实了其推测.该现象是 . (5)按照(4)的原理,该同学用图2装置进行实验,证实了中Fe2+向Fe3+转化的原因. ①转化的原因是 . ②与(4)实验对比,不同的操作是 . (6)实验Ⅰ中,还原性:I>Fe2;而实验Ⅱ中,还原性Fe2>I.将(3)和(4)、(5)作对比,得出的结论是 . 2015年北京市高考化学试卷 参考答案与试题解析 一、选择题。
2014年北京市高考化学试卷(附参考答案+详细解析Word打印版)

2014年北京市普通高等学校招生统一考试化学试卷一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项.1.(6分)下列试剂中,标签上应标注和的是()A.C2H5OH B.HNO3C.NaOH D.HCl2.(6分)下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是()A.K B.Na C.Fe D.Al3.(6分)下列电池工作时,O2在正极放电的是()A.锌锰电池B.氢燃料电池C.铅蓄电池D .镍镉电池4.(6分)下列解释事实的方程式不正确的是()A.测0.1mol/L氨水的pH为11:NH3•H2O⇌NH4++OH﹣B.将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑C.用CuCl2溶液做导电实验,灯泡发光:CuCl2Cu2++2Cl﹣D.Al片溶于NaOH溶液中,产生气体:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑5.(6分)下列说法正确的是()A.室温下,在水中的溶解度:丙三醇>苯酚>1﹣氯丁烷B.用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3C.用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3D.油脂在酸性或碱性条件下均可发生水解反应,且产物相同6.(6分)用如图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是()A.A B.B C.C D.D7.(6分)一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解。
不同时刻测得生成O2的体积(已折算为标准状况)如下表。
下列叙述不正确的是(溶液体积变化忽略不计)()A.0~6min的平均反应速率:v(H2O2)≈3.3×10﹣2mol/(L•min)B.6~10min的平均反应速率:v(H202)<3.3×10﹣2mol/(L•min)C.反应至6min时,c(H2O2)=0.30mol/LD.反应至6min时,H2O2分解了50%二、非选择题:共4小题,共180分8.(17分)顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:已知:i.ⅱ.RCH=CHR′RCHO+R′CHO (R、R′代表烃基或氢)(1)CH2=CH﹣CH=CH2的名称是.(2)反应Ⅰ的反应类型是(选填字母).a、加聚反应b、缩聚反应(3)顺式聚合物P的结构式是(选填字母).(4)A的相对分子质量为108.①反应Ⅱ的化学方程式是.②1mol B完全转化成M所消耗H2的质量是g.(5)反应Ⅲ的化学方程式是.(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式.9.(14分)NH3经一系列反应可以得到HNO3和NH4NO3,如图1所示.(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是.(2)Ⅱ中,2NO(g)+O2(g)⇌2N02(g).在其它条件相同时,分别测得NO 的平衡转化率在不同压强(p1,p2)下随温度变化的曲线(如图2).①比较p1,p2的大小关系:②随温度升高,该反应平衡常数变化的趋势是.(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸.①已知:2NO2(g)⇌N2O4(g)△H12NO2(g)⇌N2O4(l)△H2图3中能量变化示意图中,正确的是(选填字母).②N2O4与O2、H2O化合的化学方程式是.(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是,说明理由:.10.(12分)碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.(1)采用图1装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.①气体a的成分是.②若钢样中碳以FeS形式存在,A中反应:3FeS+5O21 +3.(2)将气体a通入测硫酸装置中(如图2),采用滴定法测定硫的含量.①H2O2氧化SO2的化学方程式:②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH 溶液相当于硫的质量为y克,则该钢样中硫的质量分数:.(3)将气体a通入测碳装置中(如图3),采用重量法测定碳的含量.①气体a通过B和C的目的是②计算钢样中碳的质量分数,应测量的数据是.11.(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a,b,c代表电压值):(1)用KSCN溶液检测处Fe3+的现象是.(2)Ⅰ中Fe3+产生的原因可能是Cl﹣在阳极放电,生成的Cl2将Fe2+氧化,写出有关反应:.(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有性.(4)Ⅱ中虽未检验处Cl2,但Cl﹣在阳极是否放电仍需进一步验证.电解pH=1的NaCl溶液做对照试验,记录如下:①NaCl溶液的浓度是mol/L.②Ⅳ中检验Cl2的实验方法:③与Ⅱ对比,得出的结论(写出两点):.2014年北京市高考化学试卷参考答案与试题解析一、选择题:共7小题,每小题6分,共120分.在每小题给出的四个选项中,选出最符合题目要求的一项.1.(6分)下列试剂中,标签上应标注和的是()A.C2H5OH B.HNO3C.NaOH D.HCl【分析】警示标记标注和说明该物质具有强的氧化性和腐蚀性,据此解答.【解答】解:A.C2H5OH为易燃品,不具有强的氧化性和腐蚀性,故A错误;B.硝酸具有强的氧化性和腐蚀性,应标注和,故B 正确;C.NaOH具有腐蚀性,但是不具有氧化性,故C错误;D.盐酸具有腐蚀性,但是不具有强的氧化性,故D错误;故选:B。
高考化学 2014顺义一模答案

顺义区2014届高三统一测试理科综合试卷参考答案及评分标准一、选择题:每小题6分,共120分。
题号 1 2 3 4 5 6 7 8 9 10 答案 B B D A A A C D B D 题号 11 12 13 14 15 16 17 18 19 20 答案 CBBCDCDBAB二、非选择题,共11题,180分。
21.(共18分)(1)① ab ② g =K24π (每空3分)(2) (每问3分) ① ②甲③(a )图线不应画为直线;(b )横坐标的标度不恰当. ④ D22.(共16分)(1)运动员从B 点开始做平抛运动;水平方向匀速运动。
X =V t (3分)X = 30x2m = 60m (2分) (2)在下滑过程中根据能量关系,有221mv W mgH f =- (3分) 运动员克服阻力做功J mv mgH W f 3000212=-= (2分)(3)竖直分速度v y =gt =20m/s ,22yx v v v +=,E K =221mv,E K =3.9X104J (6分)或由机械能守恒也可 23.(18分) (1)由221。
mv mgH =,物块m自由下落与金属条碰撞的速度为0v =(2分) 设物体m 落到金属条2m 上,金属条立即与物体有相同的速度v 开始下落,由m 和2m 组成的系统相碰过程动量守恒0(2)mv m m v =+ (2分)则v =(2分) (2)当金属条和物体的加速度达到2g时,有:错误!未找到引用源。
, (2分) 则: I =3mg /2BL 错误!未找到引用源。
(2分)(3)金属条和物体一起下滑过程中受安培力和重力,随速度变化,安培力也变化, 做变加速度运动,最终所受重力和安培力相等,加速度也为零,物体将以速度m v 做匀速运动,则有:30mg F '-= (1分)BIL F BL E R EI ===,m ,ν (3分)22m B L v F R '=金属条的最终速度为:223m mgRv B L=下落h 的过程中,设金属条克服安培力做功为W A ,由动能定理:221133322A m mgh W mv mv -=⨯-⨯(2分) 感应电流产生的热量:Q =W A得:Q =3mg (h +H /9)-27m 3g 2R 2/2B 4L 4(2分)24.(20分)(1)设正离子经过窄缝被第一次加速加速后的速度为v 1,由动能定理得 2121mv qU =(2分) 正离子在磁场中做匀速圆周运动,半径为r 1,由牛顿第二定律得1211r vm Bqv = (2分)由以上两式解得 212qBmUr =(1分) (2)设粒子飞出的末速度为v ,将多次电场加速等效为一次从0到v 的匀加速直线运动。
北京市顺义区2014届高三3月月统一测试化学试题Word版含答案

北京市顺义区 2014 届高三 3 月月一致测试理科综合化学试卷2014.36.以下说法中,正确的选项是A.的构造中含有酯基B.纤维素、葡萄糖和鸡蛋白在必定条件下都能够发生水解反响C.顺― 2―丁烯和反― 2―丁烯的加氢产物不一样D.维生素 A 的构造简式为 :它是一种易溶于水的醇7.以下解说实验的离子反响方程式正确的选项是A.用 KIO3氧化酸性溶液中的KI:5I --+3H2O = 3I 2-+IO3+6OHB.向 FeBr2溶液中通入足量氯气: 2Fe2++2Br— +2Cl 2 =2Fe3+ + Br 2 +4Cl —C.向 Cu(OH)2悬浊液中滴加 Na2S 溶液,蓝色积淀变黑色:Cu(OH)2+ S 2-CuS + 2OH-D.用稀硝酸清洗试管内壁的银镜: Ag + 2H++ 3NO- = Ag++ NO↑+ H2O8.糕点包装中常用的脱氧剂构成为复原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐化同样。
以下剖析正确的选项是A.脱氧过程中脱氧剂发生复原反响B.脱氧过程中铁作原电池正极,电极反响为:Fe - 2e—= Fe 2+C.脱氧过程中碳作原电池负极,电极反响为:2H2O + O2 + 4e — = 4OH—D.含有 1.12g 铁粉的脱氧剂,理论上最多能汲取氧气336mL(标准状况 )9.已知 X、Y、Z、W四种短周期元素在周期表中的相对地点如下图,以下说法正确的是A. 非金属性: X<Y<ZB.W 的原子序数可能是 Y 的原子序数的 2 倍C.气态氢化物稳固性: Y < WD.Z 的化学开朗性必定比 X 强10.用以下图所示实验装置进行相应实验,能达到实验目的的是A.装置①可用于除掉 Cl 2中含有的少许 HCl 气体B.按装置②所示的气流方向可用于采集H2、 NH3等C.用图③所示装置蒸干NH4Cl 饱和溶液制备 NH4Cl 晶体D.用图④所示装置分别CCl4萃取碘水后已分层的有机层和水层11.T ℃时在 2 L 的密闭容器中 X(g) 与 Y(g) 发生反响生成 Z(g) 。
2024北京顺义区高三一模化学(第二次统练)试题及答案

光照2024北京顺义高三一模化学(第二次统练)可能用到的相对原子质量: Cu 64 In 115 Te 128第一部分本部分共14小题,每题3分,共42分。
在每题列出的四个选项中,选出最符合题目要求的一项。
1.我国科研人员以全卤化蒽(图a )为原料,在一定条件下首次成功合成了由14个碳原子组成的累积烯烃型环形碳分子C 14(图b )。
环形C 14有望发展成为新型半导体材料。
下列说法不正确的是A .C 14Cl 10的空间结构为平面形B .环形C 14与石墨互为同位素C .C 14Cl 10与环形C 14均属于分子晶体D .该合成过程中会有极性共价键的断裂2.三尖杉属植物是我国特有树种,含有黄酮类化合物。
某种黄酮类化合物的分子结构如图所示。
下列说法不正确的是 A. 分子式为C 15H 12O 6 B. 分子中含有手性碳原子 C. 能与 Na 2CO 3 溶液反应 D. 能发生消去反应和水解反应3.下列化学用语或图示表达不正确的是A .基态溴原子中,电子填入的最高能级原子轨道B .用电子式表示KCl 的形成过程C .中子数为16的磷原子 31 15PD .SO 2 的VSEPR 模型4.下列化学用语与所给事实不相符的是A .向FeCl 3稀溶液中加入铜片,铜片溶解:2Fe 3+ + Cu === 2Fe 2+ + Cu 2+B .Cl 2通入NaOH 溶液中制漂白液:Cl 2 + 2OH —=== Cl —+ ClO —+ H 2OC .浓硝酸应保存在棕色试剂瓶中: 4HNO 3 === 4NO 2↑+ O 2↑+2H 2OOHOOH OOHOHD .钢铁发生吸氧腐蚀时铁做负极:Fe —3e —== Fe 3+5. 下列物质性质的比较,与键的极性或分子的极性无关的是A .酸性:CH 2ClCOOH > CH 3COOH B .硬度:金刚石> 晶体硅C .水中溶解度:NH 3 > CH 4D .沸点:CO > N 26.下列实验中,能够达到实验目的的是7.以CO 2、N 2为原料,电解KHCO 3溶液制备尿素[]是一种新兴的尿素合成方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市顺义区2014届高三第二次统练(化学)
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Fe 56 6.下列物质及用途对应不正确...的是
7.解释下列事实的化学用语正确的是
A .将NH
3通入滴有酚酞的水中,溶液变红:NH 3 + H 2O NH 3·H 2O
4
NH
+ OH -
B .铜与浓硫酸共热产生气体:Cu +H 2SO 4(浓)
Cu 2+ + SO 42- + H 2↑
C .CH 3COONa 的水溶液呈碱性:CH 3COO - + H 2O = CH 3COOH + OH -
D .用NaOH 溶液吸收Cl 2:Cl 2+2OH - = 2Cl - + H 2O
8. 铜锌原电池装置(见右图),下列分析正确的是 A .一段时间后两烧杯中c(Zn 2+)、c(Cu 2+)均减小 B .原电池工作时,Cu 电极流出电子,发生氧化反应 C .原电池工作时的总反应为Zn +Cu 2+
=Zn 2+
+Cu
D .盐桥中装有含氯化钾的琼脂,其作用是传递电子
9. 下列进行性质比较的实验,不合理...
的是 A.比较Cu 、Fe 的还原性:铜加入硫酸铁溶液中 B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气 C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸
D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L -1
的盐
酸中
10. 实验:① 0.1 mol·L -
1 MgCl 2溶液和0.
2 mol·L -
1NaOH 溶液等体积混合得到浊液a,
取少量浊液a 过滤得到滤液b 和白色沉淀c ;② 向浊液a 中滴加0.1 mol·L -
1FeCl 3溶
液,出现红褐色沉淀。
下列分析不正确...
的是
A . 滤液b 的pH=7
B .②中颜色变化说明Mg(OH)2转化为Fe(OH)3
C .实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小
D .浊液a 中存在沉淀溶解平衡:Mg(OH)2(s
) Mg 2+(aq ) + 2OH -
(aq )
11. 实验室中某些气体的制取、除杂及收集装置如图所示。
仅用此装置和表中提供的物质完
成相关实验,最合理的是
12. 第三周期元素,浓度均为0.01 mol/L 的最高价氧 化物对应水化物的pH 与原子半径的关系如右图所示。
则下列说法正确的是
A. 气态氢化物的稳定性:N >R
B. Z 的最高价氧化物对应的水化物能溶于稀氨水
C. Y 和R 形成的化合物既含离子键又含共价键
D. X 和M 两者最高价氧化物对应的水化物反应后溶液的pH >7 答案下载即可看见
pH。
