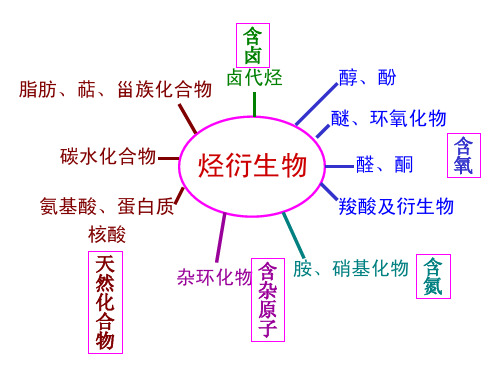
第20章 氨基酸,蛋白质和核酸
Ch.20 蛋白质和核酸

第20章蛋白质和核酸蛋白质与核酸是构成生物体最重要的二类物质,是一切生命的物质基础。
这二类物质都是结构十分复杂的天然高分子化合物。
纯粹的蛋白质,不管来源如何,不管相对分子质量有多大,结构有多复杂,在酸或碱的催化下,都可以彻底水解产生各种α-氨基酸:可见,α-氨基酸是构成蛋白质的结构单元。
第一节α-氨基酸一、分类、命名、结构羧酸烃基的H被氨基取代后的产物通称为氨基酸。
1. 分类根据氨基离 -COOH的远近来分:根据氨基与-COOH的相对数目来分:2. 命名可用系统命名由蛋白质水解得到的氨基酸都是α-氨基酸,这些氨基酸都有俗名,习惯上多使用俗名。
到目前为止,从动植物体获得的α-氨基酸有近百种,但构成蛋白质的α-氨基酸只有23种。
见教材P.268 表20-1表中只列出20种♦请指出表中的中性氨基酸、酸性氨基酸、碱性氨基酸。
♦何谓必需氨基酸?一共有多少种必需氨基酸?3. 结构表中所列的均为天然存在的α-氨基酸,是由蛋白质水解得到的,除了甘氨基酸外,它们的α-C均为手性C,具有旋光性,它们的结构可表示为:二、天然α-氨基酸的构型其构型是通过将其α-C与乳酸的α-C的构型相比较来确定的。
天然α-氨基酸均为L构型:三、化学性质1. 两性和等电点α-氨基酸无论是晶体还是在水溶液中,都主要以内盐的形式存在:这个内盐也叫两性离子,或偶极离子。
因为是内盐,所以,α-氨基酸的晶体熔点很高、大多能溶于水、不溶于非极性或弱极性有机溶剂中。
α-氨基酸具有酸性,又具有碱性:α-氨基酸在水溶液中发生两性离解:通过控制溶液的pH值,可以使氨基酸阳离子的浓度与氨基酸阴离子的浓度相等,溶液此时的pH值叫做该α-氨基酸的等电点(pI)。
不同的α-氨基酸,其等电点是不同的。
各种α-氨基酸的pI见教材P.268 表20-1在等电点时,氨基酸在电场中不向正极移动,也不向阴极移动;氨基酸偶极离子的浓度最大;氨基酸在水中的溶解度最小。
2. 与水合茚三酮的显色反应大多数α-氨基酸(除脯氨酸外)都能与水合茚三酮作用生成蓝色至紫蓝色的化合物:反应很灵敏,常用于鉴定α-氨基酸,也用于α-氨基酸的比色测定及纸上层析的显色。
2020-2021学年度高二化学《蛋白质和核酸》知识点总结以及例题导析

蛋白质和核酸【学习目的】1、理解氨基酸、蛋白质与人体安康的关系,认识人工合成多肽、蛋白质、核酸的意义;2、掌握氨基酸和蛋白质的构造特点及其重要的化学性质。
【要点梳理】要点一、氨基酸的构造和性质蛋白质是生命活动的主要物质根底,氨基酸是组成蛋白质的根本构造单位,而核酸对蛋白质的生物合成又起着决定作用。
因此,研究氨基酸、蛋白质、核酸等根本的生命物质的构造,有助于揭开生命现象的本质。
1.氨基酸的组成和构造。
(1)氨基酸是羧酸分子中烃基上的氢原子被氨基取代后的生成物。
氨基酸分子中含有氨基和羧基,属于取代羧酸。
(2)组成蛋白质的氨基酸几乎都是α-氨基酸。
α-氨基酸的构造简式可表示为:常见的α-氨基酸有许多种。
如:2.氨基酸的物理性质。
天然氨基酸均为无色晶体,主要以内盐形式存在,熔点较高,在200℃~300℃时熔化分解。
它们能溶于强酸或强碱溶液中,除少数外一般都能溶于水,而难溶于乙醇、乙醚。
提示:(1)内盐是指氨基酸分子中的羟基和氨基作用。
使氨基酸成为带正电荷和负电荷的两性离子(如)。
(2)氨基酸具有一般盐的物理性质。
3.氨基酸的主要化学性质。
(1)氨基酸的两性。
氨基酸是两性化合物,能与酸、碱反响生成盐。
氨基酸分子既含有氨基又含有羧基,通常以两性离子形式存在,溶液的pH不同,可发生不同的解离。
不同的氨基酸在水中的溶解度最小时的pH(即等电点)不同,可以通过控制溶液的pH别离氨基酸。
(2)氨基酸的成肽反响。
在酸或碱存在的条件下加热,一个氨基酸分子的氨基与另一个氨基酸分子的羧基间脱去一分子水,缩合形成含有肽键()的化合物,称为成肽反响。
例如:由两个氨基酸分子间脱水形成的含有肽键的化合物叫二肽。
由三个氨基酸分子间脱水形成的含有肽键的化合物叫三肽,以此类推,三肽以上均可称为多肽。
相对分子质量在10000以上并具有一定空间构造的多肽,称为蛋白质。
4.α-氨基酸的鉴别。
大多数α-氨基酸在pH为5.5时与茚三酮()的醇溶液共热煮沸,可以生成蓝紫色物质,与脯氨酸和羟脯氨酸生成黄色,这一显色反响可以用于识别除脯氨酸和羟脯氨酸以外的α-氨基酸。
有机化学 蛋白质和核酸

Phe
2). C-末端测定
羧肽酶法: 羧肽酶只能水解C端氨基酸的肽键。
O O O H2NCH 2CNHCHCNHCHCOH CH2C6H5 CH3
H2O, 羧肽酶
O O O H2NCH2CNHCHCOH + H2NCHCOH CH3 CH2C6H5
新C端 根据各氨基酸放出的先后和含量,就可以推断出C端 氨基酸的种类和次序。 对于大分子蛋白质或较长的肽链,必须结合部分水解 法,利用各个肽片断中的重叠结构推出整个肽链的氨基酸 排列次序。
α-羟基-α氨基酸
α-酮酸
α - 氨基酸中的氨基被氧化剂氧化,或在生物体内酶的作 用下生成α - 亚氨基酸,然后经过水解、脱氨生成α - 酮酸。
3.脱水反应—成肽
O -H2O H2N CH C OH + H NH CH COOH R R
O H2N CH C NH CH COOH R
二肽
肽键
R
4. 与水合茚三酮的反应
pH=9 说明为碱性氨基酸,调pI 应加碱,故pI >9。
2.氨基酸中氨基的性质
(1)与亚硝酸反应
R CH COOH + HNO2 NH2
R CH COOH + N2 + H2O
OH α - 氨基酸中的伯氨基可与亚硝酸反应生成羟基酸, 并放出氮气,根据放出氮气的量可计算出α - 氨基酸的 含量。脯氨酸不含伯氨基除外。
(3)与生物碱试剂作用
+ NH3 Pr COOH
+ Cl 3COO
Pr
NH2 COOH
+ OOCCCl 3
5、蛋白质的变性 蛋白质因受物理或化学因素的影响,改变了分子内部 的特有结构,导致理化性质改变,生理活性丧失的现象称 为蛋白质的变性。
蛋白质和核酸

【讨论】若不小心误服了铅离子,在去医院前可 以采用什么急救措施?
盐析与变性的对比
盐析
变性
相同点
加入某种物质后有沉淀生成
不 同
盐 加入某些浓盐溶液,
不 如: Na2SO4 同 (NH4)2SO4等
重金属盐、醛、加 热或剧烈震动
点 复原 可逆,加水即可
不可逆
的缩反合应机理: 酸脱羟基,氨脱氢
+
肽键
+ H2O
多种氨基酸分子按不同的排列顺序以肽键相互结合,
可以形成千百万种具有不同的理化性质和生理活性 的多肽链。相对分子量在10 000以上的,并具有一 定空间结构的多肽,称为蛋白质。
知识拓展
H
NH HO O
CH2
C
Δ
O
C
CH2 OH HN
H
H NO ON H
3、具有酸性
4、分类: (1)脱氧核糖核酸(DNA):生物遗传信息的载体; 还指挥着蛋白质的合成、细胞的分裂和制造新的细胞。 (2)核糖核酸(RNA):根据DNA提供的信息控制 体内蛋白质的合成。
二、蛋白质的结构与性质
1、蛋白质的组成
组成元素主要包括: C、H、O、N、S等
组成基本结构单元: 氨基酸
相对分子质量:
几万----几千万
属于含氮生物高分子化合物
2、蛋白质的结构
一级结构:蛋白质中各种氨基酸的连接方式和排列顺序, 肽键是一级结构的主键。
二级结构:多肽链卷曲盘旋和折叠的空间结构
三级结构:二级结构 的肽链进一步盘曲折 叠形成亚基。
1、什么是酶
一类由细胞产生的,对生物体内的化学反 应具有催化作用的蛋白质。
生物化学第三版课后习题答案

生物化学第三版课后习题答案生物化学第三版课后习题答案生物化学是研究生物体内化学反应的科学,它研究了生物体内各种生物大分子的结构、性质和功能,以及生物体内化学反应的机制和调控。
生物化学的课后习题对于学生的学习和理解非常重要,通过解答习题,可以帮助学生巩固所学知识,提高问题解决能力。
下面是生物化学第三版课后习题的答案。
第一章:绪论1. 生物化学的研究对象是什么?答:生物化学的研究对象是生物体内的化学物质,包括蛋白质、核酸、碳水化合物、脂类等。
2. 生物化学的研究方法有哪些?答:生物化学的研究方法包括分离纯化、鉴定结构、测定性质、研究功能、探索机制等。
第二章:氨基酸和蛋白质1. 什么是氨基酸?答:氨基酸是构成蛋白质的基本单位,它由氨基、羧基和侧链组成。
2. 氨基酸的分类有哪些?答:氨基酸可以根据侧链的性质分为非极性氨基酸、极性氨基酸和带电氨基酸。
第三章:核酸1. 核酸的组成单位是什么?答:核酸的组成单位是核苷酸,它由糖、碱基和磷酸组成。
2. 核酸的功能有哪些?答:核酸的功能包括存储遗传信息、传递遗传信息和参与蛋白质合成等。
第四章:碳水化合物1. 碳水化合物的分类有哪些?答:碳水化合物可以根据分子中含有的糖单位数目分为单糖、双糖和多糖。
2. 碳水化合物的功能有哪些?答:碳水化合物的功能包括提供能量、构建细胞壁和参与细胞信号传导等。
第五章:脂类1. 脂类的分类有哪些?答:脂类可以根据分子中含有的酯键数目和酸基的性质分为简单脂类、复合脂类和衍生脂类。
2. 脂类的功能有哪些?答:脂类的功能包括提供能量、构建细胞膜和参与信号传导等。
第六章:酶1. 酶的特点是什么?答:酶是生物体内的催化剂,具有高效、高选择性和高度专一性的特点。
2. 酶的分类有哪些?答:酶可以根据催化反应类型分为氧化还原酶、转移酶、水解酶和合成酶等。
通过解答以上习题,可以帮助学生巩固对生物化学知识的理解和掌握。
同时,习题的答案也为学生提供了参考,帮助他们更好地完成学习任务。
2024年高考生物复习易错点解析—蛋白质和核酸的三个理解误区

2024年高考生物复习易错点解析—蛋白质和核酸的三个理解误区易错陷阱1:蛋白质变性和盐析本质相同。
【分析】高温使蛋白质变性的原因不是高温破坏了氨基酸之间的肽键,而是高温使肽链盘曲折登形成的空间结构发生不可逆变化。
低温和盐析未使蛋白质分子的空间结构发生不可逆变。
易错陷阱2:DNA分子和蛋白质分子在高温下空间结构都会出现不可逆的变化。
【分析】DNA分子和蛋白质分子对高温的耐受性不同,DNA分子对高温的耐受性通常比蛋白质分子高。
易错陷阱3:蛋白质的水解就是氧化分解。
【分析】蛋白质初步水解的产物是:多肽,彻底水解的产物是:氨基酸,氧化分解的产物是:二氧化碳、水和尿素。
【易错点提醒一】变性≠盐析【例1】某兴趣小组采用两种途径处理鸡蛋清溶液,过程如图所示。
有关叙述正确的是()A.①③处理后溶液中含有氨基酸B.②过程可能破坏了蛋白质的空间结构C.高温后蛋白质容易被蛋白酶水解,吃熟鸡蛋容易消化D.④过程若加入取自动物消化道中的物质,会破坏蛋白质的空间结构但不影响肽键【答案】BC【解析】蛋白质经盐析处理后再溶解还是蛋白质,A错误;②过程可能破坏了蛋白质的空间结构,B正确;高温后蛋白质分子的空间结构变得伸展、松散,更易被蛋白酶水解,吃熟鸡蛋容易消化,C正确;④过程蛋白质被消化液中的蛋白酶催化水解,会破坏蛋白质的空间结构和肽键,D错误;【变式1-1】(2023·海南·高考真题)科学家将编码天然蜘蛛丝蛋白的基因导入家蚕,使其表达出一种特殊的复合纤维蛋白,该复合纤维蛋白的韧性优于天然蚕丝蛋白。
下列有关该复合纤维蛋白的叙述,正确的是()A.该蛋白的基本组成单位与天然蜘蛛丝蛋白的不同B.该蛋白的肽链由氨基酸通过肽键连接而成C.该蛋白彻底水解的产物可与双缩脲试剂发生作用,产生紫色反应D.高温可改变该蛋白的化学组成,从而改变其韧性【答案】B【解析】该蛋白的基本组成单位是氨基酸,与天然蜘蛛丝蛋白的基本单位相同,A 错误;氨基酸是组成蛋白质的基本单位,该蛋白的肽链由氨基酸经过脱水缩合反应通过肽键连接而成,B正确;该蛋白彻底水解的产物为氨基酸,不能与双缩脲试剂发生作用产生紫色反应,C错误;高温可改变该蛋白的空间结构,从而改变其韧性,但不会改变其化学组成,D错误。
高鸿宾《有机化学》(第4版)课后习题-氨基酸、蛋白质和核酸(圣才出品)

第20章氨基酸、蛋白质和核酸1.命名下列化合物:解:(1)甘氨酸铵(2-氨基乙酸铵)(2)亮氨酸(2-氨基丙酸)(3)丝氨酸(2-氨基-3-羟基丙酸)(4)N-乙酰基丙氨酸(5)γ-丁内酰胺(6)半胱氨酸(2-氨基-3-巯基丙酸)2.写出下列氨基酸的投影式,并用R,S-标记法表示它们的构型。
(1)L-天门冬氨酸(2)L-半胱氨酸(3)L-异亮氨酸解:3.用化学方法区别和。
解:4.指出下列氨基酸与过量HCl或NaOH溶液反应的产物。
(1)Pro(2)Tyr(3)Ser(4)Asp解:5.说明为什么Lys的等电点为9.74,而Trp的等电点是5.88。
(提示:考虑为什么杂环N在Trp中不是碱性的。
)解:Lys的结构为:,其分子中有两个氨基,在水溶液均可电离,必须加入碱才能抑制氨基的电离,使Lys以偶极离子形式存在,而碱的加入必然会使溶液的pH升高,所以,Lys的等电点为9.74,高于中性氨基酸。
Trp的结构为:,其分子中虽然有两个氮原子,但吡咯氮上的一对孤对电子参与了环状离域体系,碱性非常弱,在水溶液中并不电离,所以Trp的等电点是5.88,接近中性氨基酸。
6.按要求分别合成下列化合物(原料自选)。
(1)应用丙二酸酯合成法合成苯丙氨酸(2)应用Gabriel合成法和丙二酸酯合成法相结合的方法合成蛋氨酸(3)应用Strecker合成法合成蛋氨酸。
解:十万种考研考证电子书、题库视频学习平台圣才电子书7.写出下列反应式中(A)~(I)的构造式。
解:8.一个氨基酸的衍生物与NaOH水溶液共热放出氨,并生成的钠盐,若把(A)进行Hofmann降解反应,则生成α,γ-二氨基丁酸,推测(A)的构造式,并写出反应式。
解:A的结构为(不稳定);相关的反应式如下:9.DNA和RNA在结构上有什么主要差别?解:DNA和RNA在结构上有两点不同。
(1)戊糖不同。
DNA中的戊糖为脱氧核糖核酸,而RNA中的戊糖为核糖核酸;(2)碱基不同。
第20章 蛋白质和核酸(proteins and nucleic acid)

奋斗,合成的牛胰岛素经过物理化学及生物活性的测定,与天然 的完全相同,这是当时世界上第一次用人工方法合成的与天然产 物完全相同的分子量最大的多肽,牛胰岛素的合成不仅是一项技 术上的成就,更重要的是它使人类在认识生命,揭开生命的奥秘 的伟大历程又前进了一步。 蛋白制是一类含氮的天然的高聚物,由N,C,O,H,有少量S,P, Cu,Mn,Zn,I等元素组成,它是生物体内一切组织的基本组成部分, 细胞内除水外,其余的80%的物质是蛋白质,在生物体内蛋白质 的功能是极其复杂的。 生理作用:负责输送氧气 ——血红蛋白 新陈代谢起调节作用——激素 催化作用——酶 预防疾病的发生(免疫)——抗体 与生物遗传有关——核蛋白(RNA,DNA)
+
H 2N C H C O N H R
鲜红色,比色分析 用已知的丙氨酸做成的比色,从而知道N端是什么氨基
NH2 NH2
应用:1) 在等电点(PI)时,偶极离子浓度最大,氨基酸的溶解度 最小,通过调节溶液的PI值,可以从氨基酸的混合物中分离出某 中氨基酸。 2) 知道等电点,在查什么类型的氨基酸,做鉴定用。 3. 氨基酸的物性和光谱性质 物性:1. ɑ-氨基酸 无色结晶 2.在PI等电点时,两性离子,有极强的静电力 3.由于是偶极离子,难溶于有机溶剂 4.IR: υ –COOH=1600cm-1 υ –NH=3100-2600cm-1(宽)
-10
H 3O ++NH 2CH2 COO = 1.6×10-10 = 6.3 ×10-5
苷胺酸中 -COO碱性基团
+ H 3NCH2 COO - + H 2O + [H 3NCH 2COOH][OH -] Kb = + [H 3NCH 2COO -][H2 O] ka .kb= 10-14 ka =10-14 kb
有机第20章2013
Mg I
N-甲基吡咯
CH3
吡咯钾盐也常用来制取吡咯的取代物。例如:
1)CO2 2)H2O
COOH N H
α-吡咯甲酸
CHCl3/KOH
CHO N H
α-吡咯甲醛
O
N+ K
CH3COCl
N COCH3
>150℃
C N H
CH3
N-乙酰基吡咯
CH3I 60℃
α-乙酰基吡咯
CH3
>150℃
N CH3
N H
糠醛与酸酐缩合(普尔金反应):
CHO O
+
(CH 3CO) 2O
CH3COONa
糠醛
CH O
CH
COOH
α-呋喃丙烯酸
2)吲哚
吲哚为白色片状结晶,熔点52.5 ℃
4 5 6 7 3 2
吲哚
N1 H
(indole)
具有极臭的气味,但纯粹的吲哚在极稀 薄时有素馨花的香味,可作香料。
重要的吲哚衍生物
CHO O
+
H2
CuO,CrO 3 150℃,10MPa
O
CH 2OH
糠醛
糠醇
糠醇也是一种良好溶剂, 是合成糠醇树脂的单体
糠醛歧化(康尼查罗反应):
CHO O
+
NaOH
O
CH2OH
+
O
COONa
糠醛
糠醇
糠酸钠
糠醛偶联:
OH O C O
CHO O
KCN 醇溶液
CH O
糠醛
呋嗡(类似安息香) (furoin)
噻吩中含硫,会使一般的催化剂中毒,氢化时 必须采用特殊催化剂。
化学蛋白质和核酸知识点

化学蛋白质和核酸知识点蛋白质是组成人体一切细胞、组织的重要成分。
核酸是由许多核苷酸聚合成的生物大分子化合物,为生命的最基本物质之一。
接下来店铺为你整理了化学蛋白质和核酸知识点,一起来看看吧。
化学蛋白质和核酸知识点(一)氨基酸的结构与性质羧酸分子中烃基上的氢原子被氨基(-NH2)取代后的生成物称为氨基酸;分子结构中同时存在羧基(-COOH)和氨基(-NH2)两个官能团,既具有氨基又具有羧基的性质。
说明:1、氨基酸的命名有习惯命名和系统命名法两种。
习惯命名法如常见的氨基酸的命名,如:甘氨酸、丙氨酸、苯丙氨酸、谷氨酸等;而系统命名法则是以酸为母体,氨基为取代基,碳原子的编号通常把离羧基最近的碳原子称为α-碳原子,次近的碳原子称为β-碳原子,依次类推。
如:甘氨酸又名α-氨基乙酸,丙氨酸又名α-氨基丙酸,苯丙氨酸又名α-氨基β-苯基丙酸,谷氨酸又名α-氨基戊二酸等。
2、某些氨基酸可与某种硝基化合物互为同分异构体,如:甘氨酸与硝基乙烷等。
3、氨基酸结构中同时存在羧基(-COOH)和氨基(-NH2),氨基具有碱性,而羧基具有酸性,因此氨基酸既具有酸性又具有碱性,是一种两性化合物,在与酸或碱作用下均可生成盐。
氨基酸在强碱性溶液中显酸性,以阴离子的形式存在,而在强酸性溶液中则以阳离子形式存在,在溶液的pH合适时,则以两性的形式存在。
如:4、氨基酸结构中存在羧基(-COOH)在一定条件下可与醇作用生成酯。
5、氨基酸结构中羧基(-COOH)和氨基(-NH2)可以脱去水分子,经缩合而成的产物称为肽,其中-CO-NH-结构称为肽键,二个分子氨基酸脱水形成二肽;三个分子氨基酸脱水形成三肽;而多个分子氨基酸脱水则生成多肽。
如:发生脱水反应时,酸脱羟基氨基脱氢多个分子氨基酸脱水生成多肽时,可由同一种氨基酸脱水,也可由不同种氨基酸脱水生成多肽。
6、α-氨基酸的制取:蛋白质水解可得到多肽,多肽水解可得到α-氨基酸。
各种天然蛋白质水解的最终产物都是α-氨基酸。
有机化学 第二十一章 氨基酸、蛋白质和核酸

氨基酸等电点可由相应氨基酸盐酸盐的pKa值求 出。如丙氨酸盐酸盐,可看作一个二元酸,具有两
个平衡常数K1和K2
用碱调节丙氨酸盐酸盐水溶液pH值,当加入 0.5mol碱时,平衡中氨基酸正离子4的浓度与偶极 离子5的相同,[4] =[5]此时溶液pH值等于pK1,实 际上此溶液中只有50%的偶极离子5。当加入1.5mol 碱时,溶液中氨基酸偶极离子5的浓度等于负离子6, [5]=[6]此时溶液的pH值等于pK2 ,溶液中也含50% 偶极离子5。所以使丙氨酸完全以偶极离子5存在时, pH值应为pK1和pK2的平均值,这个pH值即为丙氨酸 的等电点(pI),pI=(pK1 + pK2)/2。根据表21-2数据, 丙氨酸盐酸盐的pK1为2. 3、pK2为9. 7,可求出丙 氨酸等电点为6. 0:
三、氨基酸的来源与合成 氨基酸不仅是组成蛋白质的结构单元,而且它
们本身也是人体生长的重要营养物质,具有特殊的 生理作用,因此氨基酸的生产和应用早就得到人们 的重视。
生产氨基酸主要有以下四条途径: 1.蛋白质的水解
由蛋白质水解制备氨基酸是从1820年开始的, 这是一个最古老的方法。味精早期就是由小麦蛋白 质—面筋水解得到。胱氨酸、半咣氨酸是由头发水 解制得的。
天然氨基酸,除甘氨酸外, α碳原子都有手 性,且都是L构型。氨基酸的构型是与乳酸相比而 确定的(也就是从甘油醛导出来的)。例如,与L -乳酸相应的L -丙氨酸的构型是:
正像糖类化合物一样,氨基酸的构型习惯于用 D,L标记法。如果用R/S法标记,那么天然氨基酸大 多属于S构型。但也有R构型的,如L-半胱氨酸为R构 型。
胺与羧酸反应很容易形成铵盐,当氨基和羧基存在 于同一分子时,可在分子内发生质子迁移而形成内盐 (zwitterion):
第二十章 氨基酸 蛋白质 核酸

完全水解后,经分析氨基酸的组成为:丙、亮、赖、苯丙、脯、丝、 酪、缬。 端基分析:N-端 丙……………………亮 C-端。 胰蛋白酶催化水解:分离得到酪氨酸,一种三肽和一种四肽。 用 Edman 降解分别测定三肽、四肽的顺序,结果为:丙-脯-苯丙;赖丝-缬-亮。 由上述信息得知,八肽的顺序为:
丙 脯 苯丙 酪 赖 丝 缬 亮 三肽 糜蛋白酶 四肽
NH2NH2
C
O NH
C NH O
+
NH2 CH COOH CH2Ph
D,L-苯丙氨酸 合成法合成的氨基酸是外消旋体,拆分后才能得到 D-合 L-氨基酸。 氨基酸的化学合成 1850 年就已实现,但氨基酸的发酵法生产在一百年后的 1957 年才得以实现用糖类(淀粉)发酵生产谷氨酸。
第二节 多 肽
一、多肽的组成和命名 1. 肽和肽键 一分子氨基酸中的羧基与另一分子氨基酸分子的氨基脱水而形成的酰胺叫 做肽,其形成的酰胺键称为肽键。
位于左边的为 L 型。例如:
COOH H C R NH2 NH2
COOH C R H
D-氨基酸
L-氨基酸
天然氨基酸(出甘氨酸外)其他所有α-碳原子都是手性的,都有旋光性, 而且发现主要是 L 型的(也有 D 型的,但很少) 。 二、氨基酸的性质 1.氨基酸的酸-碱性——两性与等电点 氨基酸分子中的氨基是碱性的,而羧基是酸性的,因而氨基酸既能与酸反 应,也能与碱反应,是一个两性化合物。
R CH COOH NH2 OH H H OH
R CH COO NH2
R CH COO NH3
R CH COO H NH3
溶Байду номын сангаас pH> 等电点 pH<等电点
等电点 (pI)
蛋白质和核酸 大学有机化学

1.氨基酸的酸-碱性——两性与等电点
(1)两性
R CH NH2 COOH
+ H 2O
R
CH NH2
COO
-
+
H3 O
+
R
CH NH3
+
COOH
+
OH
-
R
CH COOH NH 3
H
OH R CH COOH NH 2 R CH COO NH 2
(2)等电点
R- CH-C O O NH 2
H
+
HO
-
R- CH-C O O NH 3
CHO OH OH OH CH 2 OH β
CHO CH 2 CH 2 OH H OH OH O H OH H H H H OH CH 2 OH H OH
OH
β
D
β D 2 脱氧呋 脱氧呋喃核糖 -D-2-脱氧呋喃核糖
2
2. 碱基 核苷酸中的碱基都是嘧啶或嘌呤的衍生物
CH 3 O N H NH O CH 3 HO N N OH
RNA 酸 单 体 中 的 核 苷中 的 核 苷 酸 单 体 RNA中的核苷酸单体
DNA 中 的 核 苷 酸 单 体 酸 单 DNA 中 的 核 DNA中的核苷酸单体苷
二、核酸的结构
1
N O O P OH H O O P OH H O O P OH O O O CH2 O H H H OH CH2 O H N
T(胸腺嘧啶)
N HO N OH
NH O N H O
U(脲嘧啶)
NH 2 N N H O
NH 2 N N OH
C(胞嘧啶)
NH 2 N N N N H
蛋白质和核酸在化学组成上的异同

蛋白质和核酸在化学组成上的异同蛋白质和核酸是生命体内重要的生物大分子,它们在化学组成上有着一些共同之处,但也存在一些显著的差异。
本文将从化学组成的角度探讨蛋白质和核酸的异同。
一、蛋白质的化学组成蛋白质是由氨基酸组成的大分子。
氨基酸是一种含有氨基(-NH2)和羧基(-COOH)的有机化合物。
常见的氨基酸有20种,它们在侧链(R基团)的结构上存在差异,从而赋予蛋白质不同的性质和功能。
二、核酸的化学组成核酸是由核苷酸组成的生物大分子。
核苷酸是由磷酸、五碳糖和氮碱基组成的。
常见的核苷酸有腺苷酸、鸟苷酸、胸苷酸和尿苷酸等。
其中,核苷酸的五碳糖是脱氧核糖(DNA)或核糖(RNA),氮碱基包括腺嘌呤、胸腺嘧啶、鸟嘌呤和尿嘧啶等。
三、蛋白质和核酸的共同之处1. 化学元素组成:蛋白质和核酸都由碳、氢、氧和氮等元素组成,其中蛋白质中还含有硫元素。
2. 功能:蛋白质和核酸都在生物体内扮演着重要的功能角色。
蛋白质参与构建细胞结构、催化生物化学反应、传递信号等;核酸则负责存储遗传信息、传递遗传信息和参与蛋白质合成等。
四、蛋白质和核酸的差异1. 化学组成:蛋白质的基本单位是氨基酸,而核酸的基本单位是核苷酸。
蛋白质中的氨基酸通过肽键连接形成多肽链,而核酸中的核苷酸通过磷酸二酯键连接形成聚合物。
2. 氨基酸和核苷酸的结构:氨基酸的结构包括氨基、羧基和侧链,而核苷酸的结构包括磷酸、五碳糖和氮碱基。
氨基酸的侧链结构多样,决定了蛋白质的特性和功能;而核苷酸的氮碱基决定了核酸的特性和功能。
3. 功能:蛋白质主要参与细胞结构和功能的建立,如构建细胞膜、骨骼、肌肉等,还能催化生物化学反应、传递信号等。
而核酸主要负责存储和传递遗传信息,参与蛋白质的合成。
4. 物理性质:蛋白质通常为无色或白色固体,可溶于水和一些有机溶剂,具有各种生物活性。
核酸一般为白色固体,可溶于水,具有较高的熔点。
总结起来,蛋白质和核酸在化学组成上有所不同。
蛋白质的基本单位是氨基酸,而核酸的基本单位是核苷酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
RCHCOOH NH2
特性 碱性
酸性
12
1) 羧基的反应
α-氨基酸分子中的羧基有典型的羧基性质
PCl5 -POCl3 RCHCOOH NH2 PhCH2OH -H2O -HCl RCHCOCl NH2
RCHCOOCH2Ph NH2
应用:
上面一个反应在肽的合成中用来活化羧基, 下面一个反应在肽的合成中用来保护羧基。
NH2
6
3.命名
天然氨基酸常使用俗名(根据来源或性质)
例如微具甜味的称为甘氨酸H2NCH2COOH; 最初从蚕丝中得到的氨基酸叫丝氨酸
HOCH2CH(NH2)COOH
系统命名法命名将氨基作为羧酸的取代基命名
CH3CHCH2CHCOOH CH3 NH2
4-甲基-2-氨基戊酸 (俗名 亮氨酸)
HOOCCH2CH2CHCOOH NH2
有较大亲合力的有机溶剂时,都能使蛋白质从水溶液
中沉淀出来。
30
4.蛋白质的变性
当蛋白质受到物理或化学因素影响时,可使蛋白质二、三级结构的结 合力遭受破坏,肽链松散,导致蛋白质在理化和生物性质上的改变,这种现 象称为蛋白质的变性。 蛋白质变性的表现主要是溶解度降低,粘度变大,难以结晶,容易为酶 所水解,丧失生物活性,等等。
蓝紫色
这是检验氨基酸的灵敏方法。与水合茚三酮反应,脯(fǓ) 氨酸或羟脯氨酸显黄色。 在生化实验中,常常用纸层析、柱层析或薄层层析法分离
氨基酸,当氨基酸分开后,总是利用水合茚三酮的显色来定性 或定量测定各种氨基酸。
19
20.2
一、多肽的结构和命名
多肽
一分子α-氨基酸的氨基和另一分子α-氨基酸的羧基之间 缩合脱水所生成的酰胺化合物称为肽(peptide)。
甘氨酰丙氨酸
丙氨酰甘氨酸
21
肽的命名是从N-端开始,由左至右依次将每个氨基 酸单位写成“某氨酰”,最后一个氨基酸单位的羧基 是完整的,写为“某氨酸”。
O H2N H C CH3 丙氨酰-甘氨酰-苯丙氨酸 C NH CH2 O C NH H C O C OH
CH2C6H5
22
20.3 蛋白质
蛋白质(proteins)存在于细胞中,是分子量很大
24
(2) 球蛋白
如蛋清蛋白、酪(lào)蛋白、胰岛素、酶等
它们的分子折叠,卷曲成球形或椭 圆形,一般能溶于水。
25
2. 根据蛋白质的化学组成分类
(1) 单纯蛋白
仅由氨基酸单位组成的蛋白质。如 球蛋白、谷蛋白等。
(2) 结合蛋白质26
一般来说,蛋白质在变性初期,分子构象未遭到深度破坏(只破坏三级 结构,而二级结构未变),那么还有可能恢复原来的结构和性质,即这种 变性是可逆的。
如变性过度,就会成为不可逆变性,这时二级结构也遭受破坏,无法恢 复。
31
蛋白质的变性,在现实生活中,有时希望它发生, 例如医疗器皿用酒精消毒,或在高温、高压下蒸煮都 是为了使细菌蛋白质变性而被杀灭。 临床上急救重金属盐中毒时,可以给病人吃大 量乳品或鸡蛋清,使蛋白质在消化道中与汞盐结合 成为变性的不溶解物质,从而阻止有毒的汞离子吸 入体内。有时则需要避免变性,例如预防接种的疫 苗需贮存在冰箱中,以免温度过高,使蛋白质变性 而失去生物活性。
氨基酸在电场中不会移动,这时溶液的pH值称为该氨基酸的等电点(用pI 表示)。 等电点是每一种氨基酸的特定常数。 在等电点时,氨基酸在水中的溶解度最小,所以可利用不同氨基酸的等 电点来进行分离提纯。
中性氨基酸: pI:5.0~6.3 酸性氨基酸溶液:pH < 7 碱性氨基酸溶液: pH > 7
按辅基种类不同,结合蛋白质又可分为:
A.脂蛋白:单纯蛋白质与脂类结合。 B.糖蛋白:单纯蛋白质与糖类结合。 C.磷蛋白:单纯蛋白质与磷酸结合。 D.色蛋白:单纯蛋白质与有色化合物结合。 E.核蛋白:单纯蛋白质与核酸结合。 F.血红蛋白:单纯蛋白质与血红素结合。 G.金属蛋白:单纯蛋白质与金属离子结合。
2.分类:
(1)根据氨基和羧基的相对位置不同,又可分为 α、β、g或δ-氨基酸。
(2)根据分子中氨基和羧基的数目可将氨基酸分为: 中性氨基酸(氨基和羧基数目相等); 酸性氨基酸(羧基数目大于氨基数); 碱性氨基酸(氨基数目大于羧基数)。
2
组成蛋白质的几乎都是α-氨基酸
R CH COOH α-氨基酸 NH2
在自然界存在的α-氨基酸(亦称天然氨基酸) 目前已知的有一百多种,但组成蛋白质的氨基酸 仅二十多种(见表)。
3
蛋白质中的氨基酸RCH(NH2)COOH
R CH COOH α-氨基酸 NH2
*
*
xié
4
R CH COOH α-氨基酸
NH2
(味精:谷氨酸钠)
-氨基戊二酸
5
R CH COOH α-氨基酸
氨基酸构型的标记通常采用D,L-命名法;分子 中的手性碳原子则采用R,S-命名法。
COOH H2N C H CH3 L -苏氨酸 2S COOH H2N C H CH3 L-丙氨酸 2S
H C OH 3R
8
二、氨基酸的制法
为了经济、大量地生产氨基酸,需要用化学合 成法。合成氨基酸的主要方法有以下几种: (1) α-卤代酸的氨解
从化学上看,蛋白质是氨基酸的高聚物;氨基酸是构成蛋白质的
“基石”。因此要讨论蛋白质的结构和性质,首先要了解氨基酸。
核酸是生物遗传信息的携带者和传递者。
1
20.1 氨基酸(Amino acids)
一、氨基酸的结构,分类和命名
1.结构特点:分子中既含有氨基(-NH2),又含有羧基
(-COOH)的化合物叫氨基酸。
Br R C COOH + 2NH3 H H2O,25℃ 56% NH2 R C COOH + HBr H
在这种反应中,常常有仲、叔胺衍生物生成, 不易得到纯的产品。
在羧酸分子中,受羧基吸电子诱导效应的影响, -H具有一定的活性,在少 量红磷(或三卤化磷)存在下,羧酸分子中的-H被氯或溴原子取代,生成 卤代酸。(Hell-Volhard-Zelinsky反应)
O
H2O2
RC COOH NO 2
NH
H2O
(氧化)
2) 氨基的反应
HNO2 - N2 - H2O
NO2
RCHCOOH OH RCHCOOH HN NO2 RCHCOOH H NCOOCH2Ph NO2
①
RCHCOOH NH2
O 2N
F
②
-HF
(氯甲酸苄酯)
PhCH2OCOCl -HCl
③
反应①用来测定含伯氨基的氨基酸; 反应②可用于氨基酸的测定(显黄色); 反应③在合成肽的反应中用来保护氨基。
又可向强碱给出一个质子。
氨基酸偶极离子作为两性物质,既能从一个强酸接受一个质子,
RCHCOOH NH3
H+ OH
RCHCOONH3
OHH+
RCHCOONH2
正离子
在强酸溶液中 主要存在形式 向阴极移动
偶极离子
负离子
在强碱溶液中 主要存在形式 向阳极移动
17
(2)等电点
当溶液的pH值为某一数值时,负离子和正离子的浓度相等,净电荷为零,
9
(2)盖布瑞尔 (Gabrial)法
α-卤代酸酯和邻苯二甲酰亚胺钾反应,再经水解,可制得产
率、纯度较高的氨基酸。
O NK + CH2CO2C2H5 97% Cl O N CH2CO2C2H5 O
O
1)KOH,H2O 2)HCl,85%
CH2CO2H CO2H + + C2H5OH CO2H NH2
32
5.蛋白质的颜色反应
(1) 水合茚三酮反应
蛋白质与稀的水合茚三酮一起加热呈现 蓝色。该反应主要用于纸上层析。
(2) 缩二脲反应
蛋白质与硫酸铜碱性溶液反应,呈现紫色。 称为缩二脲反应(因缩二脲有这种颜色反应而 得名)。
33
(3) 蛋白质黄色反应
含有芳香族氨基酸,特别是酪氨酸,色氨 酸残基的蛋白质,遇浓硝酸后产生白色沉淀, 加热时沉淀变为黄色。所以称为蛋白黄反应。 这实际上就是芳香环上的硝化反应,生 成了黄色的硝基化合物。皮肤、指甲被硝酸 沾污后变黄就是这个道理。
2-氨基戊二酸
* (俗名 谷氨酸)
7
天然氨基酸,除甘氨酸外, α-碳原子都有手性, 具有旋光性,都是L-构型。氨基酸的构型是与乳酸相比 而确定的(也就是从甘油醛导出来的)。例如:
COOH H2N C H CH2OH L-丝氨酸 COOH H2N C H R L-α-氨基酸 CHO HO C H CH2OH L-甘油醛
pI: 2.8~3.2 pI: 7.6~10.6
用电泳技术分离氨基酸正是基于不同氨基酸具有不同等 电点的性质。 18
4)与水合茚三酮的反应
α-氨基酸与水合茚三酮在碱性溶液中加热,发生氧化、脱 氨、脱羧作用,最终生成蓝紫色物质。其反应过程为:
O OH OH O O NH2 + R CH COOH OH N O + RCHO + CO2 + 3H2O O
13
2) 氨基的反应
H
+
R CHCOOH NH 3
(成盐)
(与亚硝酸反应再水解)
H2CO
R
CHCOOH N(CH 2OH) 2
(与甲醛反应) (酰化)
R CHCOOH NH2
(CH3CO)2O R
CHCOOH HNC CH3
O2N F NO2
O
R CHCOOH
HN NO 2
(烃基化)
RC COOH
蛋白质在水溶液中形成的颗粒直径 在1〜100nm内,具有胶体性质。所以蛋 白质溶液不能通过半透膜(如玻璃纸等)
