献给初学者:手把手教你用 PS 做出漂亮的 WB 结果图
PhotoShop简单三步制作真实的给草坪喷上白色图案教程

PhotoShop简单三步制作真实的给草坪喷上白色图案教程
原先这是一个吧友的作品,那位吧友作品中我比较中意的是角线的效果,感觉非常的好,超出我的想象。
白漆喷在草坪上的效果简直是太真实了,美中不足的是ID和英文部分的表现力一般,没有惊人之处,
下面我制作的最终效果还是不尽人意。
大家将就吧~
效果图:
首先我百度了一张草坪的图片~
新建画布粘贴入草坪。
用画笔预设一个笔刷,新建一层画一个井字棋,我小时候的最爱~
ctrl+t自由变换一下,让这个井字棋符合草坪的透视角度~
双击井字棋进入图层样式的混合颜色带,在下一图层里按住alt键将半个黑色按钮往右边移动,
这时要你自己把握从草坪层反射上来的深色的度量,到哪里最舒服的时候就停手~
非常简单的几个步骤,完成!。
WB实验基本步骤

实验基本步骤提取细胞蛋白↓BCA定量↓制备蛋白胶(SDS-PAGE胶)↓蛋白样品变性↓电泳↓转膜↓封闭↓一抗↓TBST洗涤↓二抗↓TBST洗涤↓显影↓结果分析试剂配制1.PBS磷酸盐缓冲溶液1L磷酸二氢钾 0.24g磷酸氢二钠 1.44g氯化钠 8g氯化钾 0.2g加入500ml纯水,调PH=7.2定容至1L,高压蒸汽灭菌2.PBST(PBS+0.05%吐温-20)500mlPBS+0.25ml吐温-203.电转液500mlTris 1.5g甘氨酸 7.2g400ml水溶解加入100ml甲醇,置于4℃冰箱预冷4.电泳液(1X)10x稀释,50ml10x电泳液+450ml纯水5.TBS6.TBST(TBS+0.05%吐温-20)50mlTBS+450ml纯水+0.25ml吐温-207.封闭液TBST1X+5%奶粉40ml封闭液=40mlTBST+2g奶粉,40℃预热WB实验一、蛋白样品制备准备:一管细胞,PBS(4℃预冷),PMSF(100mM),移液枪(1000ul,10ul),1.5mlEP管2个,高速冷冻离心机4℃预冷1.于-20℃冰箱中取出一管细胞样品,吸去培养液2.加入1ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
用移液枪轻轻吹成悬浮液后4℃,8000r离心5min,然后弃去上清。
重复以上操作一次,共洗细胞两次以洗去培养液。
3.按1ml裂解液加10 μl PMSF(100 mM),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合。
)4.在样品中加入300ul含PMSF的裂解液,吹匀,于冰上裂解30 min,为使细胞充分裂解培养瓶要经常来回摇动。
5.裂解完后,于4℃下12000 rpm离心5 min。
7.将离心后的上清分装转移倒0.5 ml的离心管中放于-20℃保存。
二、蛋白含量的测定(BCA定量)准备:96孔板,移液枪(1000ul,10ul,200ul),BCA工作液(A+B),50mlEP管,1xPBS,BSA标准液1.将96孔板分好区域,若不够分则只做两个重复,(外围一圈的孔最好不用)2.算好孔数(总的)每孔加200ulBCA工作液(A+B),(A液:B液=50:1,一般配多些,如60孔,A液12000ul,B液240ul)3.将样品稀释到一定倍数才能定量,(10倍,20倍,30倍),每孔需要20ul样品(2ul样品+18ulPBS,即稀释10倍),做三个重复则需要60ul,一般配80ul4.配蛋白标准样品,将2mg/ml的蛋白标准溶液稀释至0.5mg/ml,若配200ul 的0.5mg/ml蛋白标准溶液则需要50ul的2mg/ml的蛋白标准溶液和150ul PBS溶液5.将稀释好的样品加入孔板中(标记的区域),接着标准品按0,1,2,4,8,12,16,20ul加到标号的区域,之后在加标准样品的孔内,将孔内溶液用PBS补足到20ul6.每孔加200ul配好的工作液,平行加,不能上下加,以减少误差7.将加好的96孔板放在37℃下孵育30分钟8.孵育完后,放在酶标仪轻微震荡3-10s,中速,吸光值595nm,进行比色测定,记录标准曲线及样品吸光值数据后,以蛋白含量(ml)为横坐标,吸光值为纵坐标作标准曲线。
WB实验操作流程

WB实验操作流程Western Blot实验操作指南Western Blot即蛋⽩质印迹法(免疫印迹试验),是分⼦⽣物学、⽣物化学和免疫遗传学中常⽤的⼀种实验⽅法。
其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或⽣物组织样品中的特定蛋⽩进⾏显影。
通过分析显影的位置和显影深度获得特定蛋⽩质在所分析的细胞或组织中表达情况的信息。
实验流程主要包括以下⼏个步骤:样品制备;SDS-PAGE凝胶电泳;转膜;封闭;免疫杂交;显影。
实验器材操作步骤样品制备准备进⾏western blot的样品可分为细胞、组织、免疫沉淀或亲和纯化后的蛋⽩等。
样品为蛋⽩溶液时不需要进⾏提取,⽽样品为细胞、组织或包埋组织等则需要根据样品的特性对其进⾏提取。
根据需求不同还可针对于细胞亚结构进⾏提取。
(1)以体外培养的贴壁细胞样本为例,对其进⾏总蛋⽩提取:1、倒掉培养液,并将瓶倒扣在吸⽔纸上使吸⽔纸吸⼲培养液(或将瓶直⽴放置⼀会⼉使残余培养液流到瓶底然后再⽤移液器将其吸⾛)。
2、每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
3、按1ml裂解液加10 µl PMSF(100mM),摇匀置于冰上。
(PMSF要摇匀⾄⽆结晶时才可与裂解液混合。
)4、每瓶细胞加400 µl含PMSF的裂解液,于冰上裂解30min,为使细胞充分裂解培养瓶要经常来回摇动。
5、裂解完后,⽤⼲净的刮棒将细胞刮于培养瓶的⼀侧(动作要快),然后⽤枪将细胞碎⽚和裂解液移⾄1.5ml离⼼管中。
(整个操作尽量在冰上进⾏。
)6、于4℃下12000rpm离⼼5min。
(提前开离⼼机预冷)7、将离⼼后的上清分装转移倒0.5min的离⼼管中放于-20℃保存。
(2)以哺乳动物组织样本为例,对其进⾏总蛋⽩提取:1. 将100 mg 组织剪切成⼩块,加⼊适量的冰冷PBS 洗涤两次后,4℃,700×g(3000 rpm) 离⼼3 min,弃上清。
WB简单流程

WB简单流程
1)PAGE胶的制备
根据目的蛋白的分子量选择不同的凝胶浓度,高分子量蛋白用低浓度胶,低分子量蛋白用高浓度胶分离。
2)上样及电泳
1. 上样
每孔上样量为10-30 μg蛋白,可以根据实验要求加大上样量。
根据蛋白定量结果取所需蛋白加入适量上样缓冲液,沸水浴10min后离心取上清上样。
2. 电泳
浓缩胶70V 30分钟,分离胶120V 90分钟,可以根据具体实验要求调整电压和时间。
当染料到达胶底部时切断电源,停止电泳,进行下一步转膜。
3)转膜
转印详细操作依据Trans-Blot Turbo RTA transfer kits在Trans-Blot Turbo TM转印系统中进行。
转印完成后,将NC膜或者PVDF膜,从暗盒中取出,进行下一步封闭。
4)膜的封闭及抗体孵育
1. 封闭:5%脱脂奶粉室温封闭1小时或4℃过夜。
2. 一抗:根据说明书稀释抗体,抗体加入封闭液中稀释到所需浓度,和膜室温孵育1小时或4 ℃孵育过夜。
3. 二抗:孵育一抗的膜用TBST洗涤3次,每次10min。
随后根据用量,按照适当比例稀释HRP标记的二抗,与膜室温孵育1h。
用TBST洗涤3次,每次10min。
5)显色:按照合适比例配置ECL后,使用BIO-RAD molecular image设置不同曝光时间,拍照并保存。
WB灰度值测定

Image J测到了WB条带灰度值关于用Image J量化westernblot条带灰度值,在网上一直盛传着两种操作方法,然鹅~小伙伴们却一直不确定到底哪种才是正确的测量灰度方法,甚至将灰度与光密度弄混淆。
今天咱们一起就这个机会学习下,请先看看你是用以下那种方法测量灰度值?以下是两种方法的具体操作。
方法一:1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先把条带摆正)2、把图片转化成灰度图片:Image→type→8—bit3、第一个矩形工具→选上所有条带4、analyze→Gels→select first lane→Gels→plot lanes(在这第四步也可以分开选取,如:框选第一个条带→analyze→Gels→select firstlane→将第一个框拖移到余下条带→Gels→select nextlane)5、选中直线工具,将开口波峰关闭6、选中魔棒工具(正数第七个),点击波峰,就得出所有area值。
方法二1、打开Image J软件→左上角file→Open 选择自己的条带图片(事先条带弄正)2、把图片转化成灰度图片:Image→type→8—bit3、扣除背景:Process→Subtract Background→50pixels 并勾选Light Background5、设定参数:Analyze→set measurement→勾选Area、Mean gray value、Min & max gray value、Integrated density6、Analyze→set scale→unit of length选项里改为pixels,确定6、图像分割。
Edit→Invert→选中椭圆圈(手残党首选)/不规则圆圈(心灵手巧党义无反顾),手动圈上单个条带7、Analyze→Measurement即得到Intden,重复6、7步就得到所有Intden值小伙伴们,你们是哪种方法呢?首先先把结论说出来,其实两者得出的area和Intden严格来说都不是灰度值,前者是面积而后者是光密度值,但用来量化WB条带都是OK的。
用imagej进行WB定量分析

ImagJ是一款简单的图像处理与分析软件,可以用来进行WB定量分析。
一、利用ImagJ对WB条带进行灰度分析1、File——》open 打开WB片子2、把图片转化成灰度图片image——》type——》8-bit3、消除背景影响process——》subtract background 选择50基本可以4、设置定量参数analyze——》set measurements,点击面积,平均密度和灰度值及Integrated Density5、设置单位analyze——》set scale ,在“unit of length”的方框里输入“pixels”6、把图片转换成亮带,Edit——》invert7、选择FreehandSelection,尽量把条带圈起来,点击键盘m,出来IntDen灰度值当测定完所有条带,选结果中的“Edit ”的“SelectAll”,然后复制数据“IntDen”到Excel表即可进行分析8、复制数据IntDen进行分析二、利用ImagJ对WB条带进行密度分析1、File——》open 打开WB片子2、如条带不正,需修正image——》transform——》rotate调节angle值,直到条带水平为止3、选中矩形选项,圈中第一个条带,然后 analyze——》gels——》select firstlane(快捷键ctrl+1),然后移动第一个条带上的矩形到第二个条带上,analyze——》gels——》select secondlane(快捷键 ctrl+2),最后analyze——》gels——》plotlanes4、选中直线工具,将开口的波峰关闭5、选中魔棒工具,点击波峰可以显示波峰下面积,即条带的密度值6、以第一个数值为基数,其他数值与第一个数值的比值为相对密度The protocol of imageJ for quantitative analysis of Western blotting:- open an image- transfer the image to 8-bitsimage → type: 8 bits- Process → substract background 50- analyze → set measurements: pick area, mean gray value, integrated density.- analyze → set scale, fill “unit of length” with “pixels”- switch the image to bright bandsedit → invert- freehand selection, choose the target area on the image (e.g. a band), type a “m” for measurement, then we get the result from a new window.- after measuring all of the bands, pick the “edit” of the result window. “select all”,copy the integrated density values to excel to analyze.The integrated density means that the area value multiplies the mean gray value. For Western blotting analysis the integrated density is very important, because the area and gray value both of them have meaning for Western blotting bands.温馨提示:最好仔细阅读后才下载使用,万分感谢!。
WB实验技术步骤
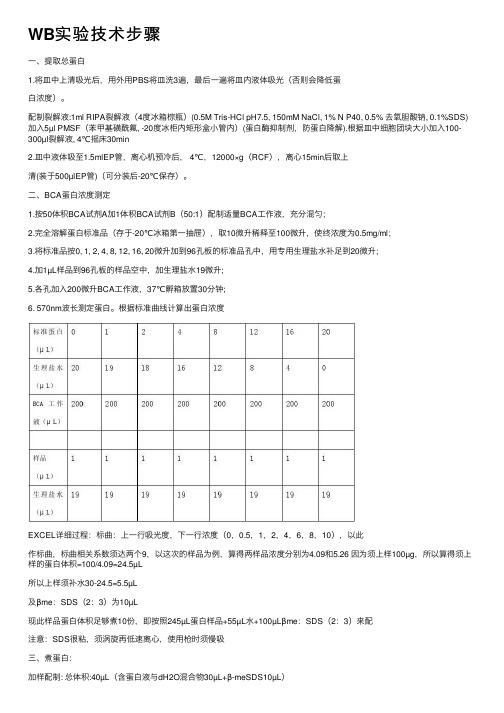
WB实验技术步骤⼀、提取总蛋⽩1.将⽫中上清吸光后,⽤外⽤PBS将⽫洗3遍,最后⼀遍将⽫内液体吸光(否则会降低蛋⽩浓度)。
配制裂解液:1ml RIPA裂解液(4度冰箱棕瓶)(0.5M Tris-HCl pH7.5, 150mM NaCl, 1% N P40, 0.5% 去氧胆酸钠, 0.1%SDS)加⼊5µl PMSF(苯甲基磺酰氟, -20度冰柜内矩形盒⼩管内)(蛋⽩酶抑制剂,防蛋⽩降解).根据⽫中细胞团块⼤⼩加⼊100-300µl裂解液, 4℃摇床30min2.⽫中液体吸⾄1.5mlEP管,离⼼机预冷后, 4℃,12000×g(RCF),离⼼15min后取上清(装于500µlEP管)(可分装后-20℃保存)。
⼆、BCA蛋⽩浓度测定1.按50体积BCA试剂A加1体积BCA试剂B(50:1)配制适量BCA⼯作液,充分混匀;2.完全溶解蛋⽩标准品(存于-20℃冰箱第⼀抽屉),取10微升稀释⾄100微升,使终浓度为0.5mg/ml;3.将标准品按0, 1, 2, 4, 8, 12, 16, 20微升加到96孔板的标准品孔中,⽤专⽤⽣理盐⽔补⾜到20微升;4.加1µL样品到96孔板的样品空中,加⽣理盐⽔19微升;5.各孔加⼊200微升BCA⼯作液,37℃孵箱放置30分钟;6. 570nm波长测定蛋⽩。
根据标准曲线计算出蛋⽩浓度EXCEL详细过程:标曲:上⼀⾏吸光度,下⼀⾏浓度(0,0.5,1,2,4,6,8,10),以此作标曲,标曲相关系数须达两个9,以这次的样品为例,算得两样品浓度分别为4.09和5.26 因为须上样100µg,所以算得须上样的蛋⽩体积=100/4.09=24.5µL所以上样须补⽔30-24.5=5.5µL及βme:SDS(2:3)为10µL现此样品蛋⽩体积⾜够煮10份,即按照245µL蛋⽩样品+55µL⽔+100µLβme:SDS(2:3)来配注意:SDS很粘,须涡旋再低速离⼼,使⽤枪时须慢吸三、煮蛋⽩:加样配制: 总体积:40µL(含蛋⽩液与dH2O混合物30µL+β-meSDS10µL)1.β-巯基⼄醇(β-me):6×SDS(2:3)样品缓冲液10µL2.蛋⽩取量取⼀组蛋⽩中,样品蛋⽩加的体积=蛋⽩浓度最低的浓度*30µL/每个样品浓度3.剩余的体积即30µL-样品蛋⽩加的体积,即为各管需补加⽔的体积4.多加⼀点防煮时蒸发部分混和后file22-start100℃煮沸5 min。
WB实验操作流程

Western Blot即蛋白质印迹法(免疫印迹试验),是分子生物学、生物化学和免疫遗传学中常用的一种实验方法。
其基本原理是通过特异性抗体对凝胶电泳处理过的细胞或生物组织样品中的特定蛋白进行显影。
通过分析显影的位置和显影深度获得特定蛋白质在所分析的细胞或组织中表达情况的信息。
实验流程主要包括以下几个步骤:样品制备;SDS-PAGE凝胶电泳;转膜;封闭;免疫杂交;显影。
实验器材操作步骤样品制备准备进行western blot的样品可分为细胞、组织、免疫沉淀或亲和纯化后的蛋白等。
样品为蛋白溶液时不需要进行提取,而样品为细胞、组织或包埋组织等则需要根据样品的特性对其进行提取。
根据需求不同还可针对于细胞亚结构进行提取。
(1)以体外培养的贴壁细胞样本为例,对其进行总蛋白提取:1、倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2、每瓶细胞加3ml 4℃预冷的PBS(0.01M pH7.2~7.3)。
平放轻轻摇动1min洗涤细胞,然后弃去洗液。
重复以上操作两次,共洗细胞三次以洗去培养液。
将PBS弃净后把培养瓶置于冰上。
3、按1ml裂解液加10 μl PMSF(100mM),摇匀置于冰上。
(PMSF要摇匀至无结晶时才可与裂解液混合。
)4、每瓶细胞加400 μl含PMSF的裂解液,于冰上裂解30min,为使细胞充分裂解培养瓶要经常来回摇动。
5、裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至1.5ml离心管中。
(整个操作尽量在冰上进行。
)6、于4℃下12000rpm离心5min。
(提前开离心机预冷)7、将离心后的上清分装转移倒0.5min的离心管中放于-20℃保存。
(2)以哺乳动物组织样本为例,对其进行总蛋白提取:1. 将100 mg 组织剪切成小块,加入适量的冰冷PBS 洗涤两次后,4℃,700×g(3000 rpm) 离心3 min,弃上清。
真实刺绣PS高级技巧教你制作刺绣文字

真实刺绣PS高级技巧教你制作刺绣文字刺绣是一种传统工艺,通过在织物上使用不同的线线绣成图案或文字。
而随着数字技术的发展,刺绣也可以在电脑中进行设计和编辑。
PS(Photoshop)作为一款强大的图像处理软件,也可以用来制作真实的刺绣效果。
本文将介绍一些PS的高级技巧,帮助你制作出真实的刺绣文字。
一、准备工作在开始制作刺绣文字之前,首先需要准备一些基本的素材。
这包括一张要刺绣的图像或文字,一些适合刺绣效果的刷子和纹理。
你可以在互联网上搜索和下载一些免费的刺绣刷子和纹理。
二、制作刺绣效果1. 创建新的工作文件打开PS软件,点击“文件”-“新建”来创建一个新的工作文件。
根据需要设置文件的大小和分辨率。
2. 导入图像或文字将你要刺绣的图像或文字导入到PS中。
你可以通过点击“文件”-“打开”来导入图像文件,或者通过“文本工具”在工作文件中输入文字。
3. 添加刺绣效果选择“图像”-“调整”-“色相/饱和度”,调整图像或文字的色相和饱和度,使其看起来更像真实的刺绣。
4. 使用刺绣刷子选择“画笔工具”,在“画笔”选项中选择一个适合的刺绣刷子。
调整画笔的大小和硬度,开始在图像或文字上绘制刺绣效果。
可以使用不同的颜色和纹理来制作多样化的刺绣效果。
5. 创建刺绣线条选择“形状工具”,在“形状”选项中选择一个适合的线条形状。
在图像或文字上绘制线条,用以模拟刺绣的线线。
可以根据需要调整线条的颜色和粗细。
6. 添加阴影和光照效果使用“筛选器”-“渲染”-“光照效果”来添加阴影和光照效果,使刺绣看起来更真实。
三、其他技巧和注意事项1. 调整图层顺序在PS中,可以通过拖拽图层来调整图层的顺序。
在制作刺绣文字时,可以将纹理图层放在最上方,然后使用“刻划工具”或“橡皮擦工具”擦除纹理图层,以便在文字上显示出刺绣的效果。
2. 使用滤镜PS中有很多滤镜效果可以用来增强刺绣的真实感。
例如,可以使用“滤镜”-“噪点”-“添加噪点”来添加一些噪点效果;可以使用“滤镜”-“扭曲”-“风”来模拟风吹拂时刺绣的效果等等。
PS图像处理实验分析报告

PS图像处理实验报告————————————————————————————————作者:————————————————————————————————日期:实验报告(理工类)2011 至2012学年度第 1 学期课程名称系别班级学号姓名授课教师指导教师实验项目一:奥运五环制作、三基色调制同组者:填写日期:实验日期:一、实验主要内容1、利用PS软件来制作一个奥运五环,并通过一些细则步骤来完善。
2、制作三基色的调制图二、实验目的1、利用PS软件来制作奥运五环和三基色调制2、通过制作过程,来了解,对于一般标志性图像的制作步骤3、学会运用PS软件制作相关标志图三、实验具体操作过程(可以附算法)(一)奥运五环的制作1、新建文件(命名为奥运五环,宽度600像素,高度480像素)2、选择工具箱里的椭圆工具,画一个圆,在复制粘贴此圆(ctrl+c.v)3、(ctrl+t 选择变换途径)新复制的圆缩小为80%,选择新复制圆,路径选择工具(A)从形状区域减去得到一个环(环颜色填充为蓝色),后同样方法,在制作四环。
4、将五环依次排开(蓝、黄、黑、绿、紫),选择这五个涂层右键图层链接,后点击水平居中分布,在取消图层链接,后选择黄色、绿色环下拉,构成五环形状。
5、选择蓝色图层,点击工具箱途径选择工具,右击蓝色图层建立区域再确定,后反向(或者采用菜单栏的反向或ctrl+shift+i),选择黄色图层,添加图层蒙版,在把前后景色设置为白和黑,运用画笔工具轻轻绘一下,蓝色和黄色左下角交接的地方,这时两环已经连套在一起了。
后以相同的方法,依次将剩余个环,相套即可!(二)三基色的调制1、打开PS页面新建一个蒙板,图像大小根据个人需要进行选定,制作三原色图建议建立一个正方形蒙板。
2、在蒙板左上方选择椭圆选框工具在新建的蒙板上作一个如下图的圆圈;并在页面的右下方点击“创建新的填充或调整图层”,选择填充——红色后点击“确定”。
此时已完成了一个实心红圈的制作过程。
用PS和AI让你的Westernblot结果更漂亮
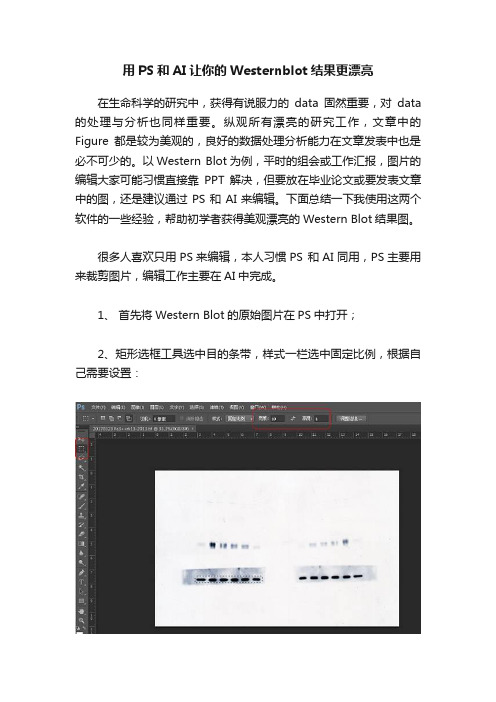
用PS和AI让你的Westernblot结果更漂亮在生命科学的研究中,获得有说服力的data固然重要,对data 的处理与分析也同样重要。
纵观所有漂亮的研究工作,文章中的Figure都是较为美观的,良好的数据处理分析能力在文章发表中也是必不可少的。
以Western Blot为例,平时的组会或工作汇报,图片的编辑大家可能习惯直接靠PPT解决,但要放在毕业论文或要发表文章中的图,还是建议通过PS和AI来编辑。
下面总结一下我使用这两个软件的一些经验,帮助初学者获得美观漂亮的Western Blot结果图。
很多人喜欢只用PS来编辑,本人习惯PS 和AI同用,PS主要用来裁剪图片,编辑工作主要在AI中完成。
1、首先将Western Blot的原始图片在PS中打开;2、矩形选框工具选中目的条带,样式一栏选中固定比例,根据自己需要设置:3、然后点击裁剪选项,4、点击图像→图像大小调整到目的大小5、确定后保存(文件→存储为)。
6、这样,PS部分就完成了。
如果泳道倾斜或歪曲,可以通过旋转后再裁剪来纠正(点击裁剪选项后利用拉直工具来旋转),其余同上。
如下:7、打开AI软件,文件→新建→图稿和插图→选择A4纸→方向选择纵向→创建。
如下:8、文件→置入,选择PS 裁剪好的图片(注意:这里一定要通过置入方式导入图片,不可通过复制粘贴完成),较老版本AI一次只能置入一张图片,2017最新版本可以一次置入多张图片。
如下:9、图片置入后就可以开始编辑,本人习惯先加边框,根据个人习惯和要求自己决定是否加边框上去。
选择矩形工具进行加边框→框选目的图片→选择黑色→再选择无填充色,就可以加上边框。
如下:10、边框的宽度也可以进行调整,大家可以根据自己的需要或杂志要求进行修改,本人习惯用1pt或0.75 pt;11、加边框后,开始添加其他注解,选择文本工具添加文字,选中所有文本后点击对齐→对齐关键对象→不同对齐方式。
如下:12、其他文字注解插入方法也相同,文本大小、字体在选中后点击文字→选择大小或字体进行修改,根据要求选择合适大小和字体。
如何用PS软件处理wb的电泳条带并分析条带的灰度
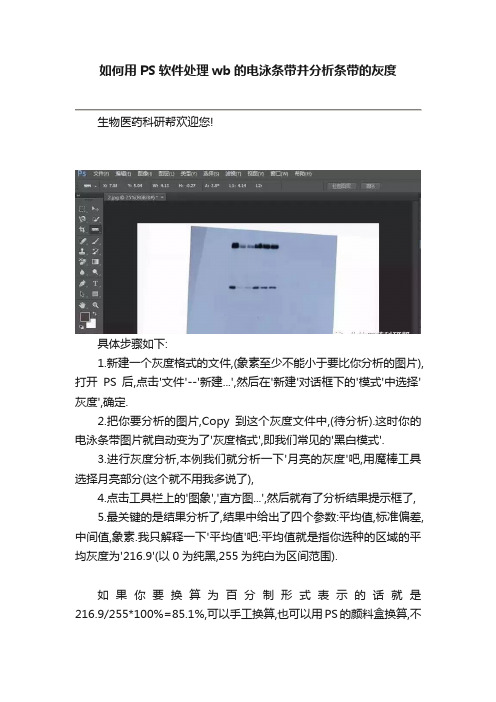
如何用PS软件处理wb的电泳条带并分析条带的灰度
生物医药科研帮欢迎您!
具体步骤如下:
1.新建一个灰度格式的文件,(象素至少不能小于要比你分析的图片),打开PS后,点击'文件'--'新建...',然后在'新建'对话框下的'模式'中选择'灰度',确定.
2.把你要分析的图片,Copy到这个灰度文件中,(待分析).这时你的电泳条带图片就自动变为了'灰度格式',即我们常见的'黑白模式'.
3.进行灰度分析,本例我们就分析一下'月亮的灰度'吧,用魔棒工具选择月亮部分(这个就不用我多说了),
4.点击工具栏上的'图象','直方图...',然后就有了分析结果提示框了,
5.最关键的是结果分析了,结果中给出了四个参数:平均值,标准偏差,中间值,象素.我只解释一下'平均值'吧:平均值就是指你选种的区域的平均灰度为'21
6.9'(以0为纯黑,255为纯白为区间范围).
如果你要换算为百分制形式表示的话就是216.9/255*100%=85.1%,可以手工换算,也可以用PS的颜料盒换算,不
过手工算挺方便的.
如果你的选择区域灰度比较均一的话,你的分析结果的'均值'和'中间值'应该比较接近的.以及那个'直方图''标准偏差'都是数理统计上的概念,在此不罗嗦了.
注意:保存为两种格式,一中为*.PSD 便于再次用PS 处理图片,一种为 TIFF,去除图层,用于发表文章。
WB操作步骤及经验

1、丙烯酰胺和N,N’-亚甲双丙烯酰胺,应以温热(以利于溶解双丙稀酰胺)的去离子水配制含有29%(w/v)丙稀酰胺和1%(w/v)N,N’-亚甲双丙烯酰胺储存液丙稀酰胺29g,N,N-亚甲叉双丙稀酰胺1g,加H2O 至100ml。
)储于棕色瓶,4℃避光保存。
严格核实PH不得超过7.0,因可以发生脱氨基反应是光催化或碱催化的。
使用期不得超过两个月,隔几个月须重新配制。
如有沉淀,可以过滤。
2、十二烷基硫酸钠SDS溶液:10%(w/v)0.1gSDS,1mlH2O去离子水配制,室温保存。
3、分离胶缓冲液:1.5mmol/L Tris-HCL(pH8.8):18.15gTris和48ml1mol/LHCL混合,加水稀释到100ml终体积。
过滤后4°C保存。
4、浓缩胶缓冲液:0.5mmol/LTris-HCL(pH6.8):6.05gTris溶于40mlH2O中,用约48ml 1mol/L HCL调至pH6.8加水稀释到100ml终体积。
过滤后4°C保存。
这两种缓冲液必须使用Tris碱制备,再用HCL 调节PH值,而不用Tris.CL。
5、TEMED原溶液四甲基乙二胺催化过硫酸铵形成自由基而加速两种丙稀酰胺的聚合。
PH太低时,聚合反应受到抑制。
AP提供两种丙稀酰胺聚合所必须的自由基。
去离子水配制数ml,临用前配制.6. 10%过硫酸铵溶液:称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,冻存。
7、SDS-PAGE加样缓冲液:在沸水终煮3min混匀后再上样,一般为20-25ul,总蛋白量100μg。
8、 Tris-甘氨酸电泳缓冲液:30.3gTris,188g甘氨酸,10gSDS,用蒸馏水溶解至1000ml,临用前稀释10倍。
PH8.39、转移缓冲液:2.9g甘氨酸、5.8gTris碱、0.37g SDS(可不加),200ml甲醇(临用前加),加水至总量1L。
WB操作步骤-自己整理

WB操作步骤-⾃⼰整理Western Blot 相关实验⽅法与试剂(湿转法)⼈⼯肝实验室学习姚瑶(⼀)⽬的蛋⽩提取:(1)单层贴壁细胞总蛋⽩的提取:1、倒掉细胞培养液,加⼊Hanks液洗涤⼀次后倒掉,根据所⽤细胞决定是否⽤胰酶消化,加⼊适量(约5ml)新鲜细胞培养液后,将贴壁细胞吹起,并转移⾄4⽀离⼼管内,配平后,1500转离⼼10min。
2、倒掉上清,⽤4度预冷PBS溶液洗涤沉淀,1500转离⼼10min。
共洗三次,每次⼗分钟。
3、倒掉上清,吸净,每管加⼊50ul 细胞裂解液RIPA,吹散,加⼊后由于DNA的释放可迅速变粘稠,故应尽快转移⾄1.5ml EP 管内,-20℃裂解30min。
4、超声波细胞裂解仪上将各管裂解15s。
(可不做)5、4℃,12000转离⼼10min。
6、将上清转移⾄0.5ml EP管中,每管100ul,冰浴待⽤。
(2)组织中总蛋⽩的提取:1、取约100mg肝组织于研磨器内,加⼊500ul 细胞裂解液RIPA,研磨后吸出于1.5ml EP管内,再加⼊500ul RIPA,研磨后吸出于上EP管内。
冰上裂解30min。
2、配平后,4℃,14000转离⼼10min。
3、将上清分装于0.5ml EP管内,每管100ul,冰浴待⽤(⼆)蛋⽩含量的测定:1、稀释标准品:10ul标准品C液+90ul PBS溶液,混匀。
2、按0、1、2、4、8、12、16、20ul将稀释后的标准品加⼊于96孔板内,并⽤PBS将各孔补⾜20ul。
3、将第2、3排96孔板分别加⼊样品1ul、0.5ul,(可采⽤倍⽐稀释法),并⽤PBS将各孔补⾜20ul。
4、配制⼯作液:按A液:B液=50:1配制适量⼯作液,每孔加⼊200ul。
5、37℃⽔浴30min。
6、酶标仪测定各孔OD值(A570,Mode1)。
7、绘制标准曲线,计算样品蛋⽩浓度。
(三)SDS-PAGE电泳:(1)清洗玻璃板(2)灌胶与上样:1、配胶:根据⽬的蛋⽩的⼤⼩,决定分离胶的浓度。
WB方法经验总结

WB经验总结来源于丁香园论坛,由张慧慧(长沙湘雅附二)推荐来dxy好多年了,这些年陆陆续续回复了一些帖子,可是回来回去,发现大家提的问题,还是那么几个,没有从根本上有所提高,确实出乎意料。
看过很多总结经验的帖子,不知道该如何评价,要么抄书本,要么人云亦云,缺乏自己的东西,新手参考这些当然难获进益。
实在受不了,这些混淆视听的东西,本人把这么多年的回复,略作整理完善拼凑成《WB实战指南》,欢迎行家批评指正。
首先,摆摆自己的经验。
鄙人做WB有8、9年了,平均下来两天跑一张多的蛋白胶;文章嘛,凑数的单篇有上24+,一作单篇15+(系国内完成;注:当年的IF,现在逐年递减没个标准)。
其次,由于一些机缘的因素,在实验室WB体系完善的过程中,很多靠自己摸索;说实话,碰了一鼻子灰,差不多能碰到的问题都经历了,因此我敢写这样一个咚咚给大家分享。
再次,我再强调一点,对我们这类人来说,实验结果的可靠、漂亮已经不算一个要求;如何缩短操作时间,使实验进行的更有效率也是我们所追求的,因此本文会针对两个普遍采用的却可以看成浪费时间的操作,Bradford法蛋白定量和立春红染膜做专门批判,这在以前的WB操作指南是绝无的,甚至叛离被视为经典的分子克隆。
——可是,请记住,经典是人定的。
话不多废,开始:样品制备:变性条件——SDS LB直接裂解:用常温或者高温预热过(预热更有利于阻止蛋白水解或者磷酸酶去磷酸化,但容易遗忘,LB久煮某些性质会改变)的1*SDS LB(或者略高1.5*)直接加到细胞或者组织上并煮样。
通常6孔板细胞80%以上密度,需200ul,其他按平板面积比类推。
通常条件下,SDS LB都是过量的(因此不一定要严格参考SDS LB稀释比);如果SDS LB不够,样品核酸、蛋白浓度过高时,煮样后会发现tip吸不上来,非常粘、一砣一砣的,很容易堵住tip。
这时候常规做法有两种,1. 再煮5min。
常规煮样时间3-5min,样品过浓时就煮10min;2.如果10min煮样后,仍然吸不起来,才适当增加SDS LB,继续煮;也可以对样品进行超声。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
献给初学者:手把手教你用PS 做出漂亮的WB 结果图
打开PS,新建画布(国际标准纸张)。
将WB 曝光原图拖入到画布中,使用参考线将条带摆正。
矩形选区选择想要的条带,cltr 单击拖动到另一个新建的空白画布中。
如下。
做好参考线,将各条带对齐。
截取相同大小的目的图片:使用矩形选区工具,挑取最小的那张图,在右下角的图层区选择其图片区域,右击「选择像素」,移动该选区到想留取的图片上(将该矩形选区框住想留下来的图片部分),图层要选择在目的图片图层,右击「选择反向」,这时候有两个矩形选区框,一大一下,在按「delete」, 图片多余部分被清除。
描边:选择目标图片,编辑——描边,参数如下。
添加文字,对齐。
裁剪画布。
保存为两种格式,一中为*.PSD 便于再次用PS 处理图片,一种为TIFF,去除图层,用于发表文章。
是不是很easy 啊,赶紧操作一下吧。
WB 相关文章献给初学者:western blot 操作步骤详解(上)献给初学者:western blot 操作步骤详解(下)献给初学者:WB 也有基本套路(送视频)如何做出高分优质的Western blot 图片?穷人的劳斯莱斯—五年western blot 体会Western blot 实验心得step by stepwestern blot 之歌如何解决ECL WB 非特异条带与背景问题没有人能随随便便WB 成功磷酸化蛋白WB 有点难?实验达人送你13 招作
者:moke琴。
