2015年版《中国药典》含片溶化性检查方法调整的回顾
浅谈2015年版中国药典的重点变更-PDF (简)

2015 年版药典收载品种总数约为 5515 个,増幅达到 26.2%。
2010 版药
2015 年版药典
类别
典收载 总收载品种 新增品种 修订品种
中药
2165
化药
2139
药用辅料
132
生物制品
品种 通则、总论
131 10
小计
4567
通则(附录)
---
指导原则
---
2627 2617 约 271 145 14 约 5515 321 31
约 462 约 500
139 14 4 约 1201 29 15
约 400 149 132 62 8
约 751 145 8
不收载 品种
2 5 --6 --13 -----
4. 2015 年版药典的部份增加及修订的项目: 附录是药典的重要部份,药典的灵魂和水平均集中反映在附录中。本版是将三部 药典的附录合一,加强共性的系统化、完善化及规范化,新版 <中国药典> 的附 录调整为凡例、通则与方法、指导原则、药用辅料等单独成卷,为第四部。把以 往各部药典附录里相同的方法之间的归纳统一作为本版药典的工作重点,同时, 亦解决长期以来各部药典之间相同方法/通则要求不统一的问题。再且,附录对 药典以外的其他国家标准具同等法律效力。
4.6 二氧化硫残留的限制 通则里说明,除另有规定外,中药材及饮片(矿物类除外)的二氧化硫残留量不得 超过 150mg/kg (ppm)。
正文品种说明山药、牛膝、粉葛、天冬、天麻、天花粉、白及、白芍、白朮、党 参 10 味药材及其饮片二氧化硫残留量不得超过 400mg/kg(ppm)。
新版药典锐意加强科学监管,防止中药材加工过程中滥用或过度使用硫磺熏蒸,
2015与2020年版药典的变化

2015与2020年版药典的变化下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!药典是指用于规范和指导药品研制、生产、质量控制和使用的权威性标准。
2015版药典通则变化总结

黏度测定法
10版:每次测定值与平均值的差值不得超过平均值的±5%。 15 版:“每次测定值与平均值的差值不得超过平均值的 ±0.25%”
铅、镉、砷、汞、铜测定法
10 版:“其中以 72 Ge 作为内标, 114 Cd 以 115 In 作为内标, 202Hg、208Pb 以209Bi作为内标,” 15版:“其中63Cu、75As以72Ge作为内标,114 Cd 以115In作 为内标,2Байду номын сангаас2Hg、208Pb以209Bi作为内标,”
10版:为增加稳定性、掩盖药物不良臭味、改善片剂外观 等,可对制成的药片包糖衣或薄膜衣。对一些遇胃液易破 坏、刺激胃黏膜或需要在肠道内释放的口服药片,可包肠 溶衣。必要时,薄膜包衣片剂应检查残留溶剂。 15版:为增加稳定性、掩盖原料药物不良臭味、改善片剂 外观等,可对制成的药片包糖衣或薄膜衣。对一些遇胃液 易破坏、刺激胃黏膜或需要在肠道内释放的口服药片,可 包肠溶衣。必要时,薄膜包衣片剂应检查残留溶剂。
10 版:胶囊剂应整洁,不得有粘结、变形、渗漏 或囊壳破裂现象,并应无异臭。 15 版:胶囊剂应整洁,不得有黏结、变形、渗漏 或囊壳破裂现象,并应无异臭。 10版:除另有规定外胶囊剂应密封贮存。 15 版:除另有规定外,胶囊剂应密封贮存,其存 放环境温度不高于 30 ℃,湿度应适宜,防止受潮、 发霉、变质。生物制品原液、半成品和成品的生 产及质量控制应符合相关品种要求。
旋光度检查法
10版:“偏振光透过长1dm且每1ml中含有旋光性物质1g的溶液,在一 定波长与温度下测得的旋光度称为比旋度。测定比旋度(或旋光度) 可以区别或检查某些药品的纯杂程度,亦可用以测定含量。” 15版:“在一定波长与温度下,偏振光透过每1ml含有1g旋光物质的溶 液且光路为长1dm时,测得的旋光度称为比旋度。比旋度(或旋光度) 可以鉴别或检查光学活性药品的纯杂程度,亦可用以测定光学活性药 品的含量。” 15版:增加 3.1“旋光度的测定一般应在溶液配制后 30分钟内进行测 定。”
2015版中国药典溶出度测定方法

我国药典(Chinese Pharmacopoeia, CP)作为我国药品质量标准的最高法规文件,不仅对药品的质量标准进行了规定,而且对于药品的质量控制和检验方法也有着详细的规定。
2015版我国药典是我国目前最新的一部药典,它包含了大量的药物质量标准和检验方法,在医药行业具有非常重要的地位。
溶出度测定方法作为药品质量控制中的一个重要环节,被广泛应用于固体制剂的质量控制和药效学研究中。
2015版我国药典对溶出度测定方法作出了规定,主要是针对固体制剂和胶囊剂的溶出度测定进行了详细的规定和说明,并且针对不同类型的药品给出了相应的实验方法。
下面,笔者将从2015版我国药典对溶出度测定方法的规定和要求、方法的操作流程和步骤、常见的注意事项和影响因素、溶出度测定方法的应用及展望等几个方面来进行详细的介绍和分析。
一、2015版我国药典对溶出度测定方法的规定和要求2015版我国药典对溶出度测定方法的要求主要包括以下几个方面:(1)药品的类型和适用范围:对不同类型的固体制剂如片剂、胶囊剂、缓释片剂等给出了相应的测定方法,并且对于不同类型的药品提出了相应的适用范围和操作要点。
(2)试剂和仪器设备:对于药品溶出度测定中所需使用的试剂和仪器设备进行了详细的规定,包括试剂的纯度要求、仪器设备的品牌和型号要求、设备的校准和验证等。
(3)测定方法和操作步骤:对不同类型药品的溶出度测定方法进行了具体的规定和说明,包括操作步骤、测定条件、数据处理方法和结果表述等。
(4)质量控制和验证:对溶出度测定方法中的质量控制和验证进行了详细的规定,包括对试剂的质量控制、仪器设备的验证、方法的准确性和精密度的验证等。
通过对2015版我国药典对溶出度测定方法的规定和要求进行了解,可以清晰地了解药品溶出度测定的操作步骤和要点,并且对于不同类型的药品有着具体的适用范围和操作要求,为药品的溶出度测定提供了明确的指导。
二、溶出度测定方法的操作流程和步骤药品溶出度测定方法的操作流程和步骤主要包括以下几个方面:(1)样品的准备:将固体制剂或胶囊剂样品按照规定的要求进行准备,包括去除封衣、研磨、称取样品等。
片剂脆碎度通则-2015药典

筛 分 法 一 般 分 为 手 动 筛 分 法 、机械筛分法与空气喷射
筛 分 法 。手动筛分法和机械筛分法适用于测定大部分粒径 大 于 7 5 p m 的 样 品 。对 于 粒 径 小 于 75/^111的 样 品 ,则应采
用空气喷射筛分法或其他适宜的方法。
机 械 筛 分 法 系 采 用 机 械 方 法 或 电 磁 方 法,产生垂直振 动 、水平圆周运 动、拍 打 、拍 打 与 水 平圆周运 动 相结 合等
1. 手动筛分法 (1) 单 筛 分 法 称 取 各 品 种 项 下 规 定 的 供 试 品 ,置规
定 号 的 药 筛 中 (筛 下 配 有 密 合 的 接 收 容 器 ),筛 上 加 盖 。 按 水 平 方 向 旋 转 振 摇 至 少 3 分 钟 ,并不时在垂直方向轻叩
筛 。取 筛 下 的 颗 粒 及 粉 末 ,称 定 重 量 ,计 算 其 所 占 比
标示装量 以上
不少于 标示装量 的 97%
不少于 标示装量
不少于标示 装 量 的 97%
【附 注 】 对 于 以 容 量 计 的 小 规 格 标 示 装 量 制 剂 ,可改 用重量法或按品种项下的规定方法检查。
平 均 装 量 与 每 个 容 器 装 量 (按 标 示 装 量 计 算 百 分 率 ), 取三位有效数字进行结果判断。
片 全 部 视 野 ,应 无 凝 聚 现 象 ,并不得检出该剂型或各品种 项 下 规 定 的 5 0 p m 及 以 上 的 粒 子 。再 在 200〜 50 0 倍的显
微镜下检视该剂型或各品种项下规定的视野内的总粒数及
规 定 大 小 的 粒 数 ,并 计 算 其 所 占 比 例 (% ) 。 第 二 法 (筛 分 法 >
分 钟 。取不能通过大孔径筛和能通过小孔径筛的颗粒及粉
《中国药典》2015年版中药材增修订内容
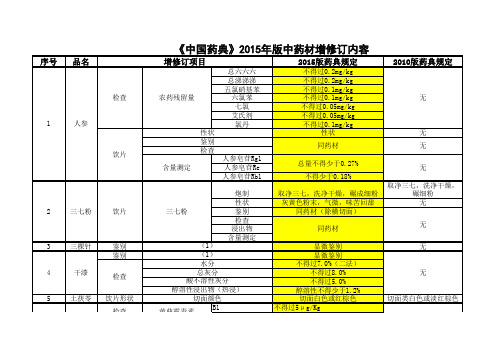
取净大黄片,照炒炭法 炒至表面焦黑色,内部 焦褐色
10 11 12
山银花 山楂 千金子
13
川木香 饮片
煨川木香
无
14 15 16 17 18 19 20 21
川贝母 川芎 广金钱草 女贞子 马兜铃 天仙子 天冬 天花粉
鉴别 性状 饮片 鉴别 鉴别 鉴别 鉴别 检查 饮片 检查 饮片
(2) (3) 表面颜色 表面颜色 (1) (1) (1) (1) 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 二氧化硫残留量 (1)
鉴别 22 天竺黄
(2) (3)
检查 性状 鉴别 检查 23 天麻 浸出物 含量测定 饮片
体积比 表面颜色 (3) 二氧化硫残留量 醇溶性浸出物 天麻素 对羟基苯甲醇 性状
贝母素乙及贝母辛 无 表面黄褐色 外表皮黄褐色 无 无 无 无 无 无 无 无 (1)溶媒为盐酸与硝酸 (1)溶媒为醋酸2滴,显色剂一滴 的等混合液,显色剂无 变化 (2)显色反应 (2)显示反应 增加天竺黄为对照药材的薄层色谱 无 鉴别 体积比:中粉10g。轻轻 中粉10g,轻轻装入量筒,体积比 装入量筒,体积比不得 不得少于24ml 少于35ml 黄白色至黄棕色 黄白色至淡黄棕色 增加对羟基苯甲醇为对照品的薄层 无 色谱鉴别 不得过400mg/Kg 无 不得少于10%,溶媒为乙 不得少于15.0%,溶媒为稀乙醇 醇 不得少于0.20% 总量不得少于0.25% 无 淡黄色至黄棕色 淡黄色至淡黄棕色
《中国药典》2015年版中药材增修订内容
序号 品名 增修订项目
总六六六 总涕涕涕 五氯硝基苯 六氯苯 七氯 艾氏剂 氯丹 性状 鉴别 检查 含量测定 人参皂苷Rg1 人参皂苷Re 人参皂苷Rb1 炮制 性状 鉴别 检查 浸出物 含量测定
2015版中国药典修订内容

《中国药典》2015版总论编制概况
通则增修订-化药 -增订
✓ 鉴别:继续增加专属性较强的方法用于药品的鉴别,扩 大红外光谱在制剂鉴别中的应用;加强对多晶型品种的 研究,建立适宜的检测方法。
✓ 含量测定:在药品质量可控的前提下,继续研究建立原 料药遗留品种的非水溶液滴定方法采用醋酸汞试液的替 代方法,解决环境污染问题;加强专属性强、适用性广 的方法用于制剂含量测定的研究。
要求:
--理论塔板数N大于规定值(按规定方法计算) --拖尾因子T应在0.95-1.05之间(以峰高定量时) --分离度R应大于1.5 --重复性:连续进样5次,峰面积的相对标准偏差不大 于2.0%
新技术与新方法的应用与实践
❖HPLC:系统适用性要求(正文) 分离度
➢ 有关物质
✓ 主成分与辅料 ✓ 主成分与杂质 ✓ 杂质与辅料 ✓ 杂质与杂质
标准物质 生物制品
• 国家药品标准物质通则
• 人血浆病毒核酸检测技术要求 • 单抗纯度茨顶方法-CE-SDS毛细管电泳 • 尼妥珠单抗生物学活性测定法 • 白介素-11-生物活性测定方法
《中国药典》2015版总论编制概况
通则增修订 -微生物检定-合并&修订
✓异常毒性检查法:
非生物制品与生物制品检查法分:仅保留静脉注射法, 特殊要求另作规定。
色谱柱对流动相的要求 ✓纯度的要求 --超纯水,或用KMnO4处理过的双蒸水 --有机溶剂:色谱纯,并与填料相匹配 ✓缓冲液的pH值,在填料的允许范围(一般2-8)内 ✓缓冲液(盐)的浓度不要太高(≤100mM) ✓流动相对样品的溶解度 --调整有机溶剂和水的比例 --最好用流动相溶样
新技术与新方法的应用与实践
《中国药典》2015版总论编制概况
中国药典溶出度_溶出度-2015中国药典

中国药典201兹舉版0931溶出度与释放度测定法溶出度系指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速率和程度,在缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中也称释放度。
仪器装置第一法(篮法>(1)转篮分篮体与篮轴两部分,均为不锈钢或其他惰性材料制成,其形状尺寸如图1所示。
篮体A由方孔筛网 (丝径为 0. 28mm士 0. 03mm,网孔为 0. 40mm士 0. 04mm) 制成,呈圆柱形,转篮内径为20.2mm±0mm,上下两端都有封边。
篮轴B的直径为 75mm士0.35mm,轴的末端连一圆盘,作为转篮的盖;盖上有一通气孔(孔径为 Omm土0.5mm);盖边系两层,上层直径与转篮外径相同,下层直径与转篮内径相同;盖上的3个弹簧片与中心呈120。
角。
(2)溶出杯一般由硬质玻璃或其他惰性材料制成的底部为半球形的1000ml杯状容器,内径为102mm 土 4mm(圆柱部分内径最大值和内径最小值之差不得大于0.5mm),高为185mm ±25mm;溶出杯配有适宜的盖子,盖上有适当的孔,中心孔为篮轴的位置,其他孔供取样或测量温度用。
溶出杯置恒温水浴或其他适当的加热装置中。
(3)篮轴与电动机相连,由速度调节装置控制电动机的转速,使篮轴的转速在各品种项下规定转速的士4%范围之内。
运转时整套装置应保持平稳,均不能产生明显的晃动或振动(包括装置所处的环境)。
转篮旋转时,篮轴与溶出杯的垂直轴在任一点的偏离均不得大于2mm,转篮下缘的摆动幅度不得偏离轴心 Omm。
(4)仪器一般配有6套以上测定装置。
75±0.3575±0.3520.2 士 0 -IO.IS8+|..9£ZZolr+lofs■ 70±5,0 -单位咖图1转篮装置图2搅拌桨装置第二法(桨法>除将转篮换成搅拌桨外,其他装置和要求与第一法相0931溶出度与释放度测定法同。
搅拌桨的下端及桨叶部分可涂适当的惰性材料(如聚四氟乙烯),其形状尺寸如图2所示。
《中国药典》2015年版制剂通则变化比较

《中国药典》2015年版制剂通则变化比较2015年版《中国药典》无论是在品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
通过学习、熟悉2015 年版《中国药典》制剂通则的变化,了解目前我国用药水平、制药水平和监管水平现状,解读未来我国药品行业的趋势。
学习重点:熟悉药典制剂通则,掌握其标准的提升。
第一部分制剂通则比较2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布,于2015年12月1日正式实施。
新版药典是国家药品标准的组成部分,是国家药品标准体系的核心。
按照党中央提出的“四个最严”要求,新版药典的制修订始终坚持“科学、先进、实用、规范”的原则,依据试验数据、研究结果、专家评估,体现药典编制的科学性和严谨性,以持续改进提高药品质量。
新版药典的颁布标志着我国用药、制药以及监管水平的全面提升,将促进药品质量的整体提高,对于保障公众用药安全有效意义重大。
《中国药典》2015年版进一步扩大药品品种的收载和修订,共收载品种5608种。
其中,一部收载品种2598种,二部收载品种2603种,三部收载品种137种。
本版药典是将三部药典的附录合一,加强共性的系统化、完善化及规范化,新版《中国药典》的附录调整为凡例、通则与方法、指导原则、药用辅料等单独成卷,为第四部。
第四部的名称为“《中国药典》2015 年版总则”,包括现有药典一部、二部、三部的附录(现改为“通则”)内容和药用辅料品种正文。
一、《中国药典》2015 年版总则(四部)项目组成:1、前言2、第十届药典委员会委员名单3、目录4、中国药典沿革5、品种及通则变化名单6、凡例(三部合一)7、品名目次(保留笔画索引,品种正文拟改为按拼音排序)8、通则(原药典附录内容):包括导引图、制剂通则、通用方法/检测方法及指导原则9、附表:包括原子量表、国际单位换算表及新旧附录/通则编码对照表10、药用辅料品种正文(原收载于药典二部正文品种第二部分)11、总索引(中英文索引)二、修订说明1、使分类更加清晰明确,药典标准更加系统化、规范化将上一版药典中中药、化学药、生物制品三部分别收载的附录(凡例、制剂通则、分析方法、指导原则、药用辅料等)三合一,独立成卷作为第四部。
2015年版《中国药典》(一部中含毒性饮片成方制剂的归纳与分析

2015年版《中国药典》(一部中含毒性饮片成方制剂的归纳与分析目的:为加强含毒性饮片成方制剂(简称“含毒中成药”)的临床安全用药与监管提供参考。
方法:整理2015年版《中国药典》(一部)中收载的含毒中成药,进行归纳分析并提出提高其临床安全用药水平的建议。
结果与结论:2015年版《中国药典》(一部)共收载含毒中成药474种,占成方制剂的31.75%。
含毒性饮片的口服制剂、外用制剂、肌内注射品种分别为435(其中12个为既可口服又可外用的品种)、38、1个,分别占含毒中成药的91.77%、8.02%、0.21%。
含有1、2、3味及3味以上毒性饮片的成方制剂分别有318、93、32、31个,分别占含毒中成药的67.09%、19.62%、6.75%、6.54%。
目前,有关含毒中成药的基础研究比较薄弱,说明书信息并不完善,缺乏临床用药指导依据,建议加强含毒中成药的基础研究,开展特殊人群用药研究,提高临床合理使用中成药水平,加强上市后安全性再评价,以保障含毒中成药的临床用药安全。
ABSTRACT OBJECTIVE:To provide reference for strengthening safe use and supervision of set prescription preparations containing toxic decoction pieces [called “Chinese patent medicine (CPM)containing toxicity” for short] in clinic. METHODS:The CPM containing toxicity in 2015 edition of Chinese Pharmacopoeia (part Ⅰ)were summarized and analyzed to put forward the suggestion on improving safe use of them in clinic. RESULTS & CONCLUSIONS:A total of 474 CPM containing toxicity are included in 2015 edition of Chinese Pharmacopoeia (part Ⅰ),accounting for 31.75% of set prescription preparations. There are 435 oral preparations (12 preparations both for oral and external use),38 preparations for external use,one intramuscular injection,accounting for 91.77%,8.02%,0.21% of CPM containing toxicity,respectively. There are 318,93,32,31 set prescription preparations containing 1,2,3 or more ingredients toxic decoction pieces,accounting for 67.09%,19.62%,6.75%,6.54%,respectively. At present,basic research on CPM containing toxicity is weak;the information of the instructions is not perfect;guidance for clinical drug use is absent. It is suggested to strengthen basic research on CPM containing toxicity,develop drug use study among special population,improve rational use of Chinese patent medicine and strengthen post-marketing safety reevaluation so as to guarantee the safety of CPM containing toxicity use in clinic.KEYWORDS 2015 edition of Chinese Pharmacopoeia (part Ⅰ);Toxic decoction pieces;Chinese patent medicine;Safe use“中藥毒性”及“中药毒性分级”为中药饮片特有的一种属性,毒性理论历史悠久,但其涵义在《神农本草经》《新修本草》《证类本草》等著作中不尽相同[1]。
中药分析——2015版《中国药典》一部修订情况解读

中药分析——2015版《中国药典》一部修订情况解读2015版《中国药典》一部修订情况解读朱晓静第一部分2015版《中国药典》概况根据国家食品药品监督管理总局2015年第67号令,《中华人民共和国药典》2015年版于2015年12月1日起实施。
作为从事药品领域的相关人员,有必要对2015版《中国药典》的修订情况进行深入了解,以便更好地实施药典相关规定。
一、2015版《中国药典》修订概况《中国药典》由国家药品监督管理部门颁布,是国家为保证药品质量、保证人民用药安全有效、质量可控而制定的药品法典。
《中国药典》对于保证药品质量,维护和保障公众身体健康及用药的合法权益,促进我国医药产业健康发展,具有十分重要的作用。
中国药典是药品行业的最重要的文件之一,其修订一直备受瞩目。
2015版《中国药典》是继我国1953年第一版药典以来的第十版药典。
2015版药典共分为四部出版,其中一部为中药;二部为化学药;三部为生物制药;四部为药典通则、药用辅料。
药典委员会副主任委员、国家食品药品监管总局吴浈副局长指出,2015年版药典无论是在药典品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
二、2015版《中国药典》的主要变化2015版《中国药典》的主要变化包括以下七个方面。
(一)收载品种大幅增加2015版药典收载品种5924个,与2010版药典相比新增品种1125个,修订品种1201个。
新版药典收录药品数量达5608个,比2010年版药典新增1082个,覆盖基本药物目录和医疗保险目录的大部分品种,更加适应临床用药。
(二)药典标准更加系统化、规范化通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
(三)健全了药品标准体系药用辅料品种增加至270个,新增相关指导原则;标准物质新增相关通则和指导原则;药包材新增相关指导原则;在归纳、验证和规范的基础上实现了《中国药典》各部共性检测方法的协调统一。
对2015年版《中国药典》(一部)板蓝根方法的改进

对2015年版《中国药典》(一部)板蓝根方法的改进Improvement of Identification Method (3)of Isatis indigotica from 2015 Edition of Chinese Pharmacopeia (PartⅠ)ZHENG Guocheng1,ZHOU Yongyan1,2,ZHANG Yanyan1,2,YANG Qin1,JIANG Guozhi1,2,SUN Shengbin1,2,LIU Tiejun1,2(1.Shineway Pharmaceutical Group Co.,Ltd.,Shijiazhuang 0*****,China;2.Hebei TCM Formula Granule EngineeringTechnology Research Center,Shijiazhuang 0*****,China)*****T *****VE:To investigate the rationality of TLC identification method (3)of (R,S)-epigoitrin in Isatis indigotica stated in 2015 edition of Chinese Pharmacopeia (partⅠ)(later abbreviated as pharmacopeia),and make some improvements. *****:Three batches I. indigotica were collected and prepared into decoction pieces according to the processing method of I. indigotica in pharmacopoeia. TLC identification of (R,S)-goitrin in I. indigotica decoction piece and medicinal material were conducted according to identification method (3)in pharmacopeia (80% ethanol as solvent for sample treatment,ultrasound extraction);the rationality of pharmacopoeia method was investigated. Then the method was improved by changing the extraction solvent and pretreatment method (method one:using water as solvent,ultrasound extraction;method two:soaking in water for 1 h,then adding into methanol,ultrasound extraction;method three:the sample was wetted and then dried,using 80% methanol as solvent,ultrasound extraction)of samples,and the optimal method wasverified. According to the optimal method,the TLC identification of (R,S)-goitrin was detected by using chromatographic plates from different manufacturers,under the conditions of low temperature and low humidity (7 ℃,relative humidity 48%)and high temperature and high humidity (35 ℃,relative humidity 75%)respectively,to investigate the durability of the method. *****:According to the method of pharmacopeia,in the chromatograms of decoction pieces,the same color spots appeared at the corresponding chromatographic positions of reference substance,but no corresponding spots appeared in the medicinal material chromatograms. After the samples were treated by three improvement methods,in medicinal material chromatograms,the same color spots appeared in the corresponding chromatographic positions of reference substances. There were single chromatographic spot after medicinal materials were treated with method one,and there were more spots after medicinal materials were treated with method two and three,and method two consumed less time than method three. The results of validation tests and method durability tests showed that after the treatment of I. indigotica and its decoction pieces according to method two,the same color spots appeared in the corresponding positions of the decoction pieces and the medicinal materials chromatograms as those of the control. *****IONS:The improved TLC identification method is effective,the chromatographic spots are clear,and the repeatability is good.*****S 2015 edition of Chinese Pharmacopoeia (part Ⅰ);Isatis indigotica;(R,S)-goitrin;TLC identification;Method improvement 板蓝根为十字花科植物菘蓝(Isatis indigotica Fort.)的干燥根,具有清热解毒、凉血利咽的功效,临床上可用于上呼吸道感染、扁桃腺感染和流行性乙型肝炎以及肺炎等的治疗,是常用的中药材,全国各地均产[1-6]。
2015版药典

三、《中国药典》2015年版制剂通则检查方法增修订概况
v 单剂量包装 系指按规定一次服用的包装剂量。凡例中还规定:“各品种[用法与用量] 项下规定服用范围者,不超过一次服用量最高剂量包装者也按单剂量包装 检查”
例如:一次服用量为:6-9g 规格1:每袋装9g——为单剂量包装,检查装量差异 规格2:每袋装12g——为多剂量包装,检查装量 v 重量差异检查边缘数据判断:遇有超出允许粒重范围并处于边缘者,应现
4
一、《中国药典》2015年版附录(总论)制修订概况
有关附录的规划指标
v 调整为风凡例、通则与方法、指导原则、药用辅料等单独成卷 v 开展附录整合工作
附录部分立足规范统、着重完善提高 重点:将原各部附录相同方法之间的规范统一,以解决长期以来各部之间相同方 法要求不统一的问题 v 重点抓好药典附录科研起草工作 扩大收载与修订完善制剂通则及与质量相关的检测项目 加强对药品标准检测方法、检测环境和检测条件的研究 增加新的成熟可靠的方法和修订落后的通用检测方法 进一步补充和完善主要检测方法应指导原则 增订药品生产、流通、储运等各环节的技术指导原则,全面控制药品质量 重视引导、推广国产检验仪器的发展和应5 用
与平均粒重相比较,计算出该粒得差异的百分率,再根据差异限度作为判 定。
31
1
17
二部药典
149条
2 三部药典
149条
8
一、《中国药典》2015年版附录(总论)制修订概况
序号 类别
0100 制剂通则 0200 药材及饮片相关通则 0300 药用辅料相关通则 0400 一般鉴别试验 0500 光谱法与波谱法 0600 色谱法 0700 理化性质 0800 含量测定
0900 限量检查
2015版中国药典发布,附7大变化清单

2015版中国药典发布,附7大变化清单2015-6-12 医学界临床药学《中华人民共和国药典》(2015年版,以下简称药典)经第十届药典委员会执委会全体会议审议通过,予以发布,自2015年12月1日起实施。
6月10日,国家药典委员会发布公告,称根据《中华人民共和国药品管理法》,《中华人民共和国药典》(2015年版,以下简称药典)经第十届药典委员会执委会全体会议审议通过,予以发布,自2015年12月1日起实施。
药典是药品行业的最重要的文件之一,其修改一直备受瞩目。
2015年版是继我国1953年第一版药典以来的第十版药典。
公开资料显示,2015年2月4日,第十届药典委员会执行委员会全体会议审议并通过了《中国药典》2015年版草案。
药典委员会副主任委员、国家食品药品监管总局吴浈副局长做了会议总结,他指出,2015年版药典无论是在药典品种收载、标准增修订幅度、检验方法完善、检测限度设定,还是在标准体系的系统完善、质控水平的整体提升都上了一个新的台阶。
《中国药典》的颁布实施体现了我国的用药水平、制药水平和监管水平。
因此,要不断加强药典标准工作,发挥其引领和规范作用。
下一版的药典将是2020年版,要认真做好2020年版药典的规划工作,使2020年版药典水平再上新台阶。
药典七大变化清单在中国药典2015的后期编制时,国家药典委员会秘书长张伟曾经介绍了2015版药典主要有七个方面的变化,由于张伟介绍时仍然不是最终定稿,所以这个方面的变化中,一些具体数字可能会有所变化,但是整体精神仍可供参考。
一是收载品种增幅达到27.4%。
2015版药典拟收载5800个品种,比2010版药典增加1200多个,修订品种751个。
(此数字是否是最终数字,有待业内人士指正)。
二是通过药典凡例、通则、总论的全面增修订,从整体上进一步提升了对药品质量控制的要求,完善了药典标准的技术规定,使药典标准更加系统化、规范化。
三是健全了药品标准体系。
对2015年版《中国药典》(一部)板蓝根【鉴别】(3)方法的改进

对2015年版《中国药典》(一部)板蓝根【鉴别】(3)方法的改进作者:郑国成周永妍张岩岩杨琴姜国志孙胜斌刘铁军来源:《中国药房》2019年第05期中圖分类号 R921;R284 文献标志码 A 文章编号 1001-0408(2019)05-0657-04DOI 10.6039/j.issn.1001-0408.2019.05.16摘要目的:探讨2015年版《中国药典》(一部)(以下简称药典)中板蓝根【鉴别】(3)(R,S)-告依春薄层色谱(TLC)鉴别方法的合理性,并进行方法改进。
方法:将3批板蓝根药材按药典板蓝根【炮制】方法制成饮片。
首先按药典板蓝根【鉴别】(3)方法分别对板蓝根饮片和药材中(R,S)-告依春进行TLC鉴别(样品处理时以80%甲醇为溶剂,超声提取),考察药典方法的合理性。
然后通过改变样品的提取溶剂及前处理方式(方法一:以水为溶剂,超声提取;方法二:先加水浸泡1 h,再加入甲醇超声提取;方法三:先将样品润湿,晾干后再以80%甲醇为溶剂,超声提取)进行方法改进,并对最优方法进行验证。
最后按最优方法操作,分别采用不同厂家来源的色谱板,以及在低温低湿(7 ℃,相对湿度48%)和高温高湿(35 ℃,相对湿度75%)条件下进行(R,S)-告依春的TLC鉴别,考察方法的耐用性。
结果:按药典方法进行检测,在饮片色谱中,与对照品色谱相应位置上显相同颜色的斑点,但在药材色谱中无相应斑点出现。
按3种改进方法对样品进行处理后,在药材色谱中,与对照品色谱相应位置上均显相同颜色的斑点;但按方法一处理后色谱斑点单一,按方法二、三处理后色谱斑点均较多,且方法二较方法三耗时更短。
验证试验结果和方法耐用性试验结果均显示,按方法二对板蓝根药材和饮片进行处理后,在饮片和药材色谱中,在与对照品色谱相应的位置上均显相同颜色的斑点。
结论:改进后的TLC鉴别方法效果良好,色谱斑点清晰、重复性好。
关键词 2015年版《中国药典》(一部);板蓝根;(R,S)-告依春;薄层色谱鉴别;方法改进Improvement of Identification Method (3) of Isatis indigotica from 2015 Edition of Chinese Pharmacopeia (PartⅠ)ZHENG Guocheng1,ZHOU Yongyan1,2,ZHANG Yanyan1,2,YANG Qin1,JIANG Guozhi1,2,SUN Shengbin1,2,LIU Tiejun1,2(1.Shineway Pharmaceutical Group Co.,Ltd., Shijiazhuang 051430, China;2.Hebei TCM Formula Granule Engineering&Technology Research Center, Shijiazhuang 051430, China)ABSTRACT OBJECTIVE: To investigate the rationality of TLC identification method (3)of (R,S)-epigoitrin in Isatis indigotica stated in 2015 edition of Chinese Pharmacopeia(partⅠ)(later abbreviated as pharmacopeia), and make some improvements. METHODS:Three batches I. indigotica were collected and prepared into decoction pieces according to the processing method of I. indigotica in pharmacopoeia. TLC identification of (R,S)-goitrin in I. indigotica decoction piece and medicinal material were conducted according to identification method (3) in pharmacopeia (80% ethanol as solvent for sample treatment, ultrasound extraction);the rationality of pharmacopoeia method was investigated. Then the method was improved by changing the extraction solvent and pretreatment method (method one: using water as solvent,ultrasound extraction; method two: soaking in water for 1 h, then adding into methanol,ultrasound extraction; method three: the sample was wetted and then dried, using 80% methanol as solvent, ultrasound extraction) of samples, and the optimal method was verified. According to the optimal method, the TLC identification of (R,S)-goitrin was detected by using chromatographic plates from different manufacturers, under the conditions of low temperature and low humidity (7 ℃, relative humidity 48%) and high temperature and high humidity (35 ℃,relative humidity 75%) respectively,to investigate the durability of the method. RESULTS:According to the method of pharmacopeia, in the chromatograms of decoction pieces, the same color spots appeared at the corresponding chromatographic positions of reference substance, but no corresponding spots appeared in the medicinal material chromatograms. After the samples were treated by three improvement methods, in medicinal material chromatograms, the same color spots appeared in the corresponding chromatographic positions of reference substances. There were single chromatographic spot after medicinal materials were treated with method one, and there were more spots after medicinal materials were treated with method two and three, and method two consumed less time than method three. The results of validation tests and method durability tests showed that after the treatment of I. indigotica and its decoction pieces according to method two, the same color spots appeared in the corresponding positions of the decoction pieces and the medicinal materials chromatograms as those of the control. CONCLUSIONS: The improved TLC identification method is effective, the chromatographic spots are clear, and the repeatability is good.KEYWORDS 2015 edition of Chinese Pharmacopoeia (part Ⅰ); Isatis indigotica;(R,S)-goitrin; TLC identification; Method improvement板蓝根为十字花科植物菘蓝(Isatis indigotica Fort.)的干燥根,具有清热解毒、凉血利咽的功效,临床上可用于上呼吸道感染、扁桃腺感染和流行性乙型肝炎以及肺炎等的治疗,是常用的中药材,全国各地均产[1-6]。
2015版《中国药典》四部介绍及其在中药分析鉴定中的应用

2015 年版《中国药典》四部介绍及其在中药分析鉴定中的应用李峰2015年版《中国药典》已于2015年6月5日由国家食品药品监督管理总局正式颁布。
2015年版《中国药典》最大的变动之一是将原药典各部附录整合,并与药用辅料标准单立成卷,首次作为《中国药典》第四部,解决了长期以来药典各部共性检测方法重复收录、彼此之间方法不协调、不统一、不规范,给药品检验实际操作带来不便的问题。
2015年版《中国药典》四部是保证《中国药典》执行的重要基础,是2015年版《中国药典》水平和特色的重要体现,也是系统阐述药品检测技术、传播药典知识的良好教科书,对于强化药品监管手段,保障药品质量不断提高,促进先进检测技术应用和行业健康必将发挥积极的作用。
一、2015年版《中国药典》四部介绍2015年版《中国药典》四部内容包括凡例、通则和药用辅料。
药典通则涵盖了通用性要求、检验方法、指导原则以及试剂和标准物质等药品标准的共性要求,是药典标准的基础,不但反映了我国药品质量控制整体状况和药品检验技术水平;同时也对规范药品研究、生产、检验、加强药品监管发挥重要作用。
现就2015年版《中国药典》四部整体情况简要介绍如下。
1.2015年版《中国药典》四部增修订整体情况2015年版《中国药典》四部收载通则总数317个,将药典一部、二部、三部制剂整合后共计38个,检测方法附录287个,其中新增通则28个 (检定方法通则27个、制剂通则1个),整合通则63个,修订通则 67 个;新增生物制品总论3个;指导原则共计30个,其中新增15个,修订10个。
辅料收载总数约270个品种,其中新增137 个,修订97个,不收载2个。
2.2015年版《中国药典》四部主要特点2.1 整体提升质控水平《中国药典》凡例、通则、总论是药典的重要组成部分,对药品标准的检测方法和限度进行总体规定,对药典以外的其他药品国家标准具同等效力。
通过对2010年版《中国药典》相关内容的全面增修订,全面完善了药典标准基本共性规定,从整体上提升对药品质量控制的要求,形成了以凡例为统领,通则为同类药品基本准则、各论作为基本要求的药典标准体例。
《中国药典》2015年版药材和饮片检定通则

药材和饮片检定通则药材和饮片的检定包括“性状”、“鉴别”、“检查”、“浸出物测定”、“含量测定”等项目。
检定时应注意下列有关的各项规定。
一、检验样品的取样应按药材和饮片取样法(通则0211)的规定进行。
二、为了正确检验,必要时可用符合本版药典规定的相应标本作对照。
三、供试品如已破碎或粉碎,除“性状”、“显微鉴别”项可不完全相同外,其它各项应符合规定。
四、“性状”系指药材和饮片的形状、大小、表面(色泽与特征)、质地、断面(包括折断面或切断面)及气味等特征。
性状的观察方法主要用感官来进行,如眼看(较细小的可借助于扩大镜或体视显微镜)、手摸、鼻闻、口尝等方法。
1. 形状是指药材和饮片的外形。
观察时一般不需预处理,如观察很皱缩的全草、叶或花类,可先浸湿使软化后,展平,观察。
观察某些果实、种子类时,如有必要可浸软后,取下果皮或种皮,以观察内部特征。
2. 大小是指药材和饮片的长短、粗细(直径)和厚薄。
一般应测量较多的供试品,可允许有少量高于或低于规定的数值。
测量时可用毫米刻度尺。
对细小的种子或果实类,可将每10粒种子紧密排成一行,以毫米刻度尺测量后求其平均值。
3. 表面是指日光下观察药材和饮片的表面色泽(颜色及光泽);如用两种色调复合描述颜色时,以后一种色调为主,例如黄棕色,即以棕色为主;以及观察药材和饮片表面的光滑、粗糙、皮孔、皱纹、附属物等外观特征。
观察时供试品一般不作预处理。
4. 质地是指用手折断药材和饮片时的感官感觉。
断面是指在日光下观察药材和饮片的断面色泽(颜色及光泽度),以及断面特征。
如折断面不易观察到纹理,可削平后进行观察。
5. 气味是指药材和饮片的嗅感和味感。
嗅感可直接嗅闻,或在折断、破碎或搓揉时进行。
必要时可用热水湿润后检查。
味感可取少量直接口尝,或加热水浸泡后尝浸出液。
有毒药材和饮片如需尝味时应注意防止中毒。
6.药材和饮片外观不得有虫蛀、发霉及其他物质污染等异常现象。
五、“鉴别”系指检验药材和饮片真实性的方法,包括经验鉴别、显微鉴别、理化鉴别、聚合酶链式反应法等。
2015版一部药材检验变化整理

名称2010版2015版山茱萸1.鉴别(3):取本品...0.5g,加无水乙醇...,...处理15分钟,...残渣加无水乙醇...。
另取马钱苷对照品...加无水乙醇...含1mg的溶液,...,吸取...各5μl,以乙酸乙酯-乙醇-冰醋酸(50:10:1)为展开剂,...喷以5%香草醛硫酸溶液,...显紫红色斑点。
2.含量测定:色谱条件与系统适用性试验:以乙腈-水(15:85)为流动相。
理论板数...3000。
对照品溶液的制备:取马钱苷对照品,...含40μg的溶液。
供试品溶液的制备:取本品约0.1g,本品含马钱苷不得少0.60%1.鉴别(3):取本品...0.5g,加甲醇...,处理20分钟,...残渣加甲醇...。
另取莫诺苷对照品、马钱苷对照品,加甲醇...含2mg的混合溶液,...,吸取...各2μl,以三氯甲烷-甲醇(3:1)为展开剂,...喷以10%硫酸乙醇溶液,...置紫外光灯(365nm)下检视。
...显荧光斑点。
2.含量测定:色谱条件与系统适用性试验:以乙腈为流动相A,以0.3%磷酸溶液为流动相B,按下表中的规定进行梯度洗脱;...;柱温为35℃。
理论板数...10000。
时间(分钟) A(%) B(%)0~20 7 9320~50 7→20 93→80对照品溶液的制备:取莫诺苷对照品、马钱苷对照品,...含50μg的混合溶液。
供试品溶液的制备:取本品约0.2g,本品含莫诺苷和马钱苷的总量不得少于1.2%山药1.来源:本品为薯蓣科植物薯蓣Dioscorea opposita Thunb.的干燥根茎。
冬季茎叶枯萎后采挖,切去根头,洗净,除去外皮和须根,干燥,(习称“毛山药片”;)或(除去外皮,)趁鲜切厚片,干燥(称为“山药片”);也有选择肥大顺直的干燥山药,置清水中,浸至无干心,闷透,切齐两端,用木板搓成圆柱状,晒干,打光,习称“光山药”。
2.性状:(毛山药)本品略呈圆柱形,弯曲而稍扁,长15~30cm,直径1.5~6cm。
《中国药典》2015年版:片剂

片剂片剂系指原料药物与适宜的辅料制成的圆形或异形的片状固体制剂。
中药还有浸膏片、半浸膏片和全粉片等。
片剂以口服普通片(也包括糖衣片、薄膜衣片)为主,另有含片、舌下片、口腔贴片、咀嚼片、分散片、可溶片、泡腾片、阴道片、阴道泡腾片、缓释片、控释片与肠溶片(包括肠溶衣片和结肠定位肠溶衣片)与口崩片等。
对片剂的质量要求除外观应完整光洁、色泽均匀,有适宜的硬度和耐磨性,以及药典品种项下规定的检验项目外,还应检查“重量差异”和“崩解时限”。
此外,阴道片应检查“融变时限”,阴道泡腾片应检查“发泡量”,分散片应检查“分散均匀性”,口腔贴片、阴道片、阴道泡腾片和1简述1.11.222.10.30g或0.30g2.22.333.13.244.1不得再放回供试品原包装容器内。
4.2遇有检出超出重量差异限度的药片,宜另器保存,供必要时的复核用。
4.3糖衣片应在包衣前检查片芯的重量差异,符合规定后方可包衣。
包衣后不再检查重量差异。
4.4薄膜衣片在包衣后也应检查重量差异。
5记录与计算5.1记录每次称量数据。
5.2求出平均片重(m),保留三位有效数字。
修约至两位有效数字,选择重量差异限度。
5.3按下表规定的重量差异限度,求出允许片重范围(m±m×重量差异限度)。
5.4再根据上表规定的重量差异限度作为判定的依据(避免在计算允许片重范围时受数值修约的影响)。
6结果与判定6.1每片重量均未超出允许片重范围(m±m×重量差异限度);或与平均片重相比较(凡无含量0.295g,应按0.30g的重量差异限度±5%计算。
(4)允许片重范围0.295±0.295×5%=0.280~0.310(g)(5)依法精密称定每片重量,保留三位有效数字,若均在上述允许片重范围内,则按6.1下判为符合规定;若上述供试品中有3片的片重分别为0.279g、0.311g、0.312g,超出允许片重范围(0.280~0.310g)但处于范围边缘,应按5.4项的要求与平均片重相比较,分别计算出该3片的重量差异百分率为-5.4%、5.4%与5.7%,因规定的限度为±5%,根据数值修约规定分别修约成-5%、5%与6%,超出重量差异限度的药片只有1片,按6.1项仍应判为符合规定;若超出重量差异限度的药片多于2片,按6.2项下判为不符合规定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作者简介尚悦,女,助理研究员E-mail:shangyue@ 收稿日期2018-02-09修回日期2018-03-222015年版《中国药典》含片溶化性检查方法调整的回顾尚悦1,洪小栩1,刘永利21国家药典委员会,北京100061;2河北省药品检验研究院,石家庄050011含片系指含于口腔中缓慢溶化产生局部或全身作用的片剂[1]。
2010年版《中国药典》二部附录规定了含片溶化性的检测方法,照崩解时限检查法检查,而2010年版《中国药典》一部中规定含片不检查崩解时限。
在2015年版《中国药典》附录整合过程中,最终将含片溶化性进行了统一。
此成因归结为:对中药、化学药含片品种作系统研究,包括含片生产品种的收集等;对含片溶化性(崩解时限)检查方法进行全面分析;对含片溶化性检查方法在药典中的变化与其整合的可行性进行探讨。
这些基础性工作为2015年版《中国药典》附录整合提供了可靠的依据。
本文作者全程参与药典附录整合工作,就此作一详实的回顾,以供药学工作者借鉴。
1国内含片现状及样品与资料收集情况1.1国内含片生产现状资料来源于国家药监局数据库[2]。
统计表明,截止到2014年4月1日,国内共有含片批准文号459个、73个品种(其中中药42个品种、化学药31个品种);330个生产企业;通用名称绝大多数为“××含片”,少数为“××含化片”或“含化××片”。
1.2样品收集情况共收集到含片样品324批,涉及41个品种;其中化学药16个品种、197批,中药25个品种、127批。
2国内外含片溶化标准2.1国外药典含片溶化标准通过查阅国外主要药典,只有《美国药典》对含片的溶化性(崩解时限)有具体规定[3],要求应在4h 内全部崩解;《日本药局方》规定非包衣片30min 内全部崩解[4]。
《欧洲药典》、《英国药典》没有相应的溶化性(崩解时限)检查方法。
2.2《中国药典》含片溶化标准在2005年版《中国药典》之前,均未对含片溶化性作出规定。
2005年版《中国药典》二部开始对含片进行了定义[5],系指含于口腔中,药物缓慢溶解,产生持久局部作用的片剂。
要求检查崩解时限,规定“除另有规定外,30min 内应全部崩解”,仅设置了上限。
在2010年版《中国药典》二部中,对含片的定义进行了修订[5],系指含于口腔中缓慢溶化产生局部或全身作用的片剂。
原含片的崩解时限描述为含片的溶化性,测定方法仍按照“崩解时限检查法”检查,要求“除另有规定外,10min 内不应全部崩解或溶化”,仅设置了下限。
《中国药典》2005、2010年版一部附录片剂项下则规定含片不检查崩解时限。
2.3各含片生产企业执行标准情况共收集到企业执行标准51个,其中中药标准28个,化学药标准23个。
中药标准均规定不检查崩解时限。
化学药品标准中,照《中国药典》附录规定检查崩解时限的有12个;规定不检查崩解时限的190有9个;另外还有2个品种崩解情况为:肝素钠含片执行标准为化学药地方标准升入国家标准第9册(WS-10001-(HD-0809)-2002),规定应在10min 内全部崩解;华北制药股份有限公司的甲硝唑含片执行标准为WS1-(X-010)-2004Z,规定“30min后应全部崩解”,标准描述不准确,联系生产企业,反馈表示,日常生产检验中,判定标准是综合了《中国药典》2005年版与2010年版,为“10min内不应全部崩解或溶化,30min内应全部崩解”。
见表1。
3试验与结果3.1试验方法将所收集到的全部含片样品照2010年版《中国药典》二部附录ⅠA“崩解时限检查法测定”[5]。
以37℃水为介质,取供试品6片,不加挡板,进行试验,记录含片样品全部崩解并通过筛网的时间。
3.2试验结果3.2.1全部样品检查结果见表2。
3.2.2中药含片127批品种溶化崩解检查结果127批中药含片崩解时段分布见表3。
结果主要集中在30min以内崩解;大于30min的仅有15批次,占总批数的11.8%。
3.2.3化学药含片197批品种崩解检查结果原标准中,化学药含片对崩解时限有规定的计11个品种、111批样品(有3批甲硝唑含片规定在30min 内崩解,其余均同药典规定,结果均符合规定),其中,76批在10~30min崩解,占总批数的68.5%;35批在30~60min崩解,占总批数的31.5%。
原标准中未规定检查崩解时限的有86批次,化学药含片崩解时段分布见表3。
4讨论4.1方法及限度制定通过上述试验,认为2010年版《中国药典》二部收载的含片溶化性检查方法可行,虽然从目前数据统计结果看,如果溶化性限度按二部规定的“10min内不得崩解”执行,中药含片有34.6%、化学药含片(原标准规定不检查溶化性的)有27.9%的样品不符合规定。
通常认为,含片崩解时间的主要影响因素是生产工艺及所用的辅料,并从药品的安全性和有效性出发,对生产工艺进行调整后,10min内不得崩解应该可以达到要求的。
同时为贯彻2015版《中国药典》通则一、二、三部先整合、后优化,求大同、存小异的原则,建议保持原2010年版《中国药典》二部的规定,即含片10min内不得崩解。
191Review of the Adjustment of Lozenge Dissolution Test in the Chinese Phar 原macopoeia 2015EditionSHANG Yue 1,HONG Xiaoxu 1,LIU Yongli 21Chinese Pharmacopoeia Commission,Beijing 100061;2Hebei Institute for Drug Control,Shijiazhuang 050011ABSTRACT Objective:To review the revision process of the 2015edition of the Chinese Pharmacopoeia,and to provide a reliable experimental basis for the establishment of unified dissolubility test method for lozenges of traditional Chinese medicines and chemical drugs.Methods:Commercially available samples were collected and tested according to the method of disintegration determination to establish a reasonable time limit.Results:A total of 324batches of samples were collected,including 127batches of traditional Chinese medicine and 197batches of chemical drugs,all the samples were tested for disintegration and the results showed that 68batches disintegrated in 5-10min,189batches in 10-30min and 67batches in more than 30min.Conclusion:There is no significant difference of dissolubility in lozenges between traditional Chinese medicines and chemical drugs,and the same time limit can be established uniformly.KEY WORDS Lozenges;Dissolubility test;Disintegration timelimit 4.2是否加挡板在2010年版《中国药典》二部附录ⅩA “崩解时限检查法”中[5],除另有规定外,为不加挡板依法试验,含片项下亦没有特别指出要求加挡板。
而在2010年版《中国药典》一部附录ⅫA “崩解时限检查法”中[8],除另有规定外,加挡板依法试验。
在试验过程中,发现收集的样品均无漂浮现象,因此在含片的溶化性(崩解时限)试验中,统一为不加挡板。
4.3终点判定在样品崩解时限检查试验中,崩解形态分为两种:①溶解溶蚀而崩解,即药片因水流运动被浸蚀,体积逐渐减小,直至通过筛网,大多数样品成此种情况;②软化碎裂,即药片因水流冲击,软化碎裂成小块,进而崩解成粉末或颗粒。
两种情况崩解后残渣为粉末,或为粒径小于筛网孔径的细小颗粒,可随水流运动而全部无残留通过筛网,即为完全崩解,以溶化过程计算崩解时间,与《中国药典》规定相同。
4.4薄膜衣含片结果判定在收集到的样品中,有两个品种为薄膜衣含片:金果含片(国药准字Z10940028,江西南昌济生制药厂)、桂林西瓜霜含片(国药准字Z10980143,桂林三金药业股份有限公司)。
因其给药方式及给药途径仍属于含片类别,因此其崩解时限仍按照含片规定,依法检验,结果均符合规定。
5结语5.1片剂通则(含片)要求更趋完善根据2015年版《中国药典》通则整合的总体要求,同一剂型下的检查项应尽量统一。
结合本试验数据,含片溶化性首次整合为“除另有规定外,各片均不应在10min 内全部崩解或溶化。
”并添加到2015年版《中国药典》第四部的崩解时限检查法中。
2015年版《中国药典》中含片溶化性检查方法的整合,有利于对目前国内外药典、文献以及上市产品质量标准中有关溶化性测定方法的衡量对比,从而进行系统研究、评价,建立适应我国药典的统一方法,以达到规范标准、提高药品质量的目的。
5.2提高对中药制剂(含片)的要求片剂溶化性的整合,优化了现行中药含片检测方法,完善了中药含片安全性检查项目,提高了中药含片质量控制水平,完全符合2015年版《中国药典》编制大纲所确定的指导思想,即中药标准逐步实现我国主导国际标准的要求。
通过整合中药制剂标准,使标准更加严谨,凸显了中药制剂质量标准作为中药质量控制的技术依据和技术规范的重要性,推动企业技术进步和产品的更新换代,有力推动中药产业的健康发展。
参考文献[1]国家药典委员会.中华人民共和国药典:四部[S].北京:中国医药科技出版社,2015:0101.[2]国家食品药品监督管理总局.数据查询[DB/OL ]./datasearch/face3/dir.html.(2014-4-1).[3]USP36-NF31[S].Disintegration,305-307.[4]JP17.0[S].Disintegration Test,135-7.[5]国家药典委员会.中华人民共和国药典:二部[S].北京:化学工业出版社,2005:附录ⅠA ,ⅩA ,ⅫA .192。
