阿苯达唑内控质量标准
阿苯达唑片_兽用阿苯达唑片说明书

畜牧堂兽药说明书,更多药品请登录畜牧堂网站查询阿苯达唑片_兽用阿苯达唑片说明书本品含阿苯达唑(C12H15N3O2S)应为标示量的90.O%~110.0%。
【性状】本品为类白色片。
【鉴别】(1)取本品的细粉适量(约相当于阿苯达唑0.2g),加乙醇30ml,置水浴上加热使阿苯达唑溶解,滤过,滤液置水浴上蒸干,残渣照阿苯达唑项下的鉴别(1)、(2)项(96页)试验,显相同的反应。
(2)取含量测定项下的溶液,照分光光度法(附求17页)测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
【检查】应符合片剂项下有关的各项规定(附录5页)。
【含量测定】取本品20片,精密称定,研细,精密称取适量(约相当于阿苯达唑20mg),置100ml最瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置另一100ml量瓶中,用己醇稀释至剿度,摇匀,照分光光度洁(附录17页).在295nm的波长处测定吸收度,按C12H15N3O2S的吸收系数(E)为444计算,即得。
【作用与用途】【用法与用量】同阿苯达唑。
【规格】(1)25mg (2)50mg (3)200mg (4)500mg【贮藏】密封保存。
阿苯达唑片说明书兽用【兽药名称】通用名:阿苯达唑片商品名:英文名:Albendazole Tablets汉语拼音:Abendazuo Pian【主要成分】阿苯达唑【性状】本品为类白色片。
【药理作用】药效学阿苯达唑为苯并咪唑类,具有广谱驱虫作用。
线虫对其敏感,对绦虫、吸虫也有较强作用(但需较大剂量),对血吸虫无效。
作用机理主要是与线虫的微管蛋白结合发挥作用。
阿苯达唑与β-微管蛋白结合后,阻止其与α-微管蛋白进行多聚化组装成微管。
微管是许多细胞器的基本结构单位,是有丝分裂、蛋白装配及能量代谢等细胞繁殖过程所必需。
阿苯达唑对线虫微管蛋白的亲和力显著高于哺乳动物的微管蛋白,因此对哺乳动物的毒性很小。
阿苯达唑片生产工艺规程

制药有限公司阿苯达唑片生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、产品概述 (3)2、生产的工艺流程图 (5)3、操作过程及工艺条件 (6)4、工艺过程中所需SOP名称 (9)5、工艺卫生及环境卫生 (9)6、工艺验证及具体要求 (10)7、设备一览表及主要设备生产能力 (10)8、物料平衡及经济技术指标计算 (10)9、技术安全及劳动保护 (11)10、劳动组织与岗位定员 (12)1.产品概述1.1产品名称:通用名:阿苯达唑片商品名:1.2性状:本品为类白色片。
1.3规格:4.5g:500mg1.4处方:阿苯达唑3.89Kg,淀粉、糊精加至35Kg。
1.5依据:《中华人民共和国兽药典》2005版第一部1.6有效期:二年1.7成品贮存方法及注意事项:密封保存。
1.8原辅材料、半成品和成品质量标准:阿苯达唑质量标准见阿苯达唑内控质量标准。
淀粉质量标准见淀粉内控质量标准。
糊精质量标准见糊精内控质量标准半成品质量标准见阿苯达唑片半成品内控质量标准。
成品内控质量标准见阿苯达唑片内控质量标准。
1.10原辅材料贮存注意事项:阿苯达唑:密封保存。
淀粉:密封保存。
糊精:密封保存。
1.11半成品检查方法及岗位控制:a质量控制要点:b 半成品检查方法见阿苯达唑片半成品检验操作规程。
1.12包装要求:应符合塑料袋质量内控标准要求。
2.生产的工艺流程图注:加粗部分为主要控制点3.操作过程及工艺条件3.1 生产前准备:3.1.1上一批次是否进行清场。
清场者、检查者是否签字,将“清场合格证”副件归入本批生产记录。
未取得清场合格证不得进行下一批次的生产。
3.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。
不得有上批生产遗留物。
3.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运行中”标牌后才能使用。
所有工具、容器、设备是否已按清洗规程完成并符合标准。
3.1.4对计量容器、衡器要进行检查、校正以后才能使用。
阿苯达唑质量标准

阿苯达唑质量标准制定人: 日期:审核人: 日期:批准人: 批准日期:生效日期:阿苯达唑AbendazuoAlbendazoleC12H15N3O2S本品为5-(丙硫基)-2-基氨基甲酸甲酯。
按干燥品计算,含C12H15N3O2S不得少于%。
[性状]本品为白色或类白色粉末;无臭,无味。
本品在丙酮或三氯甲烷中微溶,在乙醇中几乎不溶,在水中不溶;在冰醋酸中溶解。
熔点本品的熔点(附录45页)为206~212℃,熔融时同时分解。
吸收系数取本品约10mg,精密称定,置100ml量瓶中,加冰醋酸5ml溶解后,加乙醇稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法(附录17页),在295nm的波长处测定吸收度,吸收系数(E1%1cm)为430-458。
[鉴别](1)取本品约0.1g,置试管底部,管口放一湿润的醋酸铅试纸,加热灼烧试管底部,产生的气体能使醋酸铅试纸显黑色。
(2)取本品约0.1g,溶于温热的稀硫酸中,滴加碘化铋钾试液,即生成红棕色沉淀。
(3)取吸收系数项下的溶液,照紫外-可见分光光度法(附录23页)测定,在295nm的波长处有最大吸收,在277nm的波长处有最小吸收。
(4)本品的红外光吸收图谱应与对照的图谱一致。
如发现在1380cm-1处的吸收峰与对照的图谱不一致时,可取本品适量溶于无水乙醇中,置水浴上蒸干,减压干燥后测定。
[检查] 有关物质取本品,加三氯甲烷-冰醋酸(9:1)溶解并稀释成每1ml 中含的溶液,作为供试品溶液;精密量取适量,加三氯甲烷-冰醋酸(9:1)稀释成每1ml中含75μg的溶液,作为对照溶液。
照薄层色谱法(附录30页)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙醚-冰醋酸(30:7:3)为展开剂,展开,晾干,立即置紫外光灯(254nm)下检视。
供试品溶液如显杂质斑点,其荧光强度与对照溶液的主斑点比较,不得更强。
阿苯达唑 (Albendazole)使用说明书

阿苯达唑 (Albendazole)使用说明书阿苯达唑 (Albendazole)使用说明书一、产品概述阿苯达唑是一种广谱抗寄生虫药物,可用于治疗人体内多种寄生虫感染症。
本说明书将详细介绍该药物的使用方法、剂量、注意事项等内容,以确保患者正确使用,达到最佳治疗效果。
二、适用范围阿苯达唑适用于以下感染症:1. 单纯或混合性肠道蠕虫感染:如钩虫病、蛔虫病、蠕虫性腹泻等。
2. 绦虫感染:如鞭虫病、猪绦虫病、牛绦虫病等。
3. 弓形虫病:可用于治疗急性和慢性弓形虫感染。
三、使用方法1. 阿苯达唑通常口服给药,推荐在饭后服用,以提高药物的有效吸收。
如需使用其他给药途径,请在医生指导下进行。
2. 剂量根据患者的体重、年龄和感染类型而定,请严格按照医生的处方进行用药。
3. 药品使用期限为开封后五年,请在保质期内使用。
四、常见副作用阿苯达唑作为一种强力药物,使用时可能出现以下副作用:1. 胃肠道反应:如恶心、呕吐、腹泻等,通常可在用药期间自然缓解。
2. 过敏反应:如皮疹、荨麻疹、呼吸困难等,停药并咨询医生。
3. 肝功能异常:如黄疸、胆汁淤积等,需监测肝功能,如出现异常应立即告知医生。
4. 低血小板计数:长期大剂量使用可能导致血小板减少,导致出血倾向。
五、注意事项1. 孕妇、哺乳期妇女和儿童慎用本药物,应在医生指导下使用。
2. 与其他药物同时使用时,应避免与抗癫痫药物、胎盘透明带阻滞剂等药物联用。
3. 如出现使用过程中的不良反应,请立即停药,并及时咨询医生。
4. 阿苯达唑可能对驾驶和操作机械等活动产生影响,请在使用期间注意安全。
六、存储要求1. 阿苯达唑应存放在阴凉、干燥的地方,远离阳光直射和高温。
2. 儿童必须无法取得该药物。
3. 已过期或不再需要的药物应通过合适的方式进行处理,切勿随意丢弃。
七、总结阿苯达唑是一种常用的抗寄生虫药物,对多种感染症有显著疗效。
在使用时,请遵循医生的指导,正确用药,以免出现不良反应和药物耐药现象。
阿苯达唑伊维菌素粉质量标准、说明书

阿苯达唑伊维菌素粉本品含阿苯达唑(C12H15N3O2S)与伊维菌素(H2B1a+H2B1b)均应为标示量的90.0%---110.0%。
【性状】本品为白色或类白色粉末。
【鉴别】(1)取阿苯达唑含量测定项下溶液,照紫外-可见分光光度法测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
(2)在伊维菌素含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】干燥失重取本品,在105℃干燥至恒重,减失重量不得过10.0%。
其他应符合粉剂项下有关的各项规定。
【含量测定】阿苯达唑取本品适量(约相当于阿苯达唑20mg),精密称定,置100ml量瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取滤液5ml,置另一100ml量瓶中用乙醇稀释至刻度,摇匀,照紫外-分光光度法(附录23页),在295nm波长处测定吸光度,按C12H15N3O2S的吸收系数(E1%1cm)为444计算,即得。
伊维菌素照高效液相色谱法(附录32页)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂;乙腈—甲醇—水(56:28:16)为流动相;检测波长为245nm.理论板数按伊维菌素H2B1a峰计算不低于2000,伊维菌素H2B1a与H2B1a分离度应符合要求。
测定法取本品适量(约相当于伊维菌素20mg),精密称定,置100ml量瓶中,加适量甲醇振荡使伊维菌素溶解,用甲醇稀释至刻度,摇匀,过滤,精密量取续滤液10ul,注入液相色谱仪,记录色谱图;另取伊维菌素对照品,按外标法,以峰面积计算,即得。
【作用与用途】驱虫药。
用于去除或杀灭猪线虫、吸虫、螨等体内外寄生虫。
【用法与用量】以本品计。
内服:一次量,每10kg体重,猪0.7~1g.【不良反应】按推存剂量使用,未见不良反应。
【注意事项】本品中伊维菌素对鱼、虾有剧毒,残存物,包装品及动物排泄物切勿污染水源。
阿苯达唑质量标准

阿苯达唑质量标准制定人: 日期: 审核人: 日期: 批准人: 批准日期:生效日期:阿苯达唑Abendazuo AlbendazoleC12H15N3O2S 265.34本品为5-(丙硫基)-2-基氨基甲酸甲酯。
按干燥品计算,含C12H15N3O2S不得少于98.5%。
[性状]本品为白色或类白色粉末;无臭,无味。
本品在丙酮或三氯甲烷中微溶,在乙醇中几乎不溶,在水中不溶;在冰醋酸中溶解。
熔点本品的熔点(附录45页)为206~212℃,熔融时同时分解。
吸收系数取本品约10mg,精密称定,置100ml量瓶中,加冰醋酸5ml 溶解后,加乙醇稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法(附录17页),在295nm的波长处测定吸收度,吸收系数(E1%1cm)为430-458。
[鉴别](1)取本品约0.1g,置试管底部,管口放一湿润的醋酸铅试纸,加热灼烧试管底部,产生的气体能使醋酸铅试纸显黑色。
(2)取本品约0.1g,溶于温热的稀硫酸中,滴加碘化铋钾试液,即生成红棕色沉淀。
(3)取吸收系数项下的溶液,照紫外-可见分光光度法(附录23页)测定,在295nm的波长处有最大吸收,在277nm的波长处有最小吸收。
(4)本品的红外光吸收图谱应与对照的图谱一致。
如发现在1380cm-1处的吸收峰与对照的图谱不一致时,可取本品适量溶于无水乙醇中,置水浴上蒸干,减压干燥后测定。
[检查] 有关物质取本品,加三氯甲烷-冰醋酸(9:1)溶解并稀释成每1ml中含5.0mg的溶液,作为供试品溶液;精密量取适量,加三氯甲烷-冰醋酸(9:1)稀释成每1ml中含75μg的溶液,作为对照溶液。
照薄层色谱法(附录30页)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙醚-冰醋酸(30:7:3)为展开剂,展开,晾干,立即置紫外光灯(254nm )下检视。
供试品溶液如显杂质斑点,其荧光强度与对照溶液的主斑点比较,不得更强。
阿苯达唑片成品检验记录
吸收,在277nm波长处有最小
吸收。规定
3、检查:
干燥失重 10.0%规定
重量应符合规定规定
崩解时限 应符合规定规定
脆碎度 应符合规定规定
4、含量测定:
含阿苯达唑应为
标示量的92.0%-108.0%规定
检验结论:
本品按<<阿苯达唑片内控质量标准(成品)>>检验,结果
规定。
检验结果:
(2)取含量测定项下的溶液,照紫外-可见分光光度法(附录-23页)
测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
检验结果:
检查
装量
样品号
1
2
3
药+包装重(g)
包装重(g)
药重(g)
平均(g)
标准规定
每袋装量不少于标示量的100%平均装量不少于标示量
项目结论
干燥
失重
称量瓶重(g)
样品编号
内容
1
2
样品取量VS(g)
样品吸收度AS
对照品取量Wc
计算公式:
X=样品吸收度×100×100/444×S×VS×5
N(对照品含量)= S=
样品百分含量
含量平均值
标准规定:含阿苯达唑应为标示量的92.0%-108.0%。
项目结论:
检验结论:本品按<<阿苯达唑片内控质量标准(成品)>>检验,结果
有限公司
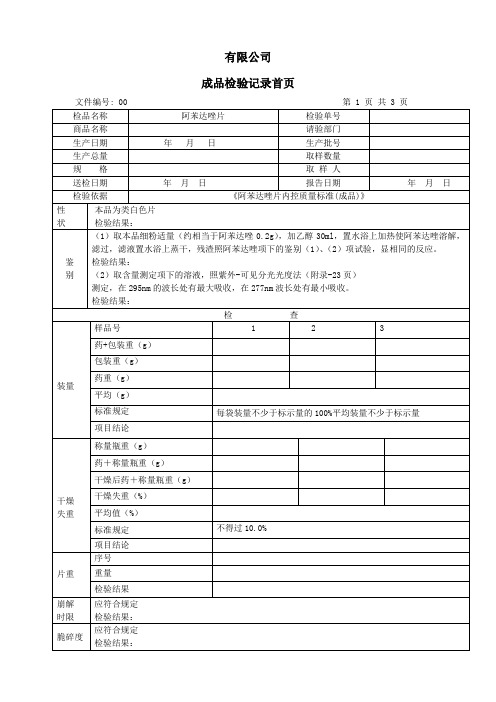
成品检验记录首页
文件编号: 00第1页共3页
检品名称
阿苯达唑片
检验单号
商品名称
请验部门
生产日期
年月日
生产批号
阿苯达唑质量标准(精制甲类)
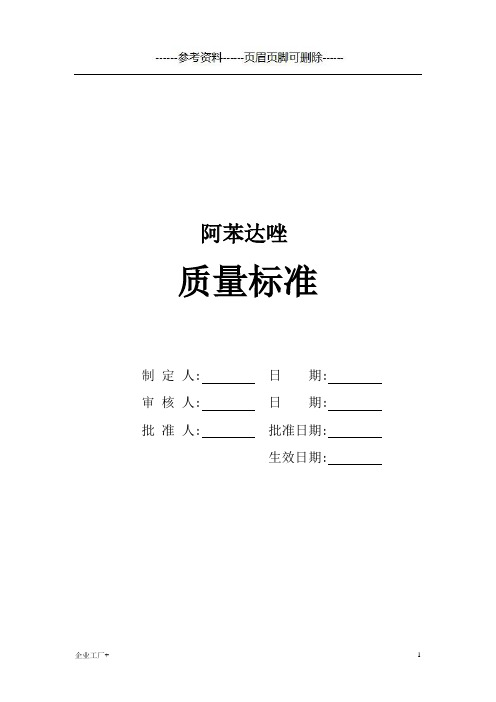
阿苯达唑质量标准制定人: 日期: 审核人: 日期: 批准人: 批准日期:生效日期:阿苯达唑Abendazuo AlbendazoleC12H15N3O2S 265.34本品为5-(丙硫基)-2-基氨基甲酸甲酯。
按干燥品计算,含C12H15N3O2S不得少于98.5%。
[性状]本品为白色或类白色粉末;无臭,无味。
本品在丙酮或三氯甲烷中微溶,在乙醇中几乎不溶,在水中不溶;在冰醋酸中溶解。
熔点本品的熔点(附录45页)为206~212℃,熔融时同时分解。
吸收系数取本品约10mg,精密称定,置100ml量瓶中,加冰醋酸5ml 溶解后,加乙醇稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法(附录17页),在295nm的波长处测定吸收度,吸收系数(E1%1cm)为430-458。
[鉴别](1)取本品约0.1g,置试管底部,管口放一湿润的醋酸铅试纸,加热灼烧试管底部,产生的气体能使醋酸铅试纸显黑色。
(2)取本品约0.1g,溶于温热的稀硫酸中,滴加碘化铋钾试液,即生成红棕色沉淀。
(3)取吸收系数项下的溶液,照紫外-可见分光光度法(附录23页)测定,在295nm的波长处有最大吸收,在277nm的波长处有最小吸收。
(4)本品的红外光吸收图谱应与对照的图谱一致。
如发现在1380cm-1处的吸收峰与对照的图谱不一致时,可取本品适量溶于无水乙醇中,置水浴上蒸干,减压干燥后测定。
[检查] 有关物质取本品,加三氯甲烷-冰醋酸(9:1)溶解并稀释成每1ml中含5.0mg的溶液,作为供试品溶液;精密量取适量,加三氯甲烷-冰醋酸(9:1)稀释成每1ml中含75μg的溶液,作为对照溶液。
照薄层色谱法。
阿苯达唑质量标准

阿苯达唑质量标准
一、性状
阿苯达唑为类白色或微黄色结晶性粉末,无臭,无味。
难溶于水,可溶于乙醇、甲醇等有机溶剂。
二、鉴别
1. 取阿苯达唑适量,加乙醇制成每1ml 含10μg 的溶液,照分光光度法测定,在247nm 的波长处有最大吸收。
2. 取阿苯达唑适量,加乙醇制成每1ml 含5μg 的溶液,照薄层色谱法试验,吸取上述溶液5μl,点于硅胶G薄层板上,以二氯甲烷-甲醇-浓氨试液(50:3:1) 为展开剂,展开后晾干,在碘蒸气中显色,供试品溶液所显主斑点的颜色和位置应与对照品溶液的主斑点相同。
三、含量测定
准确称取适量阿苯达唑,按照药典规定的重量法或滴定法进行含量测定。
四、类别
阿苯达唑属于抗寄生虫药物,用于治疗蛔虫病、蛲虫病等。
五、剂型
阿苯达唑的剂型包括片剂、胶囊剂等。
六、规格
阿苯达唑的规格因剂型不同而异,例如片剂可能有200mg、400mg等不同规格,胶囊剂可能有100mg、200mg等不同规格。
七、贮藏
阿苯达唑应密封保存,置于干燥、阴凉、通风的地方,避免阳光直射。
八、有效期
阿苯达唑的有效期因包装和存储条件而异,通常为24个月至36个月。
在使用过程中,应遵循药品说明书中的用法用量和注意事项,确保安全有效。
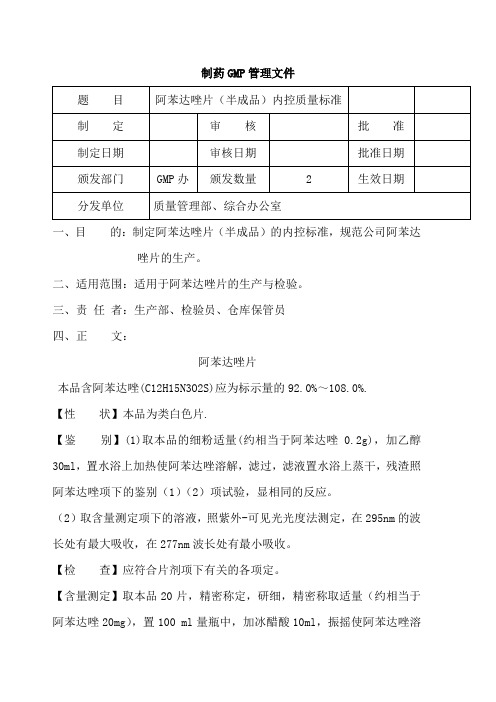
阿苯达唑片(半成品)内控制量标准
制药GMP管理文件
一、目的:制定阿苯达唑片(半成品)的内控标准,规范公司阿苯达
唑片的生产。
二、适用范围:适用于阿苯达唑片的生产与检验。
三、责任者:生产部、检验员、仓库保管员
四、正文:
阿苯达唑片
本品含阿苯达唑(C12H15N3O2S)应为标示量的92.0%~108.0%.
【性状】本品为类白色片.
【鉴别】(1)取本品的细粉适量(约相当于阿苯达唑0.2g),加乙醇30ml,置水浴上加热使阿苯达唑溶解,滤过,滤液置水浴上蒸干,残渣照阿苯达唑项下的鉴别(1)(2)项试验,显相同的反应。
(2)取含量测定项下的溶液,照紫外-可见光光度法测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
【检查】应符合片剂项下有关的各项定。
【含量测定】取本品20片,精密称定,研细,精密称取适量(约相当于阿苯达唑20mg),置100 ml量瓶中,加冰醋酸10ml,振摇使阿苯达唑溶
解,用乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置100ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法,在295nm的波长处测定吸光度,按C12H15N3O2S吸收系数(E1%1㎝)为444计算,即得。
【类别】同阿苯达唑。
【规格】(1)25mg (2)50mg (3)200mg (4)500mg
【贮藏】密封保存。
阿苯达唑片(成品)检验操作规程
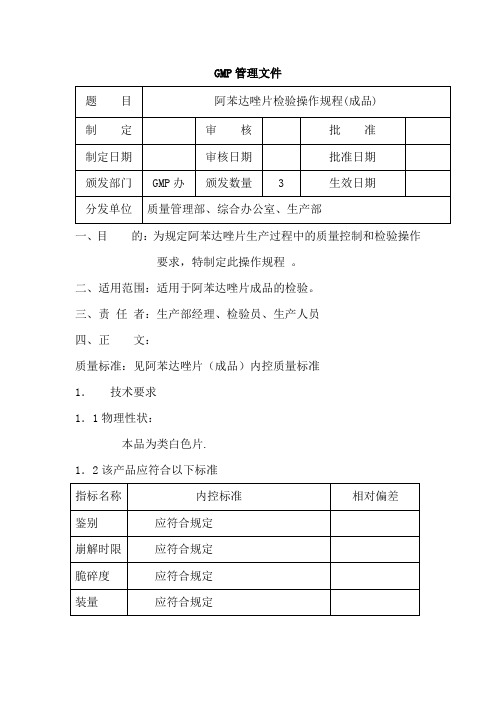
GMP管理文件一、目的:为规定阿苯达唑片生产过程中的质量控制和检验操作要求,特制定此操作规程。
二、适用范围:适用于阿苯达唑片成品的检验。
三、责任者:生产部经理、检验员、生产人员四、正文:质量标准:见阿苯达唑片(成品)内控质量标准1.技术要求1.1物理性状:本品为类白色片.1.2该产品应符合以下标准2.鉴别2.1仪器与用具水浴锅、紫外线-可见光分光光度仪、2.2操作方法(1)取本品的细粉适量(约相当于阿苯达唑0.2g),加乙醇30ml,置水浴上加热使阿苯达唑溶解,滤过,滤液置水浴上蒸干,残渣照阿苯达唑项下的鉴别(1)、(2)项试验,显相同的反应。
(2)取含量测定项下的溶液,照紫外-可见光光度法测定,在295nm 的波长处有最大吸收,在277nm波长处有最小吸收。
3.检查3.1仪器与用具崩解时限检测仪、脆碎度测试仪。
3.2操作方法(1)崩解时限:取供试品6片,分别置吊篮的玻璃管中,启动崩解仪进行检查,各片均应在15分钟内全部崩解。
(2)脆碎度测试:取供试品10片,用吹风机吹去脱落的粉末,精密称重,减失重量不得过1%,且不得检出断裂、龟裂及粉碎的片。
如减失重量超过1%时,应复检2次,3次的平均减失重不得过1%,并不得检出断裂、龟裂及粉碎的片。
4.含量测定4.1仪器与用具分析天平、紫外分光光度计、4.2操作方法取本品20片,精密称定,研细,精密称取适量(约相当于阿苯达唑20mg),置100 ml量瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置100ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法,在295nm的波长处测定吸光度,按C12H15N3O2S吸收系数(E1%1㎝)为444计算,即得。
4.3结果计算A=E﹡C﹡LA为吸光度E为吸收系数,采用的表示方法是E1%1㎝其物理意义为当溶液浓度为1%(g/ml)、液层厚度为1cm时的吸光时的吸光度数值;C为100ml溶液中所含被测物质的重量(按干燥品或无水物计算),gL为液层厚度,cm。
阿苯达唑片质量标准

阿苯达唑片质量标准阿苯达唑片是一种常用的药物,用于治疗消化道溃疡和胃食管反流病。
作为一种重要的药物,其质量标准对于药品的安全性和疗效起着至关重要的作用。
本文将对阿苯达唑片的质量标准进行详细介绍,以期为相关行业提供参考。
一、外观和性状。
阿苯达唑片应为白色或类白色结晶性粉末,无明显气味,味微苦。
在外观上应无异物,无明显不均匀现象。
二、含量测定。
阿苯达唑片的含量应符合国家药典规定,一般来说,含量应在98%至102%之间。
含量测定是保证药物疗效的重要指标,对于药品的稳定性和疗效具有重要意义。
三、溶出度。
阿苯达唑片的溶出度是指在一定时间内,药物溶出的百分比。
溶出度合格范围应在75%至90%之间。
溶出度的合格与否直接关系到药物的释放速度和生物利用度,是药物质量的重要评价指标。
四、纯度。
阿苯达唑片的纯度应符合国家药典规定,杂质含量应在规定范围内。
纯度是药物质量的重要保证,直接关系到药物的安全性和稳定性。
五、微生物限度。
阿苯达唑片的微生物限度应符合国家药典规定,微生物总数、大肠埃希氏菌、金黄色葡萄球菌等指标应符合规定范围。
微生物限度是保证药物无菌的重要指标,对于药品的安全性具有重要意义。
六、贮存。
阿苯达唑片在贮存过程中,应避光、密封、干燥,贮存温度不得超过25摄氏度。
贮存条件的合理与否直接关系到药物的稳定性和有效期,对于药品的质量具有重要影响。
七、包装。
阿苯达唑片的包装应符合国家药典规定,应具有防潮、防污染、防光等功能。
合格的包装能够有效保护药物,延长其有效期,对于药品的质量具有重要作用。
总结:阿苯达唑片作为一种重要的药物,其质量标准对于药品的安全性和疗效具有重要的意义。
各项质量指标的合格与否直接关系到药品的质量和疗效,因此在生产和质量控制过程中,应严格按照国家药典的规定进行质量标准的执行和监控,确保阿苯达唑片的质量符合国家标准,为患者的用药安全提供保障。
阿苯达唑检验记录
复核人: 检验人:
有限公司
原辅料检验记录报告单
文件编号:00第 3 页 共 3 页
原辅料名称
阿苯达唑
检验单号
批 号
供货单位
供货数量
请验单位
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
<<阿苯达唑内控质量标准>>
检验项目 标准规定 检验结果 项目结论
(1)性状应为白色或类白色
有限公司
原辅料检验记录首页
文件编号: 00第 1 页 共 3 页
原辅料名称
阿苯达唑
检验单号
批 号
供货单位
供货数量
请验部门
原辅料库
取样数量
取 样 人
规 格
送检日期
年 月 日
报告日期
年 月 日
检验依据
《阿苯达唑内控质量标准》
性
状
本品应为白色或类白色粉末。检验结果:
熔点:本品的熔点为206-212℃.检验结果:
干燥后瓶+药重W2(g)
计算公式
W1- W2
干燥失重=×100%
W1- W0
干燥失重(%)
平均值(%)
标准规定
减失重量不得过0.5%
项目结论:
炽灼残渣
不得过0.2%。
结果:
检验人: 复核人:
有限公司
原辅料检验记录附页
文件编号: 00 第 2 页 共 3 页
含量测定:阿苯达唑室温 ℃ 湿度 %
滴定液名称:高氯酸滴定液标示浓度0.1mol/L 实际浓度 mol/L
吸收系数:在295nm波长处测定吸光度,吸收系数为430-458.
阿苯达唑混悬剂的研制及其品质控制

阿苯达唑混悬剂的研制及其品质控制党丽梅;崔耀明;冶冬阳;张洁;李会芳;王炫博;李引乾【摘要】[目的]对研制的阿苯达唑混悬剂的品质进行评价,为扩大其临床应用奠定基础.[方法]采用分散法制备阿苯达唑混悬剂,以沉降体积比、再分散性和药物含量等混悬剂药剂学特性为指标,在单因素试验的基础上采用正交试验优选并确定最佳配方,对制备的阿苯达唑混悬剂进行品质评价.[结果]阿苯达唑混悬剂的最佳配方为:每25 mL混悬剂中含有1.75g阿苯达唑,0.3g羧甲基纤维素钠,0.012 5 mL聚山梨酯80,0.3g柠檬酸,0.075 g苯甲酸钠.制备的阿苯达唑混悬剂沉降体积比为0.94,再分散性良好,平均同收率(99.60±1.47)%,变异系数1.48%.[结论]确定的阿苯达唑混悬剂配方的药剂学特性稳定,制备的混悬剂物理稳定性良好,符合混悬剂的品质要求.【期刊名称】《西北农林科技大学学报(自然科学版)》【年(卷),期】2016(044)006【总页数】6页(P40-45)【关键词】阿苯达唑;混悬剂;药物研制;质量控制【作者】党丽梅;崔耀明;冶冬阳;张洁;李会芳;王炫博;李引乾【作者单位】西北农林科技大学动物医学院,陕西杨凌712100;河南牧业经济学院,河南郑州450046;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100;西北农林科技大学动物医学院,陕西杨凌712100【正文语种】中文【中图分类】S859.5+3阿苯达唑(Albendazole,ABZ)为苯并咪唑类广谱抗寄生虫药,是该类药物中驱虫谱较广、作用较强的药物之一,对线虫、吸虫、绦虫均有驱除作用,对包虫、泡球蚴病和细粒棘球蚴病也有较好的疗效,被广泛用于预防和治疗人及动物蛔虫病、钩虫病、鞭虫病、旋毛虫病以及粪类圆线虫病和棘球蚴病[1-4]。
HPLC法测定阿苯达唑胶囊的含量及有关物质

HPLC法测定阿苯达唑胶囊的含量及有关物质
林晨;林伊莉
【期刊名称】《海峡药学》
【年(卷),期】2013(025)011
【摘要】目的建立HPLC法测定阿苯达唑胶囊的含量及有关物质.方法采用HPLC法,以Welch Ultimate XB-C18 (4.6mm×200mm,5μm)为色谱柱;甲醇-水(70∶30)为流动相;流速1.0mL·min-1;检测波长295nm;进样量10μL.结果阿苯达唑线性范围为5.032μg·mL-1 ~15.096 μg·mL-1(r =0.9999);回收率为100.7%(RSD =0.2%,n=9);测定样品有关物质显示有较好的重复性和稳定性,各个杂质与主峰能完全分离,检测限是0.4825ng.结论本文方法简便、准确、快速、专属性好,适合于阿苯达唑胶囊的质量控制.
【总页数】3页(P72-74)
【作者】林晨;林伊莉
【作者单位】福建省药品检验所福州350001;福建中医药大学福州350122【正文语种】中文
【中图分类】R927.2
【相关文献】
1.HPLC法测定肠虫清胶囊中阿苯达唑的含量 [J], 游国叶;樊轻亚;熊大伟
2.HPLC法测定环孢素胶囊及软胶囊的含量及有关物质 [J], 庞文哲;王茉莉;宋更申;韩彬;李香荷;王强
3.HPLC法测定肠虫清胶囊中阿苯达唑的含量 [J], 游国叶;熊大伟
4.HPLC法测定缬沙坦胶囊中缬沙坦的含量及有关物质 [J], 陈莉;刘秀娟;张玉霖
5.HPLC法测定苯唑嗪胶囊中主成分及有关物质的含量 [J], 张英华; 高佳; 陈人萍; 刘卫; 王清; 张炜煜
因版权原因,仅展示原文概要,查看原文内容请购买。
阿苯达唑脂质体口服液质量控制中薄层层析条件的筛选与应用

阿苯达唑脂质体口服液质量控制中薄层层析条件的筛选与应用王建华;林筱琦;陈迹;温浩;孙殿甲;买尔旦【期刊名称】《新疆医科大学学报》【年(卷),期】2001(024)003【摘要】目的:筛选确定阿苯达唑脂质体口服液质量控制中的阿苯达唑、磷脂的薄层层析色谱(TLC)优化条件.方法:采用正交试验设计,碘池显色,计算分离度,根据直观分析和方差统计分析,确定TLC条件.结果:分别确定了TLC分离阿苯达唑脂质体中阿苯达唑及分解产物、磷脂及分解产物的优化条件.结论:此法应用于阿苯达唑脂质体的稳定性和质量考察中,直接点样分离,操作简便,分离效果满意,结果直观可靠.【总页数】3页(P192-194)【作者】王建华;林筱琦;陈迹;温浩;孙殿甲;买尔旦【作者单位】新疆医科大学第一附属医院药剂科,新疆,乌鲁木齐,830054;新疆医科大学第一附属医院药剂科,新疆,乌鲁木齐,830054;新疆医科大学第一附属医院药剂科,新疆,乌鲁木齐,830054;新疆医科大学普外科,新疆,乌鲁木齐,830054;新疆医科大学药学院,新疆,乌鲁木齐,830054;新疆医科大学第一附属医院药剂科,新疆,乌鲁木齐,830054【正文语种】中文【中图分类】R978.6;R96【相关文献】1.薄层层析法在产海藻糖合酶菌株筛选中的应用研究 [J], 谭海刚2.薄层层析-生物自显影法筛选油菜蜂花粉中活性成分 [J], 孙丽萍;杜夏;徐响;董捷;安仲姚;杨佳林3.阿苯达唑与脂质体应用在绵羊肝包虫病治疗中的效果研究 [J], 图尔浑·阿卜杜赛麦提4.薄层层析法测定保健食品口服液中罂粟壳 [J], 吕玉琼5.薄层层析-干柱层析技术在分离制备石油生物标志物——卟啉中的应用 [J], 陈培榕;王志杰;郭建林;廖志勤;黄第藩因版权原因,仅展示原文概要,查看原文内容请购买。
06025 阿苯达唑伊维菌素粉成品内控质量标准

广西农大康园生物药品有限公司GMP管理文件一目的:制定阿苯达唑伊维菌素粉成品的内控质量标准,规范公司阿苯达唑伊维菌素粉的生产。
二标准依据:《兽药国家标准汇编》—兽药地方标准上升国家标准(第一册)三适用范围:适用于阿苯达唑伊维菌素粉成品的质量检查。
四责任者:质量部经理、检验员、仓管员。
五正文:阿苯达唑伊维菌素粉Abendazuo Yiweijunsu FenAlbendazole and Ivermectin Powder本品为阿苯达唑(C12H15N3O2S)与伊维菌素(H2B1a+H2B1b)均应为标示量的92.0%~108%。
【性状】本品为白色或类白色粉末。
【鉴别】(1)取阿苯达唑含量测定项下溶液,照紫外-可见分光光度法(附录23页)测定,在295nm的波长处有最大吸收,在277nm波长处有最小吸收。
(2)在伊维菌素含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
【检查】干燥失重取本品,在105℃干燥至恒重,减失重量不得过8.0%(附录69页)。
粒度本品应全部通过五号筛。
外观均匀度取本品2g,置光滑纸上,平铺5c㎡,将其表面压平,在亮的背景下观察,应呈均匀的色泽、无花纹与色斑。
装量按最低装量检查法检查,应符合规定。
【含量测定】阿苯达唑取本品适量(约相当于阿苯达唑20mg),精密称定,置100ml量瓶中,加冰醋酸10ml,振摇使阿苯达唑溶解,用乙醇稀释至刻度,摇匀,滤过,精密量取续滤液5ml,置另一100 ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法,在295nm的波长处测定吸光度,按C12H15N3O2S 的吸收系数(E cm%11)为444计算,即得。
伊维菌素照高效液相色谱法测定。
色谱条件及系统适用性试验用十八烷基硅烷键合硅胶为填充剂,乙睛-甲醇-水(56:28:16)为流动相,检测波长为245nm。
理论板数按伊维菌素H2B1a峰计算不低于2000,伊维菌素H2B1a与H2B1b峰的分离度应符合要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制药GMP管理文件
一、目的:制定阿苯达唑的内控标准,规范公司阿苯达唑的采购与使
用。
二、适用范围:适用于阿苯达唑的采购与验收。
三、责任者:生产部、检验员、仓库保管员
四、正文:
阿苯达唑
本品为5-(丙硫基)-2-苯并咪唑-氨基甲酸甲酯.按干燥品计算,含C12H15N3O2S不得少于98.5%,
【性状】本品为白色或类白色粉末;无臭,无味.
本品在丙酮或三氯甲烷中微溶,在乙醇中几乎不溶,在水中不溶;在冰醋酸中溶解.
溶点本品的熔点为206~212℃,熔融时同时分解。
吸收系数取本品约10mg,精密称定,置100ml量瓶中,加冰醋酸5ml 溶解后,加乙醇稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用乙醇稀释至刻度,摇匀,照紫外-可见分光光度法,在295nm的波长处测定吸光度,吸收系数(E1%1㎝)为430~458。
【鉴别】(1)取本品约0.1g,置试管底部,管口放一湿润的醋酸铅试纸,加热灼烧试管底部,产生的气体能使醋酸铅试纸显黑色.
(2)取本品约0.1 g,溶于微温的稀硫酸中,滴加碘化铋钾试液,即生成红
棕色沉淀.
(3)取吸收系数项下的溶液,照紫外-可见分光光度法测定,在295nm的波长处有最大吸收,在277nm的波长处有最小吸收.
(4)本品的红外光吸收图谱应与对的照图一致.如发现在1380㎝-1处的吸收峰与对照的图谱不一致时,可取本品适量溶于无水乙醇中,置水浴上蒸干,减压干燥后测定.
【检查】有关物质取本品,加三氯甲烷-冰醋酸(9:1)溶解并稀释成每1 ml中含5.0mg的溶液,作为供试品溶液;精密量取适量,加三氯甲烷-冰醋酸(9;1)稀释成每1ml中含75ug的溶液,作为对照溶液。
照薄层色谱法试验,吸取上太守两种溶液各5ul,分加紧点于同一硅胶G薄层板上,以三氯甲烷-乙醚-冰醋酸(30:7:30)为展开剂,展开,晾干,立即置紫外光灯(254nm)下检视。
供试品溶液如显杂质斑点,其荧光强度与对照溶液的主斑点比较,不得更强。
干燥失重取本品,在105℃干燥至恒重,减失重量不得过0.5%.
炽灼残渣不得过0.2%.
铁盐取炽灼残渣项下遗留的残渣,加盐酸2ml,置水浴上蒸干,再加稀盐酸4ml,微温溶解后,加水30ml与过硫酸铵50mg,依法检查,与标准铁溶液3.0ml制成的对照液比较,不得更深(0.0030%).
【含量测定】取本品约0.2g,精密称定,加冰醋酸20ml溶解后,加结晶紫指示液1滴,用高氯酸滴定液(0.1mol/l)滴定至溶液显绿色,并将滴定
的结果用空白试验校正。
每1ml高氯酸滴定液(0.1mol/l)相当于26.53mg的C12H15N3O2S.。
