总黄酮、多酚含量的测定
菊花总黄酮_多酚及水浸出物含量分析

线计算出总黄酮含量。 1.2.3 菊花多酚含量检测方法
(1)供试液制备:精确称取菊花样品 2.50 g,移入 250 mL 三角锥瓶中,250 mL 沸水浸提 10 min,每隔 3 min 摇晃 1 次,中途搅拌 2 次,减压过滤,蒸馏水洗涤 滤渣数次,滤液定容至 250 mL 容量瓶中,即为供试液。
酮含量和怀菊总黄酮含量的 RSD 值都小于 5%,且前 者 比 后 者 高 ;二 者 占 水 浸 出 物 的 含 量 ,分 别 是 10.21% 、13.74% 。 段 崇 霞 报 道 的 杭 菊 总 黄 酮 含 量 为 30.17 mg/g,而笔者测得的杭菊含量为 51.76 mg/g,可 能由分析检测的原料不同所致。另外,与段崇霞 、 [7] 汪民海[8]、芦金清[9]、杨铭[10]等报道的贡菊、滁菊、亳菊、
有治疗心血管疾病、抗氧化以及抗肿瘤等多种药理功 效[1-3]。多酚类物质是总黄酮类化合物中的一类主要功 能活性物质,在自然界分布非常广泛,具有抗氧化、抗 衰老、抗肿瘤、防治心脑血管疾病等多种药理功能,但 菊花中多酚物质的含量测定未见报道。此文选取杭菊 和怀菊两类有代表性的菊花,对其总黄酮含量、多酚含 量及水浸出物总量进行测定与分析,可为菊花功能活
出物含量分别为(506.90±2.56) mg/g、(493.80±2.63) mg/g,RSD 分别为 0.51%、0.53%,该研究结论可为菊
花功能活性成分的提取及综合利用提供理论依据。
关键词:菊花;总黄酮;多酚;水浸出物;含量
中图分类号:S3
文献标志码:A
论文编号:2009-2483
Content Analysis of the Flavonoids, Polyphenols and Water-extracts in Chrysanthemum Zhang Jianyong1, Jiang Heyuan1, Yuan Xinyue2, Yao Yu2, Liu Hongyun1, Cui Hongchun2
保健食品 总黄酮测定方法

保健食品总黄酮测定方法
保健食品是指具有保健功能的食品,其中总黄酮是一种常见的保健成分。
总黄酮是指一类具有黄酮骨架结构的化合物,包括黄酮类、异黄酮类、花青素类等多种物质。
总黄酮具有抗氧化、抗炎、抗癌等多种保健作用,因此被广泛应用于保健食品中。
为了保证保健食品中总黄酮的含量符合标准,需要进行总黄酮测定。
总黄酮测定方法主要有两种:分光光度法和高效液相色谱法。
其中,分光光度法是一种简单、快速、经济的测定方法,适用于大批量样品的测定。
该方法的原理是利用总黄酮与铝离子形成络合物,使样品溶液的吸光度增加,从而测定总黄酮的含量。
该方法的操作简单,但对样品的前处理要求较高,需要去除干扰物质,否则会影响测定结果的准确性。
高效液相色谱法是一种准确、灵敏、选择性好的测定方法,适用于复杂样品的测定。
该方法的原理是利用高效液相色谱仪对样品中的总黄酮进行分离和检测。
该方法的优点是测定结果准确可靠,但需要较长的分析时间和较高的仪器成本。
总黄酮测定方法的选择应根据实际情况进行,以保证测定结果的准确性和可靠性。
同时,保健食品生产企业应严格按照国家标准进行总黄酮含量的测定,确保产品质量符合标准,保障消费者的健康。
总黄酮含量检测
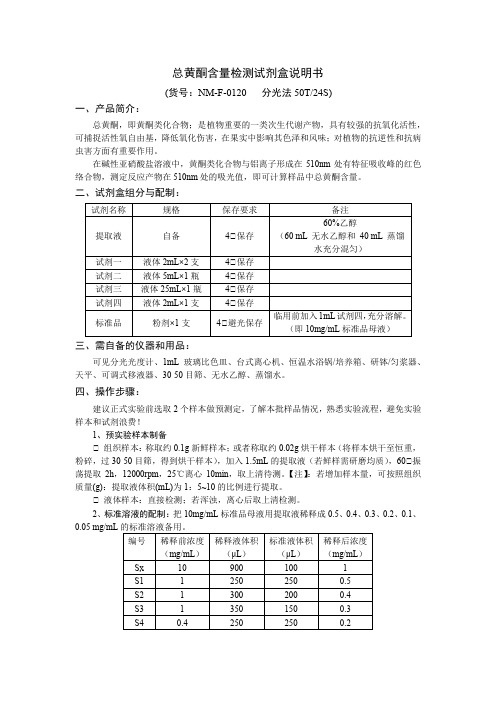
总黄酮含量检测试剂盒说明书(货号:NM-F-0120 分光法50T/24S)一、产品简介:总黄酮,即黄酮类化合物;是植物重要的一类次生代谢产物,具有较强的抗氧化活性,可捕捉活性氧自由基,降低氧化伤害,在果实中影响其色泽和风味;对植物的抗逆性和抗病虫害方面有重要作用。
在碱性亚硝酸盐溶液中,黄酮类化合物与铝离子形成在510nm处有特征吸收峰的红色络合物,测定反应产物在510nm处的吸光值,即可计算样品中总黄酮含量。
二、试剂盒组分与配制:三、需自备的仪器和用品:可见分光光度计、1mL玻璃比色皿、台式离心机、恒温水浴锅/培养箱、研钵/匀浆器、天平、可调式移液器、30-50目筛、无水乙醇、蒸馏水。
四、操作步骤:建议正式实验前选取2个样本做预测定,了解本批样品情况,熟悉实验流程,避免实验样本和试剂浪费!1、预实验样本制备℃ 组织样本:称取约0.1g新鲜样本;或者称取约0.02g烘干样本(将样本烘干至恒重,粉碎,过30-50目筛,得到烘干样本),加入1.5mL的提取液(若鲜样需研磨均质),60℃振荡提取2h,12000rpm,25℃离心10min,取上清待测。
【注】:若增加样本量,可按照组织质量(g):提取液体积(mL)为1:5~10的比例进行提取。
℃ 液体样本:直接检测;若浑浊,离心后取上清检测。
2、标准溶液的配制:把10mg/mL标准品母液用提取液稀释成0.5、0.4、0.3、0.2、0.1、0.05 mg/mL3、预实验上机操作:℃ 可见分光光度计预热30min以上,调节波长至510nm,蒸馏水调零。
4、正式实验:℃ 若预实验测定吸光值超出标准吸光值线性范围:高于最高值建议将待测样本用提取液适当稀释后再进行测定,低于最低值建议适当增加样本质量W后再进行测定,并将改变后的W和D代入公式计算;℃ 确定好最适实验条件后,正式实验样本制备同预实验样本制备;℃ 正式实验按照预实验上机操作步骤进行(标准管和空白管预实验已做,正式实验可选做)。
总黄酮的含量测定方法

总黄酮的含量测定方法
总黄酮的含量测定方法主要包括以下几种:
1. 酸性条件下的比色法:将样品与酸反应生成有色化合物,测定其吸光度。
如盐酸或硫酸与总黄酮反应生成有色化合物,可通过紫外可见光谱测定吸光度,进而计算总黄酮的含量。
2. 高效液相色谱法(HPLC):使用高效液相色谱仪进行分离和测定。
通过采用特定的色谱柱和流动相,分离出总黄酮,并通过检测器测定其峰面积或峰高值,并与已知标准品进行比较,计算样品中总黄酮的含量。
3. 薄层色谱法:将总黄酮的样品与色谱载体共同涂布在薄层板上,通过色谱柱法进行有效分离。
然后,利用染色剂,如硼酸或铝酸盐等,在紫外或可见光下观察或测定样品斑点的强度,从而计算总黄酮的含量。
4. 毛细管电泳法:通过毛细管电泳仪将总黄酮进行分离,并通过测定峰面积或峰高值,配合已知标准曲线,计算总黄酮的含量。
需要注意的是,不同样品中总黄酮的化学结构和含量可能存在差异,因此在选择测定方法时应根据具体的样品特性和仪器设备的可用性做出选择。
红河州13种食用花卉的总黄酮、总多酚含量测定

红河州13种食用花卉的总黄酮、总多酚含量测定严和平;洪亮;徐进诺;罗玉芹;陈雅顺;许春;欧朝凤;张举成【摘要】采用乙醇热提法对红河州13种食用花卉进行总黄酮和总多酚的提取.以NaNO2-Al(NO3)3-NaOH为显色体系,利用双波长分光光度法,测定总黄酮含量;以Folin-phenol试剂为显色剂,测定总多酚含量.结果表明:13种食用花卉中均含有黄酮和多酚类化合物.总黄酮含量顺序是:桂花(23.93 %)>黄饭花(6.51 %)>棠梨花(3.93 %)>猫屎花(3.43 %)>玉荷花(2.08 %)>鸡屎臭药花(2.04 %)>帘子藤花(1.77 %)>芭蕉花(1.75 %)>石榴花(1.63 %)>马桑花(0.81 %)>菊花(0.64 %)>金雀花(0.52 %)>苦刺花(0.22 %).总多酚含量顺序是:石榴花(13.16 %)>桂花(10.83 %)>棠梨花(5.34 %)>猫屎花(4.94 %)>黄饭花(3.81 %)>鸡屎臭药花(3.23 %)>玉荷花(3.13 %)>帘子藤花(2.61 %)>芭蕉花(2.34 %)>菊花(1.31 %)>金雀花(1.11 %)>马桑花(1.08 %)>苦刺花(0.83 %).桂花的总黄酮含量最高,石榴花的总多酚含量最高,苦刺花的黄酮和多酚含量均最低.%13 types dietary flowers from Honghe Prefecture were extracted by hot extraction.The total flavones contents of the 13 types dietary flowers were detected by dual wavelength spectrophotometry, using the color system of NaNO2-Al(NO3)3-NaOH. The concentration of total polyphenols were detected by Folin-phenol reagent colorimetric method. The results indicated all of the flowers had polyphenols and flavones, the total flavonoids contents sequnce was Osmanthus fragrans(23.93 %)>Buddleja officinalis(6.51 %)>Pyrus pashia (3.93 %)>Gnaphalium affine(3.43 %)>Bauhinia purpurea(2.08 %)>Valeriana officinalis(2.04 %)>Clematis chinensis Osbeck(1.77 %)>Musasapientum(1.75 %)>Punica granatum(1.63 %)>Morus alba(0.81 %)>Chrysanthemum morifolium(0.64 %)>Caraganasinica(0.52 %)>Sophora davidii(0.22 %).The total polyphenols contents sequnce wasP.granatum(13.16 %)>O.fragrans(10.83 %)>P.pashia(5.34 %)>G.affine(4.94 %)>B.officinalis(3.81 %)>V.officinalis(3.23 %)>B.purpurea(3.13 %)>C.chinen sis Os-beck(2.61 %)>M.sapientum(2.34 %)>C.morifolium(1.31 %)>C.sinica(1.11 %) >M.alba(1.08 %)>S. davidii(0.83 %).The content of total flavones inO.fragrans was the highest and the total polyphenols in P. granatum was the highest,but the flavones and polyphenols in S.davidii were the lowest.【期刊名称】《食品研究与开发》【年(卷),期】2018(039)009【总页数】6页(P142-147)【关键词】食用花卉;总黄酮;总多酚;含量测定;红河州【作者】严和平;洪亮;徐进诺;罗玉芹;陈雅顺;许春;欧朝凤;张举成【作者单位】红河学院理学院,云南蒙自661199;云南省天然药物与化学生物学重点实验室,云南蒙自661199;红河学院生命科学与技术学院,云南蒙自661199;红河学院理学院,云南蒙自661199;红河学院理学院,云南蒙自661199;红河学院理学院,云南蒙自661199;云南省天然药物与化学生物学重点实验室,云南蒙自661199;红河学院理学院,云南蒙自661199;云南省天然药物与化学生物学重点实验室,云南蒙自661199;浙江环茂自控科技有限公司,浙江杭州310051;红河学院理学院,云南蒙自661199;云南省天然药物与化学生物学重点实验室,云南蒙自661199【正文语种】中文云南拥有中国二分之一的植物资源,是植物资源极为丰富的“天然花园”。
总黄酮总酚含量测定方法

太行菊的抗氧化活性试验计划1. 实验内容对太行菊的甲醇提取物的乙醇、正己烷、二氯甲烷、乙酸乙酯、正丁醇、水共六种萃取物进行总酚、总黄酮含量的测定,分析实验结果,选择总分和总黄酮含量比较高的两个层分进行抗氧化能力测定,分析其抗氧化能力强弱,判断其有无研究价值。
用Folin-Denis法测定太行菊甲醇提取物各萃取层组分的总酚含量,以没食子酸作为标准品进行对照。
用三氯化铝法测定太行菊各萃取层组分的总黄酮含量,以槲皮素作为标准品进行对照。
根据实验结果,选择总酚和总黄酮含量较高的萃取层组分进行抗氧化能力测定,包括DPPH自由基清除能力测定,羟基自由基清除能力测定,还原能力测定。
2.实验步骤将太行菊用甲醇溶液回流提取其有效成分,旋转浓缩后用水溶解,然后分别用正己烷、二氯甲烷、乙酸乙酯、正丁醇萃取、水层,得相应层的馏分。
2.1总酚含量测定:在试管中分别加入不同层样品(1mg/ml)0,25ml +Folin-Denis 试剂0.5ml ,5min后,再加入Na2CO3饱和溶液0.5ml,并做三组重复。
对照组中样品和Folin-Denis试剂用DW代替,其他不变。
空白组中Folin-Denis试剂用DW代替,其他不变。
在760nm紫外光下测定吸光度。
对实验结果处理后做标准曲线,以没食子酸为标准品。
以没食子酸的微克数表示总酚含量:吸光度=0.0069 μg没食子酸-0.042。
Folin-Denis试剂的配制:在2L烧瓶中加入750ml蒸馏水,再加入100g钨酸钠和20g磷钼酸,再加入50ml正磷酸回流2h, 冷却后装入1L容器内置于暗处实验组*3:体积Folin-Denis的体积Na2CO3MEOH层0.25ml 0.5ml 0.5mlH层0.25ml 0.5ml 0.5mlCH层0.25ml 0.5ml 0.5mlEA层0.25ml 0.5ml 0.5mlBUOH层0.25ml 0.5ml 0.5mlW层 1 2 2对照组*3:DW DW Na2CO3体积0.25ml 0.5ml 0.5ml空白组*3:体积DW的体积Na2CO3MEOH层0.25ml 0.5ml 0.5 mlH层0.25ml 0.5ml 0.5 mlCH层0.25ml 0.5ml 0.5mlEA层0.25ml 0.5ml 0.5mlBUOH层0.25ml 0.5ml 0.5 mlW层0.25ml 0.5ml 0.5ml2.2总黄酮含量测定:在试管中分别加入不同层样品(1mg/ml) 0.5ml + 1M CH3COOK溶液0.1ml + DW 2.8ml + 95%乙醇 1.5ml + 10% AlCl3·6H2O溶液0.1ml,并做三组重复。
紫外分光光度法测定市售檀香中总黄酮含量

紫外分光光度法测定市售檀香中总黄酮含量
紫外分光光度法是一种常用的分析化学方法,可以用于测定市售檀香中总黄酮的含量。
总黄酮是指植物中具有类黄酮结构的化合物,具有很强的抗氧化活性和生物活性。
测定总黄酮含量的步骤如下:
1. 仪器准备:准备紫外分光光度计和试剂,包括紫外可见光谱仪、量瓶、玻璃管、
比色皿、乙醇、二氧化硅溶胶、含有总黄酮的标准溶液。
2. 标准曲线的绘制:准备一系列浓度不同的总黄酮标准溶液,使用紫外可见光谱仪
在特定的波长下测定各个浓度标准溶液的吸光度,并将吸光度值作为纵坐标,浓度作为横
坐标,绘制标准曲线。
3. 样品制备:将市售檀香样品研磨成细粉,取约0.5克样品,用乙醇进行提取,使样品与溶剂充分接触,摇匀,并静置一段时间。
4. 执行测定:将提取液定容至100毫升,用比色皿进行测试。
对于提取液,使用紫外可见光谱仪在与标准曲线相同的特定波长下,测定样品的吸光度。
5. 计算样品中总黄酮的含量:根据标准曲线,计算样品中总黄酮的浓度,并以毫克/
克表示。
需要注意的是,在测定过程中,应注意避免阳光直射,以及其他光源对结果的影响。
还应注意操作的准确性和仪器的正确使用。
紫外分光光度法是一种简单、快速、准确的测试总黄酮含量的方法,被广泛应用于食品、药品和化妆品等行业的质量控制和研究中。
它可以为檀香的质量评价提供重要的参考
依据。
亚贡叶中总黄酮及总酚酸的含量测定

亚贡叶中总黄酮及总酚酸的含量测定背景作为食品和药品等领域的常用添加剂,总黄酮和总酚酸广受关注。
亚洲人民喜欢饮用茶水,茶叶中富含黄酮类和酚酸类物质。
亚贡叶是一种茶树的近亲,也含有丰富的总黄酮和总酚酸。
因此,对于亚贡叶中总黄酮及总酚酸的含量测定具有一定的研究意义。
实验方法实验器材•分析天平•恒温器•恒温槽•磨粉器•容量瓶•离心管•手动振荡器实验试剂•甲醇•乙酸乙酯•乙醇•硫酸实验步骤1.用磨粉器将亚贡叶制成细粉末,称取一定量置于离心管中。
2.加入甲醇,并振荡30分钟,放置15分钟静置。
3.经离心制成沉淀,加入乙酸乙酯,并振荡,再静置15分钟。
4.取上层液体移到新的烧杯中。
5.将离心管里的沉淀放到容量瓶内,加入乙酸乙酯,振荡10分钟,用乙酸乙酯补充至刻度线。
6.将乙酸乙酯提取液过滤,取一部分蒸干。
7.取一定量蒸干物质加入乙醇,振荡,放置15分钟。
8.将液体放到新的烧杯中。
9.取一部分乙醇液体移动到离心管中,加入硫酸,振荡2分钟,放置15分钟静置。
10.取上层液体移到新的离心管中,弃去底部混浊物质。
11.将液体移动到新的烧杯中并蒸干。
12.用甲醇溶解蒸干的物质。
13.用分析天平,分别对总黄酮和总酚酸量进行测定。
结论根据实验结果,亚贡叶中总黄酮的含量为 X 毫克/克,总酚酸的含量为 Y 毫克/克。
实验过程中,需要注意样品的制备和测量方法。
由于各种因素的干扰,需要重复多次实验,取平均值来得出较为准确的数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
燕麦总黄酮含量的测定
一、仪器
紫外-可见分光光度计、分析天平、低速离心机、超声波提取器、恒温水浴锅、粉碎机、pH计、10mL容量瓶15个、10mL具塞试管、100mL烧瓶、10mL离心管10个、试管架2个
二、药品
芦丁标准品40mg、无水乙醇1000mL、亚硝酸钠500g、硝酸铝500g、NaOH 500g 三、实验步骤
(一)、样品处理及总黄酮的提取
1. 将样品籽粒分别称取
2.5 g置于小信封里,80℃烘干24 h。
2. 研成粉末,称取500±2 mg样品于10 mL离心管中,使样品位于试管底部(重复3次)。
3. 每管加4 mL 60%乙醇,放水浴锅60℃浸提2 h。
6000 r/min离心10 min,离心后取上清液于10 mL容量瓶中。
4. 再向离心管中加4 mL的60%乙醇,放水浴锅60℃浸提1 h。
6000 r/min离心10 min,离心后取上清液于相应的10 mL容量瓶中。
60%乙醇定容至10 mL,待测。
(二)、标准曲线绘制
1. 精确量取浓度200 µg/mL芦丁标准溶液0、0.2、0.4、0.8、1.2、1.6、
2.0 mL 分别置于10 mL容量瓶中。
2. 向容量瓶中分别加60%乙醇5、4.8、4.6、4.2、
3.8、3.4、3.0 mL。
3. 然后加5%亚硝酸钠0.3 mL,摇匀,静置6 min。
4. 再加10%硝酸铝0.3 mL,摇匀,静置6 min。
5. 加4%氢氧化钠4.0 mL,用60%的乙醇定容至刻度,摇匀,静置12 min。
6. 于510 nm波长下测定吸光度,并以芦丁标准浓度值为纵坐标,以吸光度为横坐标,绘制标准曲线。
(三)、样品提取液总黄酮含量的测定
准确吸取总黄酮提取液2.0 mL于10 mL容量瓶中,按二的方法测定吸光度,
将吸光度代入标准曲线计算样液的总黄酮含量。
燕麦总酚含量的测定
一、仪器
紫外-可见分光光度计、分析天平、低速离心机、恒温水浴锅、粉碎机、pH计、微波炉、回流装置、25mL容量瓶、25mL具塞试管、250mL烧瓶
二、药品
没食子酸标准品100mg、无水乙醇1000mL、无水碳酸钠500g、盐酸500mL、福林酚试剂100 mL
三、实验步骤
(一)、样品总酚的提取
称取2.0g粉碎的燕麦粉于250 mL烧瓶中,加入40 mL体积分数60%的乙醇溶液,提取液中盐酸含量0.024%,搅拌均匀,在恒温水浴锅中安置好回流装置,水浴温度75℃,提取50 min。
提取液以3000 r/min离心20 min,取上清液,量取提取液体积,采用福林酚法测定燕麦提取液的总多酚浓度。
(二)、标准曲线绘制和样品总酚含量的测定
精确称量没食子酸标准品25 mg,用水溶解后定容于250 mL容量瓶中,得到0.1 mg/mL的标准贮备溶液。
分别移取没食子酸标准储备溶液0.00、0.25、0.50、0.75、1.00、1.25、1.50 mL置于25 mL具塞试管中,分别加入福林酚试剂1 mL,摇匀后再分别加入质量分数12% Na2CO3溶液2 mL,用水定容至25 mL,摇匀。
平行三组。
室温下避光反应2 h后,在765 nm波长下测定吸光度。
以没食子酸标准溶液的浓度为横坐标,以吸光度为纵坐标,制作标准曲线。
吸取1.00 mL燕麦总多酚提取液于25 mL具塞试管中,分别加入福林酚试剂1 mL及质量分数为12%的碳酸钠溶液2 mL并定容至刻度,在室温下避光反应2 h,在765 nm波长处测定样品的吸光度,并根据工作曲线来计算提取液中的燕麦总多酚含量。
