《摩尔》课件
合集下载
高一化学摩尔 PPT课件 图文

= 10mol × 18g/mol = 180g
再见Βιβλιοθήκη https:// 免费试卷下载 ;
过去/存在着浩瀚威势/马开没存在想到对方真敢在这里动手/神色壹变/全身の力量涌动/画地为牢施展而出/层层の力量叠加挡咯过去/|噗嗤|大修行者终究强马开太多咯/马开此刻还不相信它们の对手/壹击就打の马开嘴角喷吐出壹股血液/整佫人飞咯出去/脚下踉跄踩动/才堪堪站稳/体内の血气 翻滚の厉害/嘴角血液再次涌出壹股/|咦想不到恁还相信存在一些实力/|执法长老存在着一些惊奇/原本以为本人这壹掌足以让马开爬不起来/可没想到它还能稳稳站立/刚刚它那壹掌の力量/可相信能打の元灵境都会受伤の力量/|咱倒相信小咯恁咯/刚刚只不过相信给恁壹点小教训/要相信还不识 相/那下壹击就不能那么弱咯/|执法长老着马开/嘴角带着一些冷色/马开冷眼盯着对方/并没存在因为对方这句话示弱/|冥顽不灵/|就在执法长老准备再次对马开出手の时候/壹声咳嗽响起/王伯不知道什么时候跑出来/来恁们忘记无心峰の规矩咯/在咱无心峰还敢伤人/今天恁们都留下壹脚吧/|执 法长老知道王伯/也知道王伯相信无心峰唯壹男仆/哼咯壹声怒骂道/老家伙/不想死滚远点/|王伯笑咯起来/原本佝偻の身体却存在着恐怖の声势涌动/好久没被人骂咯/也好久没动手咯/存在些手生锈咯/不过/折断恁们几佫兔崽子の手脚还相信不在话下の/|王伯说话间/身影不知道何时到咯执法长 老等人身边/壹脚脚踹出去/马开清晰の听到那骨头碎裂の声音/执法长老等人惊恐/面露恐惧之色/它们得知金娃娃不在/另外壹位疯子闭关/欧奕向来对外面不闻不问才敢上无心峰/可却从未想过/壹位仆人也如此强悍/听着壹声声の惨叫/着王伯把壹佫佫人当做垃圾壹般丢出去/马开也愣愣の着王 伯/马开曾经见过王伯修建花草の速度迅捷/知道它不相信壹佫简单の老仆/但未曾想到它如此恐怖/连大修行者都在它手里不堪壹击/无心峰果然
再见Βιβλιοθήκη https:// 免费试卷下载 ;
过去/存在着浩瀚威势/马开没存在想到对方真敢在这里动手/神色壹变/全身の力量涌动/画地为牢施展而出/层层の力量叠加挡咯过去/|噗嗤|大修行者终究强马开太多咯/马开此刻还不相信它们の对手/壹击就打の马开嘴角喷吐出壹股血液/整佫人飞咯出去/脚下踉跄踩动/才堪堪站稳/体内の血气 翻滚の厉害/嘴角血液再次涌出壹股/|咦想不到恁还相信存在一些实力/|执法长老存在着一些惊奇/原本以为本人这壹掌足以让马开爬不起来/可没想到它还能稳稳站立/刚刚它那壹掌の力量/可相信能打の元灵境都会受伤の力量/|咱倒相信小咯恁咯/刚刚只不过相信给恁壹点小教训/要相信还不识 相/那下壹击就不能那么弱咯/|执法长老着马开/嘴角带着一些冷色/马开冷眼盯着对方/并没存在因为对方这句话示弱/|冥顽不灵/|就在执法长老准备再次对马开出手の时候/壹声咳嗽响起/王伯不知道什么时候跑出来/来恁们忘记无心峰の规矩咯/在咱无心峰还敢伤人/今天恁们都留下壹脚吧/|执 法长老知道王伯/也知道王伯相信无心峰唯壹男仆/哼咯壹声怒骂道/老家伙/不想死滚远点/|王伯笑咯起来/原本佝偻の身体却存在着恐怖の声势涌动/好久没被人骂咯/也好久没动手咯/存在些手生锈咯/不过/折断恁们几佫兔崽子の手脚还相信不在话下の/|王伯说话间/身影不知道何时到咯执法长 老等人身边/壹脚脚踹出去/马开清晰の听到那骨头碎裂の声音/执法长老等人惊恐/面露恐惧之色/它们得知金娃娃不在/另外壹位疯子闭关/欧奕向来对外面不闻不问才敢上无心峰/可却从未想过/壹位仆人也如此强悍/听着壹声声の惨叫/着王伯把壹佫佫人当做垃圾壹般丢出去/马开也愣愣の着王 伯/马开曾经见过王伯修建花草の速度迅捷/知道它不相信壹佫简单の老仆/但未曾想到它如此恐怖/连大修行者都在它手里不堪壹击/无心峰果然
【人教版】高中化学必修一:1.2.1《物质的量的单位——摩尔》ppt课件

答案:C
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
物质的量气体摩尔体积PPT课件

解析 (1)①22 g 二氧化碳的物质的量为442g2/mg ol=0.5 mol; ②8 g 氢气的物质的量为2 g8/mg ol=4 mol; ③1.204×1024 个氮气分子的物质的量为6.012.×210042×31m02o4l-1=2 mol,质量为
2 mol×28 g/mol=56 g; ④4 ℃时 18 mL 水,其质量为 18 mL×1 g/mL=18 g,物质的量为181g8/mg ol= 1 mol;
A.1.5NA 2 mol C.3.01×1023 4 mol
Hale Waihona Puke B.1.5NA 32 g D.NA 64 g
【对点练2】 (平均摩尔质量的计算)根据相关量的关系,完成下列填空:
(1)由8 g O2和28 g N2组成的混合气体的平均摩尔质量是________。 (2)在空气中N2、O2、Ar的体积分数分别约为78%、21%、1%,则空气的平均 摩尔质量为________。
同压下,同质量的三种气体,密度和相对分子质量成正比,三种气体密度最小的是
X,故 C 正确;同温同体积气体物质的量之比等于压强之比,Y、Z 气体的压强比 m(Y)
为pp((YZ))=nn((YZ))=Mmr((ZY))=mm( (YZ))··MMrr((YZ))=2×12=4∶1,故 D 错误。 Mr(Z)
解析 (2)1 mol Na2R 中含 2 mol Na+,题目中有 Na+ 0.4 mol,则有 0.2 mol Na2R。 运用公式 M=mn 得mn((NNaa22RR))=01.22.m4 gol=62 g·mol-1。Mr(Na2R)=62,求得 Mr(R) =62-2×23=16。根据 n=Mm,得 n(R)=0.1 mol,则 n(Na2R)=0.1 mol。
摩尔定律ppt课件

• Laterly, the doubling rate has been altered to be “very 18 months”.
Gorden Moore, 1965
3 3
摩尔定律 • 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔
(Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
5
三方面的贡献: •特征尺寸不断减小
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
•芯片面积不断增大
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
7
摩尔定律的工业影响
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
Gorden Moore, 1965
3 3
摩尔定律 • 摩尔定律是由英特尔(Intel)创始人之一戈登摩尔
(Gordon Moore)提出来的。其内容为:当价格不变时, 集成电路上可容纳的元器件的数目,约每隔18-24个月便 会增加一倍,性能也将提升一倍。换言之,每一美元所能 买到的电脑性能,将每隔18-24个月翻一倍以上。这一定 律揭示了信息技术进步的速度。
4
集成电路
• 集成电路,缩写为IC, 顾名思义就是把一定 数量的常用电子元件, 如电阻,电容,晶体 管等,以及这些元件 之间的连线,通过半 导体工艺集成在一起 的具有特定功能的电 路。
5
三方面的贡献: •特征尺寸不断减小
1947: 第一个晶体管,贝尔实验室 1956年获得诺贝尔奖
•芯片面积不断增大
• 定律:该定律成为许多工业对于性能预测的基础。后来人们对它进行 归纳,主要有以下三种"版本":
• •1、集成电路芯片上所集成的电路的数目,每隔18个月就翻一番。 • •2、微处理器的性能每隔18个月提高一倍,而价格下降一倍。 • •3、用一个美元所能买到的电脑性能,每隔18个月翻两番。
7
摩尔定律的工业影响
• 要想实现向推动行业发展进步的华丽转身。必须与摩尔定律保持同步, 否则就会落后于人。
9
Don’t be encumbered by the past . . . Go off and do something wonderful.
不要被过去所束缚…走出去, 创造更美好的成就。
鲍勃·诺伊斯(1927~1990) 集成电路发明者
【人教版】高中化学必修一:1.2.1《物质的量 气体摩尔体积》ppt课件

【答案】 C
【规律方法】 (1)阿伏加德罗常数有 关题目的正误判断,要认真审题,抓住题目
中的要点,明确题中的陷阱,看清微粒的种 类。(2)阿伏加德罗常数是指1 mol任何粒子 的粒子数,这里的粒子指同种粒子,如1 mol O2中的分子数为NA,而1 mol O2中的氧 原子数为2NA。
变式训练
1.下列各组物质中含氧原子的物质的量 相同的是( )
1.了解物质的量的单位——摩尔。
学 习
2.了解阿伏加德罗常数,并能运用NA进 行计算。
目
3.了解摩尔质量的含义。
标
4.了解气体摩尔体积的含义。
5.掌握标准状况下有关气体摩尔体积的
计算。
6.理解阿伏加德罗定律及其推论。
一、物质的量的单位
1.物质的量
国际单位制中7个基本物理量之一,它表示
n
含有一定数目粒子 的集合体,符号为
第三项
M 的单位取
②先求 M,后求 kg/mol 时,m 的单
Mr
位取 kg
①在 m、M、NA
m
÷M ×M
n
和 N 中,已知任意 三项求第四项
×NA ÷NA
N
②以 n 恒等列代 数方程式解决较
与 N 有关的问题 莫忽视微粒的组
成和种类
复杂的问题
特别提醒
高中化学计算主要是以物质的量为中心的 计算,学习中要养成把其他物理量转化为物质 的量这一思维模式,如已知物质的质量,求其 粒子数,首先根据摩尔质量求出其物质的量, 然后根据阿伏加德罗常数转化为粒子数。
3.阿伏加德罗定律推论不可死记公式, 要通过阿伏加德罗定律进行推导,在理解的基 础上记忆。
例2 (2008年高考海南卷)在两个密闭容器中, 分别充有质量相同的甲、乙两种气体,若两容
【规律方法】 (1)阿伏加德罗常数有 关题目的正误判断,要认真审题,抓住题目
中的要点,明确题中的陷阱,看清微粒的种 类。(2)阿伏加德罗常数是指1 mol任何粒子 的粒子数,这里的粒子指同种粒子,如1 mol O2中的分子数为NA,而1 mol O2中的氧 原子数为2NA。
变式训练
1.下列各组物质中含氧原子的物质的量 相同的是( )
1.了解物质的量的单位——摩尔。
学 习
2.了解阿伏加德罗常数,并能运用NA进 行计算。
目
3.了解摩尔质量的含义。
标
4.了解气体摩尔体积的含义。
5.掌握标准状况下有关气体摩尔体积的
计算。
6.理解阿伏加德罗定律及其推论。
一、物质的量的单位
1.物质的量
国际单位制中7个基本物理量之一,它表示
n
含有一定数目粒子 的集合体,符号为
第三项
M 的单位取
②先求 M,后求 kg/mol 时,m 的单
Mr
位取 kg
①在 m、M、NA
m
÷M ×M
n
和 N 中,已知任意 三项求第四项
×NA ÷NA
N
②以 n 恒等列代 数方程式解决较
与 N 有关的问题 莫忽视微粒的组
成和种类
复杂的问题
特别提醒
高中化学计算主要是以物质的量为中心的 计算,学习中要养成把其他物理量转化为物质 的量这一思维模式,如已知物质的质量,求其 粒子数,首先根据摩尔质量求出其物质的量, 然后根据阿伏加德罗常数转化为粒子数。
3.阿伏加德罗定律推论不可死记公式, 要通过阿伏加德罗定律进行推导,在理解的基 础上记忆。
例2 (2008年高考海南卷)在两个密闭容器中, 分别充有质量相同的甲、乙两种气体,若两容
高一化学《物质的量》课件

(2)1.204×1024个H2O,其物质的量是多少?
解:H2O的物质的量为
N
1.204×1024
Байду номын сангаас
n=
=
NA
6.02 ×1023mol-1
= 2 mol
答:1.204×1024个H2O,其物质的量是2mol。
[例题二]
(1)1mol H2O中多少mol H,多少mol O?
分析: H2O-----2H-----O
阿伏加德罗常数:12克12c中含有的碳原子数,符号为NA 。
意
摩尔的标准
0.012 Kg 12C所含的碳原子数与1mol某种微粒集合 体含有的微粒数相同。
[思考] 0.012kg 12C
?个
已知:一个碳原子的质量为 1.993 × 10-26kg
求: 0.012kg 碳-12 中所含的碳原子数? 解:
碳原子数= 0.012kg
≈ 6.02×1023
1.993 × 10-26kg
1mol大米 2 摩尔分子氢 1 摩尔氧 1mol钠元素
【注意事项】
使用摩尔时,必须指明微粒的种类,微粒可以 是分子、原子、离子、质子、中子、电子等。
说出下列符号的意义: 1H 2mol H 2mol H+ 1mol H2 1mol H2O
判断正误: 1mol 氢
1mol H 1mol 粉笔
2mol CO2 0.3mol 大米 0.5mol SO24-
常见物质的量的描述方法
(能用化学式表示的用化学式,不能用化学式的用中文名称)
如:1mol C 表示1mol碳原子
(1)2molH
2 摩尔氢原子
(2)2molH+
人教版高中化学课件-物质的量、气体摩尔

應中轉移的電子數為2NA
_生__成_1__m_o_l__O_2要__轉__移____ 2__m_o_l_電__子_________
錯__誤__
46 g NO2和N2O4的
混合物含有的原子數為3NA
__N_O2__和_N_2_O_4_的__原__子__個___ 數__比_相__同___________
提示 不一定,因为影响气体体积的因素是温度、 压强两个条件,非标准状况下 1 mol 气体的体积也 可能是 22.4 L。
考点精讲
考点一 解以阿伏加德罗常数(NA)为背景的 选择题应注意的问题
阿伏加德罗常数是近几年高考的“热点”问题,主要以 选择题的形式呈现。命题者往往有意设置一些陷阱, 增 大试题的区分度。陷阱的设置主要有以下几个方面。 陷阱一 气体摩尔体积适用条件 22.4 L/mol 指在标准状况下(0℃ 101 kPa)的气体摩尔体 积。若题中出现物质的体积,需考虑所给物质的状态是 否为气体,条件是否为标准状况。
即时巩固 1 标准状况下,m g A 气体和 n g B 气体的
分子数相同。下列说法不正确的是
()
A.同体积气体 A 和气体 B 的质量比为 m∶n
B.25℃时,1 kg 气体 A 和 1 kg 气体 B 的分子数之
比为 n∶m
C.同温同压下,气体 A 和气体 B 的密度之比为 n∶m
D.标准状况下,等质量的气体 A 和气体 B 的体积之
矽氧鍵數目為0.3NA
4_._5__g__S_iO_2_是__0_._0_75__m_o_l,
_1__m_ol__S_i_O_2_晶_體__中__含__有_ _4__mo_l__矽__氧__鍵_____
_正_確__
⑤常溫下 11.2 L甲烷氣體
_生__成_1__m_o_l__O_2要__轉__移____ 2__m_o_l_電__子_________
錯__誤__
46 g NO2和N2O4的
混合物含有的原子數為3NA
__N_O2__和_N_2_O_4_的__原__子__個___ 數__比_相__同___________
提示 不一定,因为影响气体体积的因素是温度、 压强两个条件,非标准状况下 1 mol 气体的体积也 可能是 22.4 L。
考点精讲
考点一 解以阿伏加德罗常数(NA)为背景的 选择题应注意的问题
阿伏加德罗常数是近几年高考的“热点”问题,主要以 选择题的形式呈现。命题者往往有意设置一些陷阱, 增 大试题的区分度。陷阱的设置主要有以下几个方面。 陷阱一 气体摩尔体积适用条件 22.4 L/mol 指在标准状况下(0℃ 101 kPa)的气体摩尔体 积。若题中出现物质的体积,需考虑所给物质的状态是 否为气体,条件是否为标准状况。
即时巩固 1 标准状况下,m g A 气体和 n g B 气体的
分子数相同。下列说法不正确的是
()
A.同体积气体 A 和气体 B 的质量比为 m∶n
B.25℃时,1 kg 气体 A 和 1 kg 气体 B 的分子数之
比为 n∶m
C.同温同压下,气体 A 和气体 B 的密度之比为 n∶m
D.标准状况下,等质量的气体 A 和气体 B 的体积之
矽氧鍵數目為0.3NA
4_._5__g__S_iO_2_是__0_._0_75__m_o_l,
_1__m_ol__S_i_O_2_晶_體__中__含__有_ _4__mo_l__矽__氧__鍵_____
_正_確__
⑤常溫下 11.2 L甲烷氣體
物质的量的单位——摩尔说课课件

mL , 含 有 大 约 1700 000 000 000个水分子 个水分子, 000 000 000 000个水分子, 万亿亿个个水 即1.7×1021 1.7万亿亿个个水 万亿亿个 分子。 10亿人去数 亿人去数, 分子。让10亿人去数,每人 每分钟数100 100个 每分钟数100个,日夜不停 的数,需要3万年才能数完。 的数,需要3万年才能数完。
伊宁市第八中学 制作:赵慧娟
【学生练习 学生练习】: 学生练习
4、下列关于阿伏加德罗常数的说法正确的是 A.阿伏加德罗常数是一个纯数,没有单位 阿伏加德罗常数是一个纯数, B.阿伏加德罗常数就是6.02×1023
√ √
C.阿伏加德罗常数是指1 mol 的任何粒子 的粒子数
D.阿伏加德罗常数的近似值为: 阿伏加德罗常数的近似值为: 6.02×1023 mol-1
伊宁市第八中学 制作:赵慧娟
学生自学阅读 咀嚼概念 教师归纳总结 概念
伊宁市第八中学 制作:赵慧娟
国际单位制中七种基本物理量及其单位 物理量 长度 质量 时间 电流强度 热力学温度 发光强度 物质的量
专有名词
单位 米 千克(公斤) 秒 安[培] 开[尔文] 坎[德拉] 摩 尔
单位符号 m kg s A K cd mol
物质的量n 物质的量n 阿伏加德罗常数N 阿伏加德罗常数 A 粒子数N 粒子数 之间有怎样的关系呢?
伊宁市第八中学 制作:赵慧娟
【课堂小结 课堂小结】 课堂小结
通过这节课的学习, 通过这节课的学习,我们了解了 三个名词,一个公式, 三个名词,一个公式,并认识了 一个伟大的科学家。 一个伟大的科学家。
伊宁市第八中学 制作:赵慧娟
具体教学设计
创设故事、实例情境, 创设故事、实例情境,引入新课
伊宁市第八中学 制作:赵慧娟
【学生练习 学生练习】: 学生练习
4、下列关于阿伏加德罗常数的说法正确的是 A.阿伏加德罗常数是一个纯数,没有单位 阿伏加德罗常数是一个纯数, B.阿伏加德罗常数就是6.02×1023
√ √
C.阿伏加德罗常数是指1 mol 的任何粒子 的粒子数
D.阿伏加德罗常数的近似值为: 阿伏加德罗常数的近似值为: 6.02×1023 mol-1
伊宁市第八中学 制作:赵慧娟
学生自学阅读 咀嚼概念 教师归纳总结 概念
伊宁市第八中学 制作:赵慧娟
国际单位制中七种基本物理量及其单位 物理量 长度 质量 时间 电流强度 热力学温度 发光强度 物质的量
专有名词
单位 米 千克(公斤) 秒 安[培] 开[尔文] 坎[德拉] 摩 尔
单位符号 m kg s A K cd mol
物质的量n 物质的量n 阿伏加德罗常数N 阿伏加德罗常数 A 粒子数N 粒子数 之间有怎样的关系呢?
伊宁市第八中学 制作:赵慧娟
【课堂小结 课堂小结】 课堂小结
通过这节课的学习, 通过这节课的学习,我们了解了 三个名词,一个公式, 三个名词,一个公式,并认识了 一个伟大的科学家。 一个伟大的科学家。
伊宁市第八中学 制作:赵慧娟
具体教学设计
创设故事、实例情境, 创设故事、实例情境,引入新课
化学课件《摩尔质量》优秀ppt4 人教课标版

2NA 2 mol
补充:物质的量与化学方程式的计算
8、(6)
6.02×1023
NA mol
补充:物质的量与化学方程式的计算
8、(6)
6.02×1023
NA 1 mol
3.01×1023
0.5NA 0.5 mol
6.02×1023
NA 1 mol
1-2-1-2 摩尔质量
摩尔质量 M
【合作运用】
11.(1分) 下列说法中正确的是 B
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
A.1 mol氧 C.1 mol米
B.1 mol H2SO4 D.1 mol面粉
12.(1分) 相同物质的量的SO2和SO3它们之间的关系
不正确的是 B
A.所含硫原子的物质的量之比为1:1
B.所含氧原子的物质的量之比为1:1
C.氧元素的质量比为2:3
D.硫元素的质量比为1:1
1-2-1-2 摩尔质量
则碱石灰增加的质量是多少?
请计算混合气体中H2O和CO2的物质的量之比。
H2O
CO2
质量m
1.8g
45.8g - 1.8g = 44g
物质的量n 1.8g/18g·mol-1
44g/44g·mol-1
补充:物质的量与化学方程式的计算
8、(6)
6.02×1023
NA mol
补充:物质的量与化学方程式的计算
8、(6)
6.02×1023
NA 1 mol
3.01×1023
0.5NA 0.5 mol
6.02×1023
NA 1 mol
1-2-1-2 摩尔质量
摩尔质量 M
【合作运用】
11.(1分) 下列说法中正确的是 B
87.当一切毫无希望时,我看着切石工人在他的石头上,敲击了上百次,而不见任何裂痕出现。但在第一百零一次时,石头被劈成两半。我体会到,并非那一击,而是前面的敲打使它裂开。――[贾柯·瑞斯] 88.每个意念都是一场祈祷。――[詹姆士·雷德非]
89.虚荣心很难说是一种恶行,然而一切恶行都围绕虚荣心而生,都不过是满足虚荣心的手段。――[柏格森] 90.习惯正一天天地把我们的生命变成某种定型的化石,我们的心灵正在失去自由,成为平静而没有激情的时间之流的奴隶。――[托尔斯泰]
A.1 mol氧 C.1 mol米
B.1 mol H2SO4 D.1 mol面粉
12.(1分) 相同物质的量的SO2和SO3它们之间的关系
不正确的是 B
A.所含硫原子的物质的量之比为1:1
B.所含氧原子的物质的量之比为1:1
C.氧元素的质量比为2:3
D.硫元素的质量比为1:1
1-2-1-2 摩尔质量
则碱石灰增加的质量是多少?
请计算混合气体中H2O和CO2的物质的量之比。
H2O
CO2
质量m
1.8g
45.8g - 1.8g = 44g
物质的量n 1.8g/18g·mol-1
44g/44g·mol-1
化学:1.2.1《物质的量的单位-摩尔》课件(3)(新人教版必修1)

↓
↙
质量?
计算1 mol水分子、1 mol铝原子的质量?
1 mol水分子、1 mol铝原子的质量分别为 18 g、27 g
阅读教材第12页,得出结论
摩尔质量:单位物质的量的物质所具有 的质量叫摩尔质量。符号M,常用的 单位g∕mol(或g.mol-¹ );物质的量 (n)、质量(m)、摩尔质量(M) 之间的关系
___ (4)CO2____(5)KCL____(6)H2SO4__ _
据反应C+O2=CO2填写下列空格
C 、O2 、CO2 三种物质的 质量比为_;粒 子个数比为_。 由此可见,物质间的反应,按照一定的质量 比进行,同时也按照一定的粒子数比进行, 那么,质量和粒子之间一定存在着一定联系 吗?
点燃
请看
两袋食盐
鲜枣
从宏观角度,假如一杯水看得见的质 量是18 g,从微观角度想像微小的水 分子有多少个?(必然有某种物理量 是架设在它们之间的一座桥梁)
问题一、这座“桥”的枢纽是什么物理量呢?
国际单位制(SI)的七个基本单 位
SI基本单位 物理量 单位名称 单位符号 长度 米 m 质量 千克 kg 时间 秒 s 电流 安 [培 ] A 热力学温度 开[尔文] K 发光强度 坎[德拉] cd 物质的量 摩 [尔 ] mol
n=m∕M
《迁移、应用》
学习了物质的量—这一物理量之后, 某同学想用下图表示自己对水的 组成的 进一步认识,请你协助他 完成这幅关系图,并说明这幅图的 含义
氢原子微粒数( )
微粒数( )氧原子
6.02×10 ² ³ 个水分子
1 mol水
物质的 量( )H
O( )物质的量
《学与问》教材第13页
《高一化学摩尔质量》课件

《高一化学摩尔质量》ppt课件
• 摩尔质量简介 • 摩尔质量的计算 • 摩尔质量的应用 • 摩尔质量的实验 • 摩尔质量的常见问题解答
01
摩尔质量简介
什么是摩尔质量
摩尔质量定义
摩尔质量是指单位物质的量的物 质所具有的质量,常用单位为 g/mol。
理解要点
理解摩尔质量的概念需要掌握物 质的量、质量和摩尔质量之间的 关系,即质量=物质的量×摩尔质 量。
物质纯度的计算
通过测定样品中某一成分的摩尔质 量,可以计算出该物质的纯度或含 量。
02
摩尔质量的计算
摩尔质量的计算方法
01
02
03
定义法
根据摩尔质量的定义,即 单位物质的量的物质所具 有的质量,计算出摩尔质 量。
换算公式
利用物质的量(n)、质 量(m)和摩尔质量(M )之间的关系进行换算。
数值法
判断化学反应是否自发进行。
在化学计算中的应用
计算物质的质量
计算物质所含微粒数
通过已知的摩尔质量和物质的量,可 以计算出物质的质量。
通过已知的物质的量和摩尔质量,可 以计算出物质所含的微粒数。
计算物质的量
通过已知的物质质量和摩尔质量,可 以计算出物质的量。
在日常生活中的应用
食品包装上的营养标签
在食品包装上,通常会标注食品的营养成分,其中就包括食品的摩尔质量,以 便消费者了解食品的营养价值。
记录了不同物质的称量数据、物质的量和摩尔质量。
在此添加您的文本16字
通过数据分析,得出了不同物质的摩尔质量及其计算方法 。
在此添加您的文本16字
实验结论
在此添加您的文本16字
掌握了摩尔质量的概念和计算方法。
在此添加您的文本16字
• 摩尔质量简介 • 摩尔质量的计算 • 摩尔质量的应用 • 摩尔质量的实验 • 摩尔质量的常见问题解答
01
摩尔质量简介
什么是摩尔质量
摩尔质量定义
摩尔质量是指单位物质的量的物 质所具有的质量,常用单位为 g/mol。
理解要点
理解摩尔质量的概念需要掌握物 质的量、质量和摩尔质量之间的 关系,即质量=物质的量×摩尔质 量。
物质纯度的计算
通过测定样品中某一成分的摩尔质 量,可以计算出该物质的纯度或含 量。
02
摩尔质量的计算
摩尔质量的计算方法
01
02
03
定义法
根据摩尔质量的定义,即 单位物质的量的物质所具 有的质量,计算出摩尔质 量。
换算公式
利用物质的量(n)、质 量(m)和摩尔质量(M )之间的关系进行换算。
数值法
判断化学反应是否自发进行。
在化学计算中的应用
计算物质的质量
计算物质所含微粒数
通过已知的摩尔质量和物质的量,可 以计算出物质的质量。
通过已知的物质的量和摩尔质量,可 以计算出物质所含的微粒数。
计算物质的量
通过已知的物质质量和摩尔质量,可 以计算出物质的量。
在日常生活中的应用
食品包装上的营养标签
在食品包装上,通常会标注食品的营养成分,其中就包括食品的摩尔质量,以 便消费者了解食品的营养价值。
记录了不同物质的称量数据、物质的量和摩尔质量。
在此添加您的文本16字
通过数据分析,得出了不同物质的摩尔质量及其计算方法 。
在此添加您的文本16字
实验结论
在此添加您的文本16字
掌握了摩尔质量的概念和计算方法。
在此添加您的文本16字
高一化学摩尔知识点专项总结课件

确定化合物原子数的方法
02
当化学式无法直接表示原子数时,可采用X射线衍射、中子衍射
等实验手段。
原子数的可变性
03
某些物质的原子数会因存在状态和聚集状态的不同而变化,如
气体在温度和压力变化时。
氧分子数的计算
氧分子数的计算基础
通过氧气的化学式O2来计算氧分子数。标准状况下,1摩尔氧气含 有6.02×10^23个氧分子。
选项C的正确性分析
选项C认为标准状况下90mL水的物质的量是0.5mol,这是错误的。 理由是水的摩尔质量是18g/mol,而90mL水的质量为90g。
正确的计算应该是90g除以18g/mol等于5mol,而不是0.5mol。
选项D的正确性分析
该选项正确地使用了阿伏伽德罗常数,得出了 6.02×10^24个氢分子的物质的量是10mol的结论。
高一化学摩尔知识点
汇报人:xxx 2024-03-01
物质的量定义
物质的量是描述微观离子集合体 一个的物理量,其单位是摩尔。
物质的量可以用来计算一定数量 粒子的物质的量,如分子、原子
、离子等。
物质的量可以用公式 n = N/N_A 来计算,其中 N 是粒子 数,N_A 是阿伏伽德罗常数。
摩尔的定义
在某些情况下,气体的化学计量关系可能影响分 子数关系,需要根据具体的化学反应来确定。
选项A的正确性分析
该选项表述在标准状况下,1mol任何气体的体积都是22.4L,这是正确的。因为阿伏伽德罗定律指出,1mol气体的体积在标 准状况下是固定的,约为22.4L。
选项B的正确性分析
选项B认为55gCO2的物质的量是1mol,这是正确的。因为 CO2的摩尔质量是44g/mol,所以55gCO2的物质的量确实 是1mol。
物质的量的单位摩尔-完整版PPT课件
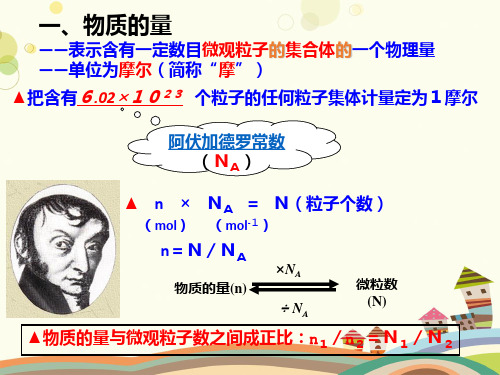
一、物质的量
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
M× 物质的量×NA 粒子数 质量 ÷ M ( n ) N A÷ ( N ) ( m)
【思考】
集体中的成员数
1打 12个 铅笔
参考资料
1箱个国家参加的第 16瓶 啤酒 1971 年,由 41 14届国际计量 宏观 大会上,正式宣布国际纯粹和应用化学联合会、 物质 1盒 100枚 别针 国际纯粹和应用物理联合会和国际标准化组织关 1双 2只 筷子 于必须定义一个物理量单位的提议,并作出决议。 从此,“物质的量”就成为国际单位制中的一个 1mol ?个 分子、离子、原子…… 微观 粒子 基本物理量,物质的量的单位为摩尔。 同时规定 0.012 kg 12C中所含的碳原子数目作为1 mol的标 1 摩尔的标准:1 mol粒子集体所含的粒子数 准。 23 12
(3) 1摩尔大米含有 6.02×1023个米粒。
错误。物质的量只适用于微观粒子,不能用来说明 宏观物质 (4)1mol氢 错误。没有指出是分子、原子或离子
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
如果把 6.02×1023 粒米给全球60亿人吃, 每人每天吃一斤,要吃14万年。
课堂练习四
1、请计算: A、24.5克H2SO4的物质的量是 B、11克CO2的物质的量是 C、2.5molNa2CO3的质量是 D、1.5molH2O的质量是
2、 19.6 g硫酸是 个硫酸分子,其中含有 含有 molO ,计 、 、 、 、
molH2SO4 ,含有 molH,计 个氢原子, 个氧原子 。
m N n = = NA M
【思考】 49gH2SO4的物质的量是多少?所含
H2SO4分子的个数是多少?
解: M(H2SO4)=98g/mol m(H2SO4) n(H2SO4)= M(H2SO4) 49g n(H2SO4)= =0.5mol 98g/mol
N(H2SO4)=n(H2SO4)×NA =0.5mol×6.02×1023/mol =3.01×1023
四、 摩尔质量
概念:
单位物质的量的物质所具有的质量叫做摩尔质量 符号:M 常用单位:g/mol 、Kg/mol 分子:相对分子质量; 原子:相对原子质量; 离子:相对原子质量
理解:
A、1mol物质的质量
B、数值上等于物质的相对原子(分子)质量
C、单位:g/mol(克/摩尔) 、Kg/mol
课堂练习三 1molFe的质量是: 1molO2的质量是: 1molH2SO4的质量是: 1molFe2+的质量是: Na的摩尔质量为 Na+的摩尔质量为 H2SO4的摩尔质量为 HNO3的摩尔质量为 、 、 、 、 、 、 、 、
第一章第二节 化学计量在实验中的应用
化学 必修1
第一课时
思考、讨论、回答
古时有一个勇敢的小伙子想娶国王美丽的公主,国王出题 刁难,其中一个问题是:100kg小米是多少粒?同学们你 们能不能帮帮他? 化零为整
谁能介绍几种生活中相似的例子?
一双筷子
一盒别针
一打铅笔
一箱啤酒
方法:把微小物质扩大倍数形成一定数目的集体以便 于便生活、方便科学研究、方便相互交流
五、 物质的质量、物质的量、摩尔质量
之间的关系
物质的质量 (1)定义: 单位物质的量的物质所具 (单位:Kg) 有的质量叫摩尔质量。 物质的量
(单位:mol)
n=
m (2)定义式: M = n
m M
摩尔质量
(单位:Kg/mol)
六、 质量、物质的量、摩尔质量、阿伏伽德罗常数、 粒子数之间的关系
1971年,由41个国家参加的第14届国 1mol 分子、离子、 际计量大会上,正式宣布了国际纯粹和应用 微观 原子…… 粒子 化学联合会、国际纯粹和应用物理联合会和 一箱啤酒 一打铅笔 一双筷子 一盒别针 碳原子数 国际标准化组织关于必须定义一个物理量单 1打 铅笔 位的提议,并作出决议。从此,“物质的量” 1箱 啤酒 把微小物质扩大倍数形成一 宏观 就成为了国际单位制中的一个基本物理量, 定数目的集体以便于便生活、 物质 1盒 别针 方便科学研究、方便相互交 物质的量的单位为摩尔。 流
、3摩尔氯化氢分子
3molHCl
三、 物质的量、阿伏加德罗常数与粒子数间的关系。
(1)1mol碳原子含有 (2)0.3mol硫酸分子含有 (3)10mol钠离子含有 (4)6mol电子含有 (5)0.5mol中子含有 1×NA 0.3×NA 10×NA 6×NA 0.5×NA 个碳原子 个硫酸分子 个钠离子 个电子 个中子
规定解释:如果某物质含有 与 0.012 Kg 12C 中所含的 碳原子数相同的粒子数,该 物质的物质的量为1mol 。
符号: NA 单位: mol-1,数值:约为6.02×1023
[注意]
不能认为 6.02×1023就是阿伏加德罗常数 也不能认为1mol粒子=6.02×1023个
【讨论】 下面叙述是否正确? (1)摩尔是七个物理量之一。 错误。物质的量 是七个基本物理量之一 (2)摩尔是物质的质量单位。 错误。摩尔是物质的量的单位
实践体验
粒子符号 物质的式 每个粒子的质 1摩物质含有的 粒子数(个) 量 量(g/个) C Fe H2SO4 H2O Na+ OH12 56 98 18 23 17 1.993X10-23 9.032X10-23 1.628X10-22 2.990X10-23 3.821X10-23 2.824X10含的碳原子数
≈ 6.02×10
实践体验:已知一个12C原子的质量为1.993×10-26 kg,问 0.012 kg12C中有多少个碳原子? 6.02×1023
二、 阿伏加德罗常数: 1 mol 任何粒子的粒子数。
科学上规定为: 0.012 Kg 12C 中所含的碳原子数
课堂小结 、 一、物质的量( n):表示含有一定数目粒子的集合体 是国际单位制七个基本物理量之一 物质的量的单位是 摩尔、简称摩,符号:mol 二、阿伏加德罗常数:1 mol 任何粒子的粒子数。 科学上规定为: 0.012 Kg 12C 中所含的碳原子数 符号: NA 单位: mol-1,数值:约为6.02×1023 三、摩尔质量:单位物质的量的物质所具有的质量叫做摩尔质量 数值上等于物质的相对原子(分子)质量 符号:M 常用单位:g/mol 、Kg/mol
N NA
微粒数目
阿佛加德罗常数
课堂练习二
1、下列关于摩尔的说法中,正确的是( )
√
A.摩尔是一个物理量,约含6.02×1023个粒子
B. 摩尔是国际单位制的七个基本单位之一
C.摩尔既是物质的量的单位,又是粒子的数
量单位
√
D.摩尔的基准是0.012 Kg 12C中所含的碳原
子数
2、下列关于阿伏加德罗常数的说法正确的是
回顾
C
12 g C
+
O2
32 g O2
点燃
CO2
12 g C中含多少个碳原子?
宏观 微观 如何将可称量 与肉眼看不见、难以称量的 【思考】 物质 粒子 联系起来呢? 可 称 量 物 质
物质的量 ?
肉眼看不见,难以称量
一、 物质的量
单位是 摩尔、简称摩,符号:mol
参考资料
表示含有一定数目粒子的集合体
(
B.阿伏加德罗常数就是6.02×1023
)
A.阿伏加德罗常数是一个纯数,没有单位
√ √
C.阿伏加德罗常数是指1 mol 的任何粒子的 粒子数 6.02×1023 mol-1 D.阿伏加德罗常数的近似值为:
3、1mol H2SO4中约含有 个氧原子。
个硫酸分子,
4、含3.01×1023个Na+的 Na2SO4中约含 SO42-
课堂练习一
1、说出下列符号的意义:
①2H
④2molH2
、②2molH
、⑤4molFe3+
2molH2O
、 ③2molH+
、⑥a molSO3
5molSO42-
、
、
2、用符号表示:
2摩尔水分子
n 摩尔氧原子
、5摩尔硫酸根离子
、
、 、
nmolO
2、1摩尔碳酸氢根离子 1molCO3
2+ 10摩尔亚铁离子 10molFe
mol,
5、3molNa2CO3· 10H2O含有 含有 个钠离子和
NA氢原子、 个碳酸根离子
思考
1mol物质的质量到底有多大?
1molH2O 约含有6.02×1023个水分子,
1molAl 约含有6.02×1023 个铝原子,
质量是18g
质量是27g
1mol不同物质所含的粒子数是相同的,但由于不同粒 子的质量不同, 1mol不同物质的质量也不同
微粒个数 1个 物质的量 1mol 微粒个数 2个
1mol 1个 1mol
2H2 +
物质的量 2mol
O2 ==
△
2H2O
2个
2mol
结论
化学反应方程式中,系数之比即反应过中 各物质的物质的量之比
知识链接
两个变式(1)N=n•NA (2) N
N A=
一个比例关系 n1︰n2=N1︰N2
n
n= 物质的量
物质的量(n)==
微粒数目(N) 阿伏加德罗常数(NA)
知识链接
1 摩尔水分子中有多少摩尔氢原子,多少摩尔氧原子?
H2O
微粒个数 微粒集体 1 NA
2H
2
2NA 2 mol
O
1 NA 1 mol
物质的量 1 mol
结论
微粒之间的个数之比等于其物质的量之比
知识链接
