TNF-α在运动调节老年小鼠骨髓间充质干细胞增殖分化能力中的作用
小鼠肿瘤坏死因子α(TNF-α)说明书
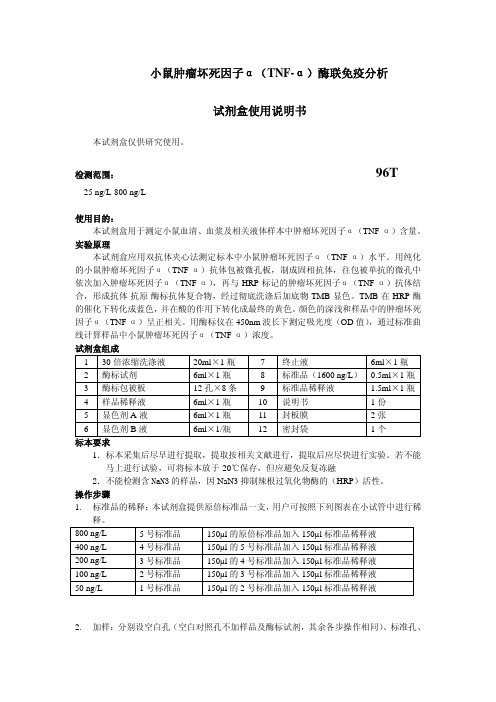
200 ng/L
3 号标准品
150µl 的 4 号标准品加入 150µl 标准品稀释液
100 ng/L
2 号标准品
150µl 的 3 号标准品加入 150µl 标准品稀释液
50 ng/L
1 号标准品
150µl 的 2 号标准品加入 150µl 标准品稀释液
2. 加样:分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、标准孔、
计算 以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的
OD 值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与 OD 值计算出标
准曲线的直线回归方程式,将样品的 OD 值代入方程式,计算出样品浓度,再乘以稀释倍数, 即为样品的实际浓度。 注意事项 1.试剂盒从冷藏环境中取出应在室温平衡 15-30 分钟后方可使用,酶标包被板开封后如未
用完,板条应装入密封袋中保存。 2.浓洗涤液可能会有结晶析出,稀释时可在水浴中加温助溶,洗涤时不影响结果。 3.各步加样均应使用加样器,并经常校对其准确性,以避免试验误差。一次加样时间最好
控制在 5 分钟内,如标本数量多,推荐使用排枪加样。 4. 请每次测定的同时做标准曲线,最好做复孔。如标本中待测物质含量过高(样本 OD 值
大于标准品孔第一孔的 OD 值),请先用样品稀释液稀释一定倍数(n 倍)后再测定,计 算时请最后乘以总稀释倍数(×n×5)。 5. 封板膜只限一次性使用,以避免交叉污染。 6.底物请避光保存。 7.严格按照说明书的操作进行,试验结果判定必须以酶标仪读数为准. 8.所有样品,洗涤液和各种废弃物都应按传染物处理。 9.本试剂不同批号组分不得混用。 10. 如与英文说明书有异,以英文说明书为准。 保存条件及有效期 1.试剂盒保存:;2-8℃。 2.有效期:6 个月
TNF-α预处理脐血间充质干细胞移植心肌梗死大鼠心功能影响

TNF-α预处理脐血间充质干细胞移植心肌梗死大鼠心功能影响樊志刚;刘芳【摘要】目的:研究肿瘤坏死因子(TNF-α)预处理的脐血间充质干细胞(HUMSC)血管细胞黏附分子-1的表达及其对心肌梗死大鼠心功能的影响。
方法:实验组取第3代HUMSC用TNF-α(10 ng/mL)预处理24 h后,迁移黏附实验检测其体外迁移黏附能力,Western blot检测VCAM-1蛋白表达;对照组不用TNF-α处理。
动物实验分为实验组(注射TNF-α预处理HUMSC)和对照组(注射HUMSC),取第3代HUMSC移植于心肌梗死大鼠的心肌内3周后,二维超声心动图检测大鼠左心室心功能。
结果:与对照组比较,实验组体外迁移黏附力明显增强(P<0.05);黏附分子VCAM-1的蛋白表达水平显著升高( P<0.05);左心室射血分数明显提高( P<0.05)。
结论:移植T N F-α预处理的HUMSC更能明显改善大鼠心功能,其机制可能与TNF-α提高HUMSC黏附分子VCAM-1的蛋白表达水平相关。
【期刊名称】《现代仪器与医疗》【年(卷),期】2015(000)004【总页数】5页(P4-7,18)【关键词】肿瘤坏死因子-α;脐血间充质干细胞;黏附分子【作者】樊志刚;刘芳【作者单位】河南医学高等专科学校,河南郑州451191;河南医学高等专科学校,河南郑州 451191【正文语种】中文【中图分类】R332每年全球约有1700万人死于心血管病,其中占总数1/2患者死于急性心肌梗死(AMI)[1]。
过去30年中,MI病死率(30 d内)虽然已降至10% ,但年病死率仍为20% 左右[2]。
目前,MI治疗方法以药物、介入和外科手术为主,这些方法可解除血管阻塞,缓解心室重构,延缓和改善心功能恶化及心律失常发生,但无法逆转坏死心肌,使已梗死心肌细胞再生。
而干细胞治疗给人们带来了新希望。
MSC具有多向分化潜能、支持和促进造血干细胞植入、调节免疫以及分离、培养时操作简便等特点[3]。
TNF-——精选推荐

TNF-T N F 根据来源和结构不同分为T N F- a 、T N F -?,其中T N F-a 与⾻质疏松关系密切。
T N F 主要由单核巨噬细胞产⽣,另外,活化的T 细胞、⾃然杀伤细胞、肥⼤细胞、软⾻细胞也能分泌这种因⼦。
单核巨噬细胞合成的TN F 是⼀个25 ku 左右的⾮糖化跨膜蛋⽩,有两种不同的受体(P55 ,P75 ) ,其分⼦量分别为55 ku 和75 ku 。
T NF 与受体结合后,信号传⼈细胞内,通过N F -xB 或活化蛋⽩(A P ).1 转录因⼦来实现其功能。
⼈的TN F .a 基因位于第 6 对染⾊体上。
1975年E.A. Carswell等⼈发现接种卡介苗的⼩⿏注射细菌脂多糖后,⾎清中出现⼀种能使多种肿瘤发⽣出⾎性坏死的物质,将其命名为肿瘤坏死因⼦(tumor necrosis factor,TNF)。
⼋⼗年代⼈们发现其在消耗症中起了重要作⽤,⼜称恶液质素。
TNF主要由活化的巨噬细胞,NK细胞及T淋巴细胞产⽣。
1985年Shalaby把巨噬细胞产⽣的TNF命名为TNF-α,把T淋巴细胞产⽣的淋巴毒素(lymphotoxin,LT)命名为TNF-β。
虽然TNF-α与TNF-β仅有约30%的同源性,但它们却拥有共同的受体。
TNFα的⽣物学活性占TNF总活性的70 %~95 %,因此⽬前常说的TNF多指TNF-α。
1984年TNF基因的克隆开辟了临床试验的时代,是第⼀个⽤于肿瘤⽣物疗法的细胞因⼦,但因其缺少靶向性且有严重的副作⽤,⽬前仅⽤于局部治疗。
⼈类TNF-α基因于1985年成功克隆,定位于6p21.4,长约3.6 kbp,有4个外显⼦和3个内含⼦,与主要组织相容性复合体(MHC)基因紧密连锁位于HLA-B 和 HLA-C2 位点之间的 MHC3 类基因区内,由TNFA和TNFB组成,分别编码TNFα和TNFβ。
位于启动⼦区238位和308位存在单核苷酸多态性,被认为可调节TNF 的转录⽔平,与慢性⼄肝、⾃⾝免疫性疾病、胰岛素抵抗、肿瘤等多种疾病的易感性相关。
tnf-a名词解释

tnf-a名词解释TNF-α是肿瘤坏死因子-α(Tumor Necrosis Factor-alpha)的简称。
它是一种由人体免疫系统产生的细胞因子,也是一种炎症性蛋白质。
TNF-α可参与多种生理和病理过程,包括免疫调节、细胞增殖和凋亡、发炎反应以及免疫细胞的激活等。
1. Elevated levels of TNF-α have been observed in patients with rheumatoid arthritis.(风湿性关节炎患者体内TNF-α的水平升高)。
2. Inflammatory bowel disease is characterized by an excessive release of TNF-α in the intestinal mucosa.(肠道炎症疾病的特征之一是肠道黏膜释放过多的TNF-α)。
3. TNF-α plays a crucial role in the pathogenesis of sepsis, a systemic inflammatory response to infection.(TNF-α在败血症(一种全身性感染引起的炎症反应)发病机制中起着关键作用)。
4. Anti-TNF-α therapies have shown promising results in the treatment of inflammatory diseases such as psoriasis and Crohn's disease.(抗TNF-α治疗在银屑病和克罗恩病等炎症性疾病的治疗中展现了良好的疗效)。
5. Increased TNF-α production has been linked to the development of insulin resistance and type 2 diabetes.(增加的TNF-α产生与胰岛素抵抗和2型糖尿病的发展相关)。
TNF-α诱导的胰岛素抵抗小鼠胰岛素敏感性及糖脂代谢的变化的开题报告

TNF-α诱导的胰岛素抵抗小鼠胰岛素敏感性及糖脂代谢的
变化的开题报告
背景:TNF-α是一种能够诱导炎症反应的细胞因子,它已被证明能诱导胰岛素抵抗和
葡萄糖和脂质代谢紊乱,并且与糖尿病、肥胖和心血管疾病等代谢性疾病的发生密切
相关。
然而,目前对TNF-α在胰岛素抵抗和糖脂代谢中的作用机制仍存在争议。
目的:本研究旨在探讨TNF-α诱导的胰岛素抵抗小鼠胰岛素敏感性及糖脂代谢的变化,以进一步阐明其作用机制。
方法:选用C57BL/6小鼠,将其随机分为对照组和TNF-α治疗组,TNF-α组小鼠每周
注射TNF-α 10μg/ kg,对照组注射等量生理盐水,持续8周。
观察小鼠的体重变化、血糖和胰岛素水平、葡萄糖耐受性、胰岛素敏感性以及脂代谢变化等指标。
结果:研究结果显示,TNF-α处理组小鼠的体重增加、血糖水平和胰岛素水平均较对
照组高,同时TNF-α处理组小鼠的葡萄糖耐受性显著降低,而胰岛素敏感性明显降低。
此外,TNF-α处理组小鼠的脂代谢变化也发生了明显的改变,包括血清总胆固醇和三
酰甘油水平显著升高。
结论:TNF-α能够导致小鼠胰岛素抵抗和糖脂代谢紊乱,并通过影响其脂代谢通路来
产生作用。
这一发现有望为进一步探讨TNF-α与代谢性疾病的关系提供新的思路和研
究方向。
tnf-α 降解

TNF-α(tumor necrosis factor,肿瘤坏死因子)在骨质吸收和重建中起重要作用,能够促进骨细胞生长和合成DNA,抑制碱性磷酸酶活性并促使骨形成受阻。
长期暴露在TNF-α中的成骨细胞,其功能受抑,胶原降解增加。
TNF-α还可刺激软骨重吸收和抑制软骨细胞合成蛋白多糖。
因此,TNF-α的降解可能与这些过程有关。
此外,TNF-α能够降低骨骼肌胞质的静息电位,增加细胞内钠离子浓度,使血管内钠离子减少,这种情况在休克和危象中经常出现。
肌肉对TNF-α的反应包括:糖原储备耗尽、氨基酸外流增加使蛋白质丢失、乳酸外流增加、糖转运先增加后受到抑制,此外还有肌肉蛋白的净分解。
TNF-α能够抑制脂蛋白脂酶的活性,刺激脂肪溶解增加,抑制几种关键的脂肪生成酶基因的转录。
所以,经TNF-α的处理,脂肪细胞会脱脂肪,外源性脂肪摄取被抑制,糖原合成脂肪的途径被阻断。
在肝脏中,TNF-α能够诱导产生急性时相蛋白,抑制白蛋白的合成,并通过IL-1和IL-6放大这种效应。
TNF-α可直接刺激循环中脂质增加,过度的脂质生成引起急性期常见的高三酰甘油血症。
TNF-α还可增加肝脏氨基酸的清除,加速糖原介导的氨基酸转运进入肝细胞,因而加速外周组织中的氨基酸进入肝脏而被降解,引起氮负平衡。
在神经内分泌系统中,TNF-α能够刺激体外培养的大鼠垂体细胞内cAMP含量减少,这一作用与前列腺素释放有关。
TNF-α还能够直接与垂体中的受体作用,诱导生长激素分泌。
总的来说,TNF-α的降解可能与上述多种生理过程有关,但具体的降解机制尚不清楚。
如需了解更多关于TNF-α降解的信息,建议查阅相关文献或咨询专业人士。
TNF信号传导通路的分子机理

TNF信号传导通路的分子机理一、本文概述肿瘤坏死因子(TNF)是一种具有广泛生物活性的细胞因子,参与调控多种细胞过程和生物反应,包括细胞生长、分化、凋亡以及炎症反应等。
TNF信号传导通路是生物体内的重要信号转导系统,对维持细胞稳态和应对外部刺激具有关键作用。
本文旨在深入探讨TNF信号传导通路的分子机理,包括TNF受体的结构特点、信号转导过程的关键分子事件以及通路调控的分子机制等。
通过阐述这些基本问题,有助于我们更好地理解TNF在生物学中的作用,为相关疾病的预防和治疗提供理论支持。
在本文中,我们首先概述了TNF及其受体的基本结构和功能,为后续的信号传导分析奠定基础。
接着,我们详细描述了TNF信号传导通路的主要过程,包括受体激活、信号分子的招募与活化、转录因子的激活以及基因表达的调控等。
我们还探讨了通路中关键分子的作用机制,如TNF受体相关因子(TRAFs)、凋亡信号调节激酶1(ASK1)等。
我们总结了TNF信号传导通路在生物学中的意义,以及其在疾病发生发展中的作用,为未来的研究提供思路。
通过本文的阐述,读者可以对TNF信号传导通路的分子机理有更全面、深入的理解,为相关领域的研究提供有益的参考。
二、TNF及其受体TNF(肿瘤坏死因子)是一种重要的细胞信号分子,它在调节细胞生长、分化、凋亡以及免疫反应等多个生理和病理过程中发挥着关键作用。
TNF有两种主要形式,即TNF-α和TNF-β,其中TNF-α是研究的最为广泛和深入的。
TNF-α主要由活化的巨噬细胞产生,但也可由其他类型的细胞,如自然杀伤细胞、肥大细胞和成纤维细胞等在特定条件下分泌。
TNF通过与特定的受体结合来发挥其生物学效应。
TNF受体(TNFR)主要分为两类:TNFR1(也称为p55或CD120a)和TNFR2(也称为p75或CD120b)。
这两类受体在结构上有所差异,TNFR1包含一个死亡结构域,而TNFR2则含有一个TRAF(TNF受体相关因子)结合位点。
TNF介绍

一、TNF的发现及发展历史目前普遍认为,TNF最早是1975年由Carswell发现的。
Carswell在研究中观察到,经卡介苗致敏的小鼠被注射大肠杆菌内毒素后,血清中出现一种物质,该物质在体内可以使移植肿瘤发生出血、坏死,遂将该物质命名为肿瘤坏死因子(tumor necrosis factor, TNF)[1]。
其实早在十九世纪后期,Coley等就观察到,当肿瘤患者伴有感染时,其肿瘤偶尔可以消退甚至痊愈。
基于这些发现,Coley等开始用一些灭活的G+和G-细菌混合物作为疫苗,来治疗恶性肿瘤,称为“Coley毒素”疗法[2]。
Coley毒素的应用,大大提高了软组织肿瘤患者的生存率,这在当时获得了较高的评价。
1936年,随着Coley的去世,人们对Coley菌苗的兴趣被广泛应用的化疗和放疗所取代。
100多年后的今天,当人们再次关注“Coley毒素”疗法的时候,发现该疗法的主要原理之一就是通过诱导体内产生大量的TNF来实现抗肿瘤作用的[3]。
自Carswell发现TNF后,许多学者进行的其他研究均观察到TNF在体外和体内对多种肿瘤细胞有明显的细胞毒作用。
1984年Pennica等首次克隆了人TNF-α的cDNA,并在大肠杆菌中表达成功[4]。
随后,即有许多学者致力于将TNF 应用于临床的研究[5]。
自1987年起,在欧洲(德国、英国、法国、波兰、埃及等)、美国、日本等地陆续有进行TNFⅠ期和Ⅱ期临床试验的报道[6]。
但临床试验的结果给对TNF满怀希望的人们带来的是失望。
TNF类似严重感染所致的不良反应令患者难以耐受,而患者可以耐受的剂量似乎达不到抗肿瘤的浓度[7]。
一时间TNF的临床研究陷入了低谷,进一步的临床研究几乎停滞。
由于TNF明确的抗肿瘤活性,使得不少学者不愿轻易放弃对其的研究。
90年代中期以来,陆续有临床研究者报道了TNF局部用药的临床结果[8]。
证明TNF 局部用药(大剂量局部灌流、肿瘤内注射、腔内注射等)既可达到良好的抗肿瘤效果,又可避免全身用药的严重副作用,这一发现重新燃起了人们对TNF的热情。
TNFα信号通路在免疫系统中的作用机制

TNFα信号通路在免疫系统中的作用机制免疫系统是人体内的重要防御机制,它负责识别、攻击和清除病原体和异常细胞。
免疫系统的正常功能对于人体的健康至关重要。
然而,在某些情况下,免疫系统可能出现失调,导致炎症和疾病的发生。
TNFα(肿瘤坏死因子α)是一个重要的炎症介质,在免疫系统中发挥着关键的作用机制。
TNFα信号通路是免疫系统中的一个复杂网络,涉及多种信号分子、受体和信号途径。
当机体受到外界刺激(如感染、细胞损伤等)时,免疫细胞会产生和释放TNFα。
TNFα结合到免疫细胞表面上的受体,进而激活信号通路,触发一系列的生物学反应。
一方面,TNFα信号通路的主要作用是促进炎症反应。
TNFα能够触发免疫细胞的活化和增殖,促使它们释放趋化因子,从而吸引其他免疫细胞到炎症部位。
此外,TNFα还可促进炎症细胞的黏附和迁移,增加炎症细胞与内皮细胞之间的相互作用,从而加剧炎症反应的程度。
另一方面,TNFα信号通路也参与了免疫调节和细胞凋亡。
在免疫调节方面,TNFα能够激活特定的信号途径,调节免疫细胞的分化和功能。
例如,TNFα可以促使细胞向着炎症型免疫反应分化,增加炎症细胞的数量。
另外,TNFα还能够抑制细胞的免疫抑制功能,通过影响T细胞的活化和调节,影响免疫耐受的维持。
在细胞凋亡方面,TNFα也发挥着重要的作用。
TNFα能够促使某些细胞通过程序性细胞死亡自杀,以维护正常组织结构和功能。
这种细胞凋亡过程可以清除一些异常和受损细胞,防止它们继续分裂和繁殖,从而保护整个机体的健康。
然而,在某些情况下,TNFα也可能引发过度的细胞凋亡,导致组织破坏和疾病的发生。
除了以上作用机制,TNFα信号通路还与许多其他信号通路相互作用,如NF-κB、MAPK和JAK/STAT等。
这些信号通路能够进一步调节免疫系统的炎症反应、免疫调节和细胞凋亡等生物学过程。
通过不同的信号途径,TNFα信号通路能够实现免疫系统多种不同的功能。
虽然TNFα的正常功能对于免疫系统和机体的健康非常重要,但过度激活的TNFα信号通路也可能导致炎症性疾病的发生和发展,如类风湿性关节炎、炎症性肠病和银屑病等。
tnf-α产生机制

tnf-α产生机制TNF-α全称为肿瘤坏死因子-α,是一种细胞因子,主要由免疫细胞产生。
TNF-α在炎症、感染及自身免疫性疾病中起到重要作用。
TNF-α的产生是一个复杂的过程,牵涉到多种细胞及生物分子之间的相互作用。
TNF-α主要由免疫细胞产生,包括巨噬细胞、树突状细胞、T淋巴细胞、B淋巴细胞、自然杀伤细胞以及某些类似上皮细胞的上皮样细胞。
这些细胞可以通过两种途径产生TNF-α:氧化应激途径和信号途径。
氧化应激途径是一种非特异性的激活方式,会导致细胞内出现氧化应激反应。
当细胞受到一些刺激,如有害微生物的存在、细胞自身的损伤或者其它物质刺激时,细胞内的NADPH氧化酶开始工作,并产生氧自由基。
这些氧自由基与胞浆中的特定酶结合,形成来自膜表面的氧化物。
接着,这些氧化物可引起细胞膜周围物质的氧化和激活趋化因子如IL-8、IL-6、TNF-α等的释放。
信号途径中,细胞内源性蛋白介导的信号转导途径扮演者重要角色。
当外部刺激作用于细胞膜表面的受体时,会激活分子使其表达,在后续级联反应中迅速触发细胞内的信号转导途径,进而激活NF-κB 和MAPK通路,促进TNF-α的产生和释放。
此外,TNF-α的产生可受到多种因素的影响,包括刺激的类型、刺激的强度、刺激的时间、刺激的地点等等。
不同的细胞类型之间也存在差异,如巨噬细胞受到病毒刺激而产生的TNF-α含量较高,而T 淋巴细胞在受到持续愈基物刺激下产生的TNF-α水平较高。
总之,TNF-α的产生是一个复杂的过程,包括信号途径和氧化应激途径两种途径,并受到多种因素的影响。
深入研究TNF-α的产生机制有助于更好地理解炎症、感染及自身免疫性疾病的病理机制,为疾病的诊断和治疗提供理论基础。
小鼠骨髓间充质干细胞成骨分化中的核受体Rev-erbα及Rorα

小鼠骨髓间充质干细胞成骨分化中的核受体Rev-erbα及Rorα林富伟;徐晓梅;崔琰;谢乙加;赵青【摘要】BACKGROUND: The orphan nuclear receptors Rev-erbα and Rorα play important roles in lipid metabolism and glucose metabolism. But it is unclear whether they are involved in bone metabolism. OBJECTIVE: To observe the expression of Rev-erbα and Rorα during the osteoblastogenesis process of bone marrow mesenchymal stem cells (BMSCs). METHODS: BMSCs were isolated and purified from C57BL/6 mice by the whole bone marrow adherence method followed by morphology observations and then BMSCs were induced to differentiate into osteoblasts and adipocytes. We detected their differentiation abilities using oil red O staining and alizarin red staining, respectively. Real-time PCR and western blot assay were conducted to detect the mRNA and protein levels of Rev-erbα and Rorα in BMSCs cultured in the osteogenic medium for 0, 7, 14 days. RESULTS AND CONCLUSION: BMSCs fromC57BL/6 mice were mainly spindle-shaped and exhibited the swirl-like pattern of growth. Following induction, oil red O staining and alizarin red staining produced a positive reaction in these cells. Rev-erbα expression at both gene and protein levels decreased at 0, 7, 14 days after osteogenic induction, while Rorα expression increased at both gene and pro tein levels. These findings indicate that Rev-erbα and Rorα may participate in the osteoblastogenesis of BMSCs.%背景:孤儿核受体Rev-erbα及Rorα已经被广泛证实与糖代谢、脂肪代谢等密切相关,但与骨代谢的关系尚不明确.目的:探讨孤儿核受体Rev-erbα及Rorα在骨髓间充质干细胞成骨分化过程中的作用.方法:采用全骨髓贴壁法分离培养C57BL/6小鼠骨髓间充质干细胞,进行形态学观察和成脂、成骨诱导分化,采用油红O染色,茜素红染色对其分化能力进行鉴定.在骨髓间充质干细胞成骨诱导分化第0,7,14天,采用Real Time PCR及Western Blot分别检测孤儿核受体Rev-erbα及Rorα的mRNA及蛋白表达变化.结果与结论:①骨髓间充质干细胞形态以梭形为主,呈典型的漩涡样生长.油红O染色及茜素红染色呈阳性;②在成骨诱导的第0,7,14天,Rev-erbα的mRNA及蛋白表达均呈下降趋势,而Rorα的mRNA及蛋白表达均呈上升趋势,提示Rev-erbα及Rorα在骨髓间充质干细胞成骨诱导过程中可能发挥了一定的作用.【期刊名称】《中国组织工程研究》【年(卷),期】2018(022)017【总页数】6页(P2625-2630)【关键词】干细胞;骨髓间充质干细胞;成骨分化;核受体;Rev-erbα;Rorα【作者】林富伟;徐晓梅;崔琰;谢乙加;赵青【作者单位】西南医科大学附属口腔医院正畸科,口颌面修复重建与再生实验室,四川省泸州市 646000;西南医科大学附属口腔医院正畸科,口颌面修复重建与再生实验室,四川省泸州市 646000;西南医科大学公共卫生学院,四川省泸州市 646000;西南医科大学附属口腔医院正畸科,口颌面修复重建与再生实验室,四川省泸州市646000;口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,四川大学华西口腔医院正畸科,四川省成都市 610041【正文语种】中文【中图分类】R394.2文章快速阅读:文题释义:Rev-erbα:又名Nr1D1,是孤儿核受体超家族中的一员,Rev-erbα基因位于人类第17号染色体上。
TNF-α抗肿瘤作用机制

TNF-α抗肿瘤作用机制实现其细胞毒性、抗病毒、免疫调节等生物学功能。
TNFR存在于多种正常细胞及肿瘤细胞表面,TNF-α通过与靶细胞膜上肿瘤坏死因子受体(tumornecrosifactorreceptorTNFR结合。
有TNFR1和TNFR2两种亚型,由于TNFR1胞内区含死亡结构域,溶细胞活性上起主要作用。
Lyu等[1]用scFv23/TNF免疫因子促使SKBR-3-LPTNF天然耐药)细胞表面TNFR1过表达,可提高HER-2/neu过表达的SKBR-3-LP细胞对TNF敏感性。
当TNF-α三聚体与靶细胞膜上TNFR1胞外区结合,PA DDTNFR1assocideathdomainprotein抑制蛋白被释放,PA DD与TNFR1死亡结构域结合,形成TNFR1/PA DD复合体,该复合体招募一系列相关蛋白,引发不同的下游信号通路,促使肿瘤细胞程序性凋亡。
2.1.1 诱导经典和非经典Caspas依赖型细胞凋亡将FA DD招募到TNFR1/PA DD复合体,TNFR1/PA DD复合体通过其死亡结构域和FA DDFaassocideathdomainprotein死亡结构域结合。
FA DD蛋白N端死亡效应结构域(DED可以激活Caspase-8属于ICE/CED3半胱氨酸蛋白酶家族)从而激活Caspase-3通过级联放大反应,引起DNA 断裂和细胞凋亡形态学改变,诱导细胞凋亡。
Chosa等[2]发现用TNF-α预处理HSG细胞,促使Fa受体表达增加,激活Caspas促进HSG细胞凋亡。
TNF-α可通过诱导凋亡启动子如凋亡前体蛋白BidBax表达,激活Caspase-8引起级联放大反应,从而诱导肿瘤细胞凋亡。
同时TNF-α也可诱导非经典的Caspas依赖型细胞凋亡,即改变肿瘤细胞质中线粒体的通透性,释放细胞色素C分泌ROS通过调节凋亡和抗凋亡因子,诱导肿瘤细胞死亡。
2.1.2 招募PA F2激活NF-κB和JNK信号通路PA F2TNFRassocifactor2可以与PA DDN端结合, 当TNF结合TNFR1后。
TNF—α诱导的衰老血管内皮细胞中泛素、细胞周期的变化及意义

注入离心管中, 同时加入新生 胎牛血清终止消化。 1 0 0 0 r / m i n离 心 5 m i n , 吸除 上 清液 , 加 入 M1 9 9完 全培养基。取 0 . 1 m L细胞悬液 , 调整细胞密度至 5 × 1 0 / m L , 接种于2 5 c m 。 培养瓶中。置于5 %C O 、
实验组 。实 验组加 入 2 0 n g / mL T N F - 2 4 h刺激 细 胞 加速 衰老 , 空 白对 照组 不予 处理 。 1 . 2 . 2 泛 素 的 检 测 血 管 内皮 细 胞 融 合 8 0 % 以 上, 收集 空 白对 照组 及 实 验组 细胞 , T r i z o l 试 剂 提 取 细胞总 R N A, 溶解 于 2 0 L D E P C处 理过 的三蒸 水 , 备 用 。在 基 因 库 中 查 得 人 泛 素 D N A序 列 , 应 用 p r i me r 5 . 0设 计 引 物 。泛 素 上 游 引 物 为 5 . 3  ̄ F C G T .
G A A G A C C C T G A C C G - 3 , 下游引物为 5 一 G G A T C T I ' G . G C C T F C A C G r I  ̄ C T 一 3 。内参照 G A P D H上游 引物为 5 一 C T C C A T C A T G A A G T G T G A C G T T - 3 , 下 游 引 物 为
细胞产生 、 释放 的, 具有强大功能 的炎症细胞 因子 ,
它 可调 节 血 管 内皮 细胞 功 能 、 改 变 其 基 因 表 达 谱 J 。T N F 一 仅引起 的血 管 内皮 细 胞损伤 破坏 在很 多 心脑 血管疾 病 和血 栓 疾病 的发 病 中具 有重 要 意 义 。
肿瘤坏死因子TNF家族及其受体基础概述
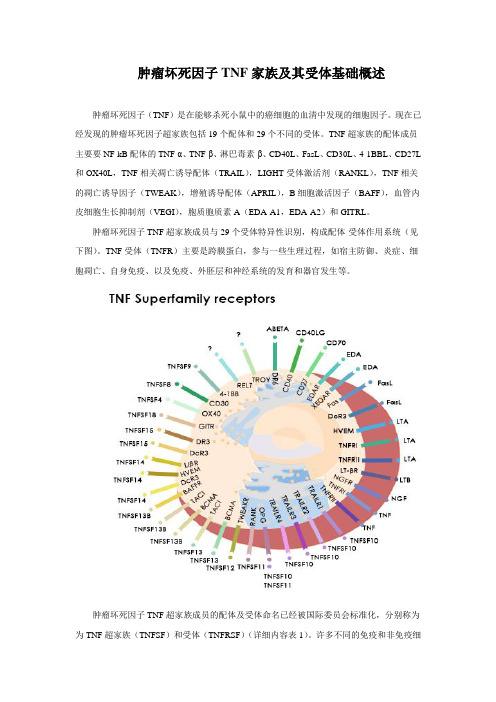
肿瘤坏死因子TNF家族及其受体基础概述肿瘤坏死因子(TNF)是在能够杀死小鼠中的癌细胞的血清中发现的细胞因子。
现在已经发现的肿瘤坏死因子超家族包括19个配体和29个不同的受体。
TNF超家族的配体成员主要要NF-kB配体的TNF-α、TNF-β、淋巴毒素-β、CD40L、FasL、CD30L、4-1BBL、CD27L 和OX40L,TNF相关凋亡诱导配体(TRAIL),LIGHT受体激活剂(RANKL),TNF相关的凋亡诱导因子(TWEAK),增殖诱导配体(APRIL),B细胞激活因子(BAFF),血管内皮细胞生长抑制剂(VEGI),胞质胞质素A(EDA-A1,EDA-A2)和GITRL。
肿瘤坏死因子TNF超家族成员与29个受体特异性识别,构成配体-受体作用系统(见下图)。
TNF受体(TNFR)主要是跨膜蛋白,参与一些生理过程,如宿主防御、炎症、细胞凋亡、自身免疫、以及免疫、外胚层和神经系统的发育和器官发生等。
肿瘤坏死因子TNF超家族成员的配体及受体命名已经被国际委员会标准化,分别称为为TNF超家族(TNFSF)和受体(TNFRSF)(详细内容表1)。
许多不同的免疫和非免疫细胞类型均可产生TNF,包括巨噬细胞、T细胞、肥大细胞、粒细胞、天然杀伤(NK)细胞和非造血细胞,如成纤维细胞、神经元、角质形成细胞和平滑肌细胞。
表达每个配体或受体的细胞类型可以查看表1。
表1:人肿瘤坏死因子TNF家族受体及其配体表达图谱官方名配体表达细胞官方名受体表达细胞TNFSF1 TNF-β、LT-αNK、T、B TNFRSF1ATNFR1(DR1)造血和免疫细胞TNFRSF1B TNFR2 免疫和内皮细胞TNFSF2 TNF-α巨噬细胞、NK、T、BTNFRSF1A/B TNFR1/2 免疫和内皮细胞TNFSF3 LT-β活化的CD4+T细胞、T、DC、NKTNFRSF3 LT-βRNK、CD4+和CD8+ T细胞TNFSF4 OX40L(CD252)B、T、DC、内皮细胞、平滑肌细胞TNFRSF4OX40(CD134)活化的CD4+T细胞、中性粒细胞TNFSF5 CD40L(CD154)活化的CD4+T细胞、肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、NKTNFRSF5 CD40B、DC、单核细胞、胸腺上皮、Reed-Sternberg细胞TNFSF6 FasL(CD95L、Apo1L)活化的脾细胞、胸腺细胞、非淋巴组织、NKTNFRSF6Fas(CD95、Apo1、DR2)上皮细胞、肝细胞、活化的成熟淋巴细胞和转化细胞TNFRSF6B DcR3 肺和结肠细胞TNFSF7 CD27L(CD70)NK、T、B、肥大细胞、平滑肌细胞、胸腺上皮细胞TNFRSF7 CD27造血祖细胞、CD4+和CD8+T细胞TNFSF8 CD30L(CD153)活化的T、B、单核细胞、粒细胞、髓质胸腺上皮细胞TNFRSF8 CD30 Reed-Sternberg细胞TNFSF9 4-1BBL APC细胞(B、DC、巨噬)、肥大细胞TNFRSF94-1BB(CD137、ILA)T、NK、肥大细胞、嗜中性粒细胞TNFSF10 TRAIL(Apo2L)DC、NK、TTNFRSF10ATRAILR1(DR4、Apo2)大多数正常和转化的细胞TNFRSF10BTRAILR2(DR5)大多数正常和转化的细胞TNFRSF10CTRAILR3(DcR1)大多数正常和转化的细胞TNFRSF10DTRAILR3(DcR2)大多数正常和转化的细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF11 RANKL(TRANCE、OPGL、ODF)T、胸腺、淋巴结TNFRSF11ARANK(TRANCER)破骨细胞、成骨细胞、活化的T细胞TNFRSF11BOPG(OCIF)破骨细胞前体,内皮细胞等TNFSF12 TWEAK(Apo3L)单核细胞TNFRSF12ATWEAKR(FN14)内皮细胞和成纤维细胞TNFSF13 APRIL(TALL-2、TRDL-1)巨噬细胞、淋巴细胞、肿瘤细胞TNFRSF13A/17BCMAB、PBL、脾、胸腺、淋巴结、肝脏、肾上腺TNFRSF13B TACIB、活化的T、PBL、脾、胸腺、小肠TNFSF13B BAFF单核细胞、巨噬细TNFRSF13B TACI B、活化的T、PBL、脾、(BLYS、THANK)胞、DC、T 胸腺、小肠TNFRSF13C BAFFRB、T、PBLs、脾脏、淋巴结TNFRSF17 BCMAB、T、PBLs、脾脏、淋巴结TNFSF14 LIGHT(HVEML,LT-γ)粒细胞、单核细胞、DC、TTNFRSF14LIGHTR(HVEM)T、B、单核细胞、淋巴样细胞TNFRSF3 LT-βR非淋巴结造血和基质细胞TNFSF15 VEGI(TL1A)内皮细胞、APC细胞(B、DC、巨噬)TNFRSF25 DR3 NK、TNFRSF6B DcR3 活化的T细胞TNFSF18 GITRL 人脐静脉内皮细胞TNFRSF18GITR(AITR)CD4+ CD25+ T细胞EDA-A1 皮肤EDAR 外胚层衍生物EDA-A2 皮肤XEDAR 外胚层衍生物、胚胎毛囊未识别TNFRSF19 TROY(TAJ)胚胎皮肤、上皮、毛囊、脑未识别TNFRSF19L RELT 淋巴组织、造血组织未识别TNFRSF21 DR6 T未识别TNFRSF16 NGFR(CD271)神经元轴突、雪旺氏细胞、神经细胞肿瘤坏死因子TNF超家族各成员在细胞生物学中重要作用。
《第2章第2节 动物细胞工程—动物细胞培养》分层作业1

《第2章第2节动物细胞工程—动物细胞培养》分层作业1一、单选题1.如图是动物细胞培养过程中可能出现的接触抑制现象,对此下列有关叙述错误的是()A.正常动物细胞培养过程中均会出现接触抑制现象B.癌细胞无接触抑制因而培养时可形成多层细胞C.出现接触抑制时细胞将停止分裂活动D.出现接触抑制后需利用胰蛋白酶消化后才可进行传代培养2.下列有关动物细胞培养及细胞工程的叙述,正确的是()A.动物组织培养过程中不会出现细胞的分化B.动物成熟体细胞的细胞核仍然具有脱分化和使其后代细胞再分化实现全能性的能力C.培养骨髓瘤细胞时要定期使细胞从培养瓶壁上脱离,以解除接触抑制D.细胞传代培养过程中,一定要用到胰蛋白酶处理3.某研究小组为测定药物对体外培养细胞毒性的大小,准备对某种动物的肝肿瘤细胞(甲)和正常肝细胞(乙)进行动物细胞培养。
下列说法正确的是()A.制备肝细胞悬液时,可用胃蛋白酶代替胰蛋白酶处理肝组织B.CO2培养箱中CO2浓度维持在5%左右,以促进细胞呼吸C.本实验应设置对照实验,以检测药物对甲、乙的毒性大小D.为防止细胞培养过程中细菌的污染,需适量添加干扰素4.下列关于动物细胞培养所需条件的叙述,错误的是()A.无毒、无菌的环境B.温度与动物体温相近C.不需要O2,需要CO2调节培养液的pH D.合成培养基中通常需加入血清5.一般来说,动物细胞体外培养需要满足以下条件()①无毒的环境②无菌的环境③培养基需加动物血清④温度与体温相近⑤需要O2,不需要CO2⑥需要保持稳定的pHA.①②③④⑤⑥B.①②③④C.①③④⑤⑥D.①②③④⑥6.下列关于动物细胞培养的叙述,错误的是()A.一般选取动物胚胎或幼龄组织细胞进行细胞培养B.为防止杂菌污染,可在培养基中添加一定量的抗生素C.培养动物细胞的培养基中无需添加血清、血浆,以免造成污染D.定期更换培养液,防止细胞代谢产物积累对细胞自身造成危害7.下图为动物成纤维细胞的培养过程示意图。
肿瘤坏死因子TNF教学文案

2. 新型TNF的研究
随着各方面研究的不断深入,对TNF家族的认识亦日趋加深。一些新的TNF突变体、TNF的类似物不断被发现。TNF的新剂型,如TNF与单克隆抗体结合的产物,用磁性高分子微球包裹TNF-α后进行磁载体导向治疗的研究等,也不断涌现。
2003年,国内也是世界上第一例突变体新型人重组肿瘤坏死因子(nrhTNF)获得批准生产。
(2)将TNF基因导入免疫细胞,利用过继免疫治疗肿瘤对肿瘤有免疫力的供者淋巴细胞或肿瘤患者自身的淋巴细胞,在体外导入TNF基因,经培养、增殖后再回输至患者体内,这些回输的免疫细胞在发挥特异的免疫反应的同时,尚可在肿瘤周围大量分泌TNF,增强其抗肿瘤活性。(3)将TNF受体基因转入肿瘤细胞,提高对TNF的敏感性TNF杀伤肿瘤细胞的主要机制是于肿瘤表面的TNF受体结合,通过受体产生的一系列效应来发挥作用。对某些肿瘤果不理想的原因的是肿瘤细胞表面缺乏TNF受体。将TNFR1(在TNF杀伤肿瘤中起主导作用的受体亚型)基因导入肿瘤细胞,可使原来TNF受体不表达或低表达的肿瘤细胞也可表达TNF受体,增加其对TNF的敏感性,提高TNF的抗肿瘤效果。
TRAIL
TRAIL(TNF related apoptosis inducing ligand)是最近发现的TNF 家族成员。在体外实验中,TRAIL能诱导多种肿瘤细胞凋亡,而正常组织细胞却对其不敏感,提示TRAIL可能成为一种新的抗肿瘤药物。TRAIL受体的发现揭示了一种新的细胞凋亡调控机制,既通过假受体竞争性抑制配体,从而诱导细胞凋亡作用。TRAIL可能与Fas互补而发挥作用,而且与HIV-1感染所致的T细胞减少及p53介导的DNA损伤所致细胞凋亡有关。
肿瘤坏死因子
Tumor Necrosis Factor, TNF
小鼠肿瘤坏死因子α(TNF-α)ELISA 实验说明书

小鼠肿瘤坏死因子α (TNF-α)酶联免疫试剂盒使用说明书【预期应用】ELISA法定量测定小鼠血清、血浆、细胞培养物上清、组织裂解液中TNF-α含量。
【产品性能指标】1、检测范围:15.6 pg/ml-1000 pg/ml2、灵敏度:3.9 pg/ml3、精密度:批内差CV%<8%,批间差CV%<10%4、特异性:本试剂盒特异性检测小鼠TNF-α,且与其他相关蛋白无交叉反应。
【实验原理】用纯化的抗体包被微孔板,制成固相载体,往包被抗TNF-α抗体的微孔中依次加入标本或标准品、生物素化的抗TNF-α抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB 在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样本中的TNF-α呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
【试剂盒组成成分】组份96T酶标板(Assay plate) 12条×8孔标准品(Standard) 2瓶(冻干品)生物素标记抗体(Biotin-antibody) 1 x 120 μl/瓶(100×)辣根过氧化物酶标记亲和素(HRP-avidin) 1 x 120 μl/瓶(100×)生物素标记抗体稀释液(Biotin-antibody Diluent) 1 x 15 ml/瓶辣根过氧化物酶标记亲和素稀释液(HRP-avidin Diluent) 1 x 15 ml/瓶样本稀释液(Sample Diluent) 1 x 50 ml/瓶浓洗涤液(Wash Buffer) 1 x 20 ml/瓶(25×)底物溶液(TMB Substrate) 1 x 10 ml/瓶终止液(Stop Solution) 1 x 10 ml/瓶板贴 4【存储条件及有效期】未开封试剂盒试剂盒避光保存于2-8℃。
有效期为六个月。
请在试剂盒标注的有效日期内使用。
骨髓T细胞高表达TNF-α在再生障碍性贫血免疫病理中的作用

骨髓T细胞高表达TNF-α在再生障碍性贫血免疫病理中的作用傅晋翔;施小凤;黄海雯;李军;陈萍;孙谕【期刊名称】《江苏医药》【年(卷),期】2004(30)10【摘要】目的观察再生障碍性贫血(AA)患者骨髓中肿瘤坏死因子(TNF-α)含量变化、分泌的细胞及临床意义.方法应用Elisa检测骨髓TNF-α水平,多色免疫荧光标记技术和流式细胞术分析T细胞膜型、胞浆内TNF-α含量;纯化T细胞经植物凝血素(PHA)、Flt3配体(FL)及白介素-2(IL-2)激发后培养上清中TNF-α水平;T辅助细胞(Th)亚群改变.结果AA患者骨髓中TNF-α水平显著升高与对照组比P<0.05,且与患者外周血白细胞数呈负相关(r=-0.78,P<0.05).患者骨髓T细胞无膜型TNF-α及受体表达,CD4+和CD8+细胞胞浆中TNF-α含量显著增加,但两者无差别;淋巴细胞经PHA、FL及IL-2激发后培养上清中TNF-α水平升高,尤以PHA的作用最为显著;AA患者骨髓中T细胞极化异常,Th1细胞比例增多,Th1/Th2增高.结论AA 患者淋巴细胞极化异常,Th1细胞比例增多,骨髓中T细胞胞浆中TNF-α含量显著增多是AA骨髓衰竭的原因之一.【总页数】3页(P740-742)【作者】傅晋翔;施小凤;黄海雯;李军;陈萍;孙谕【作者单位】苏州大学附属第二医院,215004;苏州大学附属第二医院,215004;苏州大学附属第二医院,215004;苏州大学附属第二医院,215004;苏州大学附属第二医院,215004;苏州大学附属第二医院,215004【正文语种】中文【中图分类】R6【相关文献】1.树突状细胞在再生障碍性贫血患者T细胞寡克隆增生中的作用 [J], 傅晋翔;张勇;张晓慧;孙谕2.免疫调节T细胞在再生障碍性贫血细胞免疫功能紊乱中的作用 [J], 唐文珏3.调节性T细胞在再生障碍性贫血发病机制中的作用 [J], 赵瑞玲;胡致平;林圣云;戴铁颖;武利强;周郁鸿4.TNF-α在运动调节老年小鼠骨髓间充质干细胞增殖分化能力中的作用 [J], 李刚5.CD4+ CD25+调节性T细胞表达在再生障碍性贫血、骨髓增生异常综合征中的意义 [J], 王欣;杨敬慈;张广杰;张建;林凤茹因版权原因,仅展示原文概要,查看原文内容请购买。
TNF-α、IL-1β预激活骨髓间充质干细胞条件培养基修复急性辐射小肠黏膜损伤

TNF-α、IL-1β预激活骨髓间充质干细胞条件培养基修复急性辐射小肠黏膜损伤叶山亮; 周伟杰; 郭科航; 卓泽伟; 卢铨; 张宸; 骆昱均; 陈浩; 沙卫红【期刊名称】《《现代消化及介入诊疗》》【年(卷),期】2019(024)011【总页数】6页(P1240-1244,1251)【关键词】急性辐射小肠损伤; 条件培养基; 预刺激【作者】叶山亮; 周伟杰; 郭科航; 卓泽伟; 卢铨; 张宸; 骆昱均; 陈浩; 沙卫红【作者单位】510080 广东省人民医院(广东省医学科学院)消化内科【正文语种】中文【中图分类】R574.5急性辐射小肠损伤(radiation-induced intestinal injury,RIII)是放射性治疗常见的并发症,尤其是盆腔、腹腔恶性肿瘤病人接受放射治疗后,发生率高达75%[1]。
常见临床表表现为腹痛、腹泻、便血等,严重损伤患者出现血样腹泻、消化不良、脂肪泻、贫血、全身感染等,严重影响着患者的生活质量[2-3]。
然而,目前的临床治疗疗效有限。
因此,临床上需要更好的治疗方法。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)是一类能够自我更新并且有多向分化能力的干细胞。
当前多项研究显示BM-MSCs移植对修复肠道黏膜损伤有良好的治疗作用[4],如炎症性肠病[5]、坏死性小肠结肠炎[6]和肠缺血再灌注损伤[7]均有明显的修复疗效。
除此之外,间充质干细胞还具有抑制炎症和直接促进再生的作用[8]。
然而,在BM-MSCs移植中,存在医源性肿瘤形成的可能、细胞排斥反应和输注毒性的风险,而且BM-MSCs静脉注射后,大部分细胞以微小的栓子形式滞留在肺脏、肝脏内,减少了它们在病灶中的含量以及作用[9-10]。
以上的不足严重限制了BM-MSC移植的临床应用。
骨髓间充质干细胞条件培养基(conditioned medium derived from bone marrow-mesenchymal stem cells, MSC-CM)含有间充质干细胞的旁分泌因子以及营养因子,可以下调炎症,起到保护肠黏膜的作用,还可避免BM-MSCs移植的不足,被认为是BM-MSCs的理想替代。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ro l e o f TNF — — O L o f Ex e r c i s e— — me d i a t e d Re g u l a t i o n o n Pr o l i f e r a t i o n a nd Di fe r e n t i a t i o n o f Ag i n g Mi c e Bo ne Ma r r o w Me s o c hy ma l S t e m Ce l l s
在运 动组 B MS C中高表 达, 成脂相关基 因 P P A R y和 C / E B P  ̄在对照组 B MS C中高表达 ; 3 ) 运动组 B MS C 中三种 炎症因 子I L一6 、 I L一8和 T N F—O L 均 出现 不同程度 的下降, 其中T N F一 降低 最明显 ; 4 ) 在 运动组 B MS C s中添加 T N F一0 【 因 子后 , 细胞生长变慢 , R u n x 2表达显著 降低 , P P A R y和 C / E B P  ̄表达升高 ; 对照组 B MS C s 添加 T N F—O t 抗体后 , 出现 细 胞 生长相反 变化 。结论 : 运动可通过 降低 T N F— O t 表达 而增强 B MS C s的增殖及 成骨分化 能 力, 这 可能是运 动抗骨质
LI Ga Байду номын сангаас g
( D e p a r t m e n t o f P . E, Z h a n j i a n g N o r ma l C o l l e g e ; Z h a n j i a n g G u a n g d o n g 5 2 4 0 4 8 , C h i n a )
Ab s t r a c t : Me t h o d s :T h e 1 8 mo n t h s o l d mi c e w e r e r a n d o ml y d i v i d e d i n t o c o n t r o l a n d e x e r c i s e g r o u p .T h e c o n t r o l mi c e w e r e n o r ma l l y b r e d a n d t h e e x e r c i s e mi c e we r e t r a i n e d o n t r e a d mi l l s .Af t e r 8 we e k s ,t h e mi c e B MS C s we r e h a r v e s t e d a n d c u l t u r e d i n v i t r o .T h e g r o w t h c u r v e wa s o b t a i n e d b y c e l l c o u n t i n g .T h e e x p r e s s i o n l e v e l o f i n f l a mma t o r y f a c t o r s ,o s t e o g e n e s i s—r e l a t e d
e x p l o r e t h e e f f e c t o f T N F一0 l o n B MS C p r o l i f e r a t i o n a n d d i f f e r e n t i a t i o n .R e s u l t s :( 1 )T h e B MS C s i n e x e r c i s e ro g u p g r e w o b v i — o u s l y f a s t e r t h a n t h e c o n t r o l g r o u p .( 2 )T h e B MS C s i n e x e r c i s e g r o u p s h o w e d h i g h e r e x p r e s s i o n o f o s t e o g e n e s i s— r e l a t e d
李 刚
( 湛江师范学院 , 广东 湛 江 5 2 4 0 4 8 )
摘
要: 方法 : 将老年 小鼠随机分 为对 照组和运动组 , 对照组常规饲养 , 运动组进行跑 步干预。8周后 用计 数法检测 细
胞 生长曲线, 实时 定 量 R T— P C R检 测 炎症 因子 及 成 骨 、 成 脂 相 关 基 因在 B M S C的表 达 。 用 T N F—O t 因子 或 T N F一0 【 抗 体观察其对 B M S C分 化 、 增 殖 能 力 的影 响 。结 果 : 1 ) 运动组 B M S C s生 长速 度 明显 快 于 对 照 组 ; 2 ) 成 骨相 关 基 因 R u n x 2
疏 松 的机 制 之 一 。
关键词 : 运动 ; 骨髓 间 充质 干 细胞 ; T N F— O t ; 分化 ; 增 殖 中 图分 类 号 : 8 0 4 . 7 文 献标 识 码 : A 文章编号 : 1 0 0 7— 3 2 3 X( 2 0 1 3 ) 0 5— 0 1 0 4—0 5
第3 3卷
第 5期
广州体育学 院学报
J o u r n a l o f Gu a n g z h o u S p o r t U n i v e r s i t y
Vo 1 . 3 3 No . 5 S e p . 201 3
2 0 1 3年 9月
T N F—O t 在 运 动 调 节 老 年 小 鼠 骨 髓 间 充 质 干 细 胞 增 殖 分 化 能 力 中 的 作 用
g e n e s a nd a d i p o g e n i c g e n e s we r e e v lua a t e d b y r e lt a i me q ua n t i t a t i v e RT — PCR. TNF 一 a n d TNF — O t a nt i b o d y we r e us e d t o
