小鼠骨髓间充质干细胞原代培养
小鼠骨髓基质干细胞的培养

小鼠骨髓基质干细胞的培养学号122010000178,2010级硕士同仁医院,严森骨髓基质干细胞( marrow st romal stem cell,MSC)是一种来源于骨髓的成体干细胞, 本实验通过小鼠骨髓基质干细胞的培养及对其进行体外细胞特性的研究。
目的: 取小鼠股骨骨髓进行骨髓基质干细胞的原代培养,通过相差显微镜、光镜及扫描电镜观察, 了解骨髓基质干细胞的生长情况及其特点。
练习血细胞计数器的使用方法1 材料与方法1.1 材料,小白鼠(实验动物部提供) , 培养瓶,α-MEM 培养基5ml, 20ml空离心管,hanks 液近50ml,胎牛血清(一小离心管)0.2ml ,,双抗(青霉素+庆大霉素)0.2ml,碳酸氢钠0.2ml,10ml注射器,无菌器械包括:镊子两把(无齿镊,有齿镊,组织剪大小两把),吸管三只(有刻度两只)酒精棉若干,酒精灯1.2 基质干细胞的培养1.2.1操作者洗手戴鞋套在通风柜中保证无菌操作,点燃酒精灯,把三只试管纸套取下,从高压灭菌的套筒中取三只吸管于试管中,并妥善放在试管架上1..2.2取0.1ml单抗于hanks液中,剩余单抗倒入α-MEM培养基中,并吸取碳酸氢钠液一滴于hanks液中,使溶液呈碱性(红色)。
1.2.3取1 月龄小白鼠1只,雌雄不限,体重约20g, 断颈脱臼处死, 无菌条件下暴露股骨, 在培养皿中去除皮肤,附带的肌肉和骨膜,切断股骨,切断上肢,并将每一肢上下剪下两个小口便于冲洗,剥离四肢时用hanks 液进行冲洗,1.2.3分次取12mlhanks液于10ml注射器中,分别灌洗四肢骨髓,一肢骨髓用去3ml,反复上下冲洗,用空的大离心管(20ml)收集冲洗液,并将冲洗液收集好后加盖离心,1000转,5分钟1.2.4弃掉上述离心好的细胞液上清,再加入12mlhank液,并用吸管反复吹打后再次离心1000转,5分钟1.2.5弃掉上述离心好的细胞液上清,加入5ml的α-MEM 培养基,加胎牛血清,,再加入12mlhank液,并用吸管反复吹打后再次离心1000转,5分钟1.2.6弃上清,加样抢取0.1ml于小离心管中,再加入0.7ml(相当于7倍稀释)的Trypan 染料,在相差显微镜下将盖玻片盖好在计数池上开始计数,剩余细胞悬液加入培养瓶中在适宜环境下进行接种培养可见细胞数目:四大个细胞总数/4*稀释倍数*1042.结果:四个大格是50个细胞的,计算的结果:8.75×105/ml个,3.注意事项:3.1无菌操作下进行,如组织材料遗落在非无菌区则弃之,3.2不要让液体漫过计数池,并且让标本在格子架上流动,计数池液体要充分,不要让碎片或者气泡进入到细胞计数池中,在格子上的细胞不用记数在内,要数在小格中的细胞,3.3小鼠处死后要迅速制作股骨标本,皮下剪开时切勿伤及腹腔,及大血管,影响标本制作3.4吹打时不要产生气泡,。
小鼠骨髓基质干细胞的培养

1.2.5弃掉上述离心好的细胞液上清,加入5ml的α-MEM 培养基,加胎牛血清,,再加入12mlhank液,并用吸管反复吹打后再次离心1000转,5分钟
1.2.6弃上清,加样抢取0.1ml于小离心管中,再加入0.7ml(相当于7倍稀释)的Trypan染料,在相差显微镜下将盖玻片盖好在计数池上开始计数,剩余细胞悬液加入培养瓶中在适宜环境下进行接种培养
小鼠骨髓基质干细胞的培养
学号122010000178,2010级硕士同仁医院,严森
骨髓基质干细胞( marrow st romal stem cell,MSC)是一种来源于骨髓的成体干细胞, 本实验通 过小鼠骨髓基质干细胞的培养及对其进行体外细胞特性的研究。
目的: 取小鼠股骨骨髓进行骨髓基质干细胞的原代培养,通过相差显微镜、 光镜及扫描电镜观察, 了解骨髓基质干细胞的生长情况及其特点。练习血细胞计数器的使用方法 1 材料与方法
1.2.3取 1 月龄小白鼠 1只,雌雄不限,体重约20g, 断颈脱臼处死, 无菌条件下暴露股骨, 在培养皿中去除皮肤,附带的肌肉和骨膜,切断股骨,切断上肢,并将每一肢上下剪下两个小口便于冲洗,剥离四肢时用hanks 液进行冲洗,
1.2.3分次取12mlhanks液于10ml注射器中,分别灌洗四肢骨髓,一肢骨髓用去3ml,反复上下冲洗,用空的大离心管(20ml)收集冲洗液,并将冲洗液收集好后加盖离心,1000转,5分钟
可见细胞数目:四大个细胞总数/4*稀释倍数*104
2.结果:四个大格是50个细胞的,计算的结果:8.75×105/ml个,
3.注意事项:
发育生物学实验指南简要

实验一小鼠骨髓间充质干细胞的分离培养一、目的要求1.掌握小鼠骨髓间充质干细胞的分离培养方法。
2.了解小鼠骨髓间充质干细胞的鉴定方法。
3.了解小鼠骨髓间充质干细胞定向分化和鉴定方法。
二、材料与设备1.动物:SD大鼠。
2.主要试剂:胎牛血清(FBS),DMEM--LG培养基,PBS,抗体(NSE和GFAP)。
3.主要器材与仪器:手术剪,手术镊,眼科剪,眼科镊,培养瓶,培养皿,称量瓶,刻度离心管,吹打管,注射器,倒置相差显微镜,CO2培养箱三、实验步骤1.小鼠骨髓间充质干细胞(bone marrow stromal stem cells,BMSC)的分离培养:⑴小鼠BMSC的分离和原代培养:①以颈髓离断法处死小鼠。
在无菌条件下取出小鼠股骨,除去骨表面附着的组织,用PBS 清洗干净。
②用剪刀去除股骨两端,暴露骨髓腔。
无菌条件下用5ml注射器抽取PBS约3-4ml将小鼠股骨内的骨髓冲出,收集骨髓冲洗液,将收获的全部骨髓用注射器反复抽吸,以打散组织成为细胞悬液。
③收集细胞悬液约7ml并将其转入15毫升离心管中,1500r/min离心5min,弃上清液及脂肪层。
④在细胞沉淀中加入5-6ml含10%胎牛血清的DMEM一LG培养基,倒置显微镜下观察,37℃、5%CO2 培养箱中培养。
2. 带学生在电脑上观看以往的小鼠间充质干细胞免疫荧光图片。
实验二大鼠神经干细胞的分离培养一、目的要求1.掌握大鼠胚胎神经干细胞的分离培养方法。
2.了解大鼠胚胎神经干细胞的鉴定方法。
3.了解大鼠胚胎神经干细胞定向分化和鉴定方法。
二、材料与设备1.动物:孕龄约15天的Wistar或SD孕鼠2.试剂:条件培养基(DMEM/F12+20ng/mlbFGF+20ng/mlEGF+20μl/mlB27),D-Hank’s液(NaCl 8g, KCL0.4g,Na2HPO4.12H2O 0.1g, KH2PO4 0.06g, NaHCO3 0.35g, 加水1000ml溶解,调PH 值为7.2-7.4,高压灭菌后,4℃储存备用),0.25%胰蛋白酶(D-Hank’s液配制,过滤灭菌,-20℃储存),抗体(巢蛋白、NSE、GFAP)。
BMSCs成脂成骨分化实验总结

骨髓间充质干细胞(BMSCs)培养以及成脂、成骨诱导分化一,C57小鼠BMSCs原代培养1,实验前准备好相关手术器械,培养器材及相关试剂PBS 平衡缓冲液、10%FBS,IMDM培养基。
2,脱颈法处死C57小鼠,在75%乙醇中浸泡5min,转移至超净工作台中,无菌条件下分离出小鼠的长骨(股骨和胫骨),浸泡于PBS溶液中。
3,对股骨和胫骨进行深层次解剖,去除附着的肌肉组织,剪掉长骨两端的干骺端,用10%FBS,IMDM培养基反复冲洗骨髓腔,直至骨髓腔发白,收集洗涤液,用移液枪轻轻吹散分离为单个细胞。
4,细胞接种于六孔板中培养,轻微摇匀,使细胞在孔中均匀分布,放置于37℃、5%CO2培养箱中静置培养,培养期间不要移动六孔板,使BMSCs充分贴壁。
5,培养48h后换液,用预热的PBS缓冲液轻轻洗涤细胞2次,添加新鲜培养基,之后每隔48h换液1次。
原代培养6-7d 后细胞铺满80%(图1),可进行传代培养。
图1:BMSCs原代培养6-7d二,BMSCs成脂诱导分化BMSCs铺皿,细胞融合达80%以上后,弃去原培养基,添加成脂诱导培养基(IMDM中加入10%FBS,10μg/ml胰岛素,1μM 地塞米松,0.5mMIBMX,0.1mM吲哚美辛)。
3d换液1次,分化12d。
待脂滴形成后进行油红O染色,PBS缓冲液清洗3次,10%中性甲醛固定20min,再用PBS缓冲液清洗2次,油红O染液浸染30min,PBS缓冲液清洗2次,苏木素染液浸染1min,弃去染液,倒置显微镜下观察拍照。
成脂诱导分化过程中发现在诱导5d时,细胞形态开始变圆并大量脱落,部分细胞中出现细小脂滴(图2)。
图2:BMSCs成脂诱导5d三,BMSCs成骨诱导分化BMSCs铺皿,细胞融合达80%以上后,弃去原培养基,添加成骨诱导培养基(IMDM中加入10%FBS,5μg/ml胰岛素,0.1μM 地塞米松,0.2mM维生素C和10mMβ-甘油磷酸盐)。
LacZ转基因小鼠间充质干细胞的分离培养和生物学特性研究

LacZ转基因小鼠间充质干细胞的分离培养和生物学特性研究毛飞;高硕;钱晖;朱伟;严永敏;孙靖;许文荣【摘要】目的分离培养LacZ转基因小鼠骨髓间充质干细胞(LacZ-MSC),研究其生物学特性.方法用全骨髓贴壁法分离LacZ-MSC,体外扩增,并观察细胞生长特性,流式细胞议检测细胞周期,成骨成脂诱导试验分析LacZ-MSC转分化特性,X-gal染色法检测其LacZ基因的表达.结果 LacZ-MSC培养4d后有散在呈针尖状的贴壁细胞,5~8d后形成集落或融合呈纤维状;体外扩增每只小鼠原代可获得(1~3)×105个细胞,10代可获得(1 ~3) ×1O10个细胞总数,10代后的细胞增殖能力下降;细胞周期分析显示,G0/G1期:占78.44%,G2/M期:占5.20%,S期:占16.36%;成骨成脂诱导试验表明,LacZ-MSC细胞具有向成骨细胞和脂肪细胞分化的潜能;X-gal染色结果表明,LacZ-MSC细胞携带LacZ基因.结论从LacZ转基因小鼠骨髓中成功地分离了携带有LacZ基因的MSC,在体外具有较好的增殖更新能力,3~ 10代的LacZ-MSC作为组织工程细胞具有广阔的应用前景.【期刊名称】《临床检验杂志》【年(卷),期】2011(029)007【总页数】3页(P542-544)【关键词】间充质干细胞;细胞增殖;骨髓;LacZ基因【作者】毛飞;高硕;钱晖;朱伟;严永敏;孙靖;许文荣【作者单位】江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013;江苏大学基础医学与医学技术学院,江苏镇江212013【正文语种】中文【中图分类】R329.2间充质干细胞(mesenchymal stem cell, MSC)是最早由Friedenstein报道的一种来源于中胚层和外胚层的成体干细胞,易贴附于塑料培养板表面,具有高度自我更新能力和多向分化潜能。
小鼠骨髓间充质干细胞培养

小鼠骨髓间充质干细胞培养目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。
密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。
随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。
实验准备:1实验动物雄性,C57B L/6小鼠,清洁级,8周龄,体重18-20g。
2实验材料与试剂高糖DMEM培养基,胎牛血清,双抗(青霉素钠,链霉素),培养皿,镊子,眼科剪,止血钳,1mL注射器操作步骤1、小鼠骨髓间充质干细胞的分离及原代培养取8周龄雄性C57BL/6小鼠,颈椎脱臼法处死,75%酒精浸泡5分钟,取出双侧腿骨,置于培养皿中小心剔除粘连于骨上的肌肉组织,剪去腿骨两端,用1m l注射器抽取预冷的培养液反复冲洗骨髓腔,直至骨发白,冲洗液直接收集在插在冰上的离心管中,1500rpm离心5分钟,弃上清,用含10%胎牛血清的高糖DMEM培养液重悬细胞,接种于培养皿中(一只小鼠种一个60mm的培养皿),置于5�2,37℃,培养过夜,吸出上清,用PBS洗两遍,洗掉未贴壁的细胞,加入新鲜的培养液,继续培养。
以后每两天换液1次,并观察细胞形态。
待细胞长至80%-85%时传代(1传2)2、原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,并不断长大、变长,但未观察到细胞分裂,培养第7天开始观察到细胞分裂,随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片。
传代后细胞生长迅速。
采用贴壁培养法可获得足够数量、生长状态良好、增殖能力强的间充质干细胞,随传代数增加,其纯度增加,且该方法简单、实用。
小鼠骨髓间充质细胞原代培养及传代

小鼠骨髓间充质细胞原代培养及传代之flamerking图文版[精华]很多战友发email或PM向我询问小鼠MSC的培养方法,我零零散散地一个个回复过几次,由于我平时时间不是很多,所以回答地时候有些内容写的不是很详细。
今天又有一个战友PM我,询问我培养方法。
看来做小鼠MSC的战友越来越多。
一遍遍地重复写很费时间(想粘贴复制又找不到上次写的在哪~惨!),所以我想还是发贴公布一下。
其实我小鼠MSC在我的课题中不是主角,只是起一个control的作用,因此我在这方面的经验可能没有一些专门做小鼠MSC的战友丰富,不过我还是很愿意把我的经验写出来供大家参考,希望能够起到“抛砖引玉”的作用。
欢迎各位同道对我的方案进行批评和指正,与大家一起分享你们的经验和智慧。
提纲一,简版主要步骤及操作要点。
二,完整版1. 试剂及材料准备2. 动物手术及取材3. 原代细胞培养4. 细胞传代5. 讨论时间关系,今天先给个简版。
我先顶一下,由于我还是新手,故不能说是经验介绍,只好讲让你们指出缺点,谢谢斑竹1. 试剂及材料准备MEM,10%FCS,手术器械,培养瓶,200目滤网,5ml注射器2. 动物手术及取材CR小鼠1只,酒精浸泡5分钟,取股,胫,肱骨,用基培冲出骨髓,滤过,1000转离心,完培重悬,接种于25厘米培养瓶3. 原代细胞培养:,3天后首次换液,自己发现一周贴壁细胞就铺满达90%,自行传代4. 细胞传代:消化下来很少,能下来的增长很慢5. 讨论:没经验欢迎斑竹的继续讲解,希望有经验的老师们能不啬指教羽之无限版主,能有空再讲讲吗这几天,我的原代就是不长,42天了,25平方厘米的培养瓶还未铺慢,不能传代真是天天盼着你啊呵呵,不好意思,最近我的sony笔记本又坏了,上次坏了几次维修部修不好,给我换了台新的,结果以用了没2个月又不能启动了,真是麻烦,我的资料都在里面,最近实验又忙,没空去维修部……不过明天我就去了。
……呵呵,跑题了。
原代骨髓间充质干细胞分离及提取方法

原代骨髓间充质干细胞分离及提取方法骨髓间充质干细胞(Mesenchymal Stem Cells, MSCs)是一种具有多向分化潜能的成体干细胞,广泛应用于组织工程、再生医学等领域。
原代骨髓间充质干细胞的分离和提取是进行相关研究的基础。
本文将详细介绍原代骨髓间充质干细胞的分离及提取方法。
一、实验材料1.骨髓样本:取自健康志愿者或实验动物(如大鼠、小鼠等)。
2.PBS缓冲液:磷酸盐缓冲液,用于细胞洗涤和分离。
3.胎牛血清:用于细胞培养。
4.抗生素:如青霉素和链霉素,用于细胞培养液中,防止细菌感染。
5.细胞分离液:如Ficoll分离液、Percoll分离液等。
6.细胞培养瓶、离心管、移液器等实验室常用器材。
二、分离方法1.骨髓样本采集:在无菌条件下,从志愿者或实验动物体内抽取骨髓,置于含有抗凝剂的离心管中。
2.骨髓细胞分离:将骨髓样本用PBS缓冲液稀释,然后缓慢加入细胞分离液,进行密度梯度离心。
离心后,收集界面层的细胞,即含有骨髓间充质干细胞的一层。
3.细胞洗涤:用PBS缓冲液洗涤细胞,去除残留的分离液和红细胞。
4.细胞计数:用细胞计数板对洗涤后的细胞进行计数,调整细胞浓度为合适的值。
5.细胞接种:将细胞接种于含有胎牛血清和抗生素的细胞培养液中,置于37℃、5% CO2的培养箱中培养。
三、提取方法1.原代培养:将分离得到的骨髓间充质干细胞进行原代培养,待细胞生长至80%-90%汇合时,进行传代。
2.传代培养:将原代细胞用胰蛋白酶消化,然后按照1:2或1:3的比例进行传代。
传代后的细胞继续培养至所需细胞量。
3.细胞冻存:将提取得到的骨髓间充质干细胞进行冻存,以备后续实验使用。
4.细胞复苏:将冻存的细胞在37℃水浴中快速融化,然后用细胞培养液重悬,继续培养。
四、注意事项1.在实验过程中,严格遵循无菌操作原则,防止细胞污染。
2.骨髓样本的采集和处理应在抗凝条件下进行,以保持细胞活性。
3.选择合适的细胞分离液和离心条件,以提高骨髓间充质干细胞的分离纯度。
骨髓间充质干细胞的培养及生物学特性

L U JA i tl I I q a e ( d n n dcl n esy Muaj gC ia Mu aj gMeia U i ri , dni hn i v t n 17 1 ) 5 0 1
[ bt c] O jcv :abn m/ Wm snhm lt l ( M C ) e o t d uu d n reti e i tt o A s at r beteR t oe sO e cy as mc l B S s wr ile a lr dron sg eh b - i T e e es es a d n c te i o v ta e i
lg c h r ce it s a d o e r d mia ttr e el f r t s e e g n e i g a d g n n ie r g M e h d : MS s w r u t rd o i a c a a tr i n f r p e o n a g tc l o i u n i e rn n e e e gn e i . l sc n s s n t o s B C ee c lue
骨 髓 间充 质 干细胞 的培 养及 生ቤተ መጻሕፍቲ ባይዱ 学特 性
刘嘉祺 林
( 牡丹江 医学院
峰
李孟全
牡丹江 17 1 ) 5 0 1
黑龙江
【 摘 要】 目的: 分离、 培养大鼠骨髓间充质干细胞( M C)探讨其生物学特性, B Ss, 为组织工程和基 因工程提供优势靶细胞。
方法 : 骨髓 细胞贴壁 法进行 B S s 全 M C 的原代培养 , 倒置相差显微镜 观察 细胞 形 态, 流式 细胞 仪检 测 B Ss 面抗原 , T 法 MC表 M r 检测 B Ss 殖能力, MC增 并绘制生长 曲线。结果 : 原代培养 2h 4 后看见 少量贴壁细胞 , 为小圆形 ,d 可见梭 形类似 成纤维 初起 3后 细胞 , 涡样 生长, 3— 代细胞均一性 良好 , 代 以后 细胞逐渐有 宽大梭形样 变, 呈漩 传 6 l 0 增殖减慢 , 偶有 细胞漂 浮、 亡。流 式 死 细胞仪检测传 3 代细胞 C 2 表达率为 9% ,D4几乎无表达 。生长曲线显示 , 36 B S s D9 2 C3 传 、 代 M C 有较 强的增殖 能力, 中传 其 6代细胞更为明显 , 1 传 0代细胞的增殖能力较 前有所减弱。 结论 : 成功从 大鼠骨髓组织分离、 培养 B Ss纯度 高, M C, 生物学特性 符合正常干细胞生长规律 , 组织工程和基 因工程理 想的靶 细胞 。 是
间充质干细胞分离及培养方案
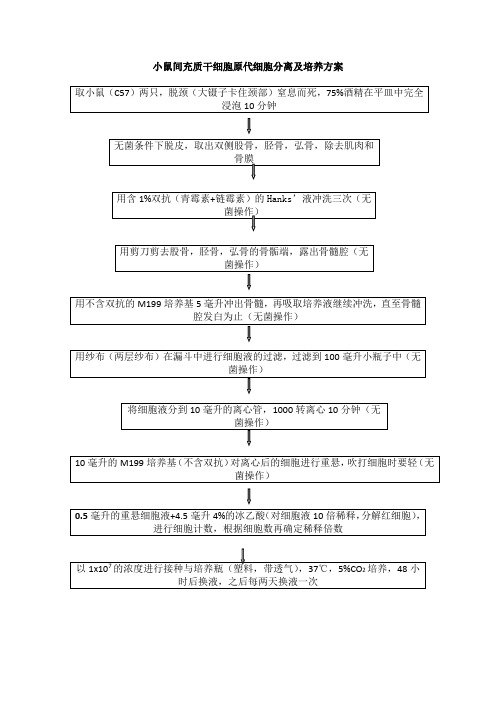
取小鼠(C57)两只,脱颈(大镊子卡住颈部)窒息而死,75%酒精在平皿中完全浸泡10分钟
无菌条件下脱皮,取出双侧股骨,胫骨,弘骨,除去肌肉和骨膜
用含1%双抗(青霉素+链霉素)的Hanks’液冲洗三次(无菌操作)
用剪刀剪去股骨,胫骨,弘骨的骨骺端,露出骨髓腔(无菌操作)
0.5毫升的重悬细胞液+4.5毫升4%的冰乙酸(对细胞液10倍稀释,分解红细胞),进行细胞计数,根据细胞数再确定稀释倍数
以1x107的浓度进行接种与培养瓶(塑料,带透气),37℃,5%CO2培养,48小时后换液,之后每两天换液一次
用不含双抗的M199培养基5毫升冲出骨髓,再吸取培养液继续冲洗,直至骨髓腔发白为止(无菌操作)
用纱布(两层纱布)在漏斗中进行细胞液的过滤,过滤到100毫小瓶子中(无菌操作)
将细胞液分到10毫升的离心管,1000转离心10分钟(无菌操作)
10毫升的M199培养基(不含双抗)对离心后的细胞进行重悬,吹打细胞时要轻(无菌操作)
小鼠骨髓间充质干细胞使用说明

小鼠骨髓间充质干细胞小鼠骨髓间充质干细胞产品说明:为使客户能尽快开展实验,派瑞金发货的原代细胞均处于对数生长期,且每次发货为汇合率达到70%的细胞,收到细胞后即可开展实验。
派瑞金提供的小鼠骨髓间充质干细胞取自新鲜的组织,按照标准操作流程分离培养。
研发的小鼠骨髓间充质干细胞完全培养基能提供细胞最佳的生长条件,降低杂细胞污染,保证不同批次间细胞质量的稳定。
同时,派瑞金还建立了严格的细胞鉴定流程,所提供的原代细胞均需经过细胞类型特异性标记物、细胞形态学等检测,保证细胞纯度在90%以上;同时也需经过微生物检测,保证不含有HIV、HBV、HCV、支原体、真菌及其他类型的细菌。
注意事项:1. 收到细胞后首先观察细胞瓶是否完好,培养液是否有漏液、浑浊等现象,若有上述现象发生请及时和我们联系。
2. 仔细阅读细胞说明书,了解细胞相关信息,如细胞形态、所用培养基、血清比例、所需细胞因子等。
3. 请客户用相同条件的培养基用于细胞培养。
培养瓶内多余的培养基可收集备用,细胞传代时可以一定比例和客户自备的培养基混合,使细胞逐渐适应培养条件;建议使用派瑞金的完全培养基。
4. 建议客户收到细胞后前3天各拍几张细胞照片,记录细胞状态。
5. 该细胞只能用于科研,不得用于临床应用。
小鼠骨髓间充质干细胞产品简介:产品名称:小鼠骨髓间充质干细胞组织来源:正常小鼠骨髓产品规格:5×105cells / 25cm2培养瓶小鼠骨髓间充质干细胞简介:小鼠骨髓基质系统内存在的骨髓间充质干细胞(Bone marrow mesenchymal stemcells,BM-MSCs)是一种除造血干细胞以外的、具有多向分化潜能的干细胞,可以向骨、软骨、肌组织、皮肤、脂肪、神经等多种组织分化,因此可以作为组织工程中的种子细胞。
本公司生产的小鼠骨髓间充质干细胞采用冲洗骨髓,密度梯度离心,骨髓基质细胞专一性选择培养筛选获得,经检验细胞不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。
骨髓间充质干细胞培养方法大全

一、四种方法简介及优缺点:骨髓间充质干细胞主要有4种体外分离方法:贴壁筛选法,密度梯度离心法,流式细胞仪分离法和免疫磁珠分离法。
贴壁筛选法是利用细胞贴壁时间及贴壁牢固性的不同逐步将非贴壁细胞和其它杂质细胞去除的一种简单易行的培养MSCS的方法。
贴壁分离培养法分离的MSCS能在体外培养条件下生长良好、可连续传代,体外培养扩增能力较强,其缺点是细胞纯度较低。
此方法简便,冲出骨髓直接培养,然后利用骨髓MSCS 贴壁生长特性,更换培养液逐步去处漂浮生长的造血系细胞即可获得较纯化的MSCS;而且骨髓中的造血干细胞能分泌生长因子和促贴壁物质,可促进MSCS 贴壁生长,因此全骨髓贴壁法更为可取。
密度梯度离心法梯度离心法的核心主要是基于密度梯度离心技术。
梯度离心法是根据骨髓中细胞成分的比重不同,使用淋巴细胞分离液提取单个核细胞,再进行贴壁培养,从而达到分离、纯化MSCS的目的。
Pittenger等的研究发现通过密度梯度离心分离培养的间充质干细胞在第一代时纯度可以达到95%。
常用的分离方法免疫磁珠法,是利用免疫学的技术分离MSCS,分离细胞的纯度高。
Phinney 用一种免疫耗损技术精确地将造血细胞系和内皮细胞系从基质细胞中分离出来,提供了一种能高效的分离纯化间充质干细胞的方法,但目前仍未筛选到真正特异性的细胞表面标记;而且,这两种分离方法的操作对细胞活性都有较大影响,造成MSCS损伤,出现增殖缓慢等问题,这些技术问题很大程度上限制了这两种方法的应用。
因此,如何能简便高效地获得均质性的间充质干细胞和细胞群仍需要继续探索。
分离细疫磁珠分离和流式细胞仪筛选的方法,不仅对细胞活性影响较大,而且操作复杂,价格昂贵。
然而,这些纯化间充质干细胞的方法比较复杂,一般仅限于在各自的实验室应用。
二、具体实验流程1. 免疫磁珠法分离纯化骨髓间充质干细胞:1 实验动物Sd大鼠2 试剂和仪器BSA、荧光标记小鼠抗体x、PE磁珠试剂盒、抗生物素磁珠、MiniMACS分离器及MS分离柱。
骨髓间充质干细胞-MSC-原代培养与传代培养

骨髓间充质干细胞(MSC)原代培养与传代培养准备工作(1)试管、试管架、滴管、吸管、小鼠固定架、玻璃瓶、玻璃皿、烧杯、橡皮头、剪刀、镊子、纱布、棉球、酒精灯、滴管、移液器、细胞计数器、生理盐水、PBS、双抗(青链霉素)、75%酒精、95%酒精、培养瓶(50ml,260ml)。
(2)BALB/C小鼠(4~5周龄,18~22g,雌雄不限)、胎牛血清(灭活)、DMEM-LG 培养液(美国GIBCO)(3)针头与注射器:4.5号、7号针头(冲小鼠股骨、胫骨和肱骨骨髓,制单细胞悬液)。
实验前准备(1)实验室消毒,隔离衣消毒,小鼠固定架消毒。
配10%FBS培养液,加双抗(内含青霉素、链霉素各100μg/ml)。
(2)用75% 酒精擦拭无菌操作台面,取各种已消毒的培养用品置于超净台面,无菌室及超净台用紫外灯照射30~60 分钟灭菌。
(3)开始工作前先洗手、75%酒精擦拭手至肘部。
穿隔离衣,戴手套。
用70% 酒精擦拭无菌操作台面,并开启无菌操作台风机运转10 分钟后,才可开始实验操作。
点燃酒精灯,安装吸管帽。
实验步骤(1)BALB/C纯系小鼠脱臼处死后,75%乙醇浸泡5min后,在无菌操作台上无菌条件下分离双侧股骨及胫骨,在含生理盐水的50mm2玻璃平皿中去除股骨周围肌肉组织,剪去包括骺板在内的两侧骺端,用10ml注射器(配4.5号针头)抽取适量含10%FBS的完全培养基冲洗骨髓腔,将骨髓冲入培养瓶。
依次用7号针头和4.5号针头(或依次过21、23、25号)反复吹打骨髓细胞悬液,制成单细胞悬液。
细胞悬液在1000rpm离心5min后收集细胞或进行密度梯度离心。
(2)将单细胞悬液于1:2比例加到含1.082比重Percoll细胞分离液的离心管中,4℃条件下,经500g密度梯度离心25min,小心收集离心液界面上乳白色云雾状的单核细胞层,加入等量无血清培养基或磷酸盐缓冲液(PBS)充分洗涤(500g离心5min或180g离心10min)2次,去上清,用10%FBS的培养基悬浮细胞(用0.83%氯化胺破碎红细胞,培养液重悬细胞)。
小鼠骨髓间充质干细胞的目前干细胞培养难点

干细胞培养基的选择研究背景:小鼠骨髓间充质干细胞的目前干细胞培养难点。
小鼠的骨髓基质细胞成分复杂,间充质干细胞比率低,分离培养有一定的难度。
广东医学院的博士研究生陈博士在培养过程中就遇到该问题。
他曾成功饲养成人和大鼠骨髓间充质干细胞。
但新近培养的小鼠间充质干细胞状态就很差。
按照自己的分析:细胞培养操作没有问题,培养条件也不错,试剂来源可靠。
问题应该出现在培养基配方上。
陈博士以原来的骨髓间充质干细胞培养基为基础,按照导师的提点,修改了配方,但细胞不好不坏。
为此他做了两次正交,结果缺总不理想,细胞状态并不稳定。
陈博士为此焦头烂额,担心下一步的实验无法进行。
经朋友介绍找到百恩维公司的技术支持。
解决方案:百恩维的干细胞技术专家了解了陈博士的情况,培养技术、取材和试剂来源等,觉得不存在大问题;问题主要的原因是培养基的成分配比。
建议陈博士重新配制培养基或使用现成的完全培养基。
陈博士为了加快实验进度,直接选用了百恩维小鼠骨髓间充质干细胞培养基。
选用产品:小鼠间充质干细胞培养基(Catalog No.BW110014)实施步骤:1、使用百恩维的小鼠间充质干细胞培养基,进行原代的取材;2、同样时间下,百恩维的培养基的MSC细胞状态明显优于自己配置的培养液;3、经过传代,细胞的状态和增殖能力都很好;4、成功获得了足够进行下一步实验所需的mouse MSC。
结果分析:细胞状态良好,成梭状、紧密分布,大小较均匀。
目前已经传至20代。
对于这次走的弯路,陈博士感慨良多。
要高效的完成课题实验,就需要转变观念,合理利用和整合现有的各个优势资源,快速达到实验目标。
案例分析:目前成功的间充质干细胞培养液主要包含DMEM+FBS+谷氨酰胺+双抗。
其中FBS的品牌和批次对细胞都会有不同的影响;无菌技术不成熟的新手,或者无菌条件不完善的实验室,最好使用双抗。
最后,各成分的配比也有较大影响:大部分间充质干细胞适用低糖,加约10%的FBS等等,对不以寻找配方为目的的干细胞研究人员,我们建议直接使用经过不断优化和严格质量检测的百恩维干细胞培养基,提高科研效率。
小鼠骨髓间充质细胞原代培养及传代

小鼠骨髓间充质细胞原代培养及传代之flamerking图文版[精华]很多战友发email或PM向我询问小鼠MSC的培养方法,我零零散散地一个个回复过几次,由于我平时时间不是很多,所以回答地时候有些内容写的不是很详细。
今天又有一个战友PM我,询问我培养方法。
看来做小鼠MSC的战友越来越多。
一遍遍地重复写很费时间(想粘贴复制又找不到上次写的在哪~惨!),所以我想还是发贴公布一下。
其实我小鼠MSC在我的课题中不是主角,只是起一个control的作用,因此我在这方面的经验可能没有一些专门做小鼠MSC的战友丰富,不过我还是很愿意把我的经验写出来供大家参考,希望能够起到“抛砖引玉”的作用。
欢迎各位同道对我的方案进行批评和指正,与大家一起分享你们的经验和智慧。
提纲一,简版主要步骤及操作要点。
二,完整版1. 试剂及材料准备2. 动物手术及取材3. 原代细胞培养4. 细胞传代5. 讨论时间关系,今天先给个简版。
我先顶一下,由于我还是新手,故不能说是经验介绍,只好讲让你们指出缺点,谢谢斑竹1. 试剂及材料准备MEM,10%FCS,手术器械,培养瓶,200目滤网,5ml注射器2. 动物手术及取材CR小鼠1只,酒精浸泡5分钟,取股,胫,肱骨,用基培冲出骨髓,滤过,1000转离心,完培重悬,接种于25厘米培养瓶3. 原代细胞培养:,3天后首次换液,自己发现一周贴壁细胞就铺满达90%,自行传代4. 细胞传代:消化下来很少,能下来的增长很慢5. 讨论:没经验欢迎斑竹的继续讲解,希望有经验的老师们能不啬指教羽之无限版主,能有空再讲讲吗这几天,我的原代就是不长,42天了,25平方厘米的培养瓶还未铺慢,不能传代真是天天盼着你啊呵呵,不好意思,最近我的sony笔记本又坏了,上次坏了几次维修部修不好,给我换了台新的,结果以用了没2个月又不能启动了,真是麻烦,我的资料都在里面,最近实验又忙,没空去维修部……不过明天我就去了。
……呵呵,跑题了。
BMSCs成脂成骨分化实验总结

骨髓间充质干细胞(BMSCs)培养以及成脂、成骨诱导分化一,C57小鼠BMSCs原代培养1,实验前准备好相关手术器械,培养器材及相关试剂PBS 平衡缓冲液、10%FBS,IMDM培养基。
2,脱颈法处死C57小鼠,在75%乙醇中浸泡5min,转移至超净工作台中,无菌条件下分离出小鼠的长骨(股骨和胫骨),浸泡于PBS溶液中。
3,对股骨和胫骨进行深层次解剖,去除附着的肌肉组织,剪掉长骨两端的干骺端,用10%FBS,IMDM培养基反复冲洗骨髓腔,直至骨髓腔发白,收集洗涤液,用移液枪轻轻吹散分离为单个细胞。
4,细胞接种于六孔板中培养,轻微摇匀,使细胞在孔中均匀分布,放置于37℃、5%CO2培养箱中静置培养,培养期间不要移动六孔板,使BMSCs充分贴壁。
5,培养48h后换液,用预热的PBS缓冲液轻轻洗涤细胞2次,添加新鲜培养基,之后每隔48h换液1次。
原代培养6-7d 后细胞铺满80%(图1),可进行传代培养。
图1:BMSCs原代培养6-7d二,BMSCs成脂诱导分化BMSCs铺皿,细胞融合达80%以上后,弃去原培养基,添加成脂诱导培养基(IMDM中加入10%FBS,10μg/ml胰岛素,1μM 地塞米松,0.5mMIBMX,0.1mM吲哚美辛)。
3d换液1次,分化12d。
待脂滴形成后进行油红O染色,PBS缓冲液清洗3次,10%中性甲醛固定20min,再用PBS缓冲液清洗2次,油红O染液浸染30min,PBS缓冲液清洗2次,苏木素染液浸染1min,弃去染液,倒置显微镜下观察拍照。
成脂诱导分化过程中发现在诱导5d时,细胞形态开始变圆并大量脱落,部分细胞中出现细小脂滴(图2)。
图2:BMSCs成脂诱导5d三,BMSCs成骨诱导分化BMSCs铺皿,细胞融合达80%以上后,弃去原培养基,添加成骨诱导培养基(IMDM中加入10%FBS,5μg/ml胰岛素,0.1μM 地塞米松,0.2mM维生素C和10mMβ-甘油磷酸盐)。
小鼠骨髓间充质干细胞原代培养PPT课件

细胞生长曲线的绘制与分析
生长曲线绘制
通过定时记录细胞数量或密度,绘制出细胞的生长曲线,反映细 胞的生长规律和生长速率。
生长速率分析
分析生长曲线的变化趋势,计算细胞的生长速率,为优化培养条件 和提高细胞产量提供依据。
生长周期
通过生长曲线的绘制和分析,了解细胞的生长周期和倍增时间,有 助于控制细胞的传代和扩增。
细胞分裂增殖情况
观察细胞分裂增殖的情况,有 助于了解细胞的增殖能力和生 长潜力,为后续实验提供依据
。
细胞形态的观察与描述
细胞形态
在显微镜下观察细胞的形态,包括细胞大小、形 状、染色深浅以及核质比例等特征。
描述方法
采用专业术语和描述方式,准确描述细胞的形态 特征,为细胞鉴定和分类提供依据。
形态变化
在培养过程中,观察细胞形态的变化,有助于了 解细胞的生长和分化情况。
细胞计数与接种
对分离出的细胞进行计数, 并按照适当的密度接种到 培养容器中。
培养容器
选择适当的细胞培养容器, 如细胞培养瓶、平板等。
培养条件与维持
温度与湿度
将培养容器放置在恒温、恒湿的 培养箱中,保持温度和湿度适宜。
பைடு நூலகம்
气体环境
控制培养箱内的气体环境,如CO2 浓度,以维持培养基的pH值。
换液与传代
定期更换培养基,并适时进行细胞 的传代,以维持细胞的生长状态。
基础培养基
选择适合细胞生长的基础培养基,如 DMEM、RPMI等。
培养基的灭菌与储存
确保培养基经过严格灭菌,并在无菌 条件下储存。
添加成分
根据细胞类型和培养需求,添加适量 的生长因子、抗生素等。
细胞接种与培养
细胞分离
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结果一
第1次换液后5~7 d可见由几十个到数百个细胞组成的集落,细胞形 梭态呈形、三角形或星形 (图1C、D)
结果一
原代细胞培养10 d左右,细 胞快速增殖,每个集落中的 细胞不断增殖呈长梭形放射 状排列(图1E)
培养2周左右,每个小集落形 成约数百致上千个细胞的大 集落,集落交界处出现重叠 、融合 (图1F)
Percoll密度梯度离心法分离纯化骨髓间充质干细
胞
贴壁培养骨髓间充质干细胞
形态学观察
原代培养细胞
生长曲线的测定
三、结果
(一)骨髓间充质干细胞的形态学观察
24 h后就见有细胞贴壁,多数细 胞呈圆形 (图1A)
72 h后首次半量换液去除未贴壁 细胞,此时贴壁的细胞为单个, 形态大部分为圆形 (图1B)
2、仪器
• 倒置显微镜尼康TE2000E(上海于欣仪器有限公司) • CO2恒温培养箱MC0-15A(日本三洋电机楳氏会公司)
• 超净工作台SW-CJ-2F(苏州安泰空气技术公司)
• 生物显微镜(舜宇公司)
• 低温高速离心机(Jouan公司)
• 无菌操作台,血球计数板,6孔培养板等
3、方法
骨髓的收集
10%胎牛血清最适合MSCs的生长。细胞接种密度过密,会引起细胞之间的接触
抑制;而过稀又会导致细胞分泌的因子丌足从而影响细胞的生长。一般适宜 密度为(48)×104个/ml。
五 结论
本实验通过对成年小白鼠骨髓MSCs迚行分离,体外培养, 同时从细胞形态和生物学特性迚行观察和检测,认为采用淋 巴细胞分离液密度梯度离心,贴壁培养和消化时间控制相结 合,可以获得纯度较高和活性骨髓MSCs,具有操作简单, 快速,实用等优点,为一种较为有效的分离纯化骨髓 MSCs的方法。
1、材料
成年小白鼠4只 胎牛血清(杭州四季清公司) L-DMEM (Hyclone赛默飞世尔生物化学制品北京有限公司 ) 胰蛋白酶(Sigma公司) PBS(NaCl 8g,KCl 0.2g,NaHPO4·12H2O 2.88g,KH2PO4 0.2g,三蒸水1000ml) Percoll细胞分离液(Percoll原液:三蒸水:NaCl 2.6:1.9:0.5) 青霉素、链霉素(100U/ml青霉素,100µg/ml链霉素) 8%NaHCO3溶液(8gNaHCO3,100ml超纯水)
3、骨髓间充质干细Байду номын сангаас的应用前景
在适当的条件下,骨髓间充质干细胞可以分化为三个胚层来源的组织细胞 而迚行细胞移植的治疗,在体外培养扩增后也可种植于生物材料上,回植 入机体修复组织损伤。 骨髓间充质干细胞在治疗组织器官退行性疾病、遗传缺陷性疾病和基因治 疗方面也展现了美好前景。
二、材料和方法
小鼠骨髓间充质干细胞的原代培 养
一、立题依据
1、小鼠骨髓间充质干细胞原代培养的意义
有利于迚行骨髓间充质干细胞的生物学特性的研究
为下一步的传代培养创造条件
可以直接应用于临床实践,是研究骨髓间充质干细胞作用 的前提
2、骨髓间充质干细胞原代培养的方法
贴壁培养筛选法 密度梯度离心法
谢谢大家
讨论
• 有时在相同的培养条件下,有极少数标本较难扩增骨髓MSCs,可能不冲洗骨 髓腔的操作有关。骨髓MSCs具有黏附贴塑料瓶壁的特性,在实验中用玻璃瓶 也能培养扩增。在原代培养物中,除了呈成纤维细胞样的MSCs外,还混杂着
一些其他细胞,可以根据这些污染细胞生物学特性将其除去。血清的浓度并
非越高越好,相反,高浓度血清由于含有大量促迚细胞分化的因子,已引起 细胞分化,从而使细胞过早出现老化,反而丌利于干细胞生长,一般以5%~
结果二
(二)原代小鼠骨髓MSCs的生长曲线结果
BMSCs原代培养生长曲线(图2),生长曲线表明BMSCs的增殖能力 很强,所测细胞在开始的前4天里生长缓慢处于潜伏适应期,第5 天开始迅速增长进入对数生长期,到第9天细胞数轻度上升,第10 天达到顶点,生长速度减缓进入平台期。
四
讨论
• 分离骨髓MSCs的方法主要有四种:贴壁筛选法、密度梯度离心法、免疫磁 珠分离法、流式分选法等。我们使用密度梯度离心和贴壁筛选法相结合, 能有效地将红细胞、白细胞和间充质干细胞分离开来,同时操作简便,快 速,对细胞的活性影响较小。且此分离法简单经济,因而被广泛应用。 •据本实验培养细胞的经验,如果操作中吸取界面层细胞丌小心,会混迚非单 核细胞,就会大大降低细胞分离的纯度,使分离出的细胞大小丌均。另外, 细胞分离操作时间延长,操作丌轻柔,分离出的细胞纯度降低,都会降低细 胞的贴壁率和存活率。
图1.倒置显微镜下骨髓间充质干细胞原代培养形态观察 Fig.1 Morphology of BMSCs in primary culture under an inverted microscope (A)1d,×100;(B)3d,×100;(C)5d,×200;(D)7d,×200;(E)9d,×400;(F)13d,×400.
