氢氧化钾蛋白质溶解度的测定
蛋白质溶解度

分析结果计算
15/75=x/1.5g=0.3gx ps%=0.3g原样中粗蛋白含量/原样中粗蛋 白含量×100%
注意事项
不同样品的粒度应相同。 不同样品在氢氧化钾溶液中的搅拌时间应 一致 。
Over 谢谢观看
试剂
a) 氢氧化钾(分析纯),无水硫酸钾、五 水硫酸铜、氢氧化钠、硼酸、甲基红、溴甲 酚绿、硫酸铵; b) 浓硫酸、盐酸(分析纯)、95%乙醇、 蒸馏水。
仪器和设备
a) 感量为0.0001 g分析天平; b) 磁力搅拌器; c) 离心机; d) 样品粉碎机; e) 60目分析筛; f) 电炉; g) 100 mL或250 mL凯氏烧瓶; h) 凯氏蒸馏装置; i) 250 mL锥形瓶; j) 1000 mL容量瓶; k) 微量滴定管。
试样处理
称取试样1.5 g(准确至0.0002 g)置于 250 mL烧杯中,准确移入 0.042 M氢氧化 钾溶液75 mL,磁力搅拌20 min,然后将 试样转移至离心管中,以2700 r/min的速 度离心10 min。
测定
吸取上清液 15 mL, 放入消化管中, 按照 GB/T 6432-1994凯氏定氮法测定试样中 可溶性蛋白质的含量。同时,按照GB/T 6432-1994凯氏定氮法测定试样中粗蛋白 质的含量。
蛋白质溶解度
在一定的氢氧化钾溶液中溶解的蛋白 质质量占试样中总蛋白质量的百分数。 NSI 通常采用氮溶解指数(NSI)和蛋白 通常采用氮溶解指数(NSI)和蛋白 质分散指数((PDI)来表示。 质分散指数((PDI)来表示。
原理
用一定浓度的氢氧化钾溶液提取试样中的可 溶性蛋白质,在催化剂作用下用浓硫酸将提 取液中可溶性蛋白质的氮转化为硫酸铵。加 出试样中可溶性蛋白质含量; 同时,测定原始试样中粗蛋白质含量,计算 出试样的蛋白溶解度。
蛋白质、粗蛋白、胃蛋白酶消化率、总氮方法步骤总结

称取样品时称样量按照样品中蛋白质含量多少称取蛋白质(GB 5009.5-2016)试剂:硼酸(20g/L):50g硼酸+2.5L水NaOH(400g/L):3瓶氢氧化钠稀释至桶标刻度线甲基红指示剂(1g/L):0.1g甲基红,95%乙醇稀释至100mL亚甲基蓝指示剂(1g/L):0.1g亚甲基蓝,95%乙醇稀释至100mL溴甲基绿指示剂(1g/L):0.1g溴甲酚绿,95%乙醇稀释至100mLB混合指示剂:2份甲基红+1份亚甲基蓝B混合指示剂:1份甲基红+5溴甲酚绿蛋白催化剂:33.3g硫酸铜+500g硫酸钾。
称样:燃烧法:0.1-0.3g 腐竹:粉碎燃烧(糖分较高或脂肪较高的样品可选择1g-1.5g的称取量)淀粉:5g 鸡蛋:1g 奶、血浆、冰棍:3-4g 酱油:1mL 醋:5mL 饮料、口服液:4-5g 调味酱:1-2g 湿饲料:2g 制不匀的饲料、酒糟、草:1g 酒:5mL挥干乙醇胃蛋白酶消化率:称样3-4g,用乙醚脱脂,洗液澄清,室温风干。
称风干试样1g→250mL磨口锥形瓶→150mL水+0.9mL浓盐酸+0.3g胃蛋白酶→盖塞→45℃振摇16h→抽滤→消化→蒸馏→滴定氢氧化钾蛋白质溶解度:称样1g→250mL烧杯→50mL 0.2%KOH→搅拌20min→2700r/min离心10min→取上清液→消化→6432的规定测粗蛋白含量酪蛋白的测定:称0.2g试样→150mL具塞锥形瓶→酸法(0.0200±0.0010gNaHCO3+ 8mL水)或酶法(0.0200±0.0010g三聚磷酸钠 + 8mL水)或膜法(8mL水)→混匀→65-67℃水浴→每隔5min轻摇一次至溶解→冷却加1mL乙酸→混匀,静置5min→加1mL乙酸钠→静置,沉淀,过滤→沉淀物置于消化管→5009.5处理水溶性蛋白质(腐乳):取样沥干汁液,捏匀称取25g,加少量水煮沸冷却转移250mL容量瓶,定容过滤,吸取10mL置于消化管→5009.5处理。
不同方法测定大豆脲酶活性的比较研究

不同方法测定大豆脲酶活性的比较研究杨奇慧舒璐钟剑锋摘要:用滴定法和增值法测定大豆粉在85℃和140℃下分别热处理0、45、90、135、180min的脲酶活性,并用0.2%KOH溶解法测定大豆粉在不同热处理下的蛋白质溶解度。
结果表明:在85℃条件下,处理0~180min 大豆粉的脲酶活性和蛋白质溶解度随着时间延长无明显变化;而在140℃条件下,大豆粉的脲酶活性和蛋白质溶解度随着处理时间的延长显著降低。
通过测定结果可见,同一样品用滴定法和增值法测得的脲酶活性在数值上不相等,不能互用,但蛋白质溶解度更能反映大豆粉受热过度的程度。
关键词:大豆粉;脲酶活性;蛋白质溶解度;pH增值法;滴定法众所周知,大豆含有较丰富的蛋白质、脂肪、碳水化合物等,是饲料生产中主要的植物蛋白质源之一,具有较高营养价值。
但是,大豆中含有多种抗营养因子,如蛋白酶抑制因子、植物凝集素、胃肠胀气因子、抗维生素因子、抗原蛋白等,这些抗营养因子阻碍营养物质在动物体内的利用,尤其是胰蛋白酶抑制因子的存在不仅会降低饲料营养成分的消化率和适口性,而且也会影响动物对蛋白质的消化吸收,对动物生长发育也产生不良的影响。
但是,胰蛋白酶抑制因子的测定较困难,而豆粕中脲酶活性与胰蛋白酶抑制因子活性呈正相关,所以通常通过测定脲酶活性来反映蛋白酶抑制因子的活性。
目前,脲酶活性的测定方法有滴定法(国标法)、pH增值法等,目前,对脲酶活性不同测定方法差异性的研究较少,本文拟对两种方法进行研究,以比较不同方法对测定结果的影响,为实际生产和理论研究提供依据和参考。
1 材料和方法1.1 实验材料大豆粉:将生大豆粉碎,过60目标准筛。
在85℃和140℃下分别处理0、45、90、135和180min冷却后装入封口袋保存备用。
1.2 化学试剂本实验所用试剂均为分析纯(AR),实验用水为蒸馏水。
1.3 测定方法1.3.1 pH增值法实验原理:将研细的试样与尿素缓冲液混合,尿素在尿素酶作用下水解产生氨,使溶液pH 值改变,改变的程度与脲酶活性大小相关,因此可以用其与空白溶液的差值表示脲酶活性高低,单位为△pH值。
饲料常规检验

饲料常规检测中的注意事项
• 二、粗蛋白(CP-- crude protein)的测定
• 1、凯氏定氮法测定粗蛋白的原理:
• 在催化剂(五水硫酸铜和硫酸钠1+10)作用下,用硫酸 破坏有机物,使含氮物转化成硫酸铵。加入强碱进行蒸馏 使氨逸出,用硼酸吸收后,再用盐酸滴定生成的硼酸铵, 测出样品的氮含量,将结果乘以换算系数6.25(饲料样品 中粗蛋白的平均含氮量)计算出粗蛋白含量。本方法适用 于配合饲料、浓缩饲料、单一饲料。
饲料常规检验
饲料常规检测中的注意事项
• 一、水分(H2O)的测定
• 1、原理:试样在105±2℃烘箱内,在大气压下烘干,直 至恒重,逸失的重量为水分。
• 2、注意事项: • 1)含糖分高的易分解或易焦化试样,应使用减压干燥法
(65℃)测定水分。 • 2)鱼油、玉米油、洗米糠、鱼粉等含不饱和脂肪酸和高脂
饲料常规检测中的注意事项
• 2、注意事项(半微量) • 1)蒸馏前应检查装置是否漏气并用硫酸铵来校正(通过电
炉温度调节)蒸馏完毕,拔入口处玻璃塞动作要轻柔。防止反应室
内碱液喷入冷凝管内,避免给下一个试样分析带来较大误差。
• 2)样品量保持在0.5克左右较适宜,若样品量较大应延长消 化时间。
• 3)硫酸应加12mI左右,以免烧干,致使结果偏低,另外加 完酸后应立即盖好硫酸瓶盖,防止浓硫酸吸水而使浓度降低。
重量占样品总重量的百分比即为粗脂肪含量。 • 2、注意事项: • (1)样品须事先烘干,称样量宜稳定,粗脂肪≥10%,称1克左右,
粗脂肪<10%,称1.5-2克 左右。 • (2)抽提必须充分,建议抽提时间10-12小时为宜,回流速度约为8-
10次每小时 ,注意控制冷却水的流量,以出口水温不超过进 口水温4度为宜。 • (3)一次性放入抽提管内的滤纸包,不宜超过4个. • (4)第一次于105度烘干的时间3h为宜,称量时读数速度应稍快且 以增重前一次重量为准。 (5)所用乙醚(石油醚)必须为无水乙醚(石油醚),如果含有水 分,则可能将样品中的糖及无机物抽出,造成误差。
对蛋白溶解度作为鉴定豆粕

EVALUATION OF PROTEIN SOLUBILITY AS AN INDICATOR OF OVERPROCESSING SOYBEAN MEAL
M. Araba, N. M. Dale,佐治亚大学家禽科学系
摘要 本项研究针对以豆粕的脲酶活性(UA)、橙黄 G 结合力(OGBC)以及
— 63 —
精氨酸和蛋氨酸促进了雏鸡生长。 试验 5 是试图确定在本研究条件下哪一种氨基酸最具有限制性。除了含有蒸煮
0min 和 40min 豆粕的两种对照日粮之外,配制了 7 种含蒸煮 40min 豆粕的日粮, 即:单独补充 0.2%L—赖氨酸、单独补充 0.2%L—精氨酸、单独补充 0.1%DL—蛋 氨酸、补充其中两种、补充全部三种。
本项研究的目的就是评价以豆粕蛋白质在 0.2%氢氧化钾溶液中的溶解度作为 鉴定豆粕是否加热过度而营养下降这一方法的价值。此外,本项目对含不同蛋白 溶解度的豆粕日粮补充氨基酸,进行动物试验以评价补充氨基酸的效果。
材料和方法
总体设计
— 61 —
试验 1、2、3 的目的是比较各种化学分析方法及其与雏鸡生产性能的关联程度。 试验 4 和 5 的目的是考察补充氨基酸以克服低蛋白溶解度豆粕抑制肉鸡生长的效 果。从一家当地饲料厂选定 5 批浸提法生产的去皮豆粕。为模拟过度加热,从每 批豆粕中采集少量实验材料,摊在浅铝盘(高 2.54cm)中,放进高压蒸煮器内以 121℃蒸煮不同时间。风干之后,将试验材料移出浅盘。
1原发表于《Poultry Science》69:76-83,1990
— 60 —
最常用来鉴定豆粕是否加工过度的指标是脲酶活性。脲酶水平本身对家禽营养 没有什么意义,但被用来做为鉴定是否含有抗胰蛋白酶之类有毒因子的指标。然 而,Abraham 等人(1971)提到,脲酶完全失活后,脲酶活性测定不能反映热处 理对豆粕品质的影响程度。而且,彻底破坏豆粕的脲酶也不一定妨碍雏鸡生长 (McNaughton and Reece,1980;Dale 等人,1986)。脲酶活性低至 0.01(pH 变化 值)的豆粕与脲酶活性较高的豆粕相比,饲喂雏鸡的效果没有差别(De Schrijver, 1977 )。 再 者 , 加 热 不 足 的 豆 粕 经 过 长 时 间 贮 存 后 , 其 脲 酶 活 性 也 会 降 低 (DeSchrijver,1977)。
评价大豆粕过熟的方法+--0.2%氢氧化钾蛋白质溶解度法

1 重病鸡 肌肉注射解氟灵 2 全群鸡 用葡萄糖和速溶电解多维饮水 3 加强饲养管理 保持安静环境 杜绝惊吓 5 体会
1 氟乙酰胺是一种嗜神经毒性药物 具有作 用时间短 发病迅速的特点 必须及时确诊 用足解 毒药物 2 本病例是由于鸡啄食了被氟乙酰胺药物 污染的冬小麦引起的 山林放鸡是农民增收节支的良 好途径 但要加强管理 不要损害周围庄稼 3 加 强农药的使用和管理 杜绝滥施滥用农药
收稿日期 2005―07―07
放养鸡氟乙酰胺中毒的诊治
新泰市某户饲养草鸡 600 只 鸡新城疫病 法 氏囊病均按常规免疫程序免疫 鸡群健康 110 日 龄时 正值冬初 在放鸡途中鸡群开始发病
剖检的鸡被犬偷食后 犬出现不安 呕吐 呼 吸困难 狂叫不安 肌肉呈阵发性痉挛 口吐白沫 等中枢神经兴奋症状 由于常见的有机磷农药都有 特殊的气味 而死亡鸡的素囊内无异常气味 于是 怀疑为氟乙酰胺药物中毒 结果给病犬按 0.1 g/kg 体重注射解氟灵后 病情很快好转 于是对病鸡进 行氟乙酰胺中毒治疗 病情得到控制 1 临床症状
1998 认为 70% 85%是可以接受的蛋白质溶解 度范围 近年来 随着加工技术的不断改进和完善 完全可以生产出蛋白质溶解度超过 85%甚至达到 90% 而尿素酶活性接近于零的优质大豆粕
笔者在前人的基础上 结合国内实验室的条 件 对该方法进行了修订和完善 1 氢氧化钾蛋白质溶解度检验方法 1.1 原理
引证文献(2条)
1.卢炳元.徐学明 微波处理对油菜籽品质的影响[期刊论文]-中国油脂 2008(4) 2.展昕.王忠艳 热处理条件参数对豆粕中脲酶活性影响的研究[期刊论文]-饲料博览(技术版) 2008(3)
脲酶活性&蛋白溶解度测定方法

出口大豆饼粕脲酶活性测定方法pH增值法、盐酸中和法1.适用范围本方法适用于大豆饼粕类脲酶活性的测定。
2.方法一2.1.术语脲酶活性:在规定的操作条件下,使试样中的脲酶分解尿素释放出氨基氮,以溶液pH值的变量表示。
2.2.原理概要将研细的试样与缓冲尿素溶液混合,在30℃作用30min后,测定溶液的pH值。
2.3.主要试剂和仪器2.3.1.主要试剂磷酸缓冲溶液:将3.403g KH2PO4和4.355g K2HPO4溶解并稀释至1000mL。
临用前,以强酸或强碱调节其pH至7.0,其使用期限不超过90d;缓冲的尿素溶液:溶15g尿素(NH2CONH2)于500mL磷酸缓冲溶液中。
加入5mL甲苯,用于防腐和防止霉菌生长。
按上法调节其pH至7.0。
2.3.2.仪器分析天平:感量0.1mg;研磨器:易于清理,研磨过程中不发热,并能达到要求的磨粉细度;恒温水浴:能控制于30±0.5℃;pH计:备有玻璃电极和甘汞电极,灵敏度不低于±0.02pH单位,同时附有温度补偿;试管:直径22mm,长150mm,具橡胶塞;烧杯:容量10mL;单刻度移液管:10mL;精密计时器;标准筛。
2.4.试样的制备用研磨器将约10g的样品,在不升高温度的条件下尽可能研细,使其通过60目标准筛的量不少于60%。
收集全部磨碎物于广口瓶中,小心混合并立即进行分析。
2.5.过程简述准确称取试样0.200g,放入试管内,加10mL缓冲的尿素溶液,塞好橡胶塞,混匀。
置于30±0.5℃水浴中,记下时间。
隔5min放入第二个与此相同的试管作重复试验。
另称试样0.200g,放另一试管内,加10mL磷酸缓冲溶液,塞好橡胶塞,混匀,作为空白试验。
与上管间隔5min置于同一水浴中。
在消化过程中,每隔5min将试管内容物都摇匀一次。
每个试管都在消化30min后,从水浴中取出,倒出上清液于小烧杯中。
并在从水浴中取出后恰好5min时,测定pH 值读数。
饲料用大豆粕

去皮大豆粕 一级 二级 ≤12.0 ≤13.0 ≥48.0 ≥46.0 ≤3.5 ≤4.5 ≤7.0 ≤0.3
≤70.0
注:粗蛋白质、粗纤维、粗灰分三项指标均以88%或者87%干物质5 6 感官形状和夹杂物 水分 粗蛋白质 粗纤维 粗灰分 尿素酶活性 GB/T 14698 GB/T 6435 GB/T 6432 GB/T 6434 GB/T 6438 GB/T 8622-1988
取具有代表性的大豆粕样品,用四分法缩减分 取200g左右,粉碎过0.25mm孔径的样品筛, 样品制备 充分混匀,装人磨口瓶中备用。
氢氧化钾蛋白质溶解度测定
称取大豆粕试样1.0g,精确到O,1mg,置于 250mL高型烧杯中,加人50,00mL氢氧化钾溶 液,在磁力搅拌器上搅拌20min,将溶液转移至 测定步骤 离心管中,以2700r/min离心10min,小心移 取上清液15.00mL,放人消化管中,按GB/T 6432的规定测定粗蛋白质含量,同时测定同一 试样总的粗蛋白质含量。
2
夹杂物
不得掺入饲用大豆粕以外的物质,若加入抗氧化剂、防霉剂、抗结剂等 添加剂时,要具体说明加入的品种和数量。
饲料用大豆粕
技术指标及质量分数
项目
水分/(%)
粗蛋白质/(%) 粗纤维/(%) 粗灰分/(%) 尿素酶活性(以氨态计)/ [mg/(min·g)] 氢氧化钾蛋白质溶解度 /(%)
带皮大豆粕 一级 二级 ≤12.0 ≤13.0 ≥44.0 ≥42.0 ≤7.0 ≤7.0 ≤0.3
原理
氢氧化钾蛋白质溶解度测定
试剂、仪器和设备 1 2 3 4 5 6
0.2%氢氧化钾溶液:2.44g氢氧化钾溶解于水中,稀释并定容 至1L.
实验室用样品粉碎机。 样品筛:孔径0.25mm。 分析天平:感量0.0001g 磁力搅拌器。 离心机:转速为2700r/min以上。
氢氧化钾蛋白质溶解度的测定

精心整理氢氧化钾蛋白质溶解度的测定
1、原理
氢氧化钾蛋白质溶解度可以反映蛋白质变性的情况。
不同的蛋白质品种,氢氧化钾蛋白质溶解度不同。
蛋白质变性越大,氢氧化钾蛋白质溶解度越小。
2、
a)??
b)??
3
a)??
e)??60目分析筛;
f)??电炉;
g)??100mL或250mL凯氏烧瓶;
h)??凯氏蒸馏装置;
i)??250mL锥形瓶;
j)??1000mL容量瓶;
k)??微量滴定管。
4、试剂的制备
a)??0.2%氢氧化钾溶液
称取2.440g氢氧化钾,加水溶解后,转移至1000mL容量瓶中,用水定容至刻度。
b)??
称取6g
c)??
称取
d)??
称取
量取
f)??
称取1g
5
混匀,装入磨口瓶中备用。
6、测定步骤
称取蛋白样品1.0g,精确到0.1mg,置于250ml高型烧杯中,加入50.00ml氢氧化钾溶液,在磁力搅拌器上搅拌20min,将溶液转移至离心管中,以2700r/min离心10min,小心移取上清液15.00ml,放入消化管中,按照GB/T6432-1994凯氏定氮法测定试样
中可溶性蛋白质的含量。
同时,按照GB/T6432-1994凯氏定氮法测定同一试样中总的粗蛋白质含量。
7、结果计算
氢氧化钾蛋白质溶解度X按下式计算:
X=W1/W2*100%
式中:
W1—
W2—,%。
8
a
2%;
b)。
蛋白质在0.2%氢氧化钾溶液中溶解度的测定方法

蛋白质在0.2%氢氧化钾溶液中溶解度的测定方法
测定蛋白质在0.2%氢氧化钾溶液中的溶解度是测定蛋白质的有效变态性的重要方法。
正确、准确地测定蛋白质溶解度是蛋白质临床诊断和干预治疗的重要前提。
0.2%氢氧化钾溶液作为存在于细胞内的重要物质,能够改变蛋白质的有效变态性,为测定蛋白质溶解度提供了参考价值。
蛋白质溶解度测定应在均温水槽中进行,稳定温度控制在25℃~30℃,以保证测定结果的准确性。
在配制好0.2%氢氧化钾溶液时,应按照实验要求称取氢氧化钾,并充分搅拌均匀后分装
成特定体积,待测定时必须使用新鲜溶液。
此外,用于测定蛋白质溶解度的蛋白质溶液,也需要按实验要求称取蛋白质,使用前搅拌均匀后加入配制好的0.2%氢氧化钾溶液中进
行测定。
在测定过程中,采用正常视野观察蛋白质溶液直至蛋白质有明显沉淀时结束,是否出现沉淀和沉淀的大小,是衡量蛋白质溶解度的重要标准。
在测定结束后,应用酶标仪、显微镜等检测仪器,检测液体中沉淀物的大小,以精确测量蛋白质溶解度。
此外,可进行重复检测,核对两次测定的结果,以确定实验结果的准确性。
总之,测定蛋白质在0.2%氢氧化钾溶液中的溶解度是一个反映蛋白质功能变态性的重要
方法,它需要严格按照实验要求,称取氢氧化钾和蛋白质,稳定温度,并对检测结果进行重复核对,才能保证测定结果的准确性。
豆粕氢氧化钾蛋白质溶解度受温度影响的研究

豆粕氢氧化钾蛋白质溶解度受温度影响的研究摘要:本实验以广西港青油脂有限公司的成品豆粕为原料,用烘箱在50℃,80℃,105℃,130℃温度下处理不同时间,和原样品共得到35种不同加热程度的豆粕,进行氢氧化钾蛋白质溶解度的研究,用以指导大豆生产工艺和后期豆粕储藏。
结果表明,各指标均随加热时间的延长和加热温度的升高而逐渐下降。
关键词:豆粕;氢氧化钾蛋白质溶解度;温度Effect of temperature on KOH protein solubility of soybean mealAbstract: In this experiment, the finished soybean meal of GUANGXI GANGQING Oil & GRAIN Co., Ltd. was used as raw material, and treated in the oven at 50 ℃, 80 ℃, 105 ℃ and 130 ℃ for different times. A total of 35 kinds of soybean meal with different degrees of heating were obtained. The KOH protein solubility was studied toguide the soybean production process and later storage of soybean meal. The results show that the indexes decrease with the increase ofheating time and temperature.Key words:soybean meal;KOH protein solubility;temperature生大豆中含有许多抗营养因子,严重影响大豆的加工和利用。
氢氧化钾溶解度

氢氧化钾溶解度氢氧化钾是一种无机化合物,化学式为KOH,常见的形式是白色固体。
它是一种强碱,可以溶解在水中,产生氢氧根离子和钾离子。
氢氧化钾在工业生产中被广泛应用,也常用作实验室试剂。
它的溶解度是一个重要的物理化学性质,对于很多实际应用和实验操作都有重要意义。
氢氧化钾在水中的溶解度受到温度的影响。
一般来说,温度越高,溶解度越大。
在室温下,氢氧化钾的溶解度约为112g/100mL。
这意味着在100毫升的水中最多可以溶解112克的氢氧化钾。
随着温度的升高,这个数值会增加。
例如,在100摄氏度下,氢氧化钾的溶解度可以达到167g/100mL。
氢氧化钾的溶解度与水的性质有关。
一般来说,硬水中氢氧化钾的溶解度会比软水要小。
这是因为硬水中含有大量的钙离子和镁离子,它们会与氢氧化钾发生反应,生成难溶的碳酸钙和碳酸镁,从而减少氢氧化钾的溶解度。
氢氧化钾溶解度的研究不仅对于工业生产有着重要意义,也对于环境保护和生活用水有一定的指导意义。
了解氢氧化钾在水中的溶解度,可以帮助我们更好地控制工业废水的处理过程,避免因过量排放氢氧化钾而引起的环境污染。
同时,对于家庭生活用水的处理也有一定的指导意义,可以帮助我们更好地选择适合的水处理设备,保证家庭用水的质量和安全。
除了溶解度,氢氧化钾在水中的溶解过程也是一个重要的研究课题。
它的溶解过程是一个放热反应,释放出大量的热量。
这意味着在氢氧化钾溶解的过程中会伴随着温度的升高。
这一点在实际应用中需要引起重视,特别是在工业生产中,需要注意控制溶解过程中产生的热量,避免因此引起的安全事故。
在实验室中,氢氧化钾的溶解度也是一个重要的研究课题。
它的溶解度可以用来帮助确定其他物质的溶解度,或者用来进行定量分析。
通过测定氢氧化钾在不同温度下的溶解度,可以获得很多有用的数据,为其他实验提供重要的参考。
总的来说,氢氧化钾的溶解度是一个重要的物理化学性质,对于工业生产、环境保护和实验研究都有着重要的意义。
气质联用技术检测食品中农药残留的要点分析

分析与检测随着农业科技的快速发展,我国农业产量稳步提升。
食品问题关系国计民生,必须秉承科学谨慎的态度开展食品农药残留检测工作,依托现代科技进行规范化管理,实现食品的供需平衡[1]。
本文通过探讨气质联用技术检验过程中应注意的问题,为食品农药残留安全检测提供更多的思考方向。
1 食品农药残留概述农药是一类化学物质,可用于防治病虫草害,包括杀虫剂、杀菌剂、除草剂、灭鼠剂及调节植物生长的化学药品和生物药品,用量最大的是前3种类型的农药。
残留量是指由于使用农药而在农产品和动物饲料中出现的任何特定物质,包括被认为具有毒理学意义的农药衍生物,如农药转化物、代谢物、反应产物及杂质等[2]。
导致食品农药残留超标的因素是多方面的,包括种植、加工和仓储环节等。
在农产品的种植阶段,人们为有效提高产量和防治病虫害,大量使用农药,农药会随着植物根茎渗入土壤,在源头上污染食品。
摄入被农药污染的食品后,残留的农药会在人体内蓄积,最终导致人体急性或慢性中毒,严重危害人体健康。
但因食物的有效供给与土地资源、劳动力资源之间存在矛盾,所以短时间内很难实现农药禁用。
因此,探寻气质联用技术的科学利用,必须深入分析导致食品农药残留问题出现的原因[3]。
2 基于气质联用技术的食品农药残留技术指标食品中的农药残留分析是微量或痕量分析,食品种类多样、样品基质复杂多变;农药品种种类多,化学结构和性质各异,待测组分复杂;有的还要检测其代谢物、降解物、转化物等;近年来,出现了在农产品和环境中残留量很低的新型高效农药品种;国际、国内对农药残留限量要求也越来越严,对检验方法的性能要求越来越苛刻,这些对农药残留检测技术带来诸多挑战。
目前的农药残留的检测技术包括气相色谱检测技术、顶空固相微萃取检测技术、液相色谱检测技术、气相色谱质谱联用技术、液相色谱质谱联用技术、气相色谱红外光谱技术等,而且随着当前计算机等行业的快速发展,给人们提供了更多的检测路径和手段。
其中质谱色谱联用技术以其灵敏度高、特异性好、准确性高、快速简便、低成本等优点,为农残检测带来了新生活力,因此具有广泛的应用市场。
浅谈凯氏定氮法测定豆粕中氢氧化钾蛋白质溶解度的不确定度评定
0.01
0.100 63
0.01
0.100 72
0.01
0.100 66
0.01
0.100 68
0.01
0.100 72
0.01
0.100 62
0.01
0.100 7
98 食品安全导刊 2021年5月 Copyright©博看网 . All Rights Reserved.
Technology 科技 分析与检测
浅谈凯氏定氮法测定定豆豆粕粕中中氢氢氧氧化化钾钾蛋蛋白白质质溶溶解解 度度的的不不确确定定度度评评定定
□ 高高敬敬芳芳 刘刘 广广 刘刘 云云 中中粮粮东东海海粮粮油油工工业业((张张家家港港))有有限限公公司司
摘摘 要要::凯凯氏氏定定氮氮法法测测定定豆豆粕粕中中氢氢氧氧化化钾钾蛋蛋白白质溶质解溶度解,度会,受会到受不到同不因同素因的素影的响影导响致检导测致结检果测存结在果误存差在,误为了差提,为高了检 提测高结果检的测可结靠果性的和可准靠确性性和,本准文确依性据,本相关文标依准据对相豆关粕标中准氢对氧豆化钾粕蛋中白氢质氧溶化解钾度蛋进白行质不确溶定解度度评进定行。不确定度评定 。
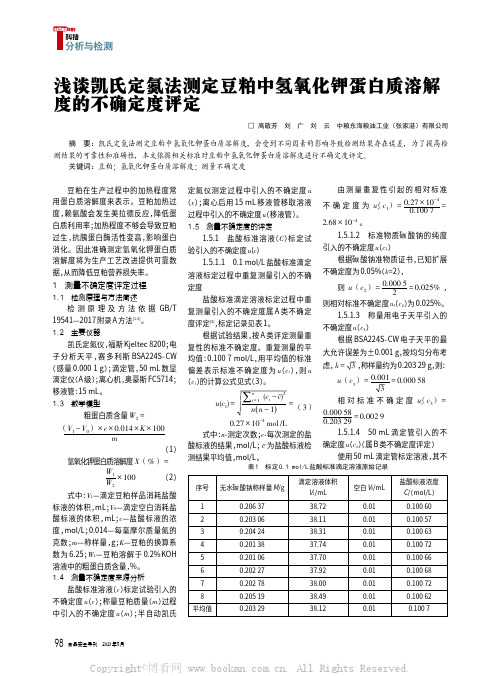
( 感量 0.000 1 g);滴定管,50 mL 数显 偏差表示标准不确定度为 u(c1),则 u
滴定仪(A 级);离心机,奥豪斯 FC5714; (c1)的计算公式见式(3)。
移液管:15 mL。
1.3 数学模型 粗蛋白质含量 W2 =
(V1 - V0) × c × 0.014 × K × 100 m (1)
∑ u(c1) =
n i=1
(ci - cˉ)2
n(n - 1)
= (3)
0.27 × 10-4 mol /L 式中:n-测定次数;c-每次测定的盐 酸标液的结果,mol/L;cˉ 为盐酸标液检
氢氧化钾蛋白质溶解度注意事项

氢氧化钾蛋白质溶解度注意事项
氢氧化钾是一种强碱,具有高度腐蚀性。
在溶解蛋白质时需要注意以下事项:
1. 安全操作:在操作过程中要佩戴防护服、眼镜和手套,避免接触皮肤和眼睛。
如不慎接触,应立即用大量清水冲洗。
2. 使用适当浓度:溶解蛋白质时,应根据具体实验要求选择适当浓度的氢氧化钾。
通常使用0.1 M的氢氧化钾溶液。
3. 控制温度:在溶解过程中,可在恒温搅拌器上进行。
控制温度有助于提高溶解度和溶解效率。
4. 溶解时间:根据蛋白质的性质和溶解需求,溶解时间可根据需要进行调整。
通常情况下,10-30分钟的搅拌时间足以使蛋白质完全溶解。
5. pH控制:氢氧化钾是碱性物质,溶解时会使pH值升高。
为了保持溶液的稳定性,可添加缓冲液或调整pH值。
6. 注意稀释:溶解完蛋白质后,若需要进一步稀释,应使用合适的缓冲液或溶剂,避免再次使用高浓度的氢氧化钾。
总之,溶解蛋白质时应谨慎操作,控制溶剂的浓度、温度、时间、pH值等因素,以确保蛋白质的完全溶解,同时确保自身安全。
利用大豆蛋白质在氢氧化钾溶液中的溶解度确定大豆粉品质

利用大豆蛋白质在氢氧化钾溶液中的溶解度确定大豆粉品质佚名
【期刊名称】《饲料工业》
【年(卷),期】1990()2
【摘要】大豆是畜禽日粮中很重要的蛋白质源,但在使用之前须经适宜地加工处理(时间和温度),以破坏种种内源抗营养因子,改变蛋白质性质。
无论是处理不够还是处理过度,均会使大豆粉(SBM)对畜禽的生长产生不利影响。
根据pH变化来间接评定尿素酶的活性,是体外评价大豆粉品质时应用得最为广泛的方法之一。
然而,由于尿素酶活性随大豆粉的加热会迅速下降至零,故此法仅用于对处理不够的大豆粉的检测。
不过尿素酶活性为零时的大豆粉,其蛋白质品质可能并未受损,故需要一种用于检测经过度处理的大豆粉蛋白品质的体外检测方法。
伊文斯(Evans)和圣约翰(St·John)曾报道过,如果延长大豆粉的高压处理时间。
【总页数】2页(P40-41)
【关键词】大豆粉;品质;检验;氢氧化钾
【正文语种】中文
【中图分类】TS237
【相关文献】
1.凯氏定氮法测定大豆粉中蛋白质的不确定度评定 [J], 林荆;林永辉;陈竞秀
2.蛋白质在0.2%氢氧化钾溶液中溶解度的测定方法 [J],
3.浅谈凯氏定氮法测定豆粕中氢氧化钾蛋白质溶解度的不确定度评定 [J], 高敬芳;刘广;刘云
4.凯氏定氮法测大豆粉中蛋白质含量的不确定度评定 [J], 马晓倩;方玲;袁月兰;赵成明
5.凯氏定氮法测大豆粉中蛋白质含量的不确定度评定 [J], 马晓倩;方玲;袁月兰;赵成明
因版权原因,仅展示原文概要,查看原文内容请购买。
发酵豆粕常见指标检测方法

粗蛋白含量检测(GB/T6432)一、原理:凯氏法测定样中的含氮量、即在催化剂作用下,用硫酸破坏有机物,使含氮物转化成硫酸铵。
加入强碱进行蒸馏使氨逸出,用硼酸吸收后,再用酸滴定,测出氮含量,将结果乘以换算系数,计算出粗蛋白含量。
二、仪器设备:1.高速粉碎机,粉碎时间1分钟。
2.分样筛;、40目3.分析天平;感量4.消化炉5.滴定管;酸式50mL6.锥形瓶;250mL7.定氮仪;以凯氏原理制造的半自动蛋白测定仪三、试剂1.硫酸:含量98%2.氢氧化钠:40%水溶液(m/V)3.硼酸:2%水溶液(m/V)4.混合催化剂:硫酸铜(5个结晶水),6g硫酸钾或硫酸钠,磨碎混匀。
5.混合指示剂:甲基红%乙醇溶液,溴甲酚绿%乙醇溶液,两溶液等体积混合,在阴凉处保存期为三个月。
6.L盐酸标准溶液:mL盐酸注入1000 mL蒸馏水中。
标定:减量法称取左右在270-300℃灼烧2h的无水NaCO3,加水50mL溶解,加10滴混合指示剂,用配好的盐酸滴定成暗红色,煮沸2min,冷却(水中)后再滴至暗红色,同时作空白试验(不加Na2C03)。
计算:C=m×1000 (V1-V2)M式中: C——硫代硫酸钠标准溶液之物质的量浓度(mol/L)m——无水碳酸钠的质量,gV1——盐酸溶液的用量,mLV2——空白试验盐酸溶液的用量,mLM——无水碳酸钠的摩尔质量数值,单位为克每摩尔(g/mol)〔M(1/2NaCO3)=〕7.蔗糖8.硫酸铵:分析纯,干燥四、分析步骤:(国标推荐法)1.试样的消煮2.称取试(含氮量5~80mg)准确至,放入消化管中,加入混合催化剂,与试样混合均匀,再加入12mL硫酸,于420℃消化炉中消化3小时。
冷却后,加入蒸馏水20ml,待用。
3.氨的蒸馏;采用半自动定氮仪,将带消化液的消化管插在蒸馏装置上,以25mL硼酸为吸收液,加入2-3滴混合指示剂,蒸馏装置的冷凝管末端要浸入装有吸收液的锥形瓶内,然后向消化管中加入氢氧化钠溶液,以溶液变黑为宜,即当生成黑色的氢氧化铜时,加碱量已够。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢氧化钾蛋白质溶解度
的测定
公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
氢氧化钾蛋白质溶解度的测定
1、原理
氢氧化钾蛋白质溶解度可以反映蛋白质变性的情况。
不同的蛋白质品种,氢氧化钾蛋白质溶解度不同。
蛋白质变性越大,氢氧化钾蛋白质溶解度越小。
用一定浓度的氢氧化钾溶液提取试样中的可溶性蛋白质,在催化剂作用下用浓硫酸将提取液中可溶性蛋白质的氮转化为硫酸铵。
加入强碱进行蒸馏使氨逸出,用硼酸吸收后,再用盐酸滴定测出试样中可溶性蛋白质含量;同时,测定原始试样中粗蛋白质含量,计算出试样的蛋白溶解度。
2、试剂
a)??氢氧化钾(分析纯),无水硫酸钾、五水硫酸铜、氢氧化钠、硼酸、甲基红、溴甲酚绿、硫酸铵;
b)??浓硫酸、盐酸(分析纯)、95%乙醇、蒸馏水。
3、仪器和设备
a)??感量为 g分析天平;
b)??磁力搅拌器;
c)??离心机(带离心管),转速为2700r/min以上;
d)??样品粉碎机;
e)??60目分析筛;
f)??电炉;
g)??100 mL或250 mL凯氏烧瓶;
h)??凯氏蒸馏装置;
i)??250 mL锥形瓶;
j)??1000 mL容量瓶;
k)??微量滴定管。
4、试剂的制备
a)??%氢氧化钾溶液
称取 g氢氧化钾,加水溶解后,转移至1000 mL容量瓶中,用水定容至刻度。
b)??混合催化剂
称取6 g硫酸钾和 g硫酸铜,磨碎混匀。
c)??氢氧化钠溶液
称取400 g氢氧化钠,加水溶解后,转移至1000 mL容量瓶中,用水定容至刻度。
d)??硼酸溶液
称取20 g硼酸,加水溶解后,转移至1000 mL容量瓶中,用水定容至刻度。
e)??盐酸标准溶液
量取 mL浓盐酸,注入1000 mL水中混匀,按GB 601-88要求进行标定即可。
f)??混合指示剂
称取1 g甲基红和5 g溴甲酚绿,加入乙醇溶解后,转移至1000 mL容量瓶中,用乙醇定容至刻度。
5、样品的制备
取具有代表性的蛋白质样品,用四分法缩减分取200g左右,粉碎过60目筛,充分混匀,装入磨口瓶中备用。
6、测定步骤
称取蛋白样品,精确到,置于250ml高型烧杯中,加入氢氧化钾溶液,在磁力搅拌器上搅拌20min,将溶液转移至离心管中,以2700r/min离心10min,小心移取上清液,放入消化管中,按照
GB/T 6432-1994凯氏定氮法测定试样中可溶性蛋白质的含量。
同时,按照GB/T 6432-1994凯氏定氮法测定同一试样中总的粗蛋白质含量。
7、结果计算
氢氧化钾蛋白质溶解度X按下式计算:
X= W1/ W2*100%
式中:
W1—试样溶于氢氧化钾溶液中的粗蛋白质含量,%;
W2—试样总的粗蛋白质含量(以两次平行测定结果的算术平均值为测定结果),%。
计算结果表示到小数点后一位。
8、精密度
a)重复性
在同一实验室,由同一操作人员完成的两个平行测定结果,相对偏差不大于2%;以两次平行测定结果的算术平均值为测定结果。
b)再现性
在不同实验室,由不同操作人员用不同的仪器设备完成的两个测定结果,相对偏差不大于4%。
