紫外分光光度法计算
紫外分光光度法和荧光分析法

1 Beer-Lambort 定律A=log T =Ecl *A为吸收度;
*T为透光率; *E为吸收系数(以 E *c为溶液浓度; *l为样品总厚度。
1% 1cm
表示,溶液浓度为1%(g/ml),厚度为1cm时的吸光度值)
适用条件:入射光为单色光 溶液是稀溶液 固体、 液体和气体样品在同一波长 下,各组分吸光度具有加和性
吸收光谱
10-4-10-7g/ml
选择性
高
一般
应用
硫色素荧光法测定维生素B1
维生素B1 在碱性溶液中被铁氰化钾氧化成硫色素,在紫(365nm)
照射下呈蓝色荧光(435nm)通过与对照品荧光强度比较。即可测得供试 品含量(课本260页)
荧光分光光度法测定维生素E
采用同步荧光扫描法测定血清中维生素E,有效的消除溶剂拉曼 光谱的干扰,提高灵敏度和准确性。(课本277页)
双波长分光光度法
不需空白溶液作参比;但需要两个单色器获得两
束单色光(λ1和λ2);以参比波长λ1处的吸光度Aλ1 作为参比,来消除干扰。在分析浑浊或背景吸收 较大的复杂试样时显示出很大的优越性。灵敏度、 选择性、测量精密度等方面都比单波长法有所提 高。 ΔA=A λ2 -A λ1 =(ελ2 -ελ1 ) b c 两波长处测得的吸光度差值ΔA与待测组分浓度 成正比 (例子:课本366页)
其他
卡尔曼滤波法
偏最小二乘法 小波变换
三波长分光光度法
系数倍率法
……
原理 与紫外-可见法异同点
应用
原理
荧光 — 分子吸收电磁波后,从其最低激发 态重新发射紫外线或可见光的现象 利用某些物质被一定波长的光照射后所产 生的,能够反映该物质特性的荧光来进行 定性定量的分析方法——荧光分析法。
紫外 可见分光光度法

12
例子:
1)乙醛分子在160, 180,290nm处产生吸收,它们对应的电子跃迁类型分别是:
2)环戊烯(190nm)、甲醚(185nm)、三乙胺(195nm)分别对应的跃迁类型是: 3)一化合物可能是=N-CH2-CH2-CH3或=N-CH=CH2其紫外吸收光谱为: 该化合物是何种化合物?
<100
吸收带的划分:落在200-780 nm的紫外-可见光区的吸收可以用紫外可见吸收光谱测定,在有机化合物的结构解析以及定量分析中常用。
18
电荷转移吸收谱带
电荷转移吸收谱带涉及的是给予体的一个电子向接受体的一个电子轨道上 的跃迁,激发态是这一内氧化还原过程的产物。电荷转移过程可表示如下:
hv CO R
光的粒子性是指光可以看成是由一系列量子化的能量子(即光子)组成。 光子能量为E=h= hc/n。h 为Plank常数,h=6.626×10-34Js。
3
➢电磁辐射与光谱分析法
物质具有能量,是诱电体。物质与光的作用可看成是光子对能量的授受,即 h=E1-E0,该原理广泛应用于光谱解析。电磁辐射与物质的作用本质是物质吸 收光能后发生跃迁。跃迁是指物质吸收光能后自身能量的改变。因这种改变 是量子化的,故称为跃迁。不同波长的光,能量不同,跃迁形式也不同,因 此有不同的光谱分析法。
190
280
CO
190
160
COOH
204
9000 20
2000
41
*
n
*
n
*
*
n
*
COOR
205
50
常用紫外分光光度法测定蛋白质含量

6种方法测定蛋白质含量一、微量凯氏(kjeldahl)定氮法样品与浓硫酸共热。
含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。
经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。
若以甘氨酸为例,其反应式如下:nh2ch2cooh+3h2so4——2co2+3so2+4h2o+nh3 (1)2nh3+h2so4——(nh4)2so4 (2)(nh4)2so4+2naoh——2h2o+na2so4+2nh3 (3)反应(1)、(2)在凯氏瓶完成,反应(3)在凯氏蒸馏装置中进行。
为了加速消化,可以加入cuso4作催化剂,k2so4以提高溶液的沸点。
收集氨可用硼酸溶液,滴定则用强酸。
实验和计算方法这里从略。
计算所得结果为样品总氮量,如欲求得样品中蛋白含量,应将总氮量减去非蛋白氮即得。
如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以6.25即得。
二、双缩脲法(biuret法)(一)实验原理双缩脲(nh3conhconh3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。
在强碱性溶液中,双缩脲与cuso4形成紫色络合物,称为双缩脲反应。
凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
测定围为1-10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、tris缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。
(二)试剂与器材1. 试剂:(1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(bsa)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用bsa浓度1mg/ml的a280为0.66来校正其纯度。
紫外-可见分光光度法测定

紫外-可见分光光度法测定1. 引言1.1 引言紫外-可见分光光度法是一种常用的分析化学方法,通常用于测定物质的浓度或测定物质的吸光度。
该方法利用紫外-可见光谱仪测量样品对紫外和可见光的吸收情况,从而推断样品中所含物质的浓度或结构。
在化学分析实验中,紫外-可见分光光度法具有灵敏度高、准确性高和简便易行的优点,因此被广泛应用于药物分析、环境监测、食品检测等领域。
本实验旨在通过该方法测定样品中目标物质的浓度,并探讨影响测定结果的因素。
通过对仪器原理、操作步骤、实验结果、数据分析和影响因素的详细讨论,我们将深入了解紫外-可见分光光度法的原理和应用,并为今后在相关领域的研究提供参考和借鉴。
希望本实验能够为我们提供更多关于分光光度法的实际操作经验,提升我们的实验技能和分析能力。
1.2 背景介绍紫外-可见分光光度法是一种广泛应用于化学分析领域的分析方法,通过测定物质在紫外-可见光区域的吸收特性,从而确定物质的浓度或者进行定性分析。
紫外-可见分光光度法具有操作简单、灵敏度高、选择性强的特点,被广泛应用于环境监测、食品安全检测、药品质量控制等领域。
随着科学技术的不断发展,紫外-可见分光光度法在实验室分析中扮演着越来越重要的角色。
通过测定物质在特定波长范围内的光吸收情况,我们可以获得关于物质性质的重要信息,如浓度、溶解度、稳定性等。
掌握紫外-可见分光光度法的原理和操作方法,对于提高实验准确性和效率具有重要意义。
在本文中,我们将介绍紫外-可见分光光度法的仪器原理、操作步骤、实验结果、数据分析和影响因素,希望能够为读者提供一份系统全面的紫外-可见分光光度法测定指南。
通过总结和展望,我们也希望能够进一步探讨该方法在化学分析领域的应用前景。
1.3 研究目的紫外-可见分光光度法是一种常用的分析化学技术,可以用于测定物质的吸光度,从而推断物质的浓度。
本实验的研究目的主要分为以下几点:1. 研究紫外-可见分光光度法在测定物质浓度方面的应用。
紫外分光光度法
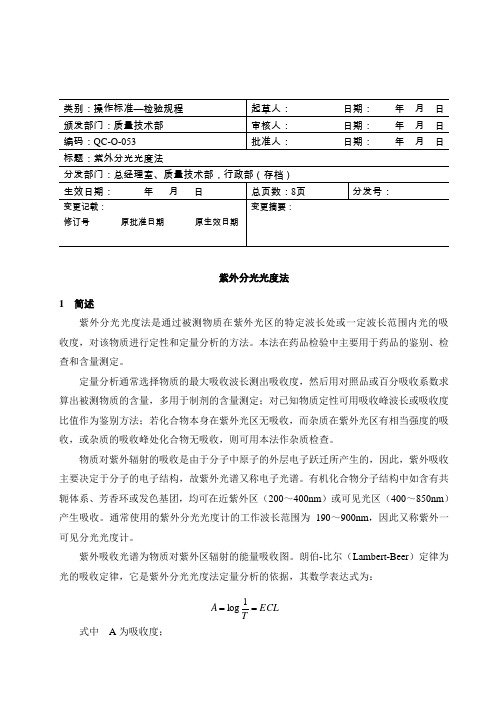
标题:紫外分光光度法分发部门:总经理室、质量技术部,行政部(存档)紫外分光光度法1 简述紫外分光光度法是通过被测物质在紫外光区的特定波长处或一定波长范围内光的吸收度,对该物质进行定性和定量分析的方法。
本法在药品检验中主要用于药品的鉴别、检查和含量测定。
定量分析通常选择物质的最大吸收波长测出吸收度,然后用对照品或百分吸收系数求算出被测物质的含量,多用于制剂的含量测定;对已知物质定性可用吸收峰波长或吸收度比值作为鉴别方法;若化合物本身在紫外光区无吸收,而杂质在紫外光区有相当强度的吸收,或杂质的吸收峰处化合物无吸收,则可用本法作杂质检查。
物质对紫外辐射的吸收是由于分子中原子的外层电子跃迁所产生的,因此,紫外吸收主要决定于分子的电子结构,故紫外光谱又称电子光谱。
有机化合物分子结构中如含有共轭体系、芳香环或发色基团,均可在近紫外区(200~400nm )或可见光区(400~850nm )产生吸收。
通常使用的紫外分光光度计的工作波长范围为190~900nm ,因此又称紫外一可见分光光度计。
紫外吸收光谱为物质对紫外区辐射的能量吸收图。
朗伯-比尔(Lambert-Beer )定律为光的吸收定律,它是紫外分光光度法定量分析的依据,其数学表达式为:式中 A 为吸收度;T 为透光率;ECL TA ==1logE 为吸收系数;C 为溶液浓度;L 为光路长路。
如溶液的浓度(C )为1%(g/ml ),光路长度(L )为1cm ,相应的吸收系数为百分吸收系数,以E 1% 1cm表示。
如溶液浓度(C )为摩尔浓度(mol/L ),光路长度为1cm 时,则相应有吸收系数摩尔吸收系数,以ε表示。
2 仪器紫外分光光度计主要由光源、单色器、样品室、检测器、记录仪、显示系统和数据处理系统等部分组成。
为了满足紫外-可见光区全波长范围的测定,仪器备有二种光源,即氚灯和碘钨灯,前者用于紫外区,后者用于可见光区。
单色器通常由进光狭缝、出光狭缝、平行光装置、色散元件、聚焦透镜或反射镜等组成。
紫外分光光度法计算

紫外分光光度法计算紫外分光光度法(UV-Vis spectrophotometry)是一种常见的分析方法,广泛应用于化学、生化和环境领域。
它利用物质对紫外光和可见光的吸收特性,通过测量吸光度来确定物质的浓度。
下面将详细介绍紫外分光光度法的原理、仪器和具体步骤。
原理:紫外分光光度法基于物质分子的电子跃迁过程。
当物质受到紫外光或可见光的照射时,能级较低的电子会吸收光子的能量,跃迁至较高的能级。
物质的吸收特性取决于它的分子结构以及电子能级的分布。
吸光度(A)定义为样品溶液中吸收光的强度与入射光的强度之比,可以表示为A=log(I₀/I)。
仪器:紫外分光光度法所使用的仪器称为紫外可见分光光度计,包含一个光源,一个单色仪、一个样品室和一个光电二极管。
光源会产生连续的电磁辐射,单色仪可以选择所需的波长,并将光传递到样品室。
样品室包含待测样品的池,光会穿过样品后被光电二极管接收,然后转化为电信号并输出到计算机上进行处理。
步骤:1.准备样品溶液。
将待测物质溶解或稀释到合适的浓度。
溶液的量应足够填满样品池。
2.扫描选取波长范围。
根据样品的吸收特性,选择合适的波长范围进行扫描。
典型的波长范围为190 nm至800 nm,在可见光和紫外光区域进行扫描。
3.仪器的校准。
对仪器进行校准操作,通常使用空白试剂(不含待测物质的溶剂)进行校准。
将空白试剂放入样品室并设置为零点,此时光电二极管输出的电信号为零。
4.测量样品的吸光度。
将样品溶液放入样品池中,确保样品表面光滑平整。
选择合适的波长,将光源打开并扫描整个波长范围。
仪器会逐个记录每个波长对应的光电二极管输出的电信号。
通过计算光电二极管输出电信号与校准信号的比值,可以得到每个波长对应的吸光度。
5.绘制吸光度和波长之间的关系曲线。
将所测得的吸光度值绘制成图表,横轴为波长,纵轴为吸光度。
这个曲线被称为吸光度谱,可以帮助确定样品的吸收峰和最大吸收波长。
6.计算浓度。
利用兰伯特-比尔定律,即A=εlc,其中A表示吸光度,ε为摩尔吸光系数,l为光程长度,c为溶液的浓度。
紫外可见分光光度法测定药物含量的计算实例.

(二)分光光度法
对乙酰氨基酚原料药含量测定
A 1 V D
含量%
E 1% 1cm
100
100 %
m
0.582 1 250 100
715 100
5 100% 99.05%
0.0411
(二)分光光度法
甲氧苄啶注射液(规格2 ml:0.1g)含量测定
精密量取本品1ml,置25ml量瓶中,用稀醋酸稀释至刻度 ,摇匀,精密量取1ml置100ml量瓶中,用稀醋酸稀释至刻度, 摇匀。照紫外-可见分光光度法,在271nm波长处测定吸光度为 0.420。另取甲氧苄啶对照品适量0.05134g,置25ml量瓶中,用 稀醋酸稀释至刻度,精密量取1ml置100ml量瓶中,用稀醋酸稀 释至刻度,摇匀。在271nm波长处测定吸光度为0.416,计算甲 氧苄啶标示量百分含量。
Байду номын сангаас
(二)分光光度法
甲氧苄啶注射液(规格2 ml:0.1g)含量测定
标示量%
cR
Ax AR
D
每支容量
100%
S
0.05134 0.420 25 100 2 25100 0.416 1 1 100% 103.7%
0.1
药物分析/药物的含量测定
紫外可见分光光度 法测定药物含量的 计算实例
制作人:谭韬
(二)分光光度法
对乙酰氨基酚原料药含量测定
精密称取对乙酰氨基酚0.04110g,置250ml量瓶中,加 0.4%氢氧化钠溶液50ml,加水至刻度,摇匀,精密量取5ml, 置100ml量瓶中,加0.4%氢氧化钠溶液10ml,加水至刻度,摇 匀。依照分光光度法,在257nm波长处测得吸收度为0.582。 按C8H9NO2的百分吸收系数为715计算对乙酰氨基酚的百分含 量
紫外可见分光光度法测定药物含量的计算实例(精)

(二)分光光度法
甲氧苄啶注射液(规格2 ml:0.1g)含量测定
标示量%
cR
Ax AR
D
每支容量
100%
S
0.05134 0.420 25 100 2 25100 0.416 1 1 100% 103.7%
0.1
(二)分光光度法
对乙酰氨基酚原料药含量测定
A 1 V D
含量%
E 1% 1cm
100
100 %
m
ห้องสมุดไป่ตู้
0.582 1 250 100
715 100
5 100% 99.05%
0.0411
(二)分光光度法
甲氧苄啶注射液(规格2 ml:0.1g)含量测定
精密量取本品1ml,置25ml量瓶中,用稀醋酸稀释至刻度 ,摇匀,精密量取1ml置100ml量瓶中,用稀醋酸稀释至刻度, 摇匀。照紫外-可见分光光度法,在271nm波长处测定吸光度为 0.420。另取甲氧苄啶对照品适量0.05134g,置25ml量瓶中,用 稀醋酸稀释至刻度,精密量取1ml置100ml量瓶中,用稀醋酸稀 释至刻度,摇匀。在271nm波长处测定吸光度为0.416,计算甲 氧苄啶标示量百分含量。
药物分析/药物的含量测定
紫外可见分光光度 法测定药物含量的 计算实例
制作人:谭韬
(二)分光光度法
对乙酰氨基酚原料药含量测定
精密称取对乙酰氨基酚0.04110g,置250ml量瓶中,加 0.4%氢氧化钠溶液50ml,加水至刻度,摇匀,精密量取5ml, 置100ml量瓶中,加0.4%氢氧化钠溶液10ml,加水至刻度,摇 匀。依照分光光度法,在257nm波长处测得吸收度为0.582。 按C8H9NO2的百分吸收系数为715计算对乙酰氨基酚的百分含 量
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第20章 吸光光度法思 考 题1. 什么叫单色光复色光哪一种光适用于朗伯-比耳定律答:仅具有单一波长的光叫单色光。
由不同波长的光所组成光称为复合光。
朗伯--比耳定律应适用于单色光。
2. 什么叫互补色与物质的颜色有何关系答:如果两种适当的单色光按一定的强度比例混合后形成白光,这两种光称为互补色光。
当混合光照射物质分子时,分子选择性地吸收一定波长的光,而其它波长的光则透过,物质呈现透过光的颜色,透过光与吸收光就是互补色光。
3. 何谓透光率和吸光度 两者有何关系答:透光率是指透射光强和入射光强之比,用T 表示 T =tI I 吸光度是吸光物质对入射光的吸收程度,用A 表示,A εbc =,其两者的关系 lg =-A T4. 朗伯-比耳定律的物理意义是什么 什么叫吸收曲线 什么叫标准曲线答:朗伯--比耳定律是吸光光度法定量分析的理论依据,即吸光物质溶液对光的吸收程度与溶液浓度和液层厚度之间的定量关系。
数学表达式为 lg A T εbc =-=吸收曲线是描述某一吸光物质对不同波长光的吸收能力的曲线,即在不同波长处测得吸光度,波长为横坐标,吸光度为纵坐标作图即可得到吸收曲线。
标准曲线是描述在一定波长下,某一吸光物质不同浓度的溶液的吸光能力的曲线,吸光度为纵坐标,浓度为横坐标作图即可得到。
5. 何谓摩尔吸光系数质量吸光系数两者有何关系答:吸光系数是吸光物质吸光能力的量度。
摩尔吸光系数是指浓度为 mol ·L ,液层度为1cm 时,吸光物质的溶液在某一波长下的吸光度。
用ε表示,其单位 11cm mol L --⋅⋅。
质量吸光系数是吸光物质的浓度为1g 1L -⋅时的吸光度,用a 表示。
其单位 11cm g L --⋅⋅ 两者的关系为 εM a =⨯ M 为被测物的摩尔质量。
6. 分光光度法的误差来源有哪些答:误差来源主要有两方面,一是所用仪器提供的单色光不纯,因为单色光不纯时,朗伯—比耳定律中吸光度和浓度之间的关系偏离线性;二是吸光物质本身的化学反应,其结果同样引起朗伯—比耳定律的偏离。
7. 分光光度计的基本部件有哪些答:主要部件有:光源,色散元件(单色器),吸收池,检测器,记录仪。
8. 如何选择参比溶液答:选择参比溶液的原则为(1)若只有显色反应产物有吸收,其它均无吸收时,可用纯溶剂作参比溶液。
(2)若显色剂或其它试剂有吸收,试样本身无吸收,则可用“试剂空白”作参比溶液。
(3)若试样本身有吸收,而显色剂等其它试剂无吸收,可用“试样空白”作参比溶液。
(4)若显色剂、试样中其它组分有吸收,则可在试液中加入掩蔽剂将被测组分掩蔽后再加显色剂,作为参比溶液。
9. 何谓示差分光光度法此法主要适合于哪些样品的测定它为什么能提高测定的准确度答:示差分光光度法是指试样溶液的吸光度和标准溶液吸光度之差与试样中被测组分浓度之间的定量关系进行分析的方法。
此法主要适用于高含量组分的测定。
因为高浓度的样品透光率很小,引起较大的透光率读数误差,而示差分光光度法采用比试样浓度较低的标准溶液作参比溶液,使透光率的读数标尺放大,其读数在透光率的适宜范围(10%~70%)内,可提高测定准确度。
10. 利用光度滴定法判断滴定终点的依据是什么答:光度滴定法确定终点的依据是滴定过程中被测组分与滴定反应产物吸光度的变化。
以吸光度对滴定体积作图,所得曲线的转折点处即为滴定终点,如下图所示。
用EDTA滴定Bi3+ 和Cu2+的光度滴定曲线11. 测定工业盐酸中铁含量时,常用盐酸羟胺还原Fe3+,用邻二氮杂菲显色。
显色剂本身及其他试剂均无色,邻二氮杂菲-Fe2+为橙色。
用标准曲线法进行工业盐酸中微量铁含量分析时,应选用什么作参比溶液答:应选用纯溶剂作参比溶液,如蒸馏水。
习 题1. 有两种不同浓度的有色溶液,当液层厚度相同时,对于某一波长的光,透光率T 分别为(1)%,(2)%,求它们的吸光度A 。
若已知溶液(1)的浓度为×104mol·L 1,求溶液(2)的浓度。
解:透光率换算成吸光度A 1 = lg T 1 = = A 2 = lg T 2 = =根据朗伯比耳定律 A 1 = c 1b 1 A 2 =c 2b 2因为相同物质的吸光系数相等,两式相除后得3121210.379 6.5110 1.3210(mol L )0.187A c c A ---⨯⨯===⨯⋅2. 一束单色光通过厚度为1cm 的有色溶液后,透光率为70%,当它们通过5cm 厚的相同溶液后,透光率变为多少解:由已知条件:A 1 = b 1 c = lg T 1 = =可求出 c = 1 =c 值代入改变厚度后的关系式中,得A 2 = c b 2 = 0155 5 =把吸光度换算为透光率20.775210100.167916.79%A T --====3. 已知某一吸光物质的摩尔吸光系数为×104L ·mol 1·cm 1,当此物质溶液的浓度为×105mol·L 1,液层厚度为0.5 cm 时,求A 和T 。
解: A = b c = 165.05.01000.3101.154=⨯⨯⨯⨯-0.16510100.683968.39%A T --====4. 用1cm 的比色皿在525 nm 波长处测得浓度为×104mol·L1KMnO 4溶液的透光率是50%,试求:(1)此溶液的吸光度是多少(2)如果KMnO 4的浓度是原来浓度的两倍,透光率和吸光度各是多少 (3)在1cm 比色皿中,若透光率是75%,则其浓度又是多少 解:(1)A = lg T = =(2)浓度为2倍时, c = 2 104= 104(mol·L -1)此时两种溶液的吸光度相比可得4122410.301 2.56100.6021.2810A c A c --⨯⨯===⨯透光率为 20.602210100.2525.00%A T --====(3) 透光率T = 75%时,A = lg T = =故浓度为45131310.125 1.2810 5.3210(mol L )0.301A c c A ---⨯⨯===⨯⋅5. 浓度为 µg / 50 mL 的Cu 2+溶液,用双环己酮草酰二腙比色测定。
在波长600 nm 处,用1 cm 的比色皿测得T = %,求摩尔吸光系数和质量吸光系数。
解:Cu 2+溶液的浓度:66125.51010008.0310(mol L )63.550c ---⨯⨯==⨯⋅⨯透光率换算为吸光度: A = lg T = = 根据朗伯比耳定律41160.150 1.8710(L mol cm )1.08.0310A εcb ---===⨯⋅⋅⨯⨯ 4112.3510294.2(L g cm )63.55εa M --⨯===⋅⋅6. mg Fe 3+,用硫氰酸盐显色后,在容量瓶中用水稀释至50 mL ,用1cm 比色皿,在波长480 nm 处测得A = 。
求吸光系数a 和 。
解: 先计算Fe 3+溶液的浓度33511010000.088101000 3.1510(mol L )5055.850m c M ----⨯⨯⨯=⨯==⨯⋅⨯由朗伯比耳定律A = b c41150.7402.3510(L mol cm )3.1510 1.0A εcb ---===⨯⋅⋅⨯⨯ 4112.3510421(L g cm )55.8εa M --⨯===⋅⋅7. 有一化合物的摩尔质量是125,摩尔吸光系数为×104L ·mol 1·cm 1,今欲配制该化合物的溶液1L ,使其在稀释1200倍后,在1 cm 的比色皿中测得的吸光度为,则应称取该化合物多少克解:根据朗伯-比耳定律求算该物质溶液的浓度 5140.60 2.410(mol L )1.0 2.510A c εb --===⨯⋅⨯⨯稀释前的浓度为1200 × ×105 = ×102( mol ∙L 1) 要配制1L 该溶液所需称量化合物的质量为22.8810125 3.6(g)m nM -==⨯⨯=8. 今有一台分光光度计,透光率的读数误差为%。
计算在下列吸光度时,测得的浓度相对误差(只考虑正误差)从计算结果得出何结论 (1) (2) (3) (4) 解:已知透光率读数误差 ∆T = %(1)当A = 时, 0.09510100.803580.35%A T --==== 由误差公式:0.4340.4340.0050.0284 2.84%lg 0.8035lg0.8035c T c T T ∆⨯=⨯∆===⨯ (2)当A = 时, 0.63110100.233923.39%A T --==== 由误差公式:0.4340.4340.0050.0147 1.47%lg 0.2339lg0.2339c T c T T ∆⨯=⨯∆===⨯ (3)当A = 时, 0.80310100.157415.74%A T --==== 由误差公式:0.4340.4340.0050.0172 1.72%lg 0.1574lg0.1574c T c T T ∆⨯=⨯∆===⨯ (4)当A = 时, 0.94210100.114311.43%A T --==== 由误差公式:0.4340.4340.0050.0202 2.02%lg 0.1143lg0.1143c T c T T ∆⨯=⨯∆===⨯ 结果表明吸光度过大或过小时,产生的相对误差较大。
9. 某溶液浓度为c ,以纯试剂作参比溶液时,吸光度A 为,设仪器读数误差为%,(1)求浓度的相对误差。
(2)在相同测量条件下,浓度为3c 的溶液在测量时引起的浓度相对误差为多少(只考虑正误差)(3)计算结果说明什么解:(1)吸光度换算为透光率 0.43410100.3681A T --===,已知∆T = % 根据浓度相对误差公式0.4340.4340.0020.00540.54%lg 0.3681lg0.3681c T c T T ∆⨯=⨯∆===⨯ (2)其他条件不变,浓度变为3c 时,吸光度变为A = 3A 1 = 3 × = 则透光率为 1.30210100.0499A T --===0.4340.4340.0020.0133 1.33%TlgT 0.0499lg0.0499c T c ∆⨯=⨯∆===⨯ (3)结果表明浓度过大时,相对误差较大。
10.在1.00 cm 比色皿中测得下列数据,求A+B 混合液中A 和B 的物质的量浓度分别为多少溶液 浓度/ mol·L 1吸光度(450 nm ) 吸光度(700 nm )A ×10–4B ×10–4 A+ B未知解:根据已知条件,计算不同物质在两个波长下的摩尔吸光系数A 物质:1= 450 nm 处, A = 1A,λεcb ,13A,4A 0.81.48105.410λA εc b -===⨯⨯2= 700 nm 处, A = 2A,λεcb ,22A,4A 0.1 1.85105.410λA εc b -===⨯⨯ B 物质:1= 450nm 处, A = 1B,λεcb , 12B,4B 0.1 5.0102.010λA εc b -===⨯⨯2= 700nm 处, A = 2B,λεcb ,23B,4B 1.0 5.0102.010λA εc b -===⨯⨯ 根据混合试样的测定数据,可以建立如下联立方程式:450A,450B,450A,450A B,450B A A A εc b εc b =+=+ 700A,700B,700A,700A B,700B A A A εc b εc b =+=+ 32A B 0.6 1.4810 1.0 5.010 1.0c c =⨯⨯⨯+⨯⨯⨯ 23A B 1.0 1.8510 1.0 5.010 1.0c c =⨯⨯⨯+⨯⨯⨯解上述联立方程式41A 3.4210(mol L )c --=⨯⋅41B 1.8710(mol L )c --=⨯⋅11. 用8-羟基喹啉-氯仿萃取比色法测定Fe 3+和Al 3+时,吸收曲线有部分重叠。
