电极溶液界面的构造与性质
第3章 电极溶液界面结构与性质

第二节 电毛细现象 electrocapillarity
电毛细现象:界面张力随电极电位变化 的现象。
电毛细曲线:界面张力与电极电位的关 系曲线 。
. 电毛细曲线的测定
体系平衡时:
2 cos gh r
∴
gr K h 2 cos
恒定一个电位 ,通 过调节贮汞瓶高度使 弯月面保持不变,从 而求得 。
~16-20 uF/cm2
微分电容曲线的应用
利用 0 判断q正负 ; 研究界面吸附 ; 求 q、 C i :
q C d d
q q 1 Ci o 0
C
0
d
d
第四节
双电层结构
一.电极/溶液界面的基本结构
电极/溶液界面的特点: 静电作用:使符号相 反的剩余电荷形成紧 密双电层结构; 热运动:使荷电粒子 趋向均匀分布,形成 分散层结构。
0 的测量方法
~ 曲线法:
C d ~ 曲线法:
铋、镉在不同浓度NaF溶液中的Cd ~ 曲线
1 — 0.001mol / L
2 — 0.01mol / L
H ~
i ~
曲线法;
曲线法;
临界接触角 ~ 曲线法。
0 的重要性
判断q的符号: 例:对于体系 Hg KCl
OHP
M
d x1 x2
x1 x2
IHP
有离子特性吸附 : IHP:阴离子电荷 中心所在的液层称 为内紧密层平面或 内Helmheltz平 面。
M
紧密层模型的实验验证
电极溶液界面的结构与性质

3.1.2理想极化电极
电化学所研究的界面结构主要是指在这一与电极/溶液任 何一相基体性质不同的相间过渡区域中剩余电荷和电位的分布 以及它们与电极电位的关系。界面性质则主要指界面层的物理 化学特性,尤其是电性质。 由于界面结构与界面性质之间有着密切的内在联系,因 而研究界面结构的基本方法是测定某些重要的、反映界面性质 的参数(例如界面张力、微分电容、电极表面剩余电荷密度等) 及其与电极电位的函数关系。
q
q
d i 0
这就是用热力学方法推导出的电毛细曲线的微分方程,通常 称为李普曼公式。
2、公式分析: ⑴如果电极表面剩余电荷等于零,即无离子双电层存在时,则有 q=0。这种情况对应于电毛细曲线的最高点。 表面电荷密度等于零时的电极电位,也就是与界面张力最大值相对 应的电极电位称为零电荷电位。
C
理想极化电极等效电路
常用的理想极化电极——滴汞电极 dropping mercury electrode (DME)
(+) (-)
Hg Hg e
电极过程动力学第2章电极-溶液界面的基本性质

电极表面吸附现象
物理吸附
物理吸附是指物质通过范德华力等物理作用在电极表面吸附的现象。 物理吸附对电极反应的影响较小。
化学吸附
化学吸附是指物质通过化学键合作用在电极表面吸附的现象。化学 吸附对电极反应的影响较大,可以改变电极表面的性质。
电极过程动力学第2章电极-溶 液界面的基本性质
目
CONTENCT
录
• 电极-溶液界面概述 • 电极表面特性 • 溶液性质对界面影响 • 界面电势差与双电层结构 • 界面电荷转移过程 • 界面传质过程与扩散层结构
01
电极-溶液界面概述
界面定义与分类
界面定义
电极与溶液之间的接触区域,发生电 化学反应的场所。
竞争吸附
当多种物质在电极表面发生吸附时,它们之间可能存在竞争关系。竞 争吸附的结果取决于各种物质的吸附能力和电极表面的性质。
03
溶液性质对界面影响
溶液组成与性质
溶质种类与浓度
不同溶质及其浓度会对电极-溶液界面的性质产生显著影响。例如 ,某些溶质可能在界面处发生吸附或反应,从而改变界面的结构 和性质。
电极表面的能量状态与晶体内部 不同,表面能的高低影响了电极 反应的进行。
电极表面粗糙度
表面形貌
电极表面的粗糙度是指表面形貌的不规则程度,它 对电极反应速率和电流分布有重要影响。
真实面积与表观面积
电极表面的真实面积通常比表观面积大,这是由于 表面粗糙度引起的。真实面积对电极反应速率有直 接影响。
粗糙度因子
扩散层结构特点
01
扩散层定义
在电极表面附近,由于浓度梯度引 起的物质扩散区域。
电化学第四章:电极溶液界面的结构性质讲解

例如在同一电极电位下,同一种溶液中,析氢反应
2H 2e H 2
在铂电极上进行的速度比在汞电极上进行的速度大 107 倍以 上。
溶液中表面活性物质或络合物的存在也能改变电极反应速度 如水溶液中苯并三氮唑的少量添加,就可以抑制铜的腐蚀 溶解
分电容,即
(3.C24d)
dq
d
式中, 为C微d分电容。它表示引起电极电位微小变化时 所需要引入电极表面的电量,从而也表征了界面上电极电
位发生微小变化时所具备的储存电荷的能力。
根据微分电容的定义和李普曼方程,很容易从电毛细 曲线求得微分电容值,因为q Nhomakorabea所以
C(d3.25)
2 2
已知可以根据电毛细曲线确定零电荷电位 ,从而0可
- - + - + - +- -
--++
-
+ -
-+
++ --
+-++- --
二、电毛线曲线的微分方程
q ( ) i (3.6)
这就是用热力学方法推导出的电毛细曲线的微分
方程,通常称为李普曼(Lippman)公式。式中q的
单位为 J/cm。
, C 的cm单2 位为V, 的单位为
q ( ) i (3.6)
以利用式(3.24)求得任一电极电位下的电极表面剩余电荷密度q,
即
q
q (30.2d6q) 0 Cdd
因此可以计算从零电荷电位 到某一0 电位
电容值 ,即
Ci
电极溶液界面课件

contents
目录
• 电极溶液界面基础 • 电极溶液界面的电化学性质 • 电极溶液界面的物理化学性质 • 电极溶液界面的应用 • 电极溶液界面的研究方法与技术
01
电极溶液界面基础
电极溶液界面的定义
总结词
电极溶液界面是指电极和与之接触的溶液之间的界面,是电化学反应的重要场 所。
燃料电池
燃料电池利用电极溶液界面将化学能转化为电能。电极溶液界面的性质决定了燃料电池的效率和耐久 性。优化电极溶液界面的结构和组成可以提高燃料电池的性能。
传感器与生物电分析
电化学传感器
电极溶液界面在电化学传感器中发挥着关键作用。通过监测电极溶液界面上的电化学反应,可以实现对气体、离 子、有机物等的快速、灵敏检测。例如,电化学气体传感器利用电极溶液界面检测环境中的有害气体。
形貌
电极表面形貌对溶液在电极表面的润湿和电化学反应过程产 生影响,不同形貌的电极具有不同的电化学性能。
04
电极溶液界面的应用
电化学能源存储与转换
电池技术
电极溶液界面在电池中起着至关重要的作用。它可以影响电池的能量密度、充放电速度和循环寿命。 例如,锂离子电池利用电极溶液界面进行电荷转移和离子传输,从而实现高效的能量存储和释放。
电极反应的步骤和涉及的中间产物。
电极反应动力学方程
描述电极反应速率与反应物浓度、温度等因素关系的方程。
离子传输与迁移
01
02
下的迁移 速率。
离子淌度
离子迁移速率与电场强度 的比值。
离子扩散系数
描述离子在溶液中扩散速 率的参数。
双电层结构与电动现象
双电层结构
电极表面与溶液之间的电荷分布, 包括紧密层和扩散层。
电化学 第2章 双电层(3)
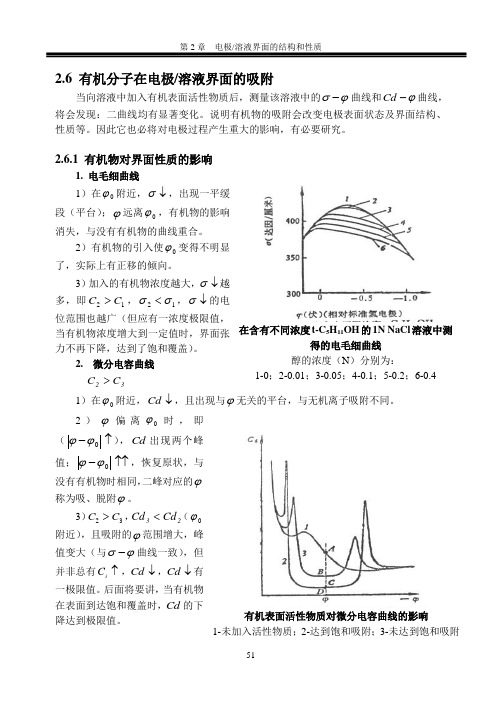
2.6 有机分子在电极/溶液界面的吸附当向溶液中加入有机表面活性物质后,测量该溶液中的ϕσ-曲线和ϕ-Cd 曲线,将会发现:二曲线均有显著变化。
说明有机物的吸附会改变电极表面状态及界面结构、性质等。
因此它也必将对电极过程产生重大的影响,有必要研究。
2.6.1 有机物对界面性质的影响1. 电毛细曲线1)在0ϕ附近,↓σ,出现一平缓段(平台);ϕ远离0ϕ,有机物的影响消失,与没有有机物的曲线重合。
2)有机物的引入使0ϕ变得不明显了,实际上有正移的倾向。
3)加入的有机物浓度越大,↓σ越多,即12C C >,12σσ<,↓σ的电位范围也越广(但应有一浓度极限值,当有机物浓度增大到一定值时,界面张力不再下降,达到了饱和覆盖)。
2. 微分电容曲线32C C >1)在0ϕ附近,↓Cd ,且出现与ϕ无关的平台,与无机离子吸附不同。
2)ϕ偏离0ϕ时,即(↑-0ϕϕ),Cd 出现两个峰值;↑↑-0ϕϕ,恢复原状,与没有有机物时相同,二峰对应的ϕ称为吸、脱附ϕ。
3)23C C >,23Cd Cd <(0ϕ附近),且吸附的ϕ范围增大,峰值变大(与ϕσ-曲线一致),但并非总有↑i C ,↓Cd ,↓Cd 有一极限值。
后面将要讲,当有机物在表面到达饱和覆盖时,Cd 的下降达到极限值。
在含有不同浓度t-C 5H 11OH 的1N NaCl 溶液中测得的电毛细曲线 醇的浓度(N )分别为: 1-0;2-0.01;3-0.05;4-0.1;5-0.2;6-0.4有机表面活性物质对微分电容曲线的影响1-未加入活性物质;2-达到饱和吸附;3-未达到饱和吸附那么,如何解释ϕ-Cd 曲线中出现的平台以及峰值呢?再有,能否利用ϕ-Cd 曲线求有机物在表面的吸附量呢?茀鲁姆金做了这方面的工作,我们来介绍一下。
2.6.2弗鲁姆金的吸附假说所谓假说,就是说该理论没有严格的热力学依据,但可以解释实验现象。
我们就看一看这个假说的内容以及它是如何解释实验现象的。
电化学原理第三章

2021/12/31
微分电容曲线可求给定电极电位下的电极表面剩余电荷q Cd=dq/dQ 积分后可得
qCdd积分常数
无电荷排斥作用,界面张力最大; 此时的电极电位称为零电荷电位,常用符号Φ0表示。
q( )i
3.6
无论电极表面存在剩余电荷符号如何,界面张力均随剩余电 荷数量的增加而降低。 由上式
可直接由电毛细曲线斜率求某一电位密度下电极电位 表面剩余电荷密度q判断表面剩余电荷密度符号 及零电荷电位。
2021/12/31
由微分电容定义和李普曼方程,由电毛细曲线很易求得微分电容 值
因
q
所以 Cd2
2
(3.25)
2021/12/31
可根据电毛细曲线确定零电荷电位φO,从而可利用式(3.24)求得 任-电极电位下的电极表面剩余电荷密度q,即
q
qodq
oCdd
(3.3)6
故可计算从零电荷电位φO到某一电位φ之间的平均电容值Ci
即由3.21和3.22求得该浓度下的离子表面剩余量。
2021/12/31
§ 双电层的微分电容
一、 双电层的电容
界面剩余电荷的变化将引起界面双电层电位差改变,因而电极/溶 液界面具有贮存电荷的能力,即具有电容的特性。
理想极化电极可作为平板电容器处理,即把电极/溶液界面的两个 剩余电荷层比拟成电容器的两个平行板,由物理学知,该电容器 的电容值为一常数,即
d为紧贴电极表面排列的水化离子的电荷中心与电极表面的 距离,也为离子电荷能接近表面的最小距离。紧密层厚度为d, 若假定d内介电常数为恒定值。则该层内电位分布是线性变化的。 从x=d到溶液中远处剩余电荷为零的双电层部分即为分散层。其 电位分布是非线性变化的。
第三章-电极溶液界面
• 影响:改变电极上双电层的分布,从而影 响反应粒子在电极表面的浓度和活化能, 使反应速率发生变化
一、无机离子的吸附
• 1.大多数无机阴离子是表面活性物质,而无 机阳离子的表面活性很小,只有少数离子 才表面活性。
表面张力变化原因
• 无论双电层是带正电还是带负电,由于同 性电荷的相互排除使界面有扩大的趋势, 与表面张力使界面缩小的趋势相反。因此, 带电界面比不带电界面表面张力下。而剩 余电荷密度与电势有关,故表面张力与电 势有关。
二、电毛细曲线的微分方程
• 根据吉布斯等温吸附方程
d id i
i
电子的表面吸附量 e q / F
• 常用的方法: • 充电曲线法
• 电位扫描法
氢原子的吸附
• 氢的吸附过程伴随有氢分子的分解,分解 生成的氢原子与金属表面相互作用而形成 吸附键。吸附氢原子与吸附自由氢原子是 不同的,吸附过程放出大量吸附热,吸附 氢原子的能量低得多。
氧原子的吸附
• 在常温下,主要是氧原子和含氧粒子的吸 附。这些含氧粒子是在逐步还原或OH-逐步 氧化过程形成并吸附的。
若保持电位恒定,并保持i组分外的化学势不变
i
(
i
) ,ki
负离子可逆,正离子表面剩余电荷量
(
Ina
)
1
正离子离子可逆,负离子表面剩余电荷量
( Ina
)
1
求解表面剩余电荷量的步骤
• 1.测量不同电解质浓度的电毛细曲线 • 2.从各条电毛细曲线下取同一相对电位下的
• 值,做出 ~ Ina 关系曲线。
双电层电位由紧密层电位差和分散层电位差
第二章 电极-溶液界面的结构与性质

则将有 α β α β 则将有: 即: α β α β
这就将内电位差的测量转化为外电位差的测量。由于外电位差是 可测的,内电位差也就成为可测的了。
(c)电化学位差 定义为
两相之间的移动状态。
:偶极层净电荷
W1 ne0
α
W1 ne0
α
实验电荷电量 若实验电荷为单 位正电荷则其外 电位即为:
W1
α
W1=ne0
10-4~10-5 cm
+
(2)表面电位() 任一表面层中,由于界面上的短程力场(范德华力,共价键力等), 引起原子或分子偶极化并定向排列,使表面成为一层偶极子层。电 引起原子或分子偶极化并定向排列,使表面成为一层偶极子层。 电 荷穿越该 所做的功为 荷穿越该层所做的功为:
α i
Wi α iα ne0 α
10-4~10-5 cm
综上所述 孤立相的“电位”可有各种不同的定义 综上所述,孤立相的 电位 可有各种不同的定义,其中 其中,,
为静电学 静电学中 中电位 电位,其数值与试验电荷无关。为整个孤立相的 ,其数值与试验电荷无关。为整个孤立相的
W2 ne0
α
W2 ne0
α
若实验电荷为单 位正电荷则其外 电位即为:
α W2
W2=ne0
10-4~10 10-5 cm
(3)内电位() 不破坏球体内的电荷与偶极分布情况下,在球体内部创立一个“空 穴”,则将试验电荷自无穷运处移至这种“空穴”中所涉及的全部 穴” ,则将试验电荷自无穷运处移至这种“空穴”中所涉及的全部 能量变化仅为W1+W2,与此相应的电位称为带电体的“ 与此相应的电位称为带电体的“内部电 内部电 位”: 位” :
电极与溶液界面的性质

(3)“紧密层”中的电势分布呈线性,“分散层”中的电势分布为非线 性
27
可解释以下实验现象: (1)、在稀溶液中,Cd有极小值; (2)、电极表面荷正电时,Cd值较大; (3)、电极表面荷较大负电时, Cd值约20; (4)、随电极表面荷电量的加大, Cd急剧上升。
C=ε0 ε/d dH2O=2.8 X10-8cm ε0= 8.85 X10-8μF/cm; εH2O= 6; C= 8.85 X10-8X6/2.8 X10-8 ≈20 μF/cm2
0.2V/20Å
106 V/cm
速率V2= exp(-βFΔV/RT)×速率V1
研究“电极 /溶液”界面的目的:弄清界面性质与电极反应速度的关联
性; 加深对界面电势和电极电势等物化概念的理解
6
“电极溶液”界面对电极反应速度的影响因素: ( 1 )材料因素:电极材料及其表面状态、电解质溶液性质 对电极反应速度有影响
上一章基本概念回顾
电极反应 阳极,阳极反应 阴极,阴极反应 电极过程,阳极过程,阴极过程 电极过程的主要特征
控制步骤
电极电势:绝对电极电势,相对电极电势,氢标电势 极化
超电势
1
本章内容引导
现象:
1、在不同电极上,同一电极反应的进行速度可以相 差10个数量级;
H+ + e
H2( Pt上比Hg上快10个数量级)
(电解质溶液的组成和浓度、电极材料的物理、化学性质及 表面状况)
(2)电场因素:界面电场影响反应的活化能,从而影响电极
反应速度;
7
3、电极/溶液界面附近荷电层的形成、结构 形成机制(金属电极/电解质界面): (1)、离子双电层
由电极表面的剩余电荷与溶液中与之相反的离子组成
电化学原理第三章__电极-溶液界面的结构与性质

M
Gouy—Chapman模型合理之处: 能较好地解释微分电容最小值的出现; 能解释电容随电极电位的变化。 不足: 完全忽视了紧密层地存在 ; 解释不了微分电容曲线“平台区”地出 现。
Stern模型
该模型认为由于静 电作用和粒子热运 动这两种矛盾作用 对立统一的结果, 使电极/溶液界面的 双电层将由紧密层 和分散层两部分组 成。
OHP
M
d x1 x2
x1 x2
IHP
有离子特性吸附 : IHP:阴离子电荷 中心所在的液层称 为内紧密层平面或 内Helmheltz平 面。
MБайду номын сангаас
紧密层模型的实验验证
按紧密层模型有:C dOHP
1 C dIHP 2
阳离子双电层的 C d紧 与离子种类无关 ; 阳离子双电层可以表示为下面的电路:
Rf
Rl
a
Cd
b
对理想极化电极还可以进一步简化为:
Cd
Rl
a
双电层电容 溶液电阻
b
三. 微分电容曲线
KCl
1 — 0.0001m ol KCl L 2 — 0.001m ol KCl L
3 — 0.01m ol KCl L 4 — 0.1 m ol KCl L
微分电容曲线的应用
利用 0 判断q正负 ; 研究界面吸附 ; 比电毛细曲线精确 求 q:
三.电毛细曲线法的主要应用
判断电极表面带电状况(符号);
求电极表面剩余电荷密度q ; 求离子表面剩余量 i 。
第三节 双电层的微分电容
一. 微分电容与积分电容 微分电容(differential capacity):引 起电位微小变化时所需引入电极表面的 电量,也表征了界面在电极电位发生微 小变化时所具备的贮存电荷的能力。
电化学电极与溶液界面的性质

d
界面荷电层中离子浓度的分布: 遵循Bolizmann分布
j-y y
j
(具体数学表达式见参考书)
j
d
x
10
4、研究电极/溶液界面的实验手段和方法
研究电极溶液界面的基本思路:实验测量反映界面性质的 参数(如界面张力,微分电容,电极表面剩余电荷密度等) 与电极电势的关系,根据结果给出理论模型。
j j-y y
d d
j
x
20
现象: 在离零电势较远的负电势区,界面微分电容值几 乎与电势无关,也与溶液中阳离子的半径及价态基本 无关。且在不同金属的荷负电表面上,微分电容具有 相近的数值(20微法/平方厘米)。
21
1963年,Bockris等人提出BDM双电层模型(BockrisDavanathan-Muller): 紧密层由两个串联的双电层组成。紧靠电极表面的内 层为吸附的水分子偶极层,外层为水化离子层。
“电极/溶液”界面的构造和性质
1
1、何为电极/溶液界面
(静电、特性吸附、水偶极分子定向排布)
电极/溶液界面:当电极与溶液接触时,在各种界面因素 的作用下,电极和溶液相之间形成的一个在结构和性质上 与本体溶液不同的过渡相。 2
E.g. 锌电极插入硫酸锌溶液中
电极/溶液界面的结构:指在这一两相过渡区域中剩余电荷和电势的分布;
电极/溶液界面的性质:指结构随电极电位的变化关系。
3
2、为什么要研究电极/溶液界面?
“电极/溶液”界面是电极反应发生的“客观环境”,其结构和性质对电极 反应速度有重大影响!
实验现象:
(1)在不同电极上,同一电极反应的进行速度可以 相差10个数量级;
H+ + e
2009-01-15--第三章+电极-溶液界面结构与性质(3.4-双电层的结构和零电荷电位2学时)
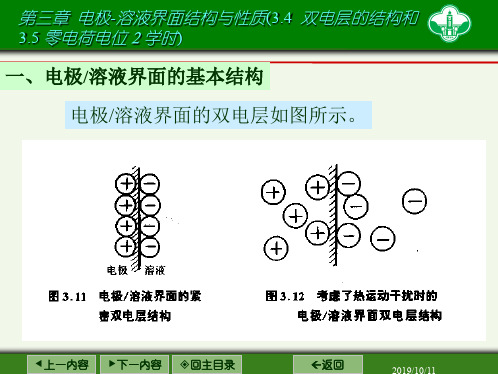
一、电极/溶液界面的基本结构
电极/溶液界面的双电层如图所示。
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
电极/溶液界面剩余电荷分布和电位分布如图3.14所示。
常数
2RT F
ln a
RT F
ln
c
Ψl<0时
1
常数
2RT F
ln( a)
RT F
ln
c
式中,“常数”为:
2RT ln 1 F C紧
2 RT 0 r
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
RT
)
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
当
1和x=时,
x
=0和
x
=0
利用数学关系式
2
x2
1 ( )2
2 x x
从x=d到x=∞积分
(
x
)2 x=d
2cRT
0 r
exp(
1F
上一内容 下一内容 回主目录
返回
第三章 电极-溶液界面结构与性质(3.4 双电层的结构和 3.5 零电荷电位2学时)
双电层电位差由紧密层电位差与分散层电位差两部分 组成,可以利用下列式计算双电层电容:
1 da d (a 1) d1 1 1
电极溶液界面的传质过程与极化

电极反应需要一定的活化能使电极上聚集着过多的电荷。 自由电子数量增多:电极电位向负方向移动; 正电荷聚积:电极电位向正方向移动。 化学电池中,两支电极的极化程度不同。 电流值一定,电极电位偏离平衡 电位很大的电极称之为极化电极; 偏离很小的称去极化电极 。 完全去极化只是一种理想情况。
10:16:04
电场中的带电离子-电迁移:形成迁移电流。
电迁移传质是电场存在下的必然现象。 电泳分析就是利用不同离子的电迁移速率不同而实现 分离。 在极谱分析中,电迁移传质所形成的迁移电流则对利 用扩散电流定量产生干扰,需要消除。
电场力对溶液中所有离子产 生作用。
利用在大量电解质存在下, 待测离子所产生的迁移相对减 少可降低迁移电流对扩散电流 的影响。
10:16:04
3. 超电位
实际电位与可逆的平衡电位之间产生一个差值。 超电位:电极极化程度的度量。
实际 理论
ηc表示阴极超电位,ηa表示阳极超电位。 阴极上的超电位使阴极电位向负的方向移动,阳极上
的超电位使阳极电位向正的方向移动。 超电位的数值无法从理论上进行计算。
10:16:04
有关 超电位的实验现象:
10:16:04
1. 浓差极化
当电流流过电极—溶液界面发生电极反应时,在电极 表面处的离子浓度迅速降低,如果扩散速度较小,溶液中 的离子不能很快扩散到电极表面,将产生一个浓度梯度。
浓差极化使电极电位偏离平衡值, 阳极更正;阴极更负。
减小浓差极化的方法:
a.减小电流密度或增加电极面积。 b.提高溶液温度,有利于质传递。 c.机械搅拌,使整个体系保持浓度均 匀,也使电极表面溶液不断更新。
均匀和不均匀电解液界面

在电化学领域中,电解液界面的性质对于电池或电解池的性能有着至关重要的影响。
电解液界面可以分为均匀和不均匀两种情况。
均匀电解液界面是指电解液在电极表面形成的一层均匀的电解液薄膜。
这种界面通常被称为“固体电解质界面”(Solid Electrolyte Interphase,简称SEI)。
SEI是在锂离子电池中正极材料与电解液之间形成的一层薄而均匀的固态薄膜,它具有良好的离子传导性质和化学稳定性,可以有效地防止电极材料与电解液之间的进一步反应,从而保护电极材料并提高电池的循环稳定性和安全性。
不均匀电解液界面则是指电解液在电极表面形成的一层不均匀的电解液薄膜。
这种界面通常由于电解液在电极表面的蒸发、电解液与电极材料之间的化学反应等原因而形成。
不均匀电解液界面通常会导致电极表面的锂离子分布不均匀,从而影响电池的性能。
此外,不均匀电解液界面还可能导致电极材料与电解液之间的进一步反应,从而影响电池的循环稳定性和安全性。
因此,为了提高电池的性能和安全性,需要尽可能地控制电解液界面的性质,特别是避免不均匀电解液界面的形成。
这通常需要通过优化电解液配方、控制电解液蒸发、控制电极材料的表面状态等手段来实现。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
作为一个最简单的例子,暂时假设研究的对象是一个由 良导电体构成的球,球体所带的电荷完全均匀地分布在球面 上,我们来分析其中的各种电位。 (1)外电位(α)
将试验电荷自无穷远处移至距球面约10-410-5厘米处。 在这一过程中可以认为球体与试验电荷之间的短程力尚未开 始作用。根据电位的定义,此时所做的功(W1)为:
将试验电荷自无穷远处移至球体内部时全部能量变化 定义为该试验电荷在球体α内部的“电化学位”。
根据前面的公式有:
当试验电荷从相内逸出到相外时,这一过程所涉 及的能量变化(-Wiα)相当于试验电荷从该相逸出 而必须摆脱与该相物质之间的短程相互作用及越过 表面时对表面电势所做的功。这部分功称为试验电 荷在α相的“逸出功”,显然应满足下列的关系式:
这是由于电子或离子等荷电粒子在两相中具 有不同的化学位所致。例如: (i)两种金属界面上 的电子转移;(ii)两种溶液界面上的离子转移; (iii)金属、溶液界面上荷电粒子(离子或电子) 的转移。
界面两侧之间的电荷转移-离子双电层
(2)离子特性吸附(非库仑力产生),形成分布于溶液一 侧的荷电层。 (3)偶极子的定向排列,例如水偶极分子形成溶液一侧的 荷电层,原子或分子在界面的极化也能导致电荷分离。例如 当偶极子在电极表面定向排列时,由于偶极子的诱导,使金 属表面中的原子或分子发生极化,产生分部于界面两侧的次 级荷电层。
上述3种均只决定于孤立相α所带的净电荷及表面电荷的 分布情况,而与试验电荷及组成孤立相物质的化学本质无 关。
(4)电化学位
化学位的定义:
当将带有电荷的物质加入相α中时,需要作两种功: ①克服物质i同相α内原有物质之间的化学作用力而作的化学 功W3,等于 。 ②一种是克服物质M所带电荷与相α的电作用力而作的电功, W1+W2。
3.1 界面荷电层的形成
当两种不同物体接触时,由于两相界面上的种 种界面作用(包括界面上发生电荷转移反应,带 电粒子、偶极子的吸附等),导致在界面两侧出 现电量相等而符号相反的电荷,使每一相的电中 性遭到破坏,形成与充电的电容器相似的荷电层。
3.1 界面荷电层的形成
界面荷电层是自然界普遍存在的现象,按形成 机理主要有下面几种: (1)界面两侧之间的电荷转移
离子特性吸附 吸附双电层
水偶极分子吸附 偶极子的诱导 偶极双电层
界面荷电层现象不仅在电子导体/离子导体的界 面上存在,也同样能出现在离子导体/离子导体、 电子导体/电子导体界面,甚至在导电体/绝缘体之间 的界面上,也可以通过电子发射或静电诱导作用形 成某种形式的界面荷电层。这里主要讨论金属电极 与电解质溶液界面上形成的荷电层。
则:
试验电荷电量
球体α的外部电位
(2)表面电位(α) 任一表面层中,由于界面上的短程力场(范德华力,共
价键力等),引起原子或分子偶极化并定向排列,使表面成 为一层偶极子层。电荷穿越该层所做的功(W2)为:
球体α的表面电位
(3)内电位() 不破坏球体内的电荷与偶极分布情况下,在球体内部创
立一个“空穴”,则将试验电荷自无穷远处移至这种“空穴” 中所涉及的全部能量变化仅为W1+W2,与此相应的电势称 为带电体的“内部电位”:
3.2 相间电位与电极电位
3.2.1 “孤立相”的几种电位 3.2.2 相间电位差 3.2.3 电池电动势 3.2.4 电极电位 3.2.5 电极的极化
3.2.1“孤立相”的几种电位
静电学对真空中任一点的电位定义为:将一个 单位正电荷从无穷远处(电位的参考零点)移至该 点时对抗电场力所作的功。这时完全不考虑非库仑 力的作用。
综上所述,孤立相的“电位”可有各 种不同的定义,其中, , 为静电学中电位, 其数值与试验电荷无关。而μi, ,-Wiα则 与粒子i的特性(包括其化学性质)有关。
3.2.2 相间电位差
(1) 相间电位差的种类 两相之间出现“相间电位差”的原因只可能
是界面层中带电粒子或偶极子的非均匀分布,并 形成了界面荷电层。
在电极系统中,两相界面上由于荷电层的形成, 必然存在电位差。这个电位差的本质就是两相内电 位的差(电极材料- sol),即伽伐尼电位。
电极系统中的这个相间电位差可以作为判断界面 上的电极反应是否达到平衡、电极反应进行的方向 的判据,因而具有重要意义。
例题:
当电极反应达到平衡时:
电极反应的平衡条件通式为:
从上式可以看到,电极系统中的电极材料- sol值, 可以反映电极反应是否达到平衡,未达到平衡时电极 反应进行的方向。因此,该式具有重要意义!
3.2.3 原电池的电动势
原电池:将化学能直接转化为电能的装置。
原电池的电动势:通常我们将用电势差计测量 得到的原电池两极间的电位差称为该原电池的 电动势。
正极:电位较高的电极; 发生还原反应,为阴极;
(c)电化学位差,定义为
(对i粒子而言)。
决定了粒子i在两相之间的移动状态。
其值为0时,粒子i在两相之间的移动达到平衡 状态,即没有宏观的净移动。大于0时,由α相向β 相移动;小于0时则相反。即:粒子总是从电化学位
高的相向电化学位低的相移动。由此不难推出,对
于任何电极反应的平衡条件为:
(2)电极系统中的相间电位差
根据以上关于孤立相电位的讨论不难推想, 所谓α、β两相之间的电位差也因此可能有各种不 同的定义,其中较常用的有下面三种:
(a)外电位差,又称“伏打(Volta)电位差”,定 义为α- β。直接接触的两相间的外电位差,用 表示。两相均为金属时,为金属接触电位差,可直 接测量。
(b)内电位差,又称“伽伐尼(Galvani)电位差”, 定义为α- β。直接接触的两相间的内电位差,用 表示。两相为不同物质时,该值不能测量。
负极:电位较低的电极; 发生氧化反应,为阳极。
电动势的本质
对于电极Ⅰ、电极Ⅱ、和溶液S组成的电池,其电动势E为 “电极Ⅰ/溶液”, “电极Ⅱ/溶液”和 “电极Ⅱ/电极Ⅰ” 三个界面上内部电势差的代数和。即:
