醇和醚
第八章 醇和醚

}
弱碱,反应条件温和, 不饱和键不受影响。
琼斯试剂
CrO3+稀H2SO4 费慈纳-莫发特试剂
醛(产率不高, 不用。)
醛(产率很高)
稀酸,反应条件温和, 不饱和键不受影响。
酸性 (H3PO4) , 其它基团不受影响。 碱性,可逆,分子 内双键不受影响。
二环己基碳二亚 胺二甲亚砜
{
丙酮、甲乙酮等 醛(会发生醇醛缩 (欧芬脑尔氧化) 合付反应,不用。)
CH3CHCH2CH2CH3 + HBr
OH
CH3CHCH2CH2CH3 + CH3CH2CHCH2CH3
Br Br
86%
14%
2o
2o, 氢重排
(CH3)2CHCH2OH + HBr
(CH3)2CHCH2Br + ( CH3)3CBr
80% 20%
1o
3o, 氢重排
(CH3)3CCH2OH + HBr
醇化物(结晶醇)
低级醇与一些无机盐形成的结晶状分子化合物称 之为结晶醇,也称之为醇化物。 MgCl2 6CH3OH CaCl2 4C2H5OH 工业乙醚常杂有 少量乙醇,加入 CaCl2可使醇从乙 醚中沉淀下来。
注意
许多无机盐 不能作为醇 的干燥剂。
结晶醇不溶于有机 溶剂而溶于水。 利用这一性质,可 以使醇和其它有机 溶剂分开,或从反 应物中除去醇类。
第八章 Alcohols
醇和醚 and Ethers
8.1 醇 本章提纲
一 、醇的分类、命名与结构 二 、醇的性质 三、醇的制备
8.2 醚 一、醚的分类和命名 二、醚的性质 三、醚的制备 四、相转移催化作用
一、 醇的分类、命名与结构
鉴别醇和醚的化学方法

鉴别醇和醚的化学方法
鉴别醇和醚的常用化学方法有以下几种:
1. 酸碱反应法:将待鉴别化合物加入一定量的酸性或碱性溶液中,若产生气泡,则表明化合物中含有醇;若无反应,则可能为醚。
2. Lucas试剂法:向待鉴别化合物中加入Lucas试剂(浓盐酸和氯化亚铁的混合物),加热后若形成浑浊的混合物,则表明化合物中含有1、2或3度醇;若产生无色液体,则表明化合物为醚。
3. 碘液试验法:向待鉴别化合物中加入碘液(碘化钠溶液),若产生黄色颜色,则表明化合物中可能含有醇;若无反应,则可能为醚。
4. 嗅觉法:由于醇具有刺鼻的气味,而醚则无气味或轻微芳香味,因此可以通过嗅觉进行初步区分。
需要注意的是,使用化学方法进行鉴别时应注意条件的选择和控制,方法操作的正确性和准确性。
同时,这些方法虽然可以用来进行初步的区分,但不能确定化合物的具体结构和成分等信息,需要结合其他分析方法进行综合分析。
有机化学醇和醚
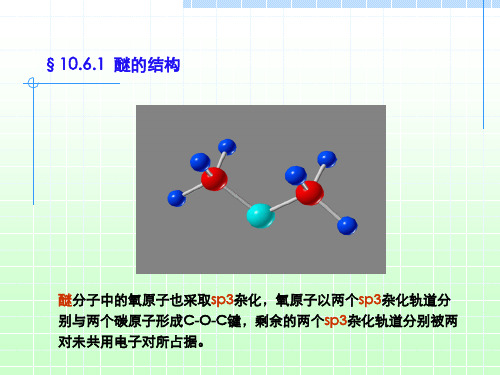
3. 溶解性 醚一般微溶于水,能与水分子形成氢键;易溶于有机溶剂。 由于 醚的化学性质不活泼,是良好的溶剂。
§10.9 醚的化学性质
醚键(C-O-C)的极性很小,比较稳定。
对碱、氧化剂、还原剂都很稳定; 在常温下醚也不与金属钠作用; 但是在一定条件下,醚也能发生某些化学反应。
§10.9 醚的化学性质
+ CH3CH2I
CH 3CH 2I
+ H2O
混醚与氢碘酸作用时,一般是较小的烃基生成碘代烷,较大的烃基
生成醇或酚。
CH 57%HI O C H 2 5 3 △ O C H 2 5 HI △ C H OH 2 5 OH + C H I 2 5 +
CH I 3
§10.9.2 络合物的生成 醚可以将氧上的未共用电子对与缺电子的试剂(如BF3、AlCl3、 RMgX等)形成相应的络合物。
HOCl
HOCH2 CH2 Cl
§10.10 重要的醚
环氧乙烷
b. 化学反应
在酸或碱催化下可以与许多含活泼氢的试剂(如水、氢卤酸、醇、氨
等)发生化学反应。
CH2 O
CH2
+
HA
CH2 OH
CH2 A
式中:A代表-OH,-X,-OR,-NH2等。
§10.10 重要的醚
环氧乙烷
b. 化学反应
① 与水反应
用,形成佯盐,而溶于强酸体系(如浓硫酸、浓盐酸)。
金 羊盐不稳定,遇水很快分解为原来的醚。
§10.9.1 佯盐的形成和醚键的断裂
醚键的断裂
醚与浓氢卤酸(一般用氢碘酸)共热,醚键可以断裂生成卤代烷 和醇。如果氢卤酸过量,生成的醇进一步反应生成卤代烷。
第十章醇和醚

Br -
CH3 CH3 C CH2CH3
Br
三卤化磷或亚硫酰氯(SOCl2)也可与醇反应 制卤代烃,且不发生重排,因此是实验室制卤代
烃的一种重要方法。
CH3CH2CH2OH
P+I2(PI3) 85~90℃
CH3CH2CH2I
CH3CH2CH2CH2OH + SOCl2
CH3CH2CH2CH2Cl + SO2 + HCl
③写出全称 “某醇”。
3CH3 H2C3CH3 3CH3
CH3
CH3CHCH2CH2CCH3
OH
CH3
5,C5H-二3C甲HC基H-22C-H己2醇CHCH2CH3
OH
OH
CHC3CHH3CCHHC2HC2HC2HC2HCHCCHH2C2CHH33
OHOH
OHOH
2,5-庚二醇
CCHH2O2OHH
3. 酯的形成
CH3 OH +H OSO3H
CH3OSO3H +H2O
硫酸氢甲酯
CH2 OH
H2SO4(浓) CH2 ONO2
CH OH + 3HONO2 10~20℃ CH ONO2 + 3H2O
CH2 OH
CH2 ONO2
三硝酸甘油酯(硝化甘油)
硝化甘油是一种烈性炸药;在医疗上可扩张血管,做心 血管的急救药。
不同的醇与同一种氢卤酸反应的活性: 烯丙醇、苄醇>叔醇>仲醇>伯醇>甲醇
卢卡斯(Lucas)试剂:无水氯化锌的浓盐酸溶液
CH3 CH3 C OH
CH3
+ HCl
ZnCl2 20℃
CH3
CH3 C Cl + H2O
第九章 醇和醚

反应可逆,需采用一定措施以利于正向进行。
各类醇的鉴别-卢卡斯试剂
用浓盐酸与ZnCl2配置的溶液-卢卡斯(Lucas)试剂与各类醇 反应的活性如下:
叔醇
(CH3)3C-OH
ZnCl2-HCl
20oC,1min
ZnCl2-HCl
(CH3)3C-Cl + H2O
仲醇 (CH3)2CH-OH 20oC,10min (CH3)2CH-Cl + H2O 伯醇 CH3(CH2)3-OH
HO-(CH2)10-OH
O2N
-CH2OH
O CH3 CH3 OH ① LiAlH4,干醚 CH3C=CHCH2CH2CCH3 CH3C=CHCH2CH2CHCH3
② H2O
CH3CH=CHCHO 巴豆醛
Al[OCH(CH3)2]3 (CH3)2CHOH
CH3CH=CHCH2-OH 巴豆醇 -CH=CHCH2OH
C-H 0.110nm
O-H 0.096nm C-O 0.143nm
∠HCH=109◦
∠HCO=110◦ ∠COH=109◦
2、醇的分类
根据羟基所连的C的性质分为伯醇、仲醇、叔醇。 称为一级醇,二级醇…..,分别记为1°,2°,3°等。 如: RCH2OH R2CHOH R3COH
根据R的性质分为饱和醇、不饱和醇和芳香醇,如: CH3CH2CH2OH
CH2=CH-CH2OH
Ph-CH2OH
根据分子中含羟基的数目分为一元醇、二元醇和多 元醇。如:
CH3CH2OH CH2-CH2 OH OH CH2-CH-CH2 OH OH OH
一个碳原子上有两个或两个以上羟基就不稳定, 容易分子内脱水形成羰基。
3、醇的异构和命名
醇和醚

* 性质
●
弱酸性(酸性比醇大)
后两个反应不仅可用来鉴定硫醇,而且 可用作重金属Pb、Hg、Sb等中毒的解毒剂。
●
氧化反应
氧化剂:H2O2、 NaIO、I2或O2
这个反应可以定量进行,因此可用来测定巯基 化合物的含量。
●
酯化反应:
●
分解反应 :
此反应工业上可用来脱硫。
第二节 醚
一、 醚的分类,命名和同分异构 * 分类 醚可看作是醇羟基的氢原子被烃基取代
●
间接水合
烯烃用 98% H2SO4 吸收后,先生成烃基硫
酸氢酯,再经水解得到醇。
*
硼氢化氧化反应
* 从醛、酮、羧酸及其酯还原
还原剂可用H2(催化剂:Ni,Pt等)或者LiAlH4、 NaBH4 等。
●
羧酸最难还原,与一般化学还原剂不起反应, 但可被LiAlH4 还成醇。
●
●
酯需高温高压才能催化加氢,用化学还原剂还 原最常用的是金属钠和醇。
溶解度越小,甚至不溶于水。这是有机化合
物在水中溶解性的一般规律。
(1)
四、醇的化学性质
* 与活泼金属的反应
此反应随着醇的相对分子量的增大而反
应速度减慢,醇的反应活性为:
甲醇>伯醇>仲醇>叔醇 醇钠遇水就分解为原来的醇和NaOH。
* 卤烃的生成
●
醇与氢卤酸作用,则羟基被卤素取代而生成卤 烃和水,这是制备卤烃的重要方法之一。
* 性质 ● 物理性质
无色,具有乙醚气味,高浓度时,具有刺激
性气味、易燃。沸点为10.5℃,溶于水。
●
化学性质
说明:
(1) 乙二醇乙醚是一具有醇和醚性质的物
有机化学中的醇和醚

有机化学中的醇和醚醇和醚是有机化合物中常见的两类化合物,它们在化学性质和应用领域上具有一定的相似性和差别。
本文将对有机化学中的醇和醚进行详细的介绍和分析。
一、醇的概念和性质1.概念:醇是由一个或多个羟基(OH)取代碳原子而形成的有机化合物,通式一般为ROH,其中R代表烷基或芳基。
2.性质:醇具有以下几个特点:(1)醇分子中的羟基具有极性,导致醇具有较高的沸点、溶解度和比热容,同时也使醇能够与水分子形成氢键。
(2)醇可以和酸反应,形成醚、酯等化合物,这是醇的一个重要反应。
(3)醇可以进行氧化反应,形成醛、酮等化合物,这是醇的另一个重要反应。
二、醇的命名和分类1.命名:醇的命名遵循系统命名法,以确定主链和羟基的位置、取代基和官能团等因素,例如乙醇、异丙醇等。
2.分类:醇可以根据羟基所连接的碳原子个数进行分类,分为一元醇、二元醇等。
三、醇在有机合成中的应用1.醇的还原性:由于醇分子中含有极易离去的羟基,醇具有还原性,可以被氢化剂还原为饱和烃。
这一性质使得醇成为重要的还原试剂,在有机合成中用于还原醛、酮等化合物。
2.醇的亲核性:醇分子中的羟基具有较强的亲核性,可以与酰卤、烯烃等电子不足的化合物发生亲核取代反应,形成醚、酯等化合物。
这一反应在有机合成中十分常见。
3.醇的氧化性:醇可以通过氧化反应被氧化剂氧化为醛、酮等化合物,这一反应常用于有机合成中的氧化反应。
四、醚的概念和性质1.概念:醚是由两个有机基通过氧原子连接而成的化合物,通式一般为R-O-R'。
2.性质:醚具有以下特点:(1)醚是较稳定的化合物,具有较低的沸点和溶解度。
(2)醚分子中的氧原子不带电荷,因此醚没有和水分子形成氢键的能力。
(3)醚可以被酸催化下的水解反应,将醚分解为两个醇。
五、醚的命名和分类1.命名:醚的命名同样遵循系统命名法,以确定两个有机基的结构和官能团等因素,例如乙醚、二甲醚等。
2.分类:醚可以根据氧原子所连接的碳原子个数进行分类,分为二元醚、三元醚等。
5第五章醇和醚

CH2OH CHOH CH2OH + 3HNO3 CH2ONO2 CHONO2 CH2ONO2 + 3H2O
广东药学院
主讲人: 主讲人 申东升
3.磷酸酯 .
磷酸酯是一类很重要的化合物,常用作萃取剂、增塑 剂和杀虫剂。由于磷酸的酸性比硫酸、硝酸弱,所以它 不易与醇直接成酯。 磷酸酯一般是由醇和POCl3作用制得的。
醇与氢卤酸作用的SN2反应 醇与氢卤酸作用的 反应 SN2机理:伯醇、仲醇与 机理: 机理 伯醇、仲醇与HX的反应 的反应
δ δ X R OH2
X
+ R-OH2 X-R + H2O
广东药学院
主讲人: 主讲人 申东升
2) 与PBr3 或 SOCl2的反应
RCH2 OH + Br P Br ( 1or 2 ) Br BrRCH2 O PBr2 R Br + HOPBr2 SN2 H
广东药学院
主讲人: 主讲人 申东升
3、欧芬脑尔氧化剂 氧化 、
欧芬脑尔氧化(Oppenauer Oxidation)是指在叔丁 醇铝或异丙醇铝存在下,仲醇和丙酮一起反应,醇上 的2个氢质子转移到丙酮后,生成酮,而丙酮被还原为 异丙醇。该方法对分子中的不饱和键(如C=C)亦无影 响。
第二节
醚和环氧化合物
一. 醚的分类和命名 醚的结 二. 醚的结构和物理性质 三. 醚的化学反应 四. 醚的制备方法 冠醚、 五. 冠醚、环氧化合物
广东药学院 主讲人: 主讲人 申东升
第一节
醇
烃分子中的氢原子被羟基取代生成的化合物称为醇 烃分子中的氢原子被羟基取代生成的化合物称为醇。 羟基取代生成的化合物称为
有机化学Chapter醇和醚

X-
RX
1。醇:SN 2
差的离去基团 好的离去基团
R-OH H+ R-O+H2 -H2O R+ X- RX
正碳离子
3。、2。醇:SN 1
醇与HX反应时,常伴有重排现象
CH3 CH3-C-CH 2OH
HBr
CH3
CH3
CH3-C-CH2CH3 + CH3-C-CH2Br
CH3
Br
CH3
(主要产物) (次要产物)
R
R
R
H-O H-O H-O H-O H-O
思考:乙二醇和甘油的沸点高低?
答案: 乙二醇 197℃ 丙三醇 290 ℃
② 溶解度:
醇在水中有一定的溶解度。C3以下醇与水混溶, C4以上随C数↑,溶解度↓。
原因:
a. 醇与水可形成分子间氢键:
R
H
R
H
R
H-O H-O H-O H-O H-O
b. 随C数↑,R在ROH中比例↑,而R一般是疏水的。
H2
CC2l3HC5COHH2O+HNa>OCHlCH2CH2OHC2>HC5OHN3CaH+2HC2HO2OH
碱性 碱性:ROH + H
ROH2 钅羊离子
低级醇能与氯化钙形成络合物—结晶醇(CaCl2·4C2H5OH)
不能用氯化钙干燥醇 可用氯化钙去除少量杂质醇
2、与无机酸的作用
醇与酸失水生成酯。
较低温度
CH3CCHH22OOH-H+ 浓H2SO4 CHO H + 3HO-N
140oC
O
170oC
CH2O-H
O
CH3CHC2HO2COHN2OCH2 3 CH2=CCHH2 ONO 2 + 3H2O
本科有机化学 第五章 醇和醚
5
6
结构与化学性质
碳氧单键为极性键 (与碳卤单键类似) 亲核取代反应、消除反应
氢氧极共用电子对 碱性、亲核性 7
一元醇的化学性质
1. O-H键的断裂:酸性(acidity)
醇酸性的体现
酸性的度量 (酸解离常数)
8
9
• the acid-dissociation constants for alcohols vary according to their structures • the acidity decreases as the substitution on the alkyl group increases • substitution by electron-withdrawing halogen atoms enhances the acidity of alcohols
27
28
本反应的一个早期应用:Alcohol Breath Tester
用嘴吹气 玻璃管:内壁附着 涂有重铬酸钾和 硫酸的硅胶颗粒
气 球
29
(2)选择性氧化剂氧化: PCC(pyridinium chlorochromate)
特点:活性相对较低,故选择性强,适合由伯醇氧化制备醛和由仲 醇氧化制备酮,不影响碳碳重键
SN2
亲核试剂进攻质子 化的羟基,水离去, 形成产物
伯醇和仲醇与HCl的反应常需添加ZnCl2,以促进反应的进行 反应活性较低的原因:亲核性Cl- < Br- (如何解释?)
16
Lucas reagent (卢卡斯试剂) 浓盐酸+无水ZnCl2
活化的原因:Zn2+与羟 基配合能力较H+更强!
Lucas test:可粗略地通过醇与Lucas试剂反应的时间推测醇的 类型(伯、仲、叔醇)
第九章醇和醚

电子基团(R)的影响,使氧原子上的电子云密度较低,O—H的氢受 到的束缚较小,所以易被取代。
醇钠(RONa)是有机合成中常用(chánɡ yònɡ)的碱性试剂。醇钠的用途:
1. 醇钠在有机合成中用作碱性试剂,其碱性比NaOH还强。 2. 醇钠也常作分子中引入烷氧基(RO-)的亲核试剂。 醇还可与其它活泼金属反应:如Mg,Al,生成醇镁、醇铝。
共五十九页
2、与氢卤酸反应(制卤代烃的重要(zhòngyào)方法)
1) 反应速度(fǎn yìng sù dù)与氢卤酸的活性和醇的结构有关。 HX的反应活性: HI > HBr > HCl
醇的活性次序: 烯丙式醇 > 叔醇 > 仲醇 > 伯醇 > CH3OH
共五十九页
醇与卢卡斯(Lucas)试剂(浓盐酸(yán suān)和无水氯化锌)的反应:
(1)加入还原剂5%的FeSO4于醚中振摇后蒸馏。 (2)贮藏时在醚中加入少许金属钠。
1. 醇脱水(tuō shuǐ)
四、醚的制备
此法只适用于制简单醚,且限于伯醇,仲醇产量低,叔醇在酸性
条件下主要生成烯烃。
共五十九页
2. 威廉姆逊合成(héchéng)法(A.W.Williamson)
威廉姆逊合成(héchéng)法是制备混合醚的一种好方法。是由卤代 烃与醇钠或酚钠作用而得。
脂肪醇、脂环醇和芳香醇(芳环侧链有羟基的化合物)。
3)根据分子中所含羟基的数目分为:
一元醇、二元醇和多元醇。 两个羟基连在同一碳上的化合物不稳定,这种结构会自发失水,
故同碳二醇不存在。另外,烯醇是不稳定的,容易互变成为比较稳
醇和醚知识点详解

醇和醚知识点详解醇和醚是有机化合物中常见的两类化合物。
它们在许多领域具有重要的应用,如有机合成、溶剂、药物和香料等。
本文将详细介绍醇和醚的定义、性质、制备方法和应用等知识点。
一、醇的定义和性质醇是一类含有氢氧基(-OH)的有机化合物。
根据氢氧基的位置,醇可以分为一次醇、二次醇和三次醇。
一次醇中,氢氧基连接在碳链上,如甲醇(CH3OH)和乙醇(C2H5OH)。
二次醇中,有两个氢氧基连接在碳原子上,如乙二醇(HOCH2CH2OH)。
三次醇则有三个氢氧基连接在碳原子上。
醇分子中的氢氧基使其具有一些特殊性质,如溶解性和酸碱性。
1. 溶解性:醇一般可溶于水。
较短的醇(一次醇和二次醇)溶解性较高,而较长的醇溶解性较差。
这是因为水分子能与醇分子的氢键形成氢键,使其能够相互溶解。
2. 酸碱性:醇可作为酸或碱。
在适当条件下,醇的氢氧基可以脱去质子成为负离子(醇的碱性),也可以接受质子成为正离子(醇的酸性)。
二、醇的制备方法1. 氢氧化物的还原:将醛或酮用还原剂(如氢气与催化剂)还原即可得到相应的醇。
2. 同分异构体的合成:对一些具有同分异构体的化合物,通过适当的反应条件,可以选择性地将其转化为某一种醇。
3. 环氧化合物的开环:将环氧化合物与酸或碱反应,使其开环而生成相应的醇。
4. 卤代烃的取代反应:醇也可以通过将卤代烃与水反应来获得。
三、醇的应用1. 溶剂:醇在许多化学反应中可以作为溶剂使用,如乙醇常用于制备药物和香料。
2. 酯的制备:醇与酸酐反应,通常可以生成酯。
酯在食品工业、香料工业和制药工业中有广泛的应用。
3. 脱水剂:由于醇分子中含有活泼的氢氧基,因此醇在一些有机合成反应中可以作为脱水剂使用。
四、醚的定义和性质醚是一类含有两个烷基或芳基团的有机化合物,其通式为R-O-R',其中R和R'可以是烷基或芳基团。
根据醚分子中氧原子在碳链上的位置,可以分为对称醚和非对称醚。
1. 对称醚:两个烷基或芳基团相同,例如乙醚(CH3OCH3),是最简单的醚。
8-1.醇和醚

2-甲基环戊醇
④ 芳香醇
CH2 CH CH3 OH 1-phenylpropan-2-ol
CH
CH CH2OH
3-phenylprop-2-en-1-ol
1-苯基-2-丙醇 ⑤ 多元醇
H3C CH CH2 OH HO propylene glycol
(1)常用催化剂:Pt、Pd、Ni
(2)分子中有碳碳重键同时被还原。
2、化学还原法 (1)LiAlH4
CH3 OH H3C C HC CH3 CH3 ( 1 )H
+
CH3 H3C C C H CH3 CH3
H3C C H3C C CH3 CH3
+
CH3 H3C C CH CH3 CH3
+
( 2 )--H2O
+
--H
但用Al2O3为催化剂时,醇在高温气相条件下脱水, 往往不发生重排。
H2SO4 CH3 CH2 CH2 CH2 OH Al 2O3 CH3 CH CH CH3 CH2
(1)O-H 键有极性,活性氢,有酸性。 (2)C-O 键有极性,-OH 被取代。 (3)α-H 有活性,发生氧化反应。 (4)β-H 有活性,消除反应。 .. .. (5)R-OH中氧的电子云密度高于H-OH ——作亲核试剂。
(一)酸性和与活泼金属的反应
与活泼金属(K、Na、Mg、Al)的反应
R OH
② 琼斯(Jones)试剂:三氧化铬溶于稀硫酸 (CrO3.H2SO4)
类似于沙瑞特试剂。 ③ 活性二氧化锰:新制备的二氧化锰 选择性地将烯丙位的醇氧化成相应的不饱和醛、酮。
H2C CH CH2OH 活性 MnO2 H2C CH CHO
第十章醇和醚

O CH3CH2CC6H5 + CH3CH2MgBr
三、醇的化学反应
Nu:C O H H
羟基质子化 弱酸性
C H
O C
O
H
O
H H
氧化与脱氢
醇的化学性质主要由羟基官能团所决定,同 时也受到烃基的一定影响,从化学键来看,反 应的部位有 C—OH、O—H、和C—H。
H2
RONa
H2O
ROH
NaOH
醇钠的碱性比NaOH强。 加入苯通过三元共沸物蒸馏也可以制备醇钠。
6(CH3)2CHOH
2Al
2 [(CH3)2CHO]3Al
3H2
Lucas reagent
CH3 H3C C OH CH3 H
H5C2 C OH CH3
无水ZnCl2 和浓HCl
ZnCl2/HCl r.t. CH3 H3C C Cl CH3
+
1 H 2 2 1 H + 12 2
3 (CH3)2CHOH + Al
(CH3)2CHO 3Al
ROH的反应活性1°>2°>3°
相对酸性
H2O > ROH.> RC CH > H2 > NH3 > RH
相对碱性
-
R >
-
NH2
> H > RC
-
C > RO > OH
2 ROH
2Na
2 RONa
H δ R C δ O δ H 酸性,生成酯
H 氧化反应 形成 C ,发生取代及消除反应
分子中的C—O键和O—H键都是极性键, 因而醇分子中有两个反应中心。 又由于受C— O键极性的影响,使得α—H具有一定的活性, 所以醇的反应都发生在这三个部位上。
醇和醚

第五章 醇和醚主要内容第一节 醇第二节 醚重点内容:醇和醚的化学性质难点内容:醇和醚的化学性质学时:4第一节 醇一、分类和命名选长链——含羟基; 编位次——羟基始。
同一个碳原子上连有两个羟基的结构是不能稳定存在的。
因此,在多元醇中,像乙二醇,丙三醇这样的名称并不会产生歧义。
只有当碳原子数多于羟基数目时,才需标出羟基所在的位置。
如:二、结构和物理性质物理性质 特点是存在分子间的氢键作用为什么醇具有较高的沸点?(分子间氢键缔合)醇分子中烃基对氢键缔合有阻碍作用。
多元醇,分子中两个以上位置可形成氢键。
低级醇与水互溶。
醇在强酸中的溶解度比在水中大。
CH 3C CH 2OH CH 2O H CH 2O H CH 3CH =C CHCH(CH 3)2(CH 3)2CH OH 3__ _2甲基戊醇243__ _4_ __ _甲基异丙基己烯醇CH 3CH CHCH 3CH 3CH 2O H O H CH 2CH 3_ _22_甲基羟甲基_ _1 , 3丙二醇2__ _1乙基环己醇三、化学反应 一元醇的化学反应 ROH 的反应活性1°>2°>3° 烷氧负离子的碱性: 碱性:盐的生成(二)碳氧键断裂的反应 1、亲核取代反应 (1)与氢卤酸反应 醇的亲核取代反应一般在酸性条件下进行 酸催化可使羟基质子化,减弱C-O 键,然后以水的形式离去。
SN1机理: (多数 叔、仲醇以及一部分伯醇)这是因为按SN1机理进行反应时,可能发生分子重排的结果。
C 性酸 性α涉及αH 的反应主次C H 3C C H C H 3C H 3O HH +C H 3C C H C H 3C H 3H 2H +重 排CH 3C CH CH 3CH 3+2°碳正离子仲醇与HX 酸的反应中,生成重排产物则是SN1机理的重要特征。
SN2机理:(多数 1o 醇 特点:没有重排 )下面的反应能否顺利进行?然而,作为新戊醇这一伯醇与HCl 的作用却是按SN1历程进行的,且几乎都是重排产物。
有机化学课件-第五章醇和醚

03
醚不溶于水,但可溶于 有机溶剂。
04
醚的稳定性相对较高, 但在强酸或强碱的作用 下可以发生水解反应。
04
醇和醚的反应
醇的反应
氧化反应
醇可以被氧化生成醛、酮、羧酸等化合物, 如用氧化剂如铬酸、硝酸或过氧化氢等处 理醇,可将其转化为相应的醛或酮。
脱水反应
醇在浓硫酸或高温下可发生脱水反应,生 成烯烃。例如,乙醇在170℃下脱水生成
醛和酮是含有羰基的有机化合物,而醌则是一种具有特殊结 构的有机化合物。这些化合物在化学性质和反应方面有着重 要的应用。
第七章 羧酸及其衍生物
羧酸是含有羧基的有机化合物,其衍生物包括酯、酸酐、酰 胺等。这些化合物在化学工业、食品、医药等领域有着广泛 的应用。
THANKS
感谢观看
醇和醚的结构多样,可以根据 连接的碳原子数、取代基的类 型等进行分类。
醚的性质和反应
醚也是一类含有氧的有机化合物 ,其化学性质与醇类似,但也有 其独特之处,如稳定性较高。
醇和醚的应用
醇和醚在日常生活和工业生产中有 着广泛的应用,如乙醇可以用于消 毒、燃料等,而乙醚则常用于麻醉 。
下章预告
第六章 醛、酮和醌
有机化学课件-第五章醇 和醚
• 引言 • 醇的分类和结构 • 醚的分类和结构 • 醇和醚的反应 • 醇和醚的应用 • 结论
01
引言
醇和醚的简介
醇
是含有羟基的有机化合物,其官能团 为$- OH$。根据与羟基所连碳原子的 类型,醇可分为伯醇、仲醇和叔醇。
醚
是含有醚键的化合物,其官能团为 $R-O-R'$。根据醚键所连碳原子的个 数,醚可分为单醚和双醚。
醇和醚的重要性
醇在日常生活和工业生产中具有广泛 的应用,如乙醇可作为消毒剂、燃料 添加剂和溶剂,而某些高级醇可用于 化妆品和润滑剂的制造。
第九章醇和醚

醇、醚可看成是水分子中的氢原子被烃基所取代的 产物,属烃的含氧衍生物。
通式:R-OH 脂肪醇;Ar-R-OH 芳香醇;
R-O-R` 脂肪醚、Ar-O-Ar 芳醚。
如果硫化氢分子中的氢原子被烃基取代,则得到硫 醇、硫酚、硫醚。R-SH、 Ar-SH、 R-S-R`
第一节
醇
醇可以看成是烃分子中的氢原子被羟基(OH)取代后 生成的衍生物(R-OH)。
环氧乙烷化学性质活泼,在酸或碱催化下能与多种试剂 反应,形成一系列重要工业原料。
A. 在酸催化下,环氧乙烷可与水、醇、卤化氢等含活泼氢的 化合物反应,生成双官能团化合物。
这些产物同时有醇和醚的性质,是很好的溶剂,常称溶 纤素,广泛用于纤维素酯和油漆工业。
B. 在碱催化下,环氧乙烷可与RO-,NH3,RMgX等反应生成 相应的开环化合物。
发。大于6个碳的醇(苄醇除外)不溶于卢卡斯试剂,易混淆实
验现象。
2) 醇与HX的反应为亲核取代反应,伯醇为SN2历程,叔醇、烯 丙醇为SN1历程,仲醇多为 SN1历程。 A. SN1: 烯丙醇、苄醇、叔醇、仲醇。
这是因为按SN1机理进行反应时,可能发生分子重排的结果。
B. SN2:大多数伯醇,且没有重排反应。
硫醇的分解:氢解和热解两种,用于脱硫。
氢解:H2,CoMnO4 340℃-400℃
RH + H2S 烯烃 + H2S
R-SH
热解:340℃-400℃
硫醚的C-S键较弱,反应活性大于醇。 硫醚的氧化:生成亚砜和砜类。
二甲亚砜的溶解能力和穿透能力极强,在实验室中应避 免与人体皮肤接触。 锍盐的生成:
3.醇的命名 1)俗名 如乙醇俗称酒精,丙三醇称为甘油等。 2)简单的一元醇用普通命名法命名。
有机化学 第5章醇和醚

(二)物理性质
1.性状:
2.沸点:
1)比烷烃的沸点高(形成分子间氢键的原因), 如 乙烷的沸点为-88.6℃,而乙醇的沸点为78.3℃。
2)含支链的醇比直链醇的沸点低,如正丁醇 (117.3 ℃ )、异丁醇(108.4 ℃ )、叔丁醇 (88.2 ℃ )。
3.溶解度:
✓ 甲、乙、丙醇与水以任意比混溶(与水形 成氢键的原因);
CH3CH2O- (乙醇钠)的碱性HO-(氢氧化钠)强, 所以醇钠极易水解。
CH3CH2ONa + H2O
较较强强键碱 较强较酸强酸
CH3CH2OH + NaOH
较弱酸 较较弱弱酸碱
较弱减
即:强酸置换弱酸盐!
工业上制备醇钠常用上述逆反应,但需将生 成的水及时移走。
醇与钠的反应活性:
CH3OH > 伯醇(乙醇) > 仲醇 > 叔醇
伯醇 仲醇 叔醇
Lucas试剂
(-) 5分钟内浑浊 立即浑浊
4)与卤化磷和亚硫酰氯反应p154
3ROH + PX3
3RX + P(OH)3
X=Br、I,制备溴代或碘代烃
( Cl的反应产率低于50%)
ROH + PCl5 ROH + SOCl2
RCl + POCl3 + HCl RCl + SO2 + HCl
OO O K+ O
OO
MnO4-
COOH COOH
六、环氧乙烷的部分化学性质
H
R Cδ
Oδ
δ H
H
酸性,生成酯
氧化反应 形成 C ,发生取代及消除反应
(一)O-H键断裂的反应 1.与活泼金属的反应
第6章 醇和醚

C CHCH2CHCH3 CH3 OH
5-苯基 己烯 醇 苯基-4-己烯 苯基 己烯-2-醇 5-phenyl-4-hexen-2-ol
6/33
(三)俗名:根据来源进行命名。 三 俗名 根据来源进行命名。 俗名:
CH3OH
H HOCH2 C OH H C C
木醇 wood alcohol
H C CH2OH 山梨醇
饱和醇 烯醇 炔醇
不饱和醇 根据烃 基不同 脂环醇
芳香醇
•羟基与不饱和键相连的醇大多不稳定, 羟基与不饱和键相连的醇大多不稳定, 羟基与不饱和键相连的醇大多不稳定 分子易异构,转变成相应的醛酮, 分子易异构,转变成相应的醛酮,所以 醇一般限于羟基与饱和碳相连的化合物。 醇一般限于羟基与饱和碳相连的化合物。
不同结构的醇与金属钠反应的速度是: 不同结构的醇与金属钠反应的速度是: 甲醇>伯醇 仲醇 叔醇、 甲醇 伯醇>仲醇 叔醇、 伯醇 仲醇>叔醇 原因:与醇的酸性次序一致。 原因:与醇的酸性次序一致。
诱导效应解释:
R O H
2、醇中碳-氧键断裂 、醇中碳 氧键断裂
羟基被取代(亲核取代反应 羟基被取代 亲核取代反应) 亲核取代反应
第6章 章
醇和酚
醇可用通式ROH表示,醇的官能团 表示, 醇可用通式 表示 为羟基(hydroxyl group); 为羟基 ; 酚是芳环上的氢被羟基代的化合物, 酚是芳环上的氢被羟基代的化合物, 酚中的羟基称为酚羟基。 酚中的羟基称为酚羟基。醇中的羟基 称醇羟基. 称醇羟基
第一节 醇
一、分类: :
伯醇分子间的脱水为SN2机理
叔醇易生成正碳离子,主要产物为烯。
如果两种不同的伯醇之间脱水, 如果两种不同的伯醇之间脱水,则得到三种 醚的混合物。因此, 醚的混合物。因此,这种方法只适合制备单 而不适合制备混醚。 醚,而不适合制备混醚。混醚的制备可利用 伯卤代烃与醇钠反应。 伯卤代烃与醇钠反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
54
(二)Williamson合成法
R ONa + R' X R O R' + NaX
反应要进行合理的选择,选好卤代烃
① 选择空间位阻小,易起SN2反应的卤代烃,
例如选用甲基卤代物或伯卤代烃,使亲核试剂 易于接近中心碳。
钠与水反应: 2Na + 2H
OH
2NaOH +H 2
钠与醇反应: 2R-OH+2Na→2R-ONa+H ↑ 2
遇水分解: R ONa + H OH
R H+NaOH
19
反应实质:取代反应 -O-H中的H被碱金属原子取代,有H2↑
反应速度 水>甲醇>伯醇>仲醇>叔醇
酸性强弱 水>甲醇>伯醇>仲醇>叔醇
O CH3 + HI
OH + CH3I
CH3 O C5H12 + HI
CH3I + C5H12OH
53
四、醚的制取
(一)醇脱水成醚
CH3CH2OH HOCH2CH3
此法的局限性在于: 1. 仅能制备对称性的醚
浓H2SO4 140
CH3CH2OCH2CH3
2. 适用于以伯醇为原料。因为仲醇和叔醇在加热 时主要进行分子内脱水成烯。
丙三醇:(10%皮肤润滑;50%便秘灌肠) 肌醇:治疗脂肪肝 甘露醇:渗透性利尿剂
40
五、醇的制取 (一)烯烃的水化
2 CH3 CH CH2 H2SO4
H O
CH3 CH CH2 OH H
(二)卤烃的水解
41
(三)醛、酮的还原
H R C O + H2 Pt H R C OH H
醛还原成伯醇,酮还原成仲醇,高效还原剂 LiAlH4, NaBH4
R O H H
R O H
R O H
R O
16
2.溶解度:
低级醇易溶于水。甲醇、乙醇、丙醇能与水混溶,从正 丁醇开始溶解度下降,癸醇以上不溶于水。
低级醇易溶于水,主要是因为水分子和醇分子之间形
成氢键的缘故。
R O H H
H O H
R O H
H O
17
三、醇的化学性质
18
(一)酸性与活泼金属反应(O—H键断裂)
1.单醚在醚字前面加上烃基的名称,“二”字可以省略
。
2.混醚必须把两个烃基的名称都表示出来,较小的烃基放
在前面;两个烃基有一个是芳香烃基,芳烃基放在前面。
47
CH3—O—CH3
CH3 CH2—O—CH2CH3
CH3 CH2—O—CH3
CH3
CH3 O CH CH3
O
CH3 O
48
二、醚的结构和物理性质
硝化甘油是烈性炸药,但溶于水稀释后,可以作为缓解 心绞痛的药物.
22
硝化甘油学名三硝酸甘油酯。是巳 知一切炸药中最富有能力的一种。
CH2ONO2 CHONO2 CH2 ONO2
苦味酸学名2,4,6-三硝基苯酚分解产物产 生有毒气体一氧化碳,因此只能用于露天作 业。又由于苦味酸具有强酸性,能腐蚀金属 ,生成极度敏感易爆的苦味酸盐
反应生成烯烃,较低温度则主要生成醚。
33
(五)成醚反应
将醇和浓硫酸一起加热发生脱水反应,脱水方式随温 度而异,一般在较高温度时,发生分子内脱水,生成烯烃; 较低温度下发生分子间脱水成醚。
CH3CH2 OH
HO CH2CH3
浓硫酸
140 ℃
CH3CH2 O CH2 CH3
34
(六)氧化和脱氢反应
在有机化合物分子中加氧或去氢的反应叫氧化反应; 而去氧加氢的反应叫还原反应。
CH3CHCH2CH2CH3 CHCH2CH3 OH
45
第二节 醚和环氧化合物
醚可看作是醇或酚中羟基上的氢被烃基取代的化合物。 一、醚的分类和命名 (一)分类
单醚:与氧相连的两个烃基相同 醚
R—O—R
混醚:与氧相连的两个烃基不相同 R—O—R’
46
(二)醚的命名 醚根据与氧原子相连的烃基来命名。
42
(四)醛、酮与Grignard试剂加成
R(H) R C O + RMgX R(H) R C OMgX R R(H)
HX
R C OH + MgX2 R
43
CH3
H 无水乙醚 C O Mg X + + H H2O/H
CH3 Mg X +
CH3 CH3
C O
无水乙醚 H2O/H
+
CH3
CH3 C O Mg X + H
OH NO2 NO2
NO2
梯思梯(TNT)学名2,4,6-三硝基甲苯,可装填各种弹药
CH3 NO2 NO2
NO2
23
(三)亲核取代反应:O—C键断裂
1、与氢卤酸的反应 醇的卤代反应是醇的C-O断裂,这个反应是卤代烃水解的逆反应。
R OH + HX
R X + H2O
HX 的活性顺序为HI>HBr>HCl
HClO4等。
H R O R H+Cl R O R Cl
用途:在强酸中溶解为醚,区别烷烃和醚
51
(二)过氧化物的生成
CH3CH2 O CH2CH3
O2
CH3CH2 O CHCH3 O O H
52
(三)醚键的断裂
R O R ' + HI R I + R' OH
醚键的断裂通常是两个R中以含碳较少的R形成碘代物。
醇的活性顺序为叔醇>仲醇>伯醇
24
25
无水氯化锌与浓盐酸混合制成的溶液称为卢卡斯(Lucas)
试剂。不同醇的与卢卡斯试剂反应速度有显著差别,
叔醇与卢卡斯试剂反应最快,立即形成混浊溶液; 仲醇在温水浴中需几分钟变混浊;
伯醇加热1小时也不混浊。 可根据出现混浊的快慢来鉴别伯、仲、叔醇。
26
② 与卤化磷的反应
1、强氧化剂氧化
RCH2 OH
[O]
RCHO
[O]
[O]
RCOOH
O RCR'
35
RCHR' OH
[O]
R R一C一OH R
不 反 应
没有 - H
伯醇和仲醇可被酸性KMnO4和酸性K2Cr2O7氧化成相 应的醛或酮。叔醇没有α-H,不能被氧化, 用此反应可以 鉴别叔醇。
36
2、选择性氧化剂氧化
R—CH2—OH
R R'
CH OH
R R' C OH
R''
5
3 .根据醇分子中羟基的数目不同,分为一元醇、二元醇、
三元醇等。二元醇以上称为多元醇。
CH3
OH
CH2 CH2
OH OH
CH 2 CH CH 2
OH OH OH
6
(二)命名
醇的命名方法,可分为普通命名法和系统命名法。结 构简单的一元醇通常采用普通命名法,在醇字前面加上烃
CHCH3 OH
13
根据名称写出结构式 5-甲基-4-氯-3-己醇 3-戊烯-2-醇
2-甲基-1,3-戊二醇
叔丁醇
14
二、醇的结构和物理性质 (一)醇的结构
15
(二)醇的物理性质
1.沸点:
醇的沸点与烷烃一样随分子量的增加而上升,在 含有相同碳原子数的醇中,支链醇的沸点比直链醇低。 同时醇的沸点比相近分子量的烷烃要大得多
28
CH3
SOCl2 乙醚
H
C Cl
CH3 H C OH
CH3CH2 CH3
SOCl2 吡啶
CH3CH2
Cl C
H CH2CH3
29
(四)消除反应
将醇和浓硫酸一起加热发生脱水反应,脱水方式随温 度而异,一般在较高温度时,发生分子内脱水,生成烯烃。
动画
CH3 CH2 OH
浓H2SO4 170
CH2 CH2
为使伯醇和仲醇氧化成羰基化合物,可采用一些较弱的 氧化剂或特殊氧化剂。例如,三氧化铬与吡啶的加合物。
RCH2OH
CrO3
吡啶
CH2Cl2
RCHO
伯醇和仲醇使三氧化铬与吡啶的加合物变为绿色,因此可 用于检测驾驶员是否饮酒.
R CH R(H)
OH
Cu,325
R CH O R(H)
37
脱氢氧化
四、邻二醇的特性
(一)与高碘酸的反应:碳碳键断裂,生成羰基化合物。
R CH CH R' + HIO4 OH OH
R C H + H C R' + HIO3 + H2O O O
反应生成的碘酸可与硝酸银反应成AgIO3沉淀,可以定量测定 邻二醇,并可根据生成的氧化产物推测邻二醇的结构。
38
(二)与氢氧化铜的反应
具有两个相邻羟基的多元醇与新配制的氢氧化铜反应生成深蓝色 的溶液 。
CH2 OH CH OH CH2 OH
HO HO
CH2 O Cu CH O
Cu
2H2O
CH2 OH
甘油铜(深蓝色)
常用此反应鉴别含有两个相邻羟基的化合物。
39
七、医药上常用的醇
甲醇:毒性强 乙醇
10毫升致双目失明多则致死
:酒精(溶剂 燃料 饮料) (杀菌消毒 75% 降温擦浴:25-35%)
CH3 CH CH CH3 CH3 OH
CH2 CH CH CH CH3
3-甲基-2-丁醇
8
不饱和醇分子中含有不饱和键,必须选取含不饱和 键 在内的最长碳链作为主链。
CH2 CH CH CH2 OH CH3
H CH3
H
