藻类膜蛋白提取方法
膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
提取膜蛋白的方法

提取膜蛋白的方法提取膜蛋白是一项关键的实验步骤,用于研究膜蛋白的结构和功能。
本文将介绍几种常用的膜蛋白提取方法。
1. 浸泡法浸泡法是一种简单的膜蛋白提取方法。
将细胞或组织样品置于适当的缓冲液中,如磷酸盐缓冲液或生理盐水中,并加入一些溶解剂(如阴离子洗涤剂)以破坏膜结构。
浸泡一段时间后,离心以分离出溶液中的膜蛋白。
2. 磷脂双层溶液法磷脂双层溶液法利用磷脂双层膜的特性来提取膜蛋白。
首先,将细胞或组织样品放入含有磷脂双层的液体中。
磷脂双层膜与细胞膜相似,可吸附并保持膜蛋白的结构和功能。
然后,用洗涤液洗涤磷脂双层,使膜蛋白释放到洗涤液中。
3. 超声法超声法是一种物理方法,通过超声波的能量来提取膜蛋白。
将细胞或组织样品置于含有缓冲液的管中,并使用超声波处理。
超声波的能量可以破坏细胞膜结构,使膜蛋白溶解到缓冲液中。
然后,对溶液进行离心,将膜蛋白分离出来。
4. 酸碱提取法酸碱提取法利用pH的变化来提取膜蛋白。
首先,将细胞或组织样品放入酸性或碱性溶液中,并搅拌。
酸性或碱性环境可以破坏细胞膜结构,使膜蛋白溶解到溶液中。
然后,通过调整pH值,使膜蛋白沉淀,进一步提纯。
5. 亲水基质法亲水基质法是一种通过亲水基质与疏水膜蛋白的选择性结合来提取膜蛋白的方法。
细胞或组织样品与亲水基质接触,亲水基质与细胞膜的亲水区域结合,使膜蛋白释放到溶液中。
然后,通过离心和洗涤步骤来分离和纯化膜蛋白。
这些方法在膜蛋白的研究中应用广泛,但根据具体的实验目的和样品特性,可以选择适合的方法进行膜蛋白提取。
实验中还应注意选择合适的缓冲液、溶液浓度和温度,并结合离心、洗涤等步骤进行蛋白的纯化和分离。
此外,需要根据实验目的选择合适的检测方法,如SDS-PAGE、Western blot等来确定提取的膜蛋白的质量和纯度。
总之,膜蛋白提取是膜生物学研究的重要一环,不同方法适用于不同的样品和实验要求。
正确选择和操作提取方法可以高效地提取膜蛋白,并为后续研究提供可靠的样品。
螺旋藻中藻蓝蛋白提取的工艺流程

螺旋藻中藻蓝蛋白提取的工艺流程王艺生物技术二班20100404071、预处理将螺旋藻洗净晾干2、细胞破碎利用超声波破碎发破碎细胞,藻胆蛋白属于胞内蛋白质,要提取分离藻胆蛋。
首先必须要破坏藻类细胞的细胞壁、细胞膜,使藻胆蛋白以溶解的状态释放出来,并保持其活性。
超声波细胞粉碎仪破碎鱼腥藻细胞的最佳处理条件是超声仪的功率为600 W,超声时间为9min,固液比为1:8,破壁容量为20 mL。
也可与其他方法合用最大限度的破碎细胞。
3、提取(初步分离)(1)用超滤膜过滤藻胆蛋白提取液,获得藻胆蛋白粗制品。
用NaNO3,高渗一超滤法分离提纯藻胆蛋白,超滤时选用聚砜膜,在超滤过程中,无机盐和小分子蛋白质,包括小分子的藻毒素透过滤膜而去掉,特别适用于易产生水华的微囊藻脱毒,提高产品的安全性。
NaNO3高渗.超滤法是提取藻胆蛋白的简单易行的方法,用此法提取的藻胆蛋白是安全无毒的,且易于纯化,脱水方便,产品易于干燥。
(2)也可利用沉淀法将大量盐加到蛋白质溶液中,蛋白质胶粒凝结并沉淀析出,因此向细胞破碎液中加入盐溶液使蛋白质沉淀析出。
用25%硫酸铵可将藻红蛋白沉淀出,用30%硫酸铵可将藻蓝蛋白沉淀出,再用50%硫酸铵可将蓝藻蛋白沉淀出。
4、精制(高度纯化)离子交换层析法,用 DEAE一步纯化藻蓝蛋白;改变传统以离子强度作梯度洗脱的方法,根据藻红蛋白的等电点进行pH梯度洗脱,仅用DEAE一步层析,就将藻红蛋白纯度从1.042提高至5.6,回收率达67.33%。
用硅藻土545柱分级洗脱,再用该法纯化,从螺旋藻中获得初度为4.1的藻蓝蛋白和纯度为4.6的别藻蓝蛋白;将提取液上DE。
AE一52纤维素柱,提取纯度只有1.9,在上葡聚糖凝胶柱,则得到了纯度较高的蓝藻蛋白。
5、成品制作随着藻蓝蛋白制品的应用范围的不断扩大,对提取分离工艺的要求也逐渐提高。
不仅要有高的提取率、好的产品质量,而且要考虑省时、省力、自动化程度高。
利用缓慢冷却加晶种的方法使藻蓝蛋白结晶,干燥后进行保存。
藻蓝蛋白的分离纯化及其在食品中的应用

藻蓝蛋白的分离纯化及其在食品中的应用蓝绿藻是一种广泛存在于水体中的微生物,具有丰富的蛋白质,其中具有生物活性的藻蓝蛋白是其重要成分之一。
藻蓝蛋白具有抗氧化、抗炎、抗肿瘤等多种生理功能,在食品领域中的应用也越来越受到人们的关注。
首先,提取藻蛋白是藻蓝蛋白分离纯化的第一步。
一种常用的方法是溶解蓝藻细胞膜,并通过离心等操作将藻蛋白从细胞中分离出来。
然后,可以使用尺寸排除色谱、离子交换色谱和亲和色谱等技术进一步纯化。
这些分离纯化的方法能够去除其他蛋白质和杂质,提高藻蓝蛋白的纯度。
藻蓝蛋白在食品中的应用有许多潜力。
首先,在抗氧化方面,藻蓝蛋白具有很高的自由基清除能力,可以减少食品在贮存和加工过程中的氧化反应,延长食品的保鲜期。
另外,藻蓝蛋白还能够稳定食品中的颜色,使颜色更加鲜艳。
这一特性使得藻蓝蛋白可以广泛应用于饮料、糕点等食品中,提高产品的市场竞争力。
其次,藻蓝蛋白还具有抗炎和抗肿瘤的作用。
研究发现,藻蓝蛋白能够抑制炎症反应中的炎症介质释放,从而减轻炎症反应对人体的伤害。
在食品加工过程中,添加藻蓝蛋白可以减少食品中的致炎物质的生成,提高食品的健康性。
此外,藻蓝蛋白还具有一定的抗肿瘤活性,可以用于开发新型的抗肿瘤功能性食品。
除此之外,藻蓝蛋白在食品领域中的应用还包括改善食品的营养价值和口感。
藻蓝蛋白中富含的氨基酸和多种微量元素可以提高食品的营养价值。
同时,藻蓝蛋白还具有一定的凝胶特性,在食品中可以改善质地和口感,提高食品的口感感受。
然而,尽管藻蓝蛋白在食品中的应用潜力巨大,但也面临一些挑战。
首先,藻蓝蛋白的生产成本较高,加上其稳定性和保存性能较差,限制了其在食品中的广泛应用。
其次,藻蓝蛋白作为一种新型成分,还需要进一步研究其对人体健康的影响,以确保其在食品中的安全性。
综上所述,藻蓝蛋白具有广泛的蛋白质来源、多种生理功能及一定的应用潜力,在食品领域中的研究和开发也取得了一些进展。
随着科学技术的不断发展,相信藻蓝蛋白在食品中的应用将会得到更大的推广和应用。
藻蛋白提取实验报告

一、实验目的本实验旨在通过学习并掌握藻蛋白的提取方法,了解不同提取方法对藻蛋白提取效果的影响,并对提取得到的藻蛋白进行初步的纯化及鉴定。
二、实验原理藻蛋白主要存在于藻类植物中,如螺旋藻、小球藻等。
藻蛋白的提取方法主要有物理法、化学法和生物法。
本实验采用物理法中的冻融法提取藻蛋白,该方法操作简单,对藻类植物损伤小,提取效率较高。
三、实验材料与仪器材料:1. 螺旋藻粉2. 蒸馏水3. 0.1mol/L的KOH溶液4. 0.1mol/L的HCl溶液5. 95%乙醇6. 无水乙醇7. 丙酮8. 磷酸盐缓冲液(pH 7.0)仪器:1. 电子天平2. 磁力搅拌器3. 超声波清洗器4. 高速离心机5. 蒸发皿6. 烧杯7. 离心管8. 吸管9. 滤纸四、实验步骤1. 藻蛋白粗提1. 称取10g螺旋藻粉,置于100ml离心管中。
2. 加入50ml蒸馏水,充分搅拌,使螺旋藻粉充分溶解。
3. 将混合液置于冰浴中冷却,每隔30分钟搅拌一次,共冷却2小时。
4. 冷却完成后,以4000r/min的转速离心10分钟,收集上清液。
5. 将上清液转移至烧杯中,加入95%乙醇,使蛋白质沉淀,静置30分钟。
6. 以4000r/min的转速离心10分钟,收集沉淀。
7. 将沉淀用蒸馏水洗涤三次,以去除杂质。
2. 藻蛋白纯化1. 将洗涤后的沉淀溶于适量的磷酸盐缓冲液(pH 7.0)中。
2. 将混合液通过DEAE纤维素层析柱,用磷酸盐缓冲液进行梯度洗脱。
3. 收集含有藻蛋白的洗脱液,经浓缩、冷冻干燥后得到藻蛋白。
五、实验结果与分析1. 藻蛋白粗提通过冻融法提取的藻蛋白,在95%乙醇中沉淀,经离心后得到淡蓝色沉淀,表明藻蛋白提取成功。
2. 藻蛋白纯化通过DEAE纤维素层析柱纯化后,得到的藻蛋白在紫外-可见光谱上呈现出典型的藻蓝蛋白特征峰,表明纯化成功。
六、实验结论本实验采用冻融法和DEAE纤维素层析柱法成功提取并纯化了藻蛋白。
实验结果表明,冻融法是一种简单、高效的藻蛋白提取方法,而DEAE纤维素层析柱法可以进一步纯化藻蛋白,提高其纯度。
western膜蛋白的提取

western膜蛋白的提取分离膜蛋白的方法有两种:1先分离膜,然后提取;2用特殊的去污剂选择性的分离。
第二种方法简单,可靠,但有时含有其他蛋白。
原理:4度时所有的蛋白质原则上都溶于TritonX114水溶液,但在37度时,此溶液分为水相和去污相;此时亲水性蛋白溶于水相,疏水的膜蛋白溶于去污剂相中。
方案1)放射性标记受试细胞2)将标记的细胞放在冰上3)去除上清,用pH7。
4的冷磷酸盐缓冲液洗涤单层细胞两次4)加入1ml2%TritonX溶液冰浴15min5)刮下单层细胞,4度下10 000g 5min离心6)溶液37度水浴10min以分离水相和去污剂相,然后37度下2 000g离心5min7)收集水相留作分析8)用500ul冰冷的buffer C溶解去污剂相沉淀,冰浴2min后加温,在按步骤6再次离心9)按步骤8再次抽提去污剂相,用buffer C将洗涤后的去污剂相稀释到初始体积10)用等量的buffer A分别稀释水相与去污相,并进行免疫沉淀实验试剂:1)2%tritonX114:2%TritonX114、50mmol/L Tris HCl(pH7。
5)、蛋白酶抑制剂2)缓冲液A(含0。
5mol/LNaCl的RIPA buffer)3)buffer C10mmol/L Tris HCl(pH7.5)150mmol/L NaCl5mmol/L EDTA(PH7.5)这是我在nwfsc上求助膜蛋白提取时别人发给我的email,其实膜蛋白的提取的方法依据膜蛋白的不同类型方法也不一样。
是组织还是细胞,细胞膜膜结合蛋白还是细胞器结构膜蛋白,如果是细胞的话建议你买个膜蛋白抽提试剂盒吧。
I'll give you these protocols that I use. The first is for isolation of mitochondria from liver and the other is for the isolation of membrane proteins. Both of these are specific to my needs and you will want to optimise them for your own needs. For the isolation of membrane proteins you will need to find references for your specific protein. The buffers and conditions that I use will not be suitable for all proteins.Isolation of mitochondria (adapted from O'Gorman et al. FEBS Lett. 414 (1997) 253-257) Isolation buffer: Mannitol 200mM Sucrose 70mMHEPES 2mMEDTA 0.5mMBSA 0.5mM pH 7.4Wash buffer: Mannitol 200mMSucrose 70mMHEPES 2mM pH 7All experimental work is carried out at 4degC and in the presence of 500uM PMSF. (the PMSF can be substituted for AEBSF but one or the other must be used)Liver is removed from Wistar rat and placed in cold isolation buffer. the liver is cut up into 4x2g pieces. Each piece is placed in1ml isolation buffer and chopped up with scissors to form a mince. This mince is placed in a Potter tissue grinder and 2ml more isolation buffer is added. The mince is homogenised with four passes of the grinder and more isolation buffer is added until the total volume is 10ml. The homogenate is put into a centrifugetube and 10ml more isolation buffer is added to give a 10% homogenate (2g of tissue in 20ml of buffer). Repeat this process with the other pieces of tissue.Differential centrifugation is used to isolate mitochondria.Centrifuge at 560g for 15min. This will give a pellet of large cell debris and nucleus (I discard this pellet)Centrifuge the supernatant from the first spin at 7000g for 15min. This gives a pellet of mitochondria. The supernatant will contain microsomes and cytosol (the microsomes can be separated by centrifuging at 21,000g for 40 min)Resuspend the pellet you want in 10ml of washing buffer and then centrifuge again at the speed required. Repeat this step until the pellet has been washed 3 times.Now you have a cellular pellet you can start to isolate your protein from it.With this protocol the most important thing to do is remember the AEBSF or PMSF. If you do not add it your protein may become degraded before you can isolate it.Isolation of membrane bound protein (adapted from Zwizinski and Schmidt Arch. Biochem Biophys 294 (1992) 178-183 and Belzacq et al. Oncogene 20 (2001) 7579-7587) The protocol will really depend on the properties of the protein that you want to isolate. Basically I use a lysis buffer like this:KH2PO4 40mMKCl 40mMEDTA 2mMTriton X-100 6%Basic protocolMix cellular pellet with 4ml of lysis buffer. Briefly vortex and mix for 30 min at 4degC. Place solution in tubes and centrifuge at 30,000g for 60min. This will separate the lysed membrane fromthe proteins that are soluble in a 6% Triton soln. Check to see what your protein is soluble in. It may be that you need to alter the buffer.I'm sorry that I can't add more to this protocol as the rest is specific to VDAC and is quite good at removing all other membrane proteins.Well I hope that this helps you and I apologise for not having replied sooner.1、因为我接下去是做western 的,所以只要膜蛋白在里面就可以了,这样是不是只要提取总的蛋白就够了,还是应该纯度高一些,提了总的蛋白之后再提取膜蛋白,这样会不会损失很大啊。
螺旋藻中藻蓝蛋白提取的工艺流程

螺旋藻中藻蓝蛋白提取的工艺流程王艺生物技术二班20100404071、预处理将螺旋藻洗净晾干2、细胞破碎利用超声波破碎发破碎细胞,藻胆蛋白属于胞内蛋白质,要提取分离藻胆蛋。
首先必须要破坏藻类细胞的细胞壁、细胞膜,使藻胆蛋白以溶解的状态释放出来,并保持其活性。
超声波细胞粉碎仪破碎鱼腥藻细胞的最佳处理条件是超声仪的功率为600 W,超声时间为9min,固液比为1:8,破壁容量为20 mL。
也可与其他方法合用最大限度的破碎细胞。
3、提取(初步分离)(1)用超滤膜过滤藻胆蛋白提取液,获得藻胆蛋白粗制品。
用NaNO3,高渗一超滤法分离提纯藻胆蛋白,超滤时选用聚砜膜,在超滤过程中,无机盐和小分子蛋白质,包括小分子的藻毒素透过滤膜而去掉,特别适用于易产生水华的微囊藻脱毒,提高产品的安全性。
NaNO3高渗.超滤法是提取藻胆蛋白的简单易行的方法,用此法提取的藻胆蛋白是安全无毒的,且易于纯化,脱水方便,产品易于干燥。
(2)也可利用沉淀法将大量盐加到蛋白质溶液中,蛋白质胶粒凝结并沉淀析出,因此向细胞破碎液中加入盐溶液使蛋白质沉淀析出。
用25%硫酸铵可将藻红蛋白沉淀出,用30%硫酸铵可将藻蓝蛋白沉淀出,再用50%硫酸铵可将蓝藻蛋白沉淀出。
4、精制(高度纯化)离子交换层析法,用 DEAE一步纯化藻蓝蛋白;改变传统以离子强度作梯度洗脱的方法,根据藻红蛋白的等电点进行pH梯度洗脱,仅用DEAE一步层析,就将藻红蛋白纯度从1.042提高至5.6,回收率达67.33%。
用硅藻土545柱分级洗脱,再用该法纯化,从螺旋藻中获得初度为4.1的藻蓝蛋白和纯度为4.6的别藻蓝蛋白;将提取液上DE。
AE一52纤维素柱,提取纯度只有1.9,在上葡聚糖凝胶柱,则得到了纯度较高的蓝藻蛋白。
5、成品制作随着藻蓝蛋白制品的应用范围的不断扩大,对提取分离工艺的要求也逐渐提高。
不仅要有高的提取率、好的产品质量,而且要考虑省时、省力、自动化程度高。
利用缓慢冷却加晶种的方法使藻蓝蛋白结晶,干燥后进行保存。
海藻的提取方法

海藻的提取方法引言海藻是一类生长在海洋中的植物,具有丰富的营养价值和药用价值。
为了有效地提取海藻中的有效成分,需要采用合适的提取方法。
本文将深入探讨海藻的提取方法,包括常用的物理提取、化学提取和生物提取方法。
物理提取方法物理提取方法是利用物理原理对海藻进行提取,常用的方法包括水泡提取、溶剂提取和超声波提取。
1. 水泡提取水泡提取是最简单的提取方法之一,只需将海藻放入水中浸泡一段时间,再将水取出即可得到提取液。
这种方法适用于海藻中溶解性较高的成分,如蛋白质和多糖。
2. 溶剂提取溶剂提取是利用溶剂对海藻中的有效成分进行提取。
常用的溶剂包括乙醇、丙酮和正己烷等。
具体操作时,先将海藻粉碎成粉末,然后与溶剂进行浸提,再经过过滤和蒸发等步骤,最终得到提取物。
3. 超声波提取超声波提取利用超声波的机械作用和热效应进行提取。
将海藻与溶剂放入装有超声波振荡器的容器中,开启超声波振荡器后,超声波的振荡将加速提取物的释放和扩散,从而提高提取效果。
化学提取方法化学提取方法是利用化学试剂对海藻中的有效成分进行提取。
常用的化学提取方法包括酸碱水解法、酶解法和气相色谱法。
1. 酸碱水解法酸碱水解法是一种酶解的方法,通过在酸性或碱性条件下,采用酸或碱对海藻中的成分进行水解。
这种方法适用于富含藻胆酸、多醣和其他可溶性物质的海藻。
2. 酶解法酶解法是利用适当的酶对海藻中的成分进行酶解,以提取目标物质。
常用的酶包括纤维素酶、藻胆酸酶等。
酶解法可用于提取海藻中的蛋白质、多糖等成分。
3. 气相色谱法气相色谱法是一种化学分析方法,通过将海藻中的有机物分离和鉴定。
该方法先将海藻提取物进行蒸发浓缩,然后通过气相色谱仪进行分析。
这种方法适用于提取海藻中的挥发性有机物。
生物提取方法生物提取方法是利用生物技术手段对海藻进行提取,常用的方法包括微生物发酵和超滤法。
1. 微生物发酵微生物发酵是利用微生物对海藻中的成分进行酶解和转化。
通过选用适当的发酵菌株和培养条件,将海藻与微生物一起进行发酵,可以获得目标物质。
膜蛋白的提取方法

膜蛋白的提取方法
膜蛋白的提取方法通常包括以下几个步骤:
1. 细胞裂解:将包含膜蛋白的细胞或组织用不同的方式进行裂解,例如超声波处理、酸碱处理、高压处理等。
2. 膜蛋白分离:通过离心、过滤等方法将膜蛋白分离出来。
3. 纯化:采用膜层联萃取、柱层析、电泳等方法对膜蛋白进行纯化。
4. 确认:通过蛋白质定量、SDS-PAGE、Western blot等方法验证膜蛋白的存在和纯度。
常见的膜蛋白提取方法有:
1. 酸性洗涤法:利用低pH值时,膜蛋白和膜脂亲性增强的特性,将细胞裂解物在酸性条件下洗涤获得膜蛋白。
2. 有机溶剂提取法:利用膜蛋白亲性较强的有机溶剂,如丙酮、甲醇等,将膜蛋白从细胞裂解物中提取出来。
3. 离心法:通过离心分离膜细胞,从而获得膜蛋白。
4. 免疫亲和层析法:利用特异性抗体将目标膜蛋白从混合蛋白中分离纯化。
以上方法的选择需根据具体情况来定,不同的细胞类型或膜蛋白性质有着不同的最佳提取方法。
藻蓝蛋白提取工艺

藻蓝蛋白提取工艺嘿,朋友们!今天咱就来唠唠藻蓝蛋白提取工艺这档子事儿。
你说这藻蓝蛋白啊,就像是大海里藏着的宝贝。
要把它给弄出来,那可得有点门道呢!咱先得找到合适的藻类来源,这就好比要去果园里找最甜的果子,得精挑细选才行。
然后呢,就是一系列的操作啦。
把藻类弄回来,就开始清洗啦,得把那些杂质啥的都洗掉,就像给它洗个舒舒服服的澡。
接下来就是破碎这一步,把藻类给弄碎,让藻蓝蛋白能跑出来。
这就好像是打开一个宝库的大门。
然后呢,就是提取啦!这可是关键的一步。
就好像是从一堆沙子里淘出金子一样,得有耐心,还得有技巧。
要用合适的溶剂,慢慢把藻蓝蛋白给弄出来。
提取完了可还不算完事儿,还得进行纯化呢!把那些不要的东西都去掉,只留下纯净的藻蓝蛋白。
这就好比是把宝石从一堆乱石里挑出来,还得给它打磨得亮晶晶的。
你想想,经过这么多步骤,最后得到那纯净美丽的藻蓝蛋白,是不是很有成就感?这过程可不比寻找宝藏容易啊!在这个过程中,每一步都很重要,就像链条上的一环扣一环,哪个环节出了问题都不行。
要是清洗不干净,那后面提取出来的藻蓝蛋白能纯吗?要是破碎不到位,藻蓝蛋白能顺利跑出来吗?而且啊,不同的藻类,提取的方法可能还不太一样呢!这就更得考验我们的本事啦。
咱得根据实际情况,灵活调整方法,就像打仗一样,得随机应变。
说真的,藻蓝蛋白的提取工艺真的很神奇,也很有趣。
当你看到那一点点被提取出来的藻蓝蛋白,你会觉得之前的所有努力都值了!这就是科学的魅力啊,能让我们从平凡的事物中发现不平凡的东西。
所以啊,朋友们,别小看了这藻蓝蛋白提取工艺,这里面的学问大着呢!咱们可得好好研究,好好探索,说不定还能发现更多有趣的东西呢!这藻蓝蛋白可是个宝,就看我们怎么去挖掘啦!。
膜蛋白的提取方法-全攻略

膜蛋白的提取方法-全攻略一、膜蛋白简介膜蛋白在细胞中扮演着重要的角色:例如被熟知的识别、信号转导、运输等功能,也是用药的理想的靶点,虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。
根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。
(1) 外在膜蛋白为水溶性蛋白,靠离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,膜结构并不被破坏。
(2) 内在膜蛋白与膜结合非常紧密,一般只有用去垢剂(detergent)使其膜解后才可分离出来。
附注:使用分级抽提方法获得的“膜蛋白”中只有很少一部分是具备多跨膜区的整合膜蛋白。
二、膜蛋白的提取方法谈及蛋白分离,我们想到:超速离心,盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法……有时这些方法常常组合到一起对特定的物质进行分离纯化。
由于蛋白质种类繁多,不同的蛋白质由于结构和组成的差异,其溶解度也各不相同.根据蛋白质的溶解特性,同时可选择不同的溶剂提取,分为水溶液提取和有机溶剂提取.但是与胞质蛋白,核蛋白提取不同之处在于膜蛋白是嵌在膜中的,水溶性不好,基本方法就是用不同的离心速度去掉胞质蛋白等,然后用去污剂把蛋白从膜中释放出来。
膜蛋白分离纯化的重要步骤是选择适当的增溶用表面活性剂,一般常用的有胆酸盐,CHAPS(一种离子去污剂),Emulgen和Lubrol等表面活性剂。
1)先分离膜,然后提取;如选用冷热交替法、反复冻融法、超声破碎法、玻璃匀浆法、自溶法和酶处理法使得细胞破碎,然后通过梯度离心得到含有膜蛋白的粗组分。
(例如:用液氮研磨组织,加入匀浆缓冲液及蛋白酶抑制剂,然后差速离心、蔗糖密度梯度离心。
收集37%与41%间的成分,即为质膜部分。
裂解即可收集膜蛋白)2)用特殊的去污剂选择性的分离。
藻类总蛋白的提取方法

IEEE802协议集介绍(802.1~802.21)TCP(Transport Control Protocol) 传输控制协议IP(Internetworking Protocol) 网间网协议UDP(User Datagram Protocol) 用户数据报协议ICMP(Internet Control Message Protocol) 互联网控制信息协议SMTP(Simple Mail Transfer Protocol) 简单邮件传输协议SNMP(Simple Network manage Protocol) 简单网络管理协议FTP(File Transfer Protocol) 文件传输协议ARP(Address Resolation Protocol) 地址解析协议1980年2月成立IEEE802委员会(IEEE - Institute of Electrical and lectronics Engineers INC,即电器和电子工程师协会)。
该委员会制定了一系列局域网标准,称为IEEE802标准。
按IEEE802标准,局域网体系结构由物理层、介质访问控制子层(MAC-Media Access Control)和逻辑链路子层LLC(Logical Link Control)组成。
IEEE委员会为局域网制定了一系列标准,统称为IEEE802标准。
IEEE802.1 —局域网概述、体系结构、网络管理和网络互联IEEE802.2 —逻辑链路控制 LLCIEEE802.3—CSMA/CD访问方法和物理层规范,主要包括如下几个标准:IEEE802.3 — CSMA/CD介质访问控制标准和物理层规范:定义了四种不同介质10Mbps以太网规范:10BASE2、10BASE5、10BASET、10BASEFIEEE802.3u — 100Mbps快速以太网标准,现已合并到802.3中IEEE802.3z —光纤介质千兆以太网标准规范IEEE802.3ab —传输距离为100米的5类无屏蔽双绞线介质千兆以太网标准规范IEEE802.4—Token Passing BUS(令牌总线)IEEE802.5—Token Ring(令牌环)访问方法和物理层规范IEEE802.6—城域网访问方法和物理层规范IEEE802.7—宽带技术咨询和物理层课题与建议实施IEEE802.8—光纤技术咨询和物理层课题IEEE802.9—综合声音/数据服务的访问方法和物理层规范IEEE802.10 —安全与加密访问方法和物理层规范IEEE802.11 —无线局域网访问方法和物理层规范,包括:IEEE802.11a、IEEE802.11b、 IEEE802.11c 和IEEE802.11q标准。
膜蛋白的分离方法

膜蛋白的分离方法
膜蛋白是一类位于细胞膜上的蛋白质,它们在细胞的代谢、信号传递、物质运输等方面起着重要作用。
以下是一些常见的膜蛋白分离方法:
1.超速离心法:利用超速离心机产生的强大离心力,将细胞膜和膜蛋白分离开来。
这种方法常用于制备纯净的细胞膜和膜蛋白。
2.电泳法:通过电泳技术,可以根据膜蛋白的电荷性质和分子量大小,将其分离开来。
电泳法包括聚丙烯酰胺凝胶电泳(PAGE)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)等。
3.层析法:层析法是一种基于膜蛋白物理化学性质差异的分离方法。
常用的层析技术包括凝胶过滤层析、离子交换层析、亲和层析等。
4.浮选分离法:利用浮力密度的差异,通过离心使不同密度的膜蛋白在溶液中分层,从而实现分离。
5.免疫沉淀法:基于抗体与抗原的特异性结合,使用特异性抗体将目标膜蛋白从混合物中沉淀出来。
6.密度梯度离心法:根据膜蛋白的密度差异,将其在密
度梯度介质中进行离心分离。
7.膜蛋白提取试剂盒:市面上有一些商业化的膜蛋白提取试剂盒,它们通常结合了多种分离技术,简化了膜蛋白的提取过程。
需要根据具体的实验需求和膜蛋白的特性选择合适的分离方法。
在膜蛋白分离过程中,需要注意保持膜蛋白的活性和稳定性,避免蛋白质的变性和降解。
膜蛋白纯化方法范文

膜蛋白纯化方法范文膜蛋白是一类存在于细胞膜上的重要蛋白质,起着许多重要的生物学功能。
为了研究膜蛋白的结构和功能,需要对其进行纯化。
然而,膜蛋白的纯化相对困难,主要是由于其高度疏水的性质和复杂的表达、折叠和定位过程。
本文将介绍几种常用的膜蛋白纯化方法。
1.高速离心:高速离心是最常用的初步膜蛋白纯化方法之一、该方法利用差速离心将细胞破碎,得到胞浆和质膜颗粒的混合物。
然后通过多次离心,逐步提高离心速度,最终得到膜蛋白的富集颗粒。
2.界面活性剂提取法:界面活性剂提取法是一种广泛应用于膜蛋白纯化的方法。
该方法通过在非离子型或阳离子型界面活性剂存在下将膜蛋白从膜上溶解转移到溶液中。
通常选用的界面活性剂包括十二烷基硫酸钠、十二烷基硫酸钠和短链磷脂。
4.高效液相色谱:高效液相色谱是一种常用于膜蛋白纯化的分离技术。
该方法利用柱上填充的固定相,通过控制溶液中的成分在固定相和流动相之间的分配,实现膜蛋白的分离纯化。
常用的高效液相色谱包括离子交换色谱、凝胶过滤色谱、逆流色谱等。
5.电泳分离:电泳是一种通过电场作用将膜蛋白根据其大小和电荷分离的方法。
电泳可以分为凝胶电泳和非凝胶电泳两种。
凝胶电泳包括聚丙烯酰胺凝胶电泳、SDS-等。
非凝胶电泳主要包括等电聚焦电泳和二维电泳。
除了这些传统的膜蛋白纯化方法之外,还有一些新的技术在膜蛋白纯化中得到了应用,例如固相提取、膜抓捕技术、质谱分析等。
这些新技术的应用,为膜蛋白纯化带来了更高的效率和准确性。
总结起来,膜蛋白的纯化方法有很多,每种方法都有其适用的场景和特定的优缺点。
研究人员可以根据具体的实验需求和条件选择合适的纯化方法,以获得高质量的膜蛋白样品。
藻类蛋白提取方法(双向电泳)
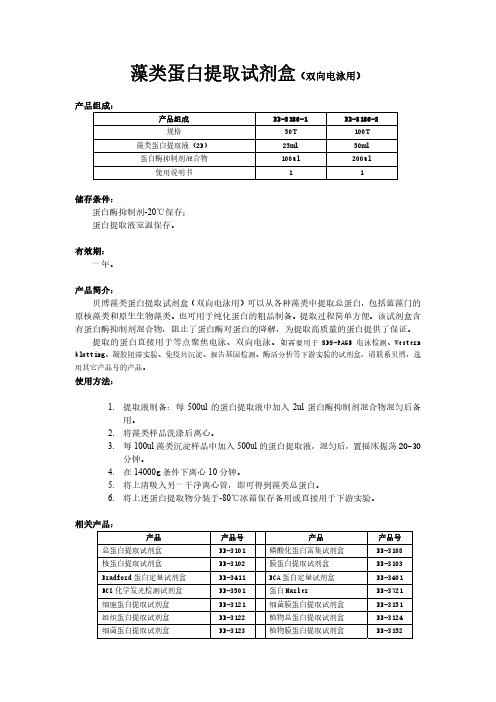
藻类蛋白提取试剂盒(双向电泳用)产品组成:产品组成 BB-3186-1 BB-3186-2规格 50T 100T藻类蛋白提取液(2D) 25ml 50ml蛋白酶抑制剂混合物 100ul 200ul使用说明书 1 1储存条件:蛋白酶抑制剂-20℃保存;蛋白提取液室温保存。
有效期:一年。
产品简介:贝博藻类蛋白提取试剂盒(双向电泳用)可以从各种藻类中提取总蛋白,包括蓝藻门的原核藻类和原生生物藻类。
也可用于纯化蛋白的粗品制备。
提取过程简单方便。
该试剂盒含有蛋白酶抑制剂混合物,阻止了蛋白酶对蛋白的降解,为提取高质量的蛋白提供了保证。
提取的蛋白直接用于等点聚焦电泳、双向电泳。
如需要用于SDS-PAGE电泳检测、Western blotting、凝胶阻滞实验、免疫共沉淀、报告基因检测、酶活分析等下游实验的试剂盒,请联系贝博,选用其它产品号的产品。
使用方法:1.提取液制备:每500ul的蛋白提取液中加入2ul蛋白酶抑制剂混合物混匀后备用。
2.将藻类样品洗涤后离心。
3.每100ul藻类沉淀样品中加入500ul的蛋白提取液,混匀后,置摇床振荡20-30分钟。
4.在14000g条件下离心10分钟。
5.将上清吸入另一干净离心管,即可得到藻类总蛋白。
6.将上述蛋白提取物分装于-80℃冰箱保存备用或直接用于下游实验。
相关产品:产品 产品号 产品 产品号 总蛋白提取试剂盒BB-3101 磷酸化蛋白富集试剂盒 BB-3108核蛋白提取试剂盒 BB-3102 膜蛋白提取试剂盒 BB-3103Bradford蛋白定量试剂盒 BB-3411 BCA蛋白定量试剂盒 BB-3401ECL化学发光检测试剂盒 BB-3501 蛋白Marker BB-3721细胞蛋白提取试剂盒 BB-3121 细菌膜蛋白提取试剂盒 BB-3151组织蛋白提取试剂盒 BB-3122 植物总蛋白提取试剂盒 BB-3124细菌蛋白提取试剂盒 BB-3123 植物膜蛋白提取试剂盒 BB-3152酵母蛋白提取试剂盒 BB-3125蛋白酶抑制剂混合物 BB-3301 磷酸化蛋白提取试剂盒 BB-3105 磷酸酶抑制剂混合物 BB-3311 SDS-PAGE凝胶配制试剂盒 BB-3702 SDS-PAGE上样Buffer BB-3703。
膜蛋白提取

1分离组织膜蛋白的方法:1、取组织,加入10ml Buffer A 于冰上充分匀浆。
2、J6-HC离心机800rpm,4℃离心10min后,所得上清液转入超速离心管。
3、100000g,4℃离心1hr。
弃去上清,沉淀用适量的Buffer B重悬,冰上孵育2hr后分装至EP管,Eppendorf台式离心机10000rpm,4℃离心30min。
4、收集所得上清液即为膜组份。
Buffer A:0.32M 蔗糖,5mM Tris-HCl(PH 7.5),120mM KCl,1mM EDTA,1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
Buffer B:20mM HEPES(PH 7.5),10%甘油,2% Triton X-100, 1mM EDTA, 1mM EDTA, 0.2mM PMSF, 1ug/ml Leupeptin, 1ug/ml Pepstatin A, 1ug/ml Aprotinin。
冰上预冷。
2取约0.1g肝组织,加入2ml粉碎缓冲液,冰浴中超声粉碎,每次20秒,间隔30秒,共3次,4°c 105xg条件下离心2小时,上清液为胞浆蛋白,沉淀部分加入1ml胞膜蛋白提取液,超声粉碎,4°c 105xg条件下离心2小时,上清液为胞膜蛋白。
样品蛋白含量测定采用酚试剂法。
3我们实验室提取膜蛋白的方法如下:1.将细胞种于T75 或T175的培养瓶中培养数天,细胞铺满瓶底后,吸去培养液。
将PBS/EDTA 溶液(NaCl:0.1M,NaH2PO4:0.01M,EDTA:0.04%)加入量以覆盖细胞为止,置于培养箱或在超净台内消化3~5分钟,如仍未脱落瓶底,用吸管吹打,使细胞完全脱落。
2.收集细胞悬液于10毫升或50毫升的离心管中,1000rpm离心10分钟,去上清液。
蛋白质的提取及测定

蛋白质的提取及含量测定蛋白质的提取1.藻细胞破碎方法1.1反复冻融法:将藻细胞在20℃以下冰冻,再在4℃左右融解,反复3-4次,利用细胞内冰粒的形成和细胞液盐浓度增高引起溶胀,使细胞结构破碎。
在显微镜下观察计数细胞破碎率可达90%以上,将破碎的的藻细胞悬浊液于4000 r/min离心20 min,弃沉淀,上清液加入一定量的壳聚糖,浓度为10g/L,充分搅拌后,4℃静置12 h,离心,取上清液。
该法操作简单、方便,适用于实验室少量藻体材料的处理。
1.2溶胀法:直接用蒸馏水或低盐溶液浸泡藻体细胞,使其溶胀、破裂,释放出藻胆蛋白。
用15 g/ L N a N O3或1 0 m m o l / L CaCl2的浸泡效果好。
余九九等比较了液氮冻融法和超声波法后,认为采用蒸馏水或低浓度CaCl2溶液40℃条件下浸泡螺旋藻的提取方法效果较好。
但溶胀法提取周期较长,用蒸馏水要浸泡10 d,用低浓度CaCl2溶液也需浸泡3~4d。
1.3超声波法:运用超声波破碎藻体细胞的细胞壁,使藻胆蛋白溶出。
在80w的超声清洗仪中超声30min,以破坏藻细胞的细胞壁。
该法常作为藻胆蛋白提取中的辅助方法。
单纯用超声波来破碎藻体细胞壁是不够的,还必须与其它方法合用,以最大限度地破碎藻体细胞。
1.4组织捣碎法:将材料配成稀糊状液,用高速组织捣碎机来破碎藻体细胞。
实际操作中,上述几种方法经常混合使用,以最大限度地破碎藻体细胞,使藻胆蛋白溶出。
2.粗提方法2.1盐析法:取上述藻蛋白粗体液,加入25%梯度饱和硫酸铵溶液,4℃静置12 h,离心,离心,取上清液,追加至55%饱和度,4℃静置12 h,离心。
将2次盐析得到的粗体液置于5%硫酸铵饱和梯度中,4℃静置12 h,离心,取上清液,追加至35% 饱和度,4℃静置12h,离心。
将4次盐析得到的粗体液置于23%硫酸铵饱和梯度中,4℃静置12 h,离心,取上清液,追加35%饱和度,4℃静置12h,离心。
膜蛋白纯化方法

膜蛋白纯化方法
膜蛋白是一类在生物体内广泛存在的蛋白质,它们扮演着许多重要的生物学功能角色。
由于其特殊的结构和生物学功能,膜蛋白的纯化一直是生物化学和分子生物学领域中的热门话题。
以下是几种常用的膜蛋白纯化方法:
1. 磷脂层萃取法:膜蛋白主要存在于生物体细胞膜中,因此利用磷脂层分离膜蛋白是一种常见的纯化方法。
该方法的基本原理是通过磷脂的亲水性和疏水性来分离膜蛋白。
2. 隔离膜蛋白的膜片:将膜蛋白采集到膜片上,然后离子交换或凝胶过滤来纯化膜蛋白。
该方法适用于小规模的样品。
3. SDS-PAGE:SDS-PAGE是一种凝胶电泳技术,可用于分离和纯化蛋白质。
在SDS-PAGE中,蛋白质会被SDS包裹并带有负电荷,从而使蛋白质分子按照大小分离。
4. 亲和层析法:亲和层析法是一种利用特定亲和性标记物分离蛋白质的方法。
例如,可以使用亲合柱将含有膜蛋白的混合物分离出来。
这些方法都有各自的优缺点,具体的选用方法需要根据实验要求和条件来确定。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用方法:
1、 每500ul抽提液A中加入2ul蛋白酶抑制剂混合物,充分混匀后置冰上备用。
2、 收集藻类样品,大型藻类组织用剪刀剪碎,用液氮研磨(没有液氮研磨条件直接
置冰上研磨也可)。
3、 按每20mg藻类样本加入500ul抽提液A(大约样品体积和提取液体积比1:2-1:3,完
全淹没样品即可),混匀,冰上放置2-3小时,中间每隔30分钟振荡混匀30秒。
4、 在低温下12000×g离心5分钟,取上清。
5、 在上清中加入10ul抽提液B,充分混匀。
6、 在37℃水浴10分钟。
7、 在37℃ 1000×g离心5分钟。
8、 此时溶液分为2层,移除上层,小心吸取下层管底部大约50ul液体。
9、 用稀释液稀释该溶液,即得膜蛋白样品。该样品可以用Bradford或BCA方法进行定
BB-3108 BB-3103 BB-3106 BB-3401 BB-3154 BB-3151 BB-3124 BB-3152 BB-3301 BB-3127 BB-3311 BB-3182 BB-3185产膜蛋白提取试剂盒。藻类膜蛋白提取试剂盒可 以从各种藻类中提取膜蛋白,包括蓝藻门的原核藻类和原生生物藻类。也可用于纯化蛋白的 粗品制备及膜蛋白制备。提取过程简单方便。该试剂盒含有蛋白酶抑制剂混合物和磷酸酶抑 制剂混合物,阻止了蛋白酶对蛋白的降解,为提取高质量的蛋白提供了保证。该试剂盒提取 的蛋白具有天然活性,可用于各种下游实验。
藻类膜蛋白提取试剂盒
产品组成:
产品组成 规格
藻类膜抽提液 A 藻类膜抽提液 B 膜蛋白稀释液 蛋白酶抑制剂混合物
BB-3170-1 50 assays
25ml 500ul 10ml 100 ul
BB-3170-2 100 assays
50ml 1ml 20ml 200 ul
储存条件: 蛋白酶抑制剂-20℃保存; 蛋白提取液 2-8℃保存。
BB-3101 BB-3102 BB-3104 BB-3411 BB-3501 BB-3121 BB-3122 BB-3123 BB-3125 BB-3126 BB-3105 BB-3181 BB-3183 BB-3187
磷酸化蛋白富集试剂盒 膜蛋白提取试剂盒 活性蛋白提取试剂盒 BCA 蛋白定量试剂盒 植物核蛋白提取试剂盒 细菌膜蛋白提取试剂盒 植物总蛋白提取试剂盒 植物膜蛋白提取试剂盒 蛋白酶抑制剂混合物 真菌蛋白提取试剂盒 磷酸酶抑制剂混合物 细菌蛋白提取盒(2D 电泳用) 酵母蛋白提取盒(2D 电泳用) 线粒体蛋白提取盒(2D 电泳用)
有效期: 一年。
产品简介: 跨膜蛋白承担各种生物功能,在疾病的发生、发展过程中扮演重要角色。膜蛋白样品
的制备需要充分考虑到与下游的胶分析及质谱分析等应用配套,因此膜蛋白样本制备成为一 个难以逾越的挑战。传统制备膜蛋白样品的方法是使用去污剂和表面活性剂增溶。去污剂处 理会使膜蛋白丧失其天然结构,因而妨碍了膜蛋白的功能研究。
量,调整相应的浓度用于下游实验。
相关产品:
产品
产品号
产品
产品号
总蛋白提取试剂盒 核蛋白提取试剂盒 膜/胞浆/核蛋白分步提取试剂盒 Bradford 蛋白定量试剂盒 ECL 化学发光检测试剂盒 细胞蛋白提取试剂盒 组织蛋白提取试剂盒 细菌蛋白提取试剂盒 酵母蛋白提取试剂盒 昆虫蛋白提取试剂盒 磷酸化蛋白提取试剂盒 总蛋白提取试剂盒(2D 电泳用) 植物蛋白提取盒(2D 电泳用) 细菌膜蛋白提取盒(2D 电泳用)
