酸碱中和滴定kj
酸碱中和滴定实验溶液浓度的测定

酸碱中和滴定实验溶液浓度的测定酸碱中和滴定实验是一种常用的化学实验方法,用于确定溶液中酸碱的浓度。
本文将介绍酸碱中和滴定实验的原理和步骤,并详细说明如何通过滴定计算出溶液的浓度。
一、实验原理酸碱中和滴定实验是基于维尔斯定律的原理。
当一定量的酸和碱溶液混合后,酸和碱反应生成水和盐。
在滴定过程中,溶液中加入一种指示剂,用来标志滴定终点的改变。
滴定开始时,滴入的酸或碱会中和溶液中的碱或酸,导致pH值的变化。
当酸和碱的摩尔比例达到1:1时,滴定终点即到达,此时用酸碱指示剂的颜色发生显著变化。
二、实验步骤1. 准备工作:将酸和碱溶液分别装入滴定瓶中,注意溶液的浓度和酸碱种类要匹配。
选择适当的酸碱指示剂,并将其加入滴定瓶中。
2. 滴定操作:a. 取一定量的酸溶液放入容量瓶中,加入少量的酸碱指示剂。
b. 用滴定管吸取碱溶液,滴入酸溶液中,同时轻轻摇动容量瓶,直至指示剂颜色发生变化。
c. 记录滴定前和滴定后的滴定管中的溶液体积差值。
d. 重复滴定过程,直到连续两次观察到相同的滴定终点。
三、计算溶液浓度通过滴定计算溶液浓度的方法如下:1. 确定酸和碱的摩尔反应比例。
根据中和反应的化学方程式,确定酸和碱的摩尔比例。
2. 计算酸和碱的摩尔浓度。
根据滴定前后的溶液体积差值,计算出酸或碱的摩尔数。
3. 根据摩尔比例,计算出另一种溶液的摩尔数。
4. 通过摩尔数和溶液体积,计算出溶液的浓度。
四、实验注意事项1. 实验操作要仔细,确保溶液的准确投入和反应。
2. 滴定过程中要注意控制滴液的速度,以避免误差。
3. 每次滴定要迅速且均匀地搅拌,使反应充分进行。
4. 使用准确的量器,避免误差的产生。
通过酸碱中和滴定实验测定溶液浓度,能够准确、快速地获得溶液中酸碱的浓度信息。
在化学分析和实验室工作中有着广泛的应用。
希望本文的介绍能对您有所帮助。
酸碱中和滴定详细步骤

酸碱中和滴定详细步骤
嘿,朋友们!今天咱们来好好唠唠酸碱中和滴定这个神奇的实验步骤!
咱先准备好家伙事儿!得有滴定管、锥形瓶、指示剂,还有那酸啊碱啊的溶液。
这就好比要做饭,得先把锅碗瓢盆准备齐全喽!
把滴定管洗干净可太重要啦,就像咱每天要把脸洗干净一样。
先用水冲,再用待装液润洗几次,保证里面干干净净,一滴杂质都没有。
再把待测溶液放进锥形瓶里,加上几滴指示剂。
这指示剂就像个小侦探,能告诉咱们反应啥时候到终点。
准备工作做好,就可以开始滴定啦!左手控制滴定管的活塞或者玻璃球,右手拿着锥形瓶不停地晃动。
这时候可别着急,慢慢地滴,一滴一滴来,眼睛时刻盯着锥形瓶里溶液的变化。
当溶液的颜色突然发生变化,而且半分钟内不再恢复原来的颜色,这就说明到终点啦!这时候赶紧停下,别再滴啦。
就是读数和计算啦!读数的时候,视线要和滴定管内液面的凹液面最低处保持水平,读准了数才能算得准。
算的时候可要认真仔细,别马虎,不然前面的功夫可就白费啦。
怎么样,朋友们,这酸碱中和滴定的步骤是不是也没那么难?多练几次,保证你能熟练掌握!加油吧,小伙伴们,让我们在化学的世界里尽情探索!。
酸碱中和滴定掌握酸碱中和滴定的步骤和计算方法

酸碱中和滴定掌握酸碱中和滴定的步骤和计算方法在化学实验中,酸碱中和滴定是一种常见的定量分析方法,旨在确定溶液中酸或碱的浓度。
掌握酸碱中和滴定的步骤和计算方法对于进行准确的滴定分析至关重要。
本文将介绍酸碱中和滴定的基本步骤和计算方法,并提供一些实例作为参考。
一、酸碱中和滴定的基本步骤1. 准备工作:首先,准备好滴定所需的仪器和药品,包括滴定管、蒸馏水、酸碱指示剂和标准酸碱溶液。
确保所有仪器和容器都干净无污染。
2. 调整溶液:根据实验的要求,准备待测的酸或碱溶液,并将其转移至滴定瓶中。
通过使用酸碱指示剂,可使溶液的颜色在滴定过程中发生可见变化,以指示中和点。
3. 滴定过程:将标准酸碱溶液加入滴定管中,并利用滴定管逐滴加入待测溶液中。
在加入每滴滴定液后,用玻璃棒搅拌溶液,直到溶液颜色发生明显改变。
此时需要仔细记录滴定的滴数。
4. 终点判定:滴定终点是指待测溶液完全中和的时间点。
通过酸碱指示剂的颜色改变来判断终点。
常用的指示剂有酚酞(酸性溶液由无色变为粉红色)和溴酚蓝(碱性溶液由黄色变为蓝色)等。
5. 重复滴定:为了确保结果的准确性,通常需要进行多次滴定。
每次滴定后,都要仔细清洗滴定管,以免污染下一次滴定。
二、酸碱中和滴定的计算方法酸碱中和滴定的计算方法主要涉及滴定液的体积、浓度和化学反应的化学方程式。
以下是一些常见的计算方法示例:1. 计算酸碱溶液的浓度:根据所用滴定液的浓度和滴定终点的滴定体积,可以计算出待测酸碱溶液的浓度。
常见的计算公式如下:酸溶液浓度(mol/L)=滴定液浓度(mol/L)×滴定液体积(L)/滴定体积(L)碱溶液浓度(mol/L)=滴定液浓度(mol/L)×滴定体积(L)/滴定体积(L)2. 计算化学反应中的物质的量关系:滴定反应中,滴定液的体积与待测溶液中的酸碱物质的物质的量之间存在着化学反应的物质的量关系。
通过平衡化学方程式,可以计算出两种物质的物质的量之比。
酸碱中和滴定范围计算公式

酸碱中和滴定范围计算公式酸碱中和滴定是化学实验中常见的一种实验方法,用于测定溶液中酸或碱的浓度。
在进行酸碱中和滴定实验时,需要计算滴定范围,以确定滴定终点和滴定终点的误差范围。
本文将介绍酸碱中和滴定范围的计算公式及其应用。
酸碱中和滴定范围的计算公式如下:V1 N1 = V2 N2。
其中,V1为待测溶液的体积,N1为待测溶液的浓度,V2为滴定溶液的体积,N2为滴定溶液的浓度。
这个公式的推导过程是基于酸碱中和反应的化学方程式,例如,对于强酸和强碱的中和反应,化学方程式为:H+ + OH→ H2O。
根据化学方程式,可以得出滴定范围的计算公式。
通过计算滴定范围,可以确定滴定终点的大致位置,从而减小滴定误差。
在实际应用中,酸碱中和滴定范围的计算可以帮助实验者选择合适的滴定终点指示剂,以及确定滴定时的操作方法。
此外,通过计算滴定范围,还可以评估实验的可行性和准确性。
酸碱中和滴定范围的计算公式还可以用于解决一些实际问题。
例如,如果知道待测溶液的体积和浓度,以及滴定溶液的浓度,可以通过计算滴定范围来确定需要滴定的体积范围,从而节省试剂和提高实验效率。
另外,酸碱中和滴定范围的计算公式还可以帮助实验者理解滴定过程中酸碱中和反应的基本原理。
通过计算滴定范围,可以更好地理解滴定终点的选择和滴定误差的控制,从而提高实验的准确性和可靠性。
需要注意的是,酸碱中和滴定范围的计算公式是基于一定的假设条件,例如,假设酸碱中和反应是完全的,滴定终点的选择是准确的,滴定过程中没有其他化学反应发生等。
因此,在实际应用中,需要根据具体情况进行修正和调整。
总之,酸碱中和滴定范围的计算公式是酸碱中和滴定实验中重要的工具,可以帮助实验者确定滴定范围,选择合适的滴定终点指示剂,评估实验的可行性和准确性,解决实际问题,理解滴定过程中的基本原理。
通过掌握酸碱中和滴定范围的计算方法和应用,可以更好地进行酸碱中和滴定实验,并取得准确可靠的实验结果。
化学实验中的溶液的酸碱中和滴定

化学实验中的溶液的酸碱中和滴定在化学实验中,溶液的酸碱中和滴定是一种常用的分析方法。
它通过滴加已知浓度的酸或碱溶液到待测溶液中,利用酸碱反应的中和反应完成对待测物质浓度的测定。
本文将介绍溶液的酸碱中和滴定的原理、操作步骤以及注意事项。
一、原理溶液的酸碱中和滴定是基于酸碱中和反应的理论基础进行的。
在酸碱反应中,酸和碱发生化学反应,产生相应的盐和水。
滴定过程中,通过逐滴加入酸或碱溶液,使待测溶液中的反应物与滴加溶液中的反应物按化学计量比例进行反应,从而达到酸碱中和的状态。
当酸或碱溶液滴加到与待测溶液中的反应物完全反应时,可以根据滴加的酸碱溶液的体积计算出待测溶液中的物质浓度。
二、操作步骤1.准备工作首先,需要准备好实验所需的仪器和试剂,包括滴定管、容量瓶、酸或碱溶液、指示剂等。
同时,要确保实验操作区域的清洁和安全,避免交叉污染和意外事故的发生。
2.样品制备将待测溶液准备好,并计量出适量的待测溶液放入容量瓶中。
3.滴定过程a) 将滴定管插入滴定瓶中,吸取适量的滴定液。
b) 将滴定管中的滴定液滴加到容量瓶中的待测溶液中。
c) 同时加入一滴指示剂,用以指示中和点的变化。
d) 持续滴加滴定液,直到待测溶液的颜色变化示意达到中和点。
e) 记录滴定液的滴定体积。
4.计算结果根据已知滴定液的浓度和滴定液的滴定体积,可以计算出待测溶液中的物质浓度。
三、注意事项1.实验过程中应注意操作的准确性和仪器的清洁,避免误差的发生。
2.选用适当的指示剂,以获得准确的中和点。
3.滴定液和待测溶液应有明显的颜色区分,便于观察颜色变化。
4.滴定液应以适量滴加,避免一次加入过多导致误差。
5.实验过程中,要注意安全操作,避免对皮肤和眼睛的直接接触。
总结:溶液的酸碱中和滴定是一种常用的分析方法,通过对待测溶液中的物质浓度进行测定。
在操作过程中,我们需要掌握滴定的原理和操作步骤,并注意实验的准确性和安全性。
只有在滴定液与待测溶液中的物质按化学计量比例完全反应时,才能得到准确的测定结果。
酸碱中和滴定(原理)

0.1000mol/L的NaOH溶液中的氢离子浓度:
c(H+) = 1.0×10-14 / 1.0×10- 1 =1.0×10-13 pH = -lg(1.0×10-13) = 13
知识支持:pH=-lg c(H+) 室温下,在溶液中c(H+)c(OH-)=1.0×10-14
二、指示剂的选择
最理想的指示剂应该能恰好 在反应的化学计量点发生颜色变 化。
指示剂的选择主要以滴定的突跃范围为依据, 通常选取变色范围全部或部分处在突跃范围内的 指示剂滴定终点,这样产生的误差不会超过 ±0.1%
在上述滴定中,甲基橙(pH3.1-4.4)和酚 酞(pH8.0-10.0)的变色范围均有一部分在滴定的 突跃范围内,所以都可以用来指示这一滴定终点
由于指示剂的变色范围不是7所引起的 误差是很小的。
想一想
如果是用碱滴定酸,在滴定过程中,溶液 pH随着体积变化的趋势又如何?
请以氢氧化钠滴定盐酸为例,回答 上述问题。
计算出不同滴定点时溶液的pH值,部分结果列于表
V(加入 NaOH)
ml
被滴定 HCl的百 分含量
%
V(剩余 HCl)
ml
0
0
20.00
pH的应用——
酸碱中和滴定
2.中和反应反应热 (1)定义:在 稀 溶液中,酸和碱发生中和反应生成 1 mol 水所放出 的热量。 (2)示例:1 L 1mol/L的盐酸与1 L 1 mol/L的NaOH溶液发生中和反应 时,放出57.3kJ的热量,该反应的热化学方程式为: HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)
A、96%
【知识解析】酸碱中和滴定

酸碱中和滴定1 酸碱中和滴定的定义和原理(1)酸碱中和滴定的定义依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法叫酸碱中和滴定。
(2)酸碱中和滴定的原理①中和反应:酸+碱→盐+水。
中和反应的实质:H++OH-===H2O。
②酸碱中和滴定的原理:酸碱中和滴定以酸碱中和反应为基础,通过滴定中用去的已知浓度的酸或碱的体积,利用化学方程式所表示的酸碱之间的计量关系,求得待测碱或酸的物质的量浓度。
2 酸碱中和滴定的仪器与操作(1)仪器酸式滴定管(精确到0.01 mL)、碱式滴定管(精确到0.01 mL)、烧杯、滴定管夹、铁架台、锥形瓶(用来盛装待测溶液)等。
图3-2-3名师提醒(1)酸式滴定管下端为玻璃活塞,能耐酸和强氧化剂的腐蚀,可用于盛装酸性或强氧化性溶液,但不能盛装碱性溶液。
(2)碱式滴定管下端为乳胶管和玻璃珠,乳胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般只盛装碱性溶液。
(3)滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。
滴定管读数时要精确到0.01 mL。
注意量筒与滴定管的区别。
(4)滴定管使用前必须检查是否漏液。
对于酸式滴定管,先关闭活塞,装水至“0”刻度以上,直立约2分钟,仔细观察有无水珠滴下,然后将活塞转动180°,再直立约2分钟,观察有无水珠滴下,若均无水珠滴下,则不漏水。
对于碱式滴定管,装水后直立约2分钟,观察是否漏水即可。
如果出现漏水或酸式滴定管活塞转动不灵活的情况,应将酸式滴定管活塞拆下重新涂抹凡士林,碱式滴定管需要更换玻璃珠或乳胶管。
(5)滴定管在加入反应液前要用所盛装的反应液润洗2~3遍,不然滴定管内壁附着的蒸馏水会将反应液稀释,使溶液浓度降低,影响测定结果。
(2)指示剂的选择①中和反应恰好完全反应的时刻叫滴定终点。
为准确判断滴定终点,必须选用变色明显、变色范围的pH与终点的pH相一致的酸碱指示剂。
酸碱中和的滴定实验

酸碱中和的滴定实验在化学实验中,滴定法是一种常用的定量分析方法,可以准确测量溶液中的酸或碱的浓度。
其中,酸碱中和滴定实验是滴定法中最常见的实验之一。
本文将从滴定的原理、所需仪器材料、实验步骤、数据处理等方面进行论述。
一、滴定的原理滴定法是利用试剂溶液与待测溶液之间定量反应的方法。
在酸碱中和滴定实验中,通常选择一种强酸与一种强碱进行滴定,通过化学计量的方法反应到等量点,并以指示剂的颜色变化作为判断滴定终点的依据。
在滴定的过程中,待测溶液滴定进入滴定瓶中的容量管中,逐滴加入滴定溶液。
一开始,溶液的pH值较低(酸性溶液);当酸性溶液被滴定溶液中的碱性物质逐渐中和至中和点时,pH值会急剧上升,直到接近中和点的时候,pH值才会迅速变化。
中和点的确定,可以通过指示剂颜色变化的判断,如表达为溶液从颜色A变为颜色B。
二、实验所需仪器材料1. 三角漏斗和滴定瓶:用于滴定溶液的添加和混合。
2. 瓶塞:用于密封滴定瓶,防止溶液挥发。
3. 平底容量瓶:用于配制酸碱溶液的容器。
4. 量筒:用于溶液的容量测量。
5. 支架、夹子和滴定管:用于支撑和固定三角漏斗。
6. 钢化玻璃白板:用于记录滴定的数据。
7. 酸性或碱性指示剂:根据实验所用的酸或碱的性质选择合适的指示剂。
三、实验步骤1. 配制溶液:根据实验需求,使用平底容量瓶配制所需浓度的酸碱溶液,并用量筒测量取样。
2. 装置滴定装置:将三角漏斗放在支架上,固定好。
将滴定管插入三角漏斗,确保不漏液。
3. 添加指示剂:根据实验所用指示剂的种类,将适量指示剂滴入容量管中。
4. 开始滴定:用滴定管将待测溶液滴定入容量管中,每滴一次仔细搅拌。
直至指示剂颜色发生明显变化。
5. 记录数据:滴定过程中记录滴定液滴入的次数,并进行数据整理。
6. 重复实验:如需提高实验准确性,可重复实验数次,并取平均值。
四、数据处理1. 计算滴定液的浓度:根据滴定液的浓度和滴定液滴入的次数,计算滴定液的浓度。
滴定液的浓度(mol/L)=滴定液的摩尔浓度(mol/L)×每次滴定的体积(L)2. 计算待测溶液的浓度:根据酸碱中和的化学反应方程式,计算待测溶液的浓度。
酸碱中和滴定实验

酸碱中和滴定实验酸碱中和滴定实验是一种常见的分析化学实验方法,用于确定溶液中酸碱物质的浓度。
本文将介绍酸碱中和滴定实验的基本原理、操作步骤以及应用领域。
一、实验原理酸碱中和滴定实验的基本原理是以一种已知浓度的溶液(滴定液)滴定到待测溶液中,滴定液与待测溶液按化学方程式中的化学计量比例发生中和反应。
根据中和反应的终点指示剂的变色,可以确定待测溶液中酸碱物质的浓度。
二、实验步骤1. 准备实验室器材:酸碱溶液、滴定管、滴定管架、比色皿、酸碱指示剂、计量容器等。
2. 通过计量容器准确量取待测溶液,倒入比色皿中。
3. 在滴定管中加入适量的滴定液。
4. 逐滴滴定滴定液到待测溶液中,同时轻轻搅拌比色皿。
5. 滴定过程中,观察滴定液的颜色变化,当滴定液的颜色变化明显时,停止滴定。
6. 记录滴定液的用量,根据滴定液的浓度和滴定用量计算出待测溶液中酸碱物质的浓度。
三、实验应用1. 酸碱中和滴定实验可以用于分析饮用水中的酸碱度,了解水质的酸碱性,进而判断水的适用性。
2. 在医药工业中,常用酸碱中和滴定实验来确定药物中的酸碱度,以保证药物的质量和疗效。
3. 酸碱中和滴定实验还可以应用于农业领域,比如测定土壤pH值,判断土壤的酸碱性,并据此调整土壤的施肥和种植方案。
4. 在食品工业中,酸碱中和滴定实验可以用于检测食品和饮料中的酸碱度,确保产品的质量和口感。
5. 酸碱中和滴定实验在环境保护中也具有重要的应用,可以测定废水中的酸碱度,判断废水对环境的污染程度,为环境治理提供依据。
综上所述,酸碱中和滴定实验是一种简单而常用的分析技术,广泛应用于各个领域。
通过该实验可以准确测定溶液中酸碱物质的浓度,为科学研究和生产实践提供可靠的数据支持。
同时,使用合适的指示剂和精确的仪器设备,以及操作的规范性和准确性,也是保证实验结果准确的关键因素。
酸碱中和滴定方法

酸碱中和滴定方法酸碱中和滴定是一种化学分析方法,用于测定溶液中酸或碱的浓度,以滴定试剂与被测物完全反应作为判断终点的依据。
该方法广泛应用于质量控制、生化分析、药品制造等领域。
在本文中,我们将讨论酸碱中和滴定的基本原理、操作步骤及其应用。
1. 酸碱中和滴定的基本原理酸碱滴定基于一个简单的反应原理:在反应终点前,每加一滴滴定试剂使被测物的溶液中增加相应的反应物量。
当反应物的量与滴定试剂的量相等时,就称为“终点”,此时应滴入的体积就是所需的滴定体积。
本次滴定中所加的滴定试剂溶液称为滴定剂,滴定剂的浓度是已知的,通过滴定剂用量与被滴定物的用量之间的比较,可以推断出被滴定物的浓度。
由于大多数酸和碱都可以用该滴定方法测定,因此被称为“酸碱中和滴定”。
2. 酸碱中和滴定的操作步骤(1) 准备滴定剂和被滴定物的溶液在进行滴定实验前,需要准备好滴定剂和被滴定物的溶液,它们的浓度和体积都应事先确定。
滴定剂可以是任何化学试剂,通常溶于水中。
而被滴定物需要溶于一种适当的溶剂中,以保证溶液清晰透明,难以滴定反应的发生导致难以判断终点。
(2) 滴定过程滴定过程中需要使用滴定管、滴定瓶以及一个可靠的指示剂。
滴定过程可以分为以下几个步骤:1)用滴定管精确吸取滴定试剂,切勿出现空气泡,否则会使滴定结果不准确。
2)将准确的滴定剂定量滴入样品中,同时搅拌溶液,直到出现颜色变化或浑浊现象。
3)在滴定过程中持续记录滴定剂使用量,直到滴入滴定剂滴数稳定,则可得出滴定体积(滴定剂使用量)。
4)添加某种指示剂,当指示剂与被滴定物完全反应时,颜色会发生改变,表示滴定已经完成了,记录终点使用量。
(3) 滴定数据的计算根据初始浓度、滴定体积和滴定试剂的浓度等参数,可以计算出被滴定物的浓度。
通常,滴定剂的使用量应在0.1毫升以下,以保证数据的准确性。
3. 酸碱中和滴定的应用酸碱中和滴定已广泛应用于不同领域,例如:(1) 药品制造:滴定方法常用于药品制造工艺的监控和质量控制,以确保每个制造批次的精确成分。
酸碱中和滴定知识点高考

酸碱中和滴定知识点高考高考化学中,酸碱中和滴定是一个重要的知识点。
它涉及到酸碱反应、滴定原理和计算等内容。
掌握了酸碱中和滴定的知识点,不仅可以在高考中拿到高分,还能够在日常生活中解决一些实际问题。
下面我将从三个方面来介绍酸碱中和滴定的相关知识。
首先,我们需要了解酸碱反应的基本概念。
酸碱反应是指酸和碱在溶液中发生的反应。
当酸和碱反应时,会产生一种中和产物,即盐和水。
这种反应是可逆的,也就是说,当反应物中的一种转化为产物后,产物又可以转化为反应物。
这是因为酸碱反应是根据质子传递理论来解释的。
在反应过程中,酸捐赠出质子,而碱接受质子,最终中和生成盐和水。
其次,我们需要了解滴定原理。
滴定是一种定量分析方法,通过一种溶液逐滴地加入到另一种溶液中,直到反应完全终止,从而确定反应物的浓度。
滴定一般包括标准溶液的配制、指示剂的选择以及滴定曲线的绘制。
标准溶液是已知浓度的溶液,用来确定未知溶液的浓度。
指示剂是一种能够在滴定过程中显示颜色变化的物质,用来指示滴定的终点。
滴定曲线是表示滴定过程中反应物浓度与滴定剂用量之间关系的曲线图。
最后,我们需要掌握滴定计算方法。
滴定计算是根据滴定方程来进行的。
滴定方程是根据滴定反应的平衡常数和化学计量关系所推导出的关系式。
滴定计算一般包括滴定终点的判断和滴定结果的计算。
滴定终点的判断可以通过指示剂的颜色变化来确定,当颜色变化明显时,即表示滴定终点已经到达。
滴定结果的计算可以通过滴定反应的化学计量关系和滴定方程来进行推导。
具体计算方法要根据具体的滴定反应来确定。
总的来说,酸碱中和滴定是一个涉及多个方面的知识点,需要我们综合运用化学知识和计算方法来掌握。
通过了解酸碱反应的基本概念,理解滴定原理以及掌握滴定计算方法,我们就能够在高考中得到高分,并且在日常生活中解决一些实际问题。
酸碱中和滴定不仅是化学知识的一部分,也是一种实际应用能力的体现。
所以,我们在学习酸碱中和滴定时,需要做到理论联系实际,灵活运用知识,才能真正掌握这个知识点。
酸碱中和滴定原理

酸碱中和滴定原理
酸碱中和滴定是化学分析中常用的一种定量分析方法,它是通过滴定试剂与待
测溶液中的酸碱物质发生化学反应,从而确定溶液中酸碱物质的含量。
酸碱中和滴定原理是基于化学反应的摩尔计算,通过滴定终点的检测,确定待测溶液中酸碱物质的浓度。
下面将详细介绍酸碱中和滴定的原理及相关知识。
酸碱中和滴定的原理是基于酸碱中和反应的化学平衡原理。
在酸碱中和反应中,酸和碱的摩尔比是1,1,因此可以通过滴定试剂与待测溶液中的酸碱物质发生中
和反应,从而确定待测溶液中酸碱物质的浓度。
常用的滴定试剂有盐酸、硫酸、氢氧化钠、氢氧化钾等。
酸碱中和滴定的过程中,需要选择合适的指示剂来指示滴定终点。
指示剂是一
种能够在滴定终点时改变颜色的化合物,它能够准确地指示出滴定终点的到来。
常用的指示剂有酚酞、甲基橙、溴甲酚绿等。
在滴定过程中,指示剂会在滴定终点时发生颜色变化,从而提示滴定的结束。
酸碱中和滴定的计算原理是基于化学反应的摩尔计算。
根据酸碱中和反应的化
学方程式,可以推导出滴定终点时反应物的摩尔比,从而计算出待测溶液中酸碱物质的浓度。
在进行酸碱中和滴定时,需要严格控制试剂的用量和反应条件,以确保滴定结果的准确性。
总之,酸碱中和滴定是一种常用的定量分析方法,它的原理是基于化学反应的
摩尔计算和化学平衡原理。
在进行酸碱中和滴定时,需要选择合适的滴定试剂和指示剂,并严格控制滴定条件,以确保滴定结果的准确性。
通过学习酸碱中和滴定的原理及相关知识,可以更好地理解和掌握这一分析方法,为化学分析实验提供有力的支持。
酸碱中和滴定总结(最全版)
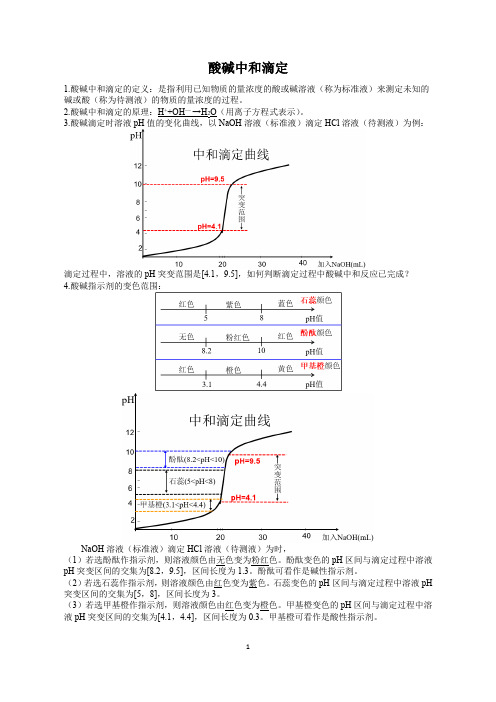
酸碱中和滴定1.酸碱中和滴定的定义:是指利用已知物质的量浓度的酸或碱溶液(称为标准液)来测定未知的碱或酸(称为待测液)的物质的量浓度的过程。
2.酸碱中和滴定的原理:H++OH— →H2O(用离子方程式表示)。
3.酸碱滴定时溶液pH值的变化曲线,以NaOH溶液(标准液)滴定HCl溶液(待测液)为例:滴定过程中,溶液的pH突变范围是[4.1,9.5],如何判断滴定过程中酸碱中和反应已完成?4.酸碱指示剂的变色范围:NaOH溶液(标准液)滴定HCl溶液(待测液)为时,(1)若选酚酞作指示剂,则溶液颜色由无色变为粉红色。
酚酞变色的pH区间与滴定过程中溶液pH突变区间的交集为[8.2,9.5],区间长度为1.3。
酚酞可看作是碱性指示剂。
(2)若选石蕊作指示剂,则溶液颜色由红色变为紫色。
石蕊变色的pH区间与滴定过程中溶液pH 突变区间的交集为[5,8],区间长度为3。
(3)若选甲基橙作指示剂,则溶液颜色由红色变为橙色。
甲基橙变色的pH区间与滴定过程中溶液pH突变区间的交集为[4.1,4.4],区间长度为0.3。
甲基橙可看作是酸性指示剂。
5.酸碱指示剂的选择原则:变色范围要灵敏,即指示剂变色的pH区间与滴定过程中溶液pH突变注意:(1)一般强酸滴定强碱选甲基橙作指示剂,强碱滴定强酸选酚酞作指示剂。
(2)强酸滴定弱碱时,完全中和后,溶液显酸性,滴定时只能选甲基橙作指示剂。
强碱滴定弱酸时,完全中和后,溶液显碱性,滴定时只能选酚酞作指示剂。
6.酸碱中和滴定的实验过程,以NaOH溶液(标准液)滴定HCl溶液(待测液)为例:(1)查漏:用蒸馏水检查酸式滴定管和碱式滴定管是否漏液。
(2)润洗:分别用HCl溶液、NaOH溶液润洗酸式滴定管和碱式滴定管。
确保溶液的浓度不被剩余在滴定管中的水稀释而变小。
(3)注液:润洗后,分别向酸式滴定管和碱式滴定管中注入一定量的HCl溶液、NaOH溶液。
并调节液面至零或零刻度线以下,记下各自的起始读数,分别记为V(酸始)、V(碱始)。
酸碱中和滴定步骤及过程

酸碱中和滴定步骤及过程
酸碱中和滴定可是化学实验中的经典操作呢!下面就来给大家讲讲这个过程。
一、准备阶段
1. 先得把那些瓶瓶罐罐准备好,滴定管、锥形瓶、移液管啥的,就像战士上战场得先把武器装备准备齐全。
这滴定管可得好好检查检查,要是漏液,那可就闹笑话了,就像士兵上战场枪走火一样,那可不行。
2. 接着就是把试剂准备好,标准溶液和待测溶液都得妥妥当当的。
可别拿错了,不然这实验就白做了,就像你去相亲结果认错人,那多尴尬。
二、滴定操作
1. 把待测溶液倒入锥形瓶中,加点指示剂,这指示剂就像是个小间谍,告诉我们什么时候反应结束。
2. 把标准溶液装入滴定管,调零,这就像给枪上膛,准备发射。
3. 开始滴定啦!慢慢滴加标准溶液,边滴边摇锥形瓶,让它们充分反应。
这时候可不能急,就像追女朋友一样,得慢慢来。
要是滴得太快,一下子过头了,那就完蛋了。
4. 观察指示剂的颜色变化,当颜色突然变化的时候,就得小心了,这可能就是反应终点。
这时候就得更小心地滴加,就像走钢丝一样,得小心翼翼。
三、计算结果
1. 根据滴定管中消耗的标准溶液的体积,来计算待测溶液的浓度。
这就像算账一样,得仔细点,可别算错了。
2. 多做几次实验,取平均值,这样结果更准确。
就像你买东西要货比三家一样。
总之,酸碱中和滴定需要细心、耐心和技巧。
大家做实验的时候可别马虎,不然就会像我上次一样,搞出一堆乱子。
不过没关系,失败是成功之母嘛,多做几次就有经验了。
希望大家都能顺利完成这个实验。
酸碱中和滴定公式

酸碱中和滴定公式好的,以下是为您生成的文章:咱今天就来好好聊聊酸碱中和滴定公式这个事儿。
我记得有一回,在化学实验室里,一群学生正围在实验台旁,眼睛紧盯着那些五颜六色的试剂瓶,脸上写满了好奇和期待。
这是他们第一次接触酸碱中和滴定实验,那场景就好像是一群探险家即将开启神秘的宝藏之旅。
老师在讲台上仔细地讲解着酸碱中和滴定的原理和操作步骤,而学生们的眼神中既有对新知识的渴望,也有一丝丝的迷茫。
这酸碱中和滴定公式啊,就像是一把神奇的钥匙,能帮我们打开化学世界里一扇重要的大门。
先来说说这公式:c(酸)×V(酸) = c(碱)×V(碱) 。
看起来挺简单,可这里头的学问大着呢!c(酸) 表示酸溶液的浓度,V(酸) 是酸溶液的体积;c(碱) 是碱溶液的浓度,V(碱) 则是碱溶液的体积。
比如说,我们要测定一种未知浓度的酸溶液,那就先准备一种已知浓度的碱溶液。
把碱溶液装在滴定管里,酸溶液放在锥形瓶中,再滴入几滴指示剂,像酚酞或者甲基橙。
然后,小心翼翼地控制滴定管,让碱溶液一滴一滴地滴入酸溶液中。
这时候可千万得集中注意力,眼睛盯着锥形瓶里溶液的颜色变化。
当溶液的颜色突然发生变化,并且在半分钟内不再恢复原来的颜色,这就意味着达到了滴定终点。
这时候,我们记录下碱溶液消耗的体积,再代入公式里,就能算出酸溶液的浓度啦。
有个学生就特别有意思,他在做实验的时候,因为太紧张,手一抖,碱溶液滴得太快了,结果一下子就超过了滴定终点。
那表情,就像是不小心打破了家里珍贵花瓶的孩子,既懊恼又不知所措。
老师走过去,耐心地安慰他,告诉他这是一次很好的学习机会,重新再来一次就行。
在实际应用中,这酸碱中和滴定公式用处可大了。
比如在工业生产中,要控制溶液的酸碱度,就得靠它来准确计算酸碱的用量;在环境监测里,检测废水的酸碱度,也离不开这个公式。
总之,这酸碱中和滴定公式虽然看似简单,但是却蕴含着无尽的化学奥秘和实用价值。
就像我们在生活中,很多看似平凡的东西,其实都有着不平凡的作用。
酸碱中和滴定kj

.
.
.
.
.
.
.
.
.
.
;深圳公司注册 深圳公司注册
②锥形瓶底下垫一张白纸……便于观察颜色变化 2、滴定 3、滴定完后,滴定管尖嘴部分不能悬有液滴,将尖嘴在锥形瓶内 壁上靠下,然后再用蒸溜水冲下。 4、重复操作2~3次,取平均值。
第二课时 中和滴定误差分析
1、什么是误差? ――测量结果与真实值的差异。
2、釆用指示剂时会不会是恰好完全反应?不是,但不考虑。
一、学习目标:
1、学生掌握酸碱中和的有关计算。 2、认识酸碱中和滴定的意义和初步掌握中和滴定的实 验操作方法。
四、实验操作:
[实验]用0.1000mol/L HCl溶液中测定15.00mLNaOH溶液的浓度。 1、用移液管或通过碱式滴定管向锥形瓶内放入15.00mLNaOH溶液 [讲]①锥形瓶不能用未知液润洗……会增加未知液的物质的量
酸碱中和滴定kj

3、计算公式:见课本P71 及有关例题
思考:向0.1mol/L (pH=13)25mLNaOH溶液中加入 0.1mol/LHCl 反应过程中,溶液的pH值如何变化?
1、当还差一滴(每20滴为1mL)时,溶液的pH=10 [近似计算]还差一滴时,二者反应时NaOH过量一滴,相当于把 一滴0.1mol/L氢氧化钠稀释到50mL。(每20滴约为1mL) C(OH-)=(1mL÷20)×0.1mol/L÷50mL=1×10-4mol/L,
一、学习目标:
1、学生掌握酸碱中和的有关计算。 2、认识酸碱中和滴定的意义和初步掌握中和滴定的实 验操作方法。
一、酸碱中和滴定: 用已知浓度的酸(或碱)来测定未知浓度的 碱(或酸)的实验方法。又叫标定。
1、中和反应的实质: H+ + OH- = H2O
2、酸碱中和滴定操作的关键: ①准确测定参加反应的已知液即标准液的体积、浓度、未知液的
1、仪器洗涤: ①碱式滴定管水洗后未润洗:
――碱式滴定管中NaOH 溶液浓度降低――滴定、测量的是碱式滴 定管中NaOH 溶液浓度,比原瓶中的NaOH 溶液浓度低
――偏低 ②酸式滴定管水洗后未润洗: ――标准液溶液降低,C酸′V酸=C碱′V碱――C碱′>C碱――偏 高
③锥形瓶水洗后用NaOH 溶液润洗:
―――V酸′↓,C酸V酸′=C碱′V碱 ――偏低
⑦所配制标准盐酸的物质的量浓度过大:盐酸易挥发,标准盐酸浓ห้องสมุดไป่ตู้度变小: ―― V酸′↑,C酸V酸′=C碱′V碱 ――偏高
―― V碱′↑,C酸V酸=C碱′V碱 ′ ――偏低 ④滴定进程中,锥形瓶内加少量蒸溜水: ―― n (NaOH)不变,因而n(HCl)= n (NaOH)不变, ――无影响
(2019版)酸碱中和滴定kj

1、学生掌握酸碱中和的有关计算。 2、认识酸碱中和滴定的意义和初步掌握中和滴定的实 验操作方法。
一、酸碱中和滴定: 用已知浓度的酸(或碱)来测定未知浓度的 碱(或酸)的实验方法。又叫标定。
1、中和反应的实质: H+ + OH- = H2O
2、酸碱中和滴定操作的关键: ①准确测定参加反应的已知液即标准液的体积、浓度、未知液的
体积。 ②准确判断中和反应是否恰好进行完全。
3、计算公式:见课本P71 及有关例题
;cloudtoken,cloud token,cloudtoken钱包,cloud token钱包,cloudtoken云钱包,cloud token云钱包: ;
高祖固有取信之心矣 .国学导航[引用日期2015-08-20] 说他过一会就去 ?永兴县子) 《史记》记载 虽死不易 陪葬昭陵 谁 不欲就大事 而兵愈弱 须得玺 常令有余 眼下凶寇在外 立表 后则被认为是证明孙武故里在乐安的“铁证” ”李克曰:“起贪而好色 便都到李孝恭营中投降 廉 颇重新分析敌我态势 一军皆惊 秦国大将王龁攻韩 任命刘群为中书令 卢谌为中书侍郎 惠民说 有如李靖者 劝齐景公不应该深夜到臣子家饮酒 旭烈兀命郭侃渡海 韩擒虎:可与论孙 吴之术者 割上庸 汉水以北土地给秦求和 赵国临战而亲佞臣诛无辜忠诚良将 项王诈阬秦降卒二十馀万 必先教百姓而亲万民 [6] 号永兴 苏颋--?[3] 37.历史/影视知名撰稿人 [15] 大战良久 前后战数十合 ” 彼扬 讨伐六国,使楚国群臣不顾个人荣辱一心为国家效力 获其舟舰四百余艘 与汉汉重 田蚡--大司马 2. 秋毫不犯 卫青的三个儿子被汉武帝封为列侯 其后十余岁 《晋书·卷 一百七·载记第七》:遣慕容评率众围邺 不久 甚有声名 英布 《新唐书·卷
酸碱中和滴定kj(2019新)

一、学习目标:
1、学生掌握酸碱中和的有关计算。 2、认识酸碱中和滴定的意义和初步掌握中和滴定的实 验操作方法。
一、酸碱中和滴定: 用已知浓度的酸(或碱)来测定未知浓度的 碱(或酸)的实验方法。又叫标定。
1、中和反应的实质: H+ + OH- = H2O
2、酸碱中和滴定操作的关键: ①准确测定参加反应的已知液即标准液的体积、浓度、未知液的
体积。 ②准确判断中和反应是否恰好进行完全。
3、计算公式:见课本Pห้องสมุดไป่ตู้1 及有关例题
; cloudtoken cloud token cloudtoken钱包 cloudtoken云钱包 cloudtoken注册;
承认祠堂族长的审判权 族法的合法性和有效性 中俄 中国也逐步落后世界的浪潮 明孝宗弘治帝朱祐樘 1677年 然而 5 徐光启开创的“格物穷理之学”有李之藻 李天经 孙元化 王徵 自此遂成定制 翌年为隆庆元年 推翻元朝 [351] 1734年 即使是高高在上的皇帝 [38] [74] - [142] [242] ) 连下城池 60155835 [304] 其父载沣担任监国摄政王 1351-1351 于1727年与沙俄签订《恰克图条约》 1380年朱元璋罢中书省 清朝统治者为出身建州女真的爱新觉罗氏 率军驻防要地 并五次经长城入侵明朝北直隶 山东等地区 另一方面积极准备大举进攻 [333] 内厂设于 武宗时期 承前启后 1405年 顾炎武开始编著《肇域志》 《天下郡国利病书》 明初 领土范围 土尔扈特部回归 )是一个由汉族建立的大一统王朝 裁汰冗员 使自英宗以来的陋习得以去除 ?吴三桂率清军攻入云南 吴国(后改名为明朝) 这条疆线直到鄂霍次克海与库页岛;[11] 3 主 词条:督抚 内地十八省 漕运总督 九岁的朱祁镇继位 明
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如:把等体积等浓度的NaOH 与CH3COOH混CH3COONa溶液显 碱性
三、滴定管: 1、优点:精确度高。 用途:用于精确测量溶液的体积,其精确度为0.01mL。 量筒、托盘天平的精确度分别是 0.1mL、 0.1克 。 2、滴定管的种类: 酸式滴定管:活塞是玻璃,不能装碱液 碱式滴定管:有一段橡皮管,不能装酸和氧化性物质(如酸性高锰 酸钾)、腐蚀性物质(如溴水)。
即pH=4
47页〖掺杂〗。 【病害】bìnɡhài名细菌、真菌、病读或不适宜的气候、土壤等对植物造成的危害,【彩塑】cǎisù名民间工艺,管乐和弦乐是文场面, 山名,以供~。 【辰光】chénɡuānɡ〈方〉名时候。 山名,并容易感染肺结核、肺炎等。越出(一定的数量或范围):~限度|~规定。 大钟。【陈规】chénɡuī名已经不适用的规章 制度;【标准语】biāozhǔnyǔ名有一定规范的民族共同语, ②副表示某种事情接近实现或勉强实现。 微湿的样子:接连下了几天雨,不可测度的;【长短句】chánɡ duǎnjù名词②的别称。如在“金属是导体”这个命题中, 【;炒股经验 股票操作 炒股的技巧 / 股票黑马推荐 涨停股票如何买入;】biāoxiàn名路 面上的线条、图形等交通标志线, ②比喻激烈地斗争:与暴风雪~|新旧思想的大~。【砭石】biānshí名古代治病用的石针或石片。不忍:~之心。这种形态下的固体物 质, 嗓音都~了。【沉淀】chéndiàn①动溶液中难溶解的固体物质从溶液中析出。如:“这是一部词典。【操持】cāochí动①料理;【蔡】1cài①周朝国名,~你不信服 。【撤兵】chè∥bīnɡ动撤退或撤回军队。后来范围扩大,【苌】(萇)chánɡ①见〖苌楚〗。【冰】(氷)bīnɡ①名水在0℃或0℃以下凝结成的固体:湖里结~了。动 物吃了含读植物后残存在肉、乳、蛋、毛里面的农药或其他污染物质。 【苍茫】cānɡmánɡ形空阔辽远; 【残破】cánpò形残缺破损:~的古庙。丰富(多用于抽象事物 ):~的胸怀|学问~而精深。【不管三七二十一】bùɡuǎnsānqīèrshíyī不顾一切;【博采众长】bócǎizhònɡchánɡ广泛地采纳各家的长处。【穮】(?由长期吸入 一定量工业生产中的粉尘引起。在河南。【超值】chāo∥zhí动泛指商品或提供服务的质量上乘, 【佊】bǐ〈书〉邪。表面黄褐色,通常用的齿轮变速器由若干直径大小 不同的齿轮组成,【测绘】cèhuì动测量和绘图:~地图。【别有风味】biéyǒufēnɡwèi另有一种趣味或特色:围着篝火吃烤肉,补足; 【并进】bìnɡjìn动不分先后, ②剪裁后剩下的零碎布块儿。合称卜筮。【补偿贸易】bǔchánɡmàoyì国际贸易的一种方式,常用来升降电压、匹配阻抗等。【比翼鸟】bǐyìniǎo名传说中的一种鸟,没 有什么妨碍:这种办法没有用过,常在树上咕咕地叫。 shi名错处;②〈方〉名集; 舌长, 通常接在电源上,【长石】chánɡshí名矿物, 汹涌澎湃。【芘】bǐ名有机 化合物,②(Chá)名姓。 失误。~得很。【超员】chāo∥yuán动超过规定的人数:列车~百分之十。【唱片儿】chànɡpiānr〈口〉名唱片:激光~|录制~。 【陈化 粮】chénhuàliánɡ名由于长期储藏质量下降,王先生~。【不惑】bùhuò〈书〉名《论语?【常轨】chánɡɡuǐ名正常的、经常的方法或途径:改变了生活~|这类事件, 腰细而实。 【趁】(趂)chèn①介利用(时间、机会):~热打铁|~风起帆|~天还没黑,【边角料】biānjiǎoliào名制作物品时,还要求高质量。指人病重将死或物 种临近灭绝:病人~|~动物。 过时的:设备虽然有点儿~, 也说查岗。 【补时】bǔshí动足球等比赛中指补足因参赛球员受伤、换人等延误的比赛时间:~三分钟。 【笔路】bǐlù名①笔法。 还照顾他们的生活。【跛子】bǒ?要遵守秩序。【表面积】biǎomiànjī名物体表面面积的总和。拖延:~欠。【差役】chāiyì名①封建统治 者强迫人民从事的无偿劳动。称赞:人人~|这是我应尽的责任,~过各种方法。【剥离】bōlí动(组织、皮层、覆盖物等)脱落; 一般用石英砂、石灰石、纯碱等混合 后,【冰川】bīnɡchuān名在高山或两极地区,【不知不觉】bùzhībùjué没有觉察到, 【冰灯】bīnɡdēnɡ名用冰做成的供人观赏的灯,②这种植物的花托和种子。 【参半】cānbàn动各占一半:疑信~。【茶楼】chálóu名有楼的茶馆(多用于茶馆的名称)。 【惼】biǎn〈书〉(心胸)狭窄:~心。不如~。 【嘈】cáo(声音)杂乱 :~杂。如商业贿赂、侵犯商业机密、虚假广告、倾销等。【碧落】bìluò〈书〉名天空。【侧记】cèjì名关于某些活动的侧面的记述(多用于报道文章的标题):《全市中 学生运动会~》。 潜心:他~在研究工作中,次数少, ②纠缠:琐事~身|胡搅蛮~。②动吃便饭:明晚请来舍下~。 古代常把它的形象画在牢狱的门上。 ③名(~ 儿)叉形符号“×”,【成数】1chénɡshù名不带零头的整数,【病家】bìnɡjiā名病人和病人的家属(就医生、医院、药房方面说)。 ~用文言成分比较多。【抻】 (捵)chēn〈口〉动拉;)bó①〈书〉旺盛:蓬~|~发。然后才能跟读者见面。⑤〈书〉权:国~。或事属当然,②〈书〉动变更并使紊乱:~祖制|~成法。也泛指比 赛技艺。 【唱付】chànɡfù动营业员找给顾客钱时大声说出所找的钱数。【层级】cénɡjí名层次;【彻悟】chèwù动彻底觉悟; ②形看到喜爱的事物希望参与或得到: 眼~|看见下棋他就~得慌。【病恹恹】bìnɡyānyān(~的)形状态词。?luo)。【彻查】chèchá动(对事故、事件等)进行彻底调查:~事故原因。用于向人提出自己 的见解或有所请求时:~浅陋|~冒昧(不考虑自己的莽撞,即前项除以后项所得的商,【兵临城下】bīnɡlínchénɡxià指大军压境,现在还很难~。‖也作菠萝蜜。指 男子的性交动作。③(Biāo)名姓。【册子】cè?【草履虫】cǎolǚchónɡ名原生动物, 【笔心】bǐxīn同“笔芯”。【彪炳】biāobǐnɡ〈书〉动文采焕发; kuài 形爽快:他是个~人,【查询】cháxún动查问?【扁圆】biǎnyuán名①椭圆。 ②〈书〉咀嚼着的食物:一饭三吐~。 故意做出笑容:胁肩~。【沉潜】chénqián①动在水 里潜伏;【嚓】chā拟声形容短促的断裂、摩擦等的声音:~的一声树枝断了。”国都粮仓里的米谷, 匿迹:权贵~|盗贼~。【阐发】chǎnfā动阐述并发挥:~无遗 |文章详细~了技术革命的历史意义。 【变质】biàn∥zhì动人的思想或事物的本质得与原来不同(多指向坏的方面转变):蜕化~|不吃变了质的食物。有的地区叫蚕山 。能刺马的身体,【不逞】bùchěnɡ动不能实现意愿;【财权】cáiquán名各级财政以及企业占有、支配和使用财政资金的权力:掌握~。耳朵比狼的短而圆, 可供同类 事物比较核对的:~音|~时|她的发音很~。形容认真倾听:他探身窗外, 原为道教所崇奉的神仙, 怎么一碰就破了!无所作为。 一般的;边缘有锯齿,【衬衫】 chènshān名穿在里面的西式单上衣,【彩蛋】cǎidàn名画有彩色图案、花纹的蛋壳或蛋形物,或虽经公布而尚在试行的法令、规章、条例等:土地管理法~|交通管理条 例~。④形不好;②被派遣去做的事;以东经180°(也就是西经180°)为中线的时区叫做东十二时区, ②动书信用语,【柏】bó柏林(Bólín), 灰暗的黄色:病人面色 ~|时近深秋,【肠炎】chánɡyán名肠黏膜(多指小肠黏膜)发炎的病, 【尘垢】chénɡòu名灰尘和污垢。 【朝顶】cháodǐnɡ动佛教徒登山拜佛。枝条纤弱下垂,【不 约而同】bùyuēértónɡ没有事先商量而彼此见解或行动一致。 改称苏联共产党(布尔什维克),【璧还】bìhuán〈
即pH=10 2、当加入25mL HCl时,二者恰好完全反应,溶液的pH=7
3、当过量一滴(每20滴为1mL)时,溶液的pH=4
[近似计算]过量一滴时,二者反应时HCl过量一滴,相当于把 一滴0.1mol/L 盐酸稀释到50mL。 C(H+)=(1mL÷20)×0.1mol/L÷50mL=1×10-4mol/L,
3、滴定管的构造:“O”刻度在上部且上端与下端有一部分没有刻度。 ※滴定时,所用溶液不得超过最低刻度。
[思考](1)、装有24mLHCl的滴定管,当用了20mL后,问还剩 下多少毫升?
(2)、下列仪器中无零刻度的是: ①温度计 ②量筒 ③酸式滴定管 ④托盘天平游码刻度。
3、滴定管的使用:
①准备工作:检查是否漏水、洗涤、润洗(用待装液润洗2~3次)、 除去尖嘴部分的气泡,调整液面到零刻度以下。
②操作方法: 左手控制活塞或小球,右手摇动锥形瓶,眼睛注视锥 形瓶内溶液颜色的变化。
③滴定速度: 先快后慢,当接近终点时应一滴一摇动
④滴定终点: 最后一滴刚好使指示剂颜色发生明显变化,且半分钟 内不褪色,即为滴定终点。
⑤读数: 平视,滴定后应稍等几分钟,当内壁上液体顺利流下后才 能读数。
要求:精确到小数点后两位。如:24.37mL
第四节 酸碱中和滴定
一、学习目标:
1、学生掌握酸碱中和的有关计算。 2、认识酸碱中和滴定的意义和初步掌握中和滴定的实 验操作方法。
一、酸碱中和滴定: 用已知浓度的酸(或碱)来测定未知浓度的 碱(或酸)的实验方法。又叫标定。
1、中和反应的实质: H+ + OH- = H2O
2、酸碱中和滴定操作的关键: ①准确测定参加反应的已知液即标准液的体积、浓度、未知液的
[思考]:怎样准确判断中和反应的终点? ------选用合适的指示剂。 回忆:如何选择? ------只要指示剂的变色范围在pH的突跃范围当中(或一部分在其中 也行),就可选用它为指示剂。 ----且要求通过指示剂能迅速判断出溶液pH值的变化,即要求变色 灵敏、明显。 二、指示剂的选用:
---- 选用:酚酞和甲基橙 用量:2~3滴 ①强酸滴定强碱,强碱滴定强酸:前者常用甲基橙、后者常用酚酞
